液体胰岛素制剂及与其相关的方法与流程
相关申请的交叉引用本申请要求于2015年2月25日提交的序列号62/120,573的美国临时专利申请的权益,该专利申请的全部内容以参考的方式并入本文中。
背景技术:
:糖尿病是一种其中个体对胰岛素做出反应使血糖水平适度的能力丧失的代谢疾病。胰岛素是由胰腺分泌进入血液并引发细胞吸收葡萄糖的一种激素。当身体不能产生胰岛素(如在1型糖尿病中所发生的)、或者不再对胰岛素做出反应并且/或者产生较少的胰岛素(如在2型糖尿病中所发生的)时,血糖水平升高。糖尿病的并发症包括患上心血管疾病、神经病变、肾病、视网膜病变、足损伤、皮肤病、听力损伤、和阿尔茨海默氏病的危险性增加。1型糖尿病的治疗包括胰岛素注射或者胰岛素泵的使用。2型糖尿病也经常用胰岛素注射或胰岛素泵进行治疗。人胰岛素蛋白质是由51个氨基酸所组成并且具有5808da的分子量。在无脊椎动物中,氨基酸序列是非常保守的。虽然最初被合成为单个多肽链,但该多肽链被切断从而形成由二硫键连接到一起的a-链和b-链。在身体中胰岛素是以锌稳定化无活性六聚体(六个胰岛素分子的单位)的形式而产生并储存,虽然活性形式为单体。六聚体胰岛素是非常稳定的,从而起到将高度反应性胰岛素保持在被保护状态的作用,但在血液中仍然可容易地被利用。六聚体的形成和分解导致以下的平衡:超过1μm浓度的胰岛素单体可以形成非共价二聚体(in2)。两个锌分子的结合促进3个二聚体(in2)组装成为六聚体形式。六聚体胰岛素可以在两种原生状态:t6和r6之间转换。在t形式→r形式之间的转换与在b链的n’末端部(b1-b8)中的构象易变性有关。在t状态中,b1-b8区处于拉伸线性状态,当处于r状态时,b1-b8区是α-螺旋(kim和shield(1992年),biochem.biophys.res.comm.186(2):1115-120)。b1-b8区的α-螺旋形式可以使六聚体稳定化。在胰岛素六聚体的t6与r6构象之间的互换可通过与t6和r6形式的配体结合而进行调节。这种配体可包括离子、防腐剂、和稳定剂。例如,酚类防腐剂和稳定剂结合到位于胰岛素表面附近的疏水性凹部从而促进r6状态(derewenda等人(1989年),nature338(6216):594-596;brzovic等人(1994年),biochemistry33:13057-13069)。当开发市售的液体胰岛素制剂时在贮存期间的胰岛素降解是一个挑战。胰岛素制剂通过一些物理过程和化学反应而发生降解或失去效力,包括(a)沉淀(晶体形成);(b)原纤维形成(蛋白质变性);(c)水解反应,特别是在某个氨基酸位置(包括a18、a21和b3)的脱酰胺;(d)通过转酰氨基作用或席夫碱形成的共价二聚化;和(e)二硫键交换反应(strickley和anderson(1997),j.pharma.sci.86(6):645-53)。当通过摇动或剪切力使两个或更多的部分去折叠的胰岛素单体结合在一起时(例如,在装运期间),通常发生原纤维形成(聚集)。胰岛素分子的疏水性表面结合到一起,从而不可逆地形成胰岛素纤维。胰岛素单体继续结合,并且纤维延长直到它变得在水溶液中不溶解。这些无活性胰岛素纤维的形成导致胰岛素制剂中的可见的混沌和效力损失。市售的胰岛素制剂经常包含六聚体构型的胰岛素和辅料(例如防腐剂或稳定剂,例如酚类化合物),这导致蛋白质复合物的刚性并且有助于六聚体的稳定性。在b链的b1-b8区中的构象易变性似乎是胰岛素化学稳定性中的一个因素。通过增加的相互作用(促进六聚体形式)或者通过添加导致在b1-b8区中的螺旋结构的辅料(例如酚类化合物)所造成的n’末端b链的刚性增加可减少脱酰胺和共价二聚体反应(berchtold和hilgenfeld(1999年),biopolymers51(2):165-72;derewenda等人(1989年),nature338(6216):594-96;darrington和anderson(1994年),pharma.res.11(6):784-793;brange等人(1994年)《胰岛素的稳定性:对药物制剂中胰岛素的物理和化学稳定性的研究》。荷兰多德雷赫特:kluwer学术出版社)。酚类化合物,尤其是苯酚和甲酚,已被证明在使b1链稳定和促进六聚体形成方面是如此有效因而它们是市售液体胰岛素制剂中的常规组分。许多的这种防腐剂和稳定剂可以是粘膜刺激性的并且有恶臭。然而,缺少这种组分的制剂(参见例如美国专利6,211,144)可具有显著的蛋白质不稳定性,并且在装运期间会更加易受物理稳定性的影响。技术实现要素:本文中公开的是液体胰岛素制剂,该胰岛素制剂含有1-13mm的最小浓度的胰岛素、50-150mm浓度是盐、3-24mm的浓度的ph缓冲剂、以1.9-2.7个锌离子每个胰岛素六聚体(0.35-0.5%w/w锌对胰岛素)的比率的锌、和在7.2至8.0范围内的ph值。这些制剂的一个重要特征是它们不含有防腐剂或稳定剂。另外,提供了这种胰岛素制剂的单位剂量、和含有这种制剂的套件。还公开了对患有糖尿病的受试者进行治疗的方法,该方法包括将有效量的胰岛素制剂向患有糖尿病的受试者给药,该胰岛素制剂含有有胰岛素(以1-13mm的最小浓度)、盐(以50-150mm的浓度)、ph缓冲剂(以3-24mm的浓度)、锌(以1.9-2.7锌离子每个胰岛素六聚体(0.35-0.5%w/w锌对胰岛素)的比率)、和在7.2至8.0范围内的ph值,其中该制剂不含有防腐剂或稳定剂。制剂可通过吸入或注射而向受试者给药。基于本申请其余部分的概述,应当理解的是其他方法和组合物也是本发明的一部分。附图说明图1示出了根据一些方面的、在包含不同的ph缓冲剂(磷酸盐、三羟甲基氨基甲烷、柠檬酸盐、三羟甲基氨基甲烷/柠檬酸盐)和/或盐(nacl)的胰岛素制剂中随时间推移异b3胰岛素降解产物的形成。图2示出了根据一些方面的、随时间推移在与如图1中所示相同的胰岛素制剂中胰岛素有关物质(irs)降解产物的形成。图3示出了根据一些方面的、由具有不同ph值的胰岛素制剂随时间推移异b3胰岛素降解产物形成所证明的化学稳定性。图4示出了根据一些方面的、由与如图3中所示相同的胰岛素制剂随时间推移irs降解产物形成所证明的化学稳定性。图5示出了根据一些方面的、由具有300u/ml或900u/ml胰岛素、0.39%锌、6mm柠檬酸钠、70mm氯化钠的胰岛素制剂在ph7.5下在冷藏期间随时间推移的胰岛素浓度所证明的效价。图6示出了根据一些方面的、在与图5中相同的制剂中在冷藏期间随时间推移irs降解产物的累积。图7示出了根据一些方面的、在与图5中相同的制剂中在冷藏期间随时间推移异b3降解产物的累积。图8示出了根据一些方面的、在与图5中相同的制剂中在冷藏期间随时间推移高分子量聚合物(hmwp)降解产物的累积。图9示出了根据一些方面的、利用在相对胰岛素含有0.39%w/w锌的制剂中随时间推移作为ph值的函数的浓度变化所测量的胰岛素溶解度。图10示出了根据一些方面的、利用在相对胰岛素含有0.45%w/w锌的制剂中随时间推移作为ph值的函数的浓度变化所测量的胰岛素浓度变化。图11示出了根据一些方面的、利用在含有0.51%w/w锌对胰岛素的制剂中随时间推移作为ph值的函数的浓度变化所测量的胰岛素浓度变化。图12示出了根据一些方面的、在含有0.39%w/w、0.45%w/w、和0.51%w/w锌对胰岛素的制剂中作为ph值和锌浓度的函数的胰岛素最终浓度的比较。图13示出了根据一些方面的、与含有酚类防腐剂的市售优泌林u-500相比,含有280u/ml和840u/ml胰岛素的无防腐剂制剂在暴露于剪切力后的稳定性评估。在28天的时间段内将制剂摇动。利用hplc测量胰岛素浓度,并且以随时间推移初始胰岛素浓度的百分率的形式而标绘效价。图14示出了根据一些方面的、与图13的市售优泌林u-500相比含有280u/ml和840u/ml胰岛素的无防腐剂制剂在暴露于剪切力之后的稳定性评估。在15天的时间段中将制剂摇动,然后用浊度计确定浊度。浊度是相对于时间而进行标绘。优泌林制剂的浊度读数到第8天达到装置的最大阈值。图15示出了根据一些方面的、添加苯酚对在冷藏期间随时间推移高浓度胰岛素制剂的化学稳定性的影响。制备含有70mg/ml胰岛素的制剂(ph7.2和7.4),包括含有0.25%v/v苯酚(“酚”)和不含有苯酚(“无防腐剂”)的批次。在时间0、3个月和6个月,对制剂进行评估。利用hplc测量相对于时间的胰岛素浓度(效价)和所标绘的效价。具体实施方式对本发明的各方面和各实施方式的此详细描述被组织入如下的各部分中。部分i提供对本发明主题的导论。部分ii提供本文中所使用术语的定义。部分iii描述了制剂。部分iv描述了含有制剂的套件。部分v描述了治疗方法。部分vi提供了示例性的制剂和治疗方法。此详细描述被组织入各部分中仅仅是为了方便读者,并且在任何部分中所看到的公开内容适用于在本说明书中其他地方的公开内容。i.导论本发明的某些实施方式和方面涉及液体胰岛素制剂和利用制剂对患有糖尿病的受试者进行治疗的方法。相对于现有的市售制剂,所公开的制剂呈稳定状态的时间充分长而适用于有效市售产品。重要地,在不含有防腐剂或稳定剂(例如酚类化合物)的情况下,制剂是稳定的。另外,所描述的制剂具有充分的胰岛素浓度从而可用于以最小体积将所需剂量的胰岛素向受试者给药,该制剂尤其可用于肺部给药。在一些情况下,相对于市售的制剂,制剂可具有相对较高的胰岛素浓度。在一些方面,制剂可通过雾化而以最小体积和吸入时间向受试者给药。制剂尤其适合于气溶胶给药,部分地由于没有防腐剂和稳定剂(可能是刺激物并且会减弱剂量给药),并且由于没有表面活性剂(也会减弱剂量给药),并且由于可以提供的相对较高的胰岛素浓度,。另外,制剂含有水溶性胰岛素,该胰岛素物理和化学稳定的时间延长,甚至在较长期地暴露于剪切力之后。长期稳定性,包括在贮存期间的化学稳定性和在装运、处理、和患者使用情况期间物理稳定性,是胰岛素制剂的监管机构批准和商业可行性中的一个因素。在适当的贮存条件(冷藏)下,所提供的制剂可在延长的时间段保持稳定,例如至少24个月。开发稳定的并且相对地浓缩的这种胰岛素制剂要求优化多个因素和组分以实现ph值高至足以维持胰岛素溶解度,但又低至足以使化学降解最小化(例如脱酰胺)并且在不借助于作为添加剂的防腐剂或稳定剂的情况下维持稳定性。为本发明的制剂而确定的条件包括特定的ph范围及各组分的组合,包括盐、锌离子、和ph缓冲剂。制剂的一个方面是在无需化学防腐剂或稳定剂的情况下,主要通过蛋白质浓度、ph值、ph缓冲剂的类型、锌离子浓度、和盐(离子强度)来控制蛋白质稳定性。ii.定义以下的定义被提供用来帮助读者阅读。除非另有规定,所有本领域的术语、符号、及本文中所使用的其他科学或医学术语或科技术语意图具有在化学和医学领域中的技术人员通常所理解的含义。在一些情况下,具有通常所理解含义的术语在本文中是为了清楚和/或为了容易引述而定义,并且本文中包括这种定义不应被解释成代表与本
技术领域:
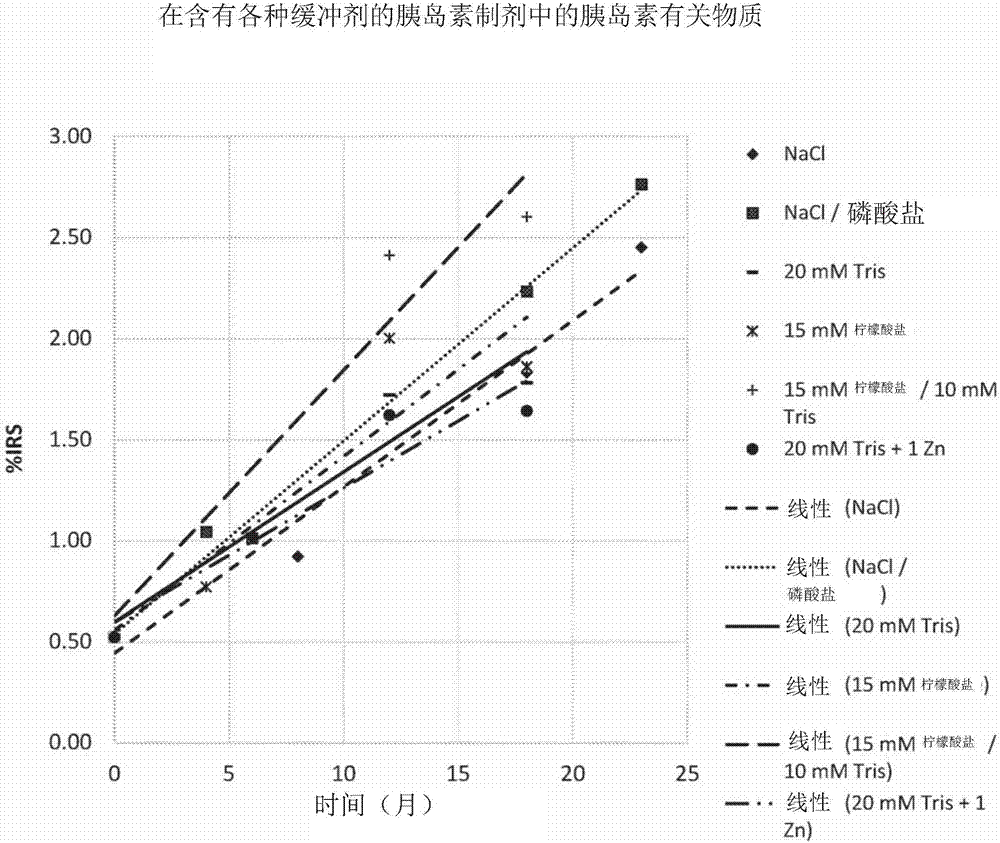
通常所理解的术语定义的实质性差异。本文中所使用的将制剂向受试者“给药”或向受试者的制剂“给药”(及此短语的语法对等词)是指直接给药,该直接给药可以是由医学专业人员向受试者给药,或者可以是自我给药和/或间接给药,该给药可以是开出制剂的行为。例如,医生指导受试者对制剂进行自我给药和/或为受试者提供制剂的药方以便将该制剂向受试者给药。本文中所使用的“化学稳定性”是指在药物制剂中药物组合物的反应性及在药物制剂中药物组合物发生化学反应或化学分解的倾向性。胰岛素制剂的化学稳定性的例子包括胰岛素蛋白质的氧化和水解。本文中所使用的“物理稳定性”是指药物组合物保持其在药物制剂中的正常物理结构的能力、和因此药物组合物在贮存和使用期间发生聚集和/或从溶液中沉淀出的倾向性。胰岛素制剂的物理稳定性是由在制剂中的胰岛素蛋白质保持其原本构型的能力所表示。示例性的胰岛素制剂的物理稳定性包括纤维化。本文中所使用的“效价”是指在组合物中活性剂的活性或量,例如在药物制剂中胰岛素的量。效价可用产生效果所需活性剂的量来表述。例如,每毫升的胰岛素单位(u/ml)、或者每毫升的胰岛素毫克数(mg/ml)。本文中所使用的效价可用于指代所描述制剂的所需胰岛素浓度。在一些情况下,百分比(%)效价可用于指代与起始/初始浓度相比在制剂中的胰岛素的量(浓度)。本文中所使用的“防腐剂”是指阻止或抑制微生物的生长一类化合物、以及有助于控制药物中的氧化反应的化合物。苯酚和edta是防腐剂的例子。本文中所使用的“稳定剂”是指使溶液中蛋白质的二级和三级结构稳定化并因此减小蛋白质的降解速率(化学、物理、或两者)的物质。就胰岛素六聚体而言,示例性的稳定剂是酚、间甲酚、和其他酚类化合物。本文中所使用的“表面活性剂”是指发生聚集以便在水性制剂中在临界浓度下形成胶束从而为疏水性化合物提供更大溶解度的两亲性有机化合物(具有疏水性基团和亲水性基团)。可将表面活性剂应用于制剂从而可提高制剂的物理稳定性、调整它们的溶解度、或两者。本文中所使用的胰岛素制剂的“治疗有效量”是指当向患有糖尿病的受试者给药时将具有预期治疗效果(例如增加血糖细胞摄取和降低血糖水平)的胰岛素制剂的量。治疗有效量可在一次或多次给药中给药。本文中所使用的“治疗”疾病或受试者、或者疾病或受试者的“治疗”是指采取行动以便获得受试者的有利或所需的结果,包括临床结果。为了本发明的目的,有利的或所需的临床结果包括但不限于:增加的血糖细胞摄取、降低的血糖水平、或两者。iii.制剂提供了不含有防腐剂、稳定剂、或表面活性剂的合适的胰岛素制剂。制剂可包含1-13mm胰岛素、50至150mm盐、3至24mm缓冲剂;按每个胰岛素六聚体1.9至2.7个锌离子的比率(或者称为锌对胰岛素0.35%至0.5%wt/wt)的锌离子,且ph值为7.2至8.0。在一些情况下,制剂可包含6mg/ml至76mg/ml的胰岛素。在本文中所描述制剂的开发中,考虑了胰岛素的若干性质。在溶液中的胰岛素自缔合模式中所包括的开发是蛋白质浓度、金属离子、ph值、离子强度、和溶剂组成的复合函数。在一个方面,制剂包含六聚体胰岛素,作为主要的胰岛素种类。制剂通常被配制成使胰岛素降解产物的形成最少化。在一个方面,制剂含有胰岛素。在一些情况下,制剂可含有在1mm至13mm范围内的胰岛素。在一些情况下,制剂可含有在6mg/ml至76mg/ml范围内的胰岛素。在一些情况下,制剂可以含有在173u/ml至2189u/ml范围内的胰岛素。例如,制剂可具有1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、11mm、12mm、或13mm、或者在任何这些浓度浓度的0.5mm内的浓度。在一些情况下,制剂可具有6mg/ml、10mg/ml、15mg/ml、20mg/ml、30mg/ml、35mg/ml、40mg/ml、45mg/ml、50mg/ml、55mg/ml、60mg/ml、65mg/ml、70mg/ml、75mg/ml的胰岛素浓度,或者在任何这些浓度的3m/ml内的浓度。在一些情况下,制剂可具有约170u/ml、175u/ml、190u/ml、225u/ml、260u/ml、280u/ml、300u/ml、325u/ml、350u/ml、375u/ml、400u/ml、425u/ml、450u/ml、475u/ml、500u/ml、525u/ml、550u/ml、600u/ml、625u/ml、650u/ml、675u/ml、700u/ml、725u/ml、750u/ml、775u/ml、800u/ml、825u/ml、850u/ml、875u/ml、900u/ml、925u/ml、950u/ml、975u/ml、1000u/ml、1025u/ml、1050u/ml、1075u/ml、1100u/ml、1125u/ml、1150u/ml、1175u/ml、1200u/ml、1225u/ml、1250u/ml、1275u/ml、1300u/ml、1325u/ml、1350u/ml、1375u/ml、1400u/ml、1425u/ml、1450u/ml、1475u/ml、1500u/ml、1525u/ml、1550u/ml、1575u/ml、1600u/ml、1625u/ml、1650u/ml、1675u/ml、1700u/ml、1725u/ml、1750u/ml、1775u/ml、1800u/ml、1825u/ml、1850u/ml、1875u/ml、1900u/ml、1925u/ml、1950u/ml、1975u/ml、2000u/ml、2025u/ml、2050u/ml、2075u/ml、2100u/ml、1225u/ml、1250u/ml、1275u/ml、或2200u/ml的胰岛素浓度。制剂可具有至少30mg/ml或5.17mm的胰岛素浓度。制剂可具有多达约76mg/ml或13mm的胰岛素浓度。在一些情况下,制剂可具有30mg/ml至76mg/ml或者5.17mm至13mm的胰岛素浓度。在一些情况下,制剂可具有10mg/ml至30mg/ml或者1.72mm至5.17mm的胰岛素浓度。在某些方面,制剂可具有在6mg/ml至35mg/ml或者1mm至6.03mm范围内的胰岛素浓度。在一些情况下,制剂含有主要处于六聚体状态中的胰岛素,这可以提高制剂中胰岛素的化学稳定性。在一些实施例中,相比现有的市售制剂,制剂可以是3至10倍地更加浓缩。在一些情况下,相比现有的市售制剂,例如ru-100(100u/ml,3.47mg/ml)ph7.4、和ru-500(500u/ml、17.35mg/ml、2.99mm)ph7.4(elililly公司),制剂可以是多达20倍地更加浓缩。制剂中所包含胰岛素的类型可变化。在一些情况下,胰岛素可以是人、猪、或牛胰岛素。在一些情况下,制剂包含人胰岛素。在一些情况下,胰岛素是人胰岛素。胰岛素可以是来源于人或其他哺乳动物细胞系的重组蛋白质。在一些情况下,胰岛素可以是来源于原核细胞的重组胰岛素蛋白质。在一些情况下,胰岛素可以是胰岛素蛋白质的全长的51个氨基酸野生型序列。在其他情况下,胰岛素可以是具有转基因序列的胰岛素类似物。例如,胰岛素可具有一个或多个氨基酸的缺失和/或被其他氨基酸(包括不可编码的氨基酸)所替换,或者可具有被添加到蛋白质序列中的一个或多个氨基酸。在一些情况下,如在实施例1至实施例6中所描述,制剂可含有从各种供应商购得的重组人胰岛素(例如,sanofi-aventis(material:192228,gmid:341921)、emdmillipore(cat.#407709-50mg)、sigmaaldrich(cas#11061-68-0,cat.#91077c、ec#234-279-7、mdl#mfcd00131380))。作为参考,1u相当于0.0347mg的人胰岛素(28.8u/mg)。另外,如上所述,人胰岛素的分子量为5808道尔顿(g/mol)。在一个方面,制剂可以是等渗的。非常低渗或高渗的溶液可以导致黏膜刺激。例如,低盐溶液(例如,纯水)或高盐溶液的吸入可以导致喉和肺的刺激,经常导致咳嗽和不适。在一些情况下,制剂具有100mosm-300mosm的张力。可利用各种化合物来调节制剂的张力。通过包含不容易穿过细胞膜的盐或其他溶质,可对制剂的张力进行调节。在一些情况下,可调整盐浓度从而优化离子强度和张力。在一些情况下,当改变制剂中的胰岛素浓度时,可改变盐的浓度从而实现所需的张力。在一些情况下,可优化制剂的离子强度从而使制剂对于吸入(例如用于肺部给药)而言是舒适的。在一些情况下,制剂可包含氯化物盐。在一些情况下,盐是氯化物盐。例如,在一些情况下,盐可以是氯化钠。在一些情况下,与其他盐相比,在包含氯化钠的制剂中胰岛素会是尤其稳定的。例如,如在实施例1至6中所描述,盐可以是nacl。在另一方面,制剂可含有在约50至150mm范围内的盐,例如氯化物盐。例如,盐浓度可以是约50-70mm、约60-80mm、约90-100mm、约65-75mm、约75-85mm、约85-95mm、约70-140mm、约110-120mm、约130-150mm、或者在其中的任何范围。在一些实施例中,盐浓度可以是约50mm、约55mm、约60mm、约65mm、约70mm、约75mm、约80mm、约85mm、约90mm、约95mm、约100mm,或者在任何这些浓度的2-3mm内的浓度。在一些情况下,如在实施例1至6中所描述,在制剂中可以以70mm的浓度包含nacl。在一个方面,制剂含有每六个分子的胰岛素(六聚体)1.9至2.7个锌离子,这相当于约0.35%至0.5%wt/wt的锌对胰岛素。在一些情况下,锌离子可提高胰岛素在制剂中的溶解度。例如,两个锌离子可促进胰岛素六聚体并且/或者使其稳定。例如,在锌离子不存在的情况下或者如果锌与六聚体的比率过低(例如小于1.9:1),胰岛素会是物理不稳定的并且不太可能形成六聚体。另外,例如如果锌离子与胰岛素六聚体的比率过高(例如3:1或更大),胰岛素会从溶液中沉淀出。在一些情况下,0.35%至0.5%wt/wt的锌对胰岛素,给制剂中的胰岛素提供稳定性。在一些情况下,在所提供的制剂中,各种比率的胰岛素可与0、1、2或3个锌离子或者其混合物结合,使得制剂的锌离子与胰岛素六聚体的比率为1.9至2.7。制剂可含有每个胰岛素六聚体1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、或2.7个锌离子。在一些情况下,制剂可含有每个六聚体2.0至2.3个锌离子、每个六聚体2.1至2.4个锌离子、每个六聚体2.2至2.5个锌离子、每个六聚体1.9至2.5个锌离子、每个六聚体2.2至2.7个锌离子、每个六聚体2.2至2.6个锌离子、或者每个六聚体2.3至2.6个锌离子。在另一个方面,制剂可具有ph缓冲能力。例如,制剂可包含ph缓冲剂。例如,ph缓冲剂可以是可离子化盐,例如磷酸盐、乙酸盐、柠檬酸盐、碳酸氢盐、三羟甲基氨基甲烷等,具有反离子。ph缓冲剂的作用是减小制剂的ph值的波动。在某些情况下,ph缓冲剂可以是柠檬酸盐、三羟甲基氨基甲烷、或三羟甲基氨基甲烷-柠檬酸盐,如在实施例1中所描述在图1和图2中所示出。在另一个方面,制剂可以以约3至24mm的浓度包含ph缓冲剂。例如,ph缓冲剂浓度可以是3-6mm、5-10mm、8-16mm、或12-24mm。在一些情况下,ph缓冲剂浓度可以是3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm、16mm、17mm、18mm、19mm、20mm、21mm、22mm、23mm、或24mm,或者在这些浓度的0.5mm内的任何浓度。在一些情况下,ph缓冲剂是柠檬酸盐。在一些情况下,ph缓冲剂可以是6mm柠檬酸盐。胰岛素的稳定性和溶解度会受到制剂ph值的影响。例如,在接近其等电点ph值(ph范围4.0-7.0)的ph值下,胰岛素的溶解度较低。在一个方面,制剂可具有相对较中性的ph值,例如在生理ph值(大约7.4)的0.6ph单位内。在一些情况下,制剂的ph值可以是略碱性的,例如高达ph8。制剂的ph值可以是在7.2至8.0的范围内。在此范围内的ph值,结合制剂的各组分,给制剂中的胰岛素赋予特定的稳定性。例如,制剂的ph值可以是约7.2至约8.0。在一些情况下,制剂具有7.2、7.25、7.3、7.35、7.4、7.45、7.5、7.55、7.6、7.65、7.7、7.75、7.8、7.85、7.9、7.95、或8.0的ph值,或者在任何这些ph值的0.5内的ph值。在一些情况下,在小于7.2的ph值下制剂的化学和物理稳定性可下降。在某些情况下,在ph8.0下胰岛素蛋白质会开始降解。猪胰岛素的高度浓缩溶液(5000u/ml,大约30mm)在酸性ph值下形成,但由于脱酰胺制剂中的胰岛素是高度不稳定的(galloway(1981年),diabetescare4,366-376)。可以在略微碱性的ph值(例如ph8-9)下制备无锌胰岛素的高度浓缩溶液,但由于高速率的聚合和脱酰胺因而它们是不稳定的。另外,高度浓缩的包含苯酚的猪锌胰岛素溶液在中性ph值下在高温下是物理稳定的,但当使温度降低至4℃时则变为过饱和。(brange和havelund,在溶液中的胰岛素的性质,用于胰岛素给药的人工系统,1983年(brunetti等人编著,raven出版社,纽约,第83-88页)。相反地,本发明的制剂在7.2至8.0的ph值下是稳定的且可含有浓缩的胰岛素并且不包含防腐剂或稳定剂,如在实施例1至6中所描述且在图1-图15中所示。在一个实施例中,如在实施例3中所描述,各制剂可具有约7.5的ph值并且包含约30mg/ml胰岛素。在另一个实施例中,如在实施例3中所描述,制剂可具有约7.5的ph值并且包含约10mg/ml胰岛素。在另一个实施例中,如在实施例4中所描述,在ph7.2和ph7.3下制剂可含有35mg/ml胰岛素。在另一个实施例中,如在实施例5中所描述,在ph7.55下制剂可含有9.7mg/ml或29.2mg/ml胰岛素。在另一个实施例,如在实施例6中所描述,在ph7.2和7.4下制剂可含有70mg/ml胰岛素。在一些情况下,制剂的ph值会影响胰岛素降解。如上所述,胰岛素降解的两个主要路径是高分子量聚合物(hmwp)的水解和形成。最常见的水解产物是b3脱酰胺基胰岛素(b3和异b3)和a21脱酰胺基胰岛素(a21),分别产生于在b链中第3个氨基酸(asn)处的脱酰胺和在a链中第21个氨基酸(asn处的脱酰胺。在一些情况下,具有在氨基酸位置21(a21)的天冬酰胺的胰岛素的水解降解在酸性ph值下会是最高、在6.5的ph值下是最低,并且通常在中性ph值下较低。在一个实施例中,在低ph值下的主要水解产物可以是从天冬酰胺a21(a21-asn)中的脱酰胺(氨基的失去)。在另一个实施例中,在碱性ph值(例如ph7.5-9.0)下水解可增加,其中脱酰胺通常是主要地发生在天冬酰胺b3(b3-asn)处。在一些情况下,asn-b3的脱酰胺可通过环状酰亚胺中间体的形成而进行以形成天冬氨酸(b3)和异天冬氨酸(异b3),从而产两个不同的副产物。因为a21、b3和异b3具有几乎为100%的生物活性(brange等人(1992年),actapharm.nord.4:223-232),所以这些降解产物通常不减弱胰岛素制剂的效价。hmwp产物的累积对于合适市售胰岛素制剂的生产而言会是更成问题的,该市售制剂就可注射胰岛素产品而言要求具有非常小量的这种降解物(例如,对hmwp的限量为1.7%;参见美国药典(美国专论))。在一些情况下,水性胰岛素制剂的最大稳定性可出现在中性ph值附近。在一些情况下,在许多水性制剂中胰岛素的hmwp产物形成速率在酸性ph值下会是较高,但在约6.5至8.0范围内的ph值下是相对较低。例如,在超过ph9.0的碱性介质中可加速hmwp产物的形成速率(例如,因为可有利于二硫化物反应)。限制hmwp形成是几乎所有市售可注射胰岛素制剂目前是在中性ph值下进行配制的原因。然而,在中性ph值下仍然可形成hmwp产物。这些产物的形成主要是通过在n-末端胺类之间(特别是b1-asn和在相邻胰岛素分子的胰岛素a链中的酰胺侧链之间,尤其是在六聚体内)的分子间氨解而发生。在一个方面,制剂不含有防腐剂或稳定剂。在一些情况下,防腐剂和稳定剂是酚类化合物。酚类化合物的例子包括苯酚、甲酚、及其衍生物。在一些情况下,制剂不含有有机溶剂。在某些方面,制剂不含有醇类,包括单元醇类、糖类、氨基酸类、或胺类。美国专利6,489,292和6,211,144中描述了含有防腐剂和稳定剂的制剂,这些专利的内容以参考的方式并入本文中。这种防腐剂和稳定剂可以包括苯酚及其衍生物,例如间甲酚、氯甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、百里香酚、以及其衍生物和这种化合物的混合物。一些类似的非酚防腐剂和稳定剂包括:二环或三环脂肪族醇类和嘌呤类,例如二环脂肪醇(包括单萜醇,例如异松蒎醇、2,3-蒎烷二醇、桃金娘烷醇、龙脑、去甲龙脑或小茴香醇)、三环脂肪醇(例如1-金刚烷醇);及嘌呤类,例如腺嘌呤、鸟嘌呤或次黄嘌呤。其他示例性的防腐剂和稳定剂包括苯甲酸钠、苯扎氯铵、苯甲醇、和硫柳汞。这种防腐剂和稳定剂通常是用于确保制剂中胰岛素的稳定性。相反,本发明的制剂不包含防腐剂或稳定剂而维持采用浓缩形式的的胰岛素的稳定性。在一些情况下,制剂不含有苯酚、甲酚、或者任一个的衍生物。在一些情况下,如在表12和图15中所描述,与由本发明所提供的制剂(无防腐剂)相比,在配制日内和经过6个月的时间段,0.25%wt/vol苯酚会降低胰岛素制剂的稳定性。在另一个方面,制剂不含有表面活性剂。例如,制剂不含有调整在溶液与任何界面(例如,液体/玻璃小瓶界面、空气/液体界面)之间的表面张力的两亲性辅料。表面活性剂(例如聚山梨醇酯-80和tritontmx-100)是众所周知的辅料。因为当使制剂雾化或气溶胶化时表面活性剂可导致起泡和因此物理稳定性的损失,所以由本发明所提供的制剂提供相对于含有表面活性剂的制剂的优点。如在各实施例中所描述,本发明中所提供的制剂是稳定的,并且在典型的冷藏温度下(2-8℃,大约5℃)有低水平的化学和物理降解达至少24个月。因此,制剂可适合于提供具有长货架稳定性的产品。通过对制剂的物理和化学性质的分析,可以评价长期稳定性。例如,制剂的物理外观可显示沉淀物、其他不溶性组分、和变色污染物的存在。在另一个实施例中,如果稳定性下降,那么可发生制剂的ph值变化。在另一个实施例中,如果稳定性下降,那么制剂的效价(水溶性胰岛素的量)会下降。在另一个实施例中,制剂中胰岛素的纯度会下降,例如由于脱酰胺内容物(例如异b3和a21杂质)、hmwp产物(例如,胰岛素二聚体和聚合物)和其他胰岛素有关物质(irs)的量的增加。术语“胰岛素有关物质(irs)”通常包括除了a21、b3和异b3脱酰胺基胰岛素以外的所有胰岛素降解产物。用于市售制剂的规格经常是基于药典专论,例如usp专论:人胰岛素(usp29-nf24,药典论坛:第31(5)卷:1135)和欧洲药典:人胰岛素(01/2005:0838,1800-1801页,acta.pharm.nord.223-232)而确立。这些规格可用作用于开发胰岛素吸入溶液的指导原则。例如,用于可注射胰岛素稳定性的规格可参见下面所陈述的欧洲药典并且可用作稳定的市售胰岛素吸入制剂的指导原则:特性指导原则效价90-110%的target高分子量聚合物(%hmwp)≤1.7%胰岛素有关物质(%irs)≤6%在一些情况下,制剂可满足上表中所陈述的效价、%hwmp、或%irs中的一个或多个的要求达至少6个月、至少12个月、至少18个月、至少24个月、或者至少包含制剂的市售产品的保质期的时间段。在某些情况下,在贮存期间随时间推移,制剂可维持相对较低水平的脱酰胺产物、hmwp产物、或其他irs形式的污染物。在一些情况下,在冷藏贮存期间随时间推移,所提供的制剂可维持相对较低水平的a21、异b3、和b3胰岛素产物中的一个或多个。例如,如在实施例1-3中所描述,由本发明所提供制剂中异b3的量保持低于5%达多达23-24个月。这些制剂也维持irs水平低于6%达多达23-24个月。在另一个实施例中,如在实施例3中所描述,所提供的制剂维持a21的量小于5%并且维持hmwp的量小于1.7%。在一些情况下,所提供的胰岛素制剂是化学和物理稳定的。在一些情况下,稳定性与制剂的ph缓冲剂有关。例如,如在表2中所描述,基于ph缓冲剂,在每个月中异b3的形成速率可在约0.14-0.25%的范围内。在一些情况下,如图1中所示,ph缓冲剂(如柠檬酸盐)或者三羟甲基氨基甲烷-柠檬酸盐混合物,在典型的冷藏温度下(2-8℃,大约5℃),可导致在6个月后形成仅约1%的异b3和在18个月之后形成仅约2.5%的异b3。在一些情况下,在典型的冷藏温度下(2-8℃,大约5℃),其他ph缓冲剂如三羟甲基氨基甲烷或磷酸盐缓冲剂单独地,可导致在18个月后形成仅约4.0-4.5%的异b3并且在24个月后形成仅约4.5-5.9%的异b3。在一些实施例中,就ph缓冲剂(例如柠檬酸盐、三羟甲基氨基甲烷、和磷酸盐)而言,irs形成的速率可在每个月约0.11-0.12%的范围内,并且就柠檬酸盐-三羟甲基氨基甲烷混合物缓冲剂而言,可以是每个月约0.16%,如在表3中所描述。例如,如图2中所示,在典型的冷藏温度(2-8℃,大约5℃)下,就ph缓冲剂(如柠檬酸盐、或三羟甲基氨基甲烷-柠檬酸盐混合物)而言可导致在6个月后形成仅约1%的irs,就柠檬酸盐缓冲剂而言在18个月后形成仅约1.8%的irs,或者就柠檬酸盐-三羟甲基氨基甲烷缓冲剂而言在18个月后形成仅约2.5%的irs。在一些情况下,在典型的冷藏温度(2-8℃,大约5℃)下,其他ph缓冲剂如三羟甲基氨基甲烷或磷酸盐缓冲剂单独地可导致以在就柠檬酸盐和三羟甲基氨基甲烷-柠檬酸盐中所观察速率的中间的速率而形成irs。在一些情况下,在ph7.5下,所提供的制剂可含有31.2mg/ml(900u/ml)的胰岛素和70mmnacl及0.42%w/w锌对胰岛素(每个胰岛素六聚体约2.2个锌),如在表2、图1、和图2中所描述。在一些情况下,制剂的化学和物理稳定性与ph值有关。例如,如在实施例2中所描述,当制剂的ph值升高时异b3的形成可减少并且irs的形成可增加,反之亦然。在一些情况下,如在表4中所示并且在图3中所示,随着ph值升高在典型的冷藏温度下异b3的形成速率会增加,从在ph7.0下的0.13%每个月升高到在ph7.8下的每个月0.21%。相反,如在表5中所描述并且在图4中所示,在一些情况下,在典型的冷藏温度下irs的形成速率随着ph值升高而下降,从在ph7.0值下的每个月0.21%下降到在ph7.8下的每个月0.09%。在另一个实施例中,在非常碱性的条件下(例如ph8.7),当在典型的室温(约22至27℃)下贮存时制剂的稳定性显著地下降,如在表6中所描述。在一些情况下,在表4和表5及图3-图中所描述的制剂可含有31.2mg/ml(900u/ml)胰岛素、6mm柠檬酸盐、和70mmnacl、及0.42%w/w锌对胰岛素(每个胰岛素六聚体约2.2锌)。在一些情况下,如在实施例3中所描述,具有300u/ml和900u/ml的制剂通常具有相似的随时间推移的化学和物理稳定性。例如,如图5中所示,在典型的冷藏温度(2-8℃、大约5℃)下贮存12个月之后,制剂可保持至少约100-101%的初始胰岛素。在一些情况下,亦如图5中所示,在典型的冷藏温度(2-8℃,大约5℃)下贮存18个月之后,制剂可保持在溶液中的至少约98%的胰岛素的初始浓度。在某些情况下,亦如图5中所示,在典型的冷藏温度(2-8℃,大约5℃)下贮存24个月之后,制剂可保持至少约100%的溶液中的胰岛素的初始浓度。在一些情况下,如在表7和表8中所描述,在典型冷藏条件下的18个月的贮存之后,制剂可显示约99%的效价。在一些情况下,如在表7和表8中所描述,在典型的冷藏条件下24个月的贮存之后,制剂可显示约101%的效价。例如,制剂可以不显现随时间推移效价的显著下降。在一些情况下,例如图6中所示在典型的冷藏温度下贮存6个月之后,制剂可累积仅约1-2%的irs。另外,在例如图6中所示的一些情况下,在典型的冷藏温度下贮存18个月之后,制剂可累积仅约2-3%的irs。另外,在例如图6中所示的一些情况下,在典型的冷藏温度下贮存24个月之后,制剂可累积仅约2-4%的irs。例如,在典型的冷藏条件下贮存18个月,制剂可显示约2.5-2.7%的%irs累积,如在表7和表8中所描述。在一些情况下,在典型的冷藏条件下24个月的贮存之后,制剂可显示约2.9-3.1%的%irs累积,如在表7和表8中所描述。在某些情况下,如图7中所示,在典型的冷藏温度下贮存6个月之后,制剂可累积仅约0.5-0.7%的异b3。在一些情况下,如图7中所示,在典型的冷藏温度下贮存18个月之后,制剂可累积仅约2.0-2.8%的异b3。在某些情况下,如图7中所示,在典型的冷藏温度下贮存24个月之后,制剂可累积仅约2.6-3.3%的异b3。例如,在典型的冷藏条件下贮存18个月之后,制剂可显示约2.29-2.45%的%b3累积,如在表7和表8中所描述。在一些情况下,在典型的冷藏条件下贮存24个月之后,制剂可显示约3.26-3.23%的%异b3累积,如在表7和表8中所描述。在一些情况下,如在图8中所示,在在典型的冷藏温度下贮存9个月之后,制剂可累积仅约0.4-0.9%的hmwp产物。在一些情况下,如图8中所示,在典型的冷藏温度下贮存18个月之后,制剂可累积仅约1.0-1.6%hmwp。在一些情况下,如图8中所示,在典型的冷藏温度下贮存24个月之后,制剂可累积仅约0.8-1.9%的hmwp。例如,在典型的冷藏条件下贮存18个月之后,制剂可显示约1.29-1.33%的%hmwp产物累积,如在表7和表8中所描述。在一些情况下,在典型的冷藏条件下贮存24个月之后,制剂可显示约1.40-1.43%的%hmwp产物累积,如在表7和表8中所描述。如在实施例3中所描述,在典型的冷藏温度下在24个月中制剂的ph值可保持稳定。在一些情况下,在ph7.5下,制剂可含有31.23mg/ml(900u/ml)或10.41mg/ml(300u/ml)胰岛素、6mm柠檬酸盐、和70mmnacl,及0.39%w/w锌对胰岛素(每个胰岛素六聚体2.0锌),如在表7和表8及图5-图8中所描述。在某些情况下,如在实施例4中所描述,胰岛素在制剂中的稳定性会受到ph值和锌浓度的影响。例如,如在图9-图12中所示,在具有较高ph值(例如至少ph7.2)和较低锌浓度(例如小于或等于约0.5%wt/wt锌对胰岛素、每个胰岛素六聚体2.7个锌)的制剂中,胰岛素的溶解度会较大(提高)。在一实施例中,如实施例4和图12中所示,ph低于7.2时胰岛素的溶解度降低,尤其是当锌浓度增高时。在一些情况下,制剂可含有35mg/ml(1009u/ml)胰岛素、6mm柠檬酸盐、和70mmnacl,如在图9-图2中所描述。在一些情况下,在这种条件下,制剂稳定达至少25周。在一些情况下,如在实施例5中所描述,本发明的胰岛素制剂当暴露于剪切力时可以是物理稳定的。在装运、处理、和典型的受试者使用产品期间,制剂经受剪切力。影响剪切力的一个因素包括制剂在容器内部的移动。因此,其中在受控制的条件下将制剂摇动的实验经常被用作用于确定剪切力对制剂的影响的实验室模式。如上所述,胰岛素制剂可显示由于可聚集并从溶液析出的胰岛素原纤维形成所造成的不稳定性。原纤维形成降低制剂的效价,并且可以通过额外的纤维化而促进进一步的脱稳。另外,原纤维沉积物对于治疗性制剂(尤其是被输送进入呼吸系统的吸入制剂)而言是不合适的。在一些情况下,如在表10和图13中所示,当暴露于恒定的搅拌剪切力达26天(冷藏条件)时,所提供的胰岛素制剂可保持大于90%的效价(初始胰岛素浓度)。在一些情况下,与在相同的时间段后保留小于50%效价的市售优泌林u-500制剂(含有0.25%wt/wt的苯酚)相比,该制剂显著地更加稳定。在一些情况下,该制剂的浊度可用于确定胰岛素聚集。例如,如在表11和图14中所示,在实施例5中所描述且在图13中所示的经搅拌制剂在5天的恒定搅拌后可具有增加的浊度。在一些情况下,提高的胰岛素浓度可促进制剂中的原纤维化,如与280u/ml制剂相比840u/ml制剂变得浊度增加的提高的速率所显示。在一些情况下,与市售的优泌林u-500制剂相比,在8天的时间段中,本发明的无防腐剂制剂显示显著较小的纤维化,如利用浊度所检测,如在图14中所示。在一些情况下,本发明的无防腐剂制剂在28天的时间段中,当暴露于剪切力时,可经历约0.5-1.7mg/ml的累积效价损失。这与在相同条件下在市售优泌林u-500制剂中所观察到的8.9mg/ml效价损失相反。在一些情况下,与市售的优泌林u-500制剂相比,所公开的制剂可经历约4-18倍较小的效价损失。换句话说,与所公开的制剂相比,市售的优泌林u-500制剂可经受约4-18倍更大的效价损失。在一些情况下,在ph7.55下,制剂可含有280u/ml(29.2mg/ml)和840u/ml(9.7mg/ml)胰岛素、6mm柠檬酸盐、70mmnacl、每个六聚体2.6个锌分子,如在图9-图12中所描述。在一些情况下,与在实施例6中所描述的含有苯酚作为防腐剂/稳定剂的类似制剂相比,本发明的无防腐剂制剂可更加稳定。例如,如在表12和图15中所示,在冷藏贮存的6个月中,在ph7.2或者ph7.4下,含有饱和量胰岛素的胰岛素制剂可保持至少90%的效价(初始的胰岛素浓度)。在另一个实施例中,还包含0.25%wt/vol苯酚的相似的制剂在6个月中仅保持在20%和35%之间的效价。在一些情况下,在无防腐剂制剂中,在贮存6个月之后,与ph7.2相比,在ph7.4下多6%的胰岛素可被保留。在其他情况下,在6个月的贮存之后,在含有苯酚的制剂中与ph7.2相比,在ph7.4下多15%的胰岛素可被保留。在一些情况下,含有苯酚的制剂会快速地变得不稳定,在1天内失去效力,如在表12和图15中所示,并且与在ph7.4下相比在ph7.2下具有更大的损失。在一些情况下,在ph7.2或7.4下,本发明的制剂可含有2017u/ml(70mg/ml),6mm的柠檬酸盐和70mm的nacl,及每个胰岛素六聚体2.6个锌分子,如在表12和图15中所描述。另一个方面是可将制剂可包装成一次使用“单位剂量”容器或多剂量容器。在一些情况下,提供在本发明中所描述的单位剂量的胰岛素制剂。一次使用容器的例子是泡罩包装或胶囊。多剂量容器的例子是滴式分配器(dropdispenser)、或玻璃小瓶。在一些情况下,提供一种胰岛素制剂,该胰岛素制剂包含胰岛素(以1-13mm的最小浓度)、盐(以50-150mm的浓度)、ph缓冲剂(以3-24mm的浓度)、锌(以每个胰岛素六聚体1.9-2.7个锌离子的比率)、及在7.2至8.0范围内的ph值,但不含有防腐剂或稳定剂。在一些情况下,该制剂可具有6-76mg/ml的胰岛素浓度。在一些情况下,该制剂可具有173u/ml至2189u/ml的胰岛素浓度。在一些情况下,胰岛素可以是人胰岛素。在一些情况下,该制剂可包含至少30mg/ml的胰岛素或者至少5.17mm的胰岛素或者至少864u/ml的胰岛素。在一些情况下,该制剂可含有10-30mg/ml或1.72-5.17mm的胰岛素。在一些情况下,该胰岛素制剂可具有约30mg/ml或者5.17mm或864u/ml的胰岛素浓度及约7.55的ph值。在一些情况下,胰岛素浓度可以是30mg/ml或者5.17mm或864u/ml,并且ph值可以是7.55。在一些情况下,该制剂的ph值可在7.4至7.6的范围内。在一些情况下,盐可以是氯化物盐。在一些情况下,盐可以是氯化钠(nacl)。在一些情况下,ph缓冲剂可以是柠檬酸盐。在一个实施例中,ph缓冲剂可以是柠檬酸钠。在一些情况下,该制剂的张力(离子强度)可以是100-300mosm。在一些情况下,该制剂可含有70mm的nacl或者具有相似离子强度的盐。在一些情况下,该制剂不含有表面活性剂。在一些情况下,该制剂可通过吸入或注射而给药。在一些情况下,该制剂可利用吸入装置而给药。在一些情况下,制剂可以被气溶胶化。在一些情况下,提供单位剂量的胰岛素制剂,如在此部分中或者本发明的其他地方所描述。iv.套件本发明的另一个方面是在部分iii中且在本发明的其他地方所描述的含有胰岛素制剂的套件。在一些情况下,套件可包含一个或多个单位剂量的所描述胰岛素制剂及用于施用该制剂的装置。套件可包括一次使用“单位剂量”容器或多剂量容器。一次使用容器的例子是泡罩包装或胶囊。多剂量容器的例子是滴式分配器、或小瓶。在一些情况下,用于施用制剂的装置可以是雾化装置。例如,在一些情况下,该装置可以是雾化器、吸入器、或喷雾器。可包括在套件中的示例性雾化装置描述于美国专利申请公布20110168172、20110017431、20130269684、20130269694、和20130269684;美国专利申请14/743,763、14/743,711、14/732,247、和14/732,446;及国际pct公布wo2013/158352和wo2013/158353中,上述各专利申请的全部内容以参考的方式并入本文中。用于液体制剂的雾化的其他装置在本
技术领域:
是众所周知的。在一些情况下,套件可包括用于通过注射而施用制剂的装置。例如,套件可包括一个或多个注射器。在另一个实施例中,套件可包括一个或多个针。在另一个实施例中,套件可包括一个或多个注射器及一个或多个针。套件也可包括用于通过注射而施用制剂的泵或笔装置。在一些情况下,套件可包括用于描述装置的使用从而施用制剂的说明书。v.治疗的方法如上所述,本发明的某些实施方式和方面涉及一种利用在部分iii中和本发明其他地方所描述的制剂对患有糖尿病的受试者进行治疗的方法。在一个方面,该方法可以包括将治疗有效量的制剂向患有糖尿病的受试者给药。可通过吸入或注射将制剂向受试者给药。例如,该制剂可以利用吸入装置例如雾化器、吸入器、或喷雾器而给药,或者通过注射(静脉内、肌肉、腹腔内)包括利用泵或笔而给药。用于施用所提供无防腐剂制剂的示例性雾化装置描述于美国专利申请公布20110168172、20110017431、20130269684、20130269694、和20130269684;美国专利申请14/743,763、14/743,711、14/732,247、和14/732,446;及国际pct公布wo2013/158352和wo2013/158353中,上述各专利申请的全部内容以参考的方式并入本文中。用于液体制剂雾化的其他装置(例如本文中所描述的)在本
技术领域:
是众所周知的。在一个方面,制剂的治疗有效量可以是经由肺路径而给药的20u至500u,典型的剂量为150u。在一些情况下,经由肺路径而给药的制剂的治疗有效量可以是150u。在一个方面,制剂的治疗有效量可以是通过皮下注射而给药的2u至28u,典型的剂量为21u。在一些情况下,这些通过皮下注射而给药的制剂的治疗有效量可以是21u。典型的剂量随着给药途径而变化,因为肺路径的效率是皮下路径的效率的大约5%-30%。作为参考,1u相当于0.0347mg的人胰岛素(28.8u/mg)。在一些情况下,合适的通过肺部给药的胰岛素制剂给药(例如通过气溶胶化制剂的吸入)是使用具有至少6mg/ml(1mm;168u/ml)浓度的制剂而执行,从而用最小的给药而实现所需的剂量。例如,如果胰岛素制剂具有低浓度,则会需要重复给药以实现所需的剂量。在一个方面,相对于可注射路径,经由吸入路径将胰岛素输送进入血液的效率为大约8-20%。在一个方面,相对效率为14%。在一些方面,通过在一次或两次给药中的气溶胶制剂的吸入,尤其是通过受试者的一次或两次吸入,胰岛素制剂可以将200u/ml胰岛素的剂量向受试者给药。在一些情况下,制剂的胰岛素浓度可在1-13mm(或者6-76mg/ml或173-2189u/ml)的范围内,以用最小的给药便提供充分的剂量。在一些情况下,制剂的胰岛素浓度可以是10-30mg/ml胰岛素(1.72-5.17mm)以便用最小的给药提供充分的剂量。在一些情况下,制剂的胰岛素浓度可以是至少30mg/ml胰岛素,以便用最小的给药提供充分的剂量。在另一个方面,制剂是在受试者就餐之前给药。例如,制剂可在受试者即将就餐之前给药。在另一个实施例中,制剂可在受试者就餐至少15分钟之前给药。在一些实施例中,制剂可每天给药至少一次。在某些情况下,制剂可以多达1、2、3或4次每天的频率而给药。vi.实施例以下所提供的实施例是用于说明但不限制要求保护的本发明。实施例1目的:为了确立含有900u/ml(31.2mg/ml,5.37mm)胰岛素的加缓冲剂的胰岛素制剂在70mm氯化钠中的化学稳定性,在多种ph缓冲剂中鉴定一个ph缓冲剂以维持制剂中的稳定的胰岛素。此研究特定地将缓冲剂类型视为一个变量。胰岛素和氯化钠水平保持不变。胰岛素浓度被固定在900u/ml(31.2mg/ml)。制剂组分:使用含有0.42%w/w锌对胰岛素(约2.2锌每六个胰岛素单体)的usp重组人胰岛素(sanofi-aventis,material:192228,gmid:341921)而制备制剂。以下的材料是从jtbaker获得:usp柠檬酸钠二水合物;usp碱;usp磷酸二氢钠;hplc级水;盐酸(37%)、氯化锌、和氢氧化钠颗粒。方法描述:制备六个不同的制剂。就各制剂而言,称量重组人胰岛素并且在87.5mm盐酸中溶解至80%的最终体积。称量缓冲剂(柠檬酸盐、三羟甲基氨基甲烷、磷酸盐、或者无缓冲剂)并加入各制剂中至表1中所列出的相对于最终稀释体积的浓度。为了+1zn条件,添加氯化锌至0.61%w/w锌对胰岛素的最终锌浓度。添加氢氧化钠(1m)将ph值调节至7.5。用水将该制剂调节到最终体积并重新检查ph值,如果需要,重新调节到ph7.5。表1.缓冲剂/浓度过程:将各制剂置于冷藏贮存中(2-8℃;大约5℃)。将冷藏的制剂贮存达多达23个月并且在0、6、12、18和23个月中两个以上的时间点取样。在0至23个月的时间点,利用高效液相色谱法对各样品进行分析。在实验开始然后在6个月、12个月、18个月和23个月,通过反相高效液相色谱法(rp-hplc)分析在5℃下各样品中的胰岛素有关物质(irs)和异b3。hplc测定:通过使用c-18、3×250mm柱反相(rp)的hplc法在waters公司(milford,ma)的带二极管阵列检测器的hplc组件中,测量异b3和胰岛素有关物质(irs)的含量。将检测器设定在214nm处。流量为0.55ml/分钟。将各样品稀释于100mm磷酸盐缓冲剂(ph7.8)中并且在2mg/ml浓度下进行测试。就异b3确定而言,移动相a是7%乙腈和93%140mm过氯酸钠(用磷酸将ph值调节到2.3),移动相b是57%乙腈、65mm过氯酸钠(用磷酸将ph值调节到2.3)。就前30分钟而言在55%b处测定条件是等度的,从30到56分钟存在到80%b的梯度,在56分钟后移动相百分比恢复到初始条件。就irs确定而言,移动相a是18%乙腈、82%200mm硫酸钠(用磷酸将ph值调节到2.8),移动相b是50%乙腈、50%200mm的硫酸钠(用磷酸将ph值调节到2.8)。就前32分钟而言在22-30%b处初始条件是等度的,对%b进行调节使得胰岛素保留时间在17-24分钟之间,从32-57分钟起使%b在线性梯度中增加到52%b,在57分钟处移动相恢复到起始条件。对hplc色谱图进行了评估以确定相对于完整胰岛素的胰岛素降解产物的峰面积。总百分比的降解产物被称为胰岛素有关物质(%irs)。这些包括所有的胰岛素相关降解峰,除了a21和异b3脱酰胺峰外。这两种物质单独地由usp和ep专论所论述并且通常不包括在%irs中。确定以总胰岛素(所有的峰)百分比形式的irs峰表示的面积,并且通过线性回归对各数据点进行分析以确立趋势线。每个月,基于该趋势线的斜率而计算%异b3和%irs变化。结果:将此实验的分析结果示于表2和表3中并且以图示于图1和图2中,并且在下面进行描述。20mm三羟甲基氨基甲烷+1zn(0.61%wt/wt锌对胰岛素)物理地沉淀,从而导致小的效价降低(数据未显示)。在图1-图2中将参比(无缓冲剂)溶液标示为“nacl”。表2.胰岛素的化学稳定性与缓冲剂类型–面积%异b3的关系(5℃)ns=未取样表3.胰岛素的化学稳定性与缓冲剂类型-面积%irs的关系(5℃)ns=未取样当ph值升高时,异b3更快地形成(参见实施例1)。缓冲剂溶液通过吸收环境中的质子和电子而限制ph值变化。表2中的结果表明:基于所选择的缓冲剂类型,在5℃下异b3的形成速率是在0.14-0.25%每个月的范围内。此数据提示当用于控制ph值的缓冲剂包括柠檬酸盐时异b3的形成速率下降。相对于含有柠檬酸盐的配方,三羟甲基氨基甲烷、磷酸盐、和未加缓冲剂的溶液显示显著较高的异b3形成速率,尽管各溶液维持7.5的ph值。irs的形成是在0.11-0.12%每个月的范围内,除了柠檬酸盐/三羟甲基氨基甲烷组合之外,该组合以0.14%每个月的速率形成irs。这些结果提示:无论缓冲剂如何,胰岛素二聚体和除异b3以外的水解产物的形成通常是相似的。三羟甲基氨基甲烷与柠檬酸盐的组合显示略微较高的%irs,这会是多种因素的结果,包括两种缓冲剂类型的存在、或者溶液渗透压的升高。此研究提示柠檬酸盐缓冲剂充分地缓冲ph从而限制胰岛素水解(异b3)和共价二聚体形成(irs)。实施例2目的:确定一系列ph值下在6mm柠檬酸钠和70mm氯化钠中的含有900u/ml(31.2mg/ml,5.37mm)胰岛素的加缓冲剂胰岛素制剂的化学稳定性,从而确定用以维持制剂中的稳定胰岛素的ph范围。此研究特定地将ph值视为一个变量。胰岛素、氯化钠、和柠檬酸钠的含量保持不变。制剂组分:使用含有0.42%wt/wt锌对胰岛素(约2.2个锌每六个胰岛素单体)的usp重组人胰岛素(sanofi-aventis,material:192228,gmid:341921)来制备制剂。以下的材料是从jtbaker获得:usp柠檬酸钠二水合物;hplc级水;盐酸(37%)、和氢氧化钠颗粒。方法描述:称量重组人胰岛素并且在87.5mm盐酸中溶解到80%的最终体积。将柠檬酸钠二水合物添加到该制剂中至6mm的浓度(相对于最终稀释体积)。添加氢氧化钠(1m)将ph值调节至7.0。用水将该制剂调节到最终体积,并重新检查ph值。将此整体制剂等分进入6个单独的具有teflontm密封件和螺丝帽封闭件的玻璃容器中。用小体积的氢氧化钠,将各单独容器的ph值仔细地调节到不同的ph值:7.0、7.2、7.4、7.6、7.8、和8.7。过程:将各制剂的一部分置于冷藏贮存(2-8℃,大约5℃)中。各制剂的还有一部分在25℃下(培养箱)贮存。将冷藏的制剂贮存达多达24个月,在0、5、9、15、18和24个月的时间进行取样。将在25℃下贮存的样品存放2周,然后进行取样。利用hplc对样品进行分析从而确定%异b3含量和%irs含量,如在实施例1中所描述。结果:将此实验的分析结果示于表4-表6并且在下面进行描述。图3和图4分别示出了在第15-第18月中在5℃下在各ph条件下的异b3和irs的生成速率。通过线性回归对各数据点进行分析,从而确立趋势线。每个月基于趋势线的斜率而计算%异b3和%irs变化。表4.胰岛素的化学稳定性ph值-面积%异b3的关系(5℃)时间(月):05151824%异b3/月ph7.00.050.651.932.312.910.12ph7.20.050.742.032.533.310.14ph7.40.050.882.372.953.830.16ph7.60.051.012.733.374.370.18ph7.80.051.163.103.884.890.20表5.胰岛素的化学稳定性ph值-面积%irs的关系(5℃)时间(月):059151824%irs/月ph7.00.501.392.603.153.384.260.15ph7.20.501.211.992.392.463.200.11ph7.40.501.031.551.802.702.890.10ph7.60.500.941.361.591.922.420.08ph7.80.500.811.201.421.671.970.06ph值与胰岛素降解之间的关系是复杂的。为了使胰岛素制剂的稳定性最大化,非常重要的是控制ph值。表5中的结果表明在5℃下随着ph值升高irs的形成速率从在ph7.0下的0.15%每个月下降至在ph7.8下的0.06%每个月。ph值的升高对异b3的生成具有相反的作用,如表4中所示,其中随着ph值的升高形成的速率从在ph7.0下的0.12%每个月提高至在ph7.8下的0.20%每个月。当ph值升高时,异b3形成增加并且irs形成下降(ph值范围:7.4-8.0)。在大于8.0的ph值下,胰岛素的水解似乎以更快速的速率而发生。所观察到的异b3水平增加对于制剂稳定性的重要程度低于irs的水平降低对制剂稳定性的重要程度,甚至在最高的ph值下,因为异b3基本上保持生物活性(它保持>90%的胰岛素活性)。因此,在ph7.6和ph7.8下胰岛素制剂维持效价,并且此水平下的异b3形成对于市售的制剂而言是可接受的。表6示出了在25℃下贮存达2的异b3的形成。随着温度(25℃)和ph值(ph8.7)的升高,异b3形成则快速地发生。表6.胰岛素的化学稳定性与ph值-面积%异b3的关系(25℃)第2周的时间点异b3(%面积)ph7.41.08ph7.61.19ph7.81.33ph8.71.96此研究提示:在长期贮存条件下,将制剂的ph范围维持在7.4和7.8之间充分地限制了胰岛素水解(异b3)和共价二聚体(胰岛素有关物质)形成。实施例3目的:此研究对在模拟市售包装的配备有滴式分配器的玻璃容器中具有不同胰岛素浓度的制剂进行了评估,从而确定胰岛素制剂的预计货架期(稳定性)。在24个月中,对在ph7.5下在6mm柠檬酸钠和70mm氯化钠中含有10.41mg/ml(300u/ml,1.79mm)和31.23mg/ml(900u/ml,5.38mm)胰岛素(0.39%锌w/w锌对胰岛素)的加缓冲剂胰岛素制剂的化学稳定性进行了评估。制剂组分:使用含有0.39%w/w锌对胰岛素(约2.2个锌每六个胰岛素单体)的usp重组人胰岛素(sanofi-aventis公司,material:192228,gmid:341921)而造制剂。以下的材料是从jtbaker获得:usp脱水柠檬酸钠、hplc级水、盐酸(37%)、和氢氧化钠颗粒。方法描述:将重组人胰岛素溶解于87.5mm盐酸至80%的最终体积。称量柠檬酸钠以6mm的浓度(相对于最终稀释体积)加入该制剂中。添加氢氧化钠(1m)至最终体积7%的量。用水使各制剂成为最终体积。检查ph值,用氢氧化钠调节到7.5的最终ph值。最终批次体积为1l;最终胰岛素浓度为10.41mg/ml(300u/ml,1.79mm)和31.23mg/ml(900u/ml,5.38mm)。过程:将各制剂等分进入4个配备有滴式分配器的玻璃容器中。填充体积为8ml。小瓶是从gerresheimer公司购得,10ml容积,部件编号f008x1p20-0150。滴式分配器是从aeropump购得,部件编号70019500。这些滴式分配器代表了最终包装的一个例子。在0至24个月的一些时间点对各样品进行了评估。在采用usp专论方法的与usp人胰岛素参考标准的比较中,利用rp-hplc测定了效价。利用rp-hplc测定异b3脱酰胺物和a21含量,如在实施例1中所描述。利用体积排阻高效液相色谱法(sec-hplc)测定高分子量聚合物(hmwp)的量。通过目视检查和效价测量而确定溶解度(对任何晶体形成的观察)。使用典型的配备有探头的ph计(orionstara211及ag/agcl组合ph半微量环氧树脂电极)来测量ph值。按照被设定用以确立最小稳定制剂的验收对标准稳定性参数进行测量。验收标准是基于用于胰岛素制剂的美国药典和欧洲药典建议并且基于用于胰岛素总体物理和化学稳定性的已知标准而设定。ph验收标准是基于在实施例2中所观察到的在低于ph7.2时胰岛素溶解度下降并且在超过ph7.8时水解反应增加而设定。将该验收标准设定为如下:90-110%效价、≤6.0%irs、≤5.0%异b3、≤5.0%a21、≤2.0%hmwp,及ph值在7.2-7.8。在24个月的时间段中符合这些验收标准的制剂将被认为对于商品化而言是充分稳定的。利用线性回归对各数据点进行分析以确立用于效价、%异b3、%irs、和%hmwp的趋势线。趋势线是用于估计在产品货架期内纯度和效价的变化速率并且用于基于所设定的验收标准来预测期望货架期。结果:将此实验的分析结果示于表7和表8及图5-图8中并且在下面进行描述。数据是n=4重复,以平均值±标准偏差的形式而提供。表7.300u/ml胰岛素制剂稳定性分析ns:未取样。表8.900u/ml胰岛素制剂稳定性分析ns:未取样。表7和表8中的结果显示了在5℃下贮存24个月后目标胰岛素浓度的101.1–101.5%的效价。这些结果相当于0.8-1.4%的效价降低。将结果以图表的形式示于图5(这些结果是以它们初始值的百分比的形式而图示)。这些结果是线性的并且表明效价保持在目标所确立的90-110%的验收标准内,达到显著地长于预期的2年产品保质期。基于趋势线的斜率,预测在132个月后效价达到90%(最低验收标准)。表7和表8中的结果表明在5℃下在24个月的贮存后胰岛素有关物质(%irs)是在2.9%-3.1%之间。此百分比显著地低于6%的验收标准。这些结果是以图表的形式示于图6中。基于趋势线,预测在50个月后%irs达到6%的验收标准。此结果表明在预计的2年产品保质期期间irs将在可接受的限值内。在表7和表8中的结果显示了在5℃下在24个月贮存后大约3.2%的异b3值。这些结果是以图表的形式示于图7中。趋势数据预测在38个月后%异b3将达到5%的验收标准。此结果表明在预计的2年产品保质期期间异b3将在可接受的限值内。在表7和表8中的结果显示了在5℃下在24个月的贮存后大约1.4%的%hmwp值。这些结果是以图表的形式示于图8中。趋势数据预测在33个月后%hmwp将达到2%的验收标准。此结果表明在预计的2年产品保质期期间%hmwp将在可接受的限值内。在初始研究期中ph略微下降,接着没有显著的趋势。此结果与典型的水溶液一致,该典型水溶液从环境中吸收二氧化碳,从而导致轻微的酸化。预测在预计的2年保质期期间ph值是稳定的。对数据的studentt-检验分析表明在为300u/ml和900u/ml制剂所观察的结果之间无显著性差异(p>0.05)。这些结果证实了300u/ml和900u/ml制剂是可接受地相似的原假设。用于确定胰岛素制剂保质期的重要标准是效价(标称/所需的制剂浓度的%)、irs水平、和hmwp水平。ph值的稳定性也是重要的,尤其是对于非常浓缩的胰岛素制剂而言(例如,接近饱和限值),以避免胰岛素的等电点沉淀或重结晶。在该研究的过程中所提供的制剂保持非常澄清(从而表明有很少的蛋白质沉淀,如果有的话)并且是在所设定的验收标准内。在5℃下各制剂也显示非常好的稳定性达至少2年的冷藏贮存期。此研究的结果提示通过限制异b3、irs和hmwp的形成在300u/ml和900u/ml胰岛素下所述制剂提供可接受的长期稳定性。实施例4目的:评估ph值与锌含量对胰岛素制剂物理稳定性的影响之间的关系,并且确定这些参数的最佳范围用以维持胰岛素制剂的物理稳定性。在此实验中,胰岛素、氯化钠、和柠檬酸盐离子保持不变。锌含量和ph值发生变化。制剂组分:使用含有0.39%w/w锌对胰岛素的usp重组人胰岛素(sanofi-aventis公司,material:192228,gmid:341921)而制备制剂。以下的材料是从jtbaker获得:usp柠檬酸钠二水合物;hplc级水;盐酸(37%)、氯化锌、和氢氧化钠颗粒。方法描述:制备四个35mg/ml胰岛素(6.03mm,1008u/ml)制剂。各制剂是通过分别添加柠檬酸钠二水合物和氯化钠至6mm和70mm的最终浓度而制备。氢氧化钠是用于分别将各制剂的ph值调节至7.0、7.1、7.2和7.3。然后,将这四个制剂各自分离成三个相等的部分。以非常小的相对体积(最终制剂体积的0.1-0.2%)将额外的锌(以氯化锌的形式)加入各ph值下一个部分中。最终锌浓度分别为0.39%w/w、0.45%w/w、和0.51%w/w锌对胰岛素,相当于2.08、2.40、和2.73锌每个六聚体。对制剂的ph值进行重新检查,如果需要的话使用小体积的氢氧化钠将ph值调节到7.0、7.1、7.2和7.3。将制剂基体示于表9。表9.具有变化的锌和ph值的制剂过程:将各制剂置于冷藏贮存(2-8℃;大约5℃)中并贮存达多达25周。在贮存中的时间0、2周、5周、10周、和25周取样。通过在276nm波长处的紫外光谱分析来确定制剂中的胰岛素浓度(胰岛素溶解度)。结果:将此实验的分析结果示于图9-图12,并且在下面进行描述。具体地,图9-图11示出了在制剂中随时间推移作为ph值的函数的胰岛素浓度变化,图12示出了作为ph值和锌浓度的函数的各制剂中胰岛素最终浓度的比较。如图9中所示,在ph7.2和7.3及0.39%锌含量下制剂的胰岛素浓度在实验误差内保持相同,但在ph7.0和7.1且具有0.39%的锌含量下随时间推移而降低。损失逐渐地发生并且在ph7.1下直到在8周的时间点后才能观察到。在ph7.0下的降低为14.4mg/ml,等同于41.9%的损失。在ph7.1下的降低为8.3mg/ml,等同于23.9%的损失。如图10中所示,在ph7.3和0.45%锌含量下制剂的胰岛素浓度在实验误差内保持相同,但在ph7.0、7.1和7.2下随时间推移而降低并且具有0.45%的锌含量。损失逐渐地发生并且在ph7.2下不能被观察到直到在第8周的时间点之后。在ph7.0下的降低为17.7mg/ml,等同于51.2%的损失。在ph7.1下的降低为12.3mg/ml,等同于35.6%的损失。在ph7.2下的降低为2.5mg/ml,等同于7.6%的损失。如图11中所示,在ph7.3和0.51%锌含量下各制剂的胰岛素浓度在实验误差内保持相同,但在ph7.0、7.1和7.2下随时间推移而降低并且具有0.51%的锌含量。损失逐渐地发生并且在ph7.2下直到在8周的时间点后才能被观察到。在ph7.0下的降低为18.6mg/ml,等同于54.1%的损失。在ph7.1下的降低为14.0mg/ml,等同于41.2%的损失。在ph7.2下的降低为7.8mg/ml,等同于22.5%的损失。图12示出了作为锌含量和ph值的总体函数的在25周时间点制剂的胰岛素浓度。这些结果显示了在ph值更高和锌浓度更低时朝向更高溶解度的趋势。所有溶液在ph7.3下是完全水溶性的。一般来说,若ph7.3以上(例如,ph7.3-7.8),在相对于胰岛素的锌浓度0.51%w/w下胰岛素易于保持35mg/ml的水溶性。然而,如在实施例1中所述,相对于胰岛素的0.61%w/w的锌浓度在ph7.5下显示沉淀。此研究的反映了在ph值、锌浓度、和胰岛素制剂随时间推移的物理稳定性之间的复杂关系。由于在ph值、锌浓度和溶解度之间的时间依赖性关系,因而重要的是评估相当于预计保质期预期或要求的胰岛素制剂的长期稳定性。此研究的结果表明:除ph值外,锌在胰岛素制剂中的浓度在长期物理稳定性中是一个重要因素。实施例5目的:了解暴露于摇动的所提供胰岛素制剂的物理稳定性。摇动模拟在胰岛素制剂的装运和处理期间会导致纤维化的状况。对具有不同缓冲剂的胰岛素制剂与市售的含有间甲酚(作为稳定剂/防腐剂)及甘油的胰岛素制剂进行了比较。制剂组分:使用含有0.50%w/w锌对胰岛素(约2.6锌每六个胰岛素单体)的usp重组人胰岛素(sanofi-aventis公司,material:192228,gmid:341921)而制备制剂。以下的材料是从jtbaker获得:usp柠檬酸钠二水合物;hplc级水;盐酸(37%)、和氢氧化钠颗粒。方法描述:制备在6mm柠檬酸钠和70mm氯化钠中含有29.2mg/ml(840u/ml,5.03mm)和9.7mg/ml(280u/ml,1.67mm)胰岛素的制剂。将重组人胰岛素称重并且在87.5mm盐酸中溶解至80%的最终体积。将柠檬酸钠二水合物添加到该制剂中至0、3、6、12、和24mm的浓度(相对于最终稀释体积)。添加氢氧化钠(1m)将ph值调节至7.55。用水将制剂调节到最终体积,并重新检查ph值。为了方便参考,这些制剂将被称为无防腐剂制剂。对无防腐剂制剂与市售的胰岛素制剂优泌林u-500(hi-500)(ndc0002-8501-01)进行了比较,该优泌林制剂含有500u/ml(17.4mg/ml)胰岛素、0.017mg锌/100胰岛素单位(相当于0.49%的锌、或者约2.6锌每个胰岛素六聚体)、16mg/ml(1.6%)甘油、和2.5mg/ml(0.25%)间甲酚,并且添加hcl和/或naoh用于ph值调节。优泌林,批号c398930a,保质期:2016年11月,是从elililly公司购得。下面此制剂被称为“优泌林”。过程:各制剂的10ml等分至20ml超净(vwr部件编号159000-020)闪烁计数瓶。将各小瓶固定到定轨摇床并且以120rpm摇动(120每分钟转数,并且具有18mm的轨道直径)。在0-28天或0-15天的多个时间点,利用被设计用于确定不溶性胰岛素原纤维(聚集的胰岛素)浓度的两种正交方法,对各样品进行分析。1.利用hplc测量效价效价是胰岛素浓度的量度。当胰岛素发生原纤维化和沉淀时,溶液中胰岛素的效价降低。较低的效价对应于较大的聚集(物理不稳定性)。在时间0、第6天、第18天、和第28天进行评估。2.利用浊度计测量浊度浊度是溶液的混沌或浑浊度的量度。为了此分析的目的,浊度描述已从样品溶液中沉淀出的不溶性颗粒(胰岛素原纤维)的存在。较高的浊度对应于较大的聚集(物理稳定性)。在时间0、第4天、第6天、第8天、第11天、和第15天进行评估。结果:将此实验的分析结果示于表10-表11及图13和图14并且在下面进行描述。表10.摇动后胰岛素制剂的效价1未取样。假设在t=0时,各浓度下的各制剂是相当的。2未取样。在此时间点对于此样品未获得数据。表11.摇动后胰岛素制剂的浊度1不适用。假设在t=0在各浓度下的各样品是相等的。2浊度>200;超过用于准确测量的阈值。已发现,与市售的优泌林制剂相比,无防腐剂胰岛素制剂具有增加的对纤维化(剪切力)的抗性,如下面进一步的描述。本文中所描述制剂的显示:与10.0和29.6mg/ml的起始浓度相比,在28天后对280u/ml和840u/ml的浓度,分别为8.7-9.5mg/ml和27.9-28.3mg/ml的效价。这意味着由于大约0.5-1.7mg/ml的纤维化所造成的累积损失。与17.1mg/ml的起始效价相比,在28天后优泌林显示8.2mg/ml的效价。这意味着由于8.9mg/ml的纤维化所造成的累积损失。此数据表明市售的优泌林制剂经历比本文中所描述无防腐剂制剂大4-18倍的效价累积损失。优泌林制剂最早在第4天显示浊度的增加(不溶性原纤维的存在),并且到第8天读数超过装置的可测量范围。相反,本文中所描述的无防腐剂制剂不显示浊度的显著增加直到第6或第8天,并且在第15天测量值仍然是在范围内。此研究表明本文中所描述的制剂对纤维化具有显著的抗性,而且与具有酚类防腐剂的稳定化效果的市售制剂相比更具有抗性。实施例6此研究的目的是评估在具有非常高浓度胰岛素的胰岛素制剂中苯酚是否影响胰岛素的溶解度。该研究评估了相对于含有酚类防腐剂/稳定剂的胰岛素制剂,根据本发明的无防腐剂胰岛素制剂的物理稳定性,这两种制剂含有饱和水平的胰岛素(70mg/ml,12mm,2016u/ml)。含有苯酚的制剂包含0.25%wt/vol的苯酚,这是在常见市售制剂(例如,r500;参见实施例5)中所发现的浓度。虽然苯酚是基于wt/wt而添加到中,但在以下实验中所评估的含苯酚制剂是基于wt/vol而包含苯酚。在本上下文中wt/wt和wt/vol基本上是可互换的,因为和含苯酚制剂的密度非常接近于1g/ml。制剂组分:使用含有0.50%wt/wt锌对胰岛素(约2.6锌每六个胰岛素单体)的usp重组人胰岛素(sanofi-aventis,material:192228,gmid:341921)而制备制剂。以下的材料是从jtbaker获得:usp柠檬酸钠二水合物;usp级苯酚;hplc级水;盐酸(37%)、和氢氧化钠颗粒。1.整体制剂:制备整体制剂,之后分为四个部分。将重组人胰岛素称重并溶解于87.5mm盐酸至80%的最终体积。将柠檬酸钠二水合物添加到制剂中至最终浓度6mm。将整体制剂的各部分取出从而制备无防腐剂和加防腐剂的制剂,如下所述。在这些最终添加之后,胰岛素浓度为70mg/ml。此制剂被预期是饱和溶液,因此70mg/ml的胰岛素浓度接近于在所评估ph值下的胰岛素溶解度的限值。nacl的最终浓度为70mm。2.无防腐剂制剂:将两个部分从整体制剂中取出。添加氢氧化钠(1m)将ph值分别调节至7.20和7.40。用水将制剂调节到最终体积并重新检查ph值。nacl的最终浓度为70mm。3.酚类制剂:将两个部分从整体制剂中取出。以最终体积的0.25%wt的浓度添加苯酚。添加氢氧化钠(1m)将ph值分别调节至7.20和7.40。用水将制剂调节到最终体积并重新检查ph值。过程:将20ml的各制剂在5℃下放置并且在0、3个月、和6个月的时间点分析胰岛素效价。通过将制剂的一部分(大约300μl)离心以去除不溶性蛋白质沉淀物,而制备样品。利用hplc对上清液的效价进行评估(以mg/ml为单位的浓度而报告),如在实施例3中所描述。结果:将此实验的分析结果示于表12和图15并且在下面进行描述。表12.无防腐剂和加防腐剂制剂的效价(浓度)含有苯酚的制剂显示立即沉淀,使得在初始分析中它们的浓度就低于70mg/ml并且到第3个月它们的效价失去超过一半。在6个月后,在ph7.2和7.4下含苯酚制剂分别显示它们理论效价的33.7%和48.1%的效价。相反,无防腐剂制剂就ph7.2制剂而言在第3个月和第6个月之间的贮存中经历小的效价损失,同时ph7.4制剂在研究过程中维持其效价。在第6个月时,在ph7.2和7.4下无防腐剂制剂的效价分别为93.1%和99.1%。因此,与含苯酚制剂相比,高浓度的无防腐剂胰岛素制剂显示提高的物理稳定性(溶解度)。此结果是出人意料的,因为如上所述,防腐剂通常是被添加用于提高可注射胰岛素制剂的化学稳定性。重要地,在长期分析中观察到效价的降低。有时是采用短时间过程(常常小于1天)来进行饱和溶解度研究。如果此研究未延长至较长的时间点,那么含苯酚制剂的效价损失程度将不被观察到。实现高胰岛素浓度并且具有可接受的物理稳定性对于可吸入胰岛素的吸入溶液而言是重要的,因此本发明的无防腐剂制剂似乎为此目的提供了一个优势。应当理解的是,在本发明中所陈述的数值可包括在合理实验误差内的一定程度的可变性。例如,所列举值可包括相比所列举值大或小10%的值。在一些情况下,该可变性适应在用于指代该特征的单位之间的转换(例如,在mg/ml和u/ml之间转换)的。在一些情况下,此可变性是通过用语“约”的使用而表示,但它是隐含在与本发明的制剂的特征和其他方面有关的所有值中,无论该值是否被用语“约”所修饰。前面对某些实施方式的描述,包括所说明的实施方式,只是为了说明和描述的目的而提供并且并非意图是详尽无遗的或者将本发明局限于所公开的具体形态。在不背离本发明的范围的前提下,许多修改、调整、及其使用对于本领域技术人员而言将是显而易见的。在本说明书中和单独实施方式的上下文上所描述的某些特征也可以在单个实施例中组合地实施。相反地,在单个实施例的上下文中所描述的各种特征也可以单独地以多种方式或者以任何合适的亚组合的形式而实施。此外,尽管各特征在上文中可以被描述为在某些组合中起作用,但在一些情况下可以将来自组合的一个或多个特征从该组合中去除,并且该组合可针对亚组合或者亚组合的变型。这样已描述了具体实施方式。其他实施方式也是在本发明的范围内。在本申请中所引用的所有印刷专利和申请的全部内容以参考的方式并入本文中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1