用于肿瘤局部放疗的可注射多肽水凝胶及其制备方法与流程
本发明涉及一种用于肿瘤局部放疗的可注射多肽水凝胶及其制备方法。基于聚乙二醇和疏水性聚酪氨酸共聚物,开发并公开了一种能够高效负载放疗剂,可注射且可降解的多肽水凝胶,用于肿瘤的特异性局部放疗。
背景技术:
目前,我国癌症的发病人数和死亡人数仍处于不断增长的状态,放射治疗仍是临床上治疗肿瘤的主要手段之一。然而,常规放射性治疗由于辐射面积较大、放射性射线剂量大和贯穿人体,对人体的正常组织结构损伤很大。现阶段,临床上广泛使用基于碘-125的“放射性籽源植入治疗”,即通过手术开创将放射性籽源植入至肿瘤组织或其周围,利用籽源发出的低能量γ射线杀死癌细胞,达到治疗和缓解癌症的目的。虽然此手段在临床治疗中取得了良好的治疗效果和较低的副作用。但是,当需要长期放疗或短半衰期放疗时,频繁地多次手术开创植入放射性籽源和治疗后开创取出籽源都会给病人的肿瘤治疗和术后愈合带来极大的痛苦和麻烦,也给放疗方案的制定和实施带来了困扰。因此,制备一种具有放疗剂高装载率、无毒、稳定、可降解、易于注射的多肽水凝胶,实现放疗制剂的可注射化、安全化、自降解化,以及对肿瘤的特异性局部放疗,这些都具有重要的基础研究意义和临床应用价值。
技术实现要素:
本发明的目的是提供一种用于肿瘤局部放疗的可注射多肽水凝胶及其制备方法。该多肽水凝胶,具有成胶速度快、放疗剂负载率高、高稳定性、易于植入、可降解和安全无毒等优点。该多肽水凝胶放疗制剂能够实现对肿瘤组织的局部特异性治疗,易于植入和可降解的特性免去了手术开创植入放射性籽源给病人带来的痛苦和麻烦。
本发明提供的用于肿瘤局部放疗的可注射多肽水凝胶为聚乙二醇与聚酪氨酸的共聚物mPEG-p(Tyr)x的131I标记物水溶液,表示为mPEG-p(Tyr-131I)x,多肽共聚物mPEG-p(Tyr)x水溶液(凝胶)的浓度范围为10 mg/mL-200 mg/mL。
本发明提供的用于肿瘤局部放疗的可注射多肽水凝胶的制备方法包括的步骤:
1)以无水二甲基甲酰胺为溶剂将端基为甲氧基和氨基的聚乙二醇(mPEG-NH2)与酪氨酸-N-羧基-环内酸酐(Tyr-NCA)均匀混合,于25-30°C水浴条件反应45-48小时。
2)将反应溶液滴加到冰乙醚中,过滤;
3)取沉淀,真空干燥得到聚乙二醇与聚酪氨酸的共聚物mPEG-p(Tyr)x;
4)通过核磁共振氢谱1H NMR鉴定分析产物中酪氨酸单体的聚合度。
5)按常规氯胺T法将放疗剂131I标记到mPEG-p(Tyr)x。
6)利用凝胶层析分离技术进行标记物mPEG-p(Tyr-131I)x 的分离,利用薄层放射性扫描技术对标记物的标记率进行检测和对分离物进行放化纯度鉴定。
7)配制浓度为50 mg/mL的mPEG-p(Tyr-131I)x水溶液,于30-37 °C恒温水浴锅内加热1-5分钟,溶液倒置30秒内不流动,得到放疗用mPEG-p(Tyr-131I)x多肽水凝胶。
所述的端基为甲氧基和氨基的聚乙二醇的分子量为2000 g/moL,端基为甲氧基和氨基的聚乙二醇与酪氨酸-N-羧基-环内酸酐的质量比为1-2:0.6-1。
所述的多肽共聚物mPEG-p(Tyr)x中Tyr的聚合度x为4-10之间。mPEG-p(Tyr-131I)x共聚物中131I的含量为16.5%-26.5%(质量)。
本发明的放疗用多肽水凝胶(甲氧基聚乙二醇-聚酪氨酸/碘-131,mPEG-p(Tyr-131I)),放疗剂131I是通过氯胺-T法标记在酪氨酸Tyr上,利用凝胶层析分离技术进行标记物mPEG-p(Tyr-131I)x的分离,利用薄层扫描仪对标记物的标记率进行检测和对分离物进行放化纯度鉴定。
本发明的放疗用mPEG-p(Tyr-131I)x多肽水凝胶,是经过温度刺激,疏水相互作用和聚酪氨酸多肽折叠相结合组装成的多肽水凝胶,在分散介质中多肽共聚物浓度范围为10 mg/mL-200 mg/mL。分散介质包括水、PBS缓冲液、氯化钠注射液以及葡萄糖注射液等。
本发明的放疗用mPEG-p(Tyr-131I)x多肽水凝胶,能够通过注射器直接注射到肿瘤组织,在体内37 °C条件下,由水溶液状态转变为凝胶相,凝胶能够长时间保持稳定、不分散状态,放疗剂131I释放射线杀死肿瘤细胞。
本发明的放疗用mPEG-p(Tyr-131I)x多肽水凝胶对多种癌细胞(宫颈癌细、肝癌、乳腺癌)都有良好的细胞生长抑制效果,并显示出放射剂量依赖性。
本发明的放疗用mPEG-p(Tyr-131I)x多肽水凝胶,能够靶向局部杀伤肿瘤细胞,对正常组织未见辐射损伤效应,表现出高特异性杀伤肿瘤效果。
本发明的放疗用mPEG-p(Tyr-131I)x多肽水凝胶,具有良好的可降解性,在放疗剂131I发挥药效后能够完全降解,不产生任何残留物,免于放射治疗后取出籽源及由蓄积产生的副作用。
本发明的放疗用mPEG-p(Tyr-131I)多肽水凝胶,能够通过疏水互相作用负载疏水性小分子抗肿瘤药物,例如阿霉素和紫杉醇等,形成放化疗共混凝胶制剂,实现放化疗结合治疗肿瘤。
附图说明
图1为本发明实施例的多肽共聚物合成路线与化学结构式。
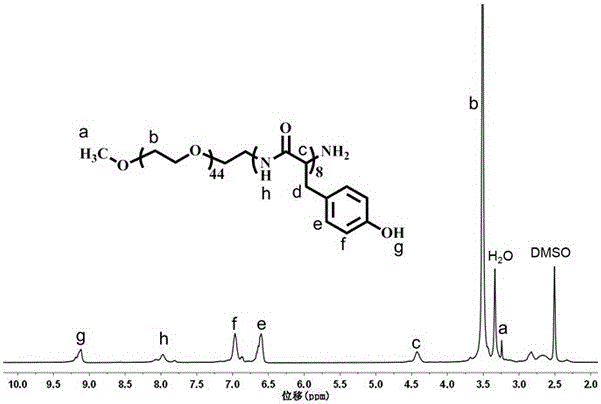
图2为本发明实施例的核磁共振氢谱1H NMR谱图。
图3为本发明实施例的聚乙二醇-多肽共聚物mPEG-p(Tyr-131I)8的同位素标记率(A)和纯化后放化纯度鉴定(B)。
图4为本发明实施例的多肽共聚物mPEG-p(Tyr-131I)8的体外成胶情况。
图5为本发明实施例的放疗用mPEG-p(Tyr-131I)8凝胶的体外癌细胞毒性结果。
图6为本发明实施例的放疗用mPEG-p(Tyr-131I)8凝胶体内稳定性结果。
图7为本发明实施例的放疗用mPEG-p(Tyr-131I)8凝胶体内脏器毒性结果。
具体实施方式
下面结合具体实施例,进一步详细阐述本发明。实施例中未注明具体条件的实验方法,通常按照常规条件以及手册中所述的条件,或按照制造厂商所建议的条件;所用的通用设备、材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:mPEG-p(Tyr)4 共聚物的制备及表征
将分子量为2000 g/moL,端基为甲氧基和氨基的聚乙二醇(mPEG-NH2,2.0 g)与酪氨酸-N-羧基-环内酸酐(Tyr-NCA,0.873g)溶于5 mL无水二甲基甲酰胺,于30 °C水浴条件反应48小时。然后,将反应溶液滴加到冰乙醚中,过滤,取沉淀,真空干燥得到聚乙二醇与聚酪氨酸的共聚物mPEG-p(Tyr)x,通过核磁共振氢谱1H NMR鉴定分析产物中酪氨酸单体的聚合度为4。聚合反应方程式与产物的化学结构式如图1所示。
实施例2:mPEG-p(Tyr)8 共聚物的制备及表征
将分子量为2000 g/moL,端基为甲氧基和氨基的聚乙二醇(mPEG-NH2,1.0 g)与酪氨酸-N-羧基-环内酸酐(Tyr-NCA,0.873 g)溶于5 mL无水二甲基甲酰胺,于30 °C水浴条件反应48小时。然后,将反应溶液滴加到冰乙醚中,过滤,取沉淀,真空干燥得到聚乙二醇与聚酪氨酸的共聚物mPEG-p(Tyr)x,通过核磁共振氢谱1H NMR分析产物中酪氨酸单元的聚合度为8,结果如图2所示,聚合物标记为mPEG-p(Tyr)8。
实施例3:mPEG-p(Tyr)10 共聚物的制备及表征
将分子量为2000 g/moL,端基为甲氧基和氨基的聚乙二醇(mPEG-NH2,1.0 g)与酪氨酸-N-羧基-环内酸酐(Tyr-NCA,1.09 g)溶于20 mL无水二甲基甲酰胺,于30 °C水浴条件反应48小时。然后,将反应溶液滴加到冰乙醚中,过滤,取沉淀,真空干燥得到聚乙二醇与聚酪氨酸的共聚物mPEG-p(Tyr)x,通过核磁共振氢谱1H NMR分析产物中酪氨酸单元的聚合度为10。
实施例4:mPEG-p(Tyr-131I)8凝胶的同位素131I标记及纯化鉴定
通过氯胺T法将放疗剂(本发明中以131I为例)标记到mPEG-p(Tyr)8的Tyr上。称取1 mg氯胺-T,溶于0.1 mL,50 mM pH=7.4的磷酸盐缓冲液中,称取2 mg偏重亚硫酸钠溶于0.1 mL,50 mM pH=7.4的磷酸盐缓冲液中。取1.0毫居碘-131化钠溶于100 μL 0.5 mM pH=7.4的磷酸盐缓冲液中,将溶液混匀,将2.0 mg mPEG-p(Tyr)8加入溶液中;取50 μL氯胺-T加入上述溶液中,室温震荡反应3 min,加入50 μL偏重亚硫酸钠,震荡终止反应。
利用凝胶层析分离技术进行标记物mPEG-p(Tyr-131I)8的分离,即使用SephacrylTM G-50凝胶层析分离纯化mPEG-p(Tyr-131I)8,用20 mM pH=7.4的磷酸缓冲液洗脱,自动收集仪收集该药物洗脱液,每2 min收集一管,每管体积1 mL,共收集40管,利用放射性γ计数器(型号:2470,PerkinElmer公司)测定每管的放射性计数。利用薄层放射性扫描仪对标记物的标记率进行检测和对分离物进行放化纯度鉴定,即取2 μL标记物和分离物分别滴在硅胶板初始一端,以乙醇和水混合溶液(体积比9:1)为展开剂在层析缸内展开,约至末端2 cm处停止,取出硅胶板,利用薄层放射性扫描仪(型号:AR-2000,Bioscan公司)检测标记物的标记率以及分离物的放化纯度。
结果如图3所示,放疗剂131I成功标记到mPEG-p(Tyr)8上,其标记率约为95%,纯化后的放化纯度高达98%,能够满足后续试验要求。
实施例5:mPEG-p(Tyr-131I)8的体外成胶试验
配制浓度为50 mg/mL的mPEG-p(Tyr-131I)8溶液置于小瓶内,将小瓶置于恒温水浴锅内加热,分别在加热至30 °C和37 °C 时,将小瓶取出进行翻转,考察小瓶内mPEG-p(Tyr-131I)8溶液的流动情况,倒置小瓶30秒内不流动定义为凝胶态。
结果如图4所示,在温度小于等于30 °C时,mPEG-p(Tyr-131I)8溶液呈现可流动的流体状态,而加热至37 °C时,mPEG-p(Tyr-131I)8溶液转变成不流动的半固体凝胶状态。mPEG-p(Tyr-131I)8呈现出较好的温敏性,且其成胶温度接近人体体温,这种良好的溶液到凝胶相转变行为能够保证凝胶的体内可注射性。
实施例6:mPEG-p(Tyr-131I)8凝胶的体外细胞毒性试验
选取宫颈癌细胞Hela、肝癌细胞HepG 2、和乳腺癌细胞MCF-7三种细胞系为模型细胞,以131I和空白细胞分别作为阳性和阴性对照组。首先,按照每孔5000细胞的密度分别将其接种于不同的96 孔板内,常规培养24小时。然后,取不同放射活性的131I和mPEG-p(Tyr-131I)8与孔内细胞共同孵育24小时,弃去所有溶液后向孔内加入20 μL噻唑蓝 (MTT) 溶液,孵育4小时后利用酶标仪检测各孔内光吸收值,计算每孔内细胞的相对存活率。
结果如图5所示,在宫颈癌细胞Hela(A)、肝癌细胞HepG 2(B)、和乳腺癌细胞MCF-7(C)三种细胞系中,131I和mPEG-p(Tyr-131I)8凝胶均呈现浓度依赖的细胞毒性作用,即放射活性越高,细胞生存率越低。然而当放射性活性达到2微居甚至更高后,mPEG-p(Tyr-131I)8凝胶的癌细胞杀伤能力明显高于131I,而且在三种不同细胞系中mPEG-p(Tyr-131I)8凝胶均展现了良好的体外抗肿瘤效果。
实施例7:mPEG-p(Tyr-131I)8水凝胶的体内稳定性及降解试验
取浓度为50 mg/mL的mPEG-p(Tyr-131I)8溶液,注射器抽取0.2 mL注射于Balb/c小鼠背部皮下,分别于给药后一天、一周、三周和六周利用放射性小动物活体成像系统(Kodak In-vivo Imaging System FX Pro)对小鼠体内植入的凝胶进行成像,分析凝胶的稳定性及降解情况。
结果如图6所示,通过小动物成像结果可以看出,mPEG-p(Tyr-131I)8溶液注射至小鼠体内后形成凝胶状态,其同位素信号稳定且团聚(A);给药后一周(B)mPEG-p(Tyr-131I)8凝胶仍能保持较稳定的半固体凝胶态,且放疗剂仍装载在凝胶之内,没有对正常组织形成放疗;由于放疗剂131I的半衰期短的特性,在第三周(C)后放疗作用基本衰减至零,给药后第三周凝胶仍保持很稳定形态,但相对第一周已发生降解;第六周(D)后凝胶基本降解完全。
实施例8:mPEG-p(Tyr-131I)8凝胶的体内毒性试验
取浓度为50mg/mL的mPEG-p(Tyr-131I)8溶液,注射器抽取0.2mL注射于Balb/c小鼠皮下,分别于给药后一天、一周、三周和六周对小鼠进行解剖取材,包括植入凝胶处的皮肤、心脏、肝脏、脾脏、肺脏及肾脏等组织,然后对组织进行HE染色,分析注射放疗凝胶后各个组织的病理结构变化。
结果如图7所示,通过对注射凝胶后小鼠的组织切片分析,皮下注射放疗mPEG-p(Tyr-131I)8凝胶后,心脏、肝脏、脾脏、肺脏及肾脏的病理结构未发生明显的变化,说明水凝胶的体内降解没有产生明显的毒性或副作用。同时,水凝胶注射部位的皮肤发生轻微的炎症反应,在给药三周后炎症反应基本痊愈。
本发明公开了一种用于肿瘤局部放疗的可注射水凝胶的制备方法,利用聚乙二醇和疏水性聚酪氨酸共聚物的特性,组装成可降解、安全、易于注射的多肽水凝胶,同时酪氨酸能够负载放疗剂131I。本发明开创了凝胶对肿瘤的特异性长期局部放疗,与其它放疗用制剂相比,具有易于注射治疗、免于手术开创植入和治疗后籽源取出、对非肿瘤组织无放射损伤、药效时间长等优点。
- 还没有人留言评论。精彩留言会获得点赞!