猪流行性腹泻病毒灭活疫苗及其制备方法与流程
本发明属于生物
技术领域:
,具体属于兽用生物制药领域,涉及猪流行性腹泻病毒灭活疫苗及其制备方法。
背景技术:
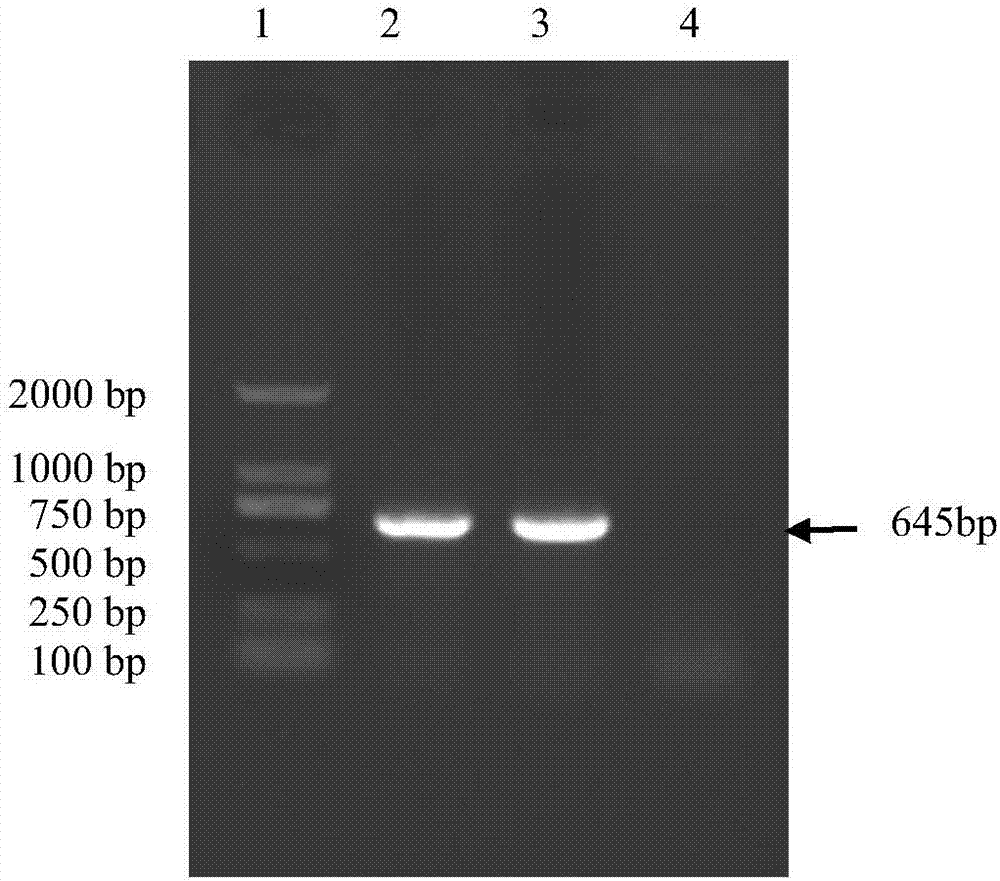
:猪流行性腹泻(porcineepidemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)引起一种急性、接触性病毒性肠道传染病,其病症以呕吐、水样腹泻、食欲下降和脱水为主,是常见的猪肠道传染性疾病。猪流行性腹泻病毒(pedv)系冠状病毒科冠状病毒属成员,猪流行性腹泻病毒(pedv)经口鼻感染后直接进入小肠,在小肠上皮细胞增殖,引起小肠绒毛吸收上皮细胞病变、损伤、脱落和小肠绒毛萎缩,导致肠内酶活性降低,吸收功能障碍,肠道内渗透压增高,引发渗透性腹泻,最终造成掉膘、降低饲料吸收利用率。pedv严重影响了我国的养猪业,其感染性强、危害性大,是影响全球养猪业的最重要病毒之一,哺乳仔猪感染后死亡率可达100%,母猪常以带毒而不表现症状形式出现。近几年我国多省爆发ped,给养猪业造成了严重的经济损失。目前尚无治疗猪流行性腹泻的特效药物,常规治疗效果不佳,因此仍以疫苗预防为主,而病毒株及其培养的成功与否是疫苗研制的关键因素。目前,国外使用的疫苗主要为韩国弱毒株,国内主要是哈尔滨兽医研究所研制的猪流行性腹泻、猪传染性胃肠炎二联灭活苗等,此疫苗中使用的毒株为猪流行性腹泻病毒pedvcv777株,该毒株分离年代较早,通过对现流行毒株的基因分析,发现流行毒株与二十世纪70年代分离到的cv777毒力基因发生了较大的改变,所以这也许是用含有原始毒株的疫苗免疫失败的原因之一。因此筛选新毒株,制备行猪流行腹泻疫苗用于预防猪流行性腹泻是十分必要的。技术实现要素:为解决上述问题,本发明旨在提供一种猪流行性腹泻病毒灭活疫苗及其制备方法,其采用本公司分离保藏的猪流行性腹泻病毒毒株(pedv-kb2013-4株),其微生物保藏编号为cgmccno.12663作为病毒毒株,该毒株遗传稳定,免疫原性能好,用其制备的灭活疫苗对于猪流行性腹泻具有良好的保护效力。为解决以上技术问题,达成本发明的目的,本发明采用如下技术方案:一种猪流行性腹泻病毒灭活疫苗,含有灭活的猪流行性腹泻病毒和佐剂,其中佐剂是由以重量百分含量计5%角鲨烷、1%油酸、1%吐温80、92%0.005m柠檬酸钠缓冲溶液和1%的β-葡聚糖组成,所述猪流行性腹泻病毒是由猪流行性腹泻病毒毒株(pedv-kb2013-4株)经灭活制备得到,其微生物保藏编号为cgmccno.12663;分类命名:猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv);保藏时间是2016年08月23日;保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。本发明还请求保护猪流行性腹泻病毒灭活疫苗在制备治疗猪流行性腹泻病毒感染药物中的应用。本发明还提供所述猪流行性腹泻病毒灭活疫苗的制备方法,包括如下步骤:a.按照常规方法制备vero细胞(vero细胞购自美国atcc),生长液为含10%新生牛血清的dmem,培养至细胞长成单层时接种pedv-kb2013-4病毒;b.取pedv-kb2013-4毒株(5×105tcid50/ml)按1%接种长势良好的vero单层细胞,置37℃吸附1小时,弃去吸附液,补加含有10μg/ml胰蛋白酶的dmem作为维持液继续培养;c.接毒后,每日观察2次,记录细胞病变情况,细胞病变达80%以上时收获病毒,将收获的病毒在-80℃,反复冻融三次,6000rpm离心20min,收集上清液,即为病毒液;d.病毒液经20倍浓缩后,加入0.2%甲醛37℃灭活24小时得到pedv-kb2013-4疫苗原液;e.配制佐剂,所述佐剂的配方含5%角鲨烷、1%油酸、1%吐温80、92%0.005m柠檬酸钠缓冲溶液和1%的β-葡聚糖,其配制方法为:将处方量的吐温80、β-葡聚糖与柠檬酸钠缓冲液搅拌混匀,再加入处方量的油酸、角鲨烷,高压均质机1200bar,进行5个循环,然后收集料液,0.22μmptfe膜过滤除菌。f.将步骤d制得的pedv-kb2013-4株疫苗原液和佐剂按1.5:1的体积比,无菌环境中,搅拌混合均匀,即制得猪流行性腹泻灭活疫苗。作为优选的技术方案,本发明的猪流行性腹泻病毒灭活疫苗还含有猪白细胞介素-4(il-4),即得到一种免疫增强型猪流行性腹泻病毒灭活疫苗,即还提供了如下技术方案:一种猪流行性腹泻病毒灭活疫苗,含有灭活的猪流行性腹泻病毒、佐剂和猪白细胞介素-4(4),其中佐剂是由以重量百分含量计5%角鲨烷、1%油酸、1%吐温80、92%0.005m柠檬酸钠缓冲溶液和1%的β-葡聚糖组成,所述猪流行性腹泻病毒是由猪流行性腹泻病毒毒株(pedv-kb2013-4株)经灭活制备得到,其微生物保藏编号为cgmccno.12663;分类命名:猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv);保藏时间是2016年08月23日;保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。以上含有猪白细胞介素-4(il-4)的免疫增强型猪流行性腹泻病毒灭活疫苗的制备方法如下:a.按照常规方法制备vero细胞(vero细胞购自美国atcc),生长液为含10%新生牛血清的dmem,培养至细胞长成单层时接种pedv-kb2013-4病毒;b.取pedv-kb2013-4毒株(5×105tcid50/ml)按1%接种长势良好的vero单层细胞,置37℃吸附1小时,弃去吸附液,补加含有10μg/ml胰蛋白酶的dmem作为维持液继续培养;c.接毒后,每日观察2次,记录细胞病变情况,细胞病变达80%以上时收获病毒,将收获的病毒在-80℃,反复冻融三次,6000rpm离心20min,收集上清液,即为病毒液;d.病毒液经20倍浓缩后,加入0.2%甲醛37℃灭活24小时得到pedv-kb2013-4疫苗原液;e.配制佐剂,所述佐剂的配方含5%角鲨烷、1%油酸、1%吐温80、92%0.005m柠檬酸钠缓冲溶液和1%的β-葡聚糖,其配制方法为:将处方量的吐温80、β-葡聚糖与柠檬酸钠缓冲液搅拌混匀,再加入处方量的油酸、角鲨烷,高压均质机1200bar,进行5个循环,然后收集料液,0.22μmptfe膜过滤除菌。f.将步骤d制得的pedv-kb2013-4株疫苗原液和佐剂按1.5:1的体积比,无菌环境中,搅拌混合均匀,进一步按照20万iu/头份(即每份疫苗中添加20万iu的猪白细胞介素-4)的量向疫苗制剂中添加猪白细胞介素-4,即制得免疫增强型猪流行性腹泻灭活疫苗。基于以上技术方案,本发明具有如下优点和有益效果:(1)与现有的商品化疫苗毒株相比,本发明所筛选的猪流行性腹泻病毒pedv-kb2013-4株具有免疫原性好,抗体产生快,产生的抗体滴度高且维持时间长,免疫剂量小,在产前42天前进行灭活疫苗的免疫注射可使怀孕母猪所产仔猪获得较好的被动免疫,能够有效抵抗强毒株的攻击,提高仔猪的存活率。(2)本发明在疫苗佐剂制备中添加了角鲨烷、油酸、吐温80、柠檬酸钠缓冲溶液和β-葡聚糖,其中葡聚糖的添加使用能够显著地提高动物对疫苗中抗原的免疫应答,缩短免疫窗口期,显著延长抗pedv抗体产生持续期,提高抗体产生水平。(3)作为本发明优选的技术方案,其进一步在疫苗制剂中添加了20万iu/头份的猪白细胞介素-4,其中il-4il-4对于b细胞、t细胞、肥大细胞、巨噬细胞和造细胞都有免疫调节作用,与pedv灭活病毒联合免疫能够显著提高猪的细胞免疫水平,提高免疫接种后的抗体水平,降低猪只的发病率和死亡率。附图说明:图1:pedv-kb2013-4株接种vero细胞在不同时期的cpe图片,其中图1-a、图1-c、图1-e分别为未接种病毒的vero细胞培养24h、36h、48h后的细胞图像;图1-b、图1-d、图1-f分别为接种pedv-kb2013-4株24h、36h、48h后的cpe图像。图2:pedvrt-pcr检测结果,通道1:takaradnamaker;通道2:阳性对照;通道3:第9代病毒液;通道4:阴性对照。图3:母猪免疫不同疫苗后的抗体水平检测结果(实施例4)。图4:母猪免疫不同疫苗后的抗体水平检测结果(实施例7)。具体实施方式:实施例1:猪流行性腹泻病毒pedv-kb2013-4株的分离鉴定(1)猪流行性腹泻病毒pedv-kb2013-4株的分离在流行病学调查时,陕西某猪场送检腹泻仔猪小肠,刮取肠粘膜和内容物,按照1:5的比例(重量:体积)加入pbs,反复冻融3次,离心取上清,0.22μm滤膜过滤,滤液中加入终浓度为20μg/ml的胰酶,37℃处理1.5小时。按常规方法接种长满单层的vero细胞(接种前用ph7.4的pbs洗三次),按照10%的比例接种病毒,37℃吸附1小时,补足细胞维持液(含10µg/ml的胰酶),37℃温箱培养。如此操作盲传至第10代,观察是否产生cpe,同时设置空白细胞作为对照。盲传传至第5代时细胞出现轻微的cpe变化,传至第9代时则出现明显、稳定的cpe变化,细胞圆缩,颗粒增加,聚堆呈葡萄串样,细胞出现损伤和脱落,即分离得到pedv-kb2013-4株。说明书附图图1展示了pedv-kb2013-4株接种vero细胞在不同时期的cpe图片,其中图1-a、图1-c、图1-e为对照组,其图像分别为未接种病毒的vero细胞培养24h、36h、48h后的细胞图像,由图可知,直到vero细胞培养到48h,细胞仍保持致密单层,仅有少量细胞脱落;图1-b、图1-d、图1-f分别为接种pedv-kb2013-4株24h、36h、48h后的cpe图像,图1-b是接种pedv-kb2013-4株24h产生的病变,其中有少量的细胞开始圆缩、脱落,图1-d是接种pedv-kb2013-4株36h后产生的病变,有较多的细胞开始脱落,细胞间的空隙变大;图1-f是接种pedv-kb2013-4株48h后产生的病变,细胞开始大量脱落,达到75%以上,且细胞间聚堆呈葡萄串样,表现为典型的网状cpe症状。(2)病毒pt-pcr检测按照omega试剂盒的说明进行rna的提取,产品立即进行反转录或贮存于-80℃备用。并合成检测引物pedvf:5’-aacggttctattcccgttgatg-3’;pedvr:5’-taaatgaagcactttctcactatc-3’。取总rna5.25µl,5×buffer2µl,dntp(10mmeach)0.5µl,下游引物(pedv-r)1µl,amv反转录酶0.5µl,rna酶抑制剂0.25µl,总体积10µl。反应条件:37℃10min,42℃反转录1h,冰浴2min。取rt产物1µl,2×promegamix12.5ul,引物pedv-f、pedv-r各1ul,高压灭菌水9.5ul,总体积25ul。反应条件:94℃3min,94℃30s,60℃45s,72℃45s,35个循环,72℃7min。扩增后的产物,进行琼脂糖凝胶电泳,扩增出目的条带645bp,参见说明书附图图2,经测序鉴定,所述病毒分离毒株为pedv。(3)病毒滴毒测定取第10代病毒,用细胞维持液进行10倍系列稀释,取10-4、10-5、10-6、10-7四个稀释度,每个稀释度分别接种长满vero细胞单层的96孔细胞板6孔,100μl/孔,同时设阴性对照细胞6孔,37℃5%co2培养箱培养72~120小时,观察细胞病变,细胞颗粒增多,圆缩,细胞破损,脱落判为感染。同时阴性对照组细胞孔应不出现细胞病变。采用reed-muench法,计算tcid50。经测定,病毒含量为5×105tcid50/ml。(4)动物回归试验取pedv中和抗体均小于1:8的母猪所产的3~5日龄仔猪10头,每头口服2ml第10代病毒,观察7天,统计接种猪的发病情况,对试验猪进行剖检,观察病理变化。刮取发病猪肠粘膜和内容物,提取rna,按实施例1第2步提到的检测引物,进行rt-pcr检测,并将pcr产物进行序列测定。结果仔猪8/10发病,发病猪表现为腹泻,个别猪出现呕吐,剖检观察发现胃和小肠出现典型的病理变化。从发病猪的肠粘膜及内容物中可扩增出645bp的片段,经序列分析为pedvs基因。经实验室分离鉴定,已成功的从陕西某猪场腹泻猪小肠内容物中分离到猪流行性腹泻病毒,命名为pedv-kb2013-4株,其微生物保藏编号为cgmccno.12663;分类命名:猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv);保藏时间是2016年08月23日;保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。实施例2:用pedv-kb2013-4株制备疫苗(1)pedv疫苗的制备a.按照常规方法制备vero细胞(vero细胞购自美国atcc),生长液为含10%新生牛血清的dmem,培养至细胞长成单层时接种pedv-kb2013-4病毒;b.取pedv-kb2013-4毒株(5×105tcid50/ml)按1%接种长势良好的vero单层细胞,置37℃吸附1小时,弃去吸附液,补加含有10μg/ml胰蛋白酶的dmem作为维持液继续培养;c.接毒后,每日观察2次,记录细胞病变情况,细胞病变达80%以上时收获病毒,将收获的病毒在-80℃,反复冻融三次,6000rpm离心20min,收集上清液,即为病毒液;d.病毒液经20倍浓缩后,加入0.2%甲醛37℃灭活24小时得到pedv-kb2013-4疫苗原液;e.配制佐剂,所述佐剂的配方含5%角鲨烷、1%油酸、1%吐温60、92%0.005m柠檬酸钠缓冲溶液和1%β-葡聚糖,其配制方法为:将处方量的吐温80、β-葡聚糖与柠檬酸钠缓冲液搅拌混匀,再加入处方量的油酸、角鲨烷,高压均质机1200bar,进行5个循环,然后收集料液,0.22μmptfe膜过滤除菌。f.将pedv-kb2013-4株疫苗原液和佐剂按1.5:1的体积比,无菌环境中,搅拌混合均匀,即制得猪流行性腹泻灭活疫苗。(2)疫苗检验方法及结果按照上述方法制备出3批疫苗,批号分别为20140101、20140102、20140103。2.1性状检验3批灭活疫苗外观呈粉红色乳胶状。2.2无菌检验3批灭活疫苗按照现《中华人民共和国兽药典》2010年版第三部附录进行检验,t.g、g.p管和g.a斜面培养基均未观察到菌落。2.3支原体检验3批灭活疫苗按照《中华人民共和国兽药典》2010年版第三部附录进行检验,未发现小瓶和小管培养物颜色出现明显变化,移植的液体培养物在固体培养基上无“煎蛋”状支原体菌落。2.4外源病毒检验3批灭活疫苗按照《中华人民共和国兽药典》2010年版第三部附录进行检验,均无猪瘟病毒、牛病毒性腹泻病毒、猪细小病毒、猪伪狂犬病毒、轮状病毒、猪传染性胃肠炎病毒等污染。证明毒种是纯净的。2.5安全检验取猪流行性腹泻中和抗体、抗原均为阴性的3日龄猪24头,随机分成4组,每组6头,肌注10头份疫苗,临床观察14日,均100%健活,未见不良反应发生。表1:3批猪流行性腹泻灭活疫苗检验结果检验项目201401012014010220140103性状检验粉红色乳液粉红色乳液粉红色乳液无菌检验无菌生长无菌生长无菌生长支原体检验无支原体生长无支原体生长无支原体生长外源病毒检验无外源病毒污染无外源病毒污染无外源病毒污染安全性检测100%健活,未见不良反应100%健活,未见不良反应100%健活,未见不良反应实施例3猪流行性腹泻病毒pedv-kb2013-4株灭活苗的安全试验1.材料与方法1.1对妊娠母猪的单剂量试验取产前5-6周猪流行性腹泻中和抗体、抗原均为阴性的妊娠母猪10头,随机分成2组,每组5头,第一组肌肉注射20140101批猪流行性腹泻病毒pedv-kb2013-4株灭活苗1头份/头,第二组不进行注射作为对照组,观察至母猪产仔。1.2对妊娠母猪的单剂量重复试验取产前5-6周猪流行性腹泻中和抗体、抗原均为阴性的妊娠母猪10头,随机分成2组,每组5头,第一组肌肉注射20140101批猪流行性腹泻病毒pedv-kb2013-4株灭活苗1头份/头,第二组不进行注射免疫。免疫后2周第1组肌肉注射20140101批猪流行性腹泻病毒pedv-kb2013-4株灭活苗1头份/头,观察至母猪产仔。1.3对妊娠母猪的超剂量试验取产前5-6周猪流行性腹泻中和抗体、抗原均为阴性的妊娠母猪16头,随机分成4组,第1、2、3组分别肌肉注射20140101、20140102、20140103批猪流行性腹泻病毒pedv-kb2013-4株灭活苗各2头份/头,第4组不进行注射作对照组,观察至母猪产仔。2.结果2.1单剂量试验结果免疫组5头妊娠母猪与对照组比较,采食、饮水、妊娠产仔均未见异常,注射部位均未见不良反应。2.2单剂量重复试验结果免疫组5头妊娠母猪与对照组比较,采食、饮水、妊娠产仔均未见异常,注射部位均未见不良反应。2.3超剂量试验结果3批疫苗免疫组12头妊娠母猪与对照组比较,采食、饮水、妊娠产仔均未见异常,注射部位均未见不良反应。实施例4母猪注射猪流行性腹泻灭活疫苗后的抗体水平检测试验1材料与方法取产前42天猪流行性腹泻中和抗体、抗原均为阴性的妊娠母猪20头,随机分成4组,每组5头,第1组肌肉注射20140101批猪流行性腹泻病毒pedv-kb2013-4株灭活苗1头份/头,第2组、第3组分别注射市场上现有的商品化pedv-tgev二联疫苗(分别标记为疫苗a、疫苗b),第4组不进行注射作为对照组。各组于免疫后第1周、第2周、第3周、第4周、第5周、第6周采血,分离血清进行病毒中和试验。2结果实验结果表明,本发明所制备的疫苗,产生抗体快,且产生的抗体滴度高,维持时间长,参见说明书附图3。实施例5猪流行性腹泻病毒pedv-kb2013-4株灭活疫苗的效力试验1材料与方法取产前5-6周猪流行性腹泻中和抗体、抗原均为阴性的妊娠母猪30头,随机分成3组,每组10头,第1组肌肉注射20140101批猪流行性腹泻病毒pedv-kb2013-4株灭活苗1头份/头,第2组注射pedv弱毒疫苗株cv777制备的弱毒疫苗1头份/头(市购,1ml/头份,病毒含量105tcid50/ml),第3组注射相同量的生理盐水作为对照组,母猪产仔后,3日龄、7日龄、14日龄仔猪各取24头,随机分成3组,每组8头,均口服猪流行性腹泻强毒5ml,观察攻毒后仔猪的临床表现。2结果第1组pedv-kb2013-4株灭活苗免疫母猪所产的仔猪,3日龄攻毒后,8头免疫仔猪哺乳、精神、粪便未见异常,均健活;第2组pedv弱毒疫苗株cv777弱毒疫苗免疫母猪所产的仔猪,3日龄攻毒后,3头表现出典型的猪流行性腹泻症状,而后死亡,5头仔猪哺乳、精神、粪便未见异常,均健活,即5/8表现出ped症状;第3组的8头对照仔猪攻毒后,8/8表现典型的猪流行性腹泻症状,8/8死亡。7日龄攻毒后,第1组的8头免疫仔猪哺乳、精神、粪便未见异常,均健活;第2组的8头仔猪,8头对照组仔猪攻毒后,3头表现出ped症状病死亡,即死亡率为3/8;第3组的仔猪全部表现典型的猪流行性腹泻症状,8/8死亡。14日龄攻毒后,第1组的8头免疫仔猪哺乳、精神、粪便未见异常,均健活;第2组的8头仔猪,8头对照组仔猪攻毒后,2头表现出ped症状病死亡,即死亡率为2/8;第3组8头对照组仔猪攻毒后,8/8表现典型的猪流行性腹泻症状,5/8死亡。表2免疫母猪所产的仔猪攻毒保护率由表2的结果可知,本发明获得的pedv-kb2013-4株具有良好的免疫原性,其对动物的保护率接近100%,高于市售的弱毒疫苗。本发明所筛选的猪流行性腹泻病毒pedv-kb2013-4株制备的疫苗免疫原性好,抗体产生快,产生的抗体滴度高且维持时间长,免疫剂量小,在产前42天前进行免疫注射可使怀孕母猪所产仔猪获得较好的被动免疫,能够有效抵抗强毒株的攻击,提高仔猪的存活率。实施例6:用pedv-kb2013-4株制备含有猪白细胞介素-4(il-4)的免疫增强型猪流行性腹泻病毒灭活疫苗的制备方法如下:a.按照常规方法制备vero细胞(vero细胞购自美国atcc),生长液为含10%新生牛血清的dmem,培养至细胞长成单层时接种pedv-kb2013-4病毒;b.取pedv-kb2013-4毒株(5×105tcid50/ml)按1%接种长势良好的vero单层细胞,置37℃吸附1小时,弃去吸附液,补加含有10μg/ml胰蛋白酶的dmem作为维持液继续培养;c.接毒后,每日观察2次,记录细胞病变情况,细胞病变达80%以上时收获病毒,将收获的病毒在-80℃,反复冻融三次,6000rpm离心20min,收集上清液,即为病毒液;d.病毒液经20倍浓缩后,加入0.2%甲醛37℃灭活24小时得到pedv-kb2013-4疫苗原液;e.配制佐剂,所述佐剂的配方含5%角鲨烷、1%油酸、1%吐温80、92%0.005m柠檬酸钠缓冲溶液和1%的β-葡聚糖,其配制方法为:将处方量的吐温80、β-葡聚糖与柠檬酸钠缓冲液搅拌混匀,再加入处方量的油酸、角鲨烷,高压均质机1200bar,进行5个循环,然后收集料液,0.22μmptfe膜过滤除菌。f.将步骤d制得的pedv-kb2013-4株疫苗原液和佐剂按1.5:1的体积比,无菌环境中,搅拌混合均匀,进一步按照20万iu/头份(即每份疫苗中添加20万iu的猪白细胞介素-4)的量向疫苗制剂中添加猪白细胞介素-4,即制得免疫增强型猪流行性腹泻灭活疫苗。实施例7:母猪注射猪流行性腹泻灭活疫苗后的抗体水平检测试验1材料与方法取产前42天猪流行性腹泻中和抗体、抗原均为阴性的妊娠母猪20头,随机分成4组,每组5头,第1组肌肉注射实施例3的20140101批猪流行性腹泻病毒pedv-kb2013-4株灭活苗1头份/头,第2组、第3组分别注射市场上现有的商品化pedv-tgev二联疫苗(分别标记为疫苗a、疫苗b),第4组不进行注射作为对照组,第5组注射实施例6制备的免疫增强型猪流行性腹泻病毒灭活疫苗1头份/头,各组于免疫后第1周、第2周、第3周、第4周、第5周、第6周采血,分离血清进行病毒中和试验。2结果实验结果表明,本发明实施例6所制备的疫苗,产生抗体快,且产生的抗体滴度高,维持时间长,参见说明书附图4。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1