一种重组猪流行性腹泻病毒抗体的制备方法与流程
本发明涉及的是猪流行性腹泻病毒(PEDV)抗体的基因工程制备,具体涉及一种重组猪流行性腹泻病毒抗体的制备方法。
二、
背景技术:
抗体是机体天然的内源性蛋白质,毒性低,特异性高,可直接作用于靶点,在疾病治疗中广泛应用,成为临床应用的一类重要的生物技术药物。截至2010年,美国FDA已批准25种抗体用于疾病治疗,超过240种抗体应用于临床,治疗的疾病包括自身免疫性疾病和炎症、癌症、器官移植、心血管疾病、传染病及眼科疾病等。抗体药物的临床成功使用产生了巨大的商业利润,2007年的销售额超过270亿美元,占20个最畅销生物技术药物中的8个,生物医药20%的份额。
猪流行性腹泻(porcine epidemic diarrhea, PED)是一种由猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)引起的高度传染性肠道疾病。任何年龄的猪均可感染,对仔猪影响尤其严重,病死率非常高;对成年的怀孕母猪来说,感染后繁殖性能受到影响,如怀孕早期的母猪感染后会出现流产,受孕率降低;育肥猪感染后体重下降。目前,虽然商品化PEDV疫苗,PEDV与猪传染性胃肠炎(TGEV)的二联苗已普遍使用,但该病仍然很流行。2007年,泰国暴发了PED,大批的仔猪发生死亡,造成严重经济损失。同时,PEDV作为冠状病毒的一员,病毒基因组大,突变率高,弱毒疫苗回复突变的可能性大。亚单位疫苗的研制也没有从根本上解决PEDV的感染问题,仔猪常常由于母源抗体低、消失或者没有母乳而失去被动免疫;或者仔猪自身注射疫苗产生的抗体来不及起到保护作用,而传统的PEDV治疗方法又无法满足人们对绿色食品需求。因此,研制一种有效防控猪流行性腹泻的抗体药物十分必要。
三、
技术实现要素:
本发明目的是提供了一种重组猪流行性腹泻病毒抗体的制备方法,这种重组猪流行性腹泻病毒抗体的制备方法用以解决传统的鼠源PEDV抗体会产生免疫反应、制备周期长、抗体中和活性低的问题。
为了实现上述目的,本发明采用的具体技术方案如下:这种重组猪流行性腹泻病毒抗体的制备方法:选取抗原抗体共表达的方式,将PEDV抗原基因S1和anti-PEDV ScFv基因共同表达在大肠杆菌周质腔内,利用流式细胞术进行三轮淘选;用大肠杆菌表达ScFv基因后纯化PEDV抗体,用ELISA方法检测PEDV ScFv抗体特异性,命名为PEDV-ScFv;具体通过抗PEDV ScFv文库的构建、抗PEDV抗体的制备两个步骤进行。
上述方案中抗PEDV ScFv文库的构建的方法如下:
1. 动物免疫及血清抗体效价的检测:
3-6日龄仔猪先以PEDV弱毒疫苗免疫,之后以中等毒力毒株攻毒,前后共3次;每次免疫或攻毒前1天及最后一次免疫1周后采血,间接ELISA检测血清抗体效价;96孔酶标板包被重组PEDV的S1蛋白,一抗为待测血清,每板设空白对照、阴性对照和阳性对照各2孔,辣根过氧化物酶标记的兔抗猪IgG为二抗,TMB显色,用酶标仪读取各孔OD值;最后一次免疫1周后,选用抗体效价高的阳性血清,加入叠氮钠至终浓度为0.2%,4 oC放置待用;
将抗体效价较高的三头仔猪处死,取脾脏,将其置于300目尼龙网上研碎,取细胞悬液;脾细胞悬液加ACK lysing buffer,室温放置5 min,2000 g离心10 min,收集白细胞沉淀;按106个细胞/ml的量加入Trizol,裂解细胞,提取总RNA;以提取的三头猪脾脏的淋巴细胞混合后的总RNA为模板,Oligo(dT)-18为引物,参照M-MLV反转录酶说明书,进行cDNA第一条链合成,并用1 μl反转录产物进行1%琼脂糖凝胶电泳检查其质量;
根据GenBank上已发表的猪抗体重链VH、轻链VL可变区基因的两端恒定区序列,分别利用引物设计软件Primer 5.0分析设计引物,并在重链上下游分别加入Nhe I、Nde I酶切位点,轻链下游分别加入Bam HI、Not I酶切位点;以免疫后猪脾cDNA为模板,分别以VH上游引物、VH下游引物和VL上游引物、VL下游引物进行梯度PCR扩增;对VH和VL扩增产物进行胶回收,并与pMD18-T载体连接,转化DH5α,并随机挑取1个单菌落进行测序,确定获得的基因序列为猪源抗体。
2. ScFv细菌展示抗体库的构建:
以免疫后猪脾cDNA为模板,以VH上游引物、VH下游引物扩增重链可变区基因,其中VH的5’端引入NheI酶切位点,3’引入NdeI酶切位点,PCR产物利用琼脂糖凝胶DNA回收试剂盒进行纯化;取VH PCR纯化产物与pMD18-T载体连接,转化DH5α,并随机挑取1个单菌落进行测序;进行Nhe I、Nde I双酶切,37oC水浴3h,1%琼脂糖凝胶电泳鉴定,并进行转化构建VH抗体库;次日,收集所有菌落并提取质粒,进行Bam HI、Not I双酶切鉴定;然后用BamH I、Not I对VL PCR回收产物进行双酶切;酶切后进行胶回收,连接并转化DH5α,涂布平板,37oC过夜培养,收集菌落并提取质粒,即为PEDV-ScFv抗体库;
取构建的PEDV-ScFv抗体库进行酶切鉴定和PCR鉴定,分别用Nhe I、Nde I和Bam HI、Not I对抗体库进行双酶切;取PEDV-ScFv抗体库质粒为模板,分别使用VH和VL的上下游引物对其进行PCR鉴定。
上述方案中抗PEDV抗体的制备方法如下:
1. 流式细胞术筛选大肠杆菌pBSD-PEDV ScFv展示文库:
取上述收集的文库所有菌落用LB液体培养基稀释至OD600≈0.2,37 oC培养2h,使之OD600≈0.4,加入IPTG至终浓度为2.5 mmol/L,诱导4 h。在1.5 ml Eppendorf管中加入1.5 ml培养物,6000 rpm离心3 min,去掉上清;
菌体沉淀用350μl Sucrose /Tris solution重悬,Sucrose 的浓度为0.75mmol/L,Tris的浓度为0.1mol/L;加入35 μl浓度为10 mg/ml新鲜配制的溶菌酶母液;逐滴加入700 μl 1 mmol/L EDTA溶液,同时涡旋混匀;冰上孵育15 min;加入50 μl 0.5mol/L MgCl2溶液,并在冰上孵育10 min;4 oC,10000 rpm离心10 min;原生质球沉淀用1 ml PBS溶液重悬洗涤,6000 rpm离心3 min,去上清;原生质球沉淀用100 μl PBS重悬;
在100 μl PBS重悬的已诱导菌液中加入10 μl 质量体积比为1% BSA贮存液、1.5 μg FITC标记后的S1,冰上避光孵育1 h;8000 rpm,离心3 min,1 ml PBS重悬洗涤一次,沉淀用100 μl PBS重悬。设置阴性对照,将空白菌DH5α处理成为原生质球,空白菌DH5α 中不含pBSD-IBDV ScFv重组质粒,用标记后的VP2抗原孵育;
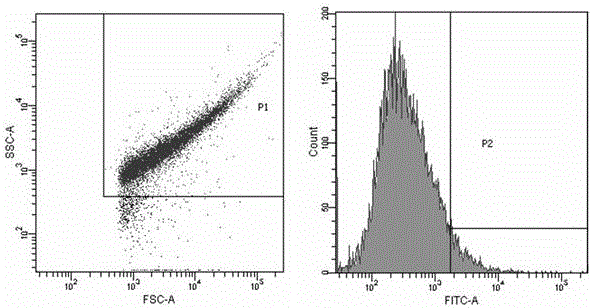
用流式细胞仪于488 nm波长激光下,检测样品及阴性对照的荧光强度,收集样品中荧光强度高于阴性对照的部分;将分选出来的细菌进行质粒制备,电击转化至大肠杆菌DH5α,构建次级筛选库,按上述的方法进行第二轮筛选,将每个峰值范围内的细胞分选出来,制备质粒后转化大肠杆菌DH5α,构建次级筛选库,按上述的方法进行第三轮筛选后,挑取单菌落20个,扩培后逐个用流式细胞仪进行检测,选出荧光信号比阴性对照强的克隆,进行测序并分析;
2. 抗PEDV ScFv抗体在大肠杆菌中的表达纯化及活性:
将质粒测序后与网上的猪源抗体进行序列比对,利用引物设计软件Primer Premier 5.0分析设计PCR引物P1、P2,选取两个进行PCR扩增、纯化、连接入pMD18-T载体,转化到大肠杆菌DH5α感受态细胞,挑取阳性克隆,接种于LB液体培养基中过夜培养,提取质粒,PCR和酶切鉴定后送去测序;测序结果正确后,对质粒进行双酶切,连入pET-27b载体,转化入Rosetta中;
挑取含有表达载体pET-27b-ScFv的Rosetta单菌落,分别接种于含有100 μg/ml Amp+的LB液体培养基中,37 oC过夜培养;次日取上述过夜培养物以1%的比例分别接种于含100 μg/ml Amp+的LB液体培养基中,37 oC振荡培养2h,加IPTG 37 oC继续培养,诱导4h。取1ml培养物菌体;洗涤后加入预冷PBS重悬;加入5×SDS样品缓冲液,煮沸5 min;取20μl样品进行SDS-PAGE;电泳后,经考马斯亮蓝R-250染色,用甲醇-冰乙酸脱色液脱色,观察结果;
挑取转化重组质粒pET-27b-ScFv单个菌落接种于含有100 µg/ml Amp+的LB液体培养基中,培养过夜;取上述两种过夜培养物以1%的比例接种于1L含有100 µg/ml Amp+的新鲜LB液体培养基中,37 oC振荡培养至OD600值达到0.3时,加IPTG至终浓度0.25 mmol/L,37 oC继续诱导培养4 h;取出培养物于4 oC以12000 r/min离心5 min,收集菌体;弃上清,每20 ml菌液沉淀加入1ml Binding buffer重悬菌体,加入溶菌酶至终浓度1mg/ml,在冰上高强度超声破碎约40 min,每次10s,每次间隔10s;菌体经超声波破碎后12000 rpm 4 oC离心30 min,分别收集包涵体;洗涤后分别用变性液溶解4 oC过夜;将溶解后蛋白加入到10倍体积的复性液中,4 oC复性24 h,pH调至7.4左右;在经pH 7.4的PBS 于4 oC透析3次,每次8 h;纯化后的蛋白进行SDS-PAGE,并用紫外分光光度计检测其浓度;将抗原蛋白以浓度梯度包被96孔板,于4 oC包被过夜。PBST洗96孔板3次,每次2 min,用5%脱脂奶粉37 oC封闭2h,分别加封闭液稀释的浓度梯度为100 μg/mL, 10 μg/mL, 5 μg/mL, 1 μg/mL阴性对照不加抗体的S1蛋白,37 oC孵育2 h,PBST洗96孔板3次,再加入二抗HRP-goat anti-porcine IgG,37 oC温育1 h,PBS洗96孔板4次后,加入TMB底物液,于37 oC避光显色5 min,每孔加入50 μL终止液,用酶标仪于波长450 nm下检测其OD值。
上述方案中S1扩增的引物:
上游引物5’- GGTCTCTAGGTGTTACTTTGCCATCATTTAA-3’(SEQ ID NO:1)
下游引物5’- ATGGATCCTTAAACGTCCGTGACACCTTCAA-3’(SEQ ID NO:2)。
上述方案中Binding buffer的组成为:8 mol/L Urea,0.1 mol/LNaH2PO4,0.01 mol/L Tris,,Binding buffer的 pH 8.0。
上述方案中变性液的组成为:8 mol/L尿素、0.1 mol/L Na2HPO4, 0.01 mol/L Tris-HCL, pH 8.0。
上述方案中复性液配方为还原型谷胱甘肽和氧化型谷胱甘肽至终浓度为2 mmol/L和0.2 mmol/L、精氨酸盐酸盐至终浓度0.5 mol/L、甘油至终浓度10%、Tris至终浓度0.4 mol/L,复性液pH调至7.4左右。
上述方案中终止液为2 mol/L的H2SO4。
有益效果:
1、本发明提供的猪源PEDV抗体不会产生免疫反应、针对性强、更容易筛选到中和活性高的抗体、制备周期短、速度快。
2、本发明以大肠杆菌展示的方式,通过流式细胞术三轮的筛选,得到了anti-PEDV的猪源抗体,具有中和PEDV能力,可作为PEDV的临床治疗性抗体。
3、本发明提供的PEDV抗体为猪源抗体,在对仔猪腹泻治疗过程中可避免由鼠源抗体引起的猪抗鼠抗体产生。
4、本发明制备方法简单易行,适合扩大中试生产,市场前景广阔。
四、附图说明
图1是本发明中流式细胞术分选抗PEDV单链抗体的空白对照;
图2是本发明中流式细胞术第一轮分选抗PEDV的单链抗体;
图3是本发明中流式细胞术第二轮分选抗PEDV的单链抗体;
图4是本发明中流式细胞术第三轮分选抗PEDV的单链抗体;
图5是本发明中PEDV抗体的表达与纯化;
图6是本发明中PEDV抗体的亲和性分析。
五、具体实施方式
下面对本发明做进一步的说明:
这种重组猪流行性腹泻病毒抗体的制备方法:选取抗原抗体共表达的方式,将PEDV抗原基因S1和anti-PEDV ScFv基因共同表达在大肠杆菌周质腔内,利用流式细胞术进行三轮淘选。用大肠杆菌表达ScFv基因后纯化PEDV抗体,用ELISA方法检测PEDV ScFv抗体特异性,命名为PEDV-ScFv。
上述PEDV抗体的具体制备方法:
一、抗PEDV ScFv文库的构建
1. 动物免疫及血清抗体效价的检测
3-6日龄仔猪先以PEDV弱毒疫苗免疫,之后以中等毒力毒株攻毒,前后共3次。每次免疫或攻毒前1天及最后一次免疫1周后采血,间接ELISA检测血清抗体效价。96孔酶标板包被重组PEDV的S1蛋白,一抗为待测血清,每板设空白对照、阴性对照和阳性对照各2孔,辣根过氧化物酶标记的兔抗猪IgG为二抗,TMB显色,用酶标仪读取各孔OD值。最后一次免疫1周后,选用抗体效价高的阳性血清,加入叠氮钠至终浓度为0.2%,4 oC放置待用。将抗体效价较高的三头仔猪处死,取脾脏,将其置于300目尼龙网上研碎,取细胞悬液。脾细胞悬液加ACK lysing buffer,室温放置5 min,2000 g离心10 min,收集白细胞沉淀。按106个细胞/ml的量加入Trizol,裂解细胞,提取总RNA。以提取的三头猪脾脏的淋巴细胞混合后的总RNA为模板,Oligo(dT)-18为引物,参照M-MLV反转录酶说明书,进行cDNA第一条链合成,并用1 μl反转录产物进行1%琼脂糖凝胶电泳检查其质量。根据GenBank上已发表的猪抗体重链(VH)、轻链(VL)可变区基因的两端恒定区序列,分别利用引物设计软件Primer 5.0分析设计引物,并在重链上下游分别加入Nhe I、Nde I酶切位点,轻链下游分别加入Bam HI、Not I酶切位点。以免疫后猪脾cDNA为模板,分别以VH上游引物、VH下游引物和VL上游引物、VL下游引物进行梯度PCR扩增。对VH和VL扩增产物进行胶回收,并与pMD18-T载体连接,转化DH5α,并随机挑取1个单菌落进行测序,确定获得的基因序列为猪源抗体。
S1扩增的引物:
上游引物5’- GGTCTCTAGGTGTTACTTTGCCATCATTTAA-3’(SEQ ID NO:1)
下游引物5’- ATGGATCCTTAAACGTCCGTGACACCTTCAA-3’(SEQ ID NO:2)
2. ScFv细菌展示抗体库的构建
以猪脾cDNA为模板,以VH上游引物、VH下游引物扩增重链可变区基因,其中VH的5’端引入NheI酶切位点,3’引入NdeI酶切位点,PCR产物利用琼脂糖凝胶DNA回收试剂盒进行纯化。取VH PCR纯化产物与pMD18-T载体连接,转化DH5α,并随机挑取1个单菌落进行测序。进行Nhe I、Nde I双酶切,37oC水浴3 h,1%琼脂糖凝胶电泳鉴定,并进行转化构建VH抗体库。次日,收集所有菌落并提取质粒,进行Bam HI、Not I双酶切鉴定。然后用BamH I、Not I对VL PCR回收产物进行双酶切,酶切体系同上。酶切后进行胶回收,连接并转化DH5α,涂布平板,37oC过夜培养,收集菌落并提取质粒,即为PEDV-ScFv抗体库。取构建的PEDV-ScFv抗体库进行酶切鉴定和PCR鉴定,分别用Nhe I、Nde I和Bam HI、Not I对抗体库进行双酶切。取PEDV-ScFv抗体库质粒为模板,分别使用VH和VL的上下游引物对其进行PCR鉴定。
PEDV抗体的ScFV基因序列如序列表中的序列3表示。
二、抗PEDV抗体的制备
1. 流式细胞术筛选大肠杆菌(pBSD-PEDV ScFv)展示文库
取上述收集的文库所有菌落用LB液体培养基稀释至OD600≈0.2,37 oC培养2h,使之OD600≈0.4,加入IPTG至终浓度为2.5 mmol/L,诱导4 h。在1.5 ml Eppendorf管中加入1.5 ml培养物,6000 rpm离心3 min,去掉上清。菌体沉淀用350 μl Sucrose (0.75mmol/L)/Tris (0.1mol/L) solution重悬;加入35 μl浓度为10 mg/ml新鲜配制的溶菌酶母液;逐滴加入700 μl 1 mmol/L EDTA溶液,同时涡旋混匀;冰上孵育15 min;加入50 μl 0.5mol/L MgCl2溶液,并在冰上孵育10 min;4 oC,10000 rpm离心10 min;原生质球沉淀用1 ml PBS溶液重悬洗涤,6000 rpm离心3 min,去上清;原生质球沉淀用100 μl PBS重悬。在100 μl PBS重悬的菌液(已诱导)中加入10 μl 1% (质量体积比) BSA贮存液、1.5 μg FITC标记后的S1,冰上避光孵育1 h;8000 rpm,离心3 min,1 ml PBS重悬洗涤一次,沉淀用100 μl PBS重悬。设置阴性对照,将空白菌DH5α (不含pBSD-IBDV ScFv重组质粒)处理成为原生质球,用标记后的VP2抗原孵育。用流式细胞仪于488 nm波长激光下,检测样品及阴性对照的荧光强度,收集样品中荧光强度高于阴性对照的部分。将分选出来的细菌进行质粒制备,电击转化至大肠杆菌DH5α,构建次级筛选库,按上述的方法进行第二轮筛选,将每个峰值范围内的细胞分选出来,制备质粒后转化大肠杆菌DH5α,构建次级筛选库,按上述的方法进行第三轮筛选后,挑取单菌落20个,扩培后逐个用流式细胞仪进行检测,选出荧光信号比阴性对照强的克隆,进行测序并分析。
2. 抗PEDV ScFv抗体在大肠杆菌中的表达纯化及活性
将质粒测序后与网上的猪源抗体进行序列比对,利用引物设计软件Primer Premier 5.0分析设计PCR引物P1、P2,选取两个进行PCR扩增、纯化、连接入pMD18-T载体,转化到大肠杆菌DH5α感受态细胞,挑取阳性克隆,接种于LB液体培养基中过夜培养,提取质粒,PCR和酶切鉴定后送去测序。测序结果正确后,对质粒进行双酶切,连入pET-27b载体,转化入Rosetta中。挑取含有表达载体pET-27b-ScFv的Rosetta单菌落,分别接种于含有100 μg/ml Amp+的LB液体培养基中,37 oC过夜培养。次日取上述过夜培养物以1%的比例分别接种于含100 μg/ml Amp+的LB液体培养基中,37 oC振荡培养2 h,加IPTG 37 oC继续培养,诱导4 h。取1 ml培养物菌体。洗涤后加入预冷PBS重悬。加入5×SDS样品缓冲液(含DTT),煮沸5 min。取20 μl样品进行SDS-PAGE。电泳后,经考马斯亮蓝R-250染色,用甲醇-冰乙酸脱色液脱色,观察结果。挑取转化重组质粒pET-27b-ScFv单个菌落接种于含有100 µg/ml Amp+的LB液体培养基中,培养过夜。取上述两种过夜培养物以1%的比例接种于1 L含有100 µg/ml Amp+的新鲜LB液体培养基中,37 oC振荡培养至OD600值达到0.3时,加IPTG至终浓度0.25 mmol/L,37 oC继续诱导培养4 h。取出培养物于4 oC以12000 r/min离心5 min,收集菌体。弃上清,每20 ml菌液沉淀加入1 ml Binding buffer (8 mol/L Urea, 0.1 mol/LNaH2PO4, 0.01 mol/L Tris, pH 8.0)重悬菌体,加入溶菌酶至终浓度1 mg/ml,在冰上高强度超声破碎约40 min,每次10 s,每次间隔10 s。菌体经超声波破碎后12000 rpm 4 oC离心30 min,分别收集包涵体。洗涤后分别用变性液(8 mol/L尿素、0.1 mol/L Na2HPO4, 0.01 mol/L Tris-HCL, pH 8.0)溶解4 oC过夜。将溶解后蛋白加入到10倍体积的复性液中,4 oC复性24 h,复性液配方为还原型谷胱甘肽和氧化型谷胱甘肽至终浓度为2 mmol/L和0.2 mmol/L、精氨酸盐酸盐至终浓度0.5 mol/L、甘油至终浓度10%、Tris至终浓度0.4 mol/L,pH调至7.4左右。在经PBS (pH 7.4) 4 oC透析3次,每次8 h。纯化后的蛋白进行SDS-PAGE,并用紫外分光光度计检测其浓度。将抗原蛋白以浓度梯度包被96孔板,于4 oC包被过夜。PBST洗96孔板3次,每次2 min,用5%脱脂奶粉37 oC封闭2 h,分别加封闭液稀释的浓度梯度为100 μg/mL, 10 μg/mL, 5 μg/mL, 1 μg/mL的S1蛋白(阴性对照不加抗体),37 oC孵育2 h,PBST洗96孔板3次,再加入二抗HRP-goat anti-porcine IgG (H+L) (阳性对照孔加HRP-goat anti-mouse antibody购自R&D公司),37 oC温育1 h,PBS洗96孔板4次后,加入TMB底物液,于37 oC避光显色5 min,每孔加入50 μL终止液(2 mol/L的H2SO4),用酶标仪于波长450 nm下检测其OD值。
实施例1:
首先选用中等毒力的毒株对仔猪进行攻毒,检测仔猪的抗体效价,之后对提取的仔猪脾脏的RNA并反转录成cDNA,构建抗体库。在制备抗原之前,对PEDV S基因进行了生物信息学分析,发现其糖基化位点较多,表达难度大,产量低,因而后期实验选取了抗原抗体共表达的方式,利用流式细胞术进行了ScFv抗体库三轮筛选。然后提取质粒,PCR扩增后、克隆到T载体上,送上海生工测序。采用Primer5.0和DNAMAN软件进行序列分析,将质粒测序后与网上的猪源抗体进行序列比对,利用引物设计软件Primer Premier 5.0分析设计PCR引物P1、P2,选取两个进行PCR扩增、纯化、连接入pMD18-T载体,转化到大肠杆菌DH5α感受态细胞,挑取阳性克隆,接种于LB液体培养基中过夜培养,提取质粒,PCR和酶切鉴定后送去测序。测序结果正确后,对质粒进行双酶切,之后连入表达载体,转化入Rosetta中IPTG诱导表达。取1 ml培养物菌体,洗涤后加入预冷PBS重悬,加入SDS样品缓冲液(含DTT),煮沸。取20 μl样品进行SDS-PAGE。电泳后,经考马斯亮蓝R-250染色,用甲醇-冰乙酸脱色液脱色,可以看到ScFv在大肠杆菌中表达。挑取转化阳性重组质粒pET-27b-ScFv单个菌落接种于含有Amp+的LB液体培养基中,经过连续培养过夜,加IPTG诱导,离心收集菌体。加入溶菌酶,在冰上高强度超声破碎。菌体经超声波破碎后离心,分别收集包涵体。洗涤后进行变性和复性,获得纯化的蛋白后进行SDS-PAGE,并用紫外分光光度计检测其浓度,用ELISA检测抗PEDV ScFv,证实PEDV ScFv具有特意中和病毒的能力。
序列表1
<110> 黑龙江八一农垦大学
<120> 一种重组猪流行性腹泻病毒抗体的制备方法
<160> 3
<210> 1
<211> 31
<212> DNA
<213> 人工序列
<400> 1
GGTCTCTAGGTGTTACTTTGCCATCATTTAA 31
序列表2
<110> 黑龙江八一农垦大学
<120> 一种重组猪流行性腹泻病毒抗体的制备方法
<160> 3
<210> 2
<211> 31
<212> DNA
<213> 人工序列
<400> 2
ATGGATCCTTAAACGTCCGTGACACCTTCAA 31
序列表3
<110> 黑龙江八一农垦大学
<120> 一种重组猪流行性腹泻病毒抗体的制备方法
<160> 3
<210> 3
<211> 753
<212> DNA
<213> 人工序列
<400> 3
1 GAGGTGAAGCTGGTGGAGTCTGGAGGAGGCCTGGTGCAGCCTGGGGGGTCTCTG
55 AGACTCTCCTGTGTCGGCTCTGGATTCACCTTCAGTAGTTATGCAATGAGCTGG
109 GTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGCTCGCATCTATTTATAGTAGT
163 GGTTGTAGCACCTACTACACAGACTCTGTGAAGGGCCGATTCACGTTCTCCATC
217 CACGACTCCCAGAACAAGGTGTATCTGCAAATCAACAGCCTCAGAACCGAAGAT
271 ACGGCCCGGTATTACTGTGCGATAGGCCCAGCGGTTGCTATAGCGGTTACTGTG
325 CAAGAGGCCGAATTCGGTGGCGGTGGCTCCGGCGGTGGTGGGTCGGGTGGCGGC
379 GGATCTGGTGGCGGTGGCTCGGGCGGTGGTGGGTCGGGTGGCGGCGGATCACTC
433 GAGGCCATCGTGCTGACCCAGACTCCAGCCTCCCTGGCTGCATCTCTAGGAGAC
487 ACGGTCTCCATCACTTGCCGGGCCAGTCAGAGTGTTAGGAGTTATTTAGCCTGG
541 TATCAACAACAACCAGGGAAGGCTCCGAAACTCGTGATCTATGCTACATCCAAT
595 TTAGAAAGTGGGGTCCCATCCCGCTTCAAGGGCAGTGGATCTGGCACCGATTTC
649 ACCCTCACCATCAGTGGCCTGCAGGCTGAAGATGTTGCAACTTATTACTGTTTG
703 CAGTGGAGCGGTGTATATGGTTTCGGCGCGGGGACCAAACTGGAGCTCAAA
序列表1
<110> 黑龙江八一农垦大学
<120> 一种重组猪流行性腹泻病毒抗体的制备方法
<160> 3
<210> 1
<211> 31
<212> DNA
<213> 人工序列
<400> 1
GGTCTCTAGGTGTTACTTTGCCATCATTTAA 31
序列表2
<110> 黑龙江八一农垦大学
<120> 一种重组猪流行性腹泻病毒抗体的制备方法
<160> 3
<210> 2
<211> 31
<212> DNA
<213> 人工序列
<400> 2
ATGGATCCTTAAACGTCCGTGACACCTTCAA 31
序列表3
<110> 黑龙江八一农垦大学
<120> 一种重组猪流行性腹泻病毒抗体的制备方法
<160> 3
<210> 3
<211> 753
<212> DNA
<213> 人工序列
<400> 3
1 GAGGTGAAGCTGGTGGAGTCTGGAGGAGGCCTGGTGCAGCCTGGGGGGTCTCTG
55 AGACTCTCCTGTGTCGGCTCTGGATTCACCTTCAGTAGTTATGCAATGAGCTGG
109 GTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGCTCGCATCTATTTATAGTAGT
163 GGTTGTAGCACCTACTACACAGACTCTGTGAAGGGCCGATTCACGTTCTCCATC
217 CACGACTCCCAGAACAAGGTGTATCTGCAAATCAACAGCCTCAGAACCGAAGAT
271 ACGGCCCGGTATTACTGTGCGATAGGCCCAGCGGTTGCTATAGCGGTTACTGTG
325 CAAGAGGCCGAATTCGGTGGCGGTGGCTCCGGCGGTGGTGGGTCGGGTGGCGGC
379 GGATCTGGTGGCGGTGGCTCGGGCGGTGGTGGGTCGGGTGGCGGCGGATCACTC
433 GAGGCCATCGTGCTGACCCAGACTCCAGCCTCCCTGGCTGCATCTCTAGGAGAC
487 ACGGTCTCCATCACTTGCCGGGCCAGTCAGAGTGTTAGGAGTTATTTAGCCTGG
541 TATCAACAACAACCAGGGAAGGCTCCGAAACTCGTGATCTATGCTACATCCAAT
595 TTAGAAAGTGGGGTCCCATCCCGCTTCAAGGGCAGTGGATCTGGCACCGATTTC
649 ACCCTCACCATCAGTGGCCTGCAGGCTGAAGATGTTGCAACTTATTACTGTTTG
703 CAGTGGAGCGGTGTATATGGTTTCGGCGCGGGGACCAAACTGGAGCTCAAA
- 还没有人留言评论。精彩留言会获得点赞!