高度开孔的消融电极的制作方法
本发明涉及医疗手术,具体地消融手术。
背景技术:
微创心内消融为用于各种类型的心律失常的治疗选择。在此类治疗期间,在心脏组织中形成不导电的消融灶。消融灶中断组织中的异常电通路,由此中断触发心律失常的异常电信号。消融可用于治疗例如室上性心动过速、预激综合征、室性心动过速和心房纤颤。
gelfand的us2013/0310823描述了用于治疗具有至少部分地与增强的外周化学感受性反射和提高的交感兴奋相关联的交感神经介导性疾病的患者的系统、装置和方法,该专利的公开内容以引用方式并入本文。治疗包括对一个或多个外周化学感受器或相关联的传入神经进行消融以减少或去除来自外周感受器的传入神经信号。
vaska的us7,824,402描述了具有保持界面材料如凝胶的覆盖件的消融装置,该专利的公开内容以引用方式并入本文。覆盖件在该装置的初始放置期间包含界面材料。该消融装置还可具有填充有流体的可移除末端或膜。在另一方面,该消融装置可在手术期间浸于液体中。
kiran的us2003/0225443描述了例如通过减小左心房或右心房的体积来调节心房构型(例如,改变心房构型)的方法和装置,该专利的公开内容以引用方式并入本文。在实施主题方法的过程中,例如通过化学改性或对心房组织施加能量来至少部分地修改或改变心房的构型而不使用植入物,其中代表性的能量源包括rf、微波、激光、超声、冷冻消融能量源等。在某些实施方案中,通过减小心房体积(例如,通过按照足以减小心房体积的方式来减小其心耳的体积或者缩小/封闭其心耳的入口)来实现期望的心房构型修改。在某些实施方案中,根据主题方法使用包括rf源的导管装置来调节心房构型。还提供了可用于实施主题方法的装置、系统和套件。主题方法、装置、系统和套件可用于多种用途,包括降低患有心房纤颤的受检者的中风风险。
技术实现要素:
根据本发明的一些实施方案,提供了消融设备。所述设备包括消融电极,所述消融电极被成形用于限定其腔体并且包括金属远极面,所述金属远极面被成形用于限定多个孔。所述设备还包括被配置成将流体递送到孔的流体递送通道和设置在消融电极的腔体内的至少一个超声换能器,所述换能器被配置成通过孔发射超声波。
在一些实施方案中,孔的总表面积为远极面的总表面积的至少20%。
在一些实施方案中,孔的总表面积小于远极面的总表面积的50%。
在一些实施方案中,远极面被成形用于限定至少100个孔。
在一些实施方案中,远极面被成形用于限定至少200个孔。
在一些实施方案中,孔中的每个孔的表面积小于远极面的总表面积的0.2%。
在一些实施方案中,远极面的厚度介于0.075和0.5mm之间。
在一些实施方案中,远极面包括网片。
在一些实施方案中,网片的一部分限定消融电极的侧壁。
在一些实施方案中,换能器被设置成距远极面至少0.5mm。
在一些实施方案中,所述至少一个超声换能器包括多个超声换能器。
在一些实施方案中,所述多个超声换能器包括超声换能器阵列。
根据本发明的一些实施方案,还提供了一种用于对患者的组织进行消融的方法。将消融电极插入患者内,所述电极包括被成形用于限定多个孔的远极面。随后,从设置在消融电极的腔体内的至少一个超声换能器通过孔发射至少一个超声波。响应于由换能器接收的超声波的反射,估计患者的组织的厚度。响应于所估计的厚度,设定消融电流的属性。将消融电流从消融电极的至少远极面传送到组织内,同时使流体通过孔流出消融电极。
在一些实施方案中,流体包括盐液。
在一些实施方案中,发射至少一个超声波包括在传送消融电流时发射至少一个超声波。
在一些实施方案中,从至少远极面传送消融电流包括从孔之间传送消融电流。
在一些实施方案中,组织包括心脏组织。
在一些实施方案中,所述方法还包括利用远极面来感测组织的电活动。
在一些实施方案中,所述至少一个超声换能器包括超声换能器的阵列,并且发射至少一个超声波包括通过从超声换能器的阵列发射超声波束来发射至少一个超声波。
在一些实施方案中,从超声换能器的阵列发射超声波束包括以相对于消融电极的中心纵向轴线呈非零角度的方式发射超声波束。
根据本发明的一些实施方案,还提供了一种用于形成消融电极的方法。提供被成形用于限定腔体的元件。在元件的远端处形成面,所述面被成形用于限定多个孔。将至少一个超声换能器放置在元件的腔体内,并且将被配置成将流体递送到孔的流体递送通道耦合到元件。
在一些实施方案中,形成面包括通过在元件的远端中制作至少100个穿孔来形成面。
在一些实施方案中,形成面包括通过在元件的远端中制作至少200个穿孔来形成面。
在一些实施方案中,制作穿孔包括通过激光钻出穿孔来制作穿孔。
在一些实施方案中,制作穿孔包括通过使用放电加工来制作穿孔。
在一些实施方案中,形成面包括通过将网片附接到元件的远端处来形成面。
结合附图阅读本发明实施方案的以下详细说明,将更全面地理解本发明,其中:
附图说明
图1为根据本发明的一些实施方案的用于心脏消融治疗的系统的示意性图解说明图;并且
图2-5为根据本发明的一些实施方案的消融电极的示意图。
具体实施方式
概述
在本发明的实施方案中,将体内探头(例如,导管)插入患者内,所述体内探头包括位于其远端处的消融电极。使消融电极与患者的组织接触,并且随后使消融电流从消融电极(例如,至少从电极的远极面,例如从电极的整个表面)流入组织内,由此对组织进行阻抗加热以在组织中产生不导电的消融灶。当消融电流传送到组织内时,冲洗流体可流出消融电极并且流入电极附近的血液内,由此冷却和稀释血液以有助于阻止血液凝固。
通常有益的是,在将消融电流传送到组织内之前和/或期间估计组织的厚度,因为消融电流的属性(例如,消融电流的功率和/或持续时间)可响应于所估计的厚度而被设定,以便实现透壁消融灶同时降低损伤外部相邻结构的风险。因此,在本发明的实施方案中,超声换能器被设置在消融电极的腔体内。换能器发射从组织反射的超声波,并且基于由换能器检测到的波的反射,估计组织的厚度。
用于定位超声换能器的一个选择是将超声换能器放置在消融电极远极面中的开口处。然而,此类开口(将需要为相对较大的,以便容纳换能器)的存在将使得远极面的相对较小的表面积被保留以用于施加消融电流。此外,换能器可阻挡开口,由此阻止冲洗流体流出开口。即使换能器从开口向后移动以允许冲洗流体的流过,冲洗流体从此类大开口的流动也将难以控制。
由本发明的实施方案提供的较有利选择是使消融电极的远极面制作为“高度开孔的”,使得远极面被成形用于限定相对较大数量的孔。然后可将至少一个超声换能器设置在消融电极的腔体内,所述腔体从高度开孔的远极面轻微凹陷。因此,本发明的实施方案提供至少以下优点:
(i)远极面中的孔允许来自换能器的超声波以及来自组织的反射穿过远极面而不被过度衰减。
(ii)当消融电流传送到组织内时,冲洗流体可从孔流出。
(iii)消融电流可从高度开孔的远极面进行传送,并且/或者高度开孔的远极面可用于感测组织的电活动。
(iv)高度开孔的远极面可保护换能器以免经受可另外损害换能器的机械力。
(v)相控阵超声技术可用于估计组织厚度。
系统描述
首先参见图1,其为根据本发明的实施方案的用于心脏消融治疗的系统20的示意性图解说明图。操作者28(诸如,介入心脏病专家)经由患者26的血管系统将体内探头,诸如导管22插入到患者的心脏24的腔室内。例如,为了治疗心房纤颤,操作者可将导管推进到左心房内并且使导管的远端处的消融电极30与待监测和/或待消融的心肌组织进行接触。
导管22在其近侧端部处连接到控制台32。控制台32包括射频(rf)能量发生器34,所述射频(rf)能量发生器34经由导管22将电力提供到消融电极30,以便对目标组织进行消融。冲洗泵38通过导管22将诸如盐水溶液(例如,生理盐水溶液)的冲洗流体提供到消融电极30。第二射频发生器(rf-us发生器40)经由导管22将电力提供到设置在消融电极的腔体内的超声换能器。如下文进一步所述,超声换能器用于估计心肌组织的厚度。响应于该估计,处理器36可通过自动地或响应于来自操作者28的输入控制rf能量发生器34来设定消融电流的属性,例如,电流的幅值、功率或持续时间。
在手术之前、期间、和/或之后,心电图(ecg)记录仪60可记录患者的ecg。
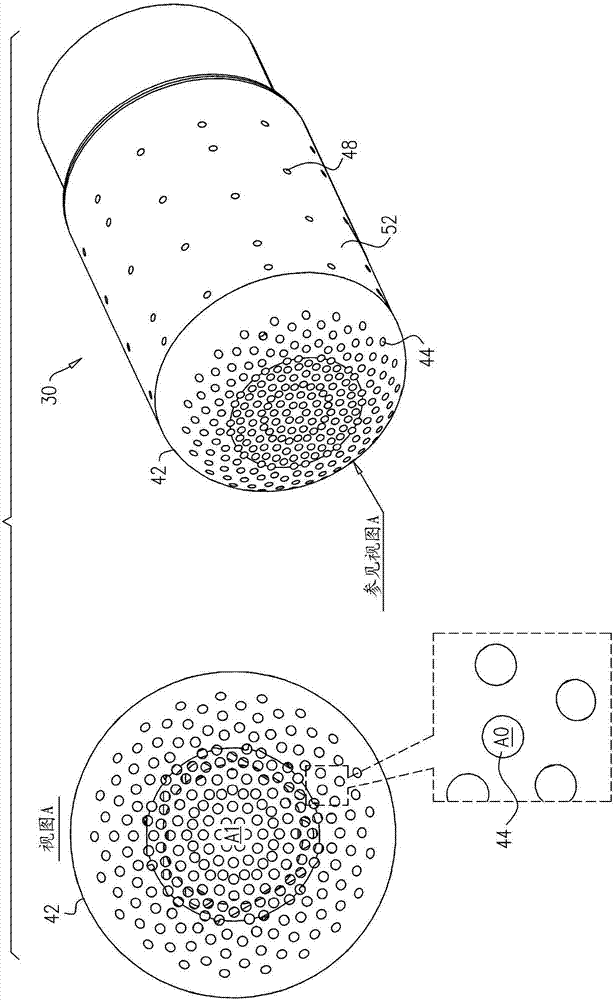
现在参见图2和图3,其为根据本发明的一些实施方案的消融电极30(图1)的示意图。
如图2所示,消融电极30包括被成形用于限定多个(并且具体地,相对较大数量的)孔44的远极面42。例如,远极面42可为高度开孔的,因为远极面被成形用于限定至少100个(例如,至少200个)孔。远极面42通常为金属的,使得远极面可用于将消融电流传送到组织内。具体地,可从孔之间传送消融电流。
通常,孔44的总表面积为远极面42的总表面积a1的至少20%(例如,至少30%或40%),但通常小于50%。(换句话讲,远极面42通常为至少20%“开口的”。)例如,如果存在n个孔,每个孔具有表面积a0,则n*a0可介于a1的20%和50%之间。孔的总表面积(i)足够大以使得超声波穿过远极面而不被过度衰减,但(ii)足够小以使得远极面具有机械坚固性并且还能够将消融电流传送到组织内和/或感测组织的电活动。通常,对于孔44中的每个而言,a0小于a1的0.2%(例如,小于0.15%或0.1%)。
在一个特定示例性实施方案中,a0可为约0.0044mm2,a1可为约4.9mm2,并且n可为约230。对于此类示例性实施方案,孔的总表面积略大于远极面的总表面积的20%。
通常,远极面相对较薄,以便减小波穿过孔时的超声波衰减。例如,远极面的厚度t0可为至少0.015mm和/或小于0.5mm,例如,介于0.075mm和0.5mm之间(例如,约0.2mm)。提供相对较薄的远极面还可缩短在远极面中形成大量孔所需的时间。
如图3所示,其中消融电极30的一部分被“切除”,并且消融电极30被成形用于限定腔体46。孔44以及任选地沿消融电极30的侧壁52的其他孔48提供腔体46与围绕消融电极的区域之间的流体连通。在一些实施方案中(不同于图2-3所示的实施方案),侧壁52为高度开孔的,即,侧壁52被成形用于限定相对较大数量的孔48。
如图3进一步所示,至少一个超声换能器50被设置在腔体46内。在一些实施方案中,多个超声换能器(例如,超声换能器的一维或二维阵列)设置在腔体46内;在其他实施方案中,如图3所示,单个超声换能器被设置在腔体内。通常,换能器50被设置成距远极面42至少0.5mm(例如,至少1mm和/或小于1.5mm,例如介于1和1.5mm之间)的距离d0。(d0通常至少与超声换能器的“死区”一样大。)
换能器50用于通过经由孔朝组织发射超声波56并且检测来自组织和组织边界的反射来估计患者的组织的厚度。响应于这些反射,估计组织厚度。该估计可例如由处理器36(图1)来执行。此外,响应于该估计,处理器36可通过自动地或响应于来自操作者28的输入控制rf能量发生器34来设定消融电流的属性,诸如,电流的幅值、功率或持续时间。
在一些实施方案中,在传送消融电流之前发射超声波56。在此类实施方案中,在估计组织的厚度之后,将消融电流58从消融电极(例如,至少从电极的远极面42,例如从电极的整个表面)传送到组织内。另选地或除此之外,在将消融电流传送到组织内期间可发射至少一个超声波,由此允许响应于组织厚度的任何变化来适当地调节消融电流的属性。(此类变化可例如由浮肿引起,所述浮肿可导致消融期间的壁厚增加。)例如,可在整个手术期间连续地发射超声波并且估计组织厚度。
在将消融电流传送到组织内期间,可使冲洗流体54(例如,盐液,诸如生理盐水溶液)通过孔44和/或孔48流出消融电极。在图3所示的实施方案中,将消融电极30耦合到具有位于换能器支撑件65中的开口的流体递送通道64,所述通道64将流体54从泵38(图1)递送到腔体46(并且因此递送到孔)。在其他实施方案中,换能器支撑件65中的开口用于保持另外的“侧向”超声换能器,并且冲洗流体可经由其他流体递送通道流入腔体46内。
在一些实施方案中,在消融电流传送到组织内之前、期间和/或之后,远极面42用于感测组织的电活动。在此类实施方案中,远极面42可经由导管22连接到ecg记录仪60(示于图1中),所述ecg记录仪60检测由组织产生的小电压。
为了制造消融电极30,在中空元件的远端处形成远极面42。例如,可通过在元件的远端中制作相对较大数量的(例如,至少100个或200个)穿孔来形成远极面42。本发明的范围包括用于制作穿孔的任何合适的技术,包括例如放电加工和/或激光钻孔。为了完整地形成消融电极,将换能器50耦合到换能器支撑件65,将换能器支撑件65放置在中空元件的腔体内,并且将流体递送通道耦合到该元件。(上述三个步骤可按照任何合适的顺序来执行。此外,上述步骤中的每个可在远极面的形成之前或在远极面的形成之后来执行。)
现在参见图4,其为根据本发明的一些实施方案的消融电极的示意图。如上所述,在一些实施方案中,将多个超声换能器(诸如,超声换能器的阵列)设置在腔体46内。例如,图4示出了超声换能器的二维直线阵列66。在此类实施方案中,波束转向技术(例如,相控阵超声技术)可用于估计组织厚度。例如,换能器可用于以相对于消融电极30的中心纵向轴线62成呈零角度的方式发射超声波束,如图4所示。(换句话讲,波束可被引导成至少部分地偏离一侧,而非径直向前。)然后可响应于超声波束的反射来估计组织的厚度。
现在参见图5,其为根据本发明的一些实施方案的消融电极30的示意图。在一些实施方案中,为了形成远极面42,将限定孔44的网片68例如通过激光焊接到侧壁52的远端附接到中空元件的远端处(在一定程度上类似于将膜放置在滚筒上)。在一些实施方案中(未示出),还将网片68附接到沿元件侧面的支架,使得该网片的一部分限定侧壁52。
本领域的技术人员应当理解,本发明并不限于上文中具体示出和描述的内容。相反,本发明的范围包括上文所述各种特征的组合与子组合,以及本领域的技术人员在阅读上述说明时可能想到的未在现有技术范围内公开的变型和修改。以引用方式并入本专利申请的文献将视为本专利申请的整体部分,不同的是如果在这些并入的文献中定义的任何术语与在本说明书中明确或隐含地给出的定义在某种程度上相冲突,则应只考虑本说明书中的定义。
- 还没有人留言评论。精彩留言会获得点赞!