大黄酚葡聚糖包合物及其应用的制作方法
本发明涉及生物工程技术领域和食品医药领域,具体提供了一种可以改善胃肠功能的大黄酚葡聚糖包合物,及其应用。
背景技术:
现代中草药减肥药或保健食品其中一个主要作用机制分就是抑制肠道消化吸收(奥利司他),其机制主要是作为肠道的胰脂肪酶抑制剂,它可使胰脂肪酶的活性降低,使人的脂肪不能分解,同时减低肠道对脂肪酸的运输。减少脂质的吸收达到目的。但是,长期服用这种药物或者保健食品,会造成胃肠道功能紊乱,负荷加重,对胃肠道的造成病理损害。为了避免此类现象的发生,市场需要研制开发来源于天然、效果显著、无明显不良反应的防治腹泻和改善胃肠道功能的新型口服制剂,以减轻患者的痛苦。长期腹泻致胃肠道功能紊乱患者众多,因此开发此类制剂产品具有良好的应用前景,是十分有益和必要的。
在丰富的中草药资源中,有些提取物具有非常好的健胃肠活性。古代学者认为,脾胃是人体重要的消化脏器之一,其功能不仅关系着人体的生理健康,且对人体的生命功能至关重要。胃肠道功能是否正常直接影响食物中营养成分的消化吸收,对维持人体各器官的正常功能至关重要。
大黄酚(chrysophanol,Chr)是一种蒽醌衍生物,化学名为1,8-二羟基-3-甲基蒽醌,是大黄、虎杖、何首乌、决明子等中草药中主要有效成分之一,具有抗菌、缩短血液凝固时间、兴奋神经、麻痹肌肉、止咳、利尿、抗癌作用。近年来研究表明,大黄酚还具有明显的减肥作用,并且有抗大鼠肝、脑过氧化脂质生成的作用。但大黄酚具有味苦、对胃有刺激性,基于此,需要一种载体将大黄酚包合,减弱其对胃肠的刺激性,但是目前采用的脂质体或者环糊精等方式其包合效果有限。
技术实现要素:
因此,本发明需要解决的技术问题是提供一种可以改善胃肠功能的大黄酚包合物,以克服现有大黄酚应用技术存在的刺激胃肠道的缺陷。本申请的发明人研究发现,使用含大黄酚的大黄、虎杖、决明子等中草药来进行减肥的缺点在于会导致腹泻,而葡聚糖包合可以减缓或者消除这种不利影响。大黄酚葡聚糖包合物在改善胃肠道功能方面具有满意的效果。原因在于两个方面,一是口服大黄酚葡聚糖包合物后可长时间黏附与小肠壁而不被排入大肠,可有效延长药物在小肠的滞留时间从而提高药物在肠道的吸收;另一方面大黄酚葡聚糖包合物可以改善胃肠道的额菌群平衡。
有鉴于此,本发明的目的首先在于提供一种大黄酚葡聚糖包合物,本包合物内容物包含大黄酚、葡聚糖。可有效帮助人们排肠毒、宿便,且无任何副作用,可避免服用单纯服用大黄酚或者西药引发的多种并发症,利于人体养生、美容,适合各种人群服用。
为实现上述目的,本发明的技术方案为:
大黄酚葡聚糖包合物,所述大黄酚葡聚糖包合物由大黄酚和葡聚糖制备而成,所述大黄酚和葡聚糖的摩尔比为0.001-150:2000。
进一步,所述的大黄酚葡聚糖包合物,所述大黄酚和葡聚糖的摩尔比为50-100:2000。
进一步,所述的大黄酚葡聚糖包合物,所述大黄酚葡聚糖包合物由大黄酚、葡聚糖和淀粉制备而成,所述大黄酚、葡聚糖和淀粉的摩尔比为0.001-150:2000:1000-2000。
优选的,所述的大黄酚葡聚糖包合物,所述大黄酚、葡聚糖和淀粉的摩尔比为50-100:2000:1500-1800。
进一步,所述的大黄酚葡聚糖包合物,所述葡聚糖为β-葡聚糖和/或β-葡聚糖衍生物。
针对上述大黄酚葡聚糖包合物,本发明还提供一种它的制备方法。该方法制得的包合物载药量高,稳定性好,操作简单,便于后续多种类型制剂的进行。该方法包括以下步骤:
(1)葡聚糖预处理
将葡聚糖充分溶解于去离子水中成为澄清透明的葡聚糖溶液;
(2)大黄酚预处理
将大黄酚充分溶解于50-70%乙醇中,得大黄酚溶液;
(3)在搅拌和加热条件下,向步骤(1)所得葡聚糖溶液中加入步骤(2)所得的大黄酚溶液,搅拌混合均匀,静置,干燥,得大黄酚葡聚糖包合物。
进一步,所述的制备方法,所述大黄酚葡聚糖包合物由大黄酚、葡聚糖和淀粉制备而成,所述大黄酚、葡聚糖和淀粉的摩尔比为0.001-150:2000:1000-2000;所述制备方法包括如下进行的步骤:
(1)葡聚糖和淀粉预处理
将葡聚糖和淀粉充分溶解于去离子水中成为澄清透明的葡聚糖淀粉混合溶液;
(2)大黄酚预处理
将大黄酚充分溶解于50-70%乙醇中,得大黄酚溶液;
(3)在搅拌和加热条件下,向步骤(1)所得葡聚糖淀粉混合溶液中加入步骤(2)所得的大黄酚溶液,搅拌混合均匀,静置,干燥,得大黄酚葡聚糖包合物。
进一步,所述的制备方法,所述步骤(1)中,于80-90℃搅拌充分溶解。
进一步,所述的制备方法,所述步骤(2)中,于30-50℃回流或者搅拌加热充分溶解。
进一步,所述的制备方法,所述步骤(3)中,控制温度在40-100℃,搅拌速度控制在500-700r/min。优选的,所述温度控制在40-60℃。
进一步,所述的制备方法,所述步骤(3)中,所述干燥可以是经冷冻干燥或喷雾干燥或40-70℃低温真空干燥,得大黄酚葡聚糖包合物的干品。获得的干品便于制备为片剂、胶囊、颗粒剂、冻干剂、胶丸、吸入粉剂、栓剂等多种剂型。
本发明还提供了一种大黄酚葡聚糖包合物的应用,具体为所述的大黄酚葡聚糖包合物在制备具有改善胃肠道功能药物中的应用。
本发明的有益效果:
(1)与现有大黄酚制剂对胃肠道的刺激作用相比,本发明的大黄酚葡聚糖包合物可以显著降低这种刺激作用。
(2)本发明的大黄酚葡聚糖包合物可以延长在胃肠道中的停留时间,形成缓释特性。
(3)本发明的大黄酚葡聚糖包合物的最终应用形式可以是片剂、胶囊、颗粒剂、等多种形式,该方法不采用有毒、刺激性及对人体产生不良影响的溶剂,不需要进行复杂的化学反应,即可实现规模化生产。
(4)本发明的大黄酚葡聚糖包合物具有保护胃肠道黏膜、调理胃肠道功能、抗菌抗炎的作用;疗效显著,使用安全,作用优于市场上常用的药剂产品,具有良好的临床应用前景。
附图说明
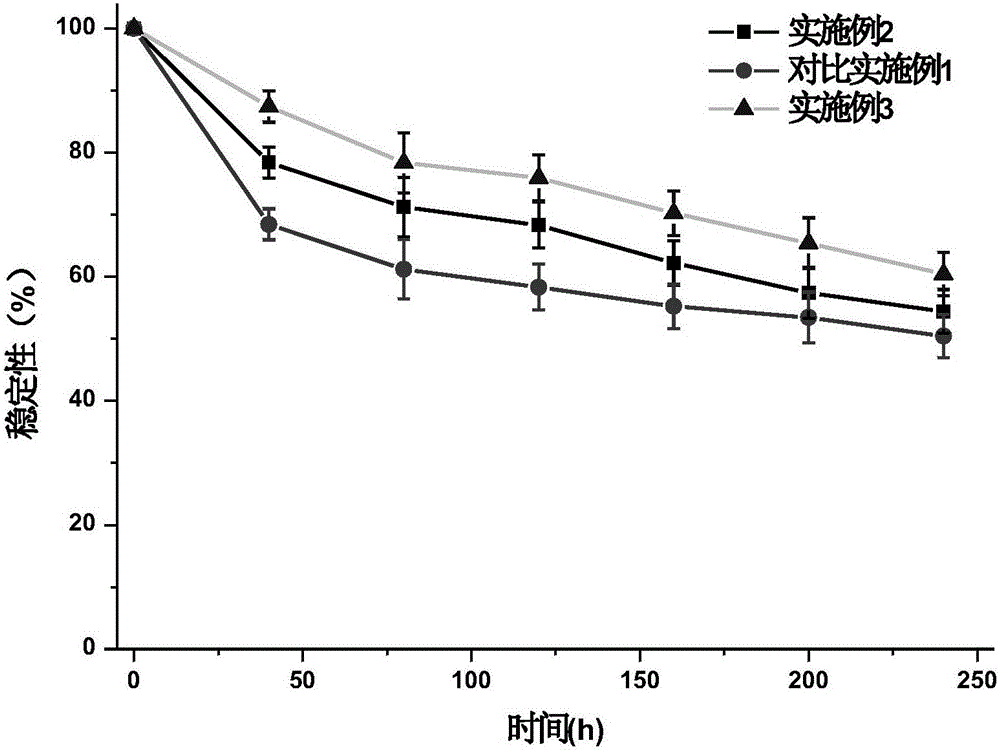
图1为在胃中的滞留时间及稳定性对比结果图。
图2为在肠道中的滞留时间及稳定性对比结果图。
图3为对小鼠腹泻率的影响结果图。
具体实施方式
所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,还包括各具体实施方式间的任意组合,仍属于本发明的保护范围。
另外,在下列实施例中所采用的材料均为已知的并且可以通过商业手段获得的,除非明确指出,所采用的装置可以为本领域中常用的设备。
实施例1大黄酚葡聚糖包合物
葡聚糖溶液的预处理方法为:将葡聚糖溶于适量去离子水中,85℃搅拌溶解1-1.5h使其充分溶解成为澄清透明的葡聚糖溶液。
大黄酚的预处理方法为:称取规定量的大黄酚置于60%乙醇中,40℃回流或者搅拌加热使药物完全溶解,得大黄酚溶液。
在搅拌和加热条件下,向葡聚糖溶液中加入大黄酚溶液,搅拌6-12h后,静置,抽真空干燥,得大黄酚葡聚糖包合物,所述大黄酚和葡聚糖的摩尔比为:50:2000。其中,加热温度控制在60℃,搅拌速度控制在600r/min。
实施例2大黄酚葡聚糖包合物
葡聚糖溶液的预处理方法为:将葡聚糖溶于适量去离子水中,90℃搅拌溶解1-1.5h使其充分溶解成为澄清透明的葡聚糖溶液。
大黄酚的预处理方法为:称取规定量的大黄酚置于65%乙醇中,45℃回流或者搅拌加热使药物完全溶解,得大黄酚溶液。
在搅拌和加热条件下,向葡聚糖溶液中加入大黄酚溶液,搅拌6-12h后,静置,抽真空干燥,得大黄酚葡聚糖包合物,所述大黄酚和葡聚糖的摩尔比为:100:2000。其中,加热温度控制在50℃,搅拌速度控制在700r/min。
对比实施例1
葡聚糖溶液的预处理方法为:将葡聚糖溶于适量去离子水中,90℃搅拌溶解1-1.5h使其充分溶解成为澄清透明的葡聚糖溶液。
大黄酚的预处理方法为:称取规定量的大黄酚置于65%乙醇中,45℃回流或者搅拌加热使药物完全溶解,得大黄酚溶液。
在搅拌和加热条件下,向葡聚糖溶液中加入大黄酚溶液,搅拌6-12h后,静置,抽真空干燥,得大黄酚葡聚糖包合物,所述大黄酚和葡聚糖的摩尔比为:100:1000。其中,加热温度控制在50℃,搅拌速度控制在700r/min。
实施例3大黄酚葡聚糖包合物
葡聚糖和淀粉预处理:葡聚糖溶液的预处理方法为:将葡聚糖和淀粉溶于适量去离子水中,80℃搅拌溶解1-1.5h使其充分溶解成为澄清透明的葡聚糖淀粉混合溶液。
大黄酚的预处理方法为:称取规定量的大黄酚置于65%乙醇中,45℃回流或者搅拌加热使药物完全溶解,得大黄酚溶液。
在搅拌和加热条件下,向葡聚糖淀粉混合溶液中加入大黄酚溶液,搅拌6-12h后,静置,抽真空干燥,得大黄酚葡聚糖包合物,所述大黄酚、葡聚糖和淀粉的摩尔比为100:2000:1600。其中,加热温度控制在50℃,搅拌速度控制在700r/min。
实施例4在胃肠道的滞留时间及稳定性对比
(1)仪器与器材
高效液相色谱仪(日本Shimadzu公司);PHS-3C酸度计(上海虹益仪器仪表有限公司);HH-S型恒温水浴锅、DHG-9240A电热恒温鼓风干燥箱、SHZ-D(III)旋转水式真空泵(巩义市予华仪器有限责任公司);KH-250DB型数控超声波清洗器(昆山禾创市超声仪器有限公司);SD-1500实验型喷雾干燥机(上海沃迪科技有限公司);R-124旋转蒸发仪(瑞典BUCHI公司);CP-224S电子天平(德国赛多利斯)。
大黄酚标准品(Chr,HPLC≥98%,南京奥多福尼生物科技有限公司);酵母β-葡聚糖(朗深系生物技术有限公司);大黄酚葡聚糖包合物(本发明自制,本实施例中取实施例2、实施例3和对比实施例1所制备的大黄酚葡聚糖包合物进行验证);胃蛋白酶(1:10000)、胰蛋白酶(1:1000)(Sigma公司);其它化学试剂均为国产分析纯;所用水为双蒸水,所用溶液均自行配制。
(2)模拟胃肠液的制备
体外模拟消化过程分为两个阶段:模拟胃液消化和模拟肠道消化。
胃液:称取3.2g胃蛋白酶和7mL 37%HCl加入1L的容量瓶,用超纯水定容;
肠液:称取6.8g KH2PO4溶于1L超纯水,加入3.2g胰蛋白酶,NaOH调节至pH 6.8。
(3)胃肠道的滞留时间及稳定性对比
口服药物的吸收在小肠上皮细胞进行,胃肠道生理环境的变化直接影响药物的稳定性从而间接对药物的吸收产生较大的影响。功能性小分子在胃肠道环境下稳定性测定是新产品发现和开发过程中非常必要的研究步骤,他对于功能性小分子结构的修饰、剂型的选择,生产条件的确定均具有重要的意义。由图1和图2可看出,总体而言含胃蛋白酶的胃液中葡聚糖对大黄酚吸附比含胰蛋白酶的肠液吸附量大,且随着时间的延长,大黄酚葡聚糖包合物有不同程度的降解。研究葡聚糖配基在胃肠道中的稳定性,为葡聚糖配基产品的开发和剂型的选择提供依据,通过测定大黄酚葡聚糖包合物在人工胃液和人工肠液中随着放置时间的稳定性;结果显示,大黄酚葡聚糖包合物在人工胃液中酸性环境下较稳定,4h后,大黄酚游离率仅为58.3%;而在肠液中葡聚糖配基的剩余量仍然达到50%以上。
从大黄酚葡聚糖包合物在人工模拟胃液中与人工模拟肠液中的稳定性基本一致,药物残留量与时间的关系曲线基本重合的情况说明胃蛋白酶和胰酶不是影响葡聚糖配基稳定性的主要因素。
实施例5改善胃肠道的菌群平衡(小鼠腹泻率试验)
大肠杆菌菌悬液的制备:将大肠杆菌接种于LB培养基中,37℃气浴恒温振荡器上振荡培养12h后,将液体培养基离心得到沉淀,用灭菌生理盐水冲洗菌落2次,离心后再用灭菌生理盐水制成大肠杆菌菌悬液,根据平板计数法分别配制浓度为2×107CFU/mL、2×108CFU/mL、2×109CFU/mL、2×1010CFU/mL细菌悬液,4℃保存备用。
建立大肠杆菌感染动物腹泻模型:小鼠实验前12h禁食、自由饮水。腹腔注射相应浓度的菌液,注射体积为0.5mL,对照组腹腔注射等体积的无菌生理盐水。小鼠出现明显的腹泻症状、水样便、精神萎靡、行动迟缓等表明模型建立成功。
试验设计:小鼠60只,雌雄各半,体重30g±2g,分6组,每组10只,分别为正常对照组、模型对照组、阳性对照组组、本发明实施例2组、实施例3组和对比实施例1组。阳性对照组小鼠造模后4h口服蒙脱石散1g/kg,本发明实施例2组、实施例3组和对比实施例1组小鼠造模后4h口服本发明的大黄粉葡聚糖包合物300mg/kg,每天1次,连续6天。
腹泻指标:将小鼠放入铺有滤纸的鼠笼内,观察小鼠腹泻情况。计算腹泻率:每组动物中排稀便的动物数占该组动物总数的百分比。对小鼠腹泻率的影响结果如图3所示。
结果表明,与正常对照组相比,模型对照组腹泻率明显升高。本发明大黄酚葡聚糖包合物可明显降低腹泻率,促进小鼠的康复;并且效果的顺序为:实施例3组>实施例2组>对比实施例1组。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!