一种具有靶向作用的基于氧化石墨烯的纳米药物载体及其制备方法与流程
本发明涉及医药领域,特别是涉及一种具有靶向作用的基于氧化石墨烯的纳米药物载体及其制备方法。
背景技术:
随着纳米技术和生物药物的日益发展,纳米药物载体成为热门的研究领域。纳米药物载体可以高效负载药物、靶向传递药物及可控地释放药物.并且可以延长药物作用时问,具有生物相容性及毒副作用小等优点。纳米药物载体可分为纳米粒、纳米脂质体、聚合物胶柬及纳米磁性颗粒。常见的纳米药物载体有碳纳米管、微球、脂质体或铁氧体磁性粒子等,它们通过表面吸附、氢键、嵌入或其它反应负载药物。
石墨烯是一种具有二维蜂窝状结构的新型纳米材料,它具有优异的力学、热学、电学和光学性能。在生物医药、生物传感器及电化学等方面具有潜在的应用。近年来,一些学者探索了石墨烯在生物医药方面的应用,特别是生物靶向及药物传递方面,取得了一定的成果。石墨烯具有较大的比表面积,可以通过其上下表面及其边缘负载药物,负载能力比其它纳米材料高很多。
技术实现要素:
本发明的第一目的在于解决现有技术中抗肿瘤靶向药物载药量较低,毒副作用较大的缺陷,提供一种毒副作用较小,在血液中循环时间较长,又具有靶向作用和响应性药物释放的纳米药物载体。
本发明解决上述技术问题的技术方案是:一种具有靶向作用的基于氧化石墨烯的纳米药物载体,所述纳米药物载体包括氧化石墨烯、PyBA-PEG-FA和PyBA-S-S-Drug;所述PyBA-S-S-Drug中的药物为阿霉素、Ce6或原卟啉IX中的一种或多种。
优选的,所述的聚乙二醇的分子量为1000~8000,至少具有两个端氨基的直链或多直臂的的聚合物。
本发明的第二目的在于解决现有技术中抗肿瘤靶向药物载药量较低,毒副作用较大的缺陷,提供一种毒副作用较小,在血液中循环时间较长,又具有靶向作用和响应性药物释放的纳米药物载体的制备方法。
本发明解决上述技术问题的技术方案是:一种具有靶向作用的基于氧化石墨烯的纳米药物载体的制备方法,其特征在于包括如下步骤:
(1)将聚乙二醇与1-芘丁酸按照一定的比例r1加入到有机溶剂S1中,在50~100℃条件下反应一段时间2~12小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-NH2;然后将PyBA-PEG-NH2与叶酸按照一定的比例r2加入到有机溶剂S2中,在50~100℃条件下反应一段时间2~12小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-FA;
(2)接着将胱氨与1-芘丁酸按照一定的比例r3加入到有机溶剂S3中,在常温下反应一段时间12~24小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-NH2;然后将PyBA-S-S-NH2用丁二酸酐处理成PyBA-S-S-COOH后与抗肿瘤药物按照一定的比例r4加入到有机溶剂S4中,在常温下反应一段时间12~24小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-Drug;
(3)然后将一定浓度C1的氧化石墨烯溶液用细胞破碎仪超声剥离.5~1.5小时;接着将前述步骤得到的PyBA-PEG-FA、PyBA-S-S-Drug和氧化石墨烯按照一定的比例r5分散于有机溶剂中S5,然后于常温下避光搅拌6~12小时,然后透析后冷冻干燥即可得到基于氧化石墨烯的纳米药物载体。
优选的,所述摩尔比r1为1:0.5~1:1.5,所述有机溶剂S1为N’N-二甲基甲酰胺、四氢呋喃、二氧六环中的一种或多种。
优选的,所述摩尔比r2为1:1~1:4,所述有机溶剂S2为N’N-二甲基甲酰胺、四氢呋喃、二氧六环、甲苯、二氯甲烷中的一种或多种。
优选的,所述摩尔比r3为1:0.3~1:1,所述有机溶剂S3为N’N-二甲基甲酰胺、四氢呋喃、二氧六环、甲苯、二氯甲烷中的一种或多种。
优选的,所述摩尔比r4为1:1~1:5,所述有机溶剂S4为N’N-二甲基甲酰胺、四氢呋喃、二氧六环、甲苯、二氯甲烷中的一种或多种。
优选的,所述的抗肿瘤药物为阿霉素DOX、Ce6、原卟啉IX(protoporphyrin IX,PpIX)中的一种或多种。
优选的,所述浓度C1为0.5~2mg/mL。
优选的,所述质量比r5为10:0.5:10~10:3:20,所述有机溶剂S5为为N’N-二甲基甲酰胺和四氢呋喃中的一种或两种。
附图说明
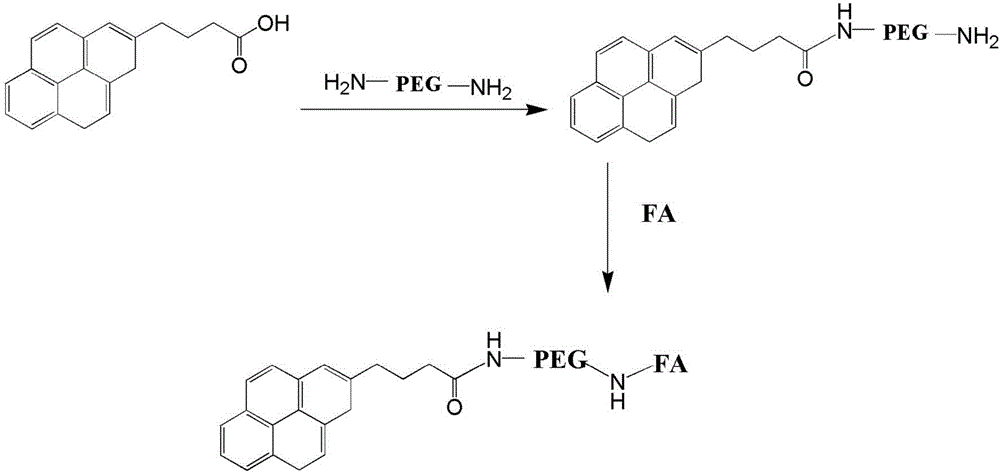
图1为叶酸介导的基于氧化石墨烯具有还原相应性的纳米药物载体的结构示意图。
图2为PyBA-PEG-FA的反应制备流程图。
图3为PyBA-S-S-DOX的反应制备流程图。
图4为实例3的动态光散射粒径图。
图5为实例3的透射电镜图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
下面为具体实施例部分。
实施例1
将分子量为3000的聚乙二醇NH2-PEG-NH2与1-芘丁酸按照摩尔比1:0.5加入到有机溶剂DMF中,DMF的用量为反应物质量的30倍,在 100℃条件下反应6个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-NH2;然后将PyBA-PEG-NH2与叶酸按照摩尔比1:2加入到DMSO中,在100℃条件下反应一段时间8个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-FA;
接着将胱氨与1-芘丁酸按照摩尔比1:0.3加入到有机溶剂DMSO中,在常温下反应一段时间12小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-NH2;然后将PyBA-S-S-NH2用丁二酸酐处理成PyBA-S-S-COOH后与抗肿瘤药物DOX按照摩尔比1:4加入到有机溶剂二氧六环中,在常温下反应一段时间 24小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-DOX;
然后将1mg/mL的氧化石墨烯溶液在冰浴下用细胞破碎仪超声玻璃1.0小时;接着将PyBA-PEG-FA、PyBA-S-S-DOX和氧化石墨烯按照一定的质量比10:0.5:10分散于DMSO中,然后于常温下避光搅拌6小时,然后透析后冷冻干燥即可得到基于氧化石墨烯的纳米药物载体;
称取5mg纳米药物载体溶解于5ml水中,即可得到叶酸介导的基于氧化石墨烯具有还原相应性的纳米药物载体。
通过马尔文粒度分析仪测得,该药物载体的平均粒径为130nm;
通过紫外光谱标准曲线算得,该药物载体的载药量为11.3%。
实施例2
将分子量为4000的聚乙二醇NH2-PEG-NH2与1-芘丁酸按照摩尔比1:1加入到有机溶剂DMSO中,DMSO的用量为反应物质量的10倍,在 100℃条件下反应8个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-NH2;然后将PyBA-PEG-NH2与叶酸按照摩尔比1:3加入到DMF中,在100℃条件下反应一段时间12个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-FA;
接着将胱氨与1-芘丁酸按照摩尔比1:0.6加入到有机溶剂DMSO中,在常温下反应一段时间18小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-NH2;然后将PyBA-S-S-NH2用丁二酸酐处理成PyBA-S-S-COOH后与抗肿瘤药物DOX按照摩尔比1:3加入到有机溶剂二氧六环中,在常温下反应一段时间 12小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-DOX;
然后将1mg/mL的氧化石墨烯溶液在冰浴下用细胞破碎仪超声玻璃1.5小时;接着将PyBA-PEG-FA、PyBA-S-S-DOX和氧化石墨烯按照一定的比例10:1:15分散于DMSO中,然后于常温下避光搅拌12小时,然后透析后冷冻干燥即可得到基于氧化石墨烯具有还原相应性的纳米药物载体;
称取5mg纳米药物载体溶解于5ml水中,即可得到一种叶酸介导的基于氧化石墨烯具有的纳米药物载体。
通过马尔文粒度分析仪测得,该药物载体的平均粒径为110nm;
通过紫外光谱标准曲线算得,该药物载体的载药量为13.8%。
实施例3
将分子量为5000的聚乙二醇NH2-PEG-NH2与1-芘丁酸按照摩尔比1:0.5加入到有机溶剂DMF中,在 80℃条件下反应12个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-NH2;然后将PyBA-PEG-NH2与叶酸按照摩尔比1:5加入到DMF中,在100℃条件下反应6个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-FA;
接着将胱氨与1-芘丁酸按照摩尔比1:1加入到有机溶剂DMSO中,在常温下反应24小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-NH2;然后将PyBA-S-S-NH2用丁二酸酐处理成PyBA-S-S-COOH后与抗肿瘤药物DOX按照摩尔比1:5加入到有机溶剂二氧六环中,在常温下反应12小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-DOX;
然后将一定浓度0.5mg/mL的氧化石墨烯溶液在冰浴下用细胞破碎仪超声玻璃1.0小时;接着将PyBA-PEG-FA、PyBA-S-S-DOX和氧化石墨烯按照一定的比例10:3:20分散于DMSO中,然后于常温下避光搅拌12小时,然后透析后冷冻干燥即可得到基于氧化石墨烯具有还原相应性的纳米药物载体;
称取5mg纳米药物载体溶解于5ml水中,即可得到一种叶酸介导的基于氧化石墨烯的纳米药物载体。
通过马尔文粒度分析仪测得,该药物载体的平均粒径为118nm(如附图所示);
通过紫外光谱标准曲线算得,该药物载体的载药量为17.6%。
实施例4
将分子量为6000的聚乙二醇NH2-PEG-NH2与1-芘丁酸按照摩尔比1:0.8加入到有机溶剂DMF中,在 90℃条件下反应12个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-NH2;然后将PyBA-S-S-NH2用丁二酸酐处理成PyBA-S-S-COOH后与叶酸按照摩尔比1:3.5加入到DMF中,在80℃条件下反应12个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-FA;
接着将胱氨与1-芘丁酸按照摩尔比1:0.5加入到有机溶剂DMSO中,在常温下反应24小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-NH2;然后将PyBA-S-S-NH2与抗肿瘤药物DOX按照摩尔比1:4加入到有机溶剂DMF中,在常温下反应20小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-DOX;
然后将一定浓度1mg/mL的氧化石墨烯溶液在冰浴下用细胞破碎仪超声玻璃0.5小时;接着将PyBA-PEG-FA、PyBA-S-S-DOX和氧化石墨烯按照一定的比例10:3:20分散于DMSO中,然后于常温下避光搅拌8小时,然后透析后冷冻干燥即可得到基于氧化石墨烯的纳米药物载体;
称取5mg纳米药物载体溶解于5ml水中。即可得到一种叶酸介导的基于氧化石墨烯具有还原相应性的纳米药物载体。
通过马尔文粒度分析仪测得,该药物载体的平均粒径为120nm;
通过紫外光谱标准曲线算得,该药物载体的载药量为12.8%.
实施例5
将分子量为7000的聚乙二醇NH2-PEG-NH2与1-芘丁酸按照摩尔比1:0.5加入到有机溶剂DMF中,在 100℃条件下反应12个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-NH2;然后将PyBA-PEG-NH2与叶酸按照摩尔比1:5加入到DMSO中,在100℃条件下反应8个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-FA;
接着将胱氨与1-芘丁酸按照摩尔比1:1.5加入到有机溶剂DMSO中,在常温下反应12小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-NH2;然后将PyBA-S-S-NH2用丁二酸酐处理成PyBA-S-S-COOH后与抗肿瘤药物PpIX按照摩尔比1:2加入到有机溶剂DMSO中,在常温下反应6小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-PpIX;
然后将一定浓度1.5mg/mL的氧化石墨烯溶液在冰浴下用细胞破碎仪超声玻璃1.0小时;接着将PyBA-PEG-FA、PyBA-S-S-Drug和氧化石墨烯按照一定的比例10:0.5:16分散于DMSO中,然后于常温下避光搅拌6小时,然后透析后冷冻干燥即可得到基于氧化石墨烯具有还原相应性的纳米药物载体;
称取5mg纳米药物载体溶解于5ml水中。即可得到一种叶酸介导的基于氧化石墨烯具有还原相应性的纳米药物载体。
通过马尔文粒度分析仪测得,该药物载体的平均粒径为90nm;
通过紫外光谱标准曲线算得,该药物载体的载药量为8.9%。
实施例6
将分子量为8000的聚乙二醇NH2-PEG-NH2与1-芘丁酸按照摩尔比1:0.5加入到有机溶剂DMF中,在 60℃条件下反应6个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-NH2;然后将PyBA-PEG-NH2与叶酸按照摩尔比1:2加入到DMSO中,在100℃条件下反应12个小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-PEG-FA;
接着将胱氨与1-芘丁酸按照摩尔比1:1.5加入到有机溶剂DMSO中,在常温下反应12小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-NH2;然后将PyBA-S-S-NH2用丁二酸酐处理成PyBA-S-S-COOH后与抗肿瘤药物Ce6按照摩尔比1:1加入到有机溶剂DMSO中,在常温下反应24小时,反应结束后将混合液透析后冷冻干燥即可得到PyBA-S-S-Ce6;
然后将一定浓度2mg/mL的氧化石墨烯溶液在冰浴下用细胞破碎仪超声玻璃1.0小时;接着将PyBA-PEG-FA、PyBA-S-S-Drug和氧化石墨烯按照一定的比例10:3:15分散于DMSO中,然后于常温下避光搅拌12小时,然后透析后冷冻干燥即可得到基于氧化石墨烯具有还原相应性的纳米药物载体;
称取5mg纳米药物载体溶解于5ml水中。即可得到一种叶酸介导的基于氧化石墨烯的纳米药物载体。
通过马尔文粒度分析仪测得,该药物载体的平均粒径为100nm;
通过紫外光谱标准曲线算得,该药物载体的载药量为11.9%。
- 还没有人留言评论。精彩留言会获得点赞!
- 过渡金属与石墨烯的复合纳米线及其制备方法与流程
- 一种氧化石墨烯表面原位生长二氧化硅的纳米杂化填料及其制备方法与流程
- GO增强CNT覆膜砂的智能混凝土无线传感器的制造方法与工艺
- 一种基于纳米纤维素晶须MoS2/石墨烯复合对电极材料及其制备方法和应用与流程
- 聚醚砜树脂/石墨烯纳米片多孔纳米复合材料、制备方法及其用途与流程
- 一种改性石墨烯与纳米纤维素复合温敏材料的制备方法与制造工艺
- 石墨烯掺杂改性纳米钙钛矿型La1‑xSrxMnO3复合材料及其制备方法和应用与制造工艺
- 一种在二氧化锰电极表面对苯胺进行原位氧化的方法与制造工艺
- 一种氧化石墨烯/银纳米颗粒/金字塔形硅三维拉曼增强基底及制备方法和应用与制造工艺
- 纳米羧基化石墨烯复合涤纶导电织物的制备方法与制造工艺
- 一种氧化石墨烯表面原位生长二氧化硅的纳米杂化填料及其制备方法与流程
- 一种基于纳米纤维素晶须MoS2/石墨烯复合对电极材料及其制备方法和应用与流程
- 一种改性石墨烯与纳米纤维素复合温敏材料的制备方法与制造工艺
- 一种石墨烯生产设备的制造方法与工艺
- 石墨烯掺杂改性纳米钙钛矿型La1‑xSrxMnO3复合材料及其制备方法和应用与制造工艺
- 一种氧化石墨烯/银纳米颗粒/金字塔形硅三维拉曼增强基底及制备方法和应用与制造工艺
- 纳米羧基化石墨烯复合涤纶导电织物的制备方法与制造工艺
- 硅烷纳米石墨烯陶化膜及其制备方法与制造工艺
- 纳米氧化石墨烯在促进小鼠胚胎干细胞培养和自我更新中的应用的制造方法与工艺
- 一种纳米石墨烯改性蓝藻基复合生物塑料及其制备方法与制造工艺
- 一种基于纳米纤维素晶须MoS2/石墨烯复合对电极材料及其制备方法和应用与流程
- 一种改性石墨烯与纳米纤维素复合温敏材料的制备方法与制造工艺
- 石墨烯掺杂改性纳米钙钛矿型La1‑xSrxMnO3复合材料及其制备方法和应用与制造工艺
- 一种多层石墨烯纳米碳管三维碳材料填充纳米硅复合材料及其制备方法与制造工艺
- 一种氧化石墨烯/银纳米颗粒/金字塔形硅三维拉曼增强基底及制备方法和应用与制造工艺
- 一种碳纳米管和石墨烯协同增强铝基复合材料及制备方法与制造工艺
- 纳米氧化石墨烯在促进小鼠胚胎干细胞培养和自我更新中的应用的制造方法与工艺
- 一种碳纳米管和石墨烯复配润滑油的制备方法与制造工艺
- 一种纳米石墨烯改性蓝藻基复合生物塑料及其制备方法与制造工艺
- 用于制备石墨烯纳米带的邻三联苯的制造方法与工艺