用于治疗IL‑6相关疾病的组合物的制作方法
本发明涉及用于治疗il-6相关疾病的药物组合物或给药方案。
背景技术:
白介素-6(il-6)是一种细胞因子,其也被称为b细胞刺激因子2(bsf2)或干扰素β2。il-6被发现是参与b淋巴样细胞激活的分化因子(非专利文献1),并且后来发现其是影响多种细胞的功能的多功能性细胞因子(非专利文献2)。据报道,il-6引起t淋巴样细胞的成熟(非专利文献3)。
il-6经由细胞上的两类蛋白传递其生物学活性。其中之一是il-6受体,所述受体是与il-6结合的分子量约为80kd的配体结合蛋白(非专利文献4和5)。除了在细胞膜上表达的膜结合形式以外,il-6受体作为可溶性il-6受体存在,其主要由其胞外区构成,并且穿透通过细胞膜。
另一个是膜蛋白gp130,其具有约130kda的分子量并且参与非配体结合的信号转导。il-6和il-6受体形成il-6/il-6受体复合物,之后所述复合物与gp130结合,从而使il-6的生物学活性被传递到细胞中(非专利文献6)。
il-6抑制剂是抑制il-6生物学活性传递的物质。目前,针对il-6的抗体(抗-il-6抗体),针对il-6受体的抗体(抗-il-6受体抗体),针对gp130的抗体(抗-gp130抗体),il-6变体,il-6或il-6受体的部分肽等是已知的。
有若干关于抗-il-6受体抗体的报道(非专利文献7和8,和专利文献1-3)。其中之一是通过将小鼠抗体pm-1的互补决定区(cdr)(非专利文献9)移植到人抗体(专利文献1)中获得的人源化pm-1抗体。
托珠单抗,作为一种抗-il-6受体抗体,目前被用于治疗炎性疾病如类风湿性关节炎和卡斯尔曼病(castleman’sdisease)(非专利文献10),并且其也已经被确认为对疾病如视神经脊髓炎(nmo)有效(非专利文献11)。
也已经报道了il-6抗体对重症肌无力的疗效(非专利文献12)。
人源化抗体如托珠单抗是第一代抗体药物。目前正通过改进第一代抗体药物的药效、方便性和成本来开发第二代抗体药物(专利文献2)。作为第二代抗体药物,sa237(一种新的抗-il-6受体抗体)已经通过应用改进技术如用于增强效应器功能,抗原-结合能力,药物动力学和稳定性的那些,或用于减小免疫学风险的那些来制备,并且已经进入临床试验。
虽然目前正在进行多种抗体治疗,但由于抗-抗体的发展所致的疗效的衰减已在阿仑珠单抗(alemtuzumab)中被确认。为了防止该衰减,据报道,有效的是施用可以高剂量施用的非细胞结合突变体,而非通过施用高剂量的阿仑珠单抗而引起免疫耐受(非专利文献13)。
与本申请发明相关的现有技术文献显示如下。
现有技术文献
[非专利文献]
[非专利文献1]hirano,t等,nature(1986)324,73-76
[非专利文献2]akira,s等,adv.inimmunology(1993)54,1-78
[非专利文献3]lotz,m等,j.exp.med.(1988)167,1253-1258
[非专利文献4]taga,t等,j.exp.med.(1987)166,967-981
[非专利文献5]yamasaki,k等,science(1988)241,825-828
[非专利文献6]taga,t等,cell(1989)58,573-581
[非专利文献7]novick,d等,hybridoma(1991)10,137-146
[非专利文献8]huang,y.w等,hybridoma(1993)12,621-630
[非专利文献9]hirata,y等,j.immunol.(1989)143,2900-2906
[非专利文献10]nishimoto,n等,blood.2005oct15;106(8):2627-32
[非专利文献11]araki等,mod.rheumatol.(2013)23(4),827-831
[非专利文献12]aricha,r等,j.autoimmun.(2011)36(2),135-141
[非专利文献13]charlottel等,naturereviewsrheumatology(2010)6,558-559
[专利文献]
[专利文献1]国际专利申请公布号wo92-19759
[专利文献2]国际专利申请公布号wo2010/035769
发明概述
[本发明要解决的问题]
即使是在通过应用降低免疫原性的技术而制备的sa237(具有seqidno:3的重链序列和seqidno:4的轻链序列的抗体)的情况下,在向健康成年男性受试者皮下施用单剂量的120mg的sa237的i期研究(sa-001jp)中,在54.2%的情况中(72个例子中的39个)产生抗-sa237抗体并且出现免疫原性问题。本发明的一个目的是抑制抗-抗体产生并且提供更有效的用于治疗il-6相关疾病的药物组合物或给药方案。
[解决问题的方式]
为了解决上述问题,本发明人聚焦于免疫耐受,并且发现通过以预定的施用方法和剂量施给药物组合物可以抑制抗-抗体产生。
更具体地,本发明人发现可以通过使用以预定的剂量和施用方法施用的药物组合物可以抑制抗-抗体产生从而治疗il-6相关疾病,并且由此完成了本发明。
具体地,本发明包括以下各项:
[1]用于治疗il-6相关疾病的药物组合物,所述药物组合物包含il-6抑制剂作为活性成分,其中在短间隔给药期后常规施用所述药物组合物,在所述短间隔给药期中以比常规给药间隔更短的间隔多次施用与常规剂量相同的剂量。
[2][1]的药物组合物,其中所述常规给药间隔为三至五周。
[3][1]的药物组合物,其中所述常规给药间隔为四周。
[4][1]至[3]中任一项的药物组合物,其中以比常规给药间隔更短的间隔多次施用所述剂量的所述短间隔给药期期间的给药间隔为一至两周。
[5][1]至[3]中任一项的药物组合物,其中以比常规给药间隔更短的间隔多次施用所述剂量的所述短间隔给药期期间的给药间隔为两周。
[6][1]至[5]中任一项的药物组合物,其中所述短间隔给药期为自初始施用起四周。
[7][1]至[6]中任一项的药物组合物,其中所述常规剂量为50mg至800mg/施用。
[8][1]至[7]中任一项的药物组合物,其中所述常规剂量为120mg/施用。
[9][1]至[8]中任一项的药物组合物,其中所述il-6抑制剂是il-6受体抗体。
[10][9]的药物组合物,其中所述il-6受体抗体是嵌合抗体,人源化抗体,或人抗体。
[11][9]的药物组合物,其中所述il-6受体抗体包含具有seqidno:1的序列的重链可变区和具有seqidno:2的序列的轻链可变区。
[12][9]的药物组合物,其中所述il-6受体抗体包含具有seqidno:3的序列的重链和具有seqidno:4的序列的轻链。
[13][9]的药物组合物,其中所述il-6受体抗体是sa237。
[14][1]至[13]中任一项的药物组合物,其中所述il-6相关疾病是类风湿性关节炎、青少年特发性关节炎、全身发作性青少年特发性关节炎、卡斯尔曼病、系统性红斑狼疮(sle)、狼疮肾炎、克罗恩氏病、淋巴瘤、溃疡性结肠炎、贫血、血管炎、川崎病、斯蒂尔病、淀粉样变性、多发性硬化、移植、年龄相关性黄斑变性、强直性脊柱炎、银屑病、银屑病关节炎、慢性阻塞性肺病(copd)、iga肾病、骨关节炎、哮喘、糖尿病肾病、gvhd、子宫内膜异位症、肝炎(nash)、心肌梗死、动脉硬化、脓毒症、骨质疏松症、糖尿病、多发性骨髓瘤、前列腺癌、肾癌、b-细胞非霍奇金、胰腺癌、肺癌、食管癌、结肠癌、癌恶病质、癌神经侵入、心肌梗死、近视性脉络膜新血管生成、特发性脉络膜新血管生成、葡萄膜炎、慢性甲状腺炎、迟发型超敏反应、接触性皮炎、特应性皮炎、间皮瘤、多肌炎、皮肌炎、全葡萄膜炎、前葡萄膜炎、中间葡萄膜炎、巩膜炎、角膜炎、眼窝炎症、视神经炎、糖尿病视网膜病、增生性玻璃体视网膜病、干眼症、术后炎症、视神经脊髓炎、重症肌无力或肺高血压。
[15][1]至[14]中任一项的药物组合物,其中所述药物组合物是用于皮下施用的制剂。
[16]用于治疗il-6相关疾病的方法,所述方法包括施用il-6抑制剂,其中在短间隔给药期后常规施用所述il-6抑制剂,在所述短间隔给药期中以比常规给药间隔更短的间隔多次施用与常规剂量相同的剂量。
[17]il-6抑制剂,其用于治疗il-6相关疾病,其中在短间隔给药期后常规施用所述il-6抑制剂,在所述短间隔给药期中以比常规给药间隔更短的间隔多次施用与常规剂量相同的剂量。
[18]il-6抑制剂用于制备药物的用途,所述药物用于治疗il-6相关疾病,其中在短间隔给药期后常规施用所述il-6抑制剂,在所述短间隔给药期中以比常规给药间隔更短的间隔多次施用与常规剂量相同的剂量。
发明效果
本发明的药物组合物或方案可以解决抗-药物抗体产生的免疫原性问题,并且以使患者负担较小的方式提供药物组合物,因为其不使患者暴露于高剂量。
附图简述
图1指示血清sa237浓度的平均值(和标准差)的变化。图1a显示主要评估期期间sa237浓度的变化,图1b显示延长期期间sa237浓度的变化,图1c显示至第8周的血清sa237浓度的变化。
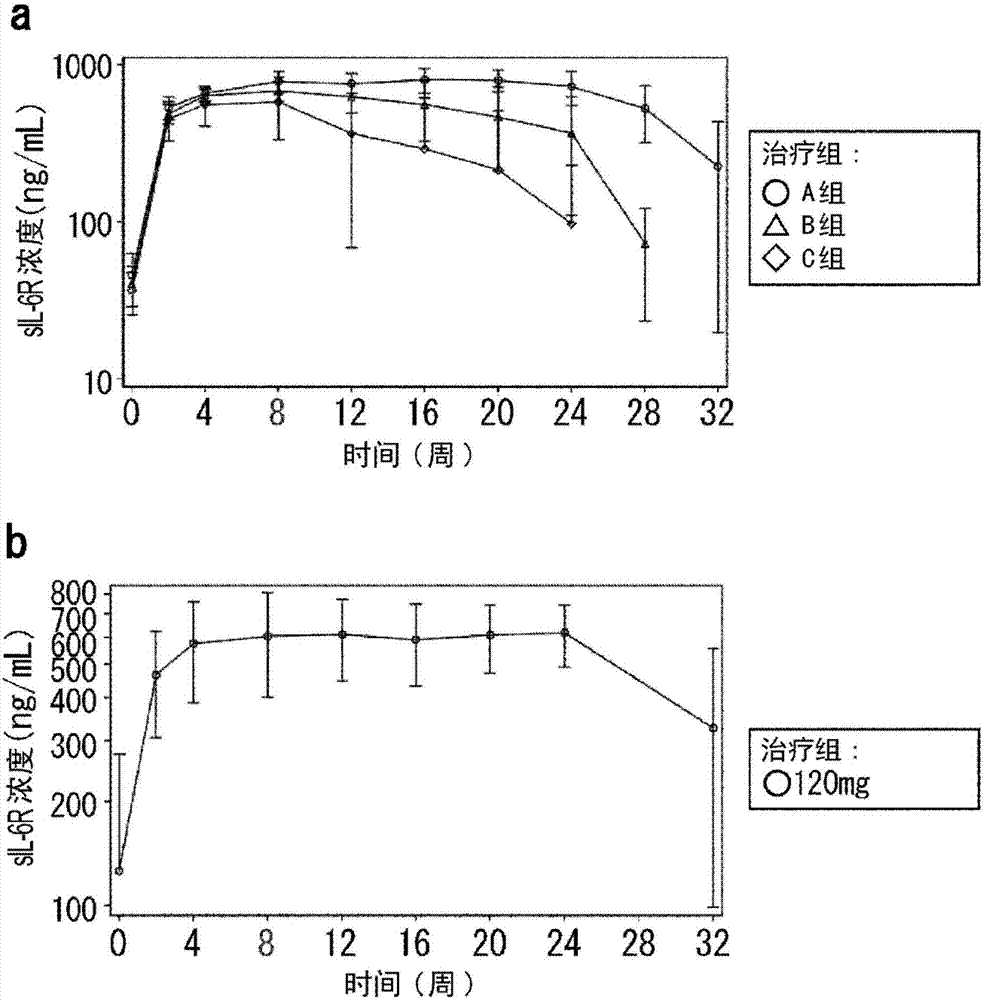
图2指示作为sa237的药效学标志物的血清sil-6r浓度的平均值(和标准差)的变化。图2a显示主要评估期期间sil-6r浓度的变化,图2b显示延长期期间血清sil-6r浓度的变化。
图3指示作为sa237的药效学标志物的血清crp浓度的平均值(和标准差)的变化。图3a显示主要评估期期间的crp浓度的变化,图3b显示延长期期间crp浓度的变化。
具体实施方式
下文中,将详细描述本发明。
本发明涉及用于治疗il-6相关疾病的药物组合物或给药方案。
本发明的“il-6抑制剂”是这样的物质,其阻断通过il-6的信号转导,并且抑制il-6的生物学活性。il-6抑制剂优选是针对与il-6,il-6受体和gp130中任一的结合具有抑制作用的物质。
本发明的il-6抑制剂的实例包括,但不特别限于,抗-il-6抗体,抗-il-6受体抗体,抗-gp130抗体,il-6变体,可溶性il-6受体变体,或il-6或il-6受体的部分肽,以及显示类似活性的低分子量物质。本发明的il-6抑制剂的实例可以优选是识别il-6受体的抗体。
本发明抗体的来源不受特别限制,但是其优选是哺乳动物并且更优选是人。
本发明中使用的抗-il-6抗体可以使用已知方法作为多克隆或单克隆抗体获得。来源于哺乳动物的单克隆抗体对于本发明中使用的抗-il-6抗体是尤其优选的。来源于哺乳动物的单克隆抗体包括通过杂交瘤产生的那些和通过使用基因工程方法用含抗体基因的表达载体转化宿主产生的那些。通过结合il-6,该抗体抑制il-6与il-6受体的结合,并且阻断il-6生物学活性转导到细胞中。
此种抗体的实例包括mh166抗体(matsuda,t.等,eur.j.immunol.(1988)18,951-956)和sk2抗体(sato,k.等,theabstractsofthe21stannualmeetingofthejapanesesocietyforimmunology(1991)21,166)。
基本上,产生抗-il-6抗体的杂交瘤可以使用已知方法如下制备。具体地,杂交瘤可以通过以下方式制备:通过常规免疫方法使用il-6作为敏化抗原进行免疫,通过常规细胞融合方法将所得的免疫细胞与已知的亲本细胞融合,然后使用常规筛选方法筛选产生单克隆抗体的细胞。
具体地,抗-il-6抗体可以制备如下。用作用于获得抗体的敏化抗原的人il-6可以通过例如使用eur.j.biochem(1987)168,543-550;j.immunol.(1988)140,1534-1541;和agr.biol.chem.(1990)54,2685-2688中公开的il-6基因和/或氨基酸序列获得。
在将合适的宿主细胞用插入有il-6基因序列的已知的表达载体系统转化后,使用已知方法从宿主细胞内部或从培养物上清中纯化靶il-6蛋白。此纯化的il-6蛋白可用作敏化抗原。备选地,il-6蛋白和另一种蛋白的融合蛋白可以用作敏化抗原。
本发明中使用的抗-il-6受体抗体可以使用已知方法作为多克隆或单克隆抗体获得。来源于哺乳动物的单克隆抗体对于本发明中使用的抗-il-6受体抗体是尤其优选的。来源于哺乳动物的单克隆抗体包括通过杂交瘤产生的那些和通过使用基因工程方法用含抗体基因的表达载体转化宿主产生的那些。通过结合il-6受体,该抗体抑制il-6与il-6受体的结合,并且阻断il-6生物学活性转导到细胞中。
此种抗体的实例包括mr16-1抗体(tamura,t.等proc.natl.acad.sci.usa(1993)90,11924-11928),pm-1抗体(hirata,y.等,j.immunol.(1989)143,2900-2906),auk12-20抗体,auk64-7抗体,和auk146-15抗体(国际专利申请公布号wo92-19759)。其中,列出pm-1抗体作为优选的针对人il-6受体的单克隆抗体的实例,并且列出mr16-1抗体作为优选的针对小鼠il-6受体的单克隆抗体的实例。
基本上,产生抗-il-6受体单克隆抗体的杂交瘤可以使用已知方法制备如下。具体地,杂交瘤可以通过以下方式制备:通过常规免疫方法使用il-6受体作为敏化抗原进行免疫,通过常规细胞融合方法将所得的免疫细胞与已知的亲本细胞融合,然后使用常规筛选方法筛选产生单克隆抗体的细胞。
具体地,抗-il-6受体抗体可以如下制备。用作用于获得抗体的敏化抗原的人il-6受体或小鼠il-6受体可以通过例如使用分别在欧洲专利申请公布号ep325474和日本专利申请kokai公布号(jp-a)h03-155795(未审的已公布的日本专利申请)中公开的il-6受体基因和/或氨基酸序列获得。
有两种类型的il-6受体蛋白:一种表达在细胞膜上而另一种分离自细胞膜(可溶性il-6受体)(yasukawa,k.等,j.biochem.(1990)108,673-676)。可溶性il-6受体基本上由与细胞膜结合的il-6受体的胞外区构成,并且与膜结合的il-6受体的不同之处在于其缺少跨膜区或跨膜区和胞内区两者。任何il-6受体都可以用作il-6受体蛋白,只要其可以用作用于产生本发明中使用的抗-il-6受体抗体的敏化抗原即可。
在将合适的宿主细胞用插入有il-6受体基因序列的已知的表达载体系统转化后,使用已知方法从宿主细胞内部或从培养物上清中纯化靶il-6受体蛋白。此纯化的il-6受体蛋白可用作敏化抗原。备选地,表达il-6受体的细胞或il-6受体蛋白与另一种蛋白的融合蛋白可以用作敏化抗原。
本发明中使用的抗-gp130抗体可以使用已知方法作为多克隆或单克隆抗体获得。来源于哺乳动物的单克隆抗体对于本发明中使用的抗-gp130抗体是尤其优选的。来源于哺乳动物的单克隆抗体包括通过杂交瘤产生的那些和通过使用基因工程方法用含抗体基因的表达载体转化宿主产生的那些。通过结合gp130,该抗体抑制il-6/il-6-受体复合物与gp130的结合,并且阻断il-6生物学活性向细胞中的转导。
此种抗体的实例包括am64抗体(jp-a(kokai)h03-219894),4b11和2h4抗体(us5571513),以及b-s12和b-p8抗体(jp-a(kokai)h08-291199)。
基本上,产生抗-gp130单克隆抗体的杂交瘤可以使用已知技术如下制备。具体地,杂交瘤可以通过以下方式制备:通过常规免疫方法使用gp130作为敏化抗原进行免疫,通过常规细胞融合方法将所得的免疫细胞与已知的亲本细胞融合,然后使用常规筛选方法筛选产生单克隆抗体的细胞。
具体地,单克隆抗体可以可以制备如下。例如,用作用于获得抗体的敏化抗原的gp130可以通过使用欧洲专利申请公布号ep411946中公开的gp130基因和/或氨基酸序列获得。
在将合适的宿主细胞用插入有gp130基因序列的已知的表达载体系统转化后,使用已知方法从宿主细胞内部或从培养物上清中纯化靶gp130蛋白。此纯化的gp130蛋白可用作敏化抗原。备选地,表达gp130的细胞或gp130蛋白与另一种蛋白的融合蛋白可以用作敏化抗原。
用敏化抗原免疫的哺乳动物不受特别限制,但是考虑与用于细胞融合的亲本细胞的相容性进行优选选择。典型地,使用啮齿动物如小鼠,大鼠和仓鼠。
根据已知方法用敏化抗原免疫动物。典型地,免疫通过例如腹膜内或皮下注射敏化抗原至哺乳动物进行。具体地,优选的是,将敏化抗原稀释或悬浮在磷酸盐缓冲盐水(pbs),生理盐水等中至适当的体积,并在需要时将其与适量的常规佐剂如弗氏完全佐剂混合并乳化,然后每4至21天向哺乳动物施用若干次。适当的载体也可以用于利用敏化抗原的免疫。
在以此方式免疫动物并确认所需抗体的血清水平增加后,将免疫的细胞从哺乳动物中移出并进行细胞融合。脾细胞作为进行细胞融合的免疫细胞是特别优选的。
将来自哺乳动物的骨髓瘤细胞用作与免疫的细胞融合的亲本细胞。目前,多种已知的细胞系如p3x63ag8.653(kearney,j.f.等,j.immunol(1979)123,1548-1550),p3x63ag8u.1(currenttopicsinmicrobiologyandimmunology(1978)81,1-7),ns-1(kohler,g.和milstein,c.,eur.j.immunol.(1976)6,511-519),mpc-11(margulies,d.h.等,cell(1976)8,405-415),sp2/0(shulman,m.等,nature(1978)276,269-270),f0(dest.groth,s.f.等,j.immunol.methods(1980)35,1-21),s194(trowbridge,i.s.,j.exp.med.(1978)148,313-323)和r210(galfre,g.等,nature(1979)277,131-133)被合适地使用。
基本上,前述免疫细胞与骨髓瘤细胞的细胞融合可以根据已知方法如milstein等的方法(kohler,g.和milstein,c.,methodsenzymol.(1981)73,3-46)进行。
更具体地,例如在常规营养培养基中在细胞融合促进剂存在下进行细胞融合。例如,将聚乙二醇(peg)或仙台病毒(hvj)用作融合促进剂,并且如果需要,可以进一步添加佐剂如二甲亚砜以用于提高融合效率。
使用的免疫细胞与骨髓瘤细胞之比优选为,例如,1至10个免疫细胞对一个骨髓瘤细胞。用于细胞融合的培养基例如是适用于骨髓瘤细胞系的增殖的rpmi1640或mem培养基。也可以使用用于该类型细胞培养的其他常规培养基。此外,血清补充物如胎牛血清(fcs)也可以组合使用。
对于细胞融合,目的融合细胞(杂交瘤)通过以下方式形成:将预定量的前述免疫细胞与骨髓瘤细胞在前述培养基中充分搅拌,添加预热至约37℃的浓度通常为30%至60%(w/v)的peg溶液(例如,平均分子量为约1,000至6,000的peg的溶液),然后将其混合。然后,可以通过重复以下操作将不适合杂交瘤生长的细胞融合剂等除去:顺序地添加适当的培养基并通过离心除去上清。
通过在常规的选择培养基,例如,hat培养基(含次黄嘌呤,氨基蝶呤和腺苷的培养基)中培养来选择杂交瘤。在hat培养基中的培养进行足够长的时间,通常数日至数周,以杀死目的杂交瘤以外的细胞(未融合的细胞)。然后,进行标准有限稀释方法以筛选和克隆产生目的抗体的杂交瘤。
除了用抗原免疫非人动物获得杂交瘤以外,所需的对所需的抗原或抗原表达细胞具有结合活性的人抗体可以通过以下方式获得:在体外用所需的抗原蛋白或抗原表达细胞敏化人淋巴细胞,并且将敏化的b淋巴细胞与人骨髓瘤细胞如u266融合(参见,日本专利申请kokoku公布号(jp-b)h01-59878(经审查批准的日本专利申请,公布用于异议))。此外,可以将抗原或抗原表达细胞施用于具有人抗体基因库(repertoire)的转基因动物,然后可以遵循前述方法获得所需的人抗体(参见,国际专利申请公布号wo93/12227,wo92/03918,wo94/02602,wo94/25585,wo96/34096和wo96/33735)。
可以将由此制备的产生单克隆抗体的杂交瘤在常规培养基中亚培养并长期储存在液氮中。
为了由杂交瘤获得单克隆抗体,可以使用以下方法:根据常规方法培养杂交瘤并且获得作为培养物上清的抗体或将杂交瘤施用到相容的哺乳动物中而使其增殖并且由腹水获得抗体;等等。前一种方法适用于获得高纯度的抗体,而后一种方法适用于大规模抗体生产。
例如,产生抗-il-6受体抗体的杂交瘤可以通过jp-a(kokai)h03-139293中公开的方法制备。此种制备可以通过以下方式进行:将产生pm-1抗体的杂交瘤注射到balb/c小鼠的腹腔中,获得腹水,然后由腹水纯化pm-1抗体;或在适当的培养基(如含10%胎牛血清和5%bm-condimedh1(boehringermannheim)的rpmi1640培养基;杂交瘤sfm培养基(gibco-brl);或pfhm-ii培养基(gibco-brl))中培养杂交瘤,然后由培养物上清纯化pm-1抗体。
重组抗体可以用作本发明的单克隆抗体,其中所述重组抗体通过以下方式制备:使用遗传重组技术,从杂交瘤克隆抗体基因,将基因插入到适当的载体中,然后将载体引入宿主中(见,例如,borrebaeck,c.a.k.和larrick,j.w.,therapeuticmonoclonalantibodies,在英国由macmillanpublishersltd出版,1990)。
更具体地,将编码抗体可变(v)区的mrna从产生目的抗体的细胞(如杂交瘤)分离。mrna可以通过以下方式分离:根据已知方法如胍超速离心法(chirgwin,j.m.等,biochemistry(1979)18,5294-5299)和agpc法(chomczynski,p.等,anal.biochem.(1987)162,156-159)制备总rna,并且使用mrna纯化试剂盒(pharmacia)等制备mrna。备选地,mrna可以直接使用quickprepmrna纯化试剂盒(pharmacia)制备。
使用反转录酶由获得的mrna合成抗体v区的cdna。cdna可以使用amv反转录酶第一链cdna合成试剂盒等合成。此外,为了合成和扩增cdna,可以使用利用5’-amplifinderrace试剂盒(clontech)和pcr的5’-race法(frohman,m.a.等,proc.natl.acad.sci.usa(1988)85,8998-9002;belyavsky,a.等,nucleicacidsres.(1989)17,2919-2932)。由获得的pcr产物纯化目的dna片段,然后与载体dna连接。然后,使用以上制备重组载体,并将其引入大肠杆菌等中,然后选择其克隆以制备所需的重组载体。通过已知方法如双脱氧法确认目的dna的核苷酸序列。
当获得编码目的抗体的v区的dna时,将该dna与编码所需抗体的恒定区(c区)的dna连接,并插入表达载体中。备选地,编码抗体v区的dna可被插入到包含抗体c区的dna的表达载体中。
为了制备本发明中使用的抗体,将抗体基因插入到表达载体中以使其在表达调节区如增强子和启动子的控制下表达,如下所述。然后,可以通过用该表达载体转化宿主细胞来表达所述抗体。
在本发明中,可以使用人工修饰的重组抗体,例如,嵌合抗体,人源化抗体,或人抗体,例如,以减小针对人的杂抗原性。这些修饰的抗体可以使用已知方法制备。
嵌合抗体可以通过以下方式获得:将如上获得的编码抗体v区的dna与编码人抗体c区的dna连接,将其插入到表达载体中,并将载体引入到宿主中以产生嵌合抗体(参见,欧洲专利申请公布号ep125023;国际专利申请公布号wo92-19759)。该已知方法可用于获得可用于本发明的嵌合抗体。
人源化抗体也被称为改造的人抗体或制成人类型的抗体。其通过将来自非人动物(例如,小鼠)的抗体的互补决定区(cdr)移植到人抗体的cdr中来制备。用于该基因重组的一般方法也是已知的(参见,欧洲专利申请公布号ep125023,国际专利申请公布号wo92-19759)。
更具体地,被设计成将小鼠抗体的cdr与人抗体的框架区(fr)连接的dna序列通过pcr由被制备成在其末端含重叠部分的若干寡核苷酸合成。将获得的dna与编码人抗体c区的dna连接并插入到表达载体中,并将表达载体引入到宿主中以制备人源化抗体(参见,欧洲专利申请公布号ep239400,国际专利申请公布号wo92-19759)。
选择经由cdr连接的人抗体fr以致cdr形成令人满意的抗原结合位点。当需要时,可以替换抗体可变区的框架区内的氨基酸,以致改造的人抗体的cdr形成适当的抗原结合位点(sato,k.等,cancerres.(1993)53,851-856)。
将人抗体c区用于嵌合和人源化抗体。人抗体c区的实例包括cγ,并且例如,可以使用cγ1,cγ2,cγ3或cγ4。此外,为了提高抗体及其制备的稳定性,可以修饰人抗体c区。
嵌合抗体由来源于非人动物的抗体的可变区和来源于人抗体的c区组成;人源化抗体由来源于非人动物的抗体的cdr和来源于人抗体的框架区和c区组成。其在人体中的抗原性被减弱,并且因此其可用作本发明中使用的抗体。
用于本发明的人源化抗体的优选的具体实例包括人源化pm-1抗体(参见,国际专利申请公布号wo92-19759)。
此外,除了上述获得人抗体的方法以外,通过使用人抗体文库进行淘选来获得人抗体的技术也是已知的。例如,可以通过使用噬菌体展示方法将人抗体的可变区作为单链抗体(scfv)表达在噬菌体表面上,然后可以选择结合抗原的噬菌体。通过分析所选噬菌体的基因,可以确定编码与抗原结合的人抗体的可变区的dna序列。在揭示了与抗原结合的scfv的dna序列后,可以制备包含所述序列的适当的表达载体以获得人抗体。这些方法是已知的,并且公开wo92/01047,wo92/20791,wo93/06213,wo93/11236,wo93/19172,wo95/01438和wo95/15388可用作参考。
如上所述构建的抗体基因可以根据已知方法表达。当使用哺乳动物细胞时,可以通过以下方式表达抗体基因:使用其中常用的有效启动子基因,要表达的抗体基因,和抗体基因3’侧(下游)的多聚腺苷酸信号被可操作地连接在一起的dna,或使用含所述dna的载体。启动子/增强子的实例包括人巨细胞病毒立早启动子/增强子。
此外,可用于表达可用于本发明的抗体的其他启动子/增强子包括来自反转录病毒,多瘤病毒,腺病毒,猿猴病毒40(sv40)等的病毒启动子/增强子;和来源于哺乳动物细胞的启动子/增强子如人延伸因子1α(hef1α)。
表达可以容易地进行,例如,在使用sv40启动子/增强子时遵循mulligan等(mulligan,r.c.等,nature(1979)277,108-114)中的方法,或在使用hef1α启动子/增强子时遵循mizushima等(mizushima,s.和nagatas.,nucleicacidsres.(1990)18,5322)中的方法。
当使用大肠杆菌时,可以通过可操作地连接常用的有效启动子基因,用于抗体分泌的信号序列,和要表达的抗体基因来表达所述抗体基因。启动子的实例包括lacz启动子和arab启动子。可以根据ward等的方法(ward,e.s.等,nature(1989)341,544-546;ward,e.s.等,fasebj.(1992)6,2422-2427)使用lacz启动子;并且可以根据better等的方法(better,m.等,science(1988)240,1041-1043)使用arab启动子。
当在大肠杆菌的周质中制备抗体时,pelb信号序列(lei,s.p.等,j.bacteriol.(1987)169,4379-4383)可以用作抗体分泌的信号序列。将周质中产生的抗体分离,然后适当再折叠要使用的抗体结构(参见,例如,wo96/30394)。
作为复制起点,可以使用来源于sv40,多瘤病毒,腺病毒,牛乳头瘤病毒(bpv)等的那些。此外,为了增加宿主细胞系统中的基因拷贝数,表达载体可以包含氨基葡糖苷磷酸转移酶(aph)基因,腺苷激酶(tk)基因,大肠杆菌黄嘌呤-鸟嘌呤磷酸核糖转移酶(ecogpt)基因,二氢叶酸还原酶(dhfr)基因等作为选择标志物。
任何制备系统都可以用于制备用于本发明的抗体。用于抗体制备的制备系统包括体外和体内制备系统。体外制备系统包括使用真核细胞的那些或使用原核细胞的那些。
当使用真核细胞时,制备系统包括使用动物细胞,植物细胞或真菌细胞的那些。此种动物细胞包括(1)哺乳动物细胞如cho,cos,骨髓瘤,幼仑鼠肾(bhk),hela和vero;(2)两栖动物细胞如非洲爪蟾卵母细胞;和(3)昆虫细胞如sf9,sf21和tn5。已知的植物细胞包括来源于烟草(nicotianatabacum)的细胞,其可以在愈伤组织中培养。已知的真菌细胞包括酵母如酵母属(saccharomyces)(例如,酿酒酵母(saccaromycescerevisiae))和霉菌真菌如曲霉菌属(aspergillus)(例如,黑曲霉(aspergillusniger))。
当使用原核细胞时,制备系统包括使用细菌细胞的那些。已知的细菌细胞包括大肠杆菌和枯草芽孢杆菌(bacillussubtilis)。
可以通过转化将目的抗体基因引入到这些细胞中然后在体外培养转化的细胞来获得抗体。细胞根据已知方法培养。例如,dmem,mem,rpmi1640或imdm可以用作培养基,并且可以组合使用血清补充物如胎牛血清(fcs)。备选地,引入有抗体基因的细胞可以被转移到动物的腹腔中以在体内制备抗体。
同时,体内制备系统包括使用动物的那些或使用植物的那些。当使用动物时,制备系统包括使用哺乳动物或昆虫的那些。
可以使用的哺乳动物包括包括山羊,猪,绵羊,小鼠和牛(vickiglaser,spectrumbiotechnologyapplications,1993)。此外,可以使用的昆虫包括蚕。当使用植物时,可以使用烟草等。
抗体基因被引入到这些动物或植物中,并且在动物或植物体内制备抗体,然后回收。例如,抗体基因可以通过将其插入到编码仅在乳汁中生产的蛋白(如山羊β酪蛋白)的基因的中部而被制备成融合基因。将含有包含插入的抗体基因的融合基因的dna片段注射到山羊胚胎中,并且将胚胎移入到母山羊中。所需的抗体获得自由受胎的山羊产下的转基因山羊或其后代产的乳汁。当适当时,可以给予转基因山羊以激素来增加其产出的含有所需抗体的奶量(ebert,k.m.等,bio/technology(1994)12,699-702)。
当使用蚕时,用插入有目的抗体基因的杆状病毒感染蚕,并且所需的抗体获得自这些蚕的体液(maeda,s.等,nature(1985)315,592-594)。此外,当使用烟草时,将目的抗体基因插入到植物表达载体如pmon530中,并将所述载体引入到细菌如根瘤农杆菌(agrobacteriumtumefaciens)中。将该细菌用于感染烟草如nicotianatabacum,然后所需的抗体获得自该烟草的叶子(julian,k.-c.ma等,eur.j.immunol.(1994)24,131-138)。
当使用如上所述的体外或体内制备系统制备抗体时,可以将编码抗体重链(h链)和轻链(l链)的dna插入到分开的表达载体中,然后用所述载体共转化宿主。备选地,编码h链的dna和编码l链的dna可以被插入到单个表达载体中用于转化宿主(参见国际专利申请公布号wo94-11523)。
本发明中使用的抗体可以是抗体片段或其修饰产物,只要其可适用于本发明即可。例如,抗体片段包括fab,f(ab’)2,fv和单链fv(scfv),其中h和l链的fv经由适当的接头连接。
具体地,抗体片段通过以下方式制备:用酶如木瓜蛋白酶或胃蛋白酶处理抗体,或备选地,构建编码这些抗体片段的基因并将其引入到表达载体中,然后在适当的宿主细胞中表达所述载体(参见,例如,co,m.s.等,j.immunol.(1994)152,2968-2976;better,m.&horwitz,a.h.,methodsinenzymology(1989)178,476-496;plueckthun,a.&skerra,a.,methodsinenzymology(1989)178,497-515;lamoyi,e.,methodsinenzymology(1989)121,652-663;rousseaux,j.等,methodsinenzymology(1989)121,663-666;以及bird,r.e.等,tibtech(1991)9,132-137)。
scfv可以通过将抗体的h-链v区和l-链v区连接而获得。在此scfv中,h-链v区和l-链v区经由接头连接,优选经由肽接头连接(huston,j.s.等,proc.natl.acad.sci.usa(1988)85,5879-5883)。scfv中h和l链的v区可以来源于任何上述抗体。用于连接v区的肽接头包括,例如,由12至19个氨基酸残基组成的任意单链肽。
编码scfv的dna可以通过以下方式获得:利用pcr使用限定编码所需氨基酸序列的dna部分的末端的引物对扩增模板序列中的所述部分,其中编码前述抗体的h链或h-链v区的dna和编码前述抗体的l链或l-链v区的dna被用作模板,然后利用编码肽接头部分的dna和限定接头两端的引物对进一步扩增扩增的dna部分,以使其可以被连接至h和l链中的每个。
在制备了编码scfv的dna后,可以根据常规方法获得包含所述dna的表达载体和转化有所述表达载体的宿主。此外,可以根据常规方法通过使用宿主获得scfv。
与以上类似,抗体片段可以通过获得其基因,将其表达,然后使用宿主来制备。本文中使用的“抗体”涵盖此种抗体片段。
与多种分子如聚乙二醇(peg)结合的抗体也可以用作修饰的抗体。本文中使用的“抗体”涵盖此种修饰的抗体。这些修饰的抗体可以通过将获得的抗体化学修饰获得。此种方法在本领域中已是确定的。
如上制备和表达的抗体可以自细胞内部或外部或自宿主分离,然后纯化至均质。用于本发明的抗体可以通过亲和色谱来分离和纯化。用于亲和色谱的柱包括蛋白a柱和蛋白g柱。用于蛋白a柱的载体包括hyperd,poros和sepharosef.f。其他用于普通蛋白的分离和/或纯化的方法可以使用而不受限制。
例如,用于本发明的抗体可以通过适当地选择和组合除上述亲和色谱以外的色谱法,过滤,超滤,盐析,透析等来分离和纯化。色谱法的实例包括离子交换色谱法,疏水性色谱法,和凝胶过滤。这些色谱法可以应用于高能液相色谱(hplc)。备选地,可以使用反相hplc。
如上获得的抗体的浓度可以通过吸光度测量,elisa等来确定。具体地,当使用吸光度测量时,浓度可以通过以下方式确定:用pbs(-)适当地稀释抗体溶液,测量其在280nm的吸光度,并且使用转换因子1.35od/1mg/ml计算浓度。备选地,当使用elisa时,浓度可以如下确定。具体地,将用0.1m碳酸氢盐缓冲液(ph9.6)稀释至1μg/ml的100μl山羊抗-人igg(tag)添加至96孔板(nunc)中并在4℃过夜孵育以固定抗体。在封闭后,添加100μl要用于本发明的适当稀释的抗体或作为标准品的包含抗体或人igg(cappel)的适当稀释的样品,并将平板在室温孵育一小时。
在洗涤后,添加100μl的5,000x稀释的碱性磷酸酶标记的抗-人igg(biosource),并将平板在室温孵育一小时。在又一次洗涤后,加入底物溶液,将平板孵育,并使用microplatereadermodel3550(bio-rad)测量在405nm的吸光度以计算目的抗体的浓度。
本发明中使用的il-6变体是这样的物质,其对il-6受体具有结合活性并且不传导il-6生物学活性。即,il-6变体与il-6竞争结合il-6受体,但是不传导il-6生物学活性,并因此阻断il-6介导的信号转导。
il-6变体通过置换在il-6的氨基酸序列中的氨基酸残基引入突变来制备。可以使用il-6变体所来源于的任何il-6,但是考虑到抗原性等,人il-6是优选的。
更具体地,氨基酸置换通过使用已知的分子建模程序如whatif(vriend等,j.mol.graphics(1990)8,52-56)由il-6氨基酸序列预测il-6的二级结构并进一步评估置换的氨基酸残基对整个分子的影响来进行。在确定了置换的适当的氨基酸残基后,通过常规进行的pcr方法使用包含编码人il-6基因的核苷酸序列的载体作为模板来引入突变从而导致氨基酸置换,并且由此获得编码il-6变体的基因。如果需要,将该基因插入到适当的表达载体中,并且可以根据前述用于表达,制备和纯化重组抗体的方法获得il-6变体。
il-6变体的具体实例公开在brakenhoff等,j.biol.chem.(1994)269,86-93;savino等,emboj.(1994)13,1357-1367;wo96-18648;和wo96-17869中。
本发明中使用的il-6或il-6受体的部分肽是这样的物质,其分别对il-6受体或il-6具有结合活性,并且不传导il-6生物学活性。即,il-6或il-6受体的部分肽结合并捕获il-6受体或il-6,并由此特异性地抑制il-6与il-6受体的结合。因此,il-6生物学活性不被传导,并且因此,il-6介导的信号转导被阻断。
il-6或il-6受体的部分肽是这样的肽,其由参与il-6和il-6受体之间的结合的il-6或il-6受体氨基酸序列的区域或其部分的整个氨基酸序列组成。此种肽通常由10至80,优选20至50,更优选20至40个氨基酸参见组成。
il-6或il-6受体的部分肽可以通过以下方式制备:指定参与il-6和il-6受体之间的结合的il-6或il-6受体氨基酸序列的区域,并将通常已知的方法如基因工程技术和肽合成方法应用于指定的区域或其部分的整个氨基酸序列。
为了通过基因工程方法制备il-6或il-6受体的部分肽,将编码所需肽的dna序列插入到表达载体中,然后可以通过应用前述用于表达,制备和纯化重组抗体的方法来获得所述肽。
为了通过肽合成方法制备il-6或il-6受体的部分肽,可以使用常用的肽合成方法如固相合成方法和液相合成方法。
具体地,所述肽可以根据“thesequelofdevelopmentofpharmaceuticals(zokuiyakuhinnokaihatsu),vol.14,peptidesynthesis(编辑haruakiyajima,1991,hirokawashoten)”中所述的方法合成。作为固相合成方法,可以采用以下方法等:使对应于要合成的肽的c末端的氨基酸结合至在有机溶剂中可溶的支持物,然后通过交替重复以下来使肽链延伸(1)缩合α-氨基和支链官能团受适当的保护基保护的氨基酸的反应,在c末端至n末端方向上,每次一个;和(2)从与树脂结合的氨基酸或肽的α-氨基除去保护基的反应。固相肽合成根据所用保护基的类型被大体分为boc法和fmoc法。
在如上合成目的肽后,进行去保护反应和从支持物上切割肽链的反应。对于切割肽链的反应,氟化氢或三氟甲磺酸通常用于boc法,而tfa通常用于fmoc法。在boc法中,例如,在茴香醚存在下将与受保护的肽结合的树脂用氟化氢处理。然后,通过除去保护基并将肽从其支持物上切割下来而回收所述肽。通过冻干回收的肽,可以获得粗肽。在fmoc法中,去保护反应和从支持物上切割肽链的反应可以在tfa等中通过与上述类似的操作来进行。
获得的粗肽可以通过应用hplc来分离和纯化。洗脱可以在最优条件下使用常用于蛋白纯化的水-乙腈溶剂系统来进行。对应于获得的色谱特征曲线的峰的级分被收集和冻干。将以此方式纯化的肽级分通过经由质谱分析,氨基酸组成分析,氨基酸序列分析等的分子量分析来鉴别。
il-6和il-6受体的部分肽的具体实例被公开在jp-a(kokai)h02-188600,jp-a(kokai)h07-324097,jp-a(kokai)h08-311098,和美国专利公布号us5210075中。
本发明中使用的抗体可以是与多种分子如聚乙二醇(peg),放射性物质和毒素结合的缀合抗体。此种缀合抗体可以通过对获得的抗体进行化学修饰获得。用于抗体修饰的方法在本领域中是已经确定的。因此,当在本文中使用时,术语“抗体”涵盖此种缀合抗体。
在本发明中,“il-6相关疾病”是指与il-6有关的疾病,并且实例包括类风湿性关节炎、青少年特发性关节炎、全身发作性青少年特发性关节炎、卡斯尔曼病、系统性红斑狼疮(sle)、狼疮肾炎、克罗恩氏病、淋巴瘤、溃疡性结肠炎、贫血、血管炎、川崎病、斯蒂尔病、淀粉样变性、多发性硬化、移植、年龄相关性黄斑变性、强直性脊柱炎、银屑病、银屑病关节炎、慢性阻塞性肺病(copd)、iga肾病、骨关节炎、哮喘、糖尿病肾病、gvhd、子宫内膜异位症、肝炎(nash)、心肌梗死、动脉硬化、脓毒症、骨质疏松症、糖尿病、多发性骨髓瘤、前列腺癌、肾癌、b-细胞非霍奇金淋巴瘤、胰腺癌、肺癌、食管癌、结肠癌、癌恶病质、癌神经侵入、心肌梗死、近视性脉络膜新血管生成、特发性脉络膜新血管生成、葡萄膜炎、慢性甲状腺炎、迟发型超敏反应、接触性皮炎、特应性皮炎、间皮瘤、多肌炎、皮肌炎、全葡萄膜炎、前葡萄膜炎、中间葡萄膜炎、巩膜炎、角膜炎、眼窝炎症、视神经炎、糖尿病视网膜病、增生性玻璃体视网膜病、干眼症、术后炎症、视神经脊髓炎、重症肌无力和肺高血压。
在本发明中,“常规给药间隔”是指通常用于上述药物(本发明的药物组合物)的给药间隔,例如,在包装内页中可被描述为“随后剂量应当以四周为间隔施用”等的常规施用的给药间隔。本发明中的常规给药间隔不受特别限制,但是实例包括一天至24周,优选两周至八周,更优选三至五周,并且甚至更优选四周。常规给药间隔可以具有一定的范围。
在本发明中,“常规剂量”是通常用于上述药物(本发明的药物组合物)的剂量,例如,在包装内页中可被描述为“通常,单剂量为8mg/kg体重”的通常施用的剂量。本发明中的常规剂量不受特别限制,但是每次施用的剂量可以为,例如,2至20mgil-6抑制剂/kg体重(2-20mg/kg)或50mg至800mgil-6抑制剂,优选2至8mgil-6抑制剂/kg体重(2-8mg/kg)或80至160mgil-6抑制剂,或更优选8mgil-6抑制剂/kg体重(8mg/kg)或120mgil-6抑制剂。
在本发明中,“短间隔给药期”是指引起针对药物(本发明的药物组合物)的免疫耐受以抑制由于免疫原性所致的抗-药物抗体产生的给药期。本发明中的短间隔给药期是指这样的给药期,其中以比常规给药间隔更短的间隔多次施用与常规剂量相同的剂量。虽然短间隔期间不受特别限制,只要其是引起免疫耐受的期间即可,该期间优选为自初始施用起1至8周,并且更优选为自初始施用起4周。“与常规剂量相同的剂量”包括这样的剂量,所述剂量提供与常规剂量相同的il-6抑制剂血液浓度。“比常规给药间隔更短的间隔”不受特别限制,只要其短于常规给药间隔即可,并且优选为常规给药间隔的一半,例如,两周(当常规给药间隔为四周时)。例如,短间隔给药期可以具有一定的范围如一至两周。“(被)多次施用”是指包括初始施用在内的两次以上施用,并且优选为包括初始施用在内的2至5次施用,更优选包括初始施用在内的3次施用。是否引起免疫耐受可以通过观察抗-药物抗体产生是否被抑制来确定。
本发明中的“常规施用”是指常用于上述药物(本发明的药物组合物)的施用,例如,按上述“常规剂量”和“常规给药间隔”施用。
本发明的“il-6受体抗体”的优选实例包括作为人源化抗-il-6受体igg1抗体的托珠单抗,和通过修饰托珠单抗的可变区和恒定区制备的人源化抗-il-6受体抗体,具体地,含有包含seqidno:1的序列的重链可变区和包含seqidno:2的序列的轻链可变区的抗体。更优选的实例是这样的抗体,所述抗体含有包含seqidno:3的序列的重链(sa237的重链)和包含seqidno:4的序列的轻链(sa237的轻链)。sa237是尤其优选的。
此种抗体可以根据wo2010/035769,wo2010/107108,wo2010/106812等中所述的方法获得。具体地,抗体可以使用本领域技术人员已知的遗传重组技术,基于上述il-6受体抗体的序列制备(参见,例如,borrebaeckcak和larrickjw,therapeuticmonoclonalantibodies,在英国由macmillanpublishersltd出版,1990)。重组抗体可以通过以下方式获得:由产生杂交瘤或抗体的细胞如产生抗体的敏化的淋巴细胞克隆编码抗体的dna,将所述dna插入到适当的载体中,并将所述载体引入到宿主(宿主细胞)中以制备抗体。
此种抗体可以使用常规用于抗体纯化的分离和纯化方法来分离和纯化而不受限制。例如,所述抗体可以通过适当地选择和组合柱色谱,过滤,超滤,盐析,溶剂沉淀,溶剂萃取,蒸馏,免疫沉淀,sds-聚丙烯酰胺凝胶电泳,等电聚焦,透析,再结晶等来分离和纯化。
在本发明中,常规给药期始自短间隔给药期的最后一次给药。更具体地,短间隔给药期中的最后一次给药之后是常规给药间隔,然后进行常规给药期中的第一次给药。
本发明的药物组合物优选是这样的药物组合物,其中自短间隔给药期中的初次给药起以1至3周的间隔将与常规剂量相同的剂量的il-6抑制剂施用2至5次,然后自短间隔给药期中的最后一次给药开始以2至8周的间隔施用il-6抑制剂,使用50mg至800mg/施用的常规剂量;或更优选这样的药物组合物,其中自短间隔给药期中的初次给药起以2周的间隔(即,在第0周,第2周和第4周)以与常规剂量相同的剂量将sa237施用3次,然后自短间隔给药期中的最后一次给药开始(即,在第12周,第20周,第28周,以此类推,以8周为间隔,自短间隔给药期中的初次给药起计数)以8周的间隔常规施用sa237,使用120mg/施用的常规剂量。
可以调整对于il-6抑制剂的优选的给药时间安排,例如,通过监测疾病状况和血液测试值的变化适当地延长给药间隔。
用于治疗或预防目的的本发明的药物组合物可以被配制成在需要时通过与合适的药用载体,赋形剂等混合来制备冻干制剂或溶液制剂。合适的药用载体和赋形剂包括,例如,无菌水,生理盐水,稳定剂,赋形剂,抗氧化剂(如抗坏血酸),缓冲剂(如磷酸盐,柠檬酸盐,组氨酸及其他有机酸),杀菌剂,表面活性剂(如peg和tween),螯合剂(如edta)和粘合剂。也可以含有其他低分子量多肽,蛋白如血清白蛋白,明胶和免疫球蛋白,氨基酸如甘氨酸,谷氨酰胺,天冬酰胺,谷氨酸,天冬氨酸,甲硫氨酸,精氨酸和赖氨酸,糖和碳水化合物如多糖和单糖,以及糖醇如甘露醇和山梨醇。当制备注射用水溶液时,可以使用包含葡萄糖和其他辅剂如d-山梨醇,d-甘露糖,d-甘露醇和氯化钠的生理盐水和等渗溶液;并且适当的增溶剂如醇(例如,乙醇),多元醇(如丙二醇和peg),和非离子表面活性剂(如聚山梨醇酯80,聚山梨醇酯20,泊洛沙姆188和hco-50)可以被组合使用。通过将透明质酸酶混合到制剂中,可以皮下施用更大的液体体积(expertopin.drugdeliv.2007jul;4(4):427-40)。此外,注射器可以预装有本发明的药物组合物。溶液制剂可以根据wo2011/090088中所述的方法制备。
如果需要,本发明的药物组合物可以被包封在微胶囊(例如,由羟甲基纤维素,明胶和聚(甲基丙烯酸甲酯)制成的那些)中,或被结合到胶体药物递送系统(例如,脂质体,白蛋白微球,微乳,纳米粒和纳米胶囊)中(参见,例如,“remington'spharmaceuticalscience16thedition(remington药物科学第16版)”,osloed.(1980))。用于将药剂制备成控释药剂的方法也是已知的,并且此种方法可以应用于本发明的药物组合物(langer等,j.biomed.mater.res.15:267-277(1981);langer,chemtech.12:98-105(1982);u.s.专利no.3,773,919;欧洲专利申请公布号ep58,481;sidman等,biopolymers22:547-556(1983);和ep133,988)。
本发明的药物组合物可以经由任何适当的途径施用于患者。例如,其可以以静脉内(通过推注或连续输注),肌肉内,腹膜内,脑脊内,透皮,皮下,关节内,舌下,滑膜内,口服,吸入,局部或外部连续输注方式施用于患者达特定时间长度。静脉内施用或皮下施用是优选的。
本文中引用的所有现有技术文献都通过引用结合的本说明书中。
实施例
下文中,将关于实施例来具体描述本发明,但是本发明不被视为限于所述实施例。
[实施例1]制备il-6抑制剂
专利文献wo2010/035769中描述的il-6受体抗体sa237(wo2010/035769中的含有具有wo2010/035769的seqidno:26(本文中的seqidno:3)的序列的重链和具有wo2010/035769的seqidno:29(本文中的seqidno:4)的序列的轻链的抗体)根据上述专利文献中的描述制备。通过专利文献wo2011/090088中的方法将制备的抗体用于制备用于皮下施用的制剂。
[实施例2]通过向健康的成年男性日本人和高加索人受试者(sa001jp)的单次皮下施用进行检测
评估在向健康的成年男性日本人和高加索人受试者皮下施用时,sa237的安全性,耐受性,药代动力学和生物利用度。在该研究中,通过滴注向48名日本个体皮下或静脉内施用sa237,并且向24名高加索个体皮下施用sa237。sa237的单次施用的安全性和耐受性在24例中几乎都是令人满意的。60mg和120mg皮下施用的sa237的绝对生物利用度分别为64.6%和69.4%。在施用了sa237的72名受试者中的39名受试者中观察到发展出抗-sa237抗体。
[实施例3]通过向日本类风湿性关节炎患者(sa-105jp)的多次皮下施用的开放标签,平行组比较研究
选择满足以下标准的患者作为受试者:
(1)根据1987美国风湿病学学院(americancollegeofrheumatology,acr)标准被诊断为患有类风湿性关节炎(ra);
(2)6个月以上的ra疾病持续时间;
(3)在开始施用研究药用产品(imp)前两周内进行的测试中显示高于实验室参比范围的上限的c反应蛋白(crp)水平;
(4)知情同意时年龄为20岁以上;
(5)本人在知情同意表上签名;
(6)在开始施用imp前16周或之后未接受甲氨蝶呤(mtx)治疗;
(7)在开始施用imp前12周或之后(或者如果已经进行了标准考来烯胺(cholestyramine)治疗或利用活性炭的药物去除,则在开始施用研究药剂前4周或之后)未接受来氟米特(leflunomide)治疗;
(8)在开始施用研究药剂前4周或之后未接受利用dmard或除上述以外的免疫抑制剂的治疗;并且
(9)在开始施用研究药剂前2周或之后未接受超过10mg/天的泼尼松龙(prednisolone)当量的治疗。
根据集中登记法将受试者随机分成三组(a、b、c组),并且进行开放标签、平行组比较研究(参见表1)。随机化通过体重分级。该临床研究包括主要评估期、延长期和随访期。
在主要评估期中,在第0周,第2周和第4周施用120mg的sa237;并且从第8周至第16周以四周为间隔,向a、b、c组分别施用120mg,60mg和30mg的sa237。之后,基本上,分别观察a、b、c组至第32周,第28周和第24周,预期在所述时间各组中的血清sa237浓度为不可检测的水平(观察包括抗-sa237抗体测量)。
在延长期中,在第0周,第2周和第4周施用120mg的sa237;并且从第8周至第20周以四周为间隔施用120mg的sa237,并继续观察至第32周。
试验药物的形式为装有1.0ml溶液的小瓶,所述溶液含120mg的sa237。所述溶液含有l-组氨酸,l-精氨酸,l-天冬氨酸和聚氧乙烯(160)聚氧丙烯(30)二醇作为添加剂,并被调节至ph5.5至6.5。基本上,所述药物被皮下施用至腹部区域。
[表1]
病例数
在药物动力学和药效学评估中,并且在重复施用sa237至ra患者的效力(在完整分析设定(fas)中)和安全性的检查中,进行每种分析的各个11个病例的组(总计33例)中的受试者的背景是:年龄为59.0至65.0岁(各组的中值范围;下文同样适用)并且体重为50.30至57.90kg。各组中女性的百分比是高的,并且在a组中为81.8%(9/11例),在b组中为90.9%(10/11例),并且在c组中为63.6%(7/11例)。接受研究药剂直至主要评估期结束的受试者在a组中为10/11例(90.9%),在b组中为10/11例(90.9%),并且在c组中为9/11例(81.8%);并且整个期间(主要评估期和延长期)都可以被观察的受试者在a组中为10/11例(90.9%),在b组中为7/11例(63.6%),并且在c组中为7/11例(63.6%)。
(1)药代动力学
评估方法:根据表2和3进行观察和测试。当没有特别指明时,评估在施用研究药剂前进行。即使限定的主要评估期没有达到完成,当在延长期的初始施用的当天或之后进行评估时,随后的对主要评估期的观察和测试被确定是不必要的。测试期被如下限定。
主要评估期:原则上,对于a、b、c组,观察和测试期始自研究药剂施用的第一天,并且分别至第32周,第28周和第24周,预期在所述时间血清sa237浓度被消除。然而,当血清sa237浓度被确认为不可检测的水平并且延长期中的施用在上述期间结束前开始时,主要评估期将被设定为延长期中的首次施用前直至观察和测试的期间。
延长期:在完成主要评估期后,始自延长期中的首次施用,并且直至延长期的第24周的观察和测试。
后观察期:从延长期的第24周的观察和测试完成开始并且直至第32周。
[表2]
观察和检查时间安排(主要评估期)
[表3]
观察和检查时间安排(延长期和随访期)
结果:指示该研究中的药代动力学的图表显示在图1中。在a组的主要评估期中并且在延长期中,从第4周起,血清sa237浓度的波谷水平大致不变。另一方面,在主要评估期期间,从第8周起,b组和c组中的血清sa237浓度下降。因为主要评估期和延长期未显示血清sa237浓度和auc0-2w(至第8周)的显著差异,所以当中断sa237施用并且在之后继续时,药代动力学不改变。
(2)药效学评估
结果:来自该研究中的药效学评估的图表显示在图2和3中。在a组中,在主要评估期期间从第8周至第20周,并且在延长期期间从第8周至第24周,其中血清sa237浓度保持在恒定水平,并且血清sil-6r浓度也被保持在大致恒定的水平。另一方面,在b和c组中,在主要评估期期间,从第8周起,作为il-6抑制的pd标志物的sil-6r血清浓度随sa237浓度下降而下降。
在主要评估期期间,从第4周至第20周,在a组中的将近一半的受试者中,作为il-6抑制的pd标志物的crp低于量化的下限(0.005mg/dl),并且平均值也保持较低,约为0.01mg/dl。所述值从第16周起(在b组中)以及从第8周起(在c组中)增加至0.1mg/dl以上。crp标准化(0.3mg/dl以下)的百分比也显示与平均值的变化类似的趋势。各组在第4周的百分比为81.8%至90.9%;并且之后,当将第20周的百分比与第8周的百分比相比时,a组未显示自100%变化,b组显示从81.8%至80.0%的变化并且是大致相同的,并且c组显示从90.9%下降至33.3%。在大多数受试者和时间点中,只要血清sa237浓度是可量化的(0.2μg/ml),则认为crp自基线下降。
(3)效力
评估方法:das28(改进的基于28个关节计数的疾病活跃度评分)是评估类风湿性关节炎活跃度的指示,其使用28个关节中的触痛关节计数(tjc)和肿胀关节计数(sjc),esr以及“患者全面评估(patientglobalassessment)”由以下等式计算。检查从开始施用直至观察的最后一天das28的变化。计算各组和各期的概要统计数字(平均值,标准差,中值,最小值和最大值)。此外,计算临床缓解率。
针对das28进行检查的28个关节
acr20%、50%、70%改善标准(acr20、acr50、acr70)评估如下。
acr改善标准
结果:主要评估期中das28评分的时程(其指示该检查中的效力)显示在下表4中。
[表4]
das28显示第8周的改善。在主要评估期中在开始施用不同剂量(在第8周)后,a显示das28的进一步改善,b组未显示明显变化,而c组显示回到基线评分的趋势。
在第8周,在每组中,根据acr标准的20%改善的频率为70.0%至81.8%,50%改善的频率为40.0%至50.0%,并且70%改善的频率为18.2%至30.0%。与第8周相比,在第20周,20%改善频率在a和b组中被保持,但在c组中降低。与第8周的值相比,在第20周,在a组中,50%和70%改善频率分别增至72.7%(8/11例)和54.5%(6/11例);然而,b和c组中没有观察到明显变化。
(4)抗体阳性例中的免疫原性和药代动力学,药效学评估,效力和安全性
在b组和c组的各一个单个病例(即,总计33例中的2例)中检测抗-sa237抗体。在这两例中,在检测出抗-sa237抗体后在延长期期间血清sa237浓度低于量化的下限,并且从检出所述抗体时起,由于sa237施用所致的可溶性il-6受体(sil-6r)浓度的增加和crp浓度的下降没有被观察到,并且das28、cdai和sdai增加。在检出所述抗体后,在这两例中的一例中观察到不良事件,即轻度糖尿病。该不良事件并非变态反应,而是并发症的恶化。在检出所述抗体后在将sa237重复施用于这两名患者中没有观察到安全性问题。
(5)结论
当以2周的间隔三次将120mg的sa237施用于ra患者,并且之后从第8周起以4周的间隔进行三次120mg施用时,从第4周至最后一次施用后四周保持稳定的血清药物浓度。这导致高血清sil-6r浓度和低crp,以及包括das28在内的所有效力评估项目的稳定改善。整个临床研究的抗-sa237抗体的发生率为6.1%(2/33例),并且在检出抗-sa237抗体时,发现在检出抗-sa237抗体后血清sa237浓度下降,但是没有观察到安全性问题并且免疫原性被认为是可接受的。因此,该施用方案中不存在安全性的担忧。
工业实用性
本发明的药物组合物或方案可以解决抗-药物抗体产生的免疫原性问题,减小副作用,并且提供在使患者负担情况更小的情况下呈现更高疗效的药物组合物,因为其不使患者暴露于高剂量。
序列表
<110>中外制药株式会社
<120>用于治疗il-6相关疾病的组合物
<130>c1-a1503p
<141>2016-02-26
<150>jp2015-037933
<151>2015-02-27
<160>4
<170>siposequencelisting1.0
<210>1
<211>119
<212>prt
<213>artificialsequence
<220>
<221>peptide
<222>(1)..(119)
<223>人工合成的多肽序列
<400>1
glnvalglnleuglngluserglyproglyleuvallysproserglu
151015
thrleuserleuthrcysalavalserglyhisserileserhisasp
202530
hisalatrpsertrpvalargglnproproglygluglyleuglutrp
354045
ileglypheilesertyrserglyilethrasntyrasnproserleu
505560
glnglyargvalthrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargserleualaargthrthralametasptyrtrpglyglugly
100105110
thrleuvalthrvalserser
115
<210>2
<211>107
<212>prt
<213>artificialsequence
<220>
<221>peptide
<222>(1)..(107)
<223>人工合成的多肽序列
<400>2
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspservalthrilethrcysglnalaserthraspileserserhis
202530
leuasntrptyrglnglnlysproglylysalaprogluleuleuile
354045
tyrtyrglyserhisleuleuserglyvalproserargphesergly
505560
serglyserglythraspphethrphethrileserserleugluala
65707580
gluaspalaalathrtyrtyrcysglyglnglyasnargleuprotyr
859095
thrpheglyglnglythrlysvalgluileglu
100105
<210>3
<211>443
<212>prt
<213>artificialsequence
<220>
<221>peptide
<222>(1)..(443)
<223>人工合成的多肽序列
<400>3
glnvalglnleuglngluserglyproglyleuvallysproserglu
151015
thrleuserleuthrcysalavalserglyhisserileserhisasp
202530
hisalatrpsertrpvalargglnproproglygluglyleuglutrp
354045
ileglypheilesertyrserglyilethrasntyrasnproserleu
505560
glnglyargvalthrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargserleualaargthrthralametasptyrtrpglyglugly
100105110
thrleuvalthrvalserseralaserthrlysglyproservalphe
115120125
proleualaproserserlysserthrserglyglythralaalaleu
130135140
glycysleuvallysasptyrpheprogluprovalthrvalsertrp
145150155160
asnserglyalaleuthrserglyvalhisthrpheproalavalleu
165170175
glnserserglyleutyrserleuserservalvalthrvalproser
180185190
serasnpheglythrglnthrtyrthrcysasnvalasphislyspro
195200205
serasnthrlysvalasplysthrvalgluarglyssercysvalglu
210215220
cysproprocysproalaproprovalalaglyproservalpheleu
225230235240
pheproprolysprolysaspthrleumetileserargthrproglu
245250255
valthrcysvalvalvalaspvalserglngluaspprogluvalgln
260265270
pheasntrptyrvalaspglyvalgluvalhisasnalalysthrlys
275280285
proargglugluglnpheasnserthrpheargvalvalservalleu
290295300
thrvalvalhisglnasptrpleuasnglylysglutyrlyscyslys
305310315320
valserasnlysglyleuproalaproileglulysthrileserlys
325330335
thrlysglyglnproarggluproglnvaltyrthrleuproproser
340345350
glngluglumetthrlysasnglnvalserleuthrcysleuvallys
355360365
glyphetyrproseraspilealavalglutrpgluserasnglygln
370375380
progluasnasntyrlysthrthrproprometleuaspseraspgly
385390395400
serphepheleutyrserlysleuthrvalasplysserargtrpgln
405410415
gluglyasnvalphesercysservalmethisglualaleuhisala
420425430
histyrthrglnlysserleuserleuserpro
435440
<210>4
<211>214
<212>prt
<213>artificialsequence
<220>
<221>peptide
<222>(1)..(214)
<223>人工合成的多肽序列
<400>4
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspservalthrilethrcysglnalaserthraspileserserhis
202530
leuasntrptyrglnglnlysproglylysalaprogluleuleuile
354045
tyrtyrglyserhisleuleuserglyvalproserargphesergly
505560
serglyserglythraspphethrphethrileserserleugluala
65707580
gluaspalaalathrtyrtyrcysglyglnglyasnargleuprotyr
859095
thrpheglyglnglythrlysvalgluilegluargthrvalalaala
100105110
proservalpheilepheproproseraspgluglnleulyssergly
115120125
thralaservalvalcysleuleuasnasnphetyrproarggluala
130135140
lysvalglntrplysvalaspasnalaleuglnserglyasnsergln
145150155160
gluservalthrgluglnaspserlysaspserthrtyrserleuser
165170175
serthrleuthrleuserlysalaasptyrglulyshislysvaltyr
180185190
alacysgluvalthrhisglnglyleuserserprovalthrlysser
195200205
pheasnargglyglucys
210
- 还没有人留言评论。精彩留言会获得点赞!