用于调节mTORC1的组合物和方法与流程
本申请要求于2014年12月22日提交的美国临时申请No.62/095,512和于2014年5月2日提交的美国临时申请No.61/987,769的权益,其全部教导内容以引用的方式并入本文中。
政府支持
本发明是在在政府支持下由国家卫生研究院授予的R01CA129105、R01CA103866和R01AI047389来完成。政府对本发明具有一定的权利。
发明背景
本发明涉及鉴别通过调节SLC38A9(NCBI基因ID:153129)的活性来调节细胞中的mTORC1活性的化合物的方法,以及所述鉴别的化合物在调节mTORC1和治疗特征在于mTORC1活性异常的疾病和病状中的用途。
雷帕霉素(rapamycin)的哺乳动物(机械)靶(mTOR)是响应营养素、生长因子和应激因子的细胞、器官和生物体生长的主要调控剂。mTOR是丝氨酸/苏氨酸激酶,并且使至少两种不同的复合物mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)成核。mTORC1活性部分由氨基酸调控。当活化时,mTORC1可通过促进合成代谢过程(例如mRNA转译)和通过其下游底物的作用抑制分解代谢过程(例如自噬)来刺激细胞生长。然而,在广泛范围的疾病中观察到异常mTORC1激活,所述疾病包括多种类型的癌症、代谢功能障碍(例如2型糖尿病、肥胖症)、自身免疫疾病(例如牛皮癣)和神经变性疾病(例如阿尔茨海默病和帕金森病)、神经精神综合症(例如自闭症和重度抑郁症)、骨骼肌功能障碍(例如少肌症、疾病诱导的恶病质和失用性萎缩)以及几种罕见疾病(包括由遗传性和获得性线粒体功能障碍(例如利氏综合征(Leigh Syndrome))和某些遗传生长缺陷引起的疾病)。
氨基酸调控mTORC1信号传导的机制是复杂的,并且以溶酶体为中心。在氨基酸饱和条件下,氨基酸穿过质膜并在溶酶体的内腔中积累。此外,溶酶体内腔中蛋白质通过溶酶体蛋白酶和肽酶的降解也可以促进溶酶体内氨基酸的积累并导致mTORC1活化。mTORC1被募集到溶酶体膜,在所述溶酶体膜中mTORC1与Rag GTP酶(RagA或RagB与RagC或RagD的专性异源二聚体)相互作用。Rag GTP酶异源二聚体不含将复合物束缚于溶酶体的脂质锚定物。相反,其依赖于五聚体Ragulator复合物,其通过Ragulator组分LAMTOR1(p18)的脂化连接至溶酶体膜用于溶酶体定位。此外,与LAMTOR1组装的Ragulator组分LAMTOR2-5(分别为p14、MP1、C7orf59和HBXIP)用作RagA和RagB的鸟嘌呤核苷酸交换因子,促进其装载GTP。因此,Ragulator不仅需要将Rag GTP酶异源二聚体定位于溶酶体表面,而且还用于催化RagA/B的活化的核苷酸结合状态。已经鉴别了响应氨基酸可用性的另外的蛋白质复合物,其调控Ragulator和Rag复合物的活性,但是尚未阐明通过mTORC1路径物理传感个别氨基酸的精确机制。
鉴于亮氨酸和精氨酸在活化mTORC1中的已知作用,我们假设存在能够在溶酶体处特异性传感亮氨酸或精氨酸的蛋白质,并且响应活化mTORC1上游的溶酶体机构。我们设法通过蛋白质组学和生物化学方法来鉴别这些蛋白质。
鉴于mTORC1调节在合成代谢过程和某些疾病状态中的重要性,需要鉴别mTORC1活化途径的其它成员作为调节的潜在靶标,其继而可调节mTORC1活性。
发明概要
本发明通过鉴别SLC38A9的蛋白质同种型作为mTORC1调控路径的重要组分并且作为此路径中的推定氨基酸传感器来解决此问题,其可以药理学方式经操纵,导致mTORC1活化的选择性调节。
在某些实施方案中,本文公开了鉴别mTORC1活性调节剂的方法,所述方法包括以下步骤:(a)使测试化合物与SLC38A9.1或其具有SLC38A9.1活性或特性的片段或突变体接触;(b)测量在测试化合物存在下的SLC38A9.1活性或特性;和(c)将测量的活性或特性与在不存在测试化合物下相同的活性或特性进行比较,由此确定测试化合物是否是SLC38A9的调节剂。
在某些方面,测试化合物与SEQ ID NO:1的氨基酸1-119、SLC38A9.1或SLC38A9Δ110接触,或与包含SEQ ID NO:1的氨基酸1-119、SLC38A9.1或SLC38A9Δ110以及异源融合配偶体的融合蛋白接触。在某些实施方案中,异源融合配偶体选自N-末端His标签、N-末端多聚-His标签、表位标签、配体标签、N-或C-末端质膜信号序列、荧光多肽或发光多肽。
在某些实施方案中,SLC38A9.1活性或特性是跨膜转移氨基酸的能力。在某些实施方案中,SLC38A9.1活性或特性是与Ragulator或RagGTP酶中的一种或多种的组分结合的能力。
本文还公开了用于调节细胞中的mTORC1水平或活性的方法,其包括使细胞与调节SLC38A9水平或活性的试剂或组合物接触。在某些方面,调节细胞中的mTORC1水平或活性包括增加细胞中的mTORC1水平或活性。在某些实施方案中,调节细胞中的mTORC1水平或活性包括降低细胞中的mTORC1水平或活性。
在某些实施方案中,本文还公开了用于增加需要mTORC1活性增加的患者中的mTORC1活性的方法,所述方法包括向患者施用活化或激活SLC38A9的试剂的步骤,由此增加患者中的mTORC1活性。
在其它实施方案中,公开了用于降低需要mTORC1活性降低的患者中的mTORC1活性的方法,其包括向患者施用抑制SLC38A9的试剂的步骤,从而降低患者的mTORC1活性。
本文还公开了用于治疗将从增加患者中mTORC1的水平或活化中受益的疾病、病状或病症的方法,所述方法包括向受试者施用有效量的活化或激活SLC38A9的试剂,并由此治疗所述疾病、病状或病症。
在某些方面,本文公开了用于治疗将从降低患者中mTORC1的水平或活化中受益的疾病、病状或病症的方法,所述方法包括向受试者施用有效量的抑制SLC38A9活性的试剂,并由此治疗所述疾病、病状或病症。
通过参考本发明的以下详细说明将更好地理解上文讨论的以及本发明的许多其它特征和伴随的优点。
附图简述
专利或申请案文件含有至少一张彩色图。具有彩色图的本专利或专利申请公开案的副本将由办公室根据请求并支付必要的费用提供。
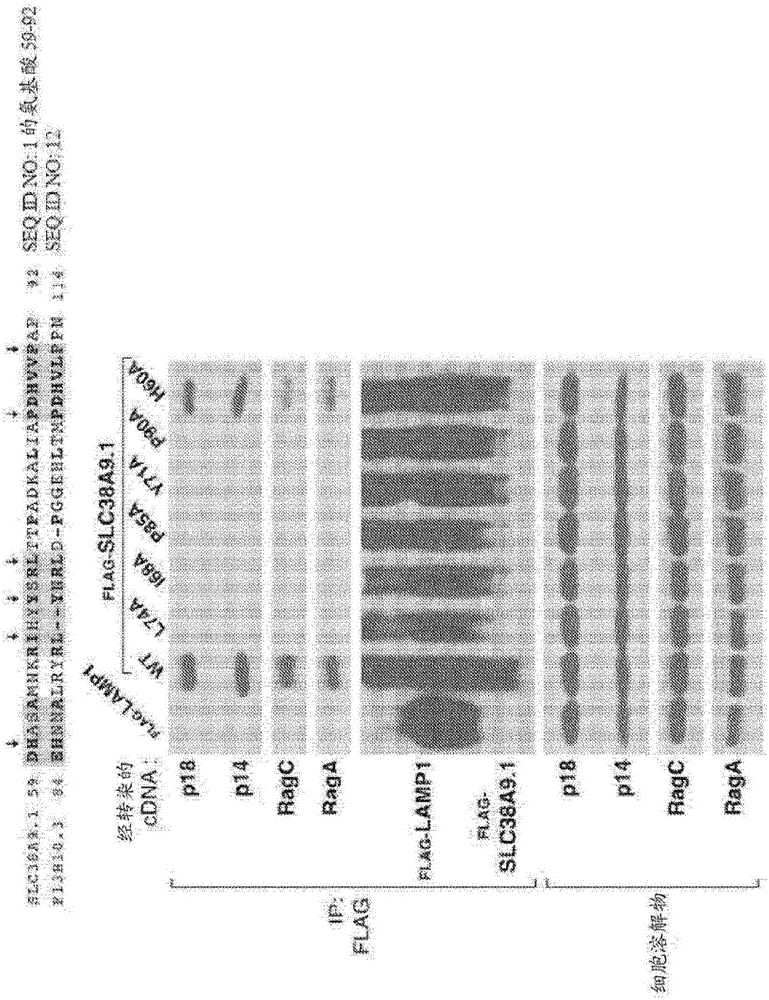
图1A-1C描述了来自用各种FLAG标记的蛋白质转染的HEK-293T细胞的细胞裂解物的免疫印迹分析。在表达载体中用指示的cDNA转染HEK-293T细胞,并制备裂解物。将一部分裂解物进行FLAG免疫沉淀。细胞裂解物和来自细胞裂解物的FLAG-免疫沉淀蛋白质二者都针对指示蛋白质进行免疫印迹分析。图1A描述了全长SLC38A9.1或其N-末端结构域与内源性Ragulator组分(p18和p14)以及RagA和RagC GTP酶的相互作用。图1B描述了与Ragulator和Rag GTP酶相互作用所需的SLC38A9.1的N-末端结构域的部分与来自秀丽隐杆线虫(C.elegans)的SLC38A9.1同源物F13H10.3的比对、以及这种相互作用所需的关键氨基酸残基(下箭头)、以及SLC38A9.1或SLC38A9.1的各种N-末端突变体与内源性Ragulator(p18和p14)以及RagA和RagC GTP酶的相互作用。图1C描述了SLC38A9.1与v-ATP酶组分V0d1和V1B2的相互作用。
图2A-2B描述了氨基酸对SLC38A9.1和溶酶体膜蛋白LAMP-2的定位的效应,以及氨基酸对mTORC1和SLC38A9产生的效应。图2A描述了展现氨基酸对稳定表达FLAG-SLC38A9.1的HEK-293T细胞中的SLC38A9.1和溶酶体膜蛋白LAMP-2的定位的效应的免疫染色。图2B描述了描述氨基酸对表达指示的短发夹RNA的HEK-293T细胞中的mTORC1和SLC38A9产生的效应的免疫印迹分析。
图3A-3D描述了展现氨基酸对经编码指示的FLAG标记蛋白的慢病毒转导的HEK-293T细胞中的各种mTORC1组分的效应的免疫印迹分析。图3A描述了在表达metap2(作为对照)或SLC38A9.1的细胞中的所有氨基酸以及亮氨酸和精氨酸的效应。图3B描述了在表达metap2、溶酶体标记蛋白LAMP1、SLC38A9.1或SLC38A9.2的细胞中氨基酸的效应。图3C描述了在表达metap2、LAMP1、SLC38A9.1或SLC38A9.1I68A的细胞中氨基酸的效应。图3D描述了在表达metap2或SLC38A9.1 1-119的细胞中的氨基酸的效应。
图4A-4B描述了展现氨基酸对稳定表达指示的FLAG标记蛋白的HEK-293T细胞中的SLC38A9.1与Ragulator和Rag GTP酶之间的相互作用的效应的免疫印迹分析。图4A描述了在表达Ragulator组分p14或p18的细胞中的氨基酸以及亮氨酸和精氨酸的效应。图4B描述了在表达metap2、SLC38A9同种型SLC38A9.1、SLC38A9.4、SLC38A9.11-119或SLC38A9.2的细胞中的氨基酸的效应。图4C描述了展现RagB和RagC中的各种突变对其与具有指示的Rag B和/或RagC突变的经转染的HEK-293T细胞中内源性SLC38A9和Ragulator组分的相关的效应的免疫印迹分析。
图5A-5E描述了实验精氨酸和相关免疫印迹分析的结果,其描述了mTORC1路径的诱导活化的损害。图5A描述了含有SCL38A9.1的蛋白磷脂体对[3H]-精氨酸的时间依赖性摄取。图5B(左图)描述了给定固定的[3H]精氨酸(0.5μM)和增加浓度的未标记的精氨酸的[3H]精氨酸摄取的时程。图5B(右图)描述了从左图计算的作为总精氨酸浓度的函数的速率。将数据拟合到Michaelis-Menton方程。图5C描述了在用0.5μM[3H]精氨酸装载1.5小时后SLC38A9.1蛋白磷脂体的时间依赖性流出。图5D描述了使用100mM指示的未标记的氨基酸通过SLC38A9.1转运0.5μM[3H]精氨酸的竞争。图5A-5D中的误差条表示从至少3次测量得到的标准偏差。图5E是描述SLC38A9无效HEK-293T细胞和阴性对照细胞(sgAAVS1_1)中亮氨酸或精氨酸诱导的mTORC1路径的活化受损的一系列免疫印迹分析。使细胞对指示的氨基酸饥饿50分钟,并使用指示的氨基酸浓度刺激10分钟。RPMI中的亮氨酸和精氨酸浓度分别为381μM和1.14mM。
图6A-6C描述了展现Ragulator和Rag GTP酶特异性结合于表达各种FLAG标记蛋白的HEK-293T细胞中SLC38A9.1的N-末端结构域的免疫印迹分析。图6A描述了与metap2、LAMP1、SLC38A9.1、SLC38A7(来自与SLC38A9相同家族的已知溶酶体转运蛋白)和SLC36A1(被认为参与mTORC1调控的已知溶酶体膜蛋白)的相互作用。图6B描述了与LAMP1、SLC38A9.1和SLC38A9.2的相互作用。图6C描述了与metap2、LAMP1、SLC38A9.1、SLC38A9.1Δ110、SLC38A9.4和SLC38A9.1 1-119的相互作用。
图7A-7D描述了所实施免疫染色和免疫印迹分析实验的结果。图7A和7B描述了展现SLC38A9.2和SLC38A9.4以及LAMP在稳定表达那些SLC38A9同种型的FLAG标记型式的HEK-293T细胞中的定位的免疫染色。图7C描述了展现SLC38A9的各种同种型与Ragulator组分的各种突变体在表达指示的同种型和突变体的HEK-293T细胞中的相互作用的免疫印迹分析。图7D描述了展现在具有短干扰RNA的SLC38A9敲低的HEK-293T细胞中氨基酸对mTORC1的效应(如通过mTORC1底物S6K1的磷酸化所分析)的免疫印迹分析。
图8A-8C描述了展现SLC38A9.1、SLC38A9.4和/或SLC38A9.1Δ110的表达的效应的免疫印迹分析。图8A描述了展现SLC38A9.1、SLC38A9.4或SLC38A9.1Δ110的瞬时过表达对HEK-293T细胞中mTORC1对于氨基酸的敏感性的效应的免疫印迹分析。图8B描述了展现SLC38A9.1在各种细胞中稳定过表达对mTORC1对于氨基酸的敏感性的效应的免疫印迹分析。图8C描述了展现SLC38A9.1稳定过表达对精氨酸饥饿和氯喹诱导的自噬的效应的免疫印迹分析,如通过自噬p62和LC3水平的标记物所测量。
图9描述了展现氨基酸对SLC38A9与Rag和Ragulator组分的内源性缔合的效应的免疫印迹分析。
图10A-10F描述了(例如)在HEK-293T细胞中实施的研究的结果。图10A描述了在导致向质膜溢出的水平下瞬时过表达SLC38A9.1的HEK-293T细胞的免疫染色。图10B-10D描述了HEK-293T细胞中各种蛋白质瞬时表达对标记的氨基酸摄取的效应(图10B-[14C]精氨酸;图10C-[14C]氨基酸混合物);图10D-[14C]亮氨酸)。图10E(左图)描述了在-80mV下来自表达指示的cDNA的HEK-293T细胞的全细胞记录。定量是在局部施用2.4mM精氨酸、1.6mM亮氨酸和4mM谷氨酰胺(4x DMEM浓度)后稳态电流的变化。图10E(右图)描述了各个记录的代表性实例。灰色条指示氨基酸的施用。图10F描述了在与0.5μM[3H]精氨酸一起培育60分钟,随后在捕获游离氨基酸的柱上进行色谱法之后,SLC38A9.1蛋白磷脂体或LAMP1蛋白磷脂体对[3H]-精氨酸的摄取。蛋白磷脂体通过柱并进行FLAG免疫印迹分析(上图)和闪烁计数(下图)。
图11描述了给定固定的[3H]精氨酸(0.5μM)在存在或不存在100mM未标记的精氨酸下由SLC38A9.1(“38A9”)脂质体或SLC38A9.1Δ110(“38A9δ110”)脂质体[3H]精氨酸摄取的时程。
具体实施方式
如本文所用,“调节(modulating)”(及其动词形式,例如“调节(modulates)”)意指引起或促进所关注分子、过程、路径或现象的定性或定量变化、改变或修饰。非限制性地,这种变化可以是过程、路径或现象的不同组分或分支的增加、减少、结合特征的变化或相对强度或活性的变化。
如本文所用的术语“抑制剂”(及其动词形式,例如“抑制”)意指如下试剂:(a)减少通常与被抑制的蛋白质相关的一种或多种活性;(b)降低或以其它方式干扰被抑制的蛋白质与另一种蛋白质或配体或核酸缔合(例如结合)的能力;和/或(c)降低自编码被抑制的蛋白质的基因的转录或表达。
如本文所用的术语“活化剂”和“激活剂”(及其动词形式,例如“活化”和“激活”)意指如下试剂:(a)增加通常与被活化的蛋白质相关的一种或多种活性;(b)增加或以其它方式增强被活化的蛋白质与另一种蛋白质或配体或核酸缔合(例如结合)的能力;和/或(c)增加自编码被活化的蛋白质的基因的转录或表达。在某些实施方案中,利用本文所述的任何活化、激活或抑制性体系、方法或试剂的调节、抑制、活化和/或激活可以在体外或离体实施,例如通过将细胞接触或暴露于活化、激活或抑制性体系、方法或试剂。在某些实施方案中,利用本文所述的任何活化、激活或抑制性体系、方法或试剂的调节、抑制、活化和/或激活可以在体内实施。
术语“SLC38A9”、“全长SLC38A9”、“SLC38A9同种型1”和“SLC38A9.1”可互换使用,并且都指SEQ ID NO:1中所述的完全氨基酸序列。
术语“SLC38A9.2”和“SLC38A9同种型2”可互换使用,并且是指SEQ ID NO:1的氨基酸64-561。
术语“SLC38A9.4”和“SLC38A9同种型4”可互换使用,并且是指SEQ ID NO:1的氨基酸120-561。
术语“SLC38A9Δ110”是指SEQ ID NO:1的氨基酸111-564。
在某些实施方案中,本发明提供了对应于在氨基酸水平上与SLC38A9氨基酸序列(SEQ ID NO:1)的一部分具有至少70%、至少75%、至少80%、至少85%、至少90%或至少95%同源性的SLC38A9或者多肽或肽的部分的肽和多肽。在所述实施方案的一个特定方面,肽或多肽片段至少包含SEQ ID NO:1的氨基酸1-119。SLC38A9的此氨基末端结构域似乎负责结合于Ragulator。在所述实施方案的更具体方面,肽或多肽片段至少对应于SEQ ID NO:1的氨基酸59-90。在替代方面,多肽或肽包含与SEQ ID NO:1的氨基酸1-119或氨基酸59-90至少70%、至少75%、至少80%、至少85%、至少90%或至少95%同源的氨基酸序列。在另一个具体方面,至少70%同源的多肽与SEQ ID NO:1的氨基酸序列的不同之处在于D59、H60、S62、S72、R73、P77、D86和V88中的至少一个或多个经不同的氨基酸取代。在某些方面,D59、H60、S62、S72、R73、P77、D86及V88中的至少一个或多个经丙氨酸取代。在另一个具体方面,至少70%同源多肽至少包含对应于SEQ ID NO:1的I68、Y71、L74、P85、V89和P90的氨基酸。在所述实施方案的另一方面,肽、多肽或其同源物缺乏对应于或定义SLC38A9的任何跨膜结构域的氨基酸序列,例如SEQ ID NO:1的氨基酸120-561都不存在。在某些实施方案中,肽、多肽或其同源物能够进入细胞。这可以通过本领域已知的方法实现,包括在肽或多肽中添加细胞黏附氨基酸序列(例如Arg-Gly-Asp)、使用构象稳定的“钉接”多肽和使用融合蛋白,其中所述肽、多肽或其同源物的融合配偶体是细胞可渗透的多肽序列。在替代实施方案中,肽或多肽片段由SEQ ID NO:1的氨基酸111-561组成。在此替代实施方案的相关方面,肽或多肽片段基本上由直接或通过连接体与任何上述肽或其多肽片段的N-或C-末端融合的质膜靶向序列组成。在更具体方面,肽或多肽片段基本上由直接或通过连接体与SEQ ID NO:1的氨基酸111-561或SEQ ID NO:1的氨基酸1-561的N-或C-末端融合的质膜靶向序列组成。质膜靶向序列是本领域公知的(参见,例如,Bhardwaj,N.等,Bioinformatics 23:3110-3112(2007))。在更具体方面,质膜靶向序列是H-Ras的C-末端25个氨基酸(QHKLRKLNPPDESGPGCMSCKCVLS=SEQ ID NO:5)。在相关的更具体方面,肽或多肽片段由SEQ ID NO:1中任一个的变体或任何上述肽或其多肽片段组成,其中溶酶体靶向序列已经通过氨基酸取代、插入和/或添加得以消除。
在某些实施方案中,本发明的肽、多肽、融合蛋白及其同源物可用作SLC38A9与Ragulator的结合的竞争性抑制剂。在其它实施方案中,本发明的肽、多肽、融合蛋白及其同源物可用于鉴别SLC38A9的调节剂的分析中。此类调节剂可以改变SLC38A9对一种或多种氨基酸(例如精氨酸、组氨酸或赖氨酸)的亲和力,或改变SLC38A9与Ragulator之间的相互作用。
在相关实施方案中,本发明提供了编码一种或多种上述肽、多肽、融合蛋白及其同源物的核酸序列;包含此类核酸序列的载体;和用所述载体转化和/或表达所述核酸序列的产物的细胞。
在另一个实施方案中,本发明提供了SLC38A9的蛋白质支架调节剂。蛋白质支架调节剂是能够进入细胞并结合靶蛋白,并且可能能够改变靶蛋白的活性的小蛋白。蛋白质支架调节剂包括但不限于亲和体、双螺旋抗体、打结素(knottin)、单体(也称为阿德乐汀(adnectin))、抗运载蛋白(anticalin)、经设计的锚蛋白重复蛋白(DARPin)、阿尔法抗体TM(AlpahbodiesTM)、高亲和性多聚体(avimer)、免疫球蛋白衍生的结合片段、单链抗体及其片段、以及天然配体的衍生物,例如VEGF、EGF和膜联蛋白V。本发明的蛋白质支架调节剂可以是SLC38A9活化的或SLC38A9抑制性的。合适的蛋白质支架调节剂可通过筛选噬菌体、细胞或核糖体展示文库来鉴别,其可以是市售的或可以由本领域技术人员产生。SLC38A9的蛋白质支架调节剂的活性可(例如)通过其引起SLC38A9对于Ragulator或者一种或多种我们认为与SLC38A9相关的其它蛋白质的亲和力的改变的能力来确定,所述其它蛋白质例如TMEM192(NCBI基因ID:201931;SEQ ID NO:2)、SLC12A9(NCBI基因ID:56996;SEQ ID NO:3)或CLCN7(NCBI基因ID:1186;SEQ ID NO:4)。或者,SLC38A9的蛋白质支架调节剂的活性可通过其引起SLC38A9的一种或多种活性的改变的能力来确定。在该实施方案的一个方面,蛋白质支架调节剂是SLC38A9的抑制剂。在替代实施方案中,蛋白质支架调节剂是SLC38A9的活化剂或激活剂。
在另一个实施方案中,本发明提供了SLC38A9的小分子调节剂。在该实施方案的一个方面,小分子调节剂是SLC38A9的抑制剂,并且引起细胞中mTORC1活性的降低。在该实施方案的替代方面,小分子调节剂是SLC38A9的活化剂或激活剂,并且引起细胞中mTORC1活性的增加。在更具体实施方案中,小分子调节剂是SLC38A9的活化剂或激活剂,并且不是精氨酸、赖氨酸或亮氨酸。在另一个实施方案中,小分子调节剂是SLC38A9的活化剂或激活剂,并且是精氨酸、赖氨酸或亮氨酸的功能性模拟物。本文所用的术语“模拟物”是指仿效细胞中mTORC1活化的精氨酸、赖氨酸或亮氨酸的生物学效应(如通过mTORC1底物(例如S6K)响应试剂的mTORC1磷酸化作用所测量)的试剂,或者直接或间接增加细胞中精氨酸、赖氨酸或亮氨酸的水平的试剂。在所述实施方案的某些方面,小分子调节剂不是具有至少10%精氨酸、赖氨酸或亮氨酸含量的肽或肽类似物(例如肽中至少10%的氨基酸是精氨酸、赖氨酸或亮氨酸中的一种)。SLC38A9的小分子调节剂可通过筛选市售的小分子和天然产物文库来鉴别,并且可通过公知的药物化学操作和修饰进一步优化SCL38A9调节活性。
在另一个实施方案中,本发明提供了一种或多种TMEM192(NCBI基因ID:201931;SEQ ID NO:2)、SLC12A9(NCBI基因ID:56996;SEQ ID NO:3)或CLCN7(NCBI基因ID:1186;SEQ ID NO:4)的小分子调节剂。在该实施方案的一个方面,小分子调节剂是TMEM192、SLC12A9或CLCN7的抑制剂,并且引起细胞中mTORC1活性的降低。在该实施方案的替代方面,小分子调节剂是TMEM192、SLC12A9或CLCN7的活化剂或激活剂,并且引起细胞中mTORC1活性的增加。在更具体实施方案中,小分子调节剂是TMEM192、SLC12A9或CLCN7的活化剂或激活剂,并且不是精氨酸、赖氨酸或亮氨酸。在另一个实施方案中,小分子调节剂是TMEM192、SLC12A9或CLCN7的活化剂或激活剂,并且是精氨酸、赖氨酸或亮氨酸的模拟物。在所述实施方案的某些方面,小分子调节剂不是具有至少10%精氨酸、赖氨酸或亮氨酸含量的肽或肽类似物(例如肽中至少10%的氨基酸是精氨酸、赖氨酸或亮氨酸中的一种)。TMEM192、SLC12A9或CLCN7的小分子调节剂可通过筛选市售的小分子文库来鉴别,并且可通过公知的药物化学操作和修饰进一步优化TMEM192、SLC12A9或CLCN7调节活性。
在另一个实施方案中,本发明提供一种或多种与编码SLC38A9、TMEM192、SLC12A9或CLCN7中的一种或多种的DNA或mRNA互补并特异性杂交的寡核苷酸,例如siRNA、shRNA或反义寡核苷酸。本发明的寡核苷酸必须能够降低相应蛋白质的转录和/或转译。
在另一个实施方案中,本发明提供了调节SLC38A9、TMEM192、SLC12A9或CLCN7中的一种或多种的表达的CRISPR/CAS9体系和方式。CRISPR/CAS9体系及其制备和使用方式是本领域已知的,并且可以用于增加或减少特定基因的表达。因此,在该实施方案的一个方面,CRISPR/CAS9体系引起SLC38A9、TMEM192、SLC12A9或CLCN7中的一种或多种的表达的抑制。在该实施方案的另一方面,CRISPR/CAS9体系引起SLC38A9、TMEM192、SLC12A9或CLCN7中的一种或多种的表达增加。
在另一个实施方案中,本发明提供了一种或多种SLC38A9、TMEM192、SLC12A9或CLCN7基因组开放阅读框的转录的小分子调节剂。所述小分子包括调节一种或多种活化转录因子、转录共活化剂和转录抑制子的存在和活性和/或随后在SLC38A9、TMEM192、SLC12A9或CLCN7中的一种或多种的启动子处转录机构的募集的小分子。在该实施方案的一个方面,小分子调节剂增加SLC38A9、TMEM192、SLC12A9或CLCN7基因组开放阅读框中的一种或多种的转录。在该实施方案的替代方面,小分子调节剂降低SLC38A9、TMEM192、SLC12A9或CLCN7基因组开放阅读框中的一种或多种的转录。
在另一个实施方案中,本发明提供了SLC38A9、TMEM192、SLC12A9或CLCN7mRNA中的一种或多种的转译的小分子调节剂。在该实施方案的一个方面,小分子调节剂增加SLC38A9、TMEM192、SLC12A9或CLCN7mRNA中的一种或多种的转译。在该实施方案的替代方面,小分子调节剂降低SLC38A9、TMEM192、SLC12A9或CLCN7mRNA中的一种或多种的转译。
在另一个实施方案中,本发明提供了SLC38A9、TMEM192、SLC12A9或CLCN7蛋白水平中的一种或多种的蛋白质降解的小分子调节剂。在该实施方案的一个方面,小分子调节剂增加SLC38A9、TMEM192、SLC12A9或CLCN7蛋白中的一种或多种的降解。在该实施方案的替代方面,小分子调节剂降低SLC38A9、TMEM192、SLC12A9或CLCN7蛋白中的一种或多种的降解。
在另一个实施方案中,本发明提供了减少或消除SLC38A9的糖基化的试剂。在该实施方案的一个方面,所述试剂在SLC38A9的一个或多个氨基酸残基117、239、248、266或274处引起部分或完全去糖基化。
在相关实施方案中,本发明提供SLC38A9的部分或完全去糖基化形式、SLC38A9的多肽或肽片段、或SLC38A9的多肽或肽片段的同源物。在该实施方案中,SLC38A9或者多肽或肽片段包含SLC38A9的氨基酸残基117、239、248、266或274中的至少一种。可用于本实施方案的同源物可在对应于残基SLC38A9中的糖基化信号的一个或多个氨基酸处突变。所述突变可发生在推定为N-糖基化的SLC38A9中的任何天冬酰胺(即,对应于SLC38A9的氨基酸117、239、248、266或274的氨基酸)和/或在紧靠那些推定N-糖基化位点的C-末端的两个氨基酸中的任一个处,使得三个氨基酸N-糖基化信号被消除。
在另一个实施方案中,本发明提供了增加患者mTORC1活性的方法,其包括向患者施用活化或激活SLC38A9的试剂的步骤。任何上述SLC38A9-活化或激活体系、方法或试剂可用于此目的。
在相关实施方案中,本发明提供了增加患者mTORC1活性的方法,包括向患者施用活化或激活TMEM192、SLC12A9或CLCN7中的一种或多种的试剂的步骤。任何上述TMEM192-、SLC12A9-或CLCN7-活化或激活体系、方法或试剂可用于此目的。
在一些实施方案中,增加mTORC1的方法用于促进肌肉合成代谢,改良肌肉功能,增加肌肉质量,逆转肌肉萎缩或预防肌肉萎缩。在一些实施方案中,所述方法用于逆转肌肉萎缩或防止由于因生活方式不活动、由整形外科手术、固定、受试者的年龄或受试者患有或遭受的疾病或病症引起的不活动引起的肌肉萎缩。在一些实施方案中,所述方法用于逆转肌肉萎缩或防止由于断骨、严重烧伤、脊柱损伤、截肢、退行性疾病、其中恢复需要受试者卧床休息、留在重症监护室或长期住院的病状的肌肉萎缩。在一些实施方案中,所述方法用于治疗导致骨骼肌肉萎缩的疾病、病状或病症,例如肌肉减少症、肌肉去神经和肌营养不良。
在一些实施方案中,需要mTORC1活性增加的受试者(例如)由于恶病质或食欲缺乏具有减少的饱腹感。在一些实施方案中,需要mTORC1活性增加的受试者患有或遭受已知与恶病质相关并选自癌症、AIDS、SARS、慢性心脏衰竭、COPD、类风湿性关节炎、肝病、肾病和创伤的疾病或病状。在一些实施方案中,受试者患有或遭受已知与吸收障碍相关的疾病或病状。在一些实施方案中,所述疾病或病状选自克罗恩氏病(Crohn’s disease)、肠易激综合征、乳糜泻和囊性纤维化。在一些实施方案中,受试者患有或遭受营养不良、肌肉减少症、肌肉去神经、肌营养不良、发炎性肌病、脊髓性肌萎缩(SMA)、肌萎缩性侧索硬化(ALS)或重症肌无力。在一些实施例中,受试者正在准备、参与或最近从空间旅行返回。在一些实施方案中,受试者正在准备、参与或最近从武装冲突或军事训练返回。
在一些实施方案中,所述方法用于治疗核糖体病。在一些实施方案中,核糖体病选自戴阿蒙-布粒凡贫血(Diamond-Blackfan anemia)、5q-综合征、施瓦赫曼戴阿蒙综合征(Shwachman-Diamond syndrome)、X-连锁性角化病、软骨毛发发育不全和特雷彻柯林斯综合征(Treacher Collins syndrome)。
在一些实施方案中,所述方法用于治疗粘连病(例如,罗伯茨综合征(Roberts syndrome)和狄兰氏综合征(Cornelia de Lange syndrome))。
在一些实施方案中,增加mTORC1活性的方法用于防止患者的自噬。在一些实施方案中,受试者以依赖于自噬的诱导的方式患有或遭受疗法抗性癌症。
在一些实施方案中,所述方法用于治疗或预防抑郁症。在一些实施方案中,所述方法用于治疗或预防特征在于耗尽的氨基酸水平的孤独症形式。在一些实施方案中,增加mTORC1活性的方法用于治疗或预防时差反应。
在一些实施方案中,所述方法用于预防或逆转受试者的心肌萎缩。在一些实施方案中,受试者患有或已经患有选自心脏病发作、充血性心脏衰竭、心脏移植、心脏瓣膜修复、动脉粥样硬化、其它主要血管疾病和心脏旁路手术的疾病或病状。
在一些实施方案中,增加mTORC1活性的方法用于增加运动后的强度和/或增加肌肉质量。在一些实施方案中,所述方法与物理治疗结合实施,作为全非经肠营养的一部分,或促进功能性电刺激。
在另一个实施方案中,本发明提供了降低患者mTORC1活性的方法,其包括向患者施用抑制SLC38A9的试剂的步骤。任何上述SLC38A9抑制体系、方法或试剂可用于该目的。在该实施方案的一个方面,患者是器官移植受体,需要免疫抑制,是支架受者,患有或遭受动脉狭窄或处于发展动脉狭窄的风险中,或者患有或遭受癌症,特别是其中由监管机构推荐或批准经雷帕霉素治疗的癌症。在该实施方案的另一方面,患者遭受选自以下的疾病或病状:代谢性疾病(例如2型糖尿病、肥胖症、非酒精性脂肪性肝炎(NASH)和高脂血症)、神经变性疾病(例如阿尔茨海默病、帕金森氏病、亨廷顿氏病(Huntington’s Disease)和肌萎缩性侧索硬化)、自身免疫疾病(例如牛皮癣、类风湿性关节炎、多发性硬化、系统性红斑狼疮、痛风、过敏性鼻炎、克罗恩氏病和溃疡性结肠炎)、罕见和线粒体疾病(例如,利氏综合征、弗里德赖希氏共济失调(Friedreich’s Ataxia)、心肌病、莱伯氏遗传性视神经病(Leber’s Hereditary Optic Neuropathy)、淋巴管平滑肌瘤病、结节性硬化、庞贝病(Pompe Disease)(糖原贮积病II)和溶酶体贮积病)、心血管疾病(例如心肌病、心脏衰竭、缺血性心脏病(动脉粥样硬化疾病)、缺血性中风和肺动脉高压)、肾病(例如糖尿病性肾病、多囊肾病和急性肾损伤)、神经精神疾病(例如癫痫、孤独症谱系病症和抑郁病症)和肿瘤疾病(例如肾细胞癌、实体瘤、血液癌症)。
在相关实施方案中,本发明提供了用于降低患者mTORC1活性的方法,包括向患者施用抑制TMEM192、SLC12A9或CLCN7中的一种或多种的试剂的步骤。任何上述TMEM192-、SLC12A9-或CLCN7-抑制体系、方法或试剂可用于此目的。在所述实施方案的一个方面,患者是器官移植受体,需要免疫抑制,是支架受体,患有或遭受动脉狭窄或处于发展动脉狭窄的危险中,或者患有或遭受癌症,特别是其中由监管机构推荐或批准经雷帕霉素治疗的癌症、特征在于通过冲击mTORC1或由mTORC1调节的信号传导路径导致活性增加的遗传扰动的癌症亚型、或上调自噬的癌症亚型。在该实施方案的另一相关方面,患者患有或遭受肥胖症、由代谢功能障碍(例如2型糖尿病、代谢综合征、β-细胞功能障碍)引起的疾病、心肌病、自身免疫疾病(例如牛皮癣、狼疮)、神经变性疾病(例如阿尔茨海默氏病、亨廷顿氏病、帕金森氏病)、与异常mTORC1活化相关的神经性病症(例如结节性硬化症综合征、神经纤维瘤病、脆性X染色体综合征、PTEN相关病状、孤独症和孤独症谱系障碍、癫痫和癫痫发作)、导致线粒体功能障碍的遗传性疾病(例如利氏综合征、弗里德赖希共济失调)或导致mTORC1信号传导活性过度的遗传性疾病(例如结节性硬化症、淋巴管平滑肌瘤病)。在该实施方案的替代方面,患者遭受选自以下的疾病或病状:代谢性疾病(例如2型糖尿病、肥胖症、非酒精性脂肪性肝炎(NASH)和高脂血症)、神经变性疾病(例如阿尔茨海默病、帕金森氏病、亨廷顿氏病和肌萎缩性侧索硬化)、自身免疫疾病(例如牛皮癣、类风湿性关节炎、多发性硬化、系统性红斑狼疮、痛风、过敏性鼻炎、克罗恩氏病和溃疡性结肠炎)、罕见和线粒体性疾病(例如利氏综合征、弗里德赖希氏共济失调性心肌病、莱伯氏遗传性视神经病、淋巴管平滑肌瘤病、结节性硬化、庞贝病(糖原贮积病II)和溶酶体贮积病)、心血管疾病(例如心肌病、心脏衰竭、缺血性心脏病(动脉粥样硬化疾病)、缺血性中风和肺动脉高压)、肾病(例如糖尿病性肾病、多囊肾病和急性肾损伤)、神经精神疾病(例如癫痫、孤独症谱系障碍和抑郁病症)和肿瘤疾病(例如肾细胞癌、实体瘤、血液癌症)。
在另一个实施方案中,本发明提供了鉴别SLC38A9调节剂的方法,其包括以下步骤:a)使测试化合物与包含SLC38A9.1或SLC38A9.1的片段或突变体的多肽接触,其中所述多肽具有SLC38A9.1活性或特性;b)测量在测试化合物存在下的SLC38A9.1活性或特性;和c)将测量的活性或特性与不存在测试化合物下的相同活性或特性进行比较,由此确定测试化合物是否是SLC38A9的调节剂。
这些方法可采用细胞体系,其中SLC38A9或其片段或突变体经工程化以驻留在质膜上(例如通过将N末端融合至质膜信号序列,例如H-Ras-的最后25个氨基酸(QHKLRKLNPPDESGPGCMSCKCVLS;SEQ ID NO:5);经工程化以在质膜(例如非洲爪蟾卵母细胞)处表达SLC38A9或其片段或突变体的非哺乳动物细胞体系;体外体系,其中SLC38A9或其片段或其突变体附接到固体载体;以及其中SLC38A9或其片段或突变体在溶液中游离的体外体系。
在这些方法中待测量的活性或特性包括在细胞体系中摄取经标记的(例如,放射性标记的、荧光标记的)氨基酸(例如精氨酸、组氨酸或赖氨酸)、在细胞体系中摄取钠、在细胞体系中跨膜的膜电位的变化、在体外体系中氨基酸与SLC38A9或其片段或突变体的结合;在体外体系中测试化合物与SLC38A9或其片段或突变体的结合;在体内和体外系统中SLC38A9或其片段或突变体结合Ragulator的能力的变化;和mTORC1的一种或多种活性的变化(例如,S6K1的磷酸化状态的变化)。
这些活性的测量可通过以下方式来实现:对放射性标记的氨基酸进行闪烁计数;流式细胞术、荧光微板或用于荧光氨基酸的分光荧光光度计,并测量膜电位的变化(例如,响应于膜电位变化而改变荧光的染料,例如FLIPR染料(Molecular Devices);用于测量跨膜的电流的膜片钳;用以测量测试化合物的氨基酸结合或直接结合的变化的固相表面等离子体共振;以及用以测量测试化合物的氨基酸结合或直接结合的变化的质谱法。
在所述方法中待使用的SLC38A9.1的片段或突变体的选择将取决于待测量的活性。缺少氨基酸1-110的片段以及SLC38A9同种型2和4不与Ragulator相互作用,且因此当待测量的活性依赖于Ragulator相互作用时应避免。然而,缺少氨基酸1-110的片段仍然结合并转运氨基酸,且因此可用于直接或间接测量氨基酸结合和转运的分析中。在一个实施方案中,完整的SLC38A9.1或SLC38A9.1Δ110用于直接或间接测量氨基酸结合和转运的分析中。
包含SLC38A9.1或SLC38A9的片段或突变体的多肽还可以包括赋予多肽其它所需性质的其它氨基酸序列,其可用于这些方法中。在一些实施方案中,多肽另外包含在N或C末端的标签,其有助于多肽的重组产生和/或多肽的分离。所述标签包括组氨酸或多聚组氨酸标签、表位标签(例如FLAG或HA多肽融合物)或配体标签(例如生物素),其可直接或通过连接体共价结合于SLC38A9.1或其片段或突变体。在一些实施方案中,多肽另外包含将多肽靶向质膜的信号序列(例如,H-Ras的最后25个氨基酸-QHKLRKLNPPDESGPGCMSCKCVLS;SEQ ID NO:5)。在一些实施方案中,多肽另外包含荧光或生物发光标签或多肽序列(例如,与绿色荧光蛋白、黄色荧光蛋白、红色荧光蛋白或荧光素酶融合)。
所述方法的具体实例阐述于以下实施例中。
应理解,本文公开的本发明在其应用中不限于说明书中阐述的或示例的详情。本发明涵盖其它实施方案,并且能够以各种方式实践或实施。此外,应理解,本文中使用的措辞和术语是为了说明的目的,而不应被认为是限制性的。
除非明确地指示相反的情形,否则本文在说明书和权利要求书中使用的冠词“一”(“a”和“an”)应当理解为包括复数个指示物。除非指示相反的情形或从上下文显而易见,否则如果一个、多于一个或所有组成员存在于、用于或以其它方式与给定产品或过程相关,则认为满足包括组的一个或多个成员之间的“或”的权利要求书或说明。本发明包括其中组中仅一个成员存在于、用于或以其它方式与给定产品或过程相关的实施方案。本发明还包括其中多于一个或整个组成员存在于、用于或以其它方式与给定产品或过程相关的实施方案。此外,应理解,本发明涵盖其中来自所列权利要求书中的一个或多个的一个或多个限制、要素、条款、描述性术语等被引入依赖于相同的基本权利要求(或者相关、任何其它权利要求)的另一权利要求中的所有变化、组合和排列,除非另有说明或者除非本领域的普通技术人员明白将会出现矛盾或不一致。在要素提供为列表(例如,以马库什组(Markush group)或类似格式)的情况下,应理解,还公开了要素的每个子组,并且可以从组中移除任何要素。应理解,一般来说,在本发明或本发明的方面被称为包括特定要素、特征等的情况下,本发明的某些实施方案或本发明的方面由所述要素、特征等组成或基本上由其组成。为了简单的目的,那些实施方案在每种情况下都没有以这么多词语具体阐述于本文中。还应理解,本发明的任何实施方案或方面可从权利要求中明确地排除,而不管在说明书中是否列举了特定的排除。本文引用的描述本发明背景并提供关于其实践的额外详情的出版物和其它参考资料通过引用方式并入本文。
实施例
实施例1. SLC38A9与Ragulator相互作用。
尚不清楚氨基酸的存在或缺乏如何触发介导mTORC1的易位和活化的溶酶体蛋白的复杂网络。一个假设是推定的氨基酸传感器将直接与参与mTORC1信号传导的溶酶体复合物之一相互作用。为了检验此假设,我们最初集中于Ragulator复合物,并在保持蛋白质-蛋白质相互作用的条件下执行从稳定表达各种FLAG标记蛋白的HEK-293T细胞的免疫沉淀。
所有人类SLC38A9同种型(天然的和密码子优化的)的cDNA是由GenScript基因合成的。通过PCR扩增cDNA,并将产物亚克隆到HA-pRK5和FLAG-pRK5的Sal I和Not I位点。使用QuikChange II试剂盒(Agilent)用获自Integrated DNA Technologies的寡核苷酸诱变cDNA。通过DNA测序验证所有构筑体。
通过PCR扩增FLAG标记的SLC38A9同种型和SLC38A9N末端1-119并将其克隆到pLJM60的Sal I和EcoR I位点或pMX的Pac I和EcoR I位点。在序列验证后,如下所述,在cDNA转染中使用这些质粒或产生生成稳定表达蛋白质的细胞系所需的慢病毒。
将HEK-293T细胞在补充有10%灭活的胎牛血清、青霉素(100IU/mL)和链霉素(100μg/mL)的DMEM中培养并保持在37℃和5%CO2下。将200万个HEK-293T细胞铺在10cm培养皿中。24小时后,用图中所示的基于pRK5的cDNA表达质粒以下列量转染细胞:500ng FLAG-metap2;50ng FLAG-LAMP1;100ng FLAG-RagB和100ng HA-RagC;300ng FLAG-SLC38A9.1;600ng FLAG-SLC38A9.1Δ110;200ng FLAG-SLC38A9.4;400ng SLC38A9.1的FLAG-N-末端119片段;200ng FLAG-RagC;200ng FLAG-RagC S75N;200ng FLAG-RagC Q120L;400ng HAGST-RagB;400ng HAGST-RagB T54N;400ng HAGST-RagB Q99L。
使用空的pRK5将转染混合物吸收到总共5μg的DNA。将稳定表达FLAG标记的蛋白质的HEK-293T细胞用冰冷的PBS冲洗一次,并在冰冷的溶解缓冲液(40mM HEPES pH7.4、1%Triton X-100、10mMβ-磷酸甘油酯、10mM焦磷酸盐、2.5mM MgCl2和1片无EDTA的蛋白酶抑制剂(Roche)/25ml缓冲液)中溶解。通过在微量离心机中以13,000rpm离心10分钟来分离来自细胞溶解物的可溶性级分。对于免疫沉淀,向每个溶解物中添加30μL 50%的抗FLAG亲和凝胶(Sigma)浆液,并于4℃下旋转培育2-3小时。用含有500mM NaCl的溶解缓冲液洗涤免疫沉淀物三次。通过添加50μL试样缓冲液并在室温下培育30分钟使免疫沉淀的蛋白质变性。关键的是,在通过SDS-PAGE拆分和通过免疫印迹分析来分析之前,含有SLC38A9的试样既不煮沸也不冷冻。当制备用于质谱的试样时使用类似的方案。
如下所述制备来自3000万个稳定表达FLAG-metap2、FLAG-p18、FLAG-p14、FLAG-HBXIP、FLAG-c7orf59和FLAG-RagB的HEK-293T细胞的免疫沉淀物。将蛋白质用来自抗FLAG亲和珠粒的FLAG肽(序列DYKDDDDK)洗脱,在4-12%凝胶(Invitrogen)上拆分,并用SimplyBlueTM SafeStain(Invitrogen)染色。将每个凝胶泳道切成10-12个片,并且将每个凝胶切片中的蛋白质用胰蛋白酶消化过夜。随后将所得的消化物进行液相色谱,然后进行串联质谱(LC-MS-MS)以进行蛋白质鉴别。作为共转运蛋白的氨基酸/钠家族的成员的SLC38A9(NCBI基因ID:153129)存在于所有Ragulator组分特异性免疫沉淀中,以及在一定程度上存在于RagB的免疫沉淀中,但不存在于对照蛋白Metap2的免疫沉淀中。
为确认LC-MS-MS数据,我们使用上述方案用SLC38A9.1的FLAG标记的构筑体转染HEK-293T细胞,并且能够免疫沉淀内源性Ragulator蛋白(如通过其p14和p18组分所检测)以及RagA和RagC。其它FLAG标记的溶酶体膜蛋白LAMP1、SC36A1和SLC38A7并不免疫沉淀p14、p18、RagA或RagC中的任一种(图1D和图6A)。我们还能够证明重组表位标记的SLC38A9和共表达的表位标记的Ragulator蛋白之间的结合。
已确认指示SLC38A9与Ragulator相互作用的质谱数据,我们开始确定SLC38A9的哪个区域负责其与Ragulator的相互作用。针对SLC38A9存在4种由NCBI注释之不同同种型;同种型1(SEQ ID NO:1)是全长蛋白;同种型2缺失SEQ ID NO:1的N-末端的前63个氨基酸;同种型3具有较短的经修饰的N-末端和截短的C-末端;并且同种型4缺失在第一跨膜结构域(AA1-119)之前的整个N-末端区。我们在HEK-293T细胞中表达同种型1、2和4、以及缺少其前110个氨基酸的SLC38A9.1的突变体(SLC38A9.1Δ110),并且发现同种型1与Ragulator强烈结合,而同种型2、4或SLC38A9.1Δ110能够免疫沉淀内源性或共转染的Ragulator蛋白(图6,B和C)。
鉴于同种型4不能沉淀Ragulator组分,我们主要关注可能负责介导SLC38A9与Ragulator之间的相互作用的N-末端(AA1-119)。我们开发仅由SLC38A9的N末端氨基酸残基1-119组成的N末端FLAG标记的构筑体,并且发现对于免疫沉淀来说Ragulator是必要和充分的(图1A和图6C)。我们观察人类、斑马鱼和秀丽隐杆线虫之间的保守残基,并且发现氨基酸59-90是强烈保守的。在AA1-119构筑体中用丙氨酸取代每个残基以下将突变鉴别为破坏SLC38A9的N-末端区域与Ragulator的结合:I68A、Y71A、L74A、P85A、V89A、P90A。在此区域内不破坏相互作用的丙氨酸取代包括D59A、H60A、S62A、S72A、R73A、P77A、D86A和V88A。我们推断出,Ragulator-SLC38A9.1相互作用需要I68、Y71、L74、P85和P90(图1E)。
鉴于其与其它氨基酸转运蛋白的同源性,在氨基酸饱和和氨基酸缺陷培养条件下在全长SLC38A9和Ragulator蛋白之间进行免疫沉淀分析。我们发现SLC38A9与Ragulator蛋白之间的相互作用由类似于在Ragulator与Rag蛋白之间观察到的氨基酸条件调节。当仅用SLC38A9的N-末端(SEQ ID NO:1的氨基酸1-119)重复此测定时,未观察到响应氨基酸水平的任何变化。因此,认为SCL38A9与Ragulator之间的相互作用将被氨基酸修饰,并且这种调节对于其作为响应氨基酸的mTORC1信号传导的调节剂的功能是重要的。很可能SLC38A9的跨膜区域需要介导对氨基酸的反应。
v-ATP酶及其活性对于mTORC1途径的氨基酸传感是必需的,并且与SLC38A9.1一样,其与稳定表达的FLAG标记的Ragulator共免疫沉淀。这指示除了Ragulator和Rag GTP酶之外,还存在与v-ATP酶的内源组分相关的稳定表达的SLC38A9.1、而非LAMP1的超复合物(图1C)。虽然SLC38A9.2不与Ragulator相互作用,但其与v-ATP酶共免疫沉淀,不过比SLC38A9.1的量更少(图1C)。这表明SLC38A9.1与v-ATP酶之间的相互作用并非通过Ragulator介导,而是直接或间接通过含有其跨膜结构域的SLC38A9.1区域介导。符合这种解释,SLC38A9.1的N-末端结构域与Ragulator强烈相互作用,不会共免疫沉淀vATP酶(图1C)。
实施例2. SLC38A9定位于溶酶体膜。
鉴于SLC38A9与Ragulator的强相互作用及其与含有规范的5+5跨膜结构的其它SLC38家族成员的同源性,预测SLC38A9定位于溶酶体膜。
将HEK-293T细胞以300,000个细胞/孔铺在6孔组织培养皿中的纤连蛋白涂布的玻璃盖玻片上。12-16小时后,将载玻片用PBS冲洗一次,并在-20℃下用冰冷的100%甲醇(用于SLC38A9检测)一步固定和渗透15min。在用PBS冲洗两次后,在室温下将载玻片与5%正常驴血清中的一级抗体(FLAG CST 1:300,LAMP2 1:400)一起培育1小时,用PBS冲洗四次,在室温下在黑暗中与驴中产生的二级抗体(在5%正常驴血清中1:400稀释)一起培育45分钟,并用PBS洗涤四次。使用具有DAPI(Vector Laboratories)的Vectashield将载玻片安装在玻璃盖玻片上,并在旋转盘共聚焦系统(Perkin Elmer)上成像。
免疫荧光成像测定SLC38A9的所有表位标记的同种型与lamp 2共定位,指示SLC38A9是溶酶体膜蛋白(图2A和图7、A和B)。还对缺乏Ragulator组分的两种不同的小鼠胚胎成纤维细胞中的SLC38A9和lamp2染色,且SLC38A9继续定位于溶酶体,指示其不需要Ragulator进行其溶酶体定位。与此发现一致,通过去除其脂质锚定将Ragulator定位于细胞质不改变SLC38A9的溶酶体定位,突变体Ragulator也不与SLC38A9.1相互作用(图7C)。所述数据指示SLC38A9是溶酶体膜蛋白,其不需要其N末端或Ragulator定位于溶酶体。
制备编码shRNA的慢病毒,并如下所述转导至HEK-293T细胞中。通过使用XTremeGene 9转染试剂(Roche)将pLJM1/pLJM60慢病毒转移载体与VSV-G包膜和CMVΔVPR包装质粒共转染至病毒HEK-293T细胞4中产生慢病毒。对于HeLa细胞、LN229细胞和MEF的感染,通过将pMX逆转录病毒转移载体与VSV-G包膜和Gag/Pol包装质粒共转染至病毒HEK-293T细胞中产生逆转录病毒。在转染后24小时,将培养基更换为补充有30%IFS的DME。转染后48小时收集含有病毒的上清液,并通过0.45μm过滤器以消除细胞。将6孔组织培养板中的靶细胞在含有8μg/mL聚凝胺的培养基中感染,并通过以2,200rpm离心1小时实施自旋感染。感染后24小时,去除病毒并用合适的抗生素选择细胞。
从RNAi Consortium 3(TRC3)获得的对照shRNA和靶向人SLC38A9的那些shRNA的序列如下(5'至3'):
SLC38A9编号1:GCCTTGACAACAGTTCTATAT(TRCN0000151238)(SEQ ID NO:6);
SLC38A9编号2:CCTCTACTGTTTGGGACAGTA(TRCN0000156474)(SEQ ID NO:7);
GFP:TGCCCGACAACCACTACCTGA(TRCN0000072186)(SEQ ID NO:8)。
在基于siRNA的实验中,将200,000个HEK-293T细胞铺在6孔板中。24小时后,使用DharmaFECT 1(Dharmacon)用250nM靶向SLC38A9的siRNA(Dharmacon)池或非靶向池转染细胞。转染后48小时,再次转染细胞,但此时用双倍量的siRNA。在第二次转染后24小时,用冰冷的PBS冲洗细胞,溶解,并如上所述进行免疫印迹分析。使用以下siRNA:非靶向:ON-TARGET加非靶向池(D-001810-10-05)SLC38A9:SMART池:ON-TARGET加SLC38A9(L-007337-02-0005)
HEK-293T细胞中ShRNA-或siRNA介导的SLC38A9的耗尽抑制氨基酸对mTORC1的活化,如通过其已确定的底物核糖体蛋白S6激酶1(S6K1)的磷酸化所检测(图2B和图7D)。因此,如Ragulator的五个已知亚单位一样,SLC38A9.1是mTORC1路径的正性组分。不受限于理论,我们认为SLC38A9.1是溶酶体膜蛋白,其通过其N-末端119个氨基酸(“Ragulator-结合结构域”)与Ragulator和Rag GTP酶相互作用,并且是mTORC1活化所需的。
实施例3.SLC38A9过表达活化mTORC1。
已经确定SCL38A9与Ragulator在溶酶体处强烈相互作用,我们希望了解SLC38A9在调节mTORC1活性中的功能。鉴于SLC38家族参与氨基酸的转运,测试SLC38A9的过表达是否响应氨基酸调节mTORC1信号传导。在培养基中的野生型细胞中,氨基酸撤除导致mTORC1信号传导的抑制。
将100万个HEK-293T细胞铺在10cm培养皿中。24小时后,用图中指示的基于pRK5的cDNA表达质粒以下列量转染细胞:500ng HA-metap2;50ng HA-LAMP1;200ng HA-SLC38A9.1;500ng HA-SLC38A9.1Δ110;200ng HASLC38A9.4;100ng HA-RagB T54N和100ng HA-RagC Q120L;2ng FLAG-S6K1。转染后72小时,将细胞洗涤一次,之后与不含氨基酸的RPMI一起培育50-min。在收获前用媒剂或氨基酸(至终浓度等效于RPMI)刺激细胞。
SLC38A9同种型1在HEK-293T细胞中的瞬时或稳定过表达使mTORC1信号传导对总氨基酸饥饿或仅亮氨酸或精氨酸饥饿具有抗性,如通过外源S6K1(mTORC1活性的确定的报告子)的苏氨酸389(T398)的磷酸化所测量(图3A和8A)。与其对mTORC1的效应相称,SLC38A9.1过表达抑制由氨基酸饥饿引起的自噬的诱导(图8C)。
不与Ragulator和Rag GTP酶相互作用的SLC38A9的变体(包括SLC38A9.2、SLC38A9.4和SLC38A9.1Δ110和SLC38A9.1I68A突变体)的瞬时过表达在氨基酸撤除后不能维持mTORC1信号传导(图3B和C和图8A)。
SLC38A9.1过表达也在HEK-293E、HeLa和LN229细胞以及小鼠胚胎成纤维细胞(MEF)中不存在氨基酸下活化mTORC1,活化程度与表达的SLC38A9.1的量成正比例(图8B)。有趣的是,仅SLC38A9.1的Ragulator结合结构域的过表达模拟全长蛋白对mTORC1信号传导的效应(图3D),指示当与SLC38A9.1的跨膜部分分离时,其可以采取活性状态。
我们还使用CRISPR/CAS9制备SLC38A9.1敲除。将设计为SLC38A9的N-末端(氨基酸1-119)或下文公开的AAVS1基因座的CRISPR/CAS9指导序列克隆到pX459中。
AAVS1:GGGGCCACTAGGGACAGGAT(SEQ ID NO:9)
SLC38A9_1:GGCTCAAACTGGATATTCATAGG(SEQ ID NO:10)
SLC38A9_2:GGAGCTGGAACTACATGGTCTGG(SEQ ID NO:11)
将HEK-293T细胞(750,000/孔)铺在6孔皿中,并且使用XtremeGene9在16小时后用1μg表达上述指导序列(guide)的pX459转染。48小时后将细胞胰蛋白酶化,施用2mg/mL嘌呤霉素72小时,并允许恢复几天。当细胞接近汇合时,将其单细胞分选到含有30%血清和条件培养基的96孔板中。扩增克隆并通过SLC38A9的蛋白印迹分析(western analysis)评估敲除状态。如上所述评价所述克隆的氨基酸反应。
使用CRISPR/CAS9基因组编辑技术的耗尽SLC38A9的HEK-293T细胞展现了响应氨基酸刺激的mTORC1活化的部分抑制。基于所述数据,假设SLC38A9是响应氨基酸的mTORC1信号传导的正调节子。
实施例4.潜在SLC38A9结合配偶体的LC-MS-MS鉴别。
使用LC-MS-MS,将TMEM192(NCBI基因ID:201931)、SLC12A9(NCBI基因ID:56996)和CLCN7(NCBI基因ID:1186)鉴别潜在蛋白结合配偶体,SLC38A9可与其同源寡聚化和/或异源寡聚化。认为SLC38A9可能与这些其它蛋白质中的一种或多种相关,作为其作为mTORC1上游的氨基酸传感器的功能的一部分。
实施例5.SLC38A9的糖基化分析。
在通过SDS-PAGE解析SLC38A9的表达中,观察到比预期更高的分子量的蛋白质条带。此类似于观察到的糖基化膜蛋白的型式。因此,我们对SLC38A9的序列进行了生物信息学分析,且发现残基117、239、248、266和274潜在经N-糖基化。不受限于理论,我们认为糖基化可在作为mTORC1信号传导的氨基酸传感器和调节子的SLC38A9的定位和功能中起作用。糖基化还可保护蛋白SLC38A9免于由溶酶体蛋白酶裂解。
实施例6.由氨基酸调节SLC38A9-Rag-Ragulator相互作用
氨基酸调节氨基酸传感路径的许多已确定的组分之间的相互作用,因此我们测试SLC38A9.1-Ragulator-Rag复合物是否也是这种情况。
将HEK-293T细胞(150,000/孔)铺在纤连蛋白涂布的12孔盘上,并在12小时后使用XtremeGene9以下述量用图中指示的基于pRK5的cDNA表达质粒转染:400ng LAMP1-FLAG、400ng FLAGSLC38A9.1、400ng SLC38A2-FLAG、150ng PQLC2-FLAG和50ng GFP。使用空的pRK5将转染混合物吸收到总共2μg DNA。48小时后通过以下方式分析细胞:在转运缓冲液(140mM NaCl、5mM KCl、2mM MgCl2、2mM CaCl2、30mM Tris-HCl(pH 7.4)、5mM葡萄糖)中洗涤两次,于37℃下在转运缓冲液中培育5分钟,之后于37℃下于指示pH(通过MES缓冲为pH 5、通过Tris缓冲为pH 8)下用补充有氨基酸(未标记和总浓度为380μM的0.1μCi[14C]亮氨酸、或未标记和RPMI中发现的总浓度的0.1μCi[14C]氨基酸、或未标记和总浓度为3mM的0.2μCi[14C]精氨酸)的新鲜缓冲液更换缓冲液达10分钟。摄取后,将细胞在冰冷的转运缓冲液中洗涤两次,并在0.5mL的1%SDS中收获用于闪烁计数。
实际上,氨基酸饥饿增强了稳定表达的或内源性Ragulator与内源性SLC38A9之间的相互作用(图4A、图9);以及稳定表达的SLC38A9.1与内源性Ragulator和Rag之间的相互作用(图4B)。当细胞被剥夺亮氨酸或精氨酸时和仅用亮氨酸或精氨酸刺激时,我们获得类似的结果(图4A)。奇怪的是,尽管SLC38A9.1的N-末端结构域容易结合Ragulator,但是相互作用对氨基酸不敏感(图4B),表明跨膜区是赋予氨基酸反应性所必需的。
由于氨基酸饥饿改变Rag GTP酶的核苷酸状态,我们测试SLC38A9是否与锁定其核苷酸状态的Rag的突变体有差异地相互作用。含有模拟GDP-结合状态的RagBT54N的表位标记的RagB-RagC的异源二聚体与含有野生型RagB的异源二聚体相比,与更多的内源性SLC38A9相关(图4C)。相比之下,含有缺乏GTP酶活性并因此结合于GTP的RagBQ99L的异源二聚体与SLC38A9的相互作用非常弱(图4C)。因此,如Ragulator一样,SLC38A9最好与Rag异源二聚体相互作用,其中RagA/B装载有GDP,此与SLC38A9与Ragulator的结合且Ragulator是RagA/B的GEF一致。所述结果表明,SLC38A9.1与Rag-Ragulator的相互作用的氨基酸调节很大程度上反映氨基酸诱导的Rag GTP酶的核苷酸状态的改变。由于RagB突变对Rag GTP酶与SLC38A9的相互作用比对于Ragulator的相互作用具有更大的效应(在图4C中比较SLC38A9印迹与对于p14和p18的印迹),Rag异源二聚体很可能与SLC38A9进行Ragulator非依赖性接触,此影响Rag-SLC38A9相互作用的稳定性。
实施例6. SLC38A9.1是氨基酸转运蛋白
我们不能在活细胞中检测到SLC38A9.1介导的氨基酸转运或氨基酸诱导的钠电流,在所述活细胞中SLC38A9.1高度过表达以至于一些到达质膜(图10,A-E)。由于所述实验分别被内源性转运蛋白的存在混杂或依赖于转运的间接测量,所以将SLC38A9.1或SLC38A9-Δ110重构至脂质体中,以直接分析放射性标记的氨基酸的转运。
除了将细胞在40mM HEPES(pH7.4)、0.5%Triton X-100、1mM DTT和蛋白酶抑制剂中溶解之外,如上所述收获稳定表达FLAG-SLC38A9.1的HEK-293T细胞用于免疫沉淀。3小时免疫沉淀后,将FLAG-亲和珠粒在补充有500mM NaCl的溶解缓冲液中洗涤两次,每次5min。用补充有10%甘油的内部缓冲液(20mM MES pH 5、90mM KCl、10mM NaCl)将珠粒洗涤5次以使其平衡。通过旋转30分钟在含有1mg/mL FLAG肽的补充有甘油的内部缓冲液中洗脱FLAG亲和纯化的SLC38A9.1蛋白。使用Amicon离心过滤器将蛋白浓缩至约1mg/mL,并在液氮中快速冷冻并储存在-80℃下。
如下进行SLC38A9-Δ110的纯化。将2升用His-SLC38A9-Δ110瞬时转染的悬浮液293F细胞沉淀,并将所得细胞浆使用杜恩斯(dounce)匀浆器在25mM Tris、10mM MgCl2、20mM KCl(pH 7.5)中进行3轮匀浆,然后超离心。第三轮后,所得细胞沉淀使用杜恩斯匀浆器在25mM Tris、1M NaCl、10mM MgCl2、20mM KCl(pH 7.5)中进行另外3轮的匀浆,然后超离心。然后将所得沉淀悬浮在25mM Hepes、150mM NaCl、5%甘油、2%DDM(pH7.5)(加蛋白酶抑制剂片剂)中,并培育过夜,然后超离心并收集所得上清液。将His-SLC38A9-Δ110通过钴亲和柱从所得上清液中纯化,并在25mM Hepes、150mM NaCl、5%甘油、0.05%DDM(pH7.5)中的250mM咪唑中洗脱。
为形成脂质体,使用干燥氮气蒸发氯仿溶解的磷脂酰胆碱(PC,50mg)以在圆底烧瓶中产生脂质膜并在真空下干燥过夜。脂质在缓冲液中以50mg/mL在水浴(Branson M2800H)中以轻微超声处理水合,并在Eppendorf管中分成100μL等分部分。使用水浴超声处理使等分的脂质澄清,重组并通过具有15个通道的100nm膜(Avanti 61000)挤出。通过在4℃下旋转30分钟引发重构反应(15μg FLAG-SLC38A9.1蛋白或15μg His-SLC38A9-Δ110、7.5mg Triton X-100、10mg挤出的PC、1mM DTT,在内部缓冲液中高达700μL)。在仅脂质体对照中使用补充甘油的缓冲液代替SLC38A9.1蛋白。通过在甲醇中洗涤1次、在水中洗涤5次和在内部缓冲液中洗涤2次制备生物珠粒(200mg/反应)。将重构反应应用于生物珠粒1小时,转移至新鲜生物珠粒过夜,并再次转移至新鲜的生物珠粒达1小时。
为分析氨基酸转运,将所有缓冲液冷冻并在4℃冷室中进行分析。对于时程实验,将SLC38A9.1蛋白磷脂体或脂质体对照上样于经外部缓冲液(20mM Tris pH 7.4、100mM NaCl)平衡的PD10柱并根据制造商的说明书洗脱。通过添加0.5μM[3H]精氨酸引发氨基酸摄取,并在30℃水浴中培育。通过取分析反应的级分并将其上样于经外部缓冲液预平衡的PD10柱来收集时间点。将柱以1.75mL的级分或单次洗脱进行洗脱,并添加到5mL闪烁液中。为获得氨基酸浓度的准确测量,将等体积的外部缓冲液添加到标准品中的闪烁液中。
对于使用未标记的氨基酸的竞争实验,由于SLC38A9.1输入活性的高Km(约39mM),需要高浓度的氨基酸。将SLC38A9.1蛋白磷脂体或脂质体对照在TLA-100.3转子中以100,000g离心30min,并重悬浮于较小体积的外部缓冲液中,使得其可添加到补充有外部缓冲液组分的较大体积的100mM未标记的氨基酸(终浓度)中。由于约130mM的亮氨酸的溶解度限制,我们必须采用此种程序。在这样高的浓度下,重要的是将所有氨基酸溶液调节至pH 7.4。通过向氨基酸缓冲溶液中添加0.5μM[3H]精氨酸、随后添加SLC38A9.1蛋白磷脂体或脂质体对照来启动分析。
对于稳态动力学实验,如上所述收集时间点并且为了评估底物特异性,在75min收集竞争实验。对于流出实验,如上所述用[3H]精氨酸装载SLC38A9.1蛋白磷脂体或脂质体对照,用于输入分析1.5小时。为去除外部氨基酸,将反应物上样于经外部缓冲液预平衡的PD10柱,并如上所述收集时间点。从SLC38A9.1蛋白磷脂体的闪烁计数减去脂质体对照的闪烁计数。
单向插入脂质体中的亲和纯化的SLC38A9.1或SCL38A9Δ110各自呈现放射性标记的精氨酸的时间依赖性摄取,而含有LAMP1的那些与和脂质体类似量的精氨酸相互作用(图5A、图11、图10F)。稳态动力学实验显示,SLC38A9.1具有约39mM的米氏常数(Michaelis constant,Km)和约1.8min-1的催化速率常数(kcat)(图5B),指示SLC38A9.1是低亲和力氨基酸转运蛋白。SLC38A9.1也可以从蛋白磷脂体中排出精氨酸(图5C),但是其在脂质体中的取向使得不可能获得用于此活性的准确的Km和kcat测量。很可能,由于必须以“反向”方向测定转运蛋白,我们低估了其在从溶酶体中输出期间对氨基酸的亲和力。
为了评估SLC38A9.1的底物特异性,我们使用未标记的氨基酸进行竞争实验(图5D)。带正电荷的氨基酸组氨酸和赖氨酸竞争放射性标记的精氨酸转运到与精氨酸相似的程度,而亮氨酸具有中等效应,且甘氨酸是最不有效的竞争剂。因此,似乎SLC38A9.1对极性氨基酸优先具有相对非特异性的底物特性。
鉴于SLC38A9.1对运输精氨酸的偏好,且精氨酸在大鼠肝脏溶酶体和酵母液泡中高度浓缩,我们探寻SLC38A9.1在将精氨酸水平传递至mTORC1中是否可能具有重要作用。为此,我们检查mTORC1信号传导如何响应于HEK-293T细胞中的一系列精氨酸或亮氨酸浓度,其中使用如上文实施例4中所述的CRISPR/CAS9基因组编辑敲除SLC38A9。有趣的是,精氨酸对mTORC1的活化在SLC38A9敲除中的所有精氨酸浓度下被强烈抑制,而对亮氨酸的响应仅被钝化,使得高亮氨酸浓度在无效和对照细胞中同样良好地活化mTORC1(图5F)。
基于上述发现,并且不受限于理论,我们认为SLC38A9结合钠和特定氨基酸,并且作为响应可能经历构象变化,其通过其与Ragulator的相互作用导致mTORC1活化。关于氨基酸底物特异性,我们认为SLC38A9结合对mTORC1重要的氨基酸(例如亮氨酸、精氨酸、赖氨酸)和/或这些氨基酸的天然或合成衍生物,但我们认为SLC38A9.1是用于mTORC1路径的基于溶酶体的精氨酸传感器的强候选者。SLC38A9对氨基酸的结合也可导致其跨溶酶体膜的转运。鉴于其它SLC38家族成员的pH敏感性以及通过mTORC1的氨基酸传感的pH敏感性,我们认为增加溶酶体内pH可能抑制SLC38A9对mTORC1的信号传导,而溶酶体的pH波动可能对于调节SLC38A9对mTORC1的活性是重要的。此外,SLC38家族的钠结合位点特征存在于SLC38A9中;因此,推测它也可在溶酶体膜上传导钠电流,并且此种电流可以被氨基酸调节并且可能对mTORC1功能重要。
实施例7.用以测量SLC38A9或SEQ ID NO:1的氨基酸1-119与Rag C/B异源二聚体或Ragulator之间的相互作用的分析。
调节mTORC1活性的测试化合物可通过测定其对SLC38A9.1(或SEQ ID NO:1的氨基酸1-119)与Rag异源二聚体之间的相互作用的效应的分析来鉴别。将测试化合物与培养的细胞系一起培育一段时间,所述细胞系稳定表达:
(i)内源性SLC38A9.1和Rag异源二聚体或Ragulator组分;或
(ii)表位标记的SLC38A9.1(或SEQ ID NO:1的氨基酸1-119)和/或表位标记的RagA或RagB或RagC或RagD、和/或表位标记的Ragulator组分(p18、MP1、p14、HBXIP、C7orf59)的组合,其中标签不阻止外源氨基酸调节mTORC1信号传导。
化合物处理后,将细胞溶解,并如本领域中所述(Sancak等,Cell 141,290-303,2010年4月16日)免疫沉淀内源性或表位标记的Rag或Ragulator组分。然后将试样去糖基化,处理用于SDS-PAGE,并如上文所述针对内源性或表位标记的SLC38A9.1或表位标记的SLC38A9.1或SEQ ID NO:1的表位标记的氨基酸1-119进行免疫印迹分析。
在该分析的另一个实施方案中,内源性或表位标记的Rag或Ragulator组分通过合适的抗体捕获在固定的表面上,然后对内源性或表位标记的SLC38A9.1或SEQ ID NO:1的氨基酸1-119进行夹心ELISA,如根据本领域所述(Daniele等,Scientific Reports 4,文件号:4749,2014)。
在该测定法的另一版本中,如本领域所述,用荧光或发光底物进行ELISA(参见http://csmedia2.corning.com/LifeSciences/media/pdf/elisa5.pdf)。
此实施例7中所述的分析是在对所有氨基酸饥饿的细胞、对精氨酸饥饿的细胞、对所有氨基酸饥饿并用所有氨基酸刺激的细胞、对精氨酸饥饿并用精氨酸刺激的细胞、和/或对所有氨基酸饥饿并用精氨酸刺激细胞中进行的。
实施例8.用以鉴别SLC38A9活性调节剂的分析
A.SLC38A9或SLC38A9Δ110针对质膜的定位。
在活细胞中进行的需要SLC38A9向质膜表达和定位的某些分析。为了将SLC38A9定位于质膜,SLC38A9的N-或C-末端与H-Ras的最后25个氨基酸(QHKLRKLNPPDESGPGCMSCKCVLS)融合。或者,H-Ras的此25个氨基酸部分可与结合并能够跨膜转运氨基酸的SLC38A9的任何肽或多肽片段或突变体(例如SLC38A9Δ110)的N或C-末端融合。此种融合蛋白靶向并在质膜表达。
或者,诱变结合并能够跨膜转运氨基酸的SLC38A9或SLC38A9的任何肽或多肽片段或突变体(例如SLC38A9Δ110)的溶酶体定位序列。如本领域所证明,这还将所得的肽、多肽或蛋白质靶向质膜(Biochem J.434(2):219-31,2011)。
任何上述构筑体在选择的细胞系(例如HEK-239细胞)中瞬时转染或稳定表达。
B.经放射标记的底物摄取分析:
放射性标记的底物摄取分析是在表达SLC38A9或SLC38A9的任何肽或多肽片段或突变体的黏附或悬浮细胞中进行的,所述肽或多肽片段或突变体结合并能够跨膜转运氨基酸,例如SLC38A9Δ110,如本领域中所述(The Journal of Neuroscience,14:5559-5569,1994)。简言之,在添加放射性标记的氨基酸底物之前或同时,在室温下、在存在或不存在测试化合物下将细胞在杜贝克氏(Dulbecco’s)磷酸盐缓冲盐水(D-PBS)中培育一段时间。为了测试SLC38A9或SLC38A9Δ110的转运,评估在不同浓度和不同时间段的氚化(3H)-精氨酸、(3H)-组氨酸和(3H)-赖氨酸的转运。在分析结束时,将黏附细胞在冰冷的D-PBS中洗涤三次,溶解在0.1%SDS中,并在适当的闪烁液(例如,来自Fisher Scientific的ScintiVerse)中处理用于闪烁计数。对于悬浮细胞,在分析结束时,使悬浮液通过Whatman GF/F微纤维过滤器(或类似型式的过滤器),洗涤,并以标准方式处理以进行闪烁计数。来自这些实验的值可用于计算底物亲和力常数。导致较低闪烁计数的化合物被认为是SLC38A9的抑制剂,而增加闪烁计数的化合物被认为是SLC38A9激活剂。
C.荧光底物摄取分析:
也在完整细胞中测量SLC38A9的荧光标记的氨基酸底物的转运。该分析与针对3H-底物摄取所述相同,其中将测试化合物在荧光氨基酸底物之前或与荧光氨基酸底物同时添加到细胞中。在分析终止时,通过荧光微板读数器、荧光显微镜或通过本领域中进行的流式细胞术(Journal of Neuroscience Methods 169,168-176,2008)测量细胞摄取的荧光底物的量。通过细胞内荧光强度的变化来测量响应化合物的底物摄取的变化。
D.基于完整细胞的闪烁迫近分析:
使用闪烁体涂布的96孔或384孔组织培养处理的微孔板(例如来自Perkin Elmer的Cytostar-T板)根据现有技术(Anal Biochem.366(2):117-25,2007)实现表达质膜定位的SLC38A9或SLC38A9Δ110的细胞的3H-底物摄取的实时分析。简言之,将黏附细胞或悬浮细胞在闪烁微孔板中生长至汇合,洗涤并用汉克氏(Hank’s)平衡盐溶液或含有不同浓度的3H-氨基酸底物的D-PBS一起培育。在3H-底物之前或与3H-底物同时,将测试化合物以不同浓度添加到含细胞的孔中。通过将板放置在能够从96或384孔板读取信号的基于光电倍增管的辐射检测器仪器中,测量放射性标记的底物的实时摄取达给定量的时间。
E.基于荧光的转运蛋白分析以检测钠转运:
SLC38A9属于钠依赖性氨基酸转运蛋白家族,并且含有协调和转运钠所需的氨基酸。使用钠敏感性荧光染料(例如结合钠的苯并呋喃间苯二甲酸酯(SBFI)(J Biol Chem.264(32):19449-57,1989)、CoroNa Green(J Physiol 498,295-307,1997)或Asante NaTRIUM Green 1(NeuroImage,第58卷:2,572-578,2011))进行检测钠摄取的转运蛋白分析。简言之,如本领域(Methods Enzymol 192:38-81,1990)中所确定,在质膜上表达SLC38A9、SLC38A9Δ110或对照蛋白的细胞预先装载有钠敏感性荧光染料的细胞可渗透的乙酰氧基甲基酯,洗涤,且然后在底物氨基酸和氯化钠之前或同时与不同浓度的测试化合物一起培育。当将过表达质膜定位的SLC38A9或SLC38A9Δ110的细胞与表达阴性对照蛋白的细胞进行比较时,在与氨基酸底物和氯化钠一起培育时荧光信号的增加指示由于通过SLC38A9或SLC38A9Δ110转运而钠摄取增加。荧光强度的变化可通过流式细胞术、荧光微板或分光荧光光度计测量。
F.膜电位分析:
钠由SLC38A9的跨膜转运也可导致膜电位变化。存在多种可用的染料,当与细胞一起预培育时,允许通过荧光的变化测量膜蛋白的变化(例如Molecular Devices的FLIPR膜电位染料)。简言之,黏附细胞在黑色不透明微孔板中生长,洗涤,在汉克氏平衡盐溶液和膜电位染料中培育足以使细胞装载染料的一段时间。然后将细胞与测试化合物一起培育。与测试化合物一起培育后,将装载有染料的细胞板装载到FLIPR工作站上,这使得可以在添加氨基酸底物和氯化钠时实时检测质膜电位变化(Assay and Drug Development Technologies,6:2,2008)。在与底物和氯化钠一起培育时防止膜电位变化的测试化合物被认为是SLC38A9的抑制剂,而导致更大膜去极化的化合物被认为是SLC38A9激活剂。
G.全细胞膜片钳:
通过SLC38A9转运氨基酸和钠可产生可通过全细胞膜片钳检测的电流。在用硼硅酸盐玻璃记录移液管(3-5μM)进行全细胞膜片钳之前,在质膜上过表达SLC38A9或SLC38A9Δ110的神经元或细胞首先针对氨基酸饥饿。外部和内部溶液经调配以与来自SLC38家族的钠依赖性氨基酸转运蛋白的记录电流相容,如本领域所述(The Journal of Biological Chemistry 284,11224-11236,2009)。在存在或不存在测试化合物下以及在存在或不存在氨基酸底物下,在外部溶液中在电压钳(保持电位为-70mV)下记录微型兴奋性突触后电流(mEPSC)的频率和振幅。随后降低兴奋性电流的频率或振幅的化合物被认为是SLC38A9的抑制剂,而增加兴奋性电流的频率或振幅的化合物被认为是SLC38A9的激活剂。
H.内溶酶体膜片钳:
如本领域(Cell.152(4):778-790,2013)中所述,使用从表达与荧光蛋白(例如绿色荧光蛋白(GFP))融合的野生型SLC38A9或SLC38A9Δ110的细胞分离的内溶酶体的直接修补。简言之,在质膜处切割表达与荧光蛋白融合的SLC38A9或SLC38A9Δ110的细胞,并通过SLC38A9或SLC38A9Δ110的其荧光染色鉴别的溶酶体被推出用于膜片钳记录。根据用于测量其它SLC38A家族成员的活性的领域(Cell.152(4):778-790,2013)调配细胞溶质和内腔缓冲液,并且在存在或不存在SLC38A9底物下和在存在和不存在测试化合物下进行兴奋性记录。调节来自钳的兴奋性信号的测试化合物被认为是SCL38A9的调节剂。
I.基于卵母细胞的转运蛋白分析:
根据本领域(J.Biol.Chem.286:20500-20511,2011)分离和显微注射爪蟾卵母细胞,其中体外转录的mRNA对应于SLC38A9、SLC38A9Δ110或对照蛋白的质膜定向形式。将所得卵母细胞置于96孔板的孔中,与Krebs-Ringer HEPES(KRH)缓冲液一起培育。在利用添加冷的KRH缓冲液终止分析之前,于30℃下将卵母细胞与在未标记的和3H-标记的氨基酸底物和氯化钠的组合之前或同时添加的测试化合物一起培育1小时(J.Biol.Chem.286:20500-20511,2011)。终止后,将细胞在10%SDS中溶解并转移至闪烁管中以定量放射性标记的氨基酸摄取。抑制3H-底物摄取的化合物被认为是SLC38A9的抑制剂,而增加3H-底物摄取的化合物被认为是SLC38A9激活剂。
J.闪烁迫近分析:
使用闪烁迫近分析(SPA)测量放射性标记的氨基酸底物与SLC38A9或SLC38A9Δ110的结合。简言之,将N-末端His-标记的SLC38A9或N末端His-标记的SLC38A9Δ110固定在含有闪烁体的铜螯合物荧光微球珠粒上。然后使用如本领域所述的这种蛋白质/珠粒复合物加适当的对照进行放射性标记的底物结合测定(Nature Protocols,7:9,1569-1578,2012)。在放射性标记的底物之前或同时添加测试化合物。降低闪烁计数的化合物被认为是SLC38A9的抑制剂,而增加放射性标记底物结合的化合物被认为是SLC38A9激活剂。
K.基于纳米圆盘的直接结合分析:
SLC38A9或SLC38A9Δ110如本领域所述组装到纳米圆盘中(FEBS Lett.584(9):1721-7,2010)。一旦组装到纳米圆盘中,多肽变得适合于广泛范围的测量小分子和氨基酸底物的直接结合的生物物理分析,包括:
1.固相表面等离子体共振。将含有SLC38A9或SLC38A9Δ110的纳米圆盘通过直接胺偶联或通过与纳米圆盘或SLC38A9或SLC38A9Δ110的N末端融合的亲合标签固定在基质板上。一旦固定,如前所述测量小分子结合(Analytical Biochemistry 408,46-52,2011)。
2.小分子结合的溶液相测量。将含有N-末端表位标记的SLC38A9或SLC38A9Δ110的纳米圆盘与测试化合物一起培育一段时间。将含有蛋白质的纳米圆盘免疫沉淀,并且通过质谱法进行分析保留在溶液中的小分子。这样可以检测和鉴别在与含有SLC38A9的纳米圆盘、而非阴性对照蛋白一起培育时耗尽的小分子。从溶液中化合物耗尽的程度与测试化合物对蛋白质的亲和力相关。
序列
SEQ ID NO:1
>gi|222418629|ref|NP_775785.2|假定钠偶联的天然氨基酸转运蛋白9同种型1[智人]
MANMNSDSRHLGTSEVDHERDPGPMNIQFEPSDLRSKRPFCIEPTNIVNVNHVIQRVSDHASAMNKRIHYYSRLTTPADKALIAPDHVVPAPEECYVYSPLGSAYKLQSYTEGYGKNTSLVTIFMIWNTMMGTSILSIPWGIKQAGFTTGMCVIILMGLLTLYCCYRVVKSRTMMFSLDTTSWEYPDVCRHYFGSFGQWSSLLFSLVSLIGAMIVYWVLMSNFLFNTGKFIFNFIHHINDTDTILSTNNSNPVICPSAGSGGHPDNSSMIFYANDTGAQQFEKWWDKSRTVPFYLVGLLLPLLNFKSPSFFSKFNILGTVSVLYLIFLVTFKAVRLGFHLEFHWFIPTEFFVPEIRFQFPQLTGVLTLAFFIHNCIITLLKNNKKQENNVRDLCIAYMLVTLTYLYIGVLVFASFPSPPLSKDCIEQNFLDNFPSSDTLSFIARIFLLFQMMTVYPLLGYLARVQLLGHIFGDIYPSIFHVLILNLIIVGAGVIMACFYPNIGGIIRYSGAACGLAFVFIYPSLIYIISLHQEERLTWPKLIFHVFIIILGVANLIVQFFM
SEQ ID NO:2
>gi|23273813|gb|AAH36301.1|TMEM192蛋白[智人]
MAAGGRMEDGSLDITQSIEDDPLLDAQLLPHHSLQAHFRPRFHPLPTVIIVNLLWFIHLVFVVLAFLTGVLCSYPNPNEDKCPGNYTNPLKVQTVIILGKVILWILHLLLECYIQYHHSKIRNRGYNLIYRSTRHLKRLALMIQSSGNTVLLLILCMQHSFPEPGRLYLDLILAILALELICSLICLLIYTVKIRRFNKAKPEPDILEEEKIYAYPSNITSETGFRTISSLEEIVEKQGDTIEYLKRHNALLSKRLLALTSSDLGCQPSRT
SEQ ID NO:3
>gi|74752435|sp|Q9BXP2.1|S12A9_人类溶质载体家族12成员9;MASESSPLLAYRLLGEEGVALPANGAGGPGGASARKLSTFLGVVVPTVLSMFSIVVFLRIGFVVGHAGLLQALAMLLVAYFILALTVLSVCAIATNGAVQGGGAYFMISRTLGPEVGGSIGLMFYLANVCGCAVSLLGLVESVLDVFGADATGPSGLRVLPQGYGWNLLYGSLLLGLVGGVCTLGAGLYARASFLTFLLVSGSLASVLISFVAVGPRDIRLTPRPGPNGSSLPPRFGHFTGFNSSTLKDNLGAGYAEDYTTGAVMNFASVFAVLFNGCTGIMAGANMSGELKDPSRAIPLGTIVAVAYTFFVYVLLFFLSSFTCDRTLLQEDYGFFRAISLWPPLVLIGIYATALSASMSSLIGASRILHALARDDLFGVILAPAKVVSRGGNPWAAVLYSWGLVQLVLLAGKLNTLAAVVTVFYLVAYAAVDLSCLSLEWASAPNFRPTFSLFSWHTCLLGVASCLLMMFLISPGAAGGSLLLMGLLAALLTARGGPSSWGYVSQALLFHQVRKYLLRLDVRKDHVKFWRPQLLLLVGNPRGALPLLRLANQLKKGGLYVLGHVTLGDLDSLPSDPVQPQYGAWLSLVDRAQVKAFVDLTLSPSVRQGAQHLLRISGLGGMKPNTLVLGFYDDAPPQDHFLTDPAFSEPADSTREGSSPALSTLFPPPRAPGSPRALNPQDYVATVADALKMNKNVVLARASGALPPERLSRGSGGTSQLHHVDVWPLNLLRPRGGPGYVDVCGLFLLQMATILGMVPAWHSARLRIFLCLGPREAPGAAEGRLRALLSQLRIRAEVQEVVWGEGAGAGEPEAEEEGDFVNSGRGDAEAEALARSANALVRAQQGRGTGGGPGGPEGGDAEGPITALTFLYLPRPPADPARYPRYLALLETLTRDLGPTLLVHGVTPVTCTDL
SEQ ID NO:4
>gi|12644301|sp|P51798.2|CLCN7_人类全=H(+)/Cl(-)交换转运蛋白7;替换名:全=氯化物通道7α亚单位;替换名:全=氯化物通道蛋白7;短=ClC-7
MANVSKKVSWSGRDRDDEEAAPLLRRTARPGGGTPLLNGAGPGAARQSPRSALFRVGHMSSVELDDELLDPDMDPPHPFPKEIPHNEKLLSLKYESLDYDNSENQLFLEEERRINHTAFRTVEIKRWVICALIGILTGLVACFIDIVVENLAGLKYRVIKGNIDKFTEKGGLSFSLLLWATLNAAFVLVGSVIVAFIEPVAAGSGIPQIKCFLNGVKIPHVVRLKTLVIKVSGVILSVVGGLAVGKEGPMIHSGSVIAAGISQGRSTSLKRDFKIFEYFRRDTEKRDFVSAGAAAGVSAAFGAPVGGVLFSLEEGASFWNQFLTWRIFFASMISTFTLNFVLSIYHGNMWDLSSPGLINFGRFDSEKMAYTIHEIPVFIAMGVVGGVLGAVFNALNYWLTMFRIRYIHRPCLQVIEAVLVAAVTATVAFVLIYSSRDCQPLQGGSMSYPLQLFCADGEYNSMAAAFFNTPEKSVVSLFHDPPGSYNPLTLGLFTLVYFFLACWTYGLTVSAGVFIPSLLIGAAWGRLFGISLSYLTGAAIWADPGKYALMGAAAQLGGIVRMTLSLTVIMMEATSNVTYGFPIMLVLMTAKIVGDVFIEGLYDMHIQLQSVPFLHWEAPVTSHSLTAREVMSTPVTCLRRREKVGVIVDVLSDTASNHNGFPVVEHADDTQPARLQGLILRSQLIVLLKHKVFVERSNLGLVQRRLRLKDFRDAYPRFPPIQSIHVSQDERECTMDLSEFMNPSPYTVPQEASLPRVFKLFRALGLRHLVVVDNRNQVVGLVTRKDLARYRLGKRGLEELSLAQT
SEQ ID NO:5
QHKLRKLNPPDESGPGCMSCKCVLS
SEQ ID NO:6
GCCTTGACAACAGTTCTATAT
SEQ ID NO:7
CCTCTACTGTTTGGGACAGTA
SEQ ID NO:8
TGCCCGACAACCACTACCTGA
SEQ ID NO:9
GGGGCCACTAGGGACAGGAT
SEQ ID NO:10
GGCTCAAACTGGATATTCATAGG
SEQ ID NO:11
GGAGCTGGAACTACATGGTCTGG
SEQ ID NO:12
EHNNALRYRL--YNRLD-PGGEHLTMPDHVLPPN
- 还没有人留言评论。精彩留言会获得点赞!