包含N‑乙酰半胱氨酸的细胞培养方法和培养基与流程
与本申请一起提交的ASCII文本文件的以电子方式提交的序列表内容(名称:IL13-310P1_SL.txt;大小:15,073字节;以及创建日期:2014年6月11日)通过引用以其整体结合在此。
背景
许多重要的基于蛋白质的生物治疗剂在细胞培养物中产生。这些治疗剂包括但不限于重组蛋白和抗体治疗剂。与传统的小分子治疗剂相比,在细胞培养物中产生生物治疗剂增加了制造商业产品和临床候选物的成本。重要的限制因素之一是在生产设施中由细胞冷冻贮存物放大生产运行所花费的时间,以及由用于生产重组蛋白和抗体治疗剂的细胞的相对缓慢生长所引起的高度设备占用率和利用率。因此,需要开发增加细胞活力和/或细胞生长率(引起细胞倍增时间减少)以减少生产放大的时间线、设备占用率或利用率并降低成本的优化的细胞培养方法和试剂。通常使用血清或其他动物蛋白成分增强细胞在实验室环境中生长的能力。然而,由于监管担忧或潜在安全性问题,细胞培养基和试剂在生产生物治疗剂时通常并不含有血清或其他动物蛋白成分。动物蛋白组分的去除使得细胞更难以在培养物中生长并且使得细胞更难以由冷冻贮存物解冻并开始生长,从而降低产物产率并增加设备占用率、利用率和成本。因此,准确地说当生产效率变得最重要时,细胞培养基成分受到了限制。因此,本领域面临着对用于产生基于蛋白质的生物治疗剂诸如异源蛋白和抗体治疗剂的细胞系的细胞培养成分进行优化的挑战。实际上,大量培养基组分的参与、细胞代谢途径的复杂性和各种培养基组分与复杂细胞途径之间的相依性通常使得优化细胞培养试剂或方法非常困难。在此背景下,在此提供了包含N-乙酰半胱氨酸(NAC)的细胞培养基和细胞培养方法,该N-乙酰半胱氨酸当被添加到涉及胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞的细胞培养基中和/或被用于涉及这些细胞的细胞培养方法中时出人意料地增加了细胞活力、细胞生长率并减少了细胞倍增时间。
其他人已建议将N-乙酰半胱氨酸作为一般氨基酸来源(参见,例如EP 2351827;在低于在此所用的数量级的量下)或作为一般还原剂(参见,例如,EP1434856、WO2012095731、US20060258003)添加到细胞培养基中,以分别支持T细胞、神经元祖细胞/干细胞、或肌肉祖细胞/干细胞的生长。相比之下,在此提供了包含N-乙酰半胱氨酸的细胞培养基和细胞培养方法,这些细胞培养基和细胞培养方法增加胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞的细胞活力、细胞生长率并减少细胞倍增时间。如在此所述的(参见,例如实例1-6),N-乙酰半胱氨酸当被添加到已含有氨基酸和还原剂的细胞培养基中时出人意料地增加了NSO细胞的细胞活力、细胞生长率并减少细胞倍增时间。
概述
说明书和权利要求书提供了包含N-乙酰半胱氨酸(NAC)的各种细胞培养基和方法,其中下文提供了这些培养基和方法中的一些的概述。根据说明书,一个实施例提供了一种细胞培养方法,该方法包括:(a)提供一种足以支持细胞生长的细胞培养基,其中该细胞培养基包含N-乙酰半胱氨酸;并且(b)在该细胞培养基中培养细胞,其中该细胞是胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞。在另一个实施例中,一种增加细胞活力的方法包括:(a)提供一种足以支持细胞生长的细胞培养基,其中该细胞培养基包含N-乙酰半胱氨酸;并且(b)在该细胞培养基中培养细胞,其中该细胞是胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞。在另一个方面中,一种增加细胞生长率的方法包括:(a)提供一种足以支持细胞生长的细胞培养基,其中该细胞培养基包含N-乙酰半胱氨酸;并且(b)在该细胞培养基中培养细胞,其中该细胞是胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞。在另一个实施例中,一种减少细胞倍增时间的方法包括:(a)提供一种足以支持细胞生长的细胞培养基,其中该细胞培养基包含N-乙酰半胱氨酸;并且(b)在该细胞培养基中培养细胞,其中该细胞是胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞。于在此所披露的方法的一个实施例中,该细胞是胆固醇营养缺陷型细胞。于在此所披露的方法的另一个实施例中,该细胞是骨髓瘤细胞。于在此所披露的方法的另一个实施例中,该细胞是杂交瘤细胞。
在一个实施例中,这些细胞是由冷冻贮存物解冻的。在另一个实施例中,这些细胞处于扩增阶段。在另一个实施例中,该细胞培养基是无血清且无动物蛋白的培养基。在另一个实施例中,该细胞培养基是化学限定培养基。在另一个实施例中,该培养基包含脂质。
在另一个实施例中,这些细胞是来源于哺乳动物。在又一个实施例中,这些哺乳动物细胞是鼠类的、仓鼠的、大鼠的、猴的、或人类的。在另一个实施例中,这些细胞是胆固醇营养缺陷型细胞。在一个实施例中,胆固醇营养缺陷型细胞可以包括NS0、NS1、U937、M19、SRD-12B、SRD-13A、CHO-215、X63细胞、来源于这些细胞系的细胞系、或工程化为胆固醇营养缺陷型细胞的任何其他细胞。在另一个实施例中,这些细胞是NS0细胞。在另一个实施例中,这些细胞是骨髓瘤的或杂交瘤的。
在另一个方面中,细胞培养基包含N-乙酰半胱氨酸、碳水化合物来源、氨基酸来源、以及胆固醇来源。在另一个实施例中,该碳水化合物来源和该氨基酸来源是不同的。在另一个实施例中,该培养基进一步包含脂质。在另一个实施例中,该细胞培养基包含碳水化合物来源、氨基酸来源、胆固醇来源、维生素、无机盐、微量金属、表面活性剂、以及pH缓冲剂。
在又一个实施例中,该细胞培养基包含浓度为从约0.25mM至约3mM的N-乙酰半胱氨酸。在另一个实施例中,该细胞培养基包含浓度为从约0.5至约2.5mM的N-乙酰半胱氨酸。在另一个实施例中,该细胞培养基包含浓度为从约1.0至约1.5mM的N-乙酰半胱氨酸。在另一个实施例中,该细胞培养基包含浓度为约1mM的N-乙酰半胱氨酸。在另一个实施例中,该细胞培养基包含浓度为约1.5mM的N-乙酰半胱氨酸。在又一个实施例中,该细胞培养基包含浓度为至少约0.5mM、至少约1.0mM、至少约1.5mM或至少约2.0mM的N-乙酰半胱氨酸。在另一个实施例中,该细胞培养基包含酵母提取液(yeastolate)。在另一个实施例中,该细胞培养基包含1g/L酵母提取液。
在另一个实施例中,该平均倍增时间比在使用排除N-乙酰半胱氨酸的对照培养基的细胞培养中更短。在另一个实施方案中,该平均倍增时间与无N-乙酰半胱氨酸的细胞培养基相比减少至少10%。在另一个实施方案中,该平均倍增时间与无N-乙酰半胱氨酸的细胞培养基相比减少至少15%。在另一个实施方案中,该平均倍增时间与无N-乙酰半胱氨酸的细胞培养基相比减少至少20%。在另一个实施方案中,该平均倍增时间与无N-乙酰半胱氨酸的细胞培养基相比减少至少25%。在另一个实施方案中,该平均倍增时间与无N-乙酰半胱氨酸的细胞培养基相比减少至少50%。在另一个实施方案中,在含有N-乙酰半胱氨酸的细胞培养基中该平均倍增时间是60小时或更少时间。在另一个实施方案中,在含有N-乙酰半胱氨酸的细胞培养基中该平均倍增时间是42小时或更少时间。在另一个实施方案中,在含有N-乙酰半胱氨酸的细胞培养基中该平均倍增时间是34小时或更少时间。在另一个实施方案中,在含有N-乙酰半胱氨酸的细胞培养基中该平均倍增时间是30小时或更少时间。在另一个实施方案中,在含有N-乙酰半胱氨酸的细胞培养基中该平均倍增时间是29小时或更少时间。
在另一个实施例中,该细胞活力相对于使用排除N-乙酰半胱氨酸的对照培养基的细胞培养有所增加。在另一个实施方案中,该细胞活力与无N-乙酰半胱氨酸的细胞培养基相比增加至少5%。在另一个实施方案中,该细胞活力与无N-乙酰半胱氨酸的细胞培养基相比增加至少7%。在另一个实施方案中,该细胞活力与无N-乙酰半胱氨酸的细胞培养基相比增加至少10%。在另一个实施例中,该细胞活力是至少90%。在另一个实施例中,该细胞活力是至少92%。在另一个实施例中,该细胞活力是至少93%。
在又一个实施例中,这些细胞并不表达一种异源蛋白。在又一个实施例中,这些细胞表达一种异源蛋白。在另一个实施例中,这些细胞用异源核酸转化。在另一个实施例中,该异源核酸是cDNA、载体、质粒、可操作地连接至启动子的核酸、和/或结合到基因组中的核酸。在另一个实施例中,该异源蛋白是瞬时表达的。在另一个实施例中,该异源蛋白是稳定表达的。在另一个实施例中,该异源蛋白是抗体或其抗原结合片段。在另一个实施例中,该抗体或其抗原结合片段是IL-13抗体。在另一个实施例中,该抗体是BAK502G9(由SEQ ID NO 1-2的VH和VL结构域和/或SEQ ID NO 3-8的重链和轻链CDR表示)、BAK278D6(由SEQ ID NO 9-10的VH和VL结构域和/或SEQ ID NO 11-16的重链和轻链CDR表示)、BAK1183H4(由SEQ ID NO 17-18的VH和VL结构域和/或SEQ ID NO 19-24的重链和轻链CDR表示)、或BAK1167F2(由SEQ ID NO 25-26的VH和VL结构域和/或SEQ ID NO 27-32的重链和轻链CDR表示)。
另外的目的和优点将在随后的说明中部分阐述,并且部分目的和优点在说明中将是显而易见的,或可以通过实践来领会。这些目的和优点将通过附加权利要求中特别指出的要素和组合来实现和获得。
应了解,上文的一般说明与下文的详细说明均仅是例示性和解释性的,而并非为权利要求的限制。
附图结合在本说明书中并构成本说明书的一部分,其阐明一个(若干)实施例并且与说明一起用于解释在此所述的原则。
附图简要说明
图1示出表达针对IL-9的单克隆抗体(“mAb”)的NS0细胞系1在无动物蛋白(APF)培养基1中在瓶解冻时的群体倍增时间。用N-乙酰半胱氨酸(NAC)(1.5mM、2.0mM或2.5mM)补充在无动物蛋白(APF)培养基1中解冻的冷冻NS0细胞系1细胞有并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加1.5mM至2.5mM NAC提高了来自瓶解冻的NS0细胞系1的细胞活力,增加了细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔。
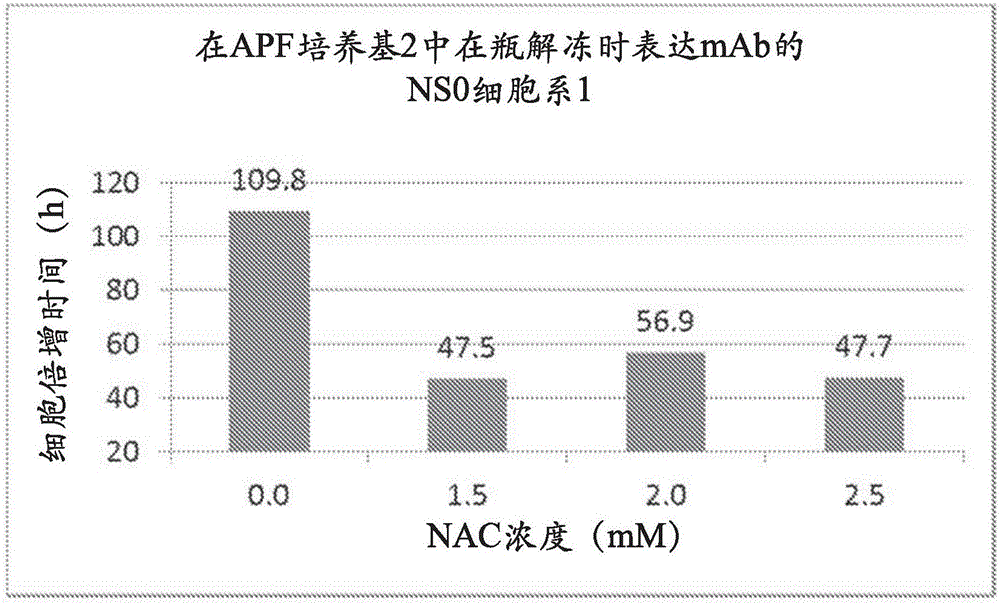
图2示出表达针对IL-9的单克隆抗体(“mAb”)的NS0细胞系1在APF培养基2中在瓶解冻时的群体倍增时间。用N-乙酰半胱氨酸(NAC)(1.5mM、2.0mM或2.5mM)补充在无动物蛋白(APF)培养基1中解冻的冷冻NS0细胞系2细胞有并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加1.5mM至2.5mM NAC提高了来自瓶解冻的NS0细胞系1的细胞活力,增加了细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔。
图3示出表达针对IL-13的单克隆抗体(“mAb”)的NS0细胞系2在APF培养基1中在瓶解冻时的群体倍增时间。用N-乙酰半胱氨酸(NAC)(0.5mM、1.0mM或2.5mM)补充在无动物蛋白(APF)培养基1中解冻的冷冻NS0细胞系2细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加0.5mM至2.5mM NAC提高了来自瓶解冻的NS0细胞系2的细胞活力,增加了细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔。
图2示出表达针对IL-13的单克隆抗体(“mAb”)的NS0细胞系2在APF培养基2中在瓶解冻时的群体倍增时间。用N-乙酰半胱氨酸(NAC)(0.5mM、1.0mM或2.0mM)补充在无动物蛋白(APF)培养基2中解冻的冷冻NS0细胞系2细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加0.5mM至2.0mM NAC提高了来自瓶解冻的NS0细胞系2的细胞活力,增加了细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔。
图5示出表达针对IL-13的单克隆抗体的NS0细胞系2在补充有胆固醇(1X英杰公司(Invitrogen)胆固醇脂质浓缩物)的可商业获得NS0细胞培养基(CD杂交瘤,吉毕科公司(Gibco))中在瓶解冻时的群体倍增时间。用N-乙酰半胱氨酸(NAC)(0.5mM、1.0mM或2.0mM)补充在具有1X胆固醇脂质浓缩物的CD杂交瘤培养基中解冻的冷冻NS0细胞系2细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加0.5mM至2.0mM NAC提高了NS0细胞系2的细胞活力,增加了细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔。
图6示出NS0裸细胞系(不表达重组蛋白的未转染NS0细胞系)在APF培养基2中在瓶解冻时的群体倍增时间。将N-乙酰半胱氨酸(NAC)(0.5mM、1.0mM或1.5mM)补充在无动物蛋白(APF)培养基2中解冻的冷冻NS0裸细胞系细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加0.5mM至1.5mM NAC提高了细胞活力,增加了细胞生长并且减少了瓶解冻时的平均细胞倍增时间。h=小时;mM=毫摩尔。
图7示出表达针对IL-9的单克隆抗体(“mAb”)的NS0细胞系1在APF培养基1中在扩增过程中的群体倍增时间。在补充有N-乙酰半胱氨酸(NAC)(1.5mM、2.0mM或2.5mM)的无动物蛋白(APF)培养基1中培养NS0细胞系1细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加1.5mM至2.0mM NAC增加了NS0细胞系1的细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔;误差棒表示平均倍增时间的标准偏差。
图8示出表达针对IL-9的单克隆抗体(“mAb”)的NS0细胞系1在APF培养基2中在扩增过程中的群体倍增时间。在补充有不同水平的N-乙酰半胱氨酸(NAC)(1.5mM、2.0mM或2.5mM)的无动物蛋白(APF)培养基2中培养NS0细胞系1细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加1.5mM至2.5mM NAC增加了NS0细胞系1的细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔;误差棒表示平均倍增时间的标准偏差。
图9示出表达针对IL-13的单克隆抗体(“mAb”)的NS0细胞系2在APF培养基1中在扩增过程中的群体倍增时间。在补充有N-乙酰半胱氨酸(NAC)(0.5mM、1.0mM或2.5mM)的无动物蛋白(APF)培养基1中培养NS0细胞系2细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加0.5mM至2.5mM NAC增加了NS0细胞系2的细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔;误差棒表示平均倍增时间的标准偏差。
图10示出表达针对IL-13的单克隆抗体(“mAb”)的NS0细胞系2在APF培养基2中在扩增过程中的群体倍增时间。在补充有N-乙酰半胱氨酸(NAC)(0.5mM、1.0mM或2.0mM)的无动物蛋白(APF)培养基2中培养NS0细胞系2细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加0.5mM至2.0mM NAC增加了NS0细胞系2的细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔;误差棒表示平均倍增时间的标准偏差。
图11示出表达针对IL-13的单克隆抗体的NS0细胞系2在补充有胆固醇(1X英杰公司胆固醇脂质浓缩物)的可商业获得NS0细胞培养基(CD杂交瘤,吉毕科公司)中在扩增过程中的群体倍增时间。在补充有N-乙酰半胱氨酸(NAC)(0.5mM、1.0mM或2.0mM)的具有1X胆固醇脂质浓缩物的CD杂交瘤培养基中培养NS0细胞系2细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加1.0mM至2.0mM NAC增加了NS0细胞系2的细胞生长并且减少了平均细胞倍增时间。误差棒的减小还表明细胞生长更加旺盛。h=小时;mM=毫摩尔;误差棒表示平均倍增时间的标准偏差。
图12示出NS0裸细胞系(不表达重组蛋白的未转染NS0细胞系)在APF培养基2中在扩增过程中的群体倍增时间。在补充有N-乙酰半胱氨酸(NAC)(0.5mM、1.0mM或1.5mM)的无动物蛋白(APF)培养基2中培养NS0裸细胞系细胞并且使用在指数生长期过程中的活细胞密度计算平均倍增时间。添加0.5mM至1.5mM NAC增加了NS0裸细胞系的细胞生长并且减少了平均细胞倍增时间。h=小时;mM=毫摩尔;误差棒表示平均倍增时间的标准偏差。
序列说明
表1提供当前实施例中提及的某些序列的列表。
定义
为了更容易地理解本披露,首先定义某些术语。附加的定义在整个详细说明中列出。
在本说明书和随附权利要求书中,除非上下文另外明确说明,否则单数形式“一个/种(a/an)”和“该(the)”包括复数参考对象。术语“一个/一种(a)”(或“一个/一种(an)”)、以及术语“一个或多个/一种或多种(one or more)”和“至少一个/至少一种(at least one)”可以在此可互换地使用。例如,一个细胞可以是指一个单一细胞或一个细胞群。
此外,在此使用“和/或”应当理解为在有或没有另一者的情况下,两个指定的特征或组分中的每一者的特定披露。因此,如在此的短语诸如“A和/或B”中所使用的术语“和/或”旨在包括“A和B”、“A或B”、“A”(单独)、以及“B”(单独)。同样,如在短语诸如“A、B和/或C”中使用的术语“和/或”旨在包括以下方面:A、B以及C;A、B或C;A或C;A或B;B或C;A和C;A和B;B和C;A(单独);B(单独);以及C(单独)。
在说明书和随附权利要求书通篇中与数值结合使用的术语“约”或“大约”表示本领域技术人员熟知并可接受的精确度的区间。一般来说,这种精确度的区间是±5%。
除非另外定义,在此所使用的所有技术和科学术语具有与本披露涉及的领域所属的技术人员通常所理解的相同的意义。例如,生物医学和分子生物学简明词典(Concise Dictionary of Biomedicine and Molecular Biology),Juo,Pei-Show,第2版,2002,CRC出版社;细胞和分子生物学词典(Dictionary of Cell and Molecular Biology),第3版,1999,学术出版社(Academic Press);以及牛津生物化学和分子生物学词典(Oxford Dictionary Of Biochemistry And Molecular Biology),修订版,2000,牛津大学出版社(Oxford University Press)为技术人员提供了本披露中所使用的许多术语的通用词典。
单位、前缀和符号均以它们的国际单位系统(SI)接受形式表示。数值范围包括定义该范围的数字。除非另外指明,否则氨基酸序列以氨基到羧基的方向从左到右书写。在此提供的小标题不是本披露的不同方面或各方面的限制,可以通过作为一个整体参考本说明书来获得这些方面。因此,通过以其全文参考说明书,更完全地定义了就在以下定义的术语。
如在此所用的,术语“N-乙酰半胱氨酸”、“N-乙酰基半胱氨酸”、“N-乙酰基-L-半胱氨酸”或“乙酰基半胱氨酸”(缩写为“NAC”)是指来源于具有连接至氮原子的乙酰基团的半胱氨酸的化合物。N-乙酰半胱氨酸还被称为(2R)-2-乙酰氨基-3-磺酰基丙酸(IUPAC)并且具有616-91-1的化学文摘社(CAS)登记号。N-乙酰半胱氨酸可从不同商业供应商(包括西格玛-奥德里奇公司(Sigma-Aldrich))处获得。
如在此所用的,术语“胆固醇营养缺陷型细胞”是指生长需要胆固醇但不能合成胆固醇的细胞或细胞系。示例性胆固醇营养缺陷型细胞包括但不限于NS0、NS1、U937、M19、SRD-12B、SRD-13A、CHO-215、X63细胞、来源于这些细胞系的细胞系、或工程化为胆固醇营养缺陷型细胞的任何其他细胞。鉴别和/或培养胆固醇营养缺陷型细胞的方法是本领域已熟知的。参见,例如,基恩(Keen)等人,细胞技术学(Cytotechnology)17(3):203-11(1995);乔弗恩(Gorfien)等人,生物技术进展(Biotechnol Prog.)16(5):682-7(2000);付(Fu)等人,美国国家科学院院刊(Proc Natl Acad Sci U S A),102(41):14551-6(2005);伯奇(Birch)等人,先进药物输送评论(Adv Drug Delivery Rev.),58:671–685(2006);冯(Feng)等人,MAbs.2(5):466–477(2010),各文献通过引用以其整体结合在此。
如在此所述的,术语“骨髓瘤”和“骨髓瘤细胞”是指来源于骨髓细胞诸如中幼粒细胞、浆细胞或B细胞的永生化细胞系。示例性骨髓瘤细胞包括但不限于,X63Ag8、Sp2/0、NS1、NS0、J558L、U266、U937、P3U1、XG-1、XG-2、XG-3、XG-4、XG-5、XG-6、XG-7、XG-8、XG-9、U266、RPM1-8226、LP1、L363、OPM1、OPM2、以及NCLH929细胞或来源于这些细胞系的细胞系。鉴别和/或培养骨髓瘤细胞的方法是本领域已熟知的。参见,例如,富勒(Fuller)等人,骨髓瘤细胞的制备(Preparation of Myeloma Cells),当代分子生物学方法(Current Protocols in Molecular Biology),18:11.5.1–11.5.3(2001);张(Zhang)等人,血液(Blood),83(12):3654-3663(1994);以及塔伊(Tai)等人,免疫学方法杂志(J.Immunol.Methods.)235:11-19(2000),各文献通过引用以其整体结合在此。
如在此所用的,术语“杂交瘤”和“杂交瘤细胞”是指通过将B细胞与永生化细胞(例如,骨髓瘤细胞)融合来形成的永生化细胞系。生成和/或培养杂交瘤细胞的方法是本领域已熟知的。参见,例如,科勒(Kohler)和米尔斯坦(Milstein),自然(Nature)256:495(1975);葛尔弗瑞(Galfrè)和米尔斯坦(Milstein),酶学方法(Methods Enzymol.),73(Pt B):3-46(1981);以及高汀(Goding),单克隆抗体:原理和实践(Monoclonal Antibodies:Principles and Practice),学术出版社(Academic Press)(1986),各文献通过引用以其整体结合在此。
如在此所用的,术语“细胞培养基”是指设计为支持来源于多细胞真核生物、特别是动物细胞的细胞生长的液体或基质。培养细胞的示例性细胞培养基和方法描述于多伊尔(Doyle)等人,“哺乳动物细胞培养:必需技术(Mammalian cell culture:essential techniques)”,威利(Wiley),(1997);弗雷谢尼(Freshney),“动物细胞的培养:基本技术和专门应用手册(Culture of Animal Cells:A Manual of Basic Technique and Specialized Applications)”,约翰·威利父子公司(John Wiley&Sons),(2011);以及米纳克什(Meenakshi),“细胞培养基:综述(Cell Culture Media:A Review)”,材料和方法(Mater Methods.),3:175(2013),各文献通过引用以其整体结合在此。
如在此所用的,术语“无血清培养基”是指不含有动物血清诸如胎牛血清、牛血清白蛋白或人血清白蛋白的细胞培养基。如在此所用的,术语“无动物蛋白培养基”是指不含有来自多细胞非植物高等真核生物的蛋白质和/或蛋白质组分诸如白蛋白、转铁蛋白、胰岛素或生长因子的细胞培养基。动物蛋白和蛋白质组分与可从植物获得(通常长度为10-30个氨基酸)或从低等真核生物诸如酵母获得的非动物蛋白、小肽和寡肽区分,这些非动物蛋白、小肽和寡肽可被包含到根据本发明的无动物蛋白细胞培养基中。根据在此披露的方法的无血清且无动物蛋白培养基可以是基于通常技术人员已知的任何基础培养基诸如DMEM、Ham's F12、Medium 199、McCoy或RPMI。基础培养基可以包含许多成分,包括氨基酸、维生素、有机盐和无机盐、以及碳水化合物来源,各种成分均以支持细胞培养的量存在,该细胞通常是本领域技术人员已知的。培养基可以含有辅助物质,诸如缓冲物质如碳酸氢钠、抗氧化剂、抵消机械应力的稳定剂、或蛋白酶抑制剂。在需要时,非离子表面活性剂诸如聚乙二醇和聚丙二醇的混合物(例如,PluronicSERVA)可以作为消泡剂添加。无血清且无动物蛋白培养基的实例是本领域所熟知的,如以下所述的:马里亚尼(Mariani)等人,“商用无血清培养基:杂交瘤生长和单克隆抗体生产(Commercial serum-free media:hybridoma growth and monoclonal antibody production)”,免疫学方法杂志145:175-83(1991);巴尔内斯(Barnes)等人,“用于在无血清培养基中生长培养的细胞的方法(Methods for growth of cultured cells in serum-free medium)”,分析生物化学(Anal Biochem.)102:255-70(1980);维莫斯(Waymouth),“无血清培养基的制备和使用(Preparation and use of serum-free culture media)”在:巴尔内斯DW、西尔巴斯库DA(Sirbasku DA)、萨托GH(Sato GH)编者“用于制备无血清动物细胞培养的培养基、补充剂和基质的方法(Methods for preparation of media,supplements and substrata for serum-free animal cell culture)”纽约:丽丝(Liss);(1984);以及门德尔松(Mendelson)等人,“人淋巴细胞在无血清培养基中的培养(Culture of human lymphocytes in serum-free medium)”,在:巴尔内斯DW、西尔巴斯库DA、萨托GH编者“用于神经元细胞和淋巴样细胞的无血清培养的方法(Methods for serum-free culture of neuronal and lymphoid cells)”,纽约:丽丝;(1984),各文献通过引用以其整体结合在此。
如在此所用的,术语“化学限定培养基”是适用于细胞培养人或动物细胞的细胞生长培养基,其中所有的化学组分均是已知的。
如在此所用的,“足以支持细胞生长的细胞培养基”是指能够支持细胞生长、存活和/或增殖的细胞培养基。通常,“足以支持细胞生长的细胞培养基”包含适当的能源和氨基酸、维生素、盐和/或技术人员通常已知的营养素的补充剂。足以支持细胞生长的示例性细胞培养基包括商业上可获得的培养基、化学限定培养基、无血清培养基、以及无动物蛋白培养基,如技术人员通常所已知的。
如在此所用的,术语“细胞活力”是指细胞存活或发育的能力。通常,测定“细胞活力”需要测量细胞或细胞群存活或发育的能力(包括例如基于总细胞样品测定活细胞或死细胞的数目),如通常技术人员所已知的。细胞活力测定是本领域所熟知的并且包括:细胞溶解或膜泄露测定(例如,使用碘化丙锭、台盼蓝和/或7-氨基放线菌素D)、线粒体活性或半胱天冬酶测定(例如,使用刃天青和/或甲臜)、细胞功能测定(例如,能动性测定、细胞增殖或生长测定)、基因组和/或蛋白质组学测定(例如,测量于细胞死亡、损伤或应激的不同基因或蛋白质的表达)、细胞毒性测定、以及活体染色。参见“分子探针手册荧光探针和标记技术指南(The Molecular Probes Handbook.A Guide to Fluorescent Probes and Labeling Technologies)”(I.约翰逊(I.Johnson)和M.斯彭斯(M.Spence)编辑)第11版,第15章,“用于细胞活力、增殖和功能的测定(Assays for Cell Viability,Proliferation and Function)”,生命技术(Life Technologies)(2010),该文献通过引用以其整体结合在此。
如在此所用的,术语“细胞倍增时间”或“倍增时间”是指细胞或细胞群数目倍增所需要的时间段。细胞或细胞群的倍增时间可以使用以下等式来确定:DT=T ln2/ln(X2/X1),其中DT=倍增时间;T是任何单位的孵育时间;X1是在孵育时间开始时的细胞数目;并且X2是在孵育时间结束时的细胞数目。如在此所用的,当细胞或细胞群的相对生长率是恒定的(例如,在指数生长期或对数期)时测量细胞倍增时间。细胞计数测定是本领域已熟知的并且包括细胞计数;使用计数室(例如,血细胞计数器);使用分光光度计;使用库尔特计数器;使用流式细胞术;或使用显微镜检查法。参见“分子探针手册荧光探针和标记技术指南”(I.约翰逊和M.斯彭斯编辑)第11版,第15章,“用于细胞活力、增殖和功能的测定”,生命技术(Life Technologies)(2010),该文献通过引用以其整体结合在此。
如在此所用的,术语“异源核酸”是指使用标准重组DNA和分子克隆技术引入到细胞中的核酸分子(例如,多核苷酸、cDNA、DNA、RNA或其片段),这些技术包括但不限于以下各项所述的技术:萨姆布鲁克(Sambrook)等人,“分子克隆:实验室手册(Molecular Cloning:A Laboratory Manual)”第二版,冷泉港实验室出版社(Cold Spring Harbor Laboratory Press),冷泉港(Cold Spring Harbor),纽约(1989);西尔哈维(Silhavy)等人,“使用基因融合物的实验(Experiments with Gene Fusions)”,冷泉港实验室出版社,冷泉港,纽约(1984);以及奥苏贝尔,F.M.等人,“当代分子生物学手册(Current Protocols in Molecular Biology)”,由格林出版协会和约翰威立公司(Greene Publishing Assoc.and Wiley-Interscience)出版(1987),各文献通过引用以其整体结合在此。根据本发明的核酸可以包含DNA或RNA并且可以是全部或部分合成。
如在此所用的,术语“转化”或“转化的”是指将核酸分子或其片段转染到宿主细胞中,从而使宿主细胞的子细胞继承该核酸分子或其片段。含有转化的核酸或其片段的宿主细胞在此被称为“转基因”或“重组”或“转化”细胞。
术语“启动子”是指能够控制编码序列或功能RNA的表达的多核苷酸序列。通常,编码序列位于启动子序列的3'处。启动子可以整体来源于天然基因,或者可以由来源于自然界中可见的不同启动子的不同元件组成,或甚至包含合成的DNA片段。本领域技术人员应理解不同启动子可以在不同组织或细胞类型中、或在不同发育阶段、或响应于不同环境或生理条件来引导核酸表达。引起基因大部分时候在大部分细胞类型中表达的启动子通常被称为“组成型启动子”。进一步认识到由于在大部分情况下调节序列的精确边界未完全限定,不同长度的DNA片段可以具有相同的启动子活性。
术语“可操作地连接”是指核酸序列在单一核酸分子上的缔合以使得一者的功能受到另一者的影响。例如,当启动子能够影响编码序列的表达时(即编码序列处于启动子的转录控制下),启动子与该编码序列可操作地连接。编码序列可以在有义取向或反义取向中可操作地连接至调节序列。
术语“质粒”和“载体”是指通常为环状双链DNA片段形式的核酸元件。此类元件可以是来源于任何来源的单链或双链DNA或RNA的线性或环状自主复制序列、基因组整合序列、噬菌体或核苷酸序列,其中许多核苷酸序列已连接或重组到独特结构中,该独特结构能够将针对选定基因产物的启动子片段和DNA序列连同适当3'未翻译序列引入到细胞中。可以选择或构建含有适当调节序列的合适载体,该调节序列包括启动子序列、终止子序列、多聚腺苷酸化序列、增强子序列、标记基因以及视情况而定的其他序列。
如在此所用的,术语“表达”是指来源于本发明的核酸分子的有义(mRNA)或反义RNA的转录和稳定累积。表达还可以是指将mRNA翻译成多肽。
如在此所用的,术语“异源蛋白”是指由异源核酸编码的且在宿主细胞中表达的蛋白质(例如,多肽、肽或其片段)。异源蛋白可以是瞬时表达(例如其中编码异源蛋白的多核苷酸并未结合到宿主细胞基因组中)或稳定表达的(例如其中编码异源蛋白的多核苷酸结合到宿主细胞基因组中)。
如在此使用的,术语“抗体”(或其片段、变体、或衍生物)是指能够结合至抗原的抗体的至少最小部分,例如,在由B细胞产生的典型抗体的情况下,至少重链(VH)的可变结构域和轻链(VL)的可变结构域。脊椎动物系统中的基础抗体结构相对较好理解。参见,例如,哈洛(Harlow)等人,抗体:实验室手册(Antibodies:A Laboratory Manual)(冷泉港实验室出版社,第2版,1988),该文献通过引用以其整体结合在此。
抗体或其抗原结合片段、变体或衍生物包括但不限于多克隆抗体、单克隆抗体、人类抗体、人源化抗体或嵌合抗体、单链抗体、表位结合片段,例如Fab、Fab'和F(ab')2、Fd、Fvs、单链Fvs(scFv)、单链抗体、二硫化物连接的Fvs(sdFv)、包括VL或VH域的片段、由Fab表达文库产生的片段。ScFv分子是本领域已知的并且描述于例如美国专利5,892,019中,该专利通过引用以其整体结合在此。本披露涵盖的免疫球蛋白或抗体分子可以是免疫球蛋白分子的任何类型(例如IgG、IgE、IgM、IgD、IgA、以及IgY)、类别(例如IgG1、IgG2、IgG3、IgG4、IgA1、以及IgA2)或子类。
在此披露的抗体或其抗原结合片段、变体或衍生物可以在抗原的一个或多个表位或一个或多个部分(例如它们识别或特异性结合的靶标多肽)方面来描述或规定。例如,IL-13或抗-IL-13抗体是结合IL-13多肽或其部分的抗体。在一些方面中,抗-IL-13抗体是BAK502G9(例如,包含SEQ ID NO:1和2的抗-IL-13抗体)。在一个实施例中,该抗体是BAK502G9(由SEQ ID NO 1-2的VH和VL结构域和/或SEQ ID NO 3-8的重链和轻链CDR表示)、BAK278D6(由SEQ ID NO 9-10的VH和VL结构域和/或SEQ ID NO 11-16的重链和轻链CDR表示)、BAK1183H4(由SEQ ID NO 17-18的VH和VL结构域和/或SEQ ID NO 19-24的重链和轻链CDR表示)、或BAK1167F2(由SEQ ID NO 25-26的VH和VL结构域和/或SEQ ID NO 27-32的重链和轻链CDR表示)。
其他可以使用的抗-IL-13单克隆抗体包括于2012年3月1日公开的美国专利申请公开号2012-0052060中所描述的那些,该专利通过引用以其整体结合在此。其他IL-13抗体包括而不限于抗-人类-IL-13抗体,例如来金珠单抗(MILR1444A/RG3637,罗氏(Roche)/基因泰克公司(Genentech))、ABT-308(阿伯特公司(Abbott))、GSK679586(葛兰素史克公司(GlaxoSmithkline))、或QAX576(诺华公司(Novartis))。如本领域已熟知的,可以适于本领域已知的不同技术在细胞中产生抗体,包括抗-IL13抗体。参见,例如,单克隆抗体,杂交瘤:生物分析的新尺寸(Monoclonal Antibodies,Hybridomas:A New Dimension in Biological Analyses),肯尼特(Kennet)等人(编辑)普莱纽姆出版社(Plenum Press),纽约(1980);以及抗体:实验室手册(Antibodies:A Laboratory Manual),哈洛和拉内(编辑),冷泉港实验室出版社,冷泉港,纽约(1988)。
实施方式说明
I.细胞培养基
细胞培养是将从动物中取出的细胞、组织或器官置于促进其存活、生长和/或增殖的人工环境中的过程。细胞最佳生长的基本环境要求包括:适合的器皿、供应营养素(包括但不限于,氨基酸、碳水化合物、维生素、矿物质、生长因子、激素等中的至少一种)的细胞培养/生长培养基、以及控制的生理化学环境(以控制例如pH、渗透压、温度、O2、CO2等)一些细胞是贴壁依赖性的并且必须在附接至固体或半固体基底(贴壁或单层培养)时培养,而其他细胞可以漂浮在培养基中生长(悬浮培养)。在细胞培养中的一个步骤是选择适当的生长培养基。根据在此所披露的实施例的细胞培养基或细胞培养方法包括足以支持细胞生长的包含N-乙酰半胱氨酸的细胞培养基。在一个实施例中,该细胞培养基是无血清且无动物蛋白的培养基。在一个实施例中,该细胞培养基是化学限定培养基。在另一个实施例中,N-乙酰半胱氨酸被添加到商业上可获得的细胞培养基中。在一个实施例中,商业上可获得的细胞培养基是用于NS0细胞的NS0无血清培养基(可从西格玛-奥德里奇公司获得,目录号H4281)、CD杂交瘤培养基(西格玛-奥德里奇公司,目录号H4409)、用于杂交瘤细胞的Ex-细胞620-HSF无血清培养基(西格玛-奥德里奇公司,目录号14621C)、用于NS0的Ex-细胞NS-无血清培养基(西格玛-奥德里奇公司,目录号14650C)、DMEM(西格玛-奥德里奇公司,目录号D567)、伊斯科夫改良杜尔贝科培养基(Iscove’s Modified Dulbecco’s Medium)(IMDM)(可从西格玛-奥德里奇公司获得,目录号I3390)、RPMI-1640培养基(西格玛-奥德里奇公司,目录号R8005)、杂交瘤-SFM(生命技术公司,目录号12045076)、CD杂交瘤AGT培养基(生命技术公司,目录号12372025)、CD杂交瘤培养基(可从生命技术公司获得,目录号11278023)、PFHM-II无蛋白质杂交瘤培养基(生命技术公司,目录号12040077)、Nutridoma-SP(罗氏公司,目录号11011374001))、UltraDOMA-PF杂交瘤培养基(龙沙公司,目录号12-727F)、UltradDOMA无血清杂交瘤培养基(龙沙公司,目录号12-723B)、Hyclone PF-Mab培养基(GE生命科学公司(GE Life Sciences),SH30138.05)、Hyclone SFM4MAb培养基(GE生命科学公司SH30391.02)、Hyclone SFM4Mab-实用性培养基(GE生命科学公司,目录号SH30382.02)、Hyclone ADCF-Mab培养基(GE生命科学公司,目录号SH30349.02)、Hyclone CCM1培养基(GE生命科学公司,SH30043.03)、HyClone CCM4MAb培养基(GE生命科学公司,SH30800.06)、Hyclone CDM4NS0培养基(GE生命科学公司,SH30478.06)、以及类似培养基。在另一个实施例中,N-乙酰半胱氨酸被添加到由组分成分与作为培养基基底的无菌去离子水制成的细胞培养基中。
A.N-乙酰半胱氨酸
N-乙酰半胱氨酸被添加到在此所述的细胞培养基或细胞培养方法中以增加细胞活力、细胞生长率并且/或者减少细胞倍增时间。虽然不受任何特定理论的限制,但是认为N-乙酰半胱氨酸通过防止细胞产生自由基、防止细胞膜破裂、和/或防止其他细胞培养基成分(包括但不限于脂质(诸如胆固醇))氧化来提供细胞在培养基中生长的益处。
在一个实施例中,如在此所述的细胞培养基或细胞培养方法包含浓度为从约0.25mM至约3mM、从约0.5mM至约2.5mM、从约0.5mM至约2.0mM、从约0.5mM至约1.5mM、从约0.5mM至约1.0mM、从约1.0mM至约2.5mM、从约1.0mM至约2.0mM、从约1.0mM至约1.5mM、从约1.5mM至约2.5mM、或从约1.5mM至约2.0mM的N-乙酰半胱氨酸。在一个实施例中,如在此所述的细胞培养基或细胞培养方法包含浓度为约1mM的N-乙酰半胱氨酸。在另一个实施例中,如在此所述的细胞培养基或细胞培养方法包含浓度为约1.5mM的N-乙酰半胱氨酸。在另一个实施例中,如在此所述的细胞培养基或细胞培养方法包含浓度为约2.0mM的N-乙酰半胱氨酸。在另一个实施例中,如在此所述的细胞培养基或细胞培养方法包含浓度为约2.5mM的N-乙酰半胱氨酸。在另一个实施例中,如在此所述的细胞培养基或细胞培养方法包含浓度为约0.5mM的N-乙酰半胱氨酸。在又一个实施例中,如在此所述的细胞培养基或细胞培养方法包含浓度为至少约0.5mM、至少约1.0mM、至少约1.5mM、至少约2.0mM或至少约2.5mM的N-乙酰半胱氨酸。
B.其他细胞培养基组分
在一些实施例中,在此所述的细胞培养基或细胞培养方法进一步包含碳源、氮源、和/或磷源。这些组分可以通过相同成分或不同成分来提供。在一些实施例中,在此所述的细胞培养基或细胞培养方法进一步包含碳源、氮源、磷源、和/或矿物盐类。适用于在此所述的细胞培养基或细胞培养方法中的碳源包括碳水化合物(诸如糖)或氨基酸诸如L-谷氨酰胺和/或丙酮酸盐或其任何组合。在一个实施例中,在此所述的细胞培养基或细胞培养方法进一步包含碳水化合物和氨基酸。在一个实施例中,在此所述的细胞培养基或细胞培养方法进一步包含盐、维生素、代谢性前体、生长因子、激素、以及微量元素中的至少一种。在一些实施例中,在此所述的细胞培养基或细胞培养方法进一步包含基础培养基,该基础培养基含有氨基酸、维生素、无机盐、以及碳源诸如葡萄糖。
1.碳水化合物
适用于在此所述的细胞培养基或细胞培养方法中的示例性碳水化合物包括葡萄糖、半乳糖、海藻糖、葡糖胺、甘露糖、棉子糖、果糖、核糖、葡糖醛酸、乳糖、麦芽糖、蔗糖、松二糖、适用于本领域通常已知的细胞培养的任何其他碳水化合物、或其任何组合。在一个方面中,碳水化合物可以是葡萄糖或半乳糖。
2.氨基酸
适用于在此所述的细胞培养基或细胞培养方法中的示例性氨基酸包括一种或多种必需氨基酸(即组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、苏氨酸、色氨酸、和/或缬氨酸)、和/或一种或多种非必需氨基酸(即丙氨酸、精氨酸、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨酸、丝氨酸、酪氨酸、以及天冬酰胺)、和/或其必需氨基酸和非必需氨基酸的任何组合。对于某些细胞,一些非必需氨基酸是必需氨基酸,因为该细胞并不具有合成该氨基酸的能力。例如,NS0细胞缺乏内源性谷氨酰胺合成酶或含有极低水平的该酶并且这样谷氨酰胺是NS0细胞的必需氨基酸,除非在异源蛋白的表达系统中包含谷氨酰胺合成酶。
氨基酸一词,在本披露中包括任何氨基酸,包括但不限于D-氨基酸或L-氨基酸和非基本氨基酸。因此,术语氨基酸涵盖了具有氨基(-NH2)和羧基(-COOH)官能团的任何有机化合物。
3.脂质
在一个实施例中,在此所述的细胞培养基或细胞培养方法进一步包含脂质。适用于在此所述的细胞培养基或细胞培养方法中的示例性脂质包括以下各项中的一种或多种:胆固醇、花生四烯酸、醋酸生育酚、亚油酸、亚麻酸、肉豆蔻酸、油酸、棕榈酸、棕榈油酸、硬脂酸、磷脂(诸如磷脂酰胆碱)、适用于通常本领域已知的细胞培养中的任何其他脂质、或其任何组合。还可以任选地包含肌醇作为膜磷脂组分。合成的或植物来源的脂质也可以任选地用于其中希望培养基不含动物来源的组分的应用中。脂质可以添加在环糊精基脂质补充剂中。环糊精可以用于溶解脂质和/或其他成分诸如脂溶性维生素和激素。
胆固醇可以合成地产生或者它可以是动物来源的。例如,胆固醇可以从绵羊毛中分离。无动物蛋白的培养基可以含有来源于动物来源的胆固醇。在一些实施例中,胆固醇是从商业来源获得的。参见,例如,来自吉毕科公司的化学限定浓缩物;来自SAFC的脂质浓缩物。胆固醇可以作为合成胆固醇(诸如但不限于SyntheCholTM)、作为胆固醇纳米颗粒(参见,例如,吴(Wu)等人,NS0细胞在具有胆固醇纳米颗粒补充剂的分批培养基中的产生增强(Enhanced Productivity of NS0cells in fed-batch culture with cholesterol nanoparticle supplementation),生物技术进展(Biotechnology Progress)27(3):796-802(2011))或通过适用于本领域通常已知的细胞培养的任何装置以胆固醇-环糊精溶液添加到培养基中。
在一个实施例中,培养基可以含有从约1至约10g/L的胆固醇。在另一个实施例中,培养基可以含有从约1至约5g/L的胆固醇。在另一个实施例中,培养基可以含有从约1.5至约4g/L的胆固醇。在另一个实施例中,培养基可以含有从约2至约3g/L的胆固醇。在另一个实施例中,培养基可以含有约2.5g/L的胆固醇。在另一个实施例中,培养基可以含有至少约1g/L的胆固醇、至少约2.5g/L的胆固醇或至少约5g/L的胆固醇。
在另一个实施例中,培养基可以含有除胆固醇之外的脂质。在一个实施例中,培养基可以含有磷脂。在另一个实施例中,培养基可以含有磷脂酰胆碱。在一个实施例中,培养基可以含有从约1至约10g/L的磷脂酰胆碱。在另一个实施例中,培养基可以含有从约1至约5g/L的磷脂酰胆碱。在另一个实施例中,培养基可以含有从约1.5至约4g/L的磷脂酰胆碱。在另一个实施例中,培养基可以含有从约2至约3g/L的磷脂酰胆碱。在另一个实施例中,培养基可以含有约2.5g/L的磷脂酰胆碱。
4.盐
在一个实施例中,在此所述的细胞培养基或细胞培养方法进一步包含盐。适用于在此所述的细胞培养基或细胞培养方法中的示例性盐包括氯化钙、氯化镁、氯化钾、氯化钠、硝酸钾、适用于本领域通常已知的细胞培养的任何其他盐、或其任何组合中的至少一种。
在另一个实施例中,在此所述的细胞培养基或细胞培养方法并不包含氯化钙或氯化镁。此实施例在希望细胞解离或释放时具有优点,因为钙或镁促进细胞粘附。
5.维生素
在一个实施例中,在此所述的细胞培养基或细胞培养方法进一步包含维生素。适用于在此所述的细胞培养基或细胞培养方法中的示例性维生素包括脂溶性维生素、维生素A、维生素D、维生素E、维生素K、维生素B1(硫胺素)、维生素B2(核黄素)、维生素B3(烟酰胺)、维生素B5(泛酸)、维生素B6(吡哆醛、吡哆胺、和/或吡哆素)、维生素B9(叶酸)、适用于本领域通常已知的细胞培养的任何其他维生素、或其任何组合。
6.生长因子和激素
在一个实施例中,至少一种激素可以添加到在此所述的细胞培养基或细胞培养方法中。在一个实施例中,激素可以选自以下至少一种:地塞米松、促红细胞生成素、雌二醇、氢化可的松、胰岛素、黄体酮、生长抑素、甲状腺素(T4)、三碘甲腺氨酸(T3)、活化素、BMP4、BMP7、BMPR1A、Cripto、FLT3配体、HGF、IGF、EGF、FGF、PDGF、IGFBP4、舒血管素(kallekrein)、LEFTY-A、NGF、TGFβ、VEGF、或适用于本领域通常已知的细胞培养的任何其他激素或生长因子。
7.微量元素
在一个实施例中,至少一种微量元素可以添加到在此所述的细胞培养基或细胞培养方法中。在一个实施例中,微量元素可以是以下至少一种:锌、铁、铜、硒、镁、锰、钼、锡、镍、或适用于本领域通常已知的细胞培养的任何其他微量元素。
8.表面活性剂
在一个实施例中,在此所述的细胞培养基或细胞培养方法进一步包含至少一种表面活性剂。适用于在此所述的细胞培养基或细胞培养方法中的示例性表面活性剂包括吐温-80、普朗尼克F-68、或适用于本领域通常已知的细胞培养的任何其他表面活性剂。
9.缓冲剂
在一个实施例中,在此所述的细胞培养基或细胞培养方法进一步包含至少一种pH缓冲剂。适用于在此所述的细胞培养基或细胞培养方法中的示例性缓冲剂包括碳酸氢钠、硼酸、柠檬酸、二硫苏糖醇、乙醇胺、甘油磷酸酯、柠檬酸钾、磷酸钾、乙酸钠、氯化钠、磷酸钠、来自小麦的淀粉、HEPES、氯化钙、MOPS、或适用于本领域通常已知的细胞培养的任何其他缓冲剂、或其任何组合。
10.其他成分
在一个实施例中,在此所述的细胞培养基或细胞培养方法进一步包含非动物来源的水解产物。例如,植物或酵母水解产物提供了包含氨基酸、短肽、碳水化合物、维生素、核苷、以及矿物质的蛋白质消化物,从而为培养基提供各种营养补充剂。例如,可以采用一种酵母水解产物即酵母提取液。酵母提取液是肽、氨基酸、碳水化合物、脂质、金属和维生素的混合物。它可以除分别提供的那些成分之外或代替分别提供的那些成分来添加。在一个实施例中,该细胞培养基包含1g/L酵母提取液。
在一个实施例中,托酚酮也可以添加到在此所述的细胞培养基或细胞培养方法中。在另一种模式中,核苷也可以添加到在此所述的细胞培养基或细胞培养方法中。在另一个实施例中,β-巯基乙醇也可以添加到在此所述的细胞培养基或细胞培养方法中。在另一个实施例中,抗生素也可以添加到在此所述的细胞培养基或细胞培养方法中。
在一些实施例中,在此所述的细胞培养基或细胞培养方法含有NAC、氨基酸、维生素、脂质、碳水化合物、pH缓冲剂、微量金属、无机盐、以及表面活性剂。在一个实施例中,该脂质是胆固醇。
II.细胞培养方法
A.细胞类型
各种细胞类型诸如胆固醇营养缺陷型细胞、骨髓瘤细胞和杂交瘤细胞可以用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养。在一个实施例中,正在培养的细胞来源于哺乳动物,包括但不限于,来源于小鼠、大鼠、人类、猴、仓鼠、兔等的细胞。
如在此所用的,术语“胆固醇营养缺陷型细胞”是指生长需要胆固醇但不能合成胆固醇的细胞或细胞系。在一个实施例中,胆固醇营养缺陷型细胞是NS0、NS1、U937、M19、SRD-12B、SRD-13A、CHO-215、X63细胞、来源于这些细胞系的细胞系、或工程化为胆固醇营养缺陷型细胞的任何其他细胞。在另一个实施例中,这些细胞是NS0细胞。
在一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞是胆固醇营养缺陷型细胞。在一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞是NS0细胞。在一个实施例中,这些细胞是NS1、U937、M19、SRD-12B、SRD-13A、CHO-215、X63细胞、来源于这些细胞系的细胞、或工程化为胆固醇营养缺陷型细胞的任何其他细胞。在另一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞是胆固醇营养缺陷型的鼠骨髓瘤细胞。在一个实施例中,这些细胞是胆固醇营养缺陷型哺乳动物骨髓瘤细胞。在一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞是胆固醇营养缺陷型的人骨髓瘤细胞。
在一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞是骨髓瘤细胞。在另一个实施例中,这些细胞是X63Ag8、Sp2/0、NS1、NS0、J558L、U266、U937、P3U1、XG-1、XG-2、XG-3、XG-4、XG-5、XG-6、XG-7、XG-8、XG-9、U266、RPM1-8226、LP1、L363、OPM1、OPM2、以及NCLH929细胞或来源于这些细胞系的细胞系。在另一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞是杂交瘤细胞。在一些方面中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的杂交瘤细胞表达并且/或者分泌抗体。
B.生物治疗剂
在一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞(例如,胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞,包括NS0细胞)在并不诱导并且/或者表达重组蛋白或异源蛋白的情况下培养。在一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞(例如,胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞,包括NS0细胞)用异源核酸(包括但不限于,cDNA、质粒、载体、可操作地连接至启动子的核酸、和/或瞬时表达异源核酸并且/或者将异源核酸结合到细胞系基因组中的核酸)转化。在另一种方法中,这些细胞表达一种重组蛋白或异源蛋白。在一种方法中,这些细胞过度表达该重组蛋白或异源蛋白。表达各种各样的异源序列的细胞系可以受益于本发明细胞培养基和培养方法。
在一个实施例中,该异源蛋白是瞬时表达的。在另一个实施例中,该异源蛋白是稳定表达的。
在一个实施例中,该异源蛋白不是抗体或其抗原结合片段。在一个实施例中,该异源蛋白是血液因子、抗凝剂、溶血栓药、促红细胞生成素、干扰素、激素、酶、疫苗、生长因子、和/或融合蛋白。
在另一个实施例中,适合于用包含N-乙酰半胱氨酸的当前披露的细胞培养基培养的细胞(例如,胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞,包括NS0细胞)表达一种异源蛋白,其中该异源蛋白是抗体或其抗原结合片段。在一个实施例中,该抗体或其抗原结合片段特异性结合IL-13或特异性结合IL-9。在另一个实施例中,该抗体或抗原结合片段是US 7,947,273、US 7,354,584或US 7,371,383中披露的抗体或抗原结合片段,这些专利各自通过引用以其整体结合在此。在另一个实施例中,该抗体是BAK502G9(包含SEQ ID NO 1和2)。在另一个实施例中,该抗体或其抗原结合片段具有与BAK502G9相同的CDR(包含重链CDR(SEQ ID NO:3-5)和轻链CDR(SEQ ID NO:6-8))。在另一个实施例中,该抗体或抗原结合片段具有包含SEQ ID NO:1、9、17或25中任一种的重链可变区和包含SEQ ID NO:2、10、18或26中任一种的轻链可变区。在另一个实施例中,该抗体或抗原结合片段具有包含以下各项的重链可变区:(a)选自SEQ ID NO:3、11、19和27的HC CDR1;(b)选自SEQ ID NO:4、12、20和28的HC CDR2;以及(c)选自SEQ ID NO:5、13、21和29的HC CDR;以及包含以下各项的轻链可变区:(a)选自SEQ ID NO:6、14、22和30的LC CDR1;(b)选自SEQ ID NO:7、15、23和31的LC CDR2;以及(c)选自SEQ ID NO:8、16、24和32的LC CDR3。在另一个实施例中,该抗体或抗原结合片段包含表1中所述的重链可变区(VH)和/或轻链可变区(VL)。或者包含一组6个表1中所述的CDR。
在另一个实施例中,该抗体或抗原结合片段具有包含与SEQ ID NO:1、9、17或25中任一种约70%、约75%、约80%、约85%、约90%、约92%、约93%、约94%、约98%、或约99%相同的序列的重链可变区和包含与SEQ ID NO:2、10、18或26中任一种约70%、约75%、约80%、约85%、约90%、约92%、约93%、约94%、约98%、或约99%相同的序列的轻链可变区。在另一个实施例中,该抗体或抗原结合片段具有包含以下各项的重链可变区:(a)与选自SEQ ID NO:3、11、19或27的序列相比具有一个突变的HC CDR1;(b)与选自SEQ ID NO:4、12、20和28的序列相比具有一个或两个突变的HC CDR2;以及(c)与选自SEQ ID NO:5、13、21和29的序列相比具有一个或两个突变的HC CDR3;以及包含以下各项的轻链可变区:(a)与选自SEQ ID NO:6、14、22和30的序列相比具有一个突变的LC CDR1;(b)与选自SEQ ID NO:7、15、23和31的序列相比具有一个或两个突变的LC CDR2;以及(c)与选自SEQ ID NO:8、16、24和32的序列相比具有一个或两个突变的LC CDR3;在另一个实施例中,该抗体或抗原结合片段具有包含与表1中所述的VH和/或VL序列约70%、约75%、约80%、约85%、约90%、约92%、约93%、约94%、约98%或约99%相同的重链可变区(VH)和/或轻链可变区(VL)。在一些实施例中,该抗体或抗原结合片段具有CDR中与表1中所述的任一种CDR相比的一个或两个突变。
在另一个实施例中,该抗体或其抗原结合片段特异性结合糖蛋白IIb/IIIa、IL-2受体(诸如IL-2受体a)、TNF-α、RSV、RSV的F蛋白表位、CD33、表皮GF受体、T-细胞VLA4受体、补体蛋白C5、IL-1、IL-9、IL-12、IL-13、IL-23、CD-20、和/或BAFF。
在另一个实施例中,该抗体或其抗原结合片段是奥法木单抗、贝利木单抗、吉妥珠单抗奥佐米星、帕利珠单抗、那他珠单抗、西妥昔单抗、康纳单抗、英利昔单抗、阿昔单抗、巴利昔单抗、达利珠单抗、依库珠单抗、或优特克单抗。
C.细胞培养过程
在一个实施例中,细胞培养方法包括提供足以支持细胞生长的细胞培养基,其中该细胞培养基包含N-乙酰半胱氨酸;并且在该细胞培养基中培养一种细胞,其中该细胞是胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞。在一个实施例中,该方法是一种通过以下各项来增加细胞活力、增加细胞生长率、和/或减少细胞的细胞倍增时间的方法:提供足以支持细胞且包含N-乙酰半胱氨酸的细胞培养基;并且在该细胞培养基中培养细胞,其中该细胞是胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞。
在一个实施例中,这些细胞在37℃下在5%CO2和85%相对湿度下培养。在一个实施例中,pH可以是从6.8至7.4。还可以使用本领域通常已知的其他可接受条件。
在一个方面中,当从冷冻贮存物到大生物反应器来放大生产时,发生细胞培养。在一个方面中,在细胞传代时改进的培养基允许至少四倍的分流比(即将含有有待传代的细胞的1X细胞培养基与不含有这些细胞的3X新鲜细胞培养基混合)。在另一个方面中,它允许五倍的分流比、六倍的分流比或七倍的分流比。
在一个实施例中,这些细胞在100L生物反应器中培养,然后转移到500L生物反应器中,并且然后转移到2500L生物反应器中。
在一个实施例中,这些细胞(例如,胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞)是由冷冻贮存物解冻。在一个实施例中,这些细胞(例如,胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞)处于扩增阶段。在另一个实施例中,这些细胞(例如,胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞)以分批方式、补料分批方式、连续培养、灌注来生长或在整合的生物反应器-纯化单元中生长。
D.对细胞培养效率的影响
本发明细胞培养方法和/或培养基可以提供多种优点。在一种情况下,它使细胞(例如,胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞诸如NS0细胞)在容器(诸如生物反应器)中生长所需要的时间与无N-乙酰半胱氨酸的细胞培养基相比减少至少约10%到至少约50%(例如,至少约10%、15%、约20%、约25%、约30%、约35%、约40%、约45%、或约50%)。在一个实施例中,这是通过计算获得所希望的每体积细胞计数所需要的时间段来确定的。
在另一个实施例中,细胞培养方法和/或培养基使得用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的平均细胞倍增时间与在用排除N-乙酰半胱氨酸的对照培养基的细胞培养中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比有所减少。在另一个实施例中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的平均细胞倍增时间与在用排除N-乙酰半胱氨酸的对照培养基的细胞培养中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比更短。在另一个实施例中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的平均和/或中间细胞倍增时间与在无N-乙酰半胱氨酸的细胞培养基中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比减少至少约10%到至少约50%(例如,至少约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、或约50%)。在一个方面中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的平均和/或中间细胞倍增时间小于或等于60小时至小于或等于约29小时(例如,小于或等于约60小时、约42小时、约34小时、约30小时、或约29小时)或者约小于或约等于图1-图12中报道的任一个平均细胞倍增时间。
在一个实施例中,细胞倍增时间可以是通过在给定时间间隔内计数给定细胞培养基中的细胞并在图中绘制数据来确定。平均倍增时间可以是通过使用等式DT=T ln2/ln(X2/X1)对多次重复培养中指数生长期的倍增时间值取平均值来计算,其中DT=倍增时间,T是任何单位的孵育时间;X1是在孵育时间开始时的细胞数目,并且X2是在孵育时间结束时的细胞数目。
在另一个实施例中,细胞培养方法和/或培养基使得用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的细胞生长率与在用排除N-乙酰半胱氨酸的对照培养基的细胞培养中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比有所增加。在另一个实施例中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的细胞生长率与在用排除N-乙酰半胱氨酸的对照培养基的细胞培养中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比更高。在另一个实施例中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的细胞生长率与在无N-乙酰半胱氨酸的细胞培养基中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比增加至少约10%到至少约50%(例如,至少约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、或约50%)。
在一个实施例中,细胞生长可以是使用细胞计数方法来确定的。在一个实施例中,获得细胞培养基的样品体积并且计数该体积中的细胞。可以在血球计数器中或用库尔特粒度仪进行细胞计数。另一种方法绘制了细胞数目针对时间的图,其中培养的图步进斜率显示提高的生长率。
在另一个实施例中,在此披露的细胞培养方法和/或培养基使得胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的细胞活力相对于在用排除N-乙酰半胱氨酸的对照培养基的细胞培养中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)有所增加。在另一个实施例中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的细胞活力与在用排除N-乙酰半胱氨酸的对照培养基的细胞培养中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比更高。在另一个实施例中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的细胞活力与在无N-乙酰半胱氨酸的细胞培养基中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比增加至少约5%到至少约15%(例如,至少约5%、约7%、约10%、约12%、或约15%)。在另一个方面中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)的细胞活力是至少约85%到至少约95%(例如,至少约85%、约88%、约90%、约92%、约93%、约94%、或约95%)。
在一个实施例中,细胞活力可以是通过台盼蓝排除活力测定法来测定。在这种测定中,可以将细胞悬浮液与磷酸盐缓冲液中的0.4%台盼蓝混合并且使用血球计数器计数细胞。活细胞出现为圆形的折射体而无任何蓝色显色,而死细胞吸收染料并且出现为蓝色。活力可以被表示为活细胞相对于所计数的总细胞的百分比,其中活细胞是其膜的完整性在台盼蓝排除活性测定中仍能够防止台盼蓝吸收的细胞。
在另一个实施例中,使用在此披露的细胞培养方法和/或培养基获得增加的蛋白质产率,诸如增加的异源蛋白表达。在另一个实施例中,在用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)中重组蛋白或异源蛋白的表达与在用排除N-乙酰半胱氨酸的对照培养基的细胞培养中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比更高。在另一个实施例中,用包含N-乙酰半胱氨酸的细胞培养方法和/或培养基培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)显示与在无N-乙酰半胱氨酸的细胞培养基中培养的胆固醇营养缺陷型细胞、骨髓瘤细胞或杂交瘤细胞(例如,NS0细胞)相比至少约10%到至少约200%(例如,至少约10%、20%、30%、40%、50%、60%、70%、80%90%、100%、150%、200%)更高的蛋白质表达。
现在将详细参考当前的示例性实施例,其实例示出在附图中。只要可能,将贯穿整个附图使用相同的参考数字来指代相同或类似部件。通过考虑在此披露的说明和实践,其他实施例对于本领域技术人员也是显而易见的。在以下实例中进一步解释这些实施例。这些实例并非限制权利要求的范围,仅用来说明某些实施例。目的在于,说明书和实例仅被认为是示例性的,其中本发明的真正范围和精神将由以下权利要求指出。
实例
实例1.NS0细胞系1在APF培养基1和2中在瓶解冻时的细胞倍增时间
为研究N-乙酰半胱氨酸对解冻复苏、细胞活力、细胞生长以及随后传代时的细胞倍增时间的作用,使用以下方法。研究在一至三种不同无动物蛋白(“APF”)培养基中培养的三种不同NS0细胞系,以研究N-乙酰半胱氨酸(NAC)对瓶解冻时和常规细胞扩增过程中的细胞生长的作用。这些细胞系之一是未转化为表达重组蛋白的NS0裸宿主细胞(NS0裸细胞系)。另外两种NS0细胞系被工程化为表达治疗性重组蛋白:NS0细胞系1(表达抗-IL-9抗体)和NS0细胞系2(表达抗-IL-13抗体BAK502G9)。NS0细胞系1在补充有范围为1.5mM至2.5mM的不同浓度的NAC的两种不同APF培养基(APF培养基1或APF培养基2)中解冻并扩增。NS0细胞系2在补充有范围为0.5mM至2.5mM的NAC的三种不同的APF培养基(APF培养基1、APF培养基2或商业上可获得的NS0细胞培养基(CD杂交瘤+来自英杰公司/吉毕科公司的胆固醇))中解冻并扩增,而未转化的宿主细胞系(NS0裸细胞系)在补充有范围为0.5mM至1.5mM的NAC的APF培养基2中解冻。从西格玛公司获得NAC并且将其直接添加到培养基中或者以100mM浓度溶解于水中,之后以适当浓度添加到培养基中。所有三种培养基(APF培养基1、APF培养基2、以及CD杂交瘤+来自英杰公司/吉毕科公司的胆固醇)均支持NS0细胞的生长,如图1-图12中所示的。APF培养基1和APF培养基2含有标准细胞培养组分,包括:氨基酸、维生素、脂质、糖、小肽、pH缓冲剂、微量金属、无机盐、核苷、核苷前体、表面活性剂、还原剂、胆固醇、脂质以及抗氧化剂。
在瓶解冻之前,将培养基的温度和pH在6%CO2孵育箱中在37℃下平衡最少1小时,同时在搅拌器上以120rpm搅拌。将瓶用37℃水浴解冻并且将全部内容物转移到平衡的培养基中。获得用贝克曼公司(Beckman)Vi-Cell(基于图像的细胞活力分析器)进行的细胞计数,以测量活细胞密度和活力。
使用每次传代的前3至4天(即指数生长期)过程中的活细胞密度,以计算在瓶解冻(当细胞从解冻中复苏时)之后的前几天过程和随后的细胞传代(当细胞完全复苏并在代与代之间达到一致的倍增时间时)过程中的群体倍增时间。
表达抗-IL-9单克隆抗体的NS0细胞(即NS0细胞系1)是处于冷冻贮存物中。在补充有不同浓度的N-乙酰半胱氨酸(NAC)的无动物蛋白(APF)培养基(即APF培养基1或APF培养基2)中解冻冷冻的NS0细胞系1细胞并且使用指数生长期过程中的活细胞密度计算如上所述的平均细胞倍增时间。
图1示出由冷冻贮存物解冻的细胞在对照培养基(无NAC的APF培养基1)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基1中的NS0细胞系1细胞倍增时间。与在对照培养基中解冻的NS0细胞系1细胞(57.6小时)相比,添加1.5mM至2.5mM NAC(1.5mM、2.0mM或2.5mM NAC)减少了瓶解冻的平均细胞倍增时间(分别是55.6小时、48.4小时和53.9小时)。在不受理论约束的情况下,在2mM与2.5mM之间倍增时间的轻微增加可能是由于溶液重量摩尔渗透压浓度的增加,特别是当NS0细胞可能在解冻过程中对重量摩尔渗透压浓度敏感时。
图2示出由冷冻贮存物解冻的细胞在对照培养基(无NAC的APF培养基2)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基2中的NS0细胞系1细胞倍增时间。类似于使用APF培养基1观察到的结果,与在对照培养基中解冻的NS0细胞系1细胞(109.8小时)相比,将1.5mM至2.5mM NAC(1.5mM、2.0mM或2.5mM NAC)添加到APF培养基2中也减少了瓶解冻时的细胞倍增时间(分别是47.5小时、56.9小时和47.7小时)。
这些实验显示在瓶解冻过程中将N-乙酰半胱氨酸(约1.5mM至约2.5mM;或约1.5mM、约2.0mM或约2.5mM)添加至NS0细胞的细胞培养基中增加了细胞活力、细胞生长并且减少了细胞倍增时间。
实例2.NS0细胞系2在APF培养基1、APF培养基2和CD杂交瘤培养基中在瓶解冻时的细胞倍增时间
表达单克隆抗体(即抗-IL-13抗体BAK502G9)的NS0细胞(即NS0细胞系2)是处于冷冻贮存物中。在补充有不同浓度的N-乙酰半胱氨酸(NAC)的无动物蛋白(APF)培养基(即APF培养基1、APF培养基2或补充有胆固醇(1X英杰公司胆固醇脂质浓缩物)的CD杂交瘤培养基(吉毕科公司))中解冻冷冻的NS0细胞系2细胞并且使用指数生长期过程中的活细胞密度计算如实例1所述的平均细胞倍增时间。
图3示出由冷冻贮存物解冻的细胞在对照培养基(无NAC的APF培养基1)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基1中的NS0细胞系2细胞倍增时间。与在对照培养基中解冻的NS0细胞系2细胞(44.6小时)相比,添加0.5mM至2.5mM NAC(0.5mM、1.0mM或2.5mM NAC)减少了瓶解冻时的平均细胞倍增时间(分别是39.6小时、41.6小时和37.5小时),其中2.5mM NAC显示瓶解冻时的细胞倍增时间的最大减少。
图4示出由冷冻贮存物解冻的细胞在对照培养基(无NAC的APF培养基2)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基2中的NS0细胞系2细胞倍增时间。类似于使用APF培养基1观察到的结果,与在对照培养基中解冻的NS0细胞系2细胞(77.0小时)相比,添加0.5mM至2.0mM NAC(0.5mM、1.0mM或2.0mM NAC)减少了瓶解冻时的平均细胞倍增时间(分别是57.7小时、37.0小时和39.7小时),其中1.0mM和2.0mM显示瓶解冻时的细胞倍增时间的最大减少。
图5示出由冷冻贮存物解冻的细胞在对照培养基(补充有1X英杰公司胆固醇脂质浓缩物而无NAC的CD杂交瘤培养基(吉毕科公司))和补充有三个增加浓度的N-乙酰半胱氨酸的对照培养基中的NS0细胞系2细胞倍增时间。类似于使用APF培养基1和APF培养基2观察到的结果,与在对照培养基中解冻的NS0细胞系2细胞(35.5小时)相比,添加1.0mM至2.0mM NAC减少了瓶解冻时的平均细胞倍增时间(分别是34.7小时、30.6小时和30.9小时),其中1.0mM和2.0mM显示瓶解冻时的细胞倍增时间的最大减少。
这些实验显示在瓶解冻时将N-乙酰半胱氨酸(约0.5mM至约2.5mM;或约0.5mM、约1.0mM、约2.0mM或约2.5mM)添加至NS0细胞的细胞培养基中增加了细胞活力、细胞生长并且减少了细胞倍增时间。
实例3.NS0裸细胞系在APF培养基2中在瓶解冻时的细胞倍增时间
未用异源蛋白质转染的NS0细胞(即NS0裸细胞系)处于冷冻贮存物中。在补充有不同浓度的N-乙酰半胱氨酸(NAC)的无动物蛋白(APF)培养基(即APF培养基2)中对冷冻的NS0裸细胞系细胞进行解冻并且使用指数生长期过程中的活细胞密度计算如实例1中所述的平均细胞倍增时间。
图6示出了从冷冻贮存物中解冻的细胞在对照培养基(无NAC的APF培养基2)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基中的NS0裸细胞系细胞倍增时间。类似于实例1和2中所报道的结果,与在对照培养基中解冻的NS0裸细胞系细胞(67.8小时)相比,添加0.5mM至1.5mM NAC(0.5mM、1.0mM或1.5mM NAC)减少了瓶解冻时的细胞倍增时间(分别是36.8小时、38.4小时和57.9小时),其中0.5mM和1.0mM显示瓶解冻时的细胞倍增时间减少最大。
这些结果当与实例1和2中概括的结果一起考虑时揭示了在补充有浓度为0.5mM、1.0mM、1.5mM、2.0mM、以及2.5mM(例如约0.5mM至约2.5mM)的N-乙酰半胱氨酸的三种不同培养基中解冻的三种NS0细胞系一致地显示出与在对照培养基中解冻的NS0细胞相比增加的细胞活力、细胞生长和减少的瓶解冻时的细胞倍增时间。
实例4.NS0细胞系1在APF培养基1和2中在细胞扩增过程中的细胞倍增时间
在无动物蛋白(APF)培养基(即APF培养基1或APF培养基2)中对表达抗-IL-9单克隆抗体的NS0细胞(即NS0细胞系1)进行培养。将实例1中所述的瓶解冻研究中使用的细胞分到相同培养基(补充有不同浓度的N-乙酰半胱氨酸的APF培养基1或APF培养基2)中并且允许在随后的传代中复苏这些细胞直到代与代之间达到一致的倍增时间。使用在复苏之后指数生长期过程的活细胞密度,计算如实例1中所述的平均细胞倍增时间。
图7和表2示出了在对照培养基(无NAC的APF培养基1)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基1中在细胞扩增过程中的NS0细胞系1细胞倍增时间。与在对照培养基中培养的NS0细胞系1细胞相比,添加1.5mM至2.0mM NAC(1.5mM或2.0mM)减少了在细胞扩增过程中的平均细胞倍增时间。误差棒表示平均倍增时间的1标准偏差(1S.D.)。
图8和表3示出了在对照培养基(无NAC的APF培养基2)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基2中在扩增过程中的NS0细胞系1细胞倍增时间。类似于使用APF培养基1所观察到的结果,与在对照培养基中培养的NS0细胞系1细胞相比,添加1.5mM至2.5mM NAC(1.5mM、2.0mM或2.5mM NAC)减少了在扩增过程中的平均细胞倍增时间。误差棒表示平均倍增时间的1标准偏差(1S.D.)。
这些实验显示了在NS0细胞进行扩增的同时添加N-乙酰半胱氨酸(约1.5mM至约2.5mM;或约1.5mM、约2.0mM或约2.5mM NAC)增加了细胞活力、细胞生长并且减少了细胞倍增时间。另外,1.5mM和2.0mM的N-乙酰半胱氨酸浓度一致地增加了在两种不同培养基中正经历细胞扩增的NS0细胞系1细胞的细胞活力、细胞生长并减少了细胞倍增时间。
实例5.NS0细胞系2在APF培养基1、APF培养基2和CD杂交瘤培养基中在细胞扩增过程中的细胞倍增时间
在无动物蛋白(APF)培养基(即APF培养基1、APF培养基2或补充有胆固醇(1X英杰公司胆固醇脂质浓缩物)的CD杂交瘤培养基(吉毕科公司))中培养表达单克隆抗体(即抗-IL-13抗体BAK502G9)的NS0细胞(即NS0细胞系2)。将实例2中所述的瓶解冻研究中使用的细胞分到补充有不同浓度的N-乙酰半胱氨酸的相同培养基(APF培养基1、APF培养基2或CD杂交瘤培养基+胆固醇)中并且允许这些细胞在随后的传代中复苏直到达到一致的代与代之间的倍增时间。使用在复苏之后指数生长期过程的活细胞密度,计算如实例1中所述的平均细胞倍增时间。
图9和表4示出在对照培养基(无NAC的APF培养基1)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基1中在扩增过程中的NS0细胞系2细胞倍增时间。与在对照培养基中解冻的NS0细胞系2细胞相比,添加0.5mM至2.5mM NAC(0.5mM、1.0mM或2.5mM)减少了扩增过程中的平均细胞倍增时间,其中1.0mM和2.5mM NAC显示扩增过程中的细胞倍增时间的最大减少。误差棒表示平均倍增时间的1标准偏差(1S.D.)。
图10和表5示出在对照培养基(无NAC的APF培养基2)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基2中在扩增过程中的NS0细胞系2细胞倍增时间。类似于使用APF培养基1观察到的结果,与在对照培养基中培养的NS0细胞系2细胞相比,添加0.5mM至2.0mM NAC(0.5mM、1.0mM或2.0mM)减少了在扩增过程中的平均细胞倍增时间。误差棒表示平均倍增时间的1标准偏差(1S.D.)。
图11和表6示出在对照培养基(补充有1X英杰公司胆固醇脂质浓缩物而无NAC的CD杂交瘤培养基(吉毕科公司))和含有三个增加浓度的N-乙酰半胱氨酸的对照培养基中在细胞扩增过程中的NS0细胞系2细胞倍增时间。类似于使用APF培养基1和APF培养基2观察到的结果,与在对照培养基中培养的NS0细胞系2细胞相比,添加1.0mM至2.0mM NAC减少了平均细胞倍增时间。误差棒表示平均倍增时间的1标准偏差(1S.D.)。
这些实验显示在扩增过程中将N-乙酰半胱氨酸(约0.5mM至约2.5mM;或约0.5mM、约1.0mM、约2.0mM或约2.5mM NAC)添加至NS0细胞的细胞培养基中增加了细胞活力、细胞生长并且减少了细胞倍增时间。
实例6.NS0裸细胞系在APF培养基2中在细胞扩增过程中的细胞倍增时间
在无动物蛋白(APF)培养基(即APF培养基2)中培养未用异源蛋白转染的NS0细胞(即NS0裸细胞系)。将实例3中所述的瓶解冻研究中使用的细胞分到相同培养基(补充有不同浓度的N-乙酰半胱氨酸的APF培养基2)中并且允许这些细胞在随后的传代中复苏直到达到一致的代与代之间的倍增时间。使用在复苏之后指数生长期过程的活细胞密度,计算如实例1中所述的平均细胞倍增时间。
图12和表7示出在对照培养基(无NAC的APF培养基2)和补充有三个增加浓度的N-乙酰半胱氨酸的APF培养基2中在扩增过程中的NS0裸细胞系细胞倍增时间。与在对照培养基中培养的裸细胞系细胞相比,添加0.5mM至1.5mM NAC(0.5mM、1.0mM或1.5mM NAC)减少了在扩增过程中的细胞倍增时间。误差棒表示平均倍增时间的1标准偏差(1S.D.)。
这些结果当与实例4和5中概括的结果一起时显示了在补充有浓度为0.5mM、1.0mM、1.5mM和2.0mM(例如约0.5mM至约2.0mM)的N-乙酰半胱氨酸的三种不同NS0培养基中培养的三种NS0细胞系与对照培养基中解冻的NS0细胞相比一致地具有增加的细胞活力、细胞生长和减少的细胞扩增过程中的细胞倍增时间。
等效物
前述书面说明书被认为足以使本领域技术人员能够实践这些实施例。前述说明和实例详述了某些实施例,并且描述了诸位发明人所期望的最佳模式。然而,将了解到,无论前述内容以文本形式表现的如何详细,这些实施例仍可以许多方式实践,并且权利要求书包括其任何等效物。
如在此所用的,术语约是指数值,包括例如整数、分数和百分比,无论是否明确指示。术语约通常是指本领域普通技术人员认为等效于所引用值(例如,具有相同功能或结果)的数值范围(例如所引用值的+/-5%)。在一些情况下,术语约可以包括四舍五入到最近的有效数字的数值。
***
在本申请中引用的所有出版物、专利、专利申请、和/或其他参考文献出于所有目的通过引用以其全部内容而结合,在程度上就像每个单独的出版物、专利、专利申请、和/其他文件被单独地指出以出于所有目的通过引用而结合相同。
- 还没有人留言评论。精彩留言会获得点赞!