直接从未纯化的生物样本分析核酸的方法与流程
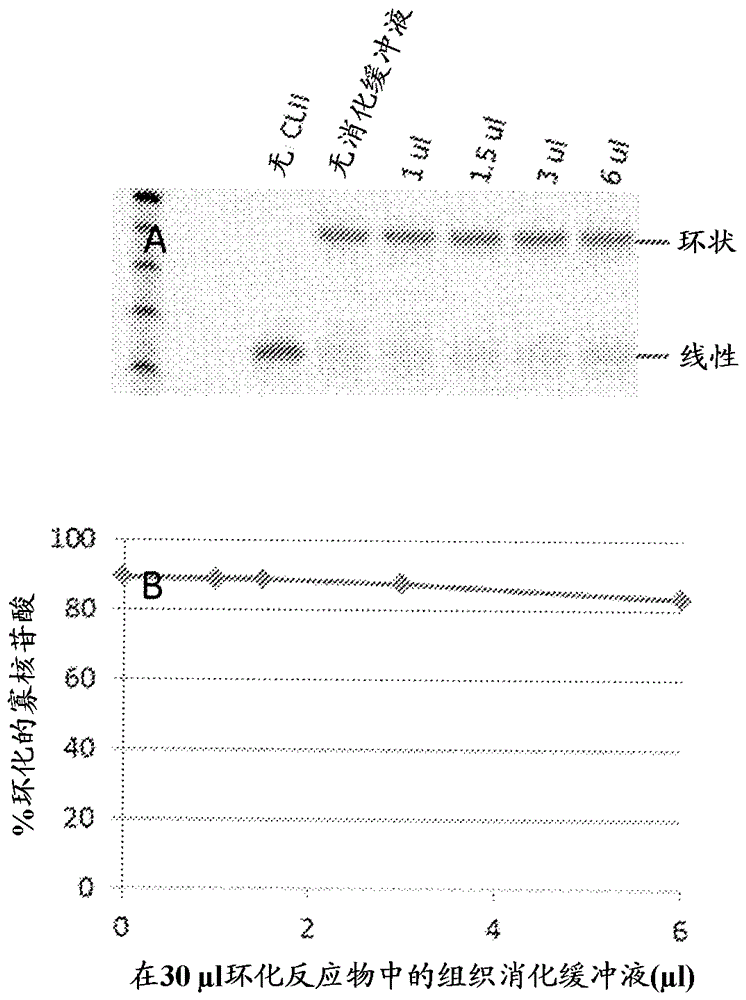
本发明总体上涉及核酸分析。更具体地说,本发明涉及一种通过模板-非依赖性单链DNA连接,环化来自生物样本的核酸分子的方法。它还涉及单链DNA环的扩增和/或检测。单链DNA环的生成在单一反应容器中,直接从生物样本进行,而无任何插入的分离和/或纯化步骤。还提供用于执行该方法的试剂盒。背景核酸分析被广泛用于临床和应用领域,以及学术研究中。虽然对于某些样本/领域,优质生物样本的大量供应是可获得的,但在许多情况下,样本可能是罕见的或被损坏。例如,在癌症研究和诊断中,越来越需要从福尔马林-固定的、石蜡包埋的(FFPE)组织样本,以及从样本内感兴趣的特定区域分析核酸。在一些情况下,仅分析少数细胞是需要的。目前,许多固定的组织样本在DNA提取后不能提供足够的DNA用于分析(例如定向重新测序和基于PCR的诊断试验),且往往DNA具有差的质量,这进一步限制了这些试验的有效性。全-基因组扩增(WGA)包括目标DNA的非-特异性扩增。WGA往往通过多重置换扩增(MDA)技术实现,其在一个等温反应中,使用在目标DNA的多个位置引发DNA合成的随机寡核苷酸引物,连同具有链置换活性的高保真性DNA聚合酶(如,Phi29聚合酶)。尽管目前可市售获得的WGAMDA系统例如GenomiPhi(GEHealthcare,USA)和RepliG(Qiagen)试剂盒提供具有高分子量目标DNA的最佳结果,但当目标DNA是短的和/或被高度片段化时,这些系统的性能就差。当目标序列长度少于约1,000个核苷酸时,使用常规方法扩增目标DNA导致降低的扩增速度,尤其是接近目标DNA两端的明显的序列丢失,和高度序列-偏倚性扩增。其一些与这样的观察有关,即随着模板DNA的长度减少,模板在MDA反应中被引发的可能性数倍减少。这降低了这些较短片段的扩增潜力。因此,用于非-特异性地扩增短的、片段化DNA的有效方法是高度需要的。连接介导的聚合酶链反应(PCR)已被用来扩增片段化dsDNA。然而,在这些反应中,只有一小部分的片段化DNA被扩增,导致基因组覆盖率不足。为有效地扩增片段化dsDNA,模板可先进行酶促修复,然后通过钝端连接来连环化(concatemerized),以生成长于1000碱基对(bp)的序列。然而,常常需要相对高浓度的目标DNA,以促进分子间连环化(concatemerization)和后续的扩增。双链目标DNA的环化也已用于各种基于核酸的测定,包括MDA、WGA、超分支滚环扩增(RCA)和大规模平行DNA测序。为有效地环化和扩增片段化dsDNA,片段化DNA的双链端首先被修复,随后通过钝端连接以形成双链DNA环。然而,环化长度少于250bp的双链DNA片段是困难的,而长度少于大约150bp的DNA则是不可能的,因为这是双链DNA的持续长度。首先可使双链DNA变性以产生单链DNA(ssDNA),然后可在模板-依赖性分子内连接反应中,使用支架/桥接寡核苷酸和连接酶进一步环化。然而,需要目标DNA的先前序列信息执行模板-依赖性环化。ssDNA的模板-非依赖性分子内连接也已有文献记载。例如,TS2126RNA连接酶(在商标名ThermoPhageTMRNA连接酶II或ThermoPhageTMssDNA连接酶(Prokaria,Matis,Iceland)或CircLigaseTMssDNA连接酶(EpicentreBiotechnologies,Wisconsin,USA)下可经市售获得)已被用来制造数字DNA球(digitalDNAball),和/或DNA(例如基因组DNA)的位点-特异性裂解和扩增。通过使用TS2126RNA连接酶,从有限量的片段化DNA,还已生成用于滚环扩增的DNA模板。该方法包括使线性、片段化dsDNA变性以获得线性ssDNA片段,使线性ssDNA与CircLigaseTMssDNA连接酶连接以获得单链DNA环,然后用随机引物和Phi29DNA聚合酶通过RCA扩增单链DNA环。此外,连接-扩增反应的所有尝试包括中间分离、纯化和/或清洁步骤,因而使得连接-扩增工作流程繁琐。例如,通过环化,随后通过滚环扩增的片段化DNA的法医样本的分析以多步骤进行,包括5'DNA磷酸化、接头连接、DNA环化,和全-基因组扩增。每个步骤在执行下一步骤之前经受反应清理。当连接和扩增在单一反应容器中进行时,未观察到扩增优点。然而,多-步骤过程常常导致模板DNA的损失并造成分析失败。WO2010094040A1(Epicentre)描述了预-腺苷酸化(pre-adenylated)噬菌体TS2126RNA连接酶的发现和使用,以解决不同序列和大小的线性单链DNA分子的可变分子内连接效率。这种酶以名称CircLigaseII经商业出售。只有预先纯化的DNA才被用作分子内连接的起始原料。在ForensicSciIntGenet.2012Mar;6(2):185-90中,为了改进有限数量的片段化DNA的法医STR特性分析的目的,Tate等在单链DNA环化和滚环扩增之前,评价了用于预先纯化的基因组DNA样本的制备和处理的一个多-步骤过程。他们发现在他们的多-步骤过程后,STR扩增效率没有改进且STR基因分型失败,"推测是由于因多个中间硅胶柱纯化步骤导致的DNA模板的损失,其中的每个步骤导致模板DNA的损失"。在单一反应容器中,直接从生物样本扩增短的DNA序列,而无任何序列偏倚和任何插入的清洁步骤的有效方法因而是高度需要的。发明简述在本发明的一个方面,提供一种从生物样本生成单链DNA环的方法。该方法包括以下步骤:用提取剂处理生物样本以释放核酸,从而形成样本混合物;中和提取剂;使释放的核酸变性以生成单链核酸;和使单链核酸与连接酶接触,所述连接酶能够模板-非依赖性分子内连接单链DNA序列,以生成单链DNA环。该方法的所有步骤在没有任何中间核酸分离或核酸纯化的情况下进行。在某些实施方案中,所述步骤以顺序的方式,在单一反应容器中进行。在某些实施方案中,单链DNA环被扩增,以使生物样本的随后分析成为可能。在某些实施方案中,样本混合物在中和步骤之前在固体基质上干燥。在某些实施方案中,对DNA的损伤在变性步骤之前经酶促修复。在本发明的第二个方面,提供一种分析生物样本的方法。因此,根据本发明的某些实施方案生成的单链DNA环被扩增,并分析扩增产物。分析可通过例如扩增产物的定向测序来进行。在本发明的另一方面,提供一种从生物样本检测染色体重排断点的方法。因此,根据本发明的某些实施方案生成的单链DNA环被扩增,并例如通过测序分析扩增产物。通过比较该序列与已知的参考序列鉴定任何染色体重排断点。在本发明的又一方面,提供一种试剂盒,其包含用于处理生物样本以释放核酸的提取剂;用于中和提取剂的试剂;和能够模板-非依赖性分子内连接单链DNA序列的连接酶。附图当参考附图阅读以下详细的描述时,本发明的这些和其它特征、方面和优点将会变得更好地理解。图1举例说明根据本发明实施方案的方法工作流程的概图。图2表示在不同量的中和提取剂的存在下,环化反应的结果。图3提供了表明使用高Tm引物的扩增反应更耐遗留(carryover)抑制作用的数据。图4提供了表明根据本发明的实施方案从人体组织直接扩增片段化DNA的实例的数据。图5提供了表明根据本发明的实施方案,在福尔马林固定的样本的DNA修复和环化后,改进的序列覆盖率和SNP检测的数据。详细描述以下详细描述是示例性的并不打算限制本发明或本发明的应用。贯穿整个说明书,特定术语的范例应被视为非-限制性实例。单数形式“一”、“一个”和“该”包括复数指代,除非上下文中另外清楚地指明。如此处贯穿说明书和权利要求书使用的近似语言,可被用来修饰在不导致其相关基本功能改变的情况下可允许变化的任何定量表示。因此,由术语例如“约”修饰的值并不限于所指定的精确值。除非另外指明,说明书和权利要求书中使用的表示成分的数量、特性例如分子量、反应条件等的所有数字应被理解为在所有情况下由术语“约”修饰。因此,除非有相反的指示,在以下说明书和所附权利要求书中提出的数字参数是近似的,其可根据本发明探寻而获得的所需特性而变化。至少,并且不试图限制等同原则适用至权利要求书的范围,每个数字参数至少应该根据报告的有效数字的数目并通过应用普通的四舍五入技术解释。必要时,提供范围,并且所述范围包括其之间的所有子范围。为了更清楚和简明地描述和指出本发明要求的主题,对在以下描述和所附权利要求书中使用的特定术语提供了以下定义。如在此所用的,术语“核苷”指一种糖基胺化合物,其中核酸碱基(核碱基)连接于糖部分。“核苷酸”指磷酸核苷。核苷酸可使用如表1所述的对应于其核苷的字母表字母(字母代号)表示。例如,A表示腺苷(一种包含核碱基腺嘌呤的核苷),C表示胞苷,G表示鸟苷,U表示尿苷,和T表示胸苷(5-甲基尿苷)。W表示A或者T/U,和S表示G或者C。N表示一种随机的核苷和dNTP指脱氧核糖核苷三磷酸。N可以是A、C、G或T/U的任何一个。表1:各种核苷酸的字母代号。符号字母由符号字母代表的核苷酸GGAATTCCUURG或AYT/U或CMA或CKG或T/USG或CWA或T/UHA或C或T/UBG或T/U或CVG或C或ADG或A或T/UNG或A或T/U或C如在此所用的,术语“核苷酸类似物”是指在结构上与天然存在的核苷酸类似的化合物。核苷酸类似物可具有改变的磷酸骨架、糖部分、核碱基,或其组合。核苷酸类似物可以是天然核苷酸、合成核苷酸、修饰的核苷酸,或代用的替换部分(如,肌苷)。一般来说,具有改变的核碱基的核苷酸类似物尤其赋予不同碱基配对和碱基堆积形式。如在此所用的,术语“LNA(锁定核酸)核苷酸”指核苷酸类似物,其中核苷酸的糖部分含有锁定在核糖核酸(RNA)-模拟糖构型中的双环呋喃糖单位。从脱氧核糖核苷酸(或核糖核苷酸)向LNA核苷酸的结构变化从化学角度来看是有限的,即在2'位和4'位的碳原子之间引入另外的连键(如,2'-C,4'-C-氧基亚甲基连键;见,例如,Singh,S.K.等,Chem.Comm.,4,455−456,1998,或Koshkin,A.A.等,Tetrahedron,54,3607−3630,1998.))。在LNA核苷酸中的呋喃糖单位的2'和4'位置可经O-亚甲基(如,氧基-LNA:2'-O,4'-C-亚甲基-β-D-呋喃核糖基核苷酸)、S-亚甲基(硫代-LNA),或NH-亚甲基部分(氨基-LNA)等连接。这样的连键限制呋喃糖环的构象自由。LNA寡核苷酸显示对互补单链RNA,和互补单链或双链DNA的增强杂交亲和性。LNA寡核苷酸可诱导A-型(RNA-样)双螺旋构象。具有改变的磷酸-糖骨架(如,PNA、LNA)的核苷酸类似物往往尤其修饰链特性,例如二级结构形成。在字母代号前的星号(*)符号表示,由字母指定的核苷酸是硫代磷酸酯修饰的核苷酸。例如,*N表示硫代磷酸酯修饰的随机核苷酸。在字母代号前的加(+)号表示,由字母指定的核苷酸是LNA核苷酸。例如,+A表示腺苷LNA核苷酸,和+N表示锁定的随机核苷酸(即,随机LNA核苷酸)。如在此所用的,术语“BNA(桥接核酸)核苷酸”(2',4'-BNANC(2'-O,4'-氨基亚乙基桥接核酸),是包含具有N-O连键的6元桥接结构的化合物。这种新核酸类似物可被合成并结合到寡核苷酸中。当与较早一代的LNA比较时,BNA被发现具有:对RNA补体的较高的结合亲和力,优越的单一-错配鉴别力,增强的RNA选择性结合,更强和更高的序列选择性三螺旋形成特性,对内切核酸酶和外切核酸酶的更强的核酸酶抗性,即,甚至高于S(p)-硫代磷酸酯类似物。如在此所用的,术语“寡核苷酸”指核苷酸的寡聚物。如在此所用的术语“核酸”指核苷酸的聚合物。如在此所用的术语“序列”指寡核苷酸或核酸的核苷酸序列。贯穿整个说明书,每当寡核苷酸或核酸用一系列字母表示时,核苷酸按5´→3´的顺序从左至右。例如,由字母序列(W)x(N)y(S)z表示的寡核苷酸,其中x=2,y=3和z=1,表示寡核苷酸序列WWNNNS,其中W是5'末端核苷酸和S是3'末端核苷酸。寡核苷酸或核酸可以是DNA、RNA,或它们的类似物(如,硫代磷酸酯类似物)。寡核苷酸或核酸也可包含修饰的碱基和/或骨架(如,修饰的磷酸连键或修饰的糖部分)。赋予核酸稳定性和/或其它优点的合成骨架的非-限制性实例可包括硫代磷酸酯连键、肽核酸、锁定核酸、木糖核酸,或其类似物。如在此所用的,术语“引物”指与目标核酸序列(如,要扩增的DNA模板)杂交以引发核酸合成反应的短的线性寡核苷酸。引物可以是RNA寡核苷酸、DNA寡核苷酸,或嵌合序列。引物可含有天然的、合成或修饰的核苷酸。引物长度的上限和下限均凭经验确定。引物长度的下限是在核酸扩增反应条件下,在与目标核酸杂交时形成稳定的双螺旋体所需的最小长度。在这样的杂交条件下,极短的引物(通常少于3个核苷酸长)不与目标核酸形成热力学稳定的双螺旋体。上限往往通过在目标核酸中并非预定的核酸序列的区域中具有双螺旋体形成的可能性确定。一般来说,合适的引物长度是在约3个核苷酸长至约40个核苷酸长的范围内。如在此所用的,术语“随机引物”指引物序列的混合物,其通过在寡核苷酸序列的任何给定位置的核苷酸的随机化来生成,其方式为给定的位置可由任何可能的核苷酸或其类似物组成(完全随机化)。因此,随机引物是寡核苷酸序列的随机混合物,其由序列中核苷酸的每一种可能的组合组成。例如,一种六聚体随机引物可由序列NNNNNN或(N)6表示。六聚体随机DNA引物由4种DNA核苷酸,A、C、G和T的每一种可能的六聚体组合组成,导致包含46(4,096)个独特的六聚体DNA寡核苷酸序列的随机混合物。当目标核酸的序列未知或为了全基因组扩增反应时,随机引物可有效地用来引发核酸合成反应。如在此所用的,术语“滚环扩增(RCA)”指经由滚环机制扩增环状核酸模板(如,单链DNA环)的核酸扩增反应。滚环扩增反应通过引物杂交至环状(往往是单链)核酸模板而启动。核酸聚合酶然后延伸引物,所述引物通过围绕环状核酸模板不断前进,杂交至环状核酸模板,以反复地复制核酸模板的序列(滚环机制)。滚环扩增通常产生包含环状核酸模板序列的串联重复单元的连环体(concatemers)。滚环扩增可以是线性RCA(LRCA),显示出线性扩增动力学(如,使用单一特异性引物的RCA),或可以是显示指数扩增动力学的指数RCA(ERCA)。滚环扩增也可使用多个引物(多重引发的滚环扩增或MPRCA)进行,导致超支链的连环体。例如,在双-引发的RCA中,一个引物可以是(如在线性RCA中)与环状核酸模板互补的,而另一个可以是与RCA产物的串联重复单元核酸序列互补的。因而,双-引发的RCA可作为具有指数(几何学)扩增动力学的链反应进行,其特征为多-杂交、引物-延伸和涉及两个引物的链置换事件的级联。这往往生成一组离散的连环(concatemeric)双链核酸扩增产物。滚环扩增可在等温条件下,使用合适的核酸聚合酶例如Phi29DNA聚合酶在体外进行。如在此所用的,术语“反向PCR”指用来扩增具有仅仅一个已知序列的DNA的聚合酶链反应的一个变型。常规PCR的一个限制是它需要与目标DNA两端互补的引物,而反向PCR允许PCR即使在只有一个序列可从可设计的引物获得的情况下进行,虽然它需要环化的DNA模板或对于线性模板需要具有直接重复的引发序列。因此,对于环化的DNA模板,通常在彼此错误的方向结合的引物对(从线性DNA上的共同位点向外扩增,其仅提供线性扩增动力学)按用于指数扩增动力学的PCR所要求的改为会聚,以产生越过环化点的扩增产物。如在此所用的,术语“固体基质”指一种允许某些成分通过,而保留其它成分存在于液体中的选择性屏障(即膜),通常由纤维素、玻璃或石英纤维/微纤维材料组成。固体基质也可包含多孔聚合物,例如多孔膜材料例如聚酯、聚醚砜(PES)、聚酰胺(尼龙)、聚丙烯、聚四氟乙烯(PTFE)、聚碳酸酯、硝酸纤维素、醋酸纤维素、藻酸盐或氧化铝。固体基质通常具有高的表面:体积比。基质可以是有序或者无序的。一些例子包括玻璃纤维、硝化纤维素、石英纤维、903卡、FTA纸和FTA-洗提纸。在一些实施方案中,本发明提供用于DNA提取,任选的酶促修复,和来自生物来源的片段化DNA的单链DNA环化的方法。因此,本发明的一个实施方案提供一种从生物样本生成单链DNA环的方法,该方法包括:(A)用提取剂处理生物样本以释放核酸,从而形成样本混合物;(B)中和提取剂;(C)使释放的核酸变性以生成单链核酸;和(D)使单链核酸与连接酶接触,所述连接酶能够模板-非依赖性分子内连接单链DNA序列,以生成单链DNA环,其中在没有任何中间核酸分离或核酸纯化的情况下进行该方法的所有步骤。在某些实施方案中,步骤(A)-(D)在单一反应容器(如,微量离心管)中,以顺序的方式进行。步骤(B)和(C)可以任一次序执行。生物样本(如,从生物来源获得的样本)可以是福尔马林-固定的组织、固定的单个细胞、血浆、古旧的组织样本,或其它环境暴露的生物样本。例如,生物样本可从(但不限于)体液(如,血、血浆、血清、尿、乳汁、脑脊液、胸腔积液、淋巴液、泪、痰、唾液、粪便、肺穿刺液、咽喉或生殖器拭子)、器官、组织、细胞培养物、细胞级分、切片(如,器官或组织的切片部分)或从生物受试者或从生物受试者的样本的特定区域(如,含有患病细胞的区域)分离的细胞获得。生物样本可具有真核来源、原核来源、病毒来源或噬菌体来源。生物样本用提取剂处理以释放核酸,从而形成样本混合物。将提取剂加入到样本中以溶解组织/细胞,和/或稳定/消化蛋白,为下游反应提供可接近的核酸。然后中和提取剂以灭活提取剂,否则其将抑制下游酶促反应。在某些实施方案中,提取剂通过加入螯合剂中和。在其它实施方案中,提取剂通过物理条件改变,例如加热来中和。术语“提取剂”指的是分解组织或细胞,和稳定/消化蛋白的组分,以使核酸可适合用于下游反应。术语“螯合剂”指中和提取剂的作用的组分。例如,如果提取剂包括碱,那么酸可被用来使溶液呈中性。例如,当生物样本是血浆时,蛋白酶K可被用作提取剂,而蛋白酶K抑制剂被用作中和蛋白酶K的螯合剂。或者,加热步骤可被用来灭活蛋白酶K。在某些实施方案中,提取剂包括去垢剂,例如SDS。包含环糊精的螯合剂可被用来中和SDS的作用。来自生物样本的核酸可以是基因组DNA、线粒体DNA、微生物DNA、病毒DNA或其它DNA来源。DNA可被片段化。来自生物样本的核酸长度范围可从15个核苷酸至21,000个核苷酸。由于持续长度,它通常不大可能环化具有序列长度少于150bp的dsDNA,环化dsDNA是极其困难的,直至DNA长于200bp。相反,具有序列长度15个核苷酸(nt)或更多的线性ssDNA分子通过合适的连接酶被极其有效地环化,只要5'端被磷酸化和3'端被羟基化。对于血浆中的核酸,它们一般为约150-180bp长,因而以如同双链DNA的低得率环化。在旧FFPE样本(>20年)中,DNA大部分为60-70nt长的片段。根据本发明的某些实施方案的方法特别地适合于分析这样的生物样本。来自中和的样本的核酸在分子内连接反应之前经变性为单链形式。这可通过使用任何本领域-公认的用于将dsDNA转化为ssDNA序列的方法实现。例如,dsDNA可经热变性、化学变性,或热变性和化学变性二种。dsDNA可使用减少dsDNA的熔化温度的变性剂(如,碱、甘油、乙二醇、甲酰胺,脲或其组合)进行化学变性。变性剂在每10%(vol./vol.)的变性剂加入到反应混合物中时,可减少熔化温度5℃-6℃。变性剂或变性剂的组合(如,10%甘油和6-7%乙二醇)可占反应混合物(vol./vol.)的1%、5%、10%、15%、20%,或25%。降低杂交严格性的盐可以低浓度包含在反应缓冲液中,以在低温下使dsDNA化学变性。dsDNA可通过例如,于95℃加热dsDNA经热变性。在变性步骤后,生成的ssDNA可在模板的不存在下,用能够分子内连接ssDNA底物的DNA或RNA连接酶处理,以形成单链DNA环。可被用于连接反应的合适的连接酶包括,但不限于,TS2126RNA连接酶、T4DNA连接酶、T3DNA连接酶或大肠杆菌(E.coli)DNA连接酶。在一些实施方案中,ssDNA转化为单链DNA环用热稳定的RNA连接酶进行,所述酶具有有效的用于具有5'磷酰基和3'羟基的线性ssDNA底物的模板-非依赖性的、分子内连接活性。连接酶可以基本上预腺苷化形式存在。例如,源自感染嗜热细菌,水管致黑栖热菌(Thermusscotoductus)的栖热菌属噬菌体TS2126的TS2126RNA连接酶,可被用于将片段化线性ssDNA经模板-非依赖性环化为环状ssDNA。TS2126RNA连接酶是比许多嗜温性RNA连接酶如T4RNA连接酶更加热稳定的(在至多约75℃是稳定的)。对于TS2126RNA连接酶活性的温度范围可大于约40℃,例如,从约50℃至约75℃。于此,TS2126RNA连接酶可在较高的温度下使用,这进一步减少ssDNA的不需要的二级结构。线性ssDNA的环化也可使用并非TS2126RNA连接酶的连接酶或通过使用具有DNA连接活性的任何其它酶如拓扑异构酶实现。在一些实施方案中,片段化的、单链DNA分子的环化通过源自嗜热古细菌,热自养甲烷杆菌(Methanobacteriumthermoautotrophicum)的RNA连接酶1(MthRNA连接酶)实现,该酶在环化线性的、片段化ssDNA分子中具有高度模板-非依赖性连接酶活性。在一些实施方案中,提供一种用于通过TS2126RNA连接酶,提高环化ssDNA的效率的方法。为连接反应使用具有8.0的pH的HEPES缓冲液增加连接效率。当反应在TRIS缓冲液(如,对于CircLigaseTMII,EpiCenter提示的10x反应缓冲液包含0.33MTRIS-乙酸盐(pH7.5)、0.66M乙酸钾,和5mMDTT)中进行时,模板-非依赖性ssDNA连接是无效的。此外,锰(一种用于连接反应的重要辅因子)在碱性条件下迅速氧化并在TRIS的存在下形成沉淀。Mn2+在空气中氧化为Mn3+可由与Mn3+离子强烈络合的阴离子促进。例如,当等体积的具有用HC1适当调节的pH的0.2mol/升Tris和2mmol/升MnC12混合时,在pH9.3(单独的TRIS碱的pH)时,颜色立刻改变;在pH8.5时有一个约3分钟的初始时间滞后。虽然反应在较低的pH下没有发生,但在较高pH观察到的改变未被添加酸逆转。由于锰在TRIS缓冲液中迅速氧化,当分子内连接在TRIS缓冲液中进行时,较高浓度的锰对于连接反应是重要的(如,加入MnCl2至2.5mM的最终浓度)。此外,当锰浓度随时间推移的继续降低时,精确地预测锰在反应中的工作浓度将变得困难。当连接和扩增在单一反应容器中进行时,较高浓度的锰可导致在扩增期间聚合酶的较高的错误率。在连接反应中,通过用HEPES缓冲液替换TRIS缓冲液,有效的分子内连接可用少于0.5mM的锰离子浓度实现。除了HEPES,任何其它的Good缓冲液(见,例如,Good,Normanetal.Biochemistry,5(2):467–477,1966;和Good,Normanetal.,MethodsEnzymol.,24:53–68,1972.)可用于分子内连接反应。在某些实施方案中,在用提取剂处理生物样本以释放核酸后,和在中和步骤之前,样本混合物任选地经受在固体基质上的干燥步骤。将样本施加于固体基质可通过防止与样本处理、混合和移液有关的剪切力,减少生成的核酸的剪切。这可导致更完整的核酸。更完整的核酸可被更有效地修复。例如,如果双链DNA明显地具有切口,并且温和的处理防止DNA在切口位点之间分离,DNA连接步骤因而更有效。干燥步骤可增加细胞溶解和蛋白变性效率,从而释放更大数量和更易接近的核酸。而且,温和的溶解和固定化DNA可促进更有效的修复反应。另外,干燥也允许样本以稳定的形式暂时贮存,允许关于工作流时限的更大的灵活性。在某些实施方案中,固体基质是玻璃纤维滤器或石英纤维滤器(QMA)。在某些其它实施方案中,固体基质是纤维素滤纸,例如FTA纸、FTAElute纸,或Whatman903纸。FTA纸(包括FTA微型卡、FTA指示,和FTA标准)是用核酸提取和稳定的化学物质(例如弱碱、螯合剂和阴离子表面活性剂)处理的纤维素滤纸,从而支持表面用稳定的化学物质浸渍。FTAElute在此描述类似的纸,但用离液剂例如硫氰酸胍鎓涂覆。在此Whatman903描述未涂覆的纤维素滤纸。在某些实施方案中,在施用样本后,核酸提取和稳定的化学物质可被加入到固体基质中。在某些实施方案中,在中和步骤之后,但在变性步骤之前,样本混合物任选地经受修复DNA损伤或除去DNA损坏的步骤。例如,尿嘧啶DNA糖基化酶(UDG)可被用来切除由于胞嘧啶的脱氨基作用可能出现的尿嘧啶碱。甲酰氨基嘧啶[fapy]-DNA糖基化酶(fpg)可被用来除去损伤的嘌呤。脱嘌呤脱嘧啶核酸内切酶(APE1和EndoIV)可被用来在脱碱基(abasic)位点和氧化损伤位点切开DNA。DNA聚合酶I可被用来替换在切口位点或在切口位点附近的损伤的碱基,而T4DNA连接酶可被用来连接切口位点。进一步地,可使用T4多核苷酸激酶以生成适于在通常不能环化的那些片段上连接的DNA末端(使具有5'-OH的DNA末端的磷酸化和使具有3'-磷酸基的DNA末端脱磷酸化)。该方法的主要益处是执行每一个连续的操作,而无将必然导致DNA损失的任何中间纯化步骤的能力。该方法允许分析比如果需要纯化步骤可能的生物材料更少得多的量的生物材料。因此,该方法能够从少量的生物样本例如少数细胞,或小的感兴趣的区域(ROI)或在其中提取的DNA的量有限,或低质量,和其中DNA纯化步骤不可行或将导致不满意的DNA损失或需要复杂和费时的样本处理的情况下分析DNA。例如,通过从FFPE组织载玻片选择小的感兴趣的区域,这种方法将能够从目标区域中的特定细胞更可靠地检测DNA序列变化和结构改变,例如染色体重排。这是有利的,因为小样本是更纯的,因为它在细胞组成可以是异质的较大组织样本中未被稀释。此外,这种方法可用于载玻片上或者另外收集的固定细胞。例如,分离的循环肿瘤细胞,或细针抽吸物,其中细胞是离散的和在混合物中,且特别是其中需要DNA扩增用于基因分析。环化反应当用片段化DNA来源进行时具有特别的重要性,因为它允许使用反应,例如滚环扩增和反向PCR进行随后的扩增和分析。标准的多重置换扩增反应在少于大约1000nt的片段化DNA上不能有效地工作,产生具有高水平的序列丢失(尤其是分子的两端附近)的DNA,此外,产生高度偏倚性扩增。将片段化输入DNA转化为单链环能够使DNA扩增通过高度灵敏和有效的滚环机制进行。因此,根据本发明的某些实施方案,环化的单链DNA环被进一步扩增。扩增可用包含锁定核酸核苷酸或桥接核酸核苷酸或未修饰的脱氧核糖核酸核苷酸的随机引物进行。例如,在连接反应混合物中的ssDNA环可在等温条件下,通过滚环扩增(RCA)方法扩增。扩增试剂(包括DNA聚合酶、引物和dNTPs)可被加入到相同的反应容器中,以产生扩增反应混合物并启动RCA反应。扩增反应混合物还可包括试剂例如单链DNA结合蛋白和/或合适的扩增反应缓冲剂。ssDNA环的扩增在其中进行连接的相同反应容器中进行。在扩增反应之前,ssDNA环的分离或纯化和/或连接酶的除去不是必需的。扩增DNA可通过任何目前已知的用于DNA检测或DNA测序的方法检测。RCA可通过使用本领域已知的任何DNA聚合酶如Phi29DNA聚合酶或BstDNA聚合酶进行。它可使用随机引物混合物或通过使用特异性引物进行。在一些实施方案中,随机引物被用于RCA反应。也可使用包含一种或多种核苷酸类似物(如,LNA核苷酸、2-氨基-dA,或2-硫代-dT修饰)的引物序列。在一些实施方案中,耐核酸酶引物(如,包含在适当位置的硫代磷酸基团的引物序列)被用于扩增反应(如,NNNN*N*N)。在一些实施方案中,RCA可通过使ssDNA环与包含随机引物混合物的引物溶液接触,以形成核酸模板-引物复合物;使核酸模板-引物复合物与DNA聚合酶和脱氧核糖核苷三磷酸接触;和扩增核酸模板来进行。在一些实施方案中,引物可具有随机的3'端,但在5'端具有能够随后进一步处理扩增产物的固定序列。或者,在连接反应混合物中的ssDNA环可通过反向PCR扩增。包括热稳定的DNA聚合酶、引物和dNTPs的扩增试剂可被加入到相同的反应容器中,以产生扩增反应混合物并启动PCR反应。扩增反应混合物可进一步包括试剂,例如单链DNA结合蛋白和/或合适的扩增反应缓冲液。ssDNA环的扩增在进行连接的相同反应容器中进行。在扩增反应之前,ssDNA环的分离或纯化和/或连接酶的除去不是必需的。扩增的DNA可通过任何目前已知的用于DNA检测或DNA测序的方法检测。在某些实施方案中,单链DNA环可首先通过滚环扩增,随后通过PCR或反向PCR或PCR和反向PCR在一起的组合来扩增。本发明的某些实施方案提供从生物学材料检测DNA的方法,而先前从该生物学材料是不可能检测到DNA的。在过去,在进行单链DNA环化反应之前,在样本溶解后从其它生物成分纯化DNA是必需的。Epicentre(WO2010094040A1)仅提供一种将具有5'-磷酸酯和3'-羟基端的纯化的单链DNA片段转化为单链环状分子的优化方法。然而,在许多情形下,DNA量是有限的,DNA受到损伤,和/或DNA可能没有可连接的末端。在这些情形下,纯化步骤将导致不可接受的DNA损失并可由于另外的处理而导致DNA的剪切。进一步地,损伤的DNA和具有不相容的末端的DNA将进一步减少可用于分析的DNA的量。例如,使用包括多个纯化步骤的方法环化和扩增有限量的DNA的尝试(Tate等ForensicScienceInternational:Genetics第6册,第2期,185-190页)已经失败,推测是由于DNA损失所致。即使使用粗制的溶胞产物,本发明的某些实施方案也提供允许DNA修复、单链DNA环化和扩增反应有效进行的方法。粗制的溶胞产物含有许多生物学分子例如蛋白、脂质、碳水化合物,以及用来提取DNA的化学物质。这些分子可能潜在地干扰酶促反应。然而单链核酸环成功地生成并使用所述新方法进一步扩增。图1是根据本发明实施方案的工作流程的概图。如所示的,片段化DNA使用包含SDS和蛋白酶K的缓冲液,直接从未纯化的材料提取。然后中和这些化学物质,随后任选修复DNA,变性为单链,并使用单链连接酶环化。这些环状分子适合于通过RCA或通过分析,使用反向PCR和外向引物扩增。以下是每个步骤的详细描述:细胞溶解/组织消化–生物样本,例如FFPE组织样本、固定的单个细胞、血浆、古旧的组织样本、环境暴露样本,与包含SDS和蛋白酶K的缓冲溶液一起孵育>1小时以分解组织,溶解细胞,并提取DNA。任选地,溶胞产物在FTA纸上干燥,其有助于细胞溶解,保存DNA,并有助于随后的DNA修复反应。蛋白酶K和SDS的灭活–蛋白酶K和SDS对随后的任选的修复、环化和DNA扩增反应是高度抑制的且在这些步骤之前必须经灭活。粗制的溶胞产物/干穿孔(driedpunch)与含有α-环糊精的溶液一起孵育,以螯合游离的SDS,使得它在下游反应中不能抑制/变性酶。灭活蛋白酶K的一个方法是于高温下加热,其具有使DNA变性,阻止修复反应利用互补序列来填补切口并合成完整的DNA的缺点。灭活蛋白酶K的另一个方法是利用蛋白酶K抑制剂(EMDMillipore,肽序列MeOSuc-Ala-Ala-Pro-Phe-CH2Cl),其在室温下不可逆转地灭活蛋白酶K。任选的DNA修复或DNA损伤去除–如果需要,粗制的DNA溶液在反应中与一种或多种以下酶的合剂孵育:切除尿嘧啶碱(其可由于胞嘧啶的脱氨基作用而出现)的尿嘧啶DNA糖基化酶(UDG),在脱碱基位点和氧化损伤位点切开DNA的脱嘌呤脱嘧啶核酸内切酶(APE1和EndoIV),除去损伤的嘌呤的甲酰氨基嘧啶[fapy]-DNA糖基化酶(fpg),在DNA的5'和3'两端切除损伤的碱基的DNA聚合酶I,在切口位点或其附近修复DNA的DNA聚合酶I和T4DNA连接酶,以及生成DNA末端的T4多核苷酸激酶,所述DNA末端对在通常不能环化的那些片段上的连接是相容的(使具有5'-OH的DNA端磷酸化并使具有3'-磷酸基的DNA端脱磷酸化)。DNA环化–首先,于95℃加热片段化输入DNA,以使双链DNA变性为单链。其次,加入包含HEPES、乙酸钾、氯化锰和甜菜碱的缓冲液,并用能够分子内连接单链DNA底物以形成单链环的DNA或RNA连接酶处理DNA。单链环可用作随后扩增和分析的模板。因此,在某些实施方案中,单链环经受滚环扩增。加入扩增试剂以启动RCA反应,生产用于下游分析的高达微克量或更多的全-基因组扩增DNA。在某些其它实施方案中,单链环经受反向PCR。在环状DNA上的反向PCR将在其中只有单一序列是已知的情况下,提供生成包含断点的旁侧序列的扩增子的能力。因为DNA被片段化且断点是随机的和未知的,标准的PCR经常失败,因为断点常常将位于所需的扩增子序列内。在环状DNA上的反向PCR将是成功的,而不管断点的位置如何,从而提供回收这些扩增子的能力并允许更有效地分析具有随机断点的片段化DNA。在一个方面,本发明提供分析生物样本的方法。因此,根据本发明的某些实施方案,首先生成单链DNA环,接着扩增单链DNA环;并分析扩增的单链DNA环。扩增的核酸可使用任何常规方法,例如测序、基因分型、比较基因组杂交等分析。在某些实施方案中,扩增的核酸通过全基因组测序分析。在其它实施方案中,扩增的核酸通过扩增的单链DNA环的定向测序分析。在某些实施方案中,通过使用其读取长度长于初始片段大小(即在环化前)的DNA测序方法测序,分析扩增的核酸。示例性方法可包括得自PacificBiosciences的纳米孔测序和SMRT(单分子实时(SingleMoleculeRealTime))测序技术。通过这些方法获得的序列信息借助于冗余测序而为更精确的,以弥补容易出错的所用方法的质量。在另一个方面,本发明提供一种从生物样本检测染色体重排断点的方法。因此,根据本发明的某些实施方案,首先生成单链DNA环,接着扩增单链DNA环;对扩增的单链DNA环测序;并通过比较该序列与已知的参考序列鉴定染色体重排断点。在一些实施方案中,提供用于分析生物样本的试剂盒。在一个实施方案中,所述试剂盒包含用于处理生物样本以释放核酸的提取剂;用于中和提取剂的试剂;和能够模板-非依赖性分子内连接单链DNA序列的连接酶。在一些实施方案中,提取剂包含蛋白酶K或去垢剂。在一些实施方案中,用于中和提取剂的试剂包含蛋白酶K抑制剂或环糊精。在其它实施方案中,连接酶是TS2126RNA连接酶(CircLigaseII)。在一些实施方案中,试剂盒还包含用于干燥样本混合物的固体基质。在一些实施方案中,试剂盒还包含修复一些类型的DNA损伤的酶。示例性的酶可以是多核苷酸激酶例如T4PNK。所述试剂盒还可包含缓冲剂(如,HEPES)、DNA扩增剂(如,DNA聚合酶、引物、dNTPs)和通过提供的方法用于单链DNA环的生成的其它试剂(如,MnCl2、甜菜碱)。在一些实施方案中,试剂盒可包括Phi29DNA聚合酶和随机/部分约束的引物。试剂盒可包括用于核酸分析的其它试剂,例如用于对扩增的核酸样本测序的试剂。试剂盒还可包括从线性DNA生成单链DNA环的用法说明书。实施例实施例1:在中和提取剂的存在下的环化反应中和的组织消化缓冲液通过合并30mMHEPES(pH8.0)、1mMEDTA、0.5%SDS、0.01%吐温-20,和2mg/ml蛋白酶K的溶液与2.5%α环糊精和0.25mM蛋白酶K抑制剂(EMDMillipore,肽序列MeOSuc-Ala-Ala-Pro-Phe-CH2Cl)来制备。将逐渐增加量的这种中和缓冲液加入到含有48mMHEPES(pH8.0)、0.5mMDTT、49.3mMKOAc、2.5mMMnCl2、500mM甜菜碱,和0.5µM磷酸化64-聚体寡核苷酸的30µl环化反应物中。于60℃孵育60min后,使用TBE缓冲液通过10%聚丙烯酰胺凝胶电泳分析反应,用SYBRGold(Invitrogen)染色并使用Typhoon成像仪可视化(图2(A))。对线性和环状物质的相对强度定量并作为环化的寡核苷酸的百分比绘图(图2(B))。如在图2中所示,组织消化缓冲液被中和并测试其对环化反应的影响。即使在6µl组织消化缓冲液的存在下,64-聚体磷酸化寡核苷酸的环化效率在30µl反应物中是相对不受影响的,表明所述组织消化缓冲液已被成功地中和。实施例2:使用高Tm引物的扩增反应更耐遗留抑制作用通过在1.2mmFTA穿孔卡上干燥1µl溶胞缓冲液并执行中和来制备遗留混合物。这种遗留混合物含有53mMHEPES(pH8.0)、0.18mMEDTA、0.05%SDS、0.07mg/ml蛋白酶K、0.01%吐温-20、0.8%α-环糊精、16.7mMNaCl、2.6mMTris(pH7.9)、3.3mMMgCl2、2.2mMDTT、25µMATP、3.3µMdNTPs、2.5mMMnCl2、500mM甜菜碱、0.6mM尿酸,和0.08mM蛋白酶K抑制剂。将逐渐增加量的遗留混合物加入到包含20mMKCl、1ng人基因组DNA,和指定的随机六聚体的20µl扩增反应物中。通过加入少量SYBR绿I(SYBRgreenI)至扩增混合物中,并在Tecan板读出仪中监测荧光随着时间推移的增加,进行实时扩增。确定荧光达到4000RFU的阈值的时间并作图。图3显示,使用锁定核酸(LNA)或桥接核酸(BNA)-修饰的随机六聚体的全-基因组扩增反应对遗留抑制剂的存在比使用标准的dN6六聚体进行的反应有更大的抗性。而来自环化反应的缓冲液成分的遗留对使用标准的dN6六聚体“NNNN*N*N”的全-基因组扩增反应有显著的负面影响,抑制作用可通过利用LNA或BNA六聚体来减少。AT随机六聚体具有序列“+N+N(atN)(atN)(atN)*N”,其中+在LNA碱基之前,*表示硫代磷酸酯连键,和(atN)表示2-氨基-dA、t-硫代-dT、正常的dC,和正常的dG的随机混合物。BNA六聚体具有序列“–N-NNN*N*N”,其中“-“表示BNA3碱基(Biosynthesis)。包含LNA或BNA的随机六聚体的使用允许使用不太纯的输入材料并允许用来自单管溶胞的成分进行扩增反应,来自生物样本的DNA的中和、修复和环化反应,而无需在前的DNA纯化。实施例3:直接从人体组织扩增片段化DNA刮去包含固定的SKOV3异种移植组织的脱石蜡切片并于50℃在包含30mMHEPES(pH8.0)、1mMEDTA、0.5%SDS、0.01%吐温-20,和0.5mg/ml蛋白酶K的溶胞缓冲液中经历消化1小时。将相当于大约1ng片段化DNA的1µl溶胞产物施加于1.2mmFTA穿孔纸中并使之干燥。在5µl中用2.5%α环糊精和0.25mM蛋白酶K抑制剂(EMDMillipore,肽序列MeOSuc-Ala-Ala-Pro-Phe-CH2Cl)中和后,组织溶胞产物被直接用来修复和环化。修复反应物(10µl)另外含有50mMNaCl、10mMMgCl2、5mMDTT、75uMATP、10mMdNTPs、NEB酶大肠杆菌(E.coli)聚合酶I(1U)、T4DNA连接酶(40U)、核酸内切酶IV(1U)、UDG(0.5U)、APE1(1U),和T4多核苷酸激酶(0.5U)并于37℃孵育30min,随后于85℃经15min。于95℃加热修复反应物以使DNA变性,然后在冰上快速冷却。环化反应物(30µl)另外含有48mMHEPES(pH8.0)、0.5mMDTT、49.3mMKOAc、2.5mMMnCl2、500mM甜菜碱。加入120U的CircLigaseII(EpiCentre),然后将反应物于60℃孵育8小时,然后通过于80℃孵育10分钟灭活酶。滚环扩增反应(60µl)另外含有25mMHEPES(pH8.0)、19mMMgCl2、400µMdNTPs、1mMTCEP、2.5%PEG-8000、40µMAT随机六聚体,和1.2µgPhi29DNA聚合酶。通过加入少量的SYBR绿I(SYBRgreenI)至扩增混合物中并在Tecan板读出仪上监测随时间推移的荧光增加(图4(A)),进行实时扩增。测定荧光达到4000RFU阈值的时间并作图(图4(B))。图4(A)中的上图对应于图4(B)(K562)中的第一个数据点,和图4(A)中的底图对应于图4(B)(FFPE加修复和环化)中的最后的数据点。图4显示从人体组织直接扩增片段化DNA的实例。消化SKOV3异种移植物组织,中和反应,并使相当于大约1ng的片段化DNA的溶胞产物经受如所指定的修复和环化的组合。经处理的DNA的全-基因组扩增动力学显示,经历环化的反应更快速地进行,表明片段化DNA在这些条件下已成功地经历环化,且扩增反应已转换为更快的滚环机制。实施例4:修复和环化后改进的序列覆盖率和SNP检测于室温下,将一块SKOV3异种移植物组织在25%中性-缓冲的福尔马林中固定10天并纯化DNA。使50ng这种片段化DNA经受如在图3中描述的修复和/或环化,除了修复酶混合物只含有T4多核苷酸激酶、UDG,和0.8UFpg外。实时DNA扩增通过加入少量SYBR绿I(SYBRgreenI)至扩增混合物中并在Tecan板读出仪上监测随时间推移的荧光增加来进行(图5A)。纯化后,扩增的DNA通过准备条形码化的IlluminaTruSeqAmpliconCancerPanel文库并根据制造商的指示,使用MiSeq测序仪(Illumina)测序来分析。将读出映射至人基因组DNA参考序列,并对覆盖率的深度作图(图5B)。此外,进行变量分析以确定检测的SNPs的数目和在这些位置的覆盖率深度(图5B)。在图5中,来自高度福尔马林-固定的SKOV3异种移植物组织的DNA经历多-步骤单管扩增方案,包括组织溶解、中和、用如所指明的修复和/或环化酶处理,接着通过RCA扩增DNA。其中DNA已经历环化的反应的较快扩增动力学表明来自组织溶解步骤的蛋白酶K和SDS的成功的中和以及片段化DNA向环状形式的转化。此外,扩增的DNA通过准备IlluminaTruSeqAmpliconCancerPanel文库并使用MiSeq测序仪(Illumina)测序来分析。结果证实经历修复和环化的反应的覆盖率深度显著地改进。比较未扩增的FFPEDNA序列与参考基因组序列,揭示总共21个单核苷酸多态现象(SNPs)。对于扩增的DNA,发明人发现更多的这些SNPs被检测,且当DNA用修复和环化处理时,在这些位置的平均覆盖率深度更高。虽然已显示和描述了本发明的具体实施方案,对本领域技术人员而言显而易见的将是,在不背离本发明的教导的情况下可进行改变和修饰。在前述的说明书和附图中提出的主题仅仅通过举例来提供且不作为一种限制。本发明的实际范围当以基于现有技术以适当观点评述时,意图在以下的权利要求书中限定。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1