用具有引入的儿茶酚基团和氧化的儿茶酚基团的交联壳聚糖涂布的无出血注射针的制作方法
本发明涉及用其中引入儿茶酚(catechol)基团和氧化的儿茶酚基团并交联的壳聚糖(chitosan)涂布的止血注射针。
背景技术:
常规止血和粘合剂产品的发展一直侧重于其在外科手术中的应用。典型的医用止血剂和粘合剂包括由fda批准的基于氰基丙烯酸酯的粘合剂和基于体内血液凝固蛋白的纤维蛋白胶。然而,这种止血和粘合剂产品不能满足所有的粘合强度、施用后的持久性、低毒性、体内免疫应答等。因此,在止血剂的开发中,开发具有生物相容性同时对组织具有优异粘附性的材料已经成为一个重要问题。
同时,壳聚糖是众所周知的具有优异止血能力的生物聚合物。然而,壳聚糖的缺点在于其在中性溶液中具有显著低的溶解度,并且仅在酸性溶液中溶解。由于这样的缺点,壳聚糖作为医用材料的使用受到限制。
因此,已经报道了对于引入重要官能团儿茶酚的研究,所述儿茶酚有助于贻贝(mussel)粘附,从而增加壳聚糖的溶解度和壳聚糖对粘膜和组织的粘附。例如,国际专利公开wo2013-077475公开了一种粘附性水凝胶组合物,其包含:儿茶酚基团偶联壳聚糖;和具有与其末端偶联的硫醇基的普郎尼克类(pluronic)。更具体地,wo2013-077475公开了一种粘合剂组合物,其在体内和体外是稳定的,具有温度敏感性,具有优异的止血效果,且因此可用作生物粘合剂,并且还公开了用于医疗用途的粘合剂、抗粘合剂和表面吸附防止剂,其包含粘合剂组合物。此外,使用儿茶酚基团偶联的壳聚糖形成的水凝胶或膜具有优异的功能,使得其可代替外科手术中使用的常规止血剂。
然而,如上所述的制剂(formulation)是考虑到外科手术的便利性而开发的形式,并且具有不能全部满足粘附强度、施用后的持久性、低毒性、体内免疫应答等的问题。
因此,发明人进行了研究,开发出作为不会引起任何出血的新型医疗装置的止血注射针,且结果发现涂布有壳聚糖的注射针,其中根据本发明引入儿茶酚基团
技术实现要素:
本发明的目的是提供一种用于在注射期间和之后防止出血的注射针涂布水凝胶。
本发明的另一个目的是提供一种止血注射针,其包含涂布在其表面上的上述注射针涂布水凝胶。
本发明的另一个目的是提供一种制造上述止血注射针的方法。
本发明的另一个目的是提供一种使用上述止血注射针的不引起任何出血的注射方法。
为了实现上述目的,本发明提供一种用于涂布注射针的水凝胶,所述注射针防止注射期间出血,所述水凝胶包含向其中引入儿茶酚基团且至少一部分所述儿茶酚基团是氧化和交联的壳聚糖。
本发明还提供一种止血注射针,其包含涂布在其表面上的上述注射针涂布水凝胶。
本发明还提供一种制备上述止血注射针的方法,该方法包括以下步骤:
(1)制备壳聚糖的溶液,其中引入儿茶酚基团
(2)用步骤(1)的溶液涂布注射针的表面。
本发明还提供一种不引起出血的注射方法,该方法包括以下步骤:
(1)制备壳聚糖的溶液,其中引入儿茶酚基团
(2)通过用步骤(1)的溶液涂布注射针的表面来制备止血注射针;和
(3)通过使用步骤(2)中制备的止血注射针对人或动物进行注射。
附图简述
图1描绘了所进行的用于分析实施例1中制造的止血注射针的形状和组分的扫描电子显微镜法的结果的图像。
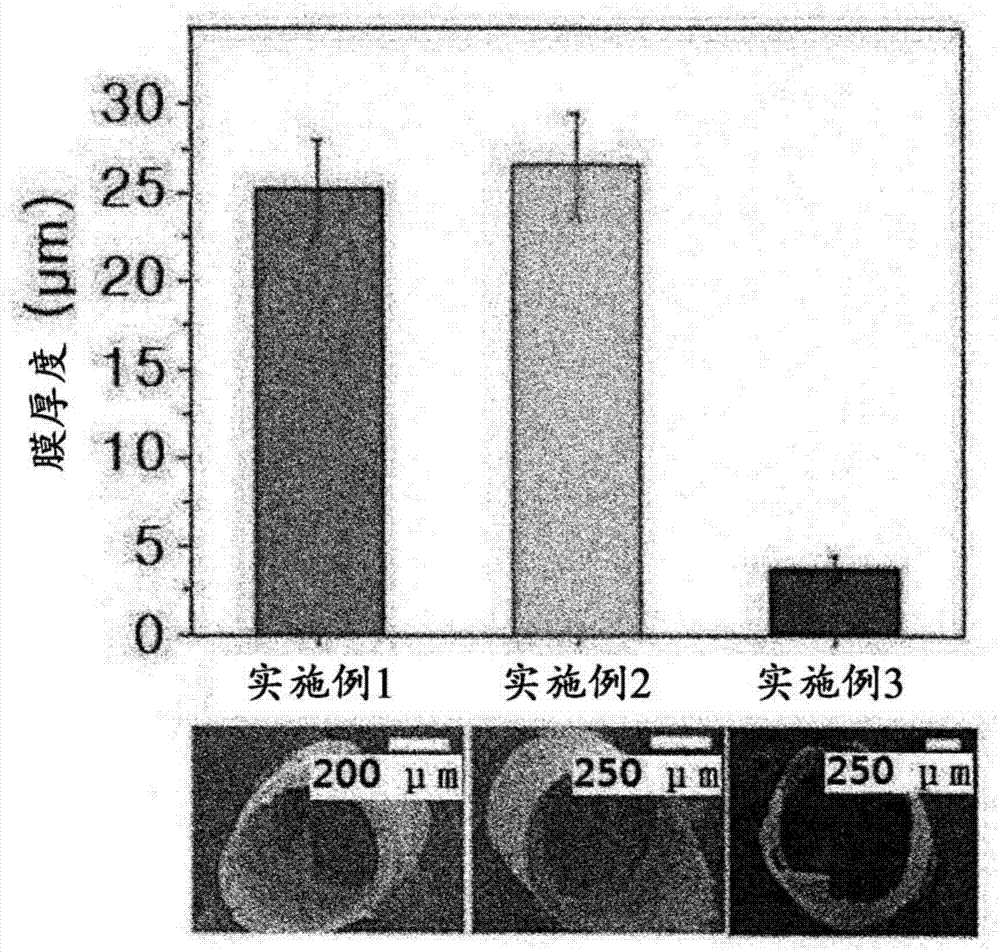
图2是显示实施例1至3中制造的各止血注射针上涂布的膜的厚度的图,图2的底部的图像显示通过扫描电子显微镜测量的膜形状。
图3显示所进行的用于确证实验例1中制造的止血注射针的止血机理的离体实验。
图4(a)显示用于制造止血注射针的壳聚糖-儿茶酚溶液(红色)的uv-vis光谱法的结果。蓝色光谱对应于用作对照的壳聚糖-儿茶酚溶液,其中不诱导儿茶酚的部分氧化和交联。
图4(b)显示用于制造止血注射针的壳聚糖-儿茶酚溶液(红色)的1氢核磁共振分析的结果。
图4(c)是显示通过将由壳聚糖-儿茶酚溶液各自形成的膜暴露于盐水所观察到的流变学性质的图(上部:未诱导儿茶酚的部分氧化和交联的壳聚糖-儿茶酚溶液;下部:实施例1至3中使用的壳聚糖-儿茶酚溶液)。
图5(a)显示实施例1中制造的止血注射针的体内实验结果。具体而言,图5(a)显示使用小鼠隐静脉模型评价的止血效果;图5(b)是显示使用小鼠隐静脉模型所观察到的出血量的图;且图5(c)显示使用兔耳静脉模型所评价的止血效果。
具体实施方式
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。通常,本文使用的命名法和下文将描述的实验方法是本领域中公知的和通常使用的那些。
以下将对本发明进行详细说明。
本发明提供一种用于涂布注射针的水凝胶,所述注射针防止注射期间出血,所述水凝胶包含向其中引入儿茶酚基团且至少一部分儿茶酚基团是氧化和交联的壳聚糖。
在本文中,水凝胶中儿茶酚基团的-oh基团被部分氧化为=o基团,然后通过与壳聚糖中所含的-nh2基团的脱水缩合反应来进行交联,且儿茶酚基团的氧化程度优选为水凝胶中所含的儿茶酚基团的1至20%(基于摩尔数)。如果儿茶酚基团的氧化程度小于水凝胶中所含的儿茶酚基团的1%,则存在与壳聚糖中所含的-nh2基团交联没有被充分诱导的问题,而如果儿茶酚基团的氧化程度大于水凝胶中所含的儿茶酚基团的20%但不超过水凝胶中所含的儿茶酚基团的80%,则可对针进行涂布,但是存在涂布膜的固化程度增加使得膜不能展现止血效果的问题。如果儿茶酚基团的氧化程度大于水凝胶中所含的儿茶酚基团的80%,则存在通过交联所引起的固化程度提高的问题,并由此获得对于涂布针而言不期望的性质。
表述“通过脱水缩合反应来进行交联”是指,如下反应方案1所示,氧化的儿茶酚基团
反应方案1
其中由式1表示的化合物表示引入儿茶酚基团
其中由式2表示的化合物表示引入儿茶酚基团
其中由式3表示的化合物表示通过由式1表示的化合物与由式2表示的化合物之间的脱水缩合反应得到的化合物;和
其中l为单键、c1-8直链或支链亚烷基或-c(=o)-r1-,其中r1为单键或c1-8直链或支链亚烷基。
具体而言,引入儿茶酚基团
式4
其中x:y:z优选为6:1:3。
本发明还提供一种止血注射针,其包含涂布在其表面上的上述注射针涂布水凝胶。在本文中,涂布在止血注射针上的水凝胶的厚度优选为2至30μm。如果厚度小于2μm,则存在以下问题:所包含的水凝胶的量不足以防止在注射期间和注射后发生的出血,且因此不能有效防止出血,而如果厚度大于30μm,则存在以下问题:涂布在针上的水凝胶的厚度较厚,且因此在注射期间水凝胶不会与注射针一起进入生物体并被皮肤推压,这表明未有效预防出血。
本发明还提供一种制造上述止血注射针的方法,该方法包括以下步骤:
(1)制备壳聚糖的溶液,其中引入儿茶酚基团
(2)用步骤(1)的溶液涂布注射针的表面。
在下文中,将逐步地详细描述止血注射针的制造方法。
在本发明的止血注射针的制造方法中,步骤(1)为制备壳聚糖的溶液的步骤,其中引入儿茶酚基团
在这种情况下,所述溶液可如下获得:使引入儿茶酚基团的壳聚糖溶于溶剂中,并储存该壳聚糖溶液以诱导儿茶酚基团的部分氧化和交联。在本文中,壳聚糖的储存温度优选为0至20℃,更优选为2至10℃,进一步优选为3至5℃,最优选为4℃。此外,储存壳聚糖的时间优选为1至5天,更优选为2至4天,最优选为3天。基于溶液的总重量,引入儿茶酚基团的壳聚糖的含量优选为1至2重量%,更优选为1.3至1.7重量%,最优选为1.5重量%。
如果壳聚糖的储存温度和时间以及引入儿茶酚基团的壳聚糖的含量在上述范围之外,则可能会出现以下问题:不能获得涂布止血注射针所需的膜的物理性质。
在本发明的止血注射针的制造方法中,步骤(2)是用步骤(1)的溶液涂布注射针的表面的步骤。具体而言,步骤(2)是以下步骤:将溶液置于注射针上,然后以一定速度旋转注射针的同时均匀地涂布注射针的表面。
在这种情况下,可取决于使用的溶液的量来调节注射针的涂布厚度,并且因此可涂布具有各种不同直径的注射针。
本发明还提供一种不引起出血的注射方法,该方法包括以下步骤:
(1)制备壳聚糖的溶液,其中引入儿茶酚基团
(2)通过用步骤(1)的溶液涂布注射针的表面来制备止血注射针;和
(3)通过使用步骤(2)中制备的止血注射针对人或动物进行注射。
在下文中,将逐步地详细描述不引起出血的注射方法。
在本发明的不引起出血的注射方法中,步骤(1)为制备壳聚糖的溶液的步骤,其中引入儿茶酚基团
在这种情况下,所述溶液可如下获得:使引入儿茶酚基团的壳聚糖溶于溶剂中,并储存该壳聚糖溶液以诱导儿茶酚基团的部分氧化和交联。在本文中,壳聚糖的储存温度优选为0至20℃,更优选为2至10℃,进一步优选为3至5℃,最优选为4℃。此外,储存壳聚糖的时间优选为1至5天,更优选为2至4天,最优选为3天。基于溶液的总重量,引入儿茶酚基团的壳聚糖的含量优选为1至2重量%,更优选为1.3至1.7重量%,最优选为1.5重量%。
如果壳聚糖的储存温度和时间以及引入儿茶酚基团的壳聚糖的含量在上述范围之外,则可能会出现以下问题:不能获得涂布止血注射针所需的膜的物理性质。
在本发明的不引起出血的注射方法中,步骤(2)是通过用步骤(1)的溶液涂布注射针的表面来制备止血注射针的步骤。具体而言,步骤(2)是以下步骤:将溶液置于注射针上,然后以一定速度旋转注射针的同时均匀地涂布注射针的表面。
在这种情况下,可取决于使用的溶液的量调节注射针的涂布厚度,并且因此可涂布具有各种不同直径的注射针。
在本发明的不引起出血的注射方法中,步骤(3)是通过使用步骤(2)中制备的止血注射针对人或动物实施注射的步骤。
在本文中,不引起出血的注射方法的特征在于,止血注射针的表面上的涂层在体内暴露于水溶性环境,并且经历相转变而成为水凝胶,其密封由注射引起的刺孔部位,从而防止出血。为了确保足够的转化为水凝胶的时间,止血注射针优选在注射后10至30秒内维持注射状态。如果止血注射针在体内维持的时间小于10秒,则存在以下问题:不能确保足够的转化为水凝胶的时间,且因此未有效防止出血,而如果止血注射针在体内维持的时间大于30秒,则可确保足够的转化为水凝胶的时间,但是会出现由于皮肤刺激而发生瘀伤的问题。
进行以下实验以评价本发明的止血注射针的止血能力。
首先,用扫描电子显微镜观察实施例1中制造的止血针。观察结果发现,实施例1中制造的止血注射针保持形状,并且注射针的表面涂布均匀。此外,通过能量弥散x射线光谱法分析实施例1中制造的止血注射针的表面上的涂层的成分。分析结果发现,在未涂布的注射针的表面中检测到作为注射针的材料的元素诸如铬、铁等,而在实施例1中制造的止血注射针的表面中检测到作为儿茶酚官能化壳聚糖中含有的主要元素的碳、氮、氧等(参见实验实施例1的图1)。
此外,为了分析在实施例1至3中制造的止血注射针的表面上的涂布膜的厚度,将膜分离并通过扫描电子显微镜测量其厚度。测量结果发现,随着每个止血注射针的厚度增加,形成的壳聚糖-儿茶酚膜的厚度由于止血注射针上的表面张力而降低。具体而言,发现实施例1至3中制造的止血注射针的表面上涂布的膜的厚度分别为25.2±2.8μm、26.6±3.0μm、3.8±0.7μm(参见实验实施例2的图2)。
此外,进行离体实验以评价实施例1中制造的止血注射针的止血能力。实验结果发现,在常规注射针中发生盐水渗漏,而在实施例3中制造的止血注射针中,由于在皮下组织刺穿15至20秒后发生的注射针上的涂布膜向水凝胶的转化,因此密封皮下组织中的刺孔并防止盐水渗漏(参见实验实施例3的图3)。
此外,发现为了验证如实验实施例3所证实的止血注射针的表面上的膜向水凝胶的转化,通过uv-vis光谱法分析用于制造止血注射针的壳聚糖-儿茶酚溶液的性质(参见实验实施例4的图4(a))。
此外,为了确证如实验实施例3所示的在止血注射针的表面上形成的涂布膜向水凝胶的转化,通过1氢核磁共振光谱法进行分析。结果发现,通过儿茶酚的部分氧化形成中间体(参见实验实施例4的图4(b))。
此外,发现将通过干燥300μl实施例中使用的壳聚糖-儿茶酚溶液而形成的膜暴露于盐水15至20秒,然后所形成的材料具有水凝胶的性质(参见实验实施例4的图4(c))。
此外,进行体内实验来评价实施例1中制造的止血注射针的止血能力。实验结果发现,在实施例1中制造的止血注射针中,由壳聚糖-儿茶酚溶液形成的涂层转化为水凝胶并溶胀,这表明止血注射针与常规注射针相比具有明显更好的止血效果(参见实验实施例5的图5(a))。
此外,发现在总计3次实验(n=3)中,常规注射针显示的总出血量为31.3μl,而实施例1中制造的止血针没有引起任何出血(参见实验实施例5的图5(b))。此外,发现常规注射针在注射至兔耳静脉期间和之后引起出血,而实施例2中制造的止血注射针在注射期间和之后没有引起出血(参见实验实施例5的图5(c))。
因此,本发明的止血注射针可抑制注射期间和之后的出血,且因此不仅可有效用于注射至患者包括糖尿病患者、进行抗癌治疗的患者和具有低止血能力的血友病患者,还可有效用于注射至显示出血液排斥反应的患者和儿童。
在下文中将参照实施例和实验实施例更详细地描述本发明。
对于本领域普通技术人员显而易见的是,这些实施例和实验实施例仅是说明性目的,而不应被解释为限制本发明的范围。
制备实施例1:制备引入儿茶酚的壳聚糖
将3g约30%乙酰化壳聚糖(壳聚糖70/100,型号:24204,由heppemedicalchitosan制造)溶于292mlhcl溶液(ph=2)中6小时。通过向其中慢慢添加8ml0.5nnaoh溶液,将壳聚糖溶液调节至ph5.5。将制备的1%壳聚糖溶液稳定化12小时。
向制备的壳聚糖溶液中添加2.37g3-(3,4-二羟基苯基)丙酸。然后,作为用于形成壳聚糖的胺(-nh2)基团和3-(3,4-二羟基苯基)丙酸的羧基(-cooh)之间的酰胺键(-conh-)的反应混合物,将2.02g1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)溶于50ml乙醇并添加至该壳聚糖溶液中。接着,将溶液调节至ph4.5,然后反应1小时。在该过程中,制备儿茶酚官能化壳聚糖。
为除去未反应的3-(3,4-二羟基苯基)丙酸和1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc),将反应后的溶液在4.5l含有氯化钠和3ml5nhcl的三重蒸馏水中使用透析膜(截留分子量:12,000-15,000)透析3天。另外,将溶液在4.5l含有3ml5nhcl的三重蒸馏水中透析2天。最后,将溶液用三重蒸馏水透析6小时,然后冻干,由此制备儿茶酚官能化壳聚糖(x:y:z=6:1:3)。
实施例1:止血注射针(26g)的制造1
将1.5ml制备实施例1中制备的儿茶酚官能化壳聚糖溶于100μl三重蒸馏水中,然后在4℃储存3天,以诱导儿茶酚基团的部分氧化和交联。结果是,制备壳聚糖溶液(下文称为“壳聚糖-儿茶酚溶液”),其中引入儿茶酚基团
通过uv-vis光谱法测量500nm波长处的吸光度,确定壳聚糖-儿茶二酚溶液中儿茶酚基团的氧化程度。当形成氧化的儿茶酚基团和壳聚糖的胺基团之间的交联时,出现500nm波长处的吸光度。因此,基于出现的吸光度,以等于儿茶酚基团的摩尔数的三倍的量,用naio4(即诱导壳聚糖-儿茶酚溶液氧化至最高可能程度的氧化剂)处理壳聚糖-儿茶酚溶液,评价壳聚糖-儿茶酚溶液的氧化程度。结果表明,壳聚糖-儿茶酚溶液的氧化程度为4.5至5.5%。
同时,为了稳定地涂布制备的壳聚糖-儿茶酚溶液,用氧等离子体处理26g厚的注射针10分钟。然后,在室温和40rpm转速,将6.5μl壳聚糖-儿茶酚溶液置于注射针上并在注射针上涂布且持续1小时,并干燥2小时。重复该操作两次,从而制造止血注射针。
实施例2:止血注射针(23g)的制造1
以与实施例1所述相同的方式制造止血注射针,除了使用23g厚的注射针代替26g厚的注射针,并且使用9μl代替6.5μl量的壳聚糖-儿茶酚溶液。
实施例3:止血注射针(18g)的制造3
以与实施例1所述相同的方式制造止血注射针,除了使用18g厚的注射针代替26g厚的注射针,并且使用20μl代替6.5μl量的壳聚糖-儿茶酚溶液。
实验实施例1:观察止血注射针的形状
用扫描电子显微镜(hitachis-4800)观察实施例1中制造的止血注射针,观察结果如图1所示。
图1描绘了所进行的用于分析实施例1中制造的止血注射针的形状和组分的扫描电子显微镜的结果的图像。
如图1所示,保持实施例1中制造的止血注射针的形状,并且将壳聚糖-儿茶酚溶液均匀地涂布在注射针的表面上。
此外,通过能量弥散x射线光谱仪分析实施例1中制造的止血注射针的表面上的涂层的组分。使用连接至扫描电子显微镜的能量弥散x射线光谱仪,检测当测量实施例1中制造的止血注射针的表面上的涂层时发生的荧光x射线,并对检测到的元素分析120秒。
结果是,如图1的底部所示,在未涂布的注射针的表面中,检测到作为注射针的材料的元素诸如铬、铁等,而在实施例1中制造的止血注射针的表面中,检测到作为儿茶酚官能化壳聚糖中所含的主要元素的碳、氮、氧等。
因此,显示精确制造本发明的止血注射针。
实验实施例2:厚度分析
为了分析实施例1至3中各自制造的止血注射针的表面上的涂布膜的厚度,将膜分离并通过扫描电子显微镜(hitachis-4800)测量其厚度。测量结果如图2所示。
图2是表示实施例1至3中制造的各止血注射针上涂布的膜的厚度的图,图2的底部的图像显示通过扫描电子显微镜测量的膜形状。
如图2所示,随着每个止血注射针的厚度增加,形成的壳聚糖-儿茶酚膜的厚度由于止血注射针上的表面张力而降低。然而,由于实施例1(26g)的止血注射针与实施例2(23g)的止血注射针之间的厚度差异不大,所以实施例1的表面上的膜厚度与实施例2的表面上的膜厚度之间没有很大差异。具体而言,实施例1至3中制造的止血注射针的表面上涂布的膜的厚度分别为25.2±2.8μm、26.6±3.0μm和3.8±0.7μm。
实验实施例3:止血能力的离体评价
为了评价实施例3中制造的止血注射针的止血能力,如图3所示进行离体实验。具体而言,用裸鼠的皮下组织(balbc裸鼠,8周龄,雄性,23至25g)封闭各注射器管的一端,并将每个注射器管内装满盐水。然后,用实施例3制造的止血注射针(18g)或常规注射针刺穿皮下组织,并观察盐水是否通过刺孔泄漏。
图3显示所进行的用于确证实验例1中制造的止血注射针的止血机理的离体实验。
如图3所示,在常规注射针中,发生盐水泄漏,而在实施例3中制造的止血注射针中,由于在皮下组织刺穿15至20秒后发生的注射针上的涂布膜向水凝胶的转化,密封皮下组织中的刺孔并防止盐水渗漏。
实验实施例4:分析膜性质以确证止血机理
为了验证如实验实施例3所证实的止血注射针的表面上的膜向水凝胶的转化,通过uv-vis光谱法(hp8453,hewlettpackard)分析用于制造止血注射针的壳聚糖-儿茶酚溶液的性质。分析结果示于图4(a)。
图4(a)显示用于制造止血注射针的壳聚糖-儿茶酚溶液(红色)的uv-vis光谱法的结果。蓝色光谱对应于用作对照的壳聚糖-儿茶酚溶液,其中不诱导儿茶酚的部分氧化和交联。
如图4(a)所示,uv-vis光谱法的测量结果显示波长500nm处的吸光度,并由此部分氧化壳聚糖-儿茶酚溶液中的儿茶酚。
此外,通过1氢核磁共振光谱法(brukerav-300)进行分析。结果是,如图4(b)所示,通过儿茶酚的部分氧化形成中间体。
图4(b)显示用于制造止血注射针的壳聚糖-儿茶酚溶液(红色)的1氢核磁共振分析的结果。
此外,将通过干燥300μl壳聚糖-儿茶酚溶液所形成的膜暴露于盐水中15至20秒,然后通过流变仪(bohlinadvancedrheometer,malverninstruments)分析所形成的材料。结果是,如图4(c)所示,所形成的材料具有水凝胶的性质。
图4(c)是显示通过将由壳聚糖-儿茶酚溶液各自形成的膜暴露于盐水所观察到的流变学性质的图(上部:其中未诱导儿茶酚的部分氧化和交联的壳聚糖-儿茶酚溶液;下部:实施例1至3中使用的壳聚糖-儿茶酚溶液)。
具体而言,将由实施例1至3中使用的壳聚糖-儿茶酚溶液形成的膜置于流变仪的样品架上,基于储能模量(storagemodulus)(g')和损耗模量(lossmodulus)(g”)分析材料的变形程度,而通过使用20mm厚的平行板以0.1-10rad/sec的频率施加100pa的剪切应力。储能模量(g')和损耗模量(g”)用以下等式1计算:
等式1
σ=γo[g′(ω)sin(ωt)+g"(ω)cos(ωt)]
其中σ为施加到材料上的剪切应力;
γ0为由于材料变形所出现的剪切应变的最大振幅;
g'为储能模量;
g"为损耗模量;
ω为频率;和
t为时间。
如图4(c)的上部所示,由其中未引入儿茶酚的氧化和交联的壳聚糖-儿茶酚溶液所形成的膜部分显示,在大部分区域中损耗模量(g")大于储存模量(g'),这表明没有形成水凝胶。
然而,如图4(c)的下部所示,由实施例1至3中使用的壳聚糖-儿茶酚溶液所形成的膜显示,在整个区域中储能模量(g')大于损耗模量(g”),这表明形成了水凝胶。
实验实施例5:止血能力的体内评价
为了评价实施例1和2中制造的止血注射针的止血能力,进行以下实验。
首先,制备小鼠隐静脉模型(balbc裸鼠,8周龄雄性,23至25g)和兔耳静脉模型(新西兰白兔,12-14周龄雌性,2.5至3.0kg)。接着,为了确保实施例1或2中制造的止血注射针的表面上涂布的膜将转化为水凝胶的充分时间,注射后20秒取出注射针。结果示于图5。
图5(a)显示实施例1或2中制造的止血注射针的体内实验结果。具体而言,图5(a)显示通过实施例1中制造的注射针使用小鼠隐静脉模型所评价的止血效果;图5(b)是显示使用小鼠隐静脉模型所观察到的出血量的图;且图5(c)显示通过实施例2中制造的注射针使用兔耳静脉模型所评价的止血效果。
如图5(a)所示,在实施例1中制造的止血注射针中,由壳聚糖-儿茶酚溶液形成的涂层转化为水凝胶并溶胀,这表明止血注射针与常规注射针相比具有明显更好的止血效果。
另外,如图5(b)所示,在总计3次实验(n=3)中,常规注射针显示总出血量为31.3μl,而实施例1中制造的止血针没有引起任何出血。
此外,如图5(c)所示,常规注射针在注射至兔耳静脉期间和之后引起出血,而实施例2中制造的止血注射针在注射期间和之后不引起任何出血。
因此,本发明的止血注射针用其中引入儿茶酚基团
工业实用性
本发明的止血注射针可抑制注射期间和之后的出血,且因此不仅可有效用于注射至患者包括糖尿病患者、进行抗癌治疗的患者和具有低止血能力的血友病患者,还可有效用于注射至显示出血液排斥反应的患者和儿童。
尽管已经参照具体特征详细描述了本发明,但是对于本领域技术人员将显而易见的是,本说明书仅针对优选实施方案,并不限制本发明的范围。因此,本发明的实质性范围将由所附权利要求及其等同物来限定。
- 还没有人留言评论。精彩留言会获得点赞!