抗菌的α-螺旋阳离子多肽的制作方法
本申请根据U.S.C.§119(e)的规定,要求下述在先申请的优先权:2015年6月26日提交的美国临时专利申请62/185,345,其在此通过引用纳入本文。
政府支助
本发明是在美国政府支助下,通过National Institutes of Health提供的拨款CHE-1153122以及National Institutes of Health提供的项目1DP2OD007246和1R21EB013379的资助进行的。美国政府对本发明享有某些权利。
背景技术:
抗菌肽(AMPs)通常含有~40-60个氨基酸,由阳离子和疏水氨基酸组成。它们具有各种二级结构(如α-螺旋)并且能够灭杀一些细菌。AMPs靶向细菌膜的一般的和必要的脂类组分而且较少依赖于特定的细菌代谢状态,从而耐药性的发展缓慢。由于这个特点,AMPs作为临床上潜在的抗菌剂受到很大关注。在已经开发的所有AMPs中,α-螺旋肽是被研究最多的,通过分开位于所述螺旋的相对面的阳离子和疏水氨基酸,表现出“表面两亲”(facially amphiphilic,FA)结构。这种结构与抗菌活性具有很好地相关性(Brogden(2005)Nat Rev Microbiol 3(3):238-250)。近期工作表明AMPs的氨基酸含量是如何通过特定类型膜曲率形成来支持这种活性(Schmidt et al.(2011)J Am ChemSoc133(17):6720-6727)。
AMPs的商业开发,虽经很大努力,成果却有限,其原因部分在于肽本身存在的缺点。尽管人们在有关AMP机理的基础研究方面已有不少了解,但是与偏离目标的真核细胞毒性相比,目前还不可能对AMP的活性、治疗指数和抗菌活性做到精确、定量的预测。对新的AMP相关抗生素的设计依赖于序列调控的肽合成以及参数的优化,而这些都是昂贵的并且需要耗费大量劳动。大多数AMP衍生抗生素的另一个缺点是它们在生物体系中的稳定性差,例如,LL-37和马盖宁(magainin)在血液循环中可在几分钟之内被蛋白酶降解并失去其抗菌活性。最后,AMPs的一个显著缺点与其具有暴露的疏水性螺旋面‘FA’结构有关(图1a),这导致非期望的与血蛋白的多肽相互作用和自聚集。已有报道,AMP螺旋束会导致抗菌活性的显著下降(Baharand Ren(2013)Pharmaceuticals(Basel)6(12):1543-1575)。
对于开发AMP类似物,例如β-肽类、α/β-肽类、类肽类和芳香族低聚物,已经得到很大程度的关注。有些这类的化合物已经被证明比常规的AMPs具有更好的稳定性。它们通常是序列特异的,并且需要固相肽合成,因此与AMPs具有相似的优点和开发方面的缺陷。同时携带阳离子和疏水基团的基于合成聚合物的AMP模拟物也越来越受到关注,其可以通过成本有效的聚合方法来制备。例如,已经开发了简化的聚合体AMP类似物,包括聚(甲基丙烯酰胺)、聚(β-内酰胺)、多肽、聚(降冰片烯)和聚(碳酸酯)。这些化合物被认为比肽类更便宜,而且对于它们的优化已经开展了很多的工作。
尽管有了一些进展,但仍需要制备新的AMPs,使其得到结构和组成控制,并且提高体内稳定性以及降低或消除对哺乳动物的毒性。另外还需要高度选择性的抗生素,避免出现抗性的抗生素,以及与现有抗生素可以协同作用的抗生素。
技术实现要素:
本文描述了具有具有季铵基团和长的疏水性侧链的稳定的α-螺旋结构的一系列阳离子多肽。与相应的非螺旋多肽相比,所述螺旋多肽表现出径向两亲性(radial amphiphilicity)并且表现出显著更高的抗菌活性,并且相对于哺乳动物细胞针对细菌具有高选择性。所述螺旋阳离子多肽通过膜溶解机制破坏细菌膜,使得能够实质上规避抗药性。所述螺旋多肽的膜破坏机制也增加了细菌对小分子抗生素的渗透性,因此增强和协同了许多商业抗生素的抗菌活性。因此,所述抗菌的螺旋多肽是有前途的抗菌药物,用于治疗各种细菌感染和相关疾病。
由此,本发明提供了一种径向两亲聚合物,包括式I:
或其盐;其中m为约6至约100;n为1,2或3;以及X为脂肪族或芳香族季铵盐基团。在一个具体实施方式中,所述聚合物包括式II的聚合物:
或其盐;其中:m为约6至约100。在各种实施方式中,所述聚合物可以是具有式III的聚合物:
或其盐;其中R0为(C1-C60)烷基,以及Rx为H或甲硅烷基。
所述径向两亲聚合物可用于制备包含所述聚合物和药学上可接受的稀释剂或载体的医药组合物。所述医药组合物还可以包含第二抗生素,例如氨基糖苷、四环素或β-内酰胺。
本发明还提供了抑制细菌生长或灭杀细菌的方法,包括在足以灭杀或抑制细菌生长的条件下,使细菌与包含本文所述径向两亲性聚合物的组合物接触。
本发明还提供了治疗哺乳动物细菌感染的方法,其包括向感染致病细菌的哺乳动物施用有效量本文所述的径向两亲性聚合物,从而通过灭杀细菌来治疗所述细菌感染,抑制所述细菌的生长,或其组合。该方法可以包括将所述径向两亲聚合物与第二抗生素组合同时或依次给药。发现所述组合给药的效果比不施用所述径向两亲聚合物显著地更为有效,而且观察到协同作用。
因此,本发明提供了本文所述的新型肽,用于合成所述肽的中间体以及制备所述肽的方法。本发明还提供了可用作合成其它有用化合物和组合物的中间体的新型肽。本发明提供了本文所述的新型肽在制备用于治疗哺乳动物(例如人)的细菌感染的药物的用途。因此,本发明提供了用于医学疗法的本文所述的组合物。所述药物或组合物可以包括药学上可接受的稀释剂、赋形剂或载体。
附图简要说明
下述附图属于说明书的一部分并且是用来对本发明的一些实施方式或不同方面作进一步的描述。在一些实例中,本发明的实施方式可以通过参照附图并结合本文提供的详细描述得到更好地理解。这些描述和附图可以突出某些具体的实施例或者本发明的某些方面。然而,本领域技术人员应当理解这些部分的实施例或方面也可用于结合本发明的其他实施例或方面。
图1A-I.示意描述(a)表面两亲性AMP和(b)径向两亲性(RA)AMP。(c)PHLG-BIm的化学结构,其中m为约6至约100。(d)PHLG-BIm40(三角形符号)、PHDLG-BIm40(正方形符号)和PHLG-BIm28(圆形符号)在pH=7的水溶液中的CD光谱。(e)从全原子分子动力学模拟预测的RA肽结构。来自我们使用VMD获得的模拟轨迹的代表性肽抓拍照图片。为了观察清楚,水分子已被去除,主干和侧链分别以红色(中心核原子)和灰色(外部附属部位)着色。(f)在α-螺旋骨架周围的侧链N12原子的3D概率分布。(g)图1(f)中3D概率分布在与肽长轴垂直的平面上的2D投影。概率密度在0-0.83nm-2的范围,并且绘制为20个均匀间隔的等位轮廓图。(h)当与胰蛋白酶、链霉蛋白酶、来自绿脓杆菌的弹性蛋白酶或来自人类白细胞的弹性蛋白酶孵育8小时后,多肽PHLG-BIm40的稳定性。(i)当与胰蛋白酶、链霉蛋白酶、来自绿脓杆菌的弹性蛋白酶或来自人类白细胞的弹性蛋白酶孵育8小时后,多肽LL-37的稳定性(对照峰在4.5分钟)。
图2A-D.PHLG-BIm40通过直接破坏细菌细胞膜来灭杀细菌。(a)用PHDLG-BIm40(非螺旋,没有径向两亲结构)或PHLG-BIm40(螺旋并具有径向两亲结构)在各种浓度下处理1小时后,一些钙黄绿素在中性囊泡(DOPC/POPC)和带负电荷囊泡(DOPE/DOPG))中流出。(b)在用游离PI、PI与PHDLG-BIm40或PI与PHLG-BIm40在不同浓度下进行培养后,碘化丙啶(PI)摄取的流式细胞计数分析。所有数据均以平均值±SD表示,并通过Student's t-检验进行分析(**p≤0.01)。(c)在不存在和存在PHDLG-BIm40和PHLG-BIm40(3.3μM)的情况下,染色的大肠杆菌MG1655的荧光显微图像。条带=50μm。(d)用PBS,PHDLG-BIm40或PHLG-BIm40处理后的MG1655的SEM图像。条带=1μm。
图3A-B.(a)SAXS光谱显示在富含于PE的膜中由PHLG-Blm40产生NGC。以P/L=1/400的摩尔比暴露于PHLG-BIm40后,来自脂质囊泡溶液的SAXS图谱。在每种组合物中仅有SUV的对照显示出与单层囊泡的形状因子一致的宽泛特征。(b)PHLG-BIm诱导Pn3m立方相。描绘已测量衍射峰的Q位置,以显示DOPG/DOPE=20/80的Pn3m立方相的指标。
图4A-B.PHLG-BIm40增强了商业抗生素的抗菌活性。用不同浓度PHLG-BIm40或PHDLG-BIm40共同递送的链霉素的抗MG1655的抗菌活性((a),PHLG-BIm40的MIC:26.1μM)和C101((b),PHLG-BIm40的MIC:52.3μM)。
图5.从分子模拟轨迹提取并且以采样点分辨率0.005nm-1在所有20个侧链上进行平均的从Cα到N12原子测量的侧链长度的概率分布。分布模式为1.24nm,平均值为1.15nm,95%可信区间为[0.90,1.33]nm。
图6A-D.PHLG-BIm对DH5α(a)、MG1655(b)、,ATCC12608(c)和ATCC11778(d)的灭菌动力学。将PHLG-Blm与细菌一起培育,并在预定的培育时间对菌落形成单位(CFU)进行计数。
图7A-B.,用仅仅PHLG-BIm40(PHLG-BIm40 only),PHLG-BIm40与NaCl(150mM)(“with NaCl(150mM)”),人造泪液(2%)(“with artificial tear(2%)”),人血清(2%)(“with human serum(2%)”),或血浆(2%)(“with plasma(2%)”)在各种浓度下处理8小时的样品中的(a)DH5α的CFU和(b)ATCC12608的百分比,相较于未经任何处理的对照样品。
图8A-B.在用PHDLG-BIm40(3.3μM)或PHLG-BIm40(3.3μM)孵育0.5小时和1小时后(a)MG1655和(b)C101中利福平(rifampicin)的细胞内摄取。
图9.多肽的脂肪族R基团对于抗菌活性和螺旋性的影响。基于聚(L-谷氨酸)和聚(DL-谷氨酸)的多肽在pH=7的水溶液中的全CD谱图。
图10A-B.多肽的芳香族R基团对于抗菌活性和溶血活性的影响。基于(a)聚(L-谷氨酸)和(b)聚(DL-谷氨酸)的多肽在pH=7的水溶液中的全CD谱图。
详细说明
抗生素的广泛使用导致耐药菌迅速传播。由于这种广泛使用,耐药细菌对于感染性疾病的治疗形成严重挑战。因此,迫切需要新的治疗剂应对耐药性细菌感染的迅速出现。抗菌肽(AMPs)一般具有两亲结构,含有一定序列的阳离子氨基酸和疏水性氨基酸。AMP的两亲性α-螺旋与它们的膜活性相关并且用作膜的减稳剂,当AMP与细菌膜相互作用时,允许将疏水性的部分插入膜脂质结构域以破坏膜结构。AMP的膜物理破坏机制降低了病原体发展抗性的可能性。然而,AMP需要特定的设计才能针对细菌细胞膜有活性。我们在此描述一系列带有季铵基团和长疏水侧链的α-螺旋多肽,并证明这些径向两亲螺旋多肽具有高抗菌活性以及高选择性。用大脂肪族烷基胺引发开环聚合进一步增强了聚合物的抗菌活性。另外,所述聚合物与其他抗生素的组合施用增强了第二抗生素的活性,通常为1-2个数量级。
定义
下面的定义是用来对说明书和权利要求书提供清晰和一致的理解。本文所采用的术语具有下述的含义。本说明书中所采用的其他术语和短语具有本领域技术人员所能理解的普通含义。这种普通含义可通过参考技术辞典获得,例如Hawley’s Condensed Chemical Dictionary 14th Edition,by R.J.Lewis,John Wiley&Sons,New York,N.Y.,2001。
本说明书中提及的“一种实施方式(one embodiment)"、“实施方式(an embodiment)”等表明所描述的实施方式可包含特定的方面、特征、结构、部分或特性,但并不是每个实施方式都必须包含这些特定的方面、特征、结构、部分或特点。此外,这些短语可能,但并不一定,适用于在本说明书其它部分提及的相同的实施方式。此外,当特定的方面、特征、结构、部分或特点是结合某种实施方式进行描述的,本领域技术人员应当能够知道将这些特定的方面、特征、结构、部分或特点应用到或关联到其它的实施方式,无论是否明确地表述出来。
单数形式的冠词"a,""an"和"the"包括复数含义,除非上下文存在明确的不同阐述。因此,例如,“化合物”可以是指包括多个这样的化合物,从而化合物X包括多个的化合物X。进一步值得注意的是,权利要求书可能被撰写为排除任何可选元素。因此,本声明旨在作为排除性术语使用的前置基础,例如"单独(solely)"、"仅仅(only)"等术语,与本文所描述的任何元素相关联和/或作为对权利要求所述要素的限定或者用作“负面”限制。
术语“和/或”("and/or")是指相关项目的任何一项、任何组合,或它们的全部。短语“一个或多个(one or more)"和“至少一个(at least one)"是本领域技术人员都能容易理解的,尤其是根据上下文理解。例如,这些短语可以是指一、二、三、四、五、六、十、一百,或大约比已经列举的下限高出10、100或1000倍的任何上限值。例如,苯环上一个或多个取代基指的是一到五,或者在比如苯环被双取代的情形是一到四。
术语“大约(about)”表示特定值可以具有±5%、±10%、±20%或±25%的变化。例如,“大约50”百分比在一些实施方式中可变化为45到55百分比。对于整数范围,术语“大约”可包含在所指范围各端相较于所列举的整数小或大一个或两个整数。除非文中另有说明,术语“大约”是用来包括对于成分、组合或实施例的功能来说等同的接近所列范围的数值。术语“大约”也能够用来对本段前述范围的端点进行调整。
本领域技术人员应当能够理解,包括表示成分含量、诸如分子量的性质、反应条件等等的任何数目都可以是近似的,并且在各种情下都能够采用术语“大约”进行修饰。取决与本领据技术人员通过本文所述方法所期望获得的性质,这些值是可以有变化的。还应当理解,这些值,由于测试中出现的标准偏差必然会导致其内在的可变化性。
本领域技术人员应当能够理解,出于任何各种目的,尤其是就提供文字描述来说,本文提供的任何范围还包括所有可能的子范围和这些子范围的组合,以及构成所述范围的单独值,尤其是整数值。所引述范围(例如重量百分比或碳基团)包括各个特定的数值、整数、小数或所述范围内的特性。应当易于理解,所列举的任何范围能够充分描述并能够使的相同的范围被分解为相等的二等份、三等分、四等分、五等分或十等分。作为非限制性例子,本文所述的每个范围都可容易地分解为下三分之一,中三分之一和上三分之一等等。本领域技术人员也应当能够理解,诸于“高至”、“至少”、“高于”、“低于”、“多于”、“或以上”或类似的术语包含所列举的数字,并且这种术语还指所述范围可随后分成上文述及的子范围。同样地,本文所列的任何比率也包含落在较宽比率之内的子比率。因此,自由基、取代基和范围的具体数值只是用来进行说明;其不排除自由基和取代基的其它指定数值或其它指定范围的数值。
本领域技术人员还应当能够容易理解,当单元被按照通常的方式例如在马库什群组中被组合起来时,本发明不仅包括所列单元组合构成的整体,还包括所述群组单独的每个单元以及所述基本群组的任何可能的亚群组。另外,对于所有的目的,本发明不仅包括基本群组,还包括基本群组去掉一个或多个单元的群组。可见,本发明可以包括明确排除所引述群组的任何一个或多个单元。因此,有关约束条件可以附加于任何公开的范畴或实施方式,其中任何一个或多个单元、种类或实施方式,可从所述范畴或实施方式中排除出来,例如,用于明示负面限定的场合。
术语“烷基”是指直链或支链烷基,例如具有1-20个碳原子而通常为1-12,1-10,1-8,1-6或1-4个碳原子。具体实例包括但不限于甲基、乙基、1丙基、2-丙基(异丙基)、1丁基、2-甲基-1-丙基(异丁基)、2-丁基(仲丁基)、2-甲基-2-丙基(叔丁基)、1戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲基-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1-己基、2-己基、3 2-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3二甲基-2-丁基、己基、辛基、癸基、十二烷基等。所述烷基可以是未取代的或可选择被取代的,例如由下述取代基所取代。所述烷基可以是分支的烷基,例如具有5、10或15个碳原子的饱和异戊二烯基。所述烷基也可以是如上描述或列举的单价烃基,或者可以是二价烃基(即亚烃基)。
术语“杂芳基”是指含有一个、两个或三个芳环,并且含有至少一个氮、氧或硫原子的单环、双环或三环体系。当所述杂芳含有氮时,可以是通式I或III中的X。所述杂芳基可以是未取代或被取代的,例如具有一个或多个,特别是一个至三个取代基,如同术语“取代的”所定义。典型的杂芳基在其环状骨架中含有2-20个碳原子,另外还含有一个或多个杂原子。所述杂芳基的示例性实例包括但不限于2H-吡咯基、3H-吲哚基、4H-喹啉基、吖啶基、苯并[b]噻吩基、苯并噻唑基、β-咔啉基、咔唑基、色烯基、噌啉基、二苯并[b,d]呋喃基、呋咱基、呋喃基、咪唑基、亚氨基、吲唑基、吲哚基、吲哚基、异苯并呋喃基、异吲哚基、异喹啉基、异噻唑基、异恶唑基、萘啶基、恶唑基、菲咯啉基、菲咯啉基、吩噻嗪基、吩噻嗪基、吩噻嗪基、吩恶嗪基、吩恶嗪基、酞嗪基、蝶啶基、嘌呤基、吡喃基、吡嗪基、吡唑基、哒嗪基、吡啶基、嘧啶基、吡咯基、喹唑啉基、喹啉基、喹喔啉基、噻二唑基、噻吩基、噻唑基、噻吩基、三唑基、四唑基和呫吨基,及其二聚体。在一种实施方式中,术语“杂芳基”表示包含五或六个环原子的单环芳环,所述环原子包括碳和1、2、3或4个独立地选自非过氧化物氧、硫和N(Z)的杂原子,其中Z是不存在或为H、O、烷基、芳基或(C1-C6)烷基芳基。在一些实施方式中,所述杂芳基表示从约8至10个环原子衍生的邻位稠合双环杂环基,尤其是苯并衍生物或通过丙烯、三甲烯或四甲烯双基稠和而来。
作为非限制性的实施例,氮键合的杂环可以在1位键接于氮丙环,氮杂环丁烷,吡咯,吡咯烷,2-吡咯啉,3-吡咯啉,咪唑,咪唑烷,2-咪唑啉,3-咪唑啉,吡唑,吡唑啉,2-吡唑啉,3-吡唑啉,哌啶,哌嗪,吲哚,二氢吲哚,1H-吲唑;在2位键接于异吲哚或异二氢吲哚;在4位键接于吗啉;在9位键接于咔唑或β-咔啉。在一种实施方式中,氮键合的杂环包括1-氮丙啶基,1-吖丁啶基,1-吡咯基,1-咪唑基,1-吡唑基和1-哌啶基。所述杂环通过疏水性侧链与本文所述多肽的多肽主干共价键合,其中多肽主干和所述杂环的四价氮(四价是因为键合到聚合物侧链)之间通常具有11-13个σ键,这导致在所述杂环中有带电荷的氮。
术语“接触”("contacting")是指触及、接触,或者邻接或紧密地靠近,例如,包括在细胞或分子水平,比如在溶液或反应混合物中,在体外或体内,发生生理反应、化学反应或物理变化。
术语“有效量”是指有效地治疗疾病、失调和/或病症,或者产生所描述效果的量。例如,有效量可以是有效地减缓所治疗的病症或症状的进展或程度的剂量。对治疗上有效量是在本领域技术人员能力范围内能够确定的。术语“有效量”是指包括本文所描述的化合物的量,或本文所描述的肽类的组合的量,比如,是用于针对受试者有效地治疗或预防疾病或失调,或者治疗疾病或失调的症状。因此,“有效量”通常是指能提供预期效果的量。
术语“治疗(treating,treat和treatment)”包括(i)防止疾病、病理或医学病症的发生或者阻止其发展;(ii)缓解疾病、病理或医学病症;(iii)减轻疾病、病理或医学病症;和/或;(iv)减轻与疾病、病理或医学病症相关的症状。因此,术语“治疗”可以包括降低、阻止或逆转所治疗病症或症状的进展或程度。因此,术语“治疗”可以酌情包括医治、疗养和/或预防性用药。
治疗可以是反应性的,例如用于抵抗现有的感染,或这可以是预防性的,例如用于防止易感染的生物体中的感染。在一些实施方式中,组合物可用于治疗细菌的耐药菌株,例如MRSA(甲氧西林抗性金黄色葡萄球菌(methicillin resistant S.aureus)),MRSE(甲氧西林抗性表皮葡萄球菌(methicillin resistant S.epidermidis)),PRSP(青霉素抗性肺炎链球菌(penicillin resistant S.pneumoniae)),VIRSA(万古霉素间歇抗性金黄色葡萄球菌(vancomycin intermittently resistant Staphylococcusaureus))或VRE(万古霉素抗性肠球菌(vancomycin resistant Enterococci))。术语“耐药性(drug-resistant)”或抗性是指细菌对于一种或多种常规抗生素,特别是β-内酰胺抗生素,的处理具有抵抗性。因此,本发明提供了灭杀或抑制革兰氏阳性菌生长的方法,包括将革兰氏阳性细菌与本文所述的聚合物接触,从而灭杀或抑制细菌的生长。所述接触可以在人或动物的体内,或者体外例如化验中进行。革兰氏阳性菌可以是具有肠球菌属或葡萄球菌属的结构。在某些具体实施方式中,所述细菌是葡萄球菌属的耐药菌株。在某些具体实施方式中,所述细菌是甲氧西林抗性金黄色葡萄球菌(MRSA)菌株。
在一些具体实施方式中,所述细菌感染可能是起因于革兰氏阳性菌,包括但不限于,甲氧西林抗性金黄色葡萄球菌(MRSA),社区感染性甲氧西林抗性金黄色葡萄球菌(CAMRSA),万古霉素中敏金黄色葡萄球菌(Staphylococcus aureus)VISA),甲氧西林抗性凝固酶阴性葡萄球菌(MR-CoNS),万古霉素中敏凝固酶阴性葡萄球菌(VI-CoNS),甲氧西林敏感金黄色葡萄球菌(MSSA),肺炎链球菌(包括青霉素抗性菌株[PRSP])和多重耐药菌株[MDRSP]),无乳链球菌,化脓性链球菌和粪肠球菌。在具体实施方式中,所述细菌感染可以包括但不限于并发的皮肤和皮肤组织感染(cSSSI);社区感染性肺炎(CAP);并发腹腔内感染,例如并发阑尾炎、腹膜炎、并发胆囊炎和并发憩室炎;无并发症和并发的尿路感染,如肾盂肾炎;以及呼吸和其他医院感染。
术语“感染(infection)”是指病菌(例如细菌)侵入宿主体内繁殖,通过局部细胞损伤、毒素释放或细胞中的生物抗体反应引起疾病。本文所述的化合物和组合物可用于治疗革兰氏阳性细菌感染,例如哺乳动物(如人类)的感染。
术语“抑制(inhibit,inhibiting和inhibition)”是指减缓、阻止或逆转疾病、感染、病症或细胞群的生长或进展。抑制作用可以大于约20%,40%,60%,80%,90%,95%或99%,例如,相比于发生在没有治疗或处理的情况下的生长或进展程度。
细菌是原核微生物。本文所述的AMPs可以抑制和灭杀致病细菌,例如当哺乳动物感染细菌并将AMPs施用于该哺乳动物时。因此,本文所述的AMPs可以用于治疗由各种细菌引起的感染,在各种实施方式中所述细菌包括不动杆菌,放线杆菌,红袍子虫属,杆菌,拟杆菌,双歧杆菌,博德特氏菌,布鲁氏菌,伯克霍尔德氏菌,弯曲杆菌,衣原体菌,梭菌,棒状杆菌,埃立克体,埃希氏菌,弗朗西斯菌,嗜血杆菌,螺杆菌,钩端螺旋体,李斯特氏菌,曼海姆氏菌,莫拉克斯氏菌,分枝杆菌,支原体菌,奈瑟氏菌,新立克次氏体,巴氏杆菌,卟啉单胞菌,普雷沃氏菌,假单胞菌,嗜冷杆菌,沙门氏菌,沙雷氏菌,希瓦氏菌,志贺氏杆菌,坦纳菌,密螺旋体菌,Tropheryma,弧菌,沃尔巴克氏菌,耶尔森氏菌,疟原虫和弓形虫,以及真杆菌,加德纳菌,克雷伯菌,消化链球菌,变形杆菌,普罗威登斯菌和隐孢子虫。
这些细菌的具体实例包括:例如,不动杆菌属(Acinetobacter sp.),胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae),伴放线放线杆菌(Actinobacillus actinomycetemcomitans),嗜吞噬细胞无形体(Anaplasma phagocytophilum),炭疽芽孢杆菌(Bacillus anthracis),蜡状芽孢杆菌(Bacillus cereus),脆弱拟杆菌(Bacteroides fragilis),多型拟杆菌(Bacteroides thetaiotaomicron),长双歧杆菌(Bifidobacterium longum),支气管炎博德特氏菌(Bordetella bronchiseptica),百日咳博德特氏菌(Bordetella pertussis),羊布鲁氏菌(Brucella melitensis),猪布鲁氏菌(Brucella suis),洋葱伯克霍尔德菌(Burkholderia cepacia),鼻疽伯克霍尔德氏菌(Burkholderia mallei),类鼻疽伯克氏菌(Burkholderia pseudomallei),空肠弯曲菌(Campylobacter jejuni),沙眼衣原体(Chlamydia trachomatis),肺炎衣原体(Chlamydia trachomatis),肉毒梭菌(Clostridium botulinum),产气荚膜梭菌(Clostridium perfringens),梭状芽孢杆菌(Clostridium diffcile),破伤风杆菌(Clostridium tetani),白喉棒状杆菌(Corynebacterium diphtheriae),查菲埃立克体(Ehrlichia chaffeensis),大肠杆菌(Escherichia coli),土拉弗朗西斯菌(Francisella tularensis),具核梭杆菌(Fusobacterium nucleatum),杜克雷嗜血杆菌(Haemophilus ducreyi),流感嗜血杆菌(Haemophilus influenzae),幽门螺杆菌(Helicobacter pylori),钩端螺旋体(Leptospira interrogans),单核细胞增多性李斯特菌(Listeria monocytogenes),溶血曼海姆菌(Mannheimia haemolytica),卡他莫拉氏菌(Moraxella catarrhalis),麻风分枝杆菌(Mycobacterium leprae),耻垢分枝杆菌(Mycobacterium smegmatis),结核分枝杆菌(Mycobacterium tuberculosis),支原体菌(Mycoplasma penetrans),淋病奈瑟球菌(Neisseria gonorrhoeae),脑膜炎奈瑟氏菌(Neisseria meningitides),新立克次氏体属(Neorickettsia sennetsu),多杀巴斯德菌(Pasteurella multocida),牙龈卟啉单胞菌(Porphyromonas gingivalis),中间普普雷沃菌(Prevotella intermedia),铜绿假单胞菌(Pseudomonas aeruginosa),恶臭假单胞菌(Pseudomonas putida),嗜冷杆菌属(Psychrobacter sp.),沙门氏菌(Salmonella enterica),肠炎沙门氏菌(Salmonella enteritidis),鼠伤寒沙门氏菌(Salmonella typhimurium),粘质沙雷氏菌(Serratia marcescens),腐败希瓦氏菌(Shewanella putrefaciens),费氏志贺菌(Shigella flexneri),志贺氏杆菌痢疾(Shigella dysenteriae),福赛斯坦纳菌(Tannerella forsythensis),齿垢密螺旋体(Treponema denticola),梅毒螺旋体(Treponema pallidum),惠普尔养障体(Tropheryma whipplei),霍乱弧菌(Vibrio cholerae),创伤弧菌(Vibrio vulnificus),沃尔巴克氏菌(Wolbachia sp.),鼠疫耶尔森氏菌(Yersinia pestis),小肠结肠炎耶尔森氏菌(Yersinia enterocolitica),恶性疟原虫(Plasmodium falciparum),间日疟原虫(Plasmodium vivax)和刚地弓形虫(Toxoplasma gondii),以及在一些实施方式中,真杆菌属(Eubacterium sp.),阴道加德纳菌(Gardnerella vaginalis),肺炎克雷伯菌(Klebsiella pneumoniae),消化链球菌(Peptostreptococcus sp.),奇异变形杆菌(Proteus mirabilis),斯氏普罗威登斯菌(Providencia stuartii)和隐孢子虫(Cryptosporidium parvum)。本文所述AMPs可用于治疗由上述任何一个或多个种类细菌引起的感染,或者所述AMPs可用于灭杀或抑制这些细菌的生长,例如,在体内或体外,比如在患者身体,在溶液中,或在生长的培养基中或之上。
径向两亲性抗菌多肽的各种具体实施方式
如上所述,本发明提供了包含式I的径向两亲聚合物:
或其盐;其中:m为约6至约100;n为1,2或3;以及X为脂肪族或芳香族季铵盐基团。在典型的具体实施方式中,所述聚合物为α-螺旋形式的。
在一些具体实施方式中,m为约10至约80,或约25至约50。n的值可以是1,例如当使用己基卤代物制备CH-L-Glu时。n的值可以是2或3,当使用庚基卤代物或辛基卤代物来制备所述单体时。
在一些具体实施方式中,X是芳香族季铵基团,包含3至13个碳原子,5至13个碳原子,或8至13个碳原子。所述芳香族季铵基团可以是,例如,吡啶基,喹啉基,咪唑基,或苯并咪唑基,其与所述聚合物的侧链在氮杂环的氮上共价键接。所述芳香族基团可以是未取代的或取代的,例如用(C1-C10)烷基或含氮芳香族基团的其它取代基取代。在某些具体实施方式中,X可以是:
其中R是(C1-C10)烷基。
在另外的具体实施方式中,X是包含约3至约13个碳原子或约8至约13个碳原子的脂肪族季铵基团。在一些具体实施方式中,X为:
其中R1、R2和R3各自为直链或支链(C1-C10)烷基,其中R1、R2和R3中组合的碳原子总数为3至约36,或3至13。在某些具体实施方式中,X为:
在一种具体实施方式中,所述聚合物包括式II:
或其盐;其中m为约6至约100,Ry为(C1-C10)烷基,例如甲基。在其他具体的实施方式中,所述聚合物为式III的聚合物:
其中R0为(C1-C60)烷基,以及Rx为H或甲硅烷基(取决于为制备聚合物的开环聚合过程是如何被淬灭的)。所述甲硅烷基可以是,例如TMS。在各种实施方式中,R0为直链或支链(C1-C60)烷基。R0的实例包括
其中y各自独立地为0至约16。
本发明还提供了一种医药组合物,包含本文所述的径向两亲聚合物和药学上可接受的稀释剂或载体和/或第二抗生素。所述第二抗生素可以是例如氨基糖苷,四环素或β-内酰胺。所述第二抗生素的具体实例包括链霉素,庆大霉素,多西环素,利福平和青霉素,以及本文列举的抗生素。
所述聚合物及其组合物可用于抑制细菌生长或灭杀细菌的方法中,所述方法包括在足以灭杀或抑制细菌生长的条件下使细菌与包含本文所述的径向两亲聚合物的组合物接触。
因此,本发明进一步提供了治疗哺乳动物细菌感染的方法,其包括向感染致病细菌的哺乳动物施用有效量的本文所述的聚合物,从而通过灭杀所述细菌来治疗所述细菌感染,抑制所述细菌的生长,或它们的组合。
所述细菌可以是革兰氏阳性细菌,或者它们可以是革兰氏阴性细菌。
所述方法可以包括同时或依次地使细菌与第二抗生素接触。所述聚合物和所述第二抗生素的组合物的活性可以对细菌感染具有协同活性。所述径向两亲聚合物的存在可以增强所述第二抗生素的抗菌活性1-2个数量级。在其他具体实施方式中,能通过施用其他方式达到有效抗菌所需的约0.1至约0.01倍的第二抗生素以获得同样的活性。
具有径向两亲性的螺旋抗菌多肽
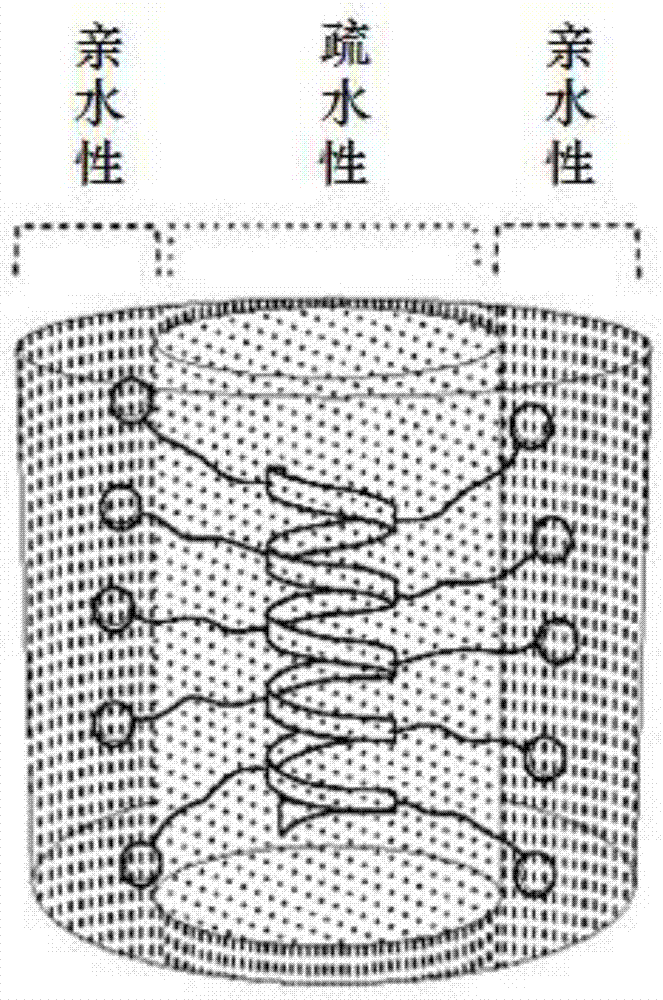
所述α-螺旋抗菌肽(AMPs)通常具有表面两亲结构。表面两亲性导致肽与血液蛋白质不需要的相互作用以及由于暴露疏水表面引起的自聚集。本文描述了一类阳离子的设计,具有疏水性内部螺旋核心和带电外壳的螺旋同质多肽抗菌剂,具有前所未有的径向两亲性。
所述径向两亲结构使多肽能够有效地结合带负电荷的细菌表面,并对革兰氏阳性菌和革兰氏阴性菌均表现出高度的抗菌活性。此外,带电荷的外壳对疏水性核心的屏蔽减少了与真核细胞的非特异性相互作用,显示出低溶血活性,并保护多肽主干免于蛋白水解性降解。所述径向两亲性多肽也可用作有效的佐剂,从而改善商业抗生素在细菌中的渗透性,并增强其抗菌活性1-2个数量级。因此,我们设计出了具有前所未有的、独特的径向两亲结构的AMPs,这代表了AMPs开发的一个新的替代方向。所述径向两亲多肽为治疗耐药细菌提供了一个综合平台。
本文描述的根本不同设计的AMPs是具有“径向两亲”(radially amphiphilic,RA)结构(图1B)而不是“FA”结构(图1A)。这些新型抗菌同质多肽具有疏水螺旋核心,其在螺旋的所有径向被阳离子基团覆盖。由于带电荷的基团处在所述多肽的外壳上而疏水性螺旋核心被隔离起来,从而这些多肽具有极小的由疏水力引起的自聚集以及与血蛋白的相互作用。通过这种RA结构,与不具有径向两亲性的典型α-螺旋AMP相比,本文所述的多肽主干酰胺键得到良好保护,并且具有改善的抗蛋白水解性降解的稳定性。
因此,我们开发了一类具有前所未有的径向两亲性的新型阳离子螺旋的抗菌同质多肽。不同于以表面两亲性或带有随机分布带电和疏水基团的生物模拟抗菌聚合物为特征的典型的AMPs,这些新型AMPs是具有RA结构的同质多肽。它们具有稳定α-螺旋构型,包括疏水螺旋核心和带电的外壳,其由长疏水性侧链(例如在聚合物主干和电荷之间具有11-13个σ键,并且没有环状部分)和末端电荷基团(例如脂肪族或芳香族季铵基团)形成。
所述RA多肽与典型的AMPs相比具有多方面的优势。它们可以容易地通过可控制的NCA聚合以及后续侧链修饰而合成,一般侧链有至少有70%,通常大于90%或95%,转化为带电的季氮基团。所述RA结构使得多肽能够有效地结合到带负电的细菌表面上,并对革兰氏阳性菌和革兰氏阴性菌都表现出高抗菌活性。此外,带电外壳对疏水性核心的屏蔽降低了与真核细胞的非特异性相互作用并有助于降低的哺乳动物细胞毒性作用。
所述多肽还表现出优异的抗酶降解稳定性,这可能是由于抑制了蛋白酶接近多肽主干。此外,所述RA多肽的抗菌和溶血活性可通过改变末端胺基和螺旋核心的疏水性来调节,这两方面均可通过我们以前描述的技术方便地实现(Yin et al.(2013)Angew Chem Int Edit 52(22):5757-5761;Lu et al.(2011)Nat Commun 2:206;Gabrielson et al.(2012)Angew Chem Int Edit 51(5):1143-1147)。因此,所述RA多肽为设计新的AMP类似物提供了极好的平台。
这些RA多肽的抗菌活性可能是由于它们的阳离子基团和阴离子细菌细胞膜之间发生静电相互作用,随后由膜活性多肽螺旋破坏细菌细胞膜。其他因素涉及到细菌膜失稳作用,如我们对模型细菌膜的SAXS研究所表明的,其中螺旋多肽PHLG-BIm促进了马鞍形膜变形(负高斯曲率,NGC),其为诸如孔隙形成的膜失稳情形在形貌上的要求。所有测试的模型膜具有固定的阴离子电荷,但是我们观察到在富含PE细菌的模型膜中选择性产生的NGC。这与先前的工作一致,其表明具有较大量负的内在曲率脂类的膜更易于失稳也更易于形成孔隙(Yang et al.(2008)Proc Natl Acad Sci USA 105(52):20595-20600)。而且,阴性和阴性固有曲率脂质两者都是活性所必需的,而不是任何单独的就足够了。因此,优选螺旋多肽在高PE含量下产生NGC指向涉及膜曲率效应的选择性机理。
观察到的协同杀菌效果是由于多肽的膜透化活性促进了抗生素的细胞渗透作用的增加。诱导的NGC在膜渗透机制的情况下广泛地使得能够产生例如跨膜孔隙、起泡、芽殖和断裂。渗透可以涉及机理的层次。我们以立方相的形式观察NGC;2D膜上缺陷的大小将取决于缺陷的类型。由多肽PHLG-BIm40诱导的Pn3m立方相的平均高斯曲率K值为-0.01065nm-2。例如,如果我们忽略所有其他的影响,这就是在~40nm的跨膜孔隙中发现的NGC的量。另一方面,如果失稳机制是芽殖然后是断裂,那么我们可以利用悬索曲面来估计缺陷的大小,就是断裂孔隙的表面的近似表述(Boucrot et al.(2012)Cell 149(1):124-136;Schmidt et al.(2013)J Am Chem Soc 135(37):13710-13719)。具有颈部半径c沿着其z轴的最小悬索曲面的高斯曲率由下式定义:K(z)=-[sech4(z/c)]/c2。所测量的<K>值对应于悬索曲线颈部直径~19.4nm。如果我们考虑双层膜厚度大约4nm,则该直径转化为~15.4nm的孔隙大小。在上述两种情况下,缺陷的尺寸明显大于典型抗生素的尺寸。因此,设计带有独特RA结构的AMPs代表AMP开发的新的替代方向。因此所述RA多肽可以是开发AMP制剂以治疗耐药细菌的通用平台。
RA多肽显示出高抗菌活性和选择性.本文描述的具有长疏水性侧链和阳离子端部基团的径向两亲的、螺旋的、带电的多肽显示出针对pH、盐类、温度以及各种变性条件的显著的螺旋稳定性。所述RA多肽被作为新型AMPs的应用而进行了探索。一种具体的带有RA结构的阳离子α-螺旋多肽为PHLG-Blm(图1C)。其通过氨基酸N-羧酸酐(NCAs)的开环聚合进行合成(参见Lu and Cheng(2007)J Am Chem Soc 129(46):14114-14115),接着用1-甲基苯并咪唑进行胺化(反应式1)(也参见美国专利9,243,040,其通过引用并入本文,涉及实用的合成技术)。
反应式1.基于抗菌PHLG的多肽的合成
(i)碳酰氯;(ii)HDMS/DMF;(iii)叔胺(e.g.,1-甲基苯并咪唑(BIm)),NaI,DMF/MeCN
PHLG-BIm,其在主干和正电荷之间隔了11个σ-键并且具有DP在约6至约100之间,具有α-螺旋构型。DP为40和28的具体实例是具有代表性的,并被进一步评估。在浓度为0.40mg/mL的水中的圆二色谱(CD)的光谱中,从208和222nm的特征双极小值明显示出α-螺旋的构型(图1D)。相应的非螺旋型PHDLG-BIm40是通过DL-NCA的聚合作用进行合成的,用来研究螺旋结构对多肽抗菌活性的影响。
我们的分子模拟提供了分子水平的理论用以支持所述RA结构。图1E中的模拟快照描述了阳离子侧链形成了在疏水脂族侧链和螺旋核心周围的亲水壳。扣除两个末端残基以消除末端效应,肽主干接近理想螺旋,RMSDhelix=(0.04±0.01)nm,半径rhelix=(0.232±0.002)nm和扭转γhelix=(100±1)°也几乎是理想的由我们利用Dichro-Calc(comp.chem.nottingham.ac.uk/cgi-bin/dichrocalc/bin/getparams.cgi)(Bulheller and Hirst(2009)Bioinformatics 25(4):539-540)进行模拟在222nm计算的平均残基摩尔椭圆率,[θ]222nm=(-21±1)×10-3deg.cm2/dmol,与图1D中记录的实验值,对PHLG-BIm40的-23×10-3deg.cm2/dmol和对PHLG-BIm28的-19×10-3deg.cm2/dmol,是非常一致的。
为了量化RA结构,在将肽主干与参照结构对齐并丢弃末端四条侧链以消除末端效应之后,我们计算了侧链N12原子的概率分布(图1F,1G)(使用MATLAB 2014a)。我们还测量了从Cα到N12原子的侧链长度的概率分布。分布模式为1.24nm,平均值为1.15nm,95%可信区间为[0.90,1.33]nm(图5)。所述结果得到核子欧豪效应(NOE)广谱的证实,在苯并咪唑上的氮原子(N12)(d,b,b’,c,c’,e)周围的质子和Cα(h,i,g)周围的质子之间没有测到NOE。由于阳离子侧链中的正电荷主要存在于末端,所以这些分布是正电荷分布的替代,为RA结构提供了强有力的支持。
PHLG-Blm的抗菌活性通过多肽对细菌的最小抑制浓度(MIC)来评估(Andrews(2002)J Antimicrob Chemother 49(6):1049-1050)。对于RA结构,PHLG-BIm40对革兰氏阴性菌DH5α、MG1655,和革兰氏阳性菌,ATCC12608、ATCC11778,均表现出较强的抗菌活性,其MIC值分别为3.3,26.1,13.1和13.1μM(表1)。
表1.多肽的抗菌和溶血活性。多肽的抗菌活性的确定是采用最小抑制浓度(MIC)。多肽的溶血活性的确定是采用HC50(50%溶血浓度)值(注:表中polypeptides即多肽,clinical isolated H.pylori即临床分离的幽门螺杆菌)。
与非螺旋PHDLG-BIm40相比,螺旋PHLG-BIm40显示出更高的抗菌活性,MIC分别相对于DH5α,MG1655,ATCC12608和ATCC11778低了16,4,4和4倍。还发现长度影响RA多肽的抗菌活性,其中PHLG-BIm28,其DP为28,显示与PHLG-BIm40相比稍低的抗菌活性。我们测试RA多肽的抗菌活性,针对了其他细菌菌株,包括临床分离的幽门螺杆菌菌株(B107,J291,J99,J99-AF,J99-A9和J99-A11)以及耐药菌株(甲氧西林抗性金黄色葡萄球菌,NRS382,NRS383,NRS384)。在这些幽门螺杆菌菌株中,J99-AF,J99-A9和J99-A11是克拉霉素抗性菌株。所述RA多肽对临床分离的菌株甚至耐药菌株也具有较高的抗菌活性。更有意思的是,在各种盐类(生理浓度为150mM的NaCl,1mM的MgCl2和2.5mM的CaCl 2)和粘蛋白(粘膜的主要成分)存在下,多肽的抗菌活性对DH5α和ATCC12608保持稳定(表2)。
表2.在存在盐(150mM NaCl,1mM MgCl2,8μM CaCl2),人血清(human serum,2%),胎牛血清(FBS,5%或10%),来自人的血浆(plasma,2%或5%),人造泪液(art.tear,2%)或粘蛋白(mucin,1mg/mL)的情况下,针对大肠杆菌DH5α和金黄色葡萄球菌ATCC12608的PHLG-BIm40的MIC值。对照组(control)表示仅用多肽处理。
与仅有多肽的处理相比,RA多肽在存在人血清,胎牛血清,血浆和人造泪液的条件下对DH5α和ATCC12608的MIC值有所降低。结果表明RA多肽在血清和血浆中稳定,聚阴离子化合物不显著影响其抗菌活性。MIC在血清和血浆中的降低可归因于血清补体系统,从而为对微生物感染提供天然的防御。PHLG-BIm40显示低溶血活性,其HC50(50%溶血浓度)值高于104.6μM,这表明>32的高选择性(定义为HC50/MIC),不同于PHDLG-Blm40对DH5α细菌细胞的选择性>2。所述多肽不仅是抑菌的,而且也是杀菌的。经观察,它们在各自的MIC或双倍的MIC时并在两个小时内,几乎100%灭杀所有四种细菌(图6)。此外,所述RA多肽显示出在培养基中,并且在具有NaCl、人血清、血浆和人造泪液的条件下的浓度依赖型杀菌作用(图7)。
尽管已经开发了许多具有高抗菌活性的AMPs,但是AMPs的使用通常受限于短时间的活性,因为它们会被内源性蛋白酶快速消化(Brogden and Brogden(2011)Int J Antimicrob Agents 38(3):217-225)。与典型的AMP相比,的所述RA多肽,其具有密集疏水侧链可以形成保护多肽骨架酰胺键的疏水性皮层,原则上对于蛋白水解应当更具稳定地。我们将PHLG-BIm40与胰蛋白酶,链霉蛋白酶,来自铜绿假单胞菌的弹性蛋白酶或来自人类白细胞的弹性蛋白酶孵育8小时,并通过HPLC分析多肽降解。PHLG-BIm40表现出优异的蛋白水解稳定性,并且几乎没有降解蛋白酶(图1H),而LL-37,阳性对照AMP,在相同条件下易于降解(图1I)。此外,蛋白酶或胰蛋白酶处理8小时后,PHLG-BIm40的抗菌活性保持不变,与未处理的多肽(3.3μM)具有相同的对DH5α的MIC值。
RA多肽通过直接破坏细菌细胞膜灭杀细菌。通过囊泡渗漏、细菌膜透化和细菌形态学测定,我们发现RA PHLG-BIm如作为典型的AMP通过直接破坏细菌细胞膜来灭杀细菌。我们首先研究了螺旋的PHLG-BIm40和非螺旋PHDLG-BIm40多肽膜破坏活性,针对阴离子脂质体1-棕榈酰-2-油酰-sn-丙三氧基-3-磷酸乙醇胺(POPE)/1-棕榈酰-2-油酰基-sn-丙三氧基-3-磷酸-(1'-rac-甘油)(POPG)和中性脂质体1,2-二油酰-sn-丙三氧基-3-胆碱磷酸(DOPC)/1-棕榈酰-2-油酰基-sn-丙三氧基-3-磷酸胆碱(POPC),其分别用于模拟富含磷脂酰乙醇胺(PE)的细菌和真核细胞膜。在相同的浓度下,PHLG-BIm40比PHDLG-BIm40从阴离子和中性脂质体诱发更大的染料渗漏,表明螺旋多肽具有更高的膜破裂能力(图2A)。与中性脂质体相比,PHLG-BIm40还引起阴离子脂质体更多的渗漏,这与所观察到的针对细菌对哺乳动物细胞的选择性密切相关。渗漏结果也显示PHLG-BIm能够渗透富含负性内在曲率形成脂质的模型细菌膜。
我们接下来使用流式细胞计数法通过细菌膜评估PHLG-BIm的透化作用。将MG1655细菌细胞与PHLG-BIm40和碘化丙锭(PI)(一种不渗透膜的染料)一起培育。用PHLG-Blm40处理的含PI细胞的总数量大于用PHDLG-BIm40处理的,并且随着多肽浓度的增大而增加(图2B)。通过荧光成像方法分析的摄取研究提供了PHLG-BIm40膜活性增强的另外的证据,即当细菌细胞与多肽和染料(PI和SYTO9)共培育时,PHLG-BIm40比PHDLG-BIm40更有效地渗透MG1655细菌细胞膜(图2C)。使用扫描电子显微镜,观察到与PHLG-BIm40培育后细菌膜的剧烈变化和损伤,而PHDLG-BIm40却很少影响到细菌形态(图2D)。总之,结果表明膜破裂和渗透是PHLG-BIm抗菌活性的重要组成部分。
为了详细研究RA多肽选择性膜活性的根本原因,我们使用同步辐射小角X射线散射(small angle x-ray scattering,SAXS)来研究PHLG-Blm诱导的膜曲率变形的类型和数量。用代表细菌(DOPG/DOPE=20/80)和真核(DOPS/DOPC=20/80)膜的脂类组合物制备小单层囊泡(SUVs)。由于已知真核细胞膜相对于细菌具有较低的PE含量,组合物DOPG/DOPE/DOPC=20/60/20和20/40/40也被用作模型系统来分离诸如PE的阴性固有曲率脂类的作用。
将SUVS与PHLG-BIm40以肽/脂(P/L)1/400摩尔比(其相当于电荷比1/2)温育,所得结构用SAXS表征。脂质囊泡溶液的同步加速器SAXS光谱显示出与单层囊泡的单脂质双层形式因子一致的广泛特征。当暴露于PHLG-BIm40时,所述脂质囊泡经历结构转变,导致在衍射数据中具有特定比值的Q比率的相关峰(图3)。对于每种膜组成,我们发现了一组与层间(Lα)相是一致的具有1:2的积分Q比率的相关峰,特征在于d距为6.7-8.8nm。由于PHLG-Blm暴露于SUVs所产生的这些层状相表明膜间吸引力没有产生显著的曲率。
有趣的是,对于模型细菌膜组成,我们鉴定出第二组相关峰,其特征Q比率为√2:√3:√4:√6,,其指标为具有24.8nm晶格参数的立方(QII)Pn3m“双钻石”晶格。诸如如Pn3m的双连续型立方相包括两个由脂质双层分开的非相交水通道。该双层的中心在每个点描绘出负的高斯曲率(NGC)亦即所谓马鞍展曲率所表征的最小表面。我们的SAXS数据显示,PHLG-BIm促进模型细菌膜中的马鞍形膜变形以稳定整体Pn3m立方相。NGC是一种鞍形曲率,其呈现为沿着孔隙内部并在囊泡基部和芽的颈部周围,基本的膜渗透机制。早期的研究已经发现立方相的形成与由AMPS诱导的膜渗透之间的强相关性(Lee et al.(2014)Biochim Biophys Acta 1838(9):2269-2279)。
PHLG-BIm在类似细菌富含PE的膜中形成立方相的能力表明所述多肽可以通过与天然AMPS一致的NGC的诱导渗透细菌膜。通过系统地检查一些膜,我们确定了脂类组成是如何影响PHLG-BIm重组囊泡的能力。我们观察到降低PE含量在总体趋势上导致抑制非层状相形成。更具体地说,我们发现所述肽不破坏具有60%及以下PE含量的膜(无NGC产生),其包括那些代表真核生物的膜。在大约80%的高PE水平PHLG-BIm优先生成立方相表明细菌超过动物膜的选择性机制基于其特定的脂类分布,这再次与一般AMP的趋
RA多肽增强传统抗生素的抗菌作用.由于PHLG-BIm可引起膜破裂和透化,我们探索了其提高传统抗生素抗菌作用的潜力。先前已经报道了由膜破坏剂与市售抗生素的共同施用导致类似于协同性增强的杀细菌作用(Ng et al.(2013)Adv Mater 25(46):6730-6736)。我们选择了四种抗生素,即链霉素(氨基糖苷),多西环素(四环素),利福平(利福霉素)和庆大霉素(氨基糖苷)。链霉素、多西环素和庆大霉素是蛋白质合成抑制剂,而利福平抑制DNA依赖性RNA合成。
我们测试了与螺旋PHLG-BIm40共同施用的这些抗生素的抗菌活性。非螺旋PHDLG-BIm40被用来作为对照。将细菌与单独的抗生素,或与PHDLG-BIm40共同施用的抗生素,或与PHLG-BIm40共同施用的抗生素在以不同浓度一起培育。对于MG1655细菌,链霉素与PHDLG-BIm40的共同施用产生与单独链霉素相同的MIC值(图4A)。然而,当链霉素与浓度为1.6、3.3和6.5μM的PHLG-BIm40共同施用时,各自对MG1655的MIC值比单独链霉素的低2、133和400倍。因为单独PHLG-BIm40对MG1655的MIC是26.1μM,所以这个结果表明了链霉素和PHLG-BIm40的组合处理的协同作用。我们还观察到PHLG-BIm40和抗生素对C101(铜绿假单胞菌),一种对许多抗生素具有高度抗性的细菌,具有类似的协同作用。对于C101细菌,单独PHLG-BIm的MIC是52.3μM。链霉素与PHLG-BIm40(13.1μM)联合给药时的协同效应比单独链霉素的低128倍的MIC(图4B)。联合治疗的协同效应的测定还针对了其他三种菌株,DH5α、ATCC11778和ATCC12608(表3)以及其他三种抗生素:多西环素,利福平和庆大霉素(表4)。
表3.链霉素与PHLG-Blm或PHDLG-Blm共同施用在不同浓度的抗菌活性,对于DH5α(PHLG-BIm的MIC:3.3μM),ATCC11778(PHLG-BIm的MIC:26.1μM)和ATCC12608(PHLG-BIm的MIC:26.1μM)。
表4.各种抗生素与PHLG-BIm(3.3μM)或PHDLG-BIm(3.3μM)共同施用的抗菌活性,对于MG1655(PHLG-BIm的MIC:26.1μM)和C101(PHLG-BIm的MIC:52.3μM)。
对于表3和表4:aΣFIC=MICA,组合/MICA,单独+MICB,组合/MICB,单独.。协同定义为ΣFIC指数≤0.5。无差异定义为ΣFIC指数>0.5但≤4。拮抗定义为ΣFIC指数>4.0。
联合治疗的协同效应可能是由于多肽诱导的膜渗透导致的抗生素摄取增加的结果。为了检验这一假设,将细菌细胞与利福平一起温育,加入或不加入多肽。与RA多肽孵育0.5小时或1小时后,我们观察到MG1655和C101细胞中利福平的细胞内摄取增加(图8)。这些发现表明,共同施用抗生素与RA多肽的协同作用是由增加的抗生素摄取引起的,例如由肽引起的缺陷引起的,或抑制的外排活性。我们的研究显示组合疗法对于这类膜活性RA多肽是有希望的用途,其可以通过不同的作用模式灭杀细菌,显著提高传统商用抗生素的效力。
联合疗法
本文所述的抗菌多肽可以单独施用或与其它治疗剂,例如抗生、抗炎或防腐剂比如抗菌剂、抗真菌剂、抗病毒剂和抗寄生虫剂,组合施用。在一些实施方式中,医药组合物包含一种或多种本文所述的抗菌多肽和一种或多种抗生或防腐剂。合适的活性剂的例子包括青霉素类,头孢菌素类,碳头孢烯类,头霉素类,碳青霉烯类,单环胺类,氨基糖苷类,糖肽类,喹诺酮类,四环素类,大环内酯类和氟喹诺酮类。合适可用的防腐剂包括碘,银,铜,氯己定,聚己缩胍和其他双胍类,壳聚糖,乙酸和过氧化氢。这些药剂可以作为相同医药组合物的一部分并入,或者可以分开(同时或依次地)给药。所述医药组合物还可以含有抗炎药如类固醇和巨内酰胺衍生物。
本文描述的几种实施方式涉及包含一种或多种-内酰胺抗生素和本文所述的一种或多种抗菌多肽的医药组合物。-内酰胺抗菌素是杀菌的,可以通过抑制细菌细胞壁的肽聚糖层的合成来起作用。肽聚糖层对于细胞壁结构完整性是重要的,特别是在革兰氏阳性细菌中。β-内酰胺抗生素的实例包括但不限于苄星青霉素(benzathine penicillin),苄青霉素(benzylpenicillin(青霉素G)),苯氧基甲基青霉素(phenoxymethylpenicillin(青霉素V)),普鲁卡因青霉素(procaine penicillin),甲氧西林(methicillin),苯唑西林(oxacillin),萘夫西林(nafcillin),氯唑西林(cloxacillin),双氯西林(dicloxacillin),氟氯西林(flucloxacillin),替莫西林(temocillin),阿莫西林(amoxicillin),氨苄西林(ampicillin),复合阿莫西林(co-amoxiclav),阿洛西林(azlocillin),羧苄青霉素(carbenicillin),替卡西林(ticarcillin),美洛西林(mezlocillin),哌拉西林(piperacillin),头孢菌素(cephalosporins),头孢氨苄(cephalexin),头孢菌素(cephalothin),头孢唑啉(cefazolin),头孢克洛(cefaclor),头孢洛林(ceftaroline),头孢呋辛(cefuroxime),头孢孟多(cefamandole),头孢菌素(cephamycins),头孢替坦(cefotetan),头孢西丁(cefoxitin),头孢曲松(ceftriaxone),头孢噻肟(cefotaxime),头孢泊肟(cefpodoxime),头孢克肟(cefixime),头孢他啶(ceftazidime),头孢吡肟(cefepime),头孢匹罗(cefpirome),亚胺培南(imipenem),美罗培南(meropenem),厄他培南(ertapenem),法罗培南(faropenem),多利培南(doripenem),单环胺(monobactams),氨曲南(aztreonam),替吉莫南(tigemonam),诺卡西林A(nocardicin A)和烟毒素-β-内酰胺(tabtoxinine- -lactam)。
本发明的实施方式包括通过与本文所述的抗菌多肽组合(同时地或依次地)施用来抑制易感生物体的生长和/或繁殖,和/或增加易感生物体对抗生素的敏感性的方法。易感有机体一般包括革兰氏阳性和革兰氏阴性有氧和厌氧有机体,其生长可以通过本文所述的实施方式来抑制。易感有机体包括但不限于葡萄球菌(Staphylococcus),乳杆菌(Lactobacillus),链球菌(Streptococcus),无乳链球菌(Streptococcus agalactiae),八叠球菌(Sarcina),肺炎链球菌(S.pneumoniae),化脓性链球菌(S.pyogenes),变形链球菌(S.mutans),埃希氏菌(Escherichia),肠杆菌(Enterobacter),克雷伯菌(Klebsiella),假单胞菌(Pseudomonas),铜绿假单胞菌(Pseudomonas aeruginosa),不动杆菌(Acinetobacter),变形杆菌(Proteus),弯曲杆菌(Campylobacter),柠檬酸杆菌(Citrobacter),奈瑟菌(Nisseria),炭疽杆菌(Bacillus anthracis),蜡状芽孢杆菌(Bacillus cereus),枯草芽孢杆菌(Bacillussubtilis),拟杆菌属(Bacteroides),消化球菌(Peptococcus),梭状芽孢杆菌Clostridiu(Clostridium),沙门氏菌(Salmonella),志贺氏菌(Shigella),沙雷氏菌(Serratia),嗜血杆菌(Haemophilus),布鲁氏菌(Brucella,),结核分枝杆菌(Mycobacterium tuberculosis)以及类似生物体。
药物制剂
本文所述的化合物可用于制备治疗性医药组合物,例如,将所述化合物与药学上可接受的稀释剂、赋形剂或载体组合。所述化合物能够以盐或溶剂合物的形式加入到载体中。例如,在化合物具有足够碱性或酸性以形成稳定的无毒的酸或碱盐的情况下,所述化合物的施用可能适于采取盐的形式。药学上可接受的盐的实例为与形成生理学上可接受的阴离子的酸形成的有机酸加成盐,例如甲苯磺酸盐,甲磺酸盐,乙酸盐,柠檬酸盐,丙二酸盐,酒石酸盐,琥珀酸盐,苯甲酸盐,抗坏血酸盐,α-酮戊二酸盐和-甘油磷酸盐。也可以形成合适的无机盐,包括盐酸盐,卤化物,硫酸盐,硝酸盐,碳酸氢盐和碳酸盐。
药学上可接受的盐可以使用本领域公知的标准方法获得,例如通过使诸如胺的足够碱性的化合物与合适的酸反应以提供生理上可接受的离子型化合物。碱金属(例如钠、钾或锂)或碱土金属(例如钙)盐也可以通过采用类似的方法制备。
本文所述述的化合物可以配制成医药组合物并以多种形式施用于哺乳动物宿主,例如人类患者。所述形式可以特别适配于选定的给药途径,例如口服或非肠道给药,通过静脉内的、肌肉内的、外用的或皮下途径。
本文所述的化合物可以与药学上可接受的载体(例如惰性稀释剂或可吸收的可食用载体)一起系统性给药。对于口服给药,化合物可被包封在硬的或软壳胶囊中,压成片剂,或直接掺入患者的食物中。化合物还可以与一种或多种赋形剂组合,并且可以用于可吸收的片剂,口含剂,锭剂,胶囊剂,酏剂,混悬剂,糖浆剂,糯米纸囊剂等的制剂形式。这样的组合物和制剂通常含有至少0.1%的活性化合物。所述组合物和制剂的百分比含量可以调整变化并且可以方便地为给定单位剂型重量的约0.5%至约60%,约1%至约25%或约2%至约10%。这种治疗上有用的组合物中的活性化合物的量可以是能够达到有效剂量程度。
所述片剂、锭剂、丸剂、胶囊剂等也可以含有一种或多种以下物质:粘合剂,如黄蓍胶、阿拉伯胶、玉米淀粉或明胶;赋形剂,如磷酸二钙;崩解剂,如玉米淀粉、马铃薯淀粉、海藻酸等;以及润滑剂,如硬脂酸镁。也可添加甜味剂,如蔗糖,果糖,乳糖或阿斯巴甜;或者调味剂,如薄荷,冬青油或樱桃调味剂。当单位剂型是胶囊时,除了上述类别的材料之外,还可以包含液态载体,例如植物油或聚乙二醇。各种其他材料可用作包衣或以其他形式改变固体单位剂型的物理形态。例如,片剂、丸剂或囊剂可以使用明胶、蜡、虫胶或糖等作为包衣。糖浆或酏剂可含有活性化合物、作为甜味剂的蔗糖或果糖、作为防腐剂的对羟基苯甲酸甲酯和对羟基苯甲酸丙酯、染料和诸如如樱桃或橙味的调味剂。用于制备任何单位剂型的任何材料应该是药学上可接受的,并且在使用量上基本上无毒。另外,所述活性化合物可以与缓释的制剂和装置结合使用。
所述活性化合物可通过输注或注射在静脉内或腹膜内给药。所述活性化合物或其盐的溶液可以在水中制备,可选择地与无毒表面活性剂混合。分散剂可以在甘油、液体聚乙二醇、甘油三乙酸酯或其混合物中或在药学上可接受的油中制备。在普通储存和使用条件下,制剂可含有防腐剂以防止微生物的生长。
适用于注射或输注的药物剂型可以包括无菌水溶液、分散体或无菌粉末,其包含适合临时制备无菌可注射或输注溶液或分散剂的活性成分,可选择地包封在脂质体中。在制备和储存条件下,最终的剂型应该是无菌的、液态的和稳定的。液态载体或赋形剂可以是溶剂或液态悬浮介质,包含例如水,乙醇,多元醇(例如丙三氧基、丙二醇、液体聚乙二醇等),植物油,无毒丙三氧基酯和其合适的混合物。合适的流动性,例如,可以通过形成脂质体,通过在分散体的情况下保持所需粒度,或通过使用表面活性剂来维持。对微生物作用的预防可以通过使用各种抗菌剂和/或抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等来实现。在许多情况下,优选包括等渗剂,例如糖、缓冲剂或氯化钠。可注射组合物的延长吸收可以通过使用诸如单硬脂酸铝和/或明胶的延缓吸收剂来实现。
无菌注射溶液可通过将所需量的活性化合物与上文列举的各种其它成分(如果需要)合并在适当的溶剂中并随后可选择地进行过滤除菌来制备。在用于制备无菌注射溶液的无菌粉末的情况下,制备方法可以包括真空干燥和冷冻干燥技术,从而生成在溶液中的活性成分加上任何额外需要成分的粉末。
对于局部给药,化合物可以以纯的形式施用,例如当它们是液体的情形。然而,通常需要将活性剂作为组合物或制剂施用于皮肤,例如与可以是固体、液体、凝胶等的皮肤可接受的载体组合。
实用的固态载体包括细碎的固体,如滑石、粘土、微晶纤维素、二氧化硅、氧化铝等。实用的液态载体包括水、二甲基亚砜(DMSO)、醇、二醇或水-醇/二醇混合物,其中化合物能够以有效的程度溶解或分散,可选择借助于无毒的表面活性剂。诸如如香料的佐剂和其他抗菌剂可以被添加从而对给定用途的性质进行优化。所得到的液体组合物可以利用吸收垫施用,用于浸渍绷带和其它敷料,或者使用泵式或气溶胶喷雾器喷洒到患处。
增稠剂,例如合成聚合物、脂肪酸、脂肪酸盐和酯、脂肪醇、改性纤维素或改性矿物材料,也可以与液态载体一起使用从而形成可涂抹的糊剂、凝胶、软膏、皂剂等,用来直接施加到患者的皮肤。
用于将活性剂递送至皮肤的皮肤用组合物的实例是本领域已知的;例如可参见美国专利4,992,478(Geria),4,820,508(Wortzman),4,608,392(Jacquet et al.)以及4,559,157(Smith等人)4,559,157(Smith et al.)。这种皮肤用组合物可以与本文所述的化合物结合使用,其中这种皮肤用组合物可以可选择性地被本文所述的化合物替代,或者可以加入本文所述的化合物。
本文所述化合物(例如所述肽)的有用剂量可以通过比较它们的体外活性和动物模型中的体内活性来确定。用于将小鼠和其它动物中的有效剂量外推至人类的方法是本领域已知的;例如可参见美国专利4,938,949(Borch et al.)。治疗所需的化合物或其活性盐或其衍生物的量可以不仅根据所选择的具体化合物或盐,而且根据给药途径、被治疗病症的性质以及患者的年龄和病状而变化,并且最终由门诊医师或临床医师决定。
所述化合物可以以单位剂量形式方便地给药,例如每单位剂型含有5至1000mg/m2,方便的10至750mg/m2,最方便的50至500mg/m2的活性成分。期望的剂量可以方便地以单剂量或以分开剂量按合适的间隔(例如每天二、三、四或更多个亚剂量)给药。所述亚剂量本身可以被进一步分开,例如分成许多离散的间隔给药。
以下实施例是用来对上述发明内容进行说明,而不应被解释为缩小发明的范围。本领域技术人员应很容易的认识到所述实施例能够提示本发明可以通过很多其他方法来实施。应当理解,在本发明的范围内可以进行很多的变化和修改。
实施例
材料.化学品购自Sigma-Aldrich(St.Louis,MO,USA)并且按到货的状态使用,除非另有说明。无水二甲基甲酰胺(DMF)、乙酸乙酯(EtOAc)和己烷是通过流经氧化铝柱进行干燥,并且在手套操作箱中在分子筛存在下贮存以保持干燥。在套手工作箱中六甲基二硅氮烷(HMDS)被溶于DMF。SiliaFlash P60硅胶(粒径40-63μm)购自SiliCycle Inc.(Quebec City,Quebec,Canada),并在使用前加热至150℃达48小时。具有1k Da切割分子量(MWCO)的透析管购自Spectrum Laboratories(Rancho Dominguez,CA,USA)。
革兰氏阴性菌DH5α(大肠杆菌)、MG1655(大肠杆菌)、C101(绿脓杆菌)和革兰氏阳性菌ATCC12608(金黄色葡萄球菌)和ATCC11778(图瓦永芽孢杆菌)是在37℃于LB培养基中生长。在37℃,在含有10%胎牛血清(FBS)的布氏培养基(BB)中,并添加万古霉素(5μg/mL),培养临床分离的幽门螺杆菌菌株B107,J291,J99,J99-AF,J99-A9和J99-A11。其中,J99-AF,J99-A9和J99-A11是耐药菌。所有脂类均得自Avanti Polar Lipids,Inc。碘化丙锭(PI)和BacLightTM Kit L-7012购自Thermo Fisher Scientific Inc。人造泪液购自Boss Safety Products。铜绿假单胞菌弹性酶购自Elastin Products Company,Inc。LL-37(参见Durr et al.(2006)Biochim Biophys Acta 1758(9):1408-1425;Stromstedt et al.(2009)Antimicrob Agents Chemother 53(2):593-602)得自AnaSpec,Inc。来自人类白细胞的弹性蛋白酶、来自人类的血清的血浆均购自Sigma-Aldrich。
表征.1H NMR光谱记录是利用Varian U500MHz或VXR-500MHz光谱仪进行的。.13C-1H HSQC(异核单量子相干)NMR,1H-1H TOCSY(总相关谱)NMR和NOESY(核欧佛豪瑟效应频谱,混合时间为150ms)NMR是在VNS750NB光谱仪上进行的。化学位移是以ppm为单位报告并参考溶剂质子杂质。所制备的多肽分子量的测定采用了凝胶渗透色谱仪(GPC),其配备有等度泵(型号1100,Agilent Technology,Santa Clara,CA,USA),DAWN HELEOS多角度激光散射(MALLS)检测器(Wyatt Technology,Santa Barbara,CA,USA)以及OptilabrEX折射率检测器(Wyatt Technology,Santa Barbara,CA,USA)。HELEOS的检测波长设定在658nm。分离过程是在60℃下使用了含有0.1mol/L LiBr的DMF作为流动相的串联连接的尺寸排阻柱(and Phenogel columns,5μm,300×7.8mm,Phenomenex,Torrance,CA,USA)。MALLS检测器使用纯甲苯校准,且可用于测定绝对分子量(MWs)。聚合物的MWs的确定是基于每种聚合物样品的dn/dc值,其通过ASTRA V软件(version 5.1.7.3,Wyatt Technology,Santa Barbara,CA,USA)处理的内部校准系统离线计算获得。
圆二色性(CD)测量在JASCO J-815CD光谱仪上进行。多肽样品是在水中以0.40mg/mL的浓度制备,并且在测量之前置于光程为0.10cm的石英池中。红外光谱是在聚苯乙烯膜校准的Perkin Elmer 100serial FTIR分光光度计上记录的。冷冻干燥是在FreeZone冷冻干燥机(Labconco,Kansas City,MO,USA)中进行。HPLC分析使用了Shimadzu CBM-20A system(Shimadzu,Kyoto,Japan),其配有SPD20A PDA检测器(190nm-800nm)和RF10Axl荧光检测器和分析C18柱(Shimadzu,3μm,50×4.6mm,Kyoto,Japan)。
实施例1.具有径向两亲性的螺旋多肽的制备
具有径向两亲性的螺旋多肽显示出高度选择性的抗菌活性。RA螺旋多肽及其非螺旋对应物可以按如下,例如反应式1-1,所述的过程进行制备。
反应式1-1.抗菌的PHLG基多肽的合成
(i)光气;(ii)HDMS/DMF;(iii)叔胺(例如,1-甲基苯并咪唑(BIm)),NaI,DMF/MeCN
具有长的疏水侧链的阳离子多肽表现出稳定的螺旋结构。这些多肽具有各向同性的螺旋结构,其中侧链的疏水链段聚集在一起形成由螺旋表面上/附近的外部阳离子电荷所屏蔽的圆柱形螺旋的内部部分。
γ-(6-氯己基)-L-谷氨酸(CH-L-Glu)的合成。将L-谷氨酸(10.0g,68.0mmol)和6-氯己醇(15mL,112.4mmol)混合并在0℃下搅拌,接着滴加H2SO4(4mL)。使反应温热至室温并保持搅拌24小时。然后加入饱和Na2CO3溶液以将pH值调节至7。得到的沉淀被过滤收集,并通过从异丙醇/H2O(1:1,v/v)重结晶来纯化。真空除去异丙醇,冷冻干燥除去水分,得到白色固体粉末(6.92g,收率38%)。1H NMR(DMSO:DCl-D2O,9:1,v/v):δ3.91(t,2H,-CH2OOC-),3.82(t,1H,α-H),3.52(t,2H,,2.53-2.32(m,2H,-CH2CH2COO-),1.98(m,2H,-CH2CH2COO-),1.64-1.17(m,8H,ClCH2(CH2)4CH2O-)。
类似地,使用DL-谷氨酸作为起始原料合成CH-DL-Glu(收率:36%)。1H NMR(DMSO:DCl-D2O,9:1,v/v):3.91(t,2H,-CH2OOC-),3.82(t,1H,α-H),3.52(t,2H,-CH2Cl),2.53-2.32(m,2H,-CH2CH2COO-),1.98(m,2H,-CH2CH2COO-),1.64-1.17(m,8H,ClCH2(CH2)4CH2O-)。
基于CH-L-Glu的N-羧酸酐(CH-L-Glu-NCA)的合成。在圆底烧瓶(100mL)中加入CH-L-Glu(7.3g,27.4mmol)并真空干燥2小时。在氮气保护下,依次加入无水四氢呋喃(THF,60mL)和光气(15wt%在甲苯中,39.2mL,54.9mmol)。将混合物在50℃搅拌2小时。在真空下除去溶剂,得到油状液体。使用EtOAC/己烷(100%至60%己烷)作为洗脱液的硅胶色谱柱进行纯化得到产物(6.6g,产率:83%)。1H NMR(CDCl3,ppm):δ7.16(s,1H,-NH),4.43(t,1H,-CHNH),4.05(t,2H,-CH2OOC-),3.51(t,2H,-CH2Cl),2.51(t,2H,-CH2CH2COO-),2.25-2.07(m,2H,-CH2CH2COO-),1.79-1.30(m,8H,ClCH2(CH2)4CH2O-).13C NMR(CDCl3,ppm):δ172.8,170.0,152.6,65.4,57.1,45.2,32.6,29.7,28.5,27.0,26.6,25.4。
类似地,使用CH-DL-Glu作为起始原料合成CH-DL-Glu-NCA(收率:79%)。1H NMR(CDCl3,ppm):δ7.31(s,1H,-NH),4.41(s,1H,-CHNH),3.99(s,2H,-CH2OOC-),3.45(s,2H,-CH2Cl),2.45(s,2H,-CH2CH2COO-),2.10(d,2H,-CH2CH2COO-),1.75-1.22(m,8H,ClCH2(CH2)4CH2O-).13C NMR(CDCl3,ppm):δ172.8,170.2,152.7,65.3,57.1,45.3,32.5,29.6,28.5,27.0,26.6,25.3。
聚(γ-6-氯己基-L-谷氨酸)(PCHLG)的合成。在手套操作箱中,CH-L-Glu NCA(100mg,0.34mmol)被溶于DMF(1.5mL),然后加入85μL或136μL HMDS(0.1M)的DMF溶液,得到PCHLG40和PCHLG28。将所述混合物在室温下搅拌48小时。然后通过在冷甲醇中沉淀得到聚合物,并在40℃下真空干燥8小时(收率:PCHLG40:66%,PCHLG28:56%)。1H NMR(CDCl3:TFA-d,85:15,v/v):DP=40:δ4.60(m,1H,-CHNH),4.09(m,2H,-CH2OOC-),3.52(t,2H,-CH2Cl),2.50(m,2H,-CH2CH2COO-),2.19-1.90(m,2H,-CH2CH2COO-),1.81-1.30(m,8H,ClCH2(CH2)4CH2O-).DP=25δ4.60(m,1H,-CHNH),4.09(m,2H,-CH2OOC-),3.52(t,2H,-CH2Cl),2.50(m,2H,-CH2CH2COO-),2.19-1.90(m,2H,-CH2CH2COO-),1.81-1.30(m,8H,ClCH2(CH2)4CH2O-)。
类似地,使用CH-DL-Glu-NCA作为单体(M/I=40)合成PCHDLG40(产率:72%)。1H NMR(CDCl3/TFA-d,85:15,v/v):δ4.60(m,1H,-CHNH),4.10(m,2H,-CH2OOC-),3.52(t,2H,-CH2Cl),2.48(s,2H,-CH2CH2COO-),2.28-1.90(m,2H,-CH2CH2COO-),1.81-1.30(m,8H,ClCH2(CH2)4CH2O-)。
PHLG-Blm多肽的合成。将在DMF(2mL)中的PCHLG40(86.5mg,0.35mmol的Cl基团)和在乙腈(2mL)中的NaI(157mg,1.05mmol)混合并且添加到1-甲基苯并咪唑(92.4mg,0.70mmol)25毫升Schlenk管。所述混合物在80℃下搅拌48小时。在真空下除去大部分溶剂后,加入NaCl水溶液(1.0M,3mL)。然后将所述溶液在室温下搅拌3小时以促进离子交换。产物通过透析(MWCO=1kDa)在蒸馏水中纯化3天。冻干后得到白色固体粉末(产率:62%)。1H NMR(TFA-d):δ9.02(s,1H,-NCHN-),7.86(m,4H,Ar-H),4.86(s,1H,α-H),4.36(m,2H,-COOCH2(CH2)4CH2N-),4.29(s,2H,-COOCH2(CH2)4CH2N-),4.24(s,3H,-NCH3),2.72(s,2H,-CH2CH2COO-),2.46-1.75(m,6H,-CH2CH2COO-and-COOCH2CH2CH2CH2CH2CH2N-),1.59(s,4H,-COOCH2CH2CH2CH2CH2CH2N-)。
类似地,使用PCHDLG40作为起始原料合成PHDLG-BIm40。1H NMR(D2O):δ7.71(s,1H,-NCHN-),7.52(m,4H,Ar-H),4.66(s,1H,α-H),4.36(m,2H,-COOCH2(CH2)4CH2N-),3.89(s,3H,-NCH3),3.74(s,2H,-COOCH2(CH2)4CH2N-),2.32(s,2H,-CH2CH2COO-),2.16-1.75(m,4H,-CH2CH2COO-and-COOCH2CH2CH2CH2CH2CH2N-),1.49-0.89(s,6H,-COOCH2CH2CH2CH2CH2CH2N-)。
类似地,使用PCHLG28作为起始原料合成PHLG-BIm28。1H NMR(TFA-d):δ9.02(s,1H,-NCHN-),7.86(m,4H,Ar-H),4.86(s,1H,α-H),4.36(m,2H,-COOCH2(CH2)4CH2N-),4.29(s,2H,-COOCH2(CH2)4CH2N-),4.24(s,3H,-NCH3),2.72(s,2H,-CH2CH2COO-),2.46-1.75(m,6H,-CH2CH2COO-and-COOCH2CH2CH2CH2CH2CH2N-),1.59(s,4H,-COOCH2CH2CH2CH2CH2CH2N-)。
表1-1.具有氯代烷基侧链的多肽的合成数据a
a聚合反应在室温下进行48小时。单体转换率全部高于99%。b由GPC测定。
实施例2.具有径向两亲性的多肽的分析和表征
本文所述多肽的抗菌活性是根据下述方法进行分析的。具有径向两亲性的螺旋多肽被发现显示出高选择性的抗菌活性。
模拟方法。对于DP为20的PHLG-BIm的分子动力学模拟我们是按照类似于Mansbach和Ferguson(2015)J Chem Phys 142,105101的程序进行。非天然肽侧链的构建是使用Automated Topology Builder(ATB)Server(compbio.biosci.uq.edu.au/atb/)(参见Koziara et al.(2014)J Comput Aid Mol Des 28(3):221-233)以定义结构,部分电荷以及在GROMOS 54A7力场内的键合和非键合相互作用(参见Schmid et al.(2011)Eur Biophys J 40(7):843-856)。肽主干以α-螺旋构象初始化,利用了Bax Group PDB Utility Server(spin.niddk.nih.gov/bax/nmrserver/pdbutil)。使用内部代码将侧链接枝到主干上以合成最初的肽结构。所述将肽被制备成两性离子,末端苯并咪唑基团被质子化,肽带有的净电荷为(+20)。肽被置于具有周期性边界条件的9×9×9nm立方体模拟盒中,并且通过SPC水分子并连同20Cl-反离子进行溶解以达到1.0g/cm3的密度,使得该系统不携带净电荷。模拟盒的尺寸规定为,使得在1.2nm的实空间截切下,每个溶剂分子能够,甚至在肽的完全延伸构象,与肽的至多一个周期图像相互作用。
分子动力学模拟使用了GROMACS 4.6simulation suite(Hess et al.(2008)J Chem Theory Comput 4(3):435-447)。在最初构象中的高能重叠被通过最速下降能量最小化过程而去除用以消除超过1000kJ/mol.nm的力。模拟过程是使用Nosé-Hoover恒温器和Parrinello-Rahman恒压器在298K和1bar条件下在NPT系统中进行。初始原子速度从298K时的麦克斯韦分布随机分配。运动方程的数值积分使用具有2fs时间步长的蛙跳算法,并使用LINCS算法固定键长以提高效率。静电相互作用的处理使用具有1.2nm的实空间截止值和0.12nm的傅里叶网格间距的Particle Mesh Ewald(PME)算法。Lennard-Jones相互作用在1.2nm处平稳地移动到零,并且Lorentz-Berthelot组合规则用于确定不同原子之间的相互作用参数。进行1.5ns平衡运行,此时温度、压力、能量和肽回转半径达到稳定值。然后,我们执行了68ns的生产运行,每5ps收集系统配置的快照以进行分析。肽在模拟轨迹的整个过程中完全保持α-螺旋。
最小抑制浓度(MIC)。革兰氏阴性菌,DH5α(大肠杆菌),MG1655(大肠杆菌),C101(铜绿假单胞菌),和革兰氏阳性菌,ATCC12608(金黄色葡萄球菌),ATCC11778(图瓦永芽孢杆菌),和甲氧西林抗性金黄色葡萄球菌(MRSA)菌株,NRS382,NRS383,NRS384,在LB培养基中于37℃生长。临床分离的幽门螺杆菌菌株,B107,J291,J99,J99-AF,J99-A9和J99-A11,在补充有万古霉素(5μg/mL)的10%FBS(胎牛血清)的BB培养基中于37℃温育。其中,J99-AF,J99-A9和J99-A11是耐药菌。为了确定MIC,使用来自原液的连续稀释液将多肽溶解在培养基中。向96孔板的每个孔中添加培养基中的200μL各种浓度和2μL细菌(1×108CFU(菌落形成单位))。该板在37℃温育。培育24小时后测量微生物溶液的光密度读数。所述MIC被认为是没有检测到细菌的视觉生长的肽的最低浓度。
在MIC测定中,在包括盐、血清、血浆、泪液和粘蛋白的不同环境中测试多肽的稳定性。用肽处理1×106CFU/ml的大肠杆菌DH5α和金黄色葡萄球菌ATCC12608,在LB培养基中施加不同的条件,并且生理条件终浓度如下:150mM NaCl,1mM MgCl2,2.5mM CaCl2,2%人血清,5%FBS,10%FBS,2%血浆,5%血浆,2%人工泪液(来自Boss Safety Products)和1mg/mL粘蛋白。这些处理后的程序与上述MIC测定相同。
灭杀动力学。通过用琼脂平板计数活细菌的菌落形成单位来测量诸如PHLG-BIm的AMPs对微生物的杀伤动力学和灭杀效率。细菌的制备采用了MIC测量中所述的相同程序。样品的处理是在MIC或双倍MIC利用AMPs(例如PHLG-BIm40)来进行,并在恒定摇动(100rpm)下于37℃温育。样品进行一系列10倍的稀释,并以预定的时间间隔(1h,2h,8h和24h)铺板在LB琼脂板上。该板在37℃温育过夜,并通过CFU对细菌进行计数。还将细菌(DH5α,ATCC12608)与含或不含NaCl(150mM)、2%人血清、2%血浆、2%人造泪液的不同浓度的AMPS孵育。细菌的制备采用了MIC测量中所述的相同程序。温育8小时后,样品进行一系列10倍的稀释,并铺在LB琼脂板上,在37℃孵育过夜后,通过CFU对细菌进行计数。
溶血测定。获得新鲜的兔血,用PBS缓冲液稀释25倍,达到约4%(体积)的血细胞浓度。将含有不同浓度聚合物的300μL的PBS溶液置于1.5mL微量离心管中,然后加入等体积(300μL)的红细胞悬浮液。将混合物在37℃孵育1小时以使溶血过程发生。在温育时间结束时,通过以1000rpm离心5分钟来分离未溶血的血细胞。将等份(100μL)的上清液转移到96孔板中,并使用酶标仪(TECAN,Switzerland)通过在576nm处的UV吸光度测量血红蛋白释放。在该测定中提供了两个对照:在PBS溶液中的未处理的红细胞悬液作为阴性对照;使用含有用1%Triton-X裂解的红细胞的溶液作为阳性对照。溶血百分率通过下述方程式计算:溶血(%)=[(处理样品的O.D.576nm-阴性对照的O.D.576nm)/(阳性对照的O.D.576nm-阴性对照的O.D.576nm)]×100%。
多肽对蛋白酶的稳定性。PHLG-Blm(1.0mg/mL)与胰蛋白酶(1.0mg/mL)或链霉蛋白酶(0.12mg/mL)或铜绿假单胞菌弹性蛋白酶(6.25mg/L),在Tris缓冲液(pH 7.4)中于37℃进行温育。PHLG-BIm(1.0mg/mL)与来自人白细胞(25mg/L)的弹性蛋白酶在乙酸钠缓冲液(0.05M,pH 5.5,含有0.6M NaCl)于37℃进行温育。作为阳性对照,LL-37(0.1mg/mL)与Tris缓冲液(pH 7.4)中的胰蛋白酶(0.1mg/mL)或链霉蛋白酶(12mg/L)或铜绿假单胞菌弹性蛋白酶(0.6mg/L)于37℃进行温育。LL-37(0.1mg/mL)与来自人白细胞(2.5mg/L)的弹性蛋白酶在乙酸钠缓冲液中于37℃进行温育。温育8小时后,取出样品进行HPLC分析。在另外的试验中,PHLG-BIm(1.0mg/mL)与Tris缓冲液(pH 7.4)中的胰蛋白酶(1.0mg/mL)或链霉蛋白酶(0.12mg/mL)在37℃温育8h,并进行MIC测量。
成孔活性的流式细胞仪分析。为了膜渗透性测定,将1×106CFU MG1655细胞与碘化丙啶(PI)(终浓度25μM),HEPES(1m M),葡萄糖(1mM)和多肽合并,并在室温下温育15分钟。用BD Biosciences LSR II流式细胞仪测量细胞结合染料荧光的变化,使用氩激光在488nm处激发,并通过带通滤波器在695/40nm处对PI测量发射。每个样本检测到至少25,000个事件。使用FCS Express 3.00.0311V Lite Stand-alone软件计算每个群体的几何平均荧光强度(MFI)。
染色的细菌细胞的荧光显微镜分析。将Zeiss XBO 75荧光显微镜(Carl Zeiss)用于荧光研究。使用BacLightTM试剂盒L-7012作为在碘化丙啶:SYTO9混合物中的荧光染料,用以检测多肽存在情况下的细菌。使用~108细胞/mL的初始细菌浓度进行显微镜检查以便于观察。在加入多肽溶液之前,将染料混合物与细菌在室温下孵育15分钟。将细胞、染料和聚合物的溶液放置30分钟,将50μL溶液置于载玻片上,盖上盖片,在荧光显微镜下进行观察。在绿色过滤器(激发/发射,420-480nm/520-800nm)或红色过滤器(480-550nm/590-800nm)下对细菌进行观察。
脂质体染料渗漏测定。将钙黄绿素染料溶解在Tris缓冲液(pH=7)中以达到40mM的浓度。在干净的圆底烧瓶中,加入适量的脂质储备物以配制1mL的CHCl3。为3:1POPE(1-棕榈酰-2-油酰-sn-丙三氧基-3-磷酸乙醇胺)/POPG(1-棕榈酰-2-油酰-sn-丙三氧基-3-磷酸(1'-rac-甘油)(钠盐))囊泡,使用了POPE(130μL,25mg/mL CHCl3)和POPG(115μL,10mg/mL CHCl3)。为DOPC(1,2-二-(9Z-十八碳烯酰)-sn-丙三氧基-3-磷酸胆碱)/POPC(1-棕榈酰-2-油酰-sn-丙三氧基-3-磷酸胆碱)囊泡,使用了DOPC(100μL,25mg/mL CHCl3)和POPC(1mL,10mg/mL CHCl3)。用氮气流除去溶剂,得到薄的脂质膜,然后用1mL钙黄绿素溶液使其水合。混合物被搅拌1小时,然后进行10次冷冻-解冻循环(使用干冰/丙酮冷冻并温水解冻)。悬浮液通过具有400nm孔径的聚碳酸酯膜挤压出20次。过量的染料用Sephadex G-50柱作为洗脱液除去。充满染料的囊泡级分用Tris缓冲液稀释200倍。该悬浮液(90μL)随后与多肽储备溶液(10μL)在96孔黑色微量板(Greiner,平底)上混合。使用Tris缓冲液(10μL)和Triton-X(0.1%v/v,10μL)分别作为阴性和阳性对照。30分钟后,使用分别具有490和515nm的激发和发射波长的酶标仪记录每个孔中的荧光强度。每个孔中渗漏的钙黄绿素染料的百分比的确定如下:渗漏(%)=[(F-F0)/(FTX-F0)]×100%,其中F是孔中记录的荧光强度,F0是阴性对照孔中的强度,FTX是阳性对照孔中的强度。
SEM分析。在具有或不具有多肽处理的LB中生长的MG1655细菌细胞的分析使用与MIC测量类似的方案进行,但具有30分钟的温育时间。将所有样品收集到微离心管中并以4000rpm离心5分钟,然后用磷酸盐缓冲盐水洗涤两次。随后,在开始之前将细菌与多聚甲醛溶液(4%)混合1小时,然后进行DI水洗涤。用一系列梯度乙醇溶液(10%,25%,50%,75%,95%和100%)进行脱水。将脱水的样品在真空下干燥过夜,然后将其安装在碳带上涂覆金-铂并使用Hitachi S-4700High Solution SEM(Japan)进行成像。
用于X射线测量的脂质体的制备。DOPS(1,2-二油酰-sn-丙三氧基-3-磷酸-L-丝氨酸(钠盐)),DOPE(1,2-二油酰-sn-丙三氧基-3-磷酸乙醇胺),DOPC(1,2-二油酰-sn-丙三氧基-3-磷酸-L-胆碱磷酸),DOPG(1,2-二油酰基-sn-丙三氧基-3-[磷酰基-rac-(1-甘油)](钠盐)),和CL(牛心磷脂(钠盐)),来自Avanti Polar Lipids的冻干脂类,被用来不经进一步纯化而形成小的单层囊泡(SUVS)。DOPS,DOPE,DOPC,DOPG和CL的单独脂质储备溶液在氯仿中以20mg/mL的浓度制备。这些脂类的混合物以摩尔比制备以产生每种模型的膜组合物。将脂质溶液混合物置于N2下以蒸发氯仿,并在真空下过夜干燥。次日,将干燥的脂质混合物在100mM NaCl,10mM HEPES中于pH 7.4溶解至20mg/mL的浓度。这些脂类水溶液在37℃温育过夜,然后超声直到澄清。将超声处理的脂质溶液通过0.2μm孔的Nucleopore过滤器(Whatman)挤出获得SUVs。
小角度X射线散射实验。多肽和SUVs以特定的P/L摩尔比混合。样品在100mM NaCl,10mM HEPES中于pH7.4制备并密封在石英毛细管(Hilgenberg GmbH,Mark-tubes)中。在Stanford Synchrotron Radiation Light source(SSRL,BL 4-2)上使用能量为9keV的单色X射线进行小角X射线散射(SAXS)实验。使用Rayonix MX225-HE检测器(像素尺寸为73.2μm)收集散射。未观察到入射光束强度和所用曝光时间的辐射损伤。使用适合Igor Pro 6.21和FIT2D的Nika 1.50封装,整合2D SAXS粉末形式。
SAXS数据拟合。衍射峰的Q位置是通过对Origin Lab软件中绘出的整合I(Q)相对于Q SAXS数据利用视觉观察得到。测量的峰位置(Q(hkl)meas)之间的比率与允许的不同晶相的反射之间的比率进行对照以确定每个样品中存在的相。在识别各个晶相之后,通过对应于反射的点的组合进行线性回归拟合,其中每个点都具有其Q位置的坐标Q(hkl)meas和以米勒指数表示的相关反射,h,k,l。对于粉末平均立方相,Q(hkl)meas=(2π/a)√(h2+k2+l2)。因此,对于立方相的Q(hkl)meas vs.√(h2+k2+l2)的线性回归,我们可以从斜率(m=2π/a)计算立方晶格参数。
利福平(rifampicin)的细胞内摄取。将细菌菌株MG1655和C101(1×106CFU)与没有多肽或具有PHLG-BIm40(3.3μM)或具有PHDLG-BIm40(3.3μM)的利福平(分别为4.85μM和38.9μM)进行温育。温育0.5小时或1小时后,通过0.2μm膜过滤获得上清液并用于HPLC分析。
实施例3.抗菌的PHLG基多肽
具有螺旋构象的肽由于医学和生物技术上的实用性而引起了很多关注。多种天然抗菌肽(AMPs),如杀菌肽素、爪蟾抗菌肽素和蜂毒肽素,与脂质双层结合后具有两亲性的α-螺旋结构。AMPs的两亲性α-螺旋具有其膜活性,并作为膜去稳定剂,允许疏水性组分插入膜脂质结构域,从而在与细菌膜相互作用时破坏膜结构。AMPs的膜物理破坏机制降低了病原体产生抗性的可能性。但是,AMPs需要精确的序列调控才能对细菌细胞膜起作用。
我们已经报道了易于产生阳离子和螺旋多肽的方法(Lu,H.;Zhang,Y.;Cheng,J.Nat.Commun.2011,2,206)。阳离子多肽的螺旋结构可以通过增加侧链荷电基团与多肽主干之间的距离而稳定,从而通过降低螺旋表面上的电荷密度来尽量降低电荷排斥的影响。本实施例中描述的是一类α-螺旋多肽AMP模拟物,其特征在于具有长的疏水性侧链,每个侧链带有具有不同阳离子化学官能团的季铵端基(反应式3-1)。
反应式3-1.抗菌多肽的制备
a)光气;b)HMDS/DMF;c)X,NaI,DMF/MeCN;X=叔胺,例如:
在各种实施方式中,X可以是任何合适的叔胺,其在共价键合到PCHLG上时形成阳离子以提供PHLG-X。
长侧链(优选地来自聚合物主干的11-13个σ-键)将阳离子铵基团延伸离开肽主干,通过减少端基电荷排斥和增加侧链之间的疏水相互作用而得到更稳定的螺旋结构。不同于典型的AMP,其具有沿着两亲性螺旋的带电和疏水表面的特征,以及无规抗菌聚合物,本文所述多肽具有棒状的螺旋结构,具有带电的外部“包衣”和疏水内部,其中螺旋多肽的疏水内部被带正电荷的外部“包衣”所遮蔽从而降低溶血活性(图1B)。
也是由于螺旋结构,所述多肽能够以良好组织的方式呈现正电荷以实现与细胞膜匹配的合适的电荷密度,并且允许有效的结合/相互作用。由于具有季铵端基的长疏水性侧链所遇到的空间位阻,螺旋结构可显著抑制蛋白水解。我们证明,所述多肽的属性可以定制,用以针对革兰氏阴性和革兰氏阳性细菌获得优异的抗菌活性。我们进一步表明,所述多肽的细菌杀伤能力可归因于其直接破坏和透化细胞膜的能力。因此,我们发现这些多肽可以通过促进膜渗透和摄取而与传统的抗生素一起使用而增强传统抗生素的效力。
单体γ-氯代烷基-L/DL-谷氨酸基N-羧基酐(CH-L/DL-glu-NCA)的制备是通过相应谷氨酸的单酯化和随后使用光气的环化反应进行的(反应式3-1)。CH-L-glu-NCA和CH-DL-glu-NCA的分子结构经1H NMR和13C NMR确证。然后,多肽的合成是在手套操作箱中并在室温(~22℃)下通过由六甲基二硅氮烷引发的CH-L/DL-Glu-NCA单体的受控开环聚合来进行。这些具有氯烷基侧链的多肽然后分别通过基于叔胺、咪唑或吡啶的亲核试剂的亲核反应进行修饰,分别产生季铵、咪唑或吡啶基多肽(反应式3-1)。
带有分开的主干和正电荷之间的11-13个σ-键,基于聚(L-谷氨酸)的多肽能够具有稳定的α-螺旋构象,这由在208和222nm具有两个极小CD的曲线证实(图9)。通过DL-构象NCA的聚合作用也合成了相应的非螺旋多肽,以研究螺旋结构对多肽的抗菌活性的影响。外消旋的聚(DL-谷氨酸)多肽在其CD谱中没有显示出科顿效应(图9),与其预期的随机构象一致。
我们调查了多肽的化学和结构特征是如何通过最小抑制浓度(MIC)来影响其抗菌活性和杀微生物的试验。MIC通常用于评估抗菌剂的活性,并通常定义为未观察到可见细菌生长的抗菌剂的最小浓度。我们首先确定在R基上分别具有6,8,9,10,13个碳的一系列螺旋多肽PHLG-X(X=TEA,DMH,MDB,DMO,MDH)针对革兰氏阴性菌DH5α(大肠杆菌)的MICs。随着R基团上碳原子数的增加,具有更为疏水端基的多肽被发现具有较低的MIC值和较低的HC50值(HC50=50%溶血浓度)。这与之前的研究结果相一致,即高疏水性与增加的整体毒性相关。当R基团的碳原子数小于9时,所述多肽表现出非常低的溶血活性。当R基团的碳原子数大于9时,溶血活性显著增加,而抗菌活性几乎没有增加。因此,在R基团上具有9和10个碳的PHLG-DMH和PHLG-DMO对DH5α显出最高的选择性,分别具有>32和64倍的选择性。在革兰氏阴性菌MG1655(大肠杆菌)和革兰氏阳性细菌ATCC12608(金黄色葡萄球菌)和ATCC11778(图瓦永芽孢杆菌)发现有相同的现象(表3-1)。
表3-1.所述多肽(polypeptides)对包括MG1655(大肠杆菌)、ATCC12608(金黄色葡萄球菌)和ATCC11778(图瓦永芽孢杆菌)的细菌的抗菌活性和溶血活性(注:表中的“Number of carbon on R group”即“R基团上的碳原子数”,“LogP of N-R group”即“N-R基团的LogP”,“Longest chain on R group”即“R基团上的最长链”)。
a选择性(Selectivity)被定义为HC50/MIC.
与对应的非螺旋多肽相比,所述螺旋PHLG-DMH和PHLG-DMO肽对所有细菌细胞显示出高得多的抗菌活性和略高的溶血活性,显示出对细菌的更高选择性。这可以归因于聚集的、杆状螺旋结构,其能够以良好有序的方式呈现正电荷以实现适当的电荷密度以匹配细菌细胞膜的电荷密度并且允许有效的结合/相互作用,同时所述螺旋多肽的疏水部分被带正电荷的外部“包衣”所屏蔽了。
我们还研究了芳香族R基团对抗菌活性和溶血活性的影响。合成了螺旋多肽PHLG-X(Py,iQu,Im和BIm)以及相应的非螺旋多肽。所述多肽的二级结构显示于CD谱图(图10a和10b)。同样,具有更疏水的芳香族R基团的多肽被发现具有较低的MIC值(表3-2),表明较高的抗菌活性。
表3-2.多肽(polypeptides)对DH5α,MG1655,ATCC12608和ATCC11778的抗菌活性和溶血活性。
a选择性(Selectivity)被定义为HC50/MIC.
例如,PHLG-Blm对DH5α、MG1655、ATCC12608和ATCC11778的MIC值为100、400、200和200mg/L,这些均显著低于PHLG-Im的相应值。而且,螺旋PHLG-X肽与对应的非螺旋PHDLG-X相比,表现出更高的抗菌活性和略高的溶血活性。对DH5α、MG1655、ATCC12608和ATCC11778,PHLG-BIm分别具有比PHDLG-BIm的低8、4、4和4倍的MIC值。尽管螺旋PHLG-X多肽表现出比其相应的非螺旋类似物略低的HC50,但是它们的选择性一致超过非螺旋多肽。所述螺旋多肽的杀菌活性用菌落测定来证实,其中细菌用一种代表性的多肽PHLG-Blm培育。结果显示在两个小时内早期100%灭杀所有五种细菌,具有各自的MIC或双重MIC值(图6)。
我们还发现,通过在所述多肽的一端添加疏水脂肪族链可以增强抗菌活性,例如通过用(C1-C60)烷基胺引发开环聚合,如下述反应式3-2所示。
反应式3-2.具有末端脂肪族基团的抗菌多肽的制备
i)碳酰氯;ii)N-TMS-(C1-C60)烷基胺(e.g.,N-TMS-十二烷基伯胺)/DMF;
iii)X,NaI,DMF/MeCN;X=叔胺
在反应式3-2中,X可以是任何合适的叔胺,例如上述反应式3-1所列的那些。有用的具体实例包括MBB(甲基二丁基胺),EBB(乙基二丁基胺)和TPA(三丙基胺)。实用的ROP引发剂包括具有与胺连接的合适硅烷的(C1-C60)烷基胺。所述(C1-C60)烷基可以是(C4-C60)烷基,并且可以是直链或支链的。实例包括:
其中y为0至约16。
用N-TMS-十二烷胺引发开环聚合由此提供了C12-PHLG-X聚合物,其分析提供的数据如表3-3所示。
表3-3.多肽对DH5α,MG1655,ATCC12608和ATCC11778的抗菌活性和溶血活性。
总之,从合理设计的螺旋阳离子多肽中,我们证明了螺旋结构和侧链排列可以显著地增强多肽的抗菌活性。阳离子多肽能有效杀灭革兰氏阳性菌和革兰氏阴性菌,并对细菌膜表现出较高的造孔能力,其进一步增加了抗生素的通透性,并增强了商用抗生素的抗菌活性。这些抗菌多肽可以用作治疗各种细菌感染性疾病的抗菌药物。
实施例4.药用剂型
下列配方举例说明药用剂型,可用于治疗性或预防性施用本文所述以下配方的化合物(例如肽)、本文具体公开的化合物或其药学上可接受的盐或溶合物(以下称为'化合物X'):
这些制剂可以通过制药领域公知的常规方法制备。应当理解,上述药物组合可根据公知的制药技术进行改变,以适应不同量和不同类型的活性成分“化合物X”。气雾剂(vi)可以与标准计量喷雾器结合使用。另外,具体的成分和比例只是用来进行说明。根据需要的剂型的期望的性质,具体成分可以用合适的等价物替代,并且比例也可以改变。
文中描述了上述的一些实施方式和实施例,但这些描述都只是示意和说明性的,对本发明的范围不产生限制作用。根据本领域的普通技术可能进行一些改变和修饰,然而并不脱离本发明由下列权利要求所定义的较为宽泛的范围。
所有的出版物、授权专利和专利申请文献均通过参考纳入文本,就如各自单独通过参考纳入本文那样。由这些公开物,应当不会引入与本文公开内容不一致的限制。本发明的描述引述了各种特定和优选的实施方式和技术方案。应当理解,还有许多变化和修饰可被采纳,仍然都应属于本发明的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!