双亲性石墨烯‑金热放疗纳米药物及其制备方法和应用与流程
本发明涉及纳米材料药物领域,尤其涉及一种双亲性石墨烯-金热放疗纳米药物及其制备方法和应用。
背景技术:
纳米技术是一种具有极大市场应用潜力的新兴科学技术,受到众多研究领域的关注。纳米材料作为一种新型材料,具有通常的宏观材料所没有的特殊性质,为医药、生物、材料、物理等领域带来了新的研究活力。
石墨烯是一种单层平面碳纳米材料,具有良好的导电、导热性能,近年来,其在医药、生物等领域取得了较大的研究进展。氧化石墨烯是石墨烯的氧化物,带有多种含氧官能团,如羰基、羧基、羟基和环氧基等,可通过化学修饰获得特异的物理化学性质;且具有良好的水溶液分散稳定性和生物相容性。但是氧化石墨烯的导电性较差,所以通常将其还原以提高导电性。还原氧化石墨烯具有导电性能好、可稳定分散溶剂范围广、生物相容性好等特点。
纳米金是金的微小颗粒,直径为1-100nm,具有高电子密度、介电特性和催化作用,能够与多种生物大分子结合,且对其生物活性无影响。纳米金在dna修复与检测、生物组织修复、药物传递等方面具有极其广泛的应用。在医学领域,纳米金已被广泛应用于疾病诊断、药物检测等方面。
聚丙烯酸(paa)是一种水溶性高分子,其带有功能基团(-cooh),是功能及高吸水性材料的重要骨架。聚丙烯酸可以发生多种化学反应,如中和反应、酯化反应、络合反应、脱水和降解反应等,且具有较好的耐热性。
穿膜肽tat是一种短肽,可以协助大分子物质进入哺乳动物细胞。研究表明,多种与tat融合的物质可以穿过细胞膜在细胞内部发挥生物学功能,并应用于疾病的治疗。目前tat已在肿瘤、免疫治疗等领域展现出极大的研究价值,具有广泛的应用前景。
质子/中子治疗,在射程的终点会形成一个尖锐的剂量峰,起到杀伤肿瘤的作用,但是存在一个问题是剂量峰过于尖锐,只会杀伤局部肿瘤,不能对大面积的肿瘤起到均匀的杀伤效果,因此,bragg峰的展宽是目前亟需解决的问题。
技术实现要素:
为解决上述技术问题,本发明的目的是提供一种双亲性石墨烯-金热放疗纳米药物及其制备方法和应用,本发明所制备的纳米药物可通过热疗复合质子/中子治疗,对肿瘤细胞具有较强的杀伤作用。
本发明提供了一种双亲性石墨烯-金热放疗纳米药物,包括双亲性石墨烯、负载于双亲性石墨烯表面的纳米金颗粒以及连接在双亲性石墨烯上的肿瘤靶向分子。
进一步地,双亲性石墨烯由含羧基的聚合物通过二异氰酸酯连接到氧化石墨烯表面得来。
进一步地,双亲性石墨烯-金热放疗纳米药物中,双亲性石墨烯的质量分数为45-99.89%,纳米金颗粒的质量分数为0.1-50%,肿瘤靶向分子的质量分数为0.01-5%。优选地,双亲性石墨烯的质量分数为68-98.95%,纳米金颗粒的质量分数为1-30%,肿瘤靶向分子的质量分数为0.05-2%。更优选地,双亲性石墨烯的质量分数为79-94.8%,纳米金颗粒的质量分数为5-20%,肿瘤靶向分子的质量分数为0.2-1%。
进一步地,双亲性石墨烯是通过将含羧基的聚合物接枝于二异氰酸酯活化的氧化石墨烯上制得的。二异氰酸酯为六亚甲基二异氰酸酯。含羧基的聚合物为聚丙烯酸、聚丙烯酸-聚乙二醇嵌段共聚物或聚丙烯酸-聚乙二醇单甲醚嵌段共聚物。含羧基的聚合物使氧化石墨烯修饰上多羧基基团,使其功能化。
进一步地,肿瘤靶向分子为穿膜肽tat。
进一步地,将双亲性石墨烯-金热放疗纳米药物分散在水或血清中,放置1周后,纳米药物的沉淀比例不高于50%。分散方法为在10000rpm下离心20min,100w水浴超声分散20min。
进一步地,双亲性石墨烯-金热放疗纳米药物纳米颗粒在水、n,n二甲基甲酰胺、四氢呋喃中均可稳定分散。
本发明还提供了一种上述双亲性石墨烯-金热放疗纳米药物的制备方法,包括以下步骤:
(1)将二异氰酸酯修饰到氧化石墨烯表面,在80-160℃下反应,然后加入含羧基的聚合物,在80-160℃下反应,使聚合物的羧基与氧化石墨烯表面的二异氰酸酯反应,得到双亲性石墨烯;
(2)通过化学还原法将金纳米颗粒原位生长于步骤(1)得到的双亲性石墨烯表面;
(3)向步骤(2)得到的产物中加入含氨基的肿瘤靶向分子和偶联剂,使含氨基的肿瘤靶向分子中的氨基与双亲性石墨烯表面的羧基反应,得到双亲性石墨烯-金热放疗纳米药物。
进一步地,在步骤(1)中,二异氰酸酯为六亚甲基二异氰酸酯。在步骤(1)中,二异氰酸酯一端的异氰酸根与氧化石墨烯表面的羧基或羟基反应,以连接到氧化石墨烯表面。
进一步地,在步骤(1)中,含羧基的聚合物为聚丙烯酸、聚丙烯酸-聚乙二醇嵌段共聚物或聚丙烯酸-聚乙二醇单甲醚嵌段共聚物。进一步地,含羧基的聚合物中,聚丙烯酸的分子量为1000-10000g/mol,聚乙二醇或聚乙二醇单甲醚的分子量为2000-5000g/mol。
进一步地,在步骤(1)中,二异氰酸酯和氧化石墨烯的质量比优选为10:1,氧化石墨烯和含羧基的聚合物的质量比优选为1:10。
进一步地,在步骤(2)中,金纳米颗粒为球形颗粒或棒状颗粒。
进一步地,在步骤(3)中,含氨基的肿瘤靶向分子为穿膜肽tat。
进一步地,在步骤(3)中,偶联剂为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)或者1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)。
本发明进一步提供了上述双亲性石墨烯-金热放疗纳米药物作为抗肿瘤药物的应用。
进一步地,应用时使用红外激光、质子射线和/或中子射线照射所述双亲性石墨烯-金热放疗纳米药物。
进一步地,肿瘤为肝癌、乳腺癌和宫颈癌中的一种或几种。
进一步地,红外激光的波长为700-900nm。优选地,红外激光的波长为810nm或980nm。
进一步地,质子射线或中子射线的能量为4mev或6mev。
进一步地,双亲性石墨烯-金热放疗纳米药物在应用时,其中的金纳米颗粒可以散射中子或质子射线,同时石墨烯吸收金纳米颗粒散射的中子或质子,扩展射线的bragg峰。
本发明的双亲性石墨烯即为双亲性还原氧化石墨烯的简称。
借由上述方案,本发明至少具有以下优点:
本发明的双亲性石墨烯-金热放疗纳米药物中的双亲性石墨烯中含有具有羧基的聚合物,可延长在药物在体内的循环时间;纳米药物中的肿瘤靶向分穿膜肽tat能够使纳米药物识别并进入肿瘤细胞,具有靶向性;纳米药物中的纳米金与石墨烯的结合使用,一方面通过热疗可以加强肿瘤的热杀伤效果;另一方面,在放射治疗中,通过放疗,au与质子/中子相互作用,扩展bragg峰,增加放疗的均匀性;石墨烯吸收中子或者质子,提供粒子的减速效应,同时产生热量,兼具热疗的效果;;因此纳米药物联合金纳米颗粒和双亲性石墨烯的优势,能兼顾热疗和质子/中子治疗的优势,靶向肿瘤组织,高效杀伤肿瘤,提高对肿瘤的治疗效果作用。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
附图说明
图1图示了不同激光能量密度对细胞存活率的影响;
图2图示了不同照射剂量对细胞存活率的影响;
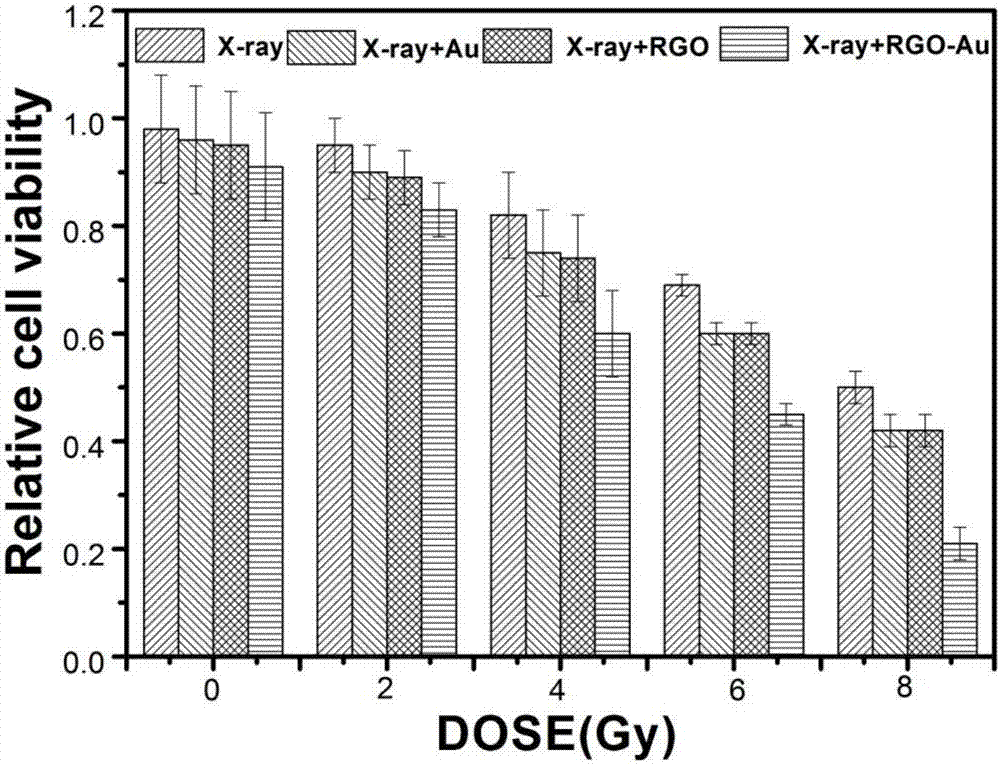
图3图示了不同治疗方法处理后细胞的存活比率。
具体实施方式
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1
将10g六亚甲基二异氰酸酯(充分过量)与1g氧化石墨烯在无水n、n-二甲基甲酰胺(dmf)中混合,在80度下反应12h,六亚甲基二异氰酸酯一端的异氰酸根与氧化石墨烯表面的羧基或羟基反应,连接到氧化石墨烯表面,将产物用无水dmf洗涤数次,以除去未反应的二异氰酸酯。然后向反应液中加入5-10g聚丙烯酸(分子量为5000g/mol),在80度下反应12h,使聚丙烯酸中的羧基与二异氰酸酯另一端的异氰酸根反应,得到双亲性还原氧化石墨烯(双亲性石墨烯)。
通过原位生长法将金纳米颗粒负载于双亲性石墨烯表面:将10mg双亲性石墨烯在水浴超声仪器中超声30min,使其均匀分散;向其中加入9ml100mm的ctab、450ul10mm的haucl4、50μl的100mm的抗坏血酸(aa),将双亲性石墨烯在其中浸泡1h,生成双亲性石墨烯-金热放疗纳米颗粒,其中金颗粒为棒状。该双亲性石墨烯-金纳米颗粒中,双亲性石墨烯的质量分数为80%,纳米金颗粒的质量分数为20%。
向2mg上述制备的双亲性石墨烯-金纳米颗粒中加入1mg穿膜肽tat,在偶联剂edc(2mg)和nhs(2mg)的作用下,穿膜肽tat表面的氨基与双亲性石墨烯表面的羧基反应,得到双亲性石墨烯-金热放疗纳米药物,反应所得产物中,肿瘤靶向分子tat的质量分数为1-2%。
取1mg上述制备的双亲性石墨烯-金热放疗纳米药物,加入1ml溶剂中,如水、n,n二甲基甲酰胺、四氢呋喃,在其中均可稳定分散。
取上述制备的双亲性石墨烯-金热放疗纳米药物加入水或血清中,在10000rpm下离心20min,100w水浴超声分散20min使其充分分散,放置1周后,纳米药物的沉淀比例不高于50%。说明该双亲性石墨烯-金热放疗纳米药物具有良好的分散稳定性。
实施例2
本发明的双亲性石墨烯-金热放疗纳米药物的制备方法如下:
将100g六亚甲基二异氰酸酯与1g氧化石墨烯在dmso溶剂中混合,在80度条件下反应24h,六亚甲基二异氰酸酯一端的异氰酸根与氧化石墨烯表面的羧基或羟基反应,连接到氧化石墨烯表面。然后向反应液中加入5g聚丙烯酸(分子量2000g/mol)和5g聚丙烯酸-聚乙二醇单甲醚共聚物,其中聚丙烯酸的分子量为5000g/mol,聚乙二醇单甲醚的分子量为500-1000g/mol,在80条件下反应24h,使聚合物中的羧基与二异氰酸酯另一端的异氰酸根反应,得到双亲性石墨烯。
通过种子介导法将金纳米颗粒负载于双亲性石墨烯表面:将双亲性石墨烯浸于金纳米颗粒溶液中20min;之后于向其中加入10ml100mm的ctab、200μl10mm的haucl4、50μl的100mm的aa,将双亲性石墨烯在其中浸泡1h,生成双亲性石墨烯-金纳米颗粒,其中金颗粒为棒状。
向双亲性石墨烯-金纳米颗粒中加入穿膜肽tat(穿膜肽tat的质量为双亲性石墨烯-金热放疗纳米颗粒的100倍),在偶联剂edc和nhs的作用下,穿膜肽tat表面的氨基与双亲性石墨烯表面的羧基反应,得到双亲性石墨烯-金热放疗纳米药物。该双亲性石墨烯-金热放疗纳米药物中,双亲性石墨烯的质量分数为45%,纳米金颗粒的质量分数为50%,肿瘤靶向分子的质量分数为5%。
取1mg上述制备的双亲性石墨烯-金热放疗纳米药物,加入1ml溶剂中,如水、n,n二甲基甲酰胺、四氢呋喃,在其中均可稳定分散。
取上述制备的双亲性石墨烯-金热放疗纳米药物加入水或血清中,在10000rpm下离心20min,100w水浴超声分散20min使其充分分散,放置1周后,纳米药物的沉淀比例不高于50%。说明该双亲性石墨烯-金热放疗纳米药物具有良好的分散稳定性。
实施例3
将实施例1所制的双亲性石墨烯(10mg)在水浴超声仪器中超声30min,使其均匀分散;向其中加入9ml100mm的ctab、1000ul10mm的haucl4、1000μl的100mm的抗坏血酸(aa),将双亲性石墨烯在其中浸泡1min,生成双亲性石墨烯-金纳米颗粒,其中金颗粒为点状。
向2mg双亲性石墨烯-金纳米颗粒中加入0.01mg穿膜肽tat,在偶联剂edc(2mg)和nhs(2mg)的作用下,穿膜肽tat表面的氨基与双亲性石墨烯表面的羧基反应,得到双亲性石墨烯-金热放疗纳米药物。该双亲性石墨烯-金热放疗纳米药物中,双亲性石墨烯的质量分数为99.89%,纳米金颗粒的质量分数为0.1%。肿瘤靶向分子tat的质量分数为0.01%。
实施例4
设置各组分别为激光照射组、激光照射联合纳米金颗粒组、激光照射联合双亲性石墨烯组、激光照射联合双亲性石墨烯-金热放疗纳米药物组。本实施例使用的双亲性石墨烯-金热放疗纳米药物中,双亲性石墨烯的质量分数为78%,纳米金颗粒的质量分数为20%,肿瘤靶向分子的质量分数为2%。
处于对数生长期的肝癌细胞,胰酶消化,接种1×106个肝癌细胞在60mm培养皿,第二天待其完全贴壁后,将细胞用pbs洗涤两次,更换新鲜完全培养基,采用波长780nm的激光分别照射0w/cm2到2w/cm2,照射时间为5min。继续培养24h后利用mtt细胞生存分析法检测。
如图1所示,图中laser代表激光照射组,laser+au代表激光照射联合纳米金颗粒组,laser+rgo代表激光照射联合双亲性石墨烯组,laser+rgo-au代表激光照射联合双亲性石墨烯-金热放疗纳米药物组。结果表明激光照射组未有显著差异;0.25w/cm2激光照射联合纳米金颗粒组肿瘤细胞存活率为80%,激光照射联合双亲性石墨烯-金热放疗纳米药物组肿瘤细胞存活率为79%;2w/cm2激光照射联合纳米金颗粒组肿瘤细胞存活率为35%,激光照射联合双亲性石墨烯-金热放疗纳米药物组肿瘤细胞存活率为30%;激光照射联合双亲性石墨烯-金热放疗纳米药物组照射激光能量密度在0.25w/cm至2w/cm2之间时,各组细胞的存活率具有显著差异,证明激光照射联合双亲性石墨烯-金热放疗纳米药物具有明显的热效应,且双亲性石墨烯-金热放疗纳米药物能有效杀伤肿瘤细胞。
实施例5
设置各组分别为x射线照射组,x射线照射联合纳米金颗粒组、x射线照射联合双亲性石墨烯组、x射线照射联合双亲性石墨烯-金热放疗纳米药物组。本实施例使用的双亲性石墨烯-金热放疗纳米药物中,双亲性石墨烯的质量分数为49%,纳米金颗粒的质量分数为50%,肿瘤靶向分子的质量分数为1%。
处于对数生长期的乳腺癌细胞,胰酶消化,接种1×106个细胞在60mm培养皿,第二天待其完全贴壁后,将细胞用pbs洗涤两次,更换新鲜完全培养基,采用6mevx射线直线加速器分别照射0gy,2gy,4gy,6gy,8gy,照射5min,继续培养24h后利用mtt细胞生存分析法检测。
如图2所示,图中x-ray代表激光照射组,x-ray+au代表激光照射联合纳米金颗粒组,x-ray+rgo代表激光照射联合双亲性石墨烯组,x-ray+rgo-au代表激光照射联合双亲性石墨烯-金热放疗纳米药物组。结果表明x射线照射对照组在照射剂量为2gy-4gy之间时,肿瘤细胞存活率具有差异,但并不显著。x射线照射联合纳米金颗粒组在照射剂量为2gy时肿瘤细胞存活率为90%,x射线照射联合纳米金颗粒组在照射剂量为8gy时肿瘤细胞存活率为40%;x射线照射联合双亲性石墨烯组在照射剂量为2gy时肿瘤细胞存活率为89%,x射线照射联合纳米金颗粒组在照射剂量为8gy时肿瘤细胞存活率为40%;x射线照射联合联合双亲性石墨烯-金热放疗纳米药物组在照射剂量为2gy-8gy之间时,肿瘤细胞存活率出现显著差异,证明x射线照射联合双亲性石墨烯-金热放疗纳米药物能有效治疗肿瘤细胞。
实施例6
设置各组分别为纳米金颗粒组、双亲性石墨烯组、双亲性石墨烯-金热放疗纳米药物。本实施例使用的双亲性石墨烯-金热放疗纳米药物中,双亲性石墨烯的质量分数为45%,纳米金颗粒的质量分数为50%,肿瘤靶向分子的质量分数为5%。以宫颈癌为细胞模型,利用mtt细胞生存分析法检测细胞存活率,其中热疗参数为0.5w/cm2,照射5min;x射线参数为4gy,照射5min。
如图3所示,图3中横坐标从左到右分别代表纳米金颗粒组、双亲性石墨烯组、双亲性石墨烯-金热放疗纳米药物。从图中可以看出,双亲性石墨烯-金热放疗纳米药物效果最好,肿瘤细胞死亡率为60%。纳米金颗粒组、双亲性石墨烯组对肿瘤细胞的杀伤效果比较接近,但均不如双亲性石墨烯-金热放疗纳米药物对肿瘤细胞的杀伤性。
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 过渡金属与石墨烯的复合纳米线及其制备方法与流程
- 一种氧化石墨烯表面原位生长二氧化硅的纳米杂化填料及其制备方法与流程
- GO增强CNT覆膜砂的智能混凝土无线传感器的制造方法与工艺
- 一种基于纳米纤维素晶须MoS2/石墨烯复合对电极材料及其制备方法和应用与流程
- 聚醚砜树脂/石墨烯纳米片多孔纳米复合材料、制备方法及其用途与流程
- 一种改性石墨烯与纳米纤维素复合温敏材料的制备方法与制造工艺
- 石墨烯掺杂改性纳米钙钛矿型La1‑xSrxMnO3复合材料及其制备方法和应用与制造工艺
- 一种在二氧化锰电极表面对苯胺进行原位氧化的方法与制造工艺
- 一种氧化石墨烯/银纳米颗粒/金字塔形硅三维拉曼增强基底及制备方法和应用与制造工艺
- 纳米羧基化石墨烯复合涤纶导电织物的制备方法与制造工艺
- 一种氧化石墨烯表面原位生长二氧化硅的纳米杂化填料及其制备方法与流程
- 一种基于纳米纤维素晶须MoS2/石墨烯复合对电极材料及其制备方法和应用与流程
- 一种改性石墨烯与纳米纤维素复合温敏材料的制备方法与制造工艺
- 一种石墨烯生产设备的制造方法与工艺
- 石墨烯掺杂改性纳米钙钛矿型La1‑xSrxMnO3复合材料及其制备方法和应用与制造工艺
- 一种氧化石墨烯/银纳米颗粒/金字塔形硅三维拉曼增强基底及制备方法和应用与制造工艺
- 纳米羧基化石墨烯复合涤纶导电织物的制备方法与制造工艺
- 硅烷纳米石墨烯陶化膜及其制备方法与制造工艺
- 纳米氧化石墨烯在促进小鼠胚胎干细胞培养和自我更新中的应用的制造方法与工艺
- 一种纳米石墨烯改性蓝藻基复合生物塑料及其制备方法与制造工艺
- 一种基于纳米纤维素晶须MoS2/石墨烯复合对电极材料及其制备方法和应用与流程
- 一种改性石墨烯与纳米纤维素复合温敏材料的制备方法与制造工艺
- 石墨烯掺杂改性纳米钙钛矿型La1‑xSrxMnO3复合材料及其制备方法和应用与制造工艺
- 一种多层石墨烯纳米碳管三维碳材料填充纳米硅复合材料及其制备方法与制造工艺
- 一种氧化石墨烯/银纳米颗粒/金字塔形硅三维拉曼增强基底及制备方法和应用与制造工艺
- 一种碳纳米管和石墨烯协同增强铝基复合材料及制备方法与制造工艺
- 纳米氧化石墨烯在促进小鼠胚胎干细胞培养和自我更新中的应用的制造方法与工艺
- 一种碳纳米管和石墨烯复配润滑油的制备方法与制造工艺
- 一种纳米石墨烯改性蓝藻基复合生物塑料及其制备方法与制造工艺
- 用于制备石墨烯纳米带的邻三联苯的制造方法与工艺