一种抗帕金森病药物的长效缓释制剂及其制备方法与流程
本发明属于制药领域,具体涉及一种抗帕金森病药物的长效缓释制剂及其制备方法。
背景技术:
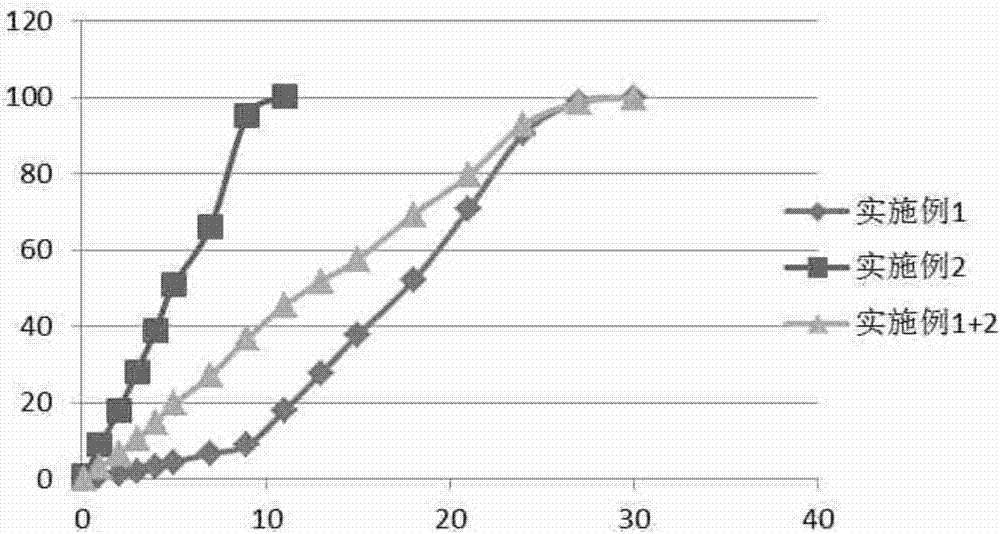
:雷沙吉兰是第二代单胺氧化酶抑制剂,能阻滞神经递质多巴胺的分解,与第一代单胺氧化酶抑制剂,包括司来吉兰、思吉宁、咪哆吡、金思平等相比,抑制作用更强,对长期应用多巴制剂药效出现衰退的患者也有改善的作用。另外,雷沙吉兰的代谢产物是一种无活性的非苯丙胺物质,副作用小,更重要的是,该药有一定的症状缓解的作用,并有较多证据证明这类药物有一定的神经保护的作用。雷沙吉兰目前在临床上仅有口服片剂。口服片剂虽然服用方便,但帕金森病人随着病情的发展,往往伴有神经损伤,出现记忆力减退,从而导致漏服药物,无法规律服用药物,导致病情进一步恶化。再者帕金森后期患者常常具有吞咽困难,不适合服用药物。另外,口服给药会有明显的血药浓度波动,加重副作用,出现剂末现象和开关现象。专利cn103494766公开了一种雷沙吉兰经口崩解组合物,虽然解决了药品吞咽困难的问题,但是无法解决漏服药物,以及频繁用药等问题。专利cn1762495公开了一种治疗帕金森病的长效缓释制剂的制备工艺,使用有机溶剂把药物和生物可降解的药用高分子辅料溶解,将有机溶剂相注入到用药用水溶性高分子配制的连续水相中以形成微球,然后挥发掉有机溶剂,过滤得到缓释微球即o/w工艺;或用有机溶剂溶解药物和生物可降解的药用高分子辅料,然后采用喷雾干燥法制得微球;或用有机溶解剂把药物和生物可降解的药用高分子辅料充分溶解配制成有机溶液,将其喷雾至一有机非溶剂或水中,经萃取而制成微球即o/o工艺或o/w工艺。使用o/w工艺,由于药物是水溶性活性的,未有任何保护措施、会直接暴露在外部水相而降低包封率,因此,难以获取具有高含量和高包封率的微球。而使用o/o工艺,需要用到大量的有机溶剂,并且需要去除使用的全部有机溶剂,工艺复杂。使用喷雾干燥第一是需要有高温使原辅料造成降解,且有机溶剂喷雾干燥,需要防爆,有一定的危险性。专利cn105769771公开了一种艾塞那肽缓释微球组合物的制备方法,首先将原料药使用强极性溶剂溶解,然后将聚合物用弱极性溶剂溶解,然后将强极性溶剂加入弱极性溶剂中形成悬浊液或均一溶液,后加入淬灭剂中,得到微粒。其中淬灭剂选自硅油、液体石蜡、矿物油,需要用到大量的有机溶剂,并且需要去除使用的全部有机溶剂,工艺复杂。m.fernández等人的文献《controlledreleaseofrasagilinemesylatepromotesneuroprotectioninarotenone-inducedadvancedmodelofparkinson’sdisease》公开了一种使用50/50plga作为缓释材料,采用o/w和w/o/w工艺制备雷沙吉兰缓释微球的方法。但该方法制备得到微球释放周期较短,仅有两周,且药物的载药量较低,相同剂量下,注射的药物总量偏大,不利于患者的顺应性。专利cn103338752公开了一种利培酮缓释微球组合物,其公开了使用两种不同粘度的聚合物来制备微球,以此来达到调节释放目的,消除延迟释放期。但是使用两种不用粘度的聚合物同时溶于有机溶剂中然后制备微球,一方面会增加处方复杂性,不同粘度聚合物有可能带来处方相容性问题,另一方面该方法应用在本发明还会造成产品突释的问题。专利cn104010629公开了一种曲普瑞林微球药物组合物,其通过在微球中添加葡萄糖或甘露醇来调节释放,提高药物的初始释放量,从而使药物尽快起效。但是使用添加释放调节剂的方法一方面同样增加处方复杂性,有可能带来处方相容性问题,另一方面该方法应用在本发明也还是会造成产品突释的问题。技术实现要素:发明目的:为解决现有技术中存在的问题,本发明提供一种雷沙吉兰长效缓释组合物及其制备方法。本发明改善了目前临床上只有口服形式进行给药的雷沙吉兰药物的依从性,并且改善了目前文献公开的缓释微球制剂药物组合物释放周期短,载药量低的缺点,且无延迟释放期。本发明人按照目前公开的技术资料,尝试将雷沙吉兰制备成释放周期更长的缓释微球,按照本领域技术人员常用技术手段,使用65/35-100/0的plga替换50/50的plga,发现确实可以将微球的释放周期延长,但是发现,微球出现了延迟释放期。在该领域,解决微球延迟释放期的常用技术有利用不同粘度型号的聚合物混合使用,以及添加释放调节剂等方法,但这些方法一个是均增加了处方复杂性,有可能带来处方相容性间题,另一个是,应用在本发明中会造成产品突释的问题。另外本发明人发现在微球常规粒径范围内,随着微球粒径的减小,微球释放周期以及延迟释放期确实会变短,但是变化均不是明显的。但是本发明人却创造性的发现,将微球制备成纳米至亚微米级别,微球释放行为却发生了明显的改变,第一是无延迟释放期且无突释,第二是释放周期明显缩短。且本发明人奇迹的发现纳米至亚微米级别微球的释放期与普通粒径微球的延迟释放期接近,甚至在一些实施例中相同。因此本发明人想到将两种不同粒径的微球混合使用,不仅可以得到释放周期较长的产品,且无延迟释放期。另外本发明人实验发现,使用目前公知技术,无法得到高载药量和包封率的产品。但是按照本发明公开的技术,却能得到高载药量和高包封率的微球。具体地,为实现本发明的技术目的,本发明的技术方案为:一种治疗帕金森病药物的长效缓释制剂,所述长效缓释制剂为微球,所述微球包含雷沙吉兰或其药物学可接受的盐和生物可降解生物相容性高分子,所述微球包括平均粒径为0.5-5μm的微球和平均粒径为20-150μm的微球。所述平均粒径为0.5-5μm的微球占长效缓释制剂的10-50wt%,平均粒径为20-150μm的微球占50-90wt%。进一步优选地,所述平均粒径为0.5-5μm的微球占长效缓释制剂的20-40wt%,平均粒径为20-150μm的微球占60-80wt%。优选地,一种治疗帕金森病药物的长效缓释制剂,所述长效缓释制剂为微球,所述微球包含雷沙吉兰或其药物学可接受的盐和生物可降解生物相容性高分子,所述微球优选包括平均粒径为0.5-3μm的微球和平均粒径为40-100μm的微球。所述平均粒径为0.5-3μm的微球占长效缓释制剂的10-50wt%,平均粒径为40-100μm的微球占50-90wt%。进一步优选地,所述平均粒径为0.5-3μm的微球占长效缓释制剂的20-40wt%,平均粒径为40-100μm的微球占60-80wt%。优选地,雷沙吉兰或其药学上可接受的盐占长效缓释制剂的10-50wt%。低含量药物会是使总给药重量增加,高载药量可能会包封率下降,进一步优选地,雷沙吉兰或其药学上可接受的盐占长效缓释制剂的20-40wt%。在一种优选地实施方案中,所述生物可降解生物相容性高分子为聚(丙交酯-乙交酯)。进一步优选地,所述聚(丙交酯-乙交酯)中,丙交酯和乙交酯的摩尔比为65∶35~100∶0。在临床应用上,药物释放时间越长越好,但是更长时间可能会一次给药过多,不利于患者顺应性,因此在某些情况下,所述聚(丙交酯-乙交酯)中,丙交酯和乙交酯的优选摩尔比为70∶30~95∶5。在临床应用上,药物释放时间越长越好,但是更长时间可能会一次给药过多,不利于患者顺应性,因此在某些情况下,所述聚(丙交酯-乙交酯)中,丙交酯和乙交酯的更优选摩尔比为75∶25~85∶15。在一种优选地实施方案中,所述聚(丙交酯-乙交酯)的粘度范围为0.2-0.8dl/g。进一步优选地,所述聚(丙交酯-乙交酯)的粘度范围为0.3-0.6dl/g。在一种优选地实施方案中,所述聚(丙交酯-乙交酯)的分子量范围21kda-89kda。在一种优选地实施方案中,所述聚(丙交酯-乙交酯)的末端基为酯基或羧基。进一步优选地,所述聚(丙交酯-乙交酯)的末端基为羧基。本发明所述长效缓释制剂的释放周期在4~12周。本发明进一步提出了一种治疗帕金森病药物的长效缓释制剂的制备方法,包括如下步骤:a)将生物可降解生物相容性高分子溶于第一类有机溶剂,得到均一溶液a;b)将雷沙吉兰或其药物学可接受的盐溶于能与第一类有机溶剂互溶的第二类有机溶剂,得均一溶液b;c)将步骤b)得到的均一溶液b加入步骤a)得到的均一溶液a中得到均一乳液c;d)将步骤c)得到的均一乳液c加入用药用水溶性高分子配制的连续水相中以形成微球;优选地,所述药用水溶性高分子为聚乙烯醇;所述聚乙烯醇溶液浓度为0.5-4%;所述连续水相温度为2-15℃,优选4℃。e)去除步骤d)微球中的有机溶剂,过滤,洗涤;f)将步骤e)所得微球冷冻干燥,得到缓释微球。优选地,第一类有机溶剂选自二氯甲烷、乙酸乙酯、四氢呋喃、二甲基亚砜、二甲基甲酰胺或二甲基乙酰胺中的任意一种。第二类有机溶剂选自乙醇、乙酸、盐酸、二甲基亚砜、二甲基甲酰胺或二甲基乙酰胺中的任意一种。进一步优选地,第一类有机溶剂选自二氯甲烷、乙酸乙酯、四氢呋喃中的任意一种。第二类有机溶剂选自乙醇、乙酸、二甲基亚砜、二甲基甲酰胺或二甲基乙酰胺中的任意一种。更进一步优选地,第一类有机溶剂选自二氯甲烷。第二类有机溶剂选自乙醇、乙酸的任意一种。将步骤b)得到的溶液在加入步骤a)时采用超声、涡旋、均质或搅拌方式。将步骤c)得到的均一乳液c加入用药用水溶性高分子配制的连续水相中时采用超声、涡旋、均质、高压均质或搅拌的方式。其中超声功率在200-400w,涡旋转速在2000-4000rpm,均质速度在4000-20000rpm,高压均质在600-1500bar;搅拌速度在1000-3000rpm。优选的,第一类有机溶剂与第二类有机溶剂的比例为2∶1-20∶1。进一步优选的,第一类有机溶剂与第二类有机溶剂的比例为2∶1-10∶1。有益效果:与现有技术相比,本发明提出的微球形式存在的药物组合物,具有药物长期释放的性质,可在超过一个月的时间里释放雷沙吉兰。本发明的特征在于通过在本发明的药物组合物中使用2种不同粒径微球的适宜组合,可以显著减少血浆中雷沙吉兰浓度的波动,且无明显的延迟释放期。本发明的另一个特征是在载药量高的情况下,无药物突释现象。附图说明图1为实施例1、实施例1-2、实施例1-4和实施例1-6所得缓释微球的释放特性,从图中可以看出,在普通粒径范围内,即20-150μm粒径范围内,虽然不同粒径范围微球释放行为有差异,但是并不明显;图2为实施例1缓释微球(标注为实施例1)、实施例2缓释微球(标注为实施例2)、两份实施例1与一份实施例2混合物(标注为实施例1+2)的体外释放曲线;图3为实施例3缓释微球(标注为实施例3)、实施例4缓释微球(标注为实施例4)、三份实施例1与一份实施例4混合物(标注为实施例3+4)的体外释放曲线;图4为实施例5缓释微球(标注为实施例5)、实施例6缓释微球(标注为实施例6)、三份实施例5与一份实施例6混合物(标注为实施例5+6)的体外释放曲线;图5为实施例7缓释微球(标注为实施例7)、实施例8缓释微球(标注为实施例8)、两份实施例7与一份实施例8混合物(标注为实施例7+8)的体外释放曲线。图6为实施例9缓释微球(标注为实施例9)、实施例10缓释微球(标注为实施例10)、五份实施例9与一份实施例10混合物(标注为实施例9+10)的体外释放曲线。图7为实施例11缓释微球(标注为实施例11)、实施例12缓释微球(标注为实施例12)、三份实施例11与两份实施例12混合物(标注为实施例11+12)的体外释放曲线。具体实施方式下面对本发明技术方案进行详细说明,但是本发明的保护范围不局限于所述实施例。实施例1.缓释微球制备。将8.00gplga(丙交酯/乙交酯=65/35,下文同,均为丙交酯/乙交酯,0.65dl/g,71kda,酯基端基)溶于80.00g二氯甲烷,得均一溶液a;将2.00g雷沙吉兰溶于10.00g乙醇,得均一溶液b;在3000rpm的涡旋条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入4℃的1.0%的聚乙烯醇水溶液中,使用2000rpm的机械搅拌器搅拌制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例2.缓释微球的制备。将8.00gplga(65/35,0.65dl/g,71kda,酯基端基)溶于80.00g二氯甲烷,得均一溶液a;将2.00g雷沙吉兰溶于10.00g乙醇,得均一溶液b;在超声条件下,功率300w,将溶液a加入溶液b得均一乳液c。将均一溶液c加入4℃的1.0%的聚乙烯醇连续水相中,在900bar的压力下高压均质制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球除去连续水相,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例3.缓释微球的制备。将7.00gplga(75/25,0.5dl/g,57kda,羧基端基)溶于70.00g乙酸乙酯,得均一溶液a;将3.00g雷沙吉兰溶于15.00g乙酸,得均一溶液b;在3000rpm的涡旋条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入4℃的0.5%的聚乙烯醇连续水相中,使用4000rpm的均质机均质制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例4.缓释微球的制备。将7.00gplga(75/25,0.5dl/g,57kda,羧基端基)溶于70.00g乙酸乙酯,得均一溶液a;将3.00g雷沙吉兰溶于15.00g乙酸,得均一溶液b;在4000rpm的涡旋条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入4℃的0.5%的聚乙烯醇连续水相中,在1000bar的压力下高压均质制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例5.缓释微球的制备。将6.00gplga(85/15,0.4dl/g,46kda,羧基端基)溶于60.00g二氯甲烷,得均一溶液a;将4.00g雷沙吉兰溶于20.00g乙醇,得均一溶液b;在超声条件下,功率300w,将溶液a加入溶液b得均一乳液c。将均一溶液c加入4℃的0.5%的聚乙烯醇连续水相中,使用1000rpm的机械搅拌制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例6.缓释微球的制备。将600gplga(85/15,0.45dl/g,51kda,羧基端基)溶于60.00g二氯甲烷,得均一溶液a;将4.00g雷沙吉兰溶于20.00g乙醇,得均一溶液b;在4000rpm的涡旋条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入4℃的1.5%的聚乙烯醇连续水相中,在1000bar的压力下高压均质制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例7.缓释微球的制备。将5.00gplga(100/0,0.65dl/g,73kda,酯基端基)溶于50.00g四氢呋喃,得均一溶液a;将5.00g雷沙吉兰溶于25.00g二甲基亚砜,得均一溶液b;在超声条件下,功率400w,将溶液a加入溶液b得均一乳液c。将均一溶液c加入4℃的0.5%的聚乙烯醇连续水相中,使用1000rpm的机械搅拌制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例8.缓释微球的制备。将5.00gplga(100/0,0.45dl/g,53kda,羧基端基)溶于50.00g四氢呋喃,得均一溶液a;将5.00g雷沙吉兰溶于25.00g二甲基亚砜,得均一溶液b;在4000rpm的涡旋条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入4℃的1.5%的聚乙烯醇连续水相中,在1000bar的压力下高压均质制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例9.缓释微球的制备。将6.00gplga(75/25,0.6dl/g,69kda,酯基端基)溶于100.00g二甲基亚砜,得均一溶液a;将4.00g雷沙吉兰溶于10.00g二甲基甲酰胺,得均一溶液b;在2000rpm的机械搅拌条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入10℃的3.0%的聚乙烯醇连续水相中,使用1500rpm的机械搅拌制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例10.缓释微球的制备。将6.00gplga(65/35,0.5dl/g,58kda,羧基端基)溶于150.00g二甲基甲酰胺,得均一溶液a;将4.00g雷沙吉兰溶于8.00g乙酸,得均一溶液b;在4000rpm的均质条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入10℃的3.0%的聚乙烯醇连续水相中,在10000rpm的高速均质条件下制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例11.缓释微球的制备。将6.50gplga(85/15,0.75dl/g,81kda,羧基端基)溶于150.00g二氯甲烷,得均一溶液a;将3.50g雷沙吉兰溶于10.00g乙酸,得均一溶液b;在2000rpm的涡旋条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入15℃的4.0%的聚乙烯醇连续水相中,使用600bar的高压均质制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例12.缓释微球的制备。将6.50gplga(100/0,0.3dl/g,27kda,酯基端基)溶于50.00g二氯甲烷,得均一溶液a;将3.50g雷沙吉兰溶于10.00g乙酸,得均一溶液b;在2000rpm的机械搅拌条件下,将溶液a加入溶液b得均一乳液c。将均一溶液c加入15℃的4.0%的聚乙烯醇连续水相中,使用1500bar的高压均质制备微球。然后升温至40℃使有机溶剂挥发,之后过滤微球,并且使用注射用水清洗微球7次,然后冷冻干燥,得到缓释微球。实施例13.微球工艺回收率的测定。分别取实施例1-12中冻干后得到的缓释微球,称重,然后计算工艺回收率,结果如表1所示。其中,工艺回收率=冻干后微球重量/投料量*100%表1项目工艺回收率/%实施例187.5实施例286.7实施例389.3实施例483.2实施例590.5实施例684.2实施例789.5实施例883.9实施例990.3实施例1087.6实施例1191.5实施例1287.7实施例14.缓释微球粒径分布测定。采用激光粒度测试仪测定释微球粒径分布。泵速度40%,测定时间90s,等待时间30s,pids设置为“开”,测定次数为1。测定时,取缓释微球适量,加入5-10滴1%的表面活性剂溶液,然后再加入1ml水,混匀。打开仪器,向样品池中加样,直至遮光度为8-12%,记录测定结果,平行测定3次,取平均值,结果如表2所示。其中d10表示小于该粒径的微球数量占总量的10%,d50表示中间粒径,即小于该粒径的微球占总量的50%,d90表示小于该粒径的微球数量占总量的90%。表2项目d10/μmd50/μmd90/μm实施例138.6470.21113.88实施例20.510.902.17实施例329.5374.07118.68实施例40.581.101.96实施例535.3481.05138.05实施例60.612.754.36实施例727.4660.57112.89实施例80.672.533.84实施例923.1740.3160.08实施例100.490.621.08实施例1165.89108.4145.79实施例123.584.154.87实施例15.雷沙吉兰含量测定。取缓释微球精密称定,加入乙腈分散微球,然后加入ph值为6.5的三乙氨-冰醋酸缓冲溶液-乙腈(52∶48)流动相溶解并定量至约100μg/ml的供试品。同法操作,配制对照品。使用hplc测定,结果如表3所示。含量为药物量占微球重的百分含量。含量=药物量/微球量*100表3实施例16.缓释微球释放特性。缓释微球的筛分:取实施例1冻干后部分缓释微球,分别用100、115、150、175、230、325、500目筛网筛分,得到不同目数微球,标记为实施例1-1至实施例1-6,如表4所示。用于考察在普通粒径范围内,即20-150μm范围内,不同粒径微球的释放行为差异。下表含义:例如实施例1-1表示将部分实施例1筛分后得到的100-115目的微球。表4项目目数实施例1-1100-115实施例1-2115-150实施例1-3150-175实施例1-4175-230实施例1-5230-325实施例1-6325-500分别取实施例1至实施例12制备的缓释微球以及由实施例1筛分成不同粒径的微球即实施例1-2、实施例1-4、实施例1-6进行体外释放。测试方法:精密称定微球(30mg),加入100ml的ph值为7.4的pbs作为释放介质,于37℃水浴摇床中进行释放实验。摇床转速100rpm,在固定的时间,取出样品静置,然后取上清液并过0.45μm微孔滤膜,同时补充新鲜的释放介质,使用hplc测定含量。每批次微球平行三份进行。释放数据如下表5、表6以及图1至图7所示。通过实施例1-1、实施例1-4、实施例1-6释放结果可知,在普通粒径范围内,即20-150μm粒径范围内,虽然不同粒径范围微球释放行为有差异,但是并不明显。通过实施例1、实施例3、实施例5、实施例7、实施例9、实施例11释放行为可知,在普通粒径范围内,即20-150μm之间,微球释放期较长,但出现了延迟释放期;通过实施例2、实施例4、实施例6、实施例8、实施例10、实施例12释放数据可知,在纳米至亚微米粒径范围内,即0.5-5微米之间,微球释放期较短,但无延迟释放期且无突释。而通过将纳米至亚微米粒径微球与普通粒径微球按照一定的比例混合,如实施例1释放周期为30天,延迟释放期为10天,而实施例2释放周期为10天,无延迟释放期。那么可以将实施例1与实施例2组合使用。刚好实施例2微球负责组合药物的前期释放,实施例1微球负责后期释放。若整个释放周期需要的药物剂量为3份,则实施例1提供两份,实施例2提供一份。具体的若整个释放周期需要的药物剂量为30mg,则实施例1需要提供20mg药物,即72.73mg微球(微球重量=所需药物量/含量);实施例2需要提供10mg药物,即37.17mg微球;以此类推三份实施例3与一份实施例4混合(释放周期5.7周左右)、三份实施例5与一份实施例6混合(释放周期8.6周左右)、两份实施例7与一份实施例8混合(释放周期12周左右)、五份实施例9与一份实施例8混合(释放周期6周左右)、三份实施例11与两份实施例12混合(释放周期7周左右),然后进行体外释放实验,即可以得到释放周期4-12周,且无突释和延迟释放期的药物组合物。混合的前提是纳米到亚微米微球的释放期能与普通粒径微球的延迟释放期刚好重叠。实施例2/4/6/8/10/12分别对应的是实施例1/3/5/7/9/11的纳米到亚微米粒径微球,两者混合可以达到较长释放期并无延迟释放期的目的。表5表6综上所述,本研究发现在微球常规粒径范围内,随着微球粒径的减小,微球释放周期以及延迟释放期确实会变短,但是变化均不明显。另外创造性的发现,将微球制备成亚微米级别,微球释放行为却发生了明显的改变,第一是无延迟释放期且无突释,第二是释放周期明显缩短。同时意外地发现本发明的亚微米级别微球的释放期与普通粒径微球的延迟释放期相同。通过将两种不同粒径的微球混合使用,不仅得到释放周期较长的产品,且无延迟释放期。且利用本技术方案可以得到高载药量和高包封率的微球,通过在本发明的药物组合物中使用2种不同粒径微球的适宜组合,可以显著减少血浆中雷沙吉兰浓度的波动,且无明显的延迟释放期。同时,本发明在载药量高的情况下,药物无突释。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1