达匹维林在制备治疗胶质母细胞瘤的药物中的应用的制作方法
本发明属于生物医药领域,涉及达匹维林在治疗胶质母细胞瘤的药物中的应用。
技术背景
胶质母细胞瘤(glioblastoma,gbm)是恶性程度最高的胶质瘤,属whoiv级,胶质母细胞瘤以手术、放疗、化疗及其他综合治疗为主,最重要的治疗手段为手术治疗(comprehensivegenomiccharacterizationdefineshumanglioblastomagenesandcorepathways.nature,2008.455(7216):p.1061-8)。药物治疗在恶性肿瘤的三大疗法中发展速度最快。替莫唑胺(temozolomide,tmz)是目前广泛用于临床的胶质瘤化疗药,尽管tmz治疗后,脑胶质瘤病人的生存期有了很大改变,但是同其他化疗药物一样,脑胶质瘤对tmz的耐药性严重限制了治疗效果而导致肿瘤的复发,这已成为严重影响化疗效果的主要因素(dehdashti,a.r.,etal.,newtrendsinthemedicalmanagementofglioblastomamultiforme:theroleoftemozolomidechemotherapy.neurosurgfocus,2006.20(4):p.e6)。因此,寻找新的用于术后控制胶质母细胞瘤药物势在必行。
根据2009年的统计,世界范围内大约有3300万人类免疫缺陷病毒(humanimmunodeficiencyvirus,hiv)感染者,其中有大约180万患者死于获得性人类免疫缺陷综合征(acquiredimmunedeficiencysyndrome,aids,艾滋病)(unaids[internet].geneva:globalreport:unaidsreportontheglobalaidsepidemic2010)。自1998年高效抗逆转录病毒疗法(highactiveanti-retroviraltherapy,harrt)被提出并推广后,艾滋病相关并发症的发生率及死亡率明显降低。harrt有效地降低了患者体内病毒载量,使艾滋病患者的平均寿命得到延长(palellafjjr,delaneykm,moormanac,etal.decliningmorbidityandmortalityamongpatientswithadvancedhumanimmunodeficiencyvirusinfection.hivoutpatientstudyinvestigators.nengljmed1998;338:853-60.)。然而与不断下降的艾滋病相关并发症的发生及死亡率相比,艾滋病非特异性肿瘤(non-aidsdefiningmalignancies,non-adms)的发生率仍然是逐年增长的,其中就包括胶质母细胞瘤(lohsen,hansenab,gerstoftj,obeln.improvedsurvivalinhiv-infectedpersons:consequencesandperspectives.jantimicrobchemother2007;60:461-3.)。大量流行病学调查显示,使用免疫抑制剂会增加颅内胶质瘤的发病率(salvatim,fratia,carolie,etal.glioblastomainkidneytransplantrecipients.reportoffivecases.jneurooncol2003;63:33-7,
对于艾滋病伴发恶性肿瘤的患者,联合应用抗肿瘤化疗及harrt已显示出有效性。maso等通过档案连锁研究分析hiv/aids患者(1986年到2005年)使用harrt后,癌症发生率的改变情况。研究表明,接受harrt的患者,中枢神经系统肿瘤的标准化发病比(standardizedincidenceratios,sir,from1986–1996and1997–2004)从3.5(95%ci:1.5–7.0)降至3.2(95%ci:1.4–6.3)(dalmasol,poleselj,serrainod,etal.patternofcancerriskinpersonswithaidsinitalyinthehaartera.brjcancer2009;100:840-7.)。shiels等对24例hiv/aids患者接受haart前后,脑肿瘤发生情况进行meta分析。分析结果表明,脑肿瘤的sir从1.9(95%ci:0.66-5.7)降至1.0(95%ci:0.63-1.7)(shielsms,colesr,kirkgd,poolec.ameta-analysisoftheincidenceofnon-aidscancersinhiv-infectedindividuals.jacquirimmunedeficsyndr2009;52:611-22.)。
目前对于艾滋病并发肿瘤的患者,其抗肿瘤化疗与之间潜在的药物相互作用了解不多,可用于安全指导和抗肿瘤化疗联合应用的研究数据非常有限,缺乏基于临床试验的普遍可行的详细指南,所以现在临床医生和临床研宄员只能从药物代谢的相关知识去推测药物间可能存在的相互作用,从而制定治疗方案(marudek,cflexneretal.useofantineoplasticagentsinpatientswithcancerwhohavehiv/aids.lancetoncol.2011;12:905-12)。如果抗hiv药物本身具有抗肿瘤细胞活性,一定程度上可以减轻药物合用(抗hiv药物与抗肿瘤化疗药物)带来的潜在不确定的相互作用。前人研究发现,蛋白酶抑制剂可能有潜在的抗胶质母细胞瘤活性。利托那韦,一种hiv蛋白酶抑制剂,能够阻断细胞内泛素化通路,同时阻滞胶质瘤细胞周期、诱导其凋亡,从而表现出抗胶质瘤活性(guptaak,cernigliagj,mickr,mckennawg,muschelrj.hivproteaseinhibitorsblockaktsignalingandradiosensitizetumorcellsbothinvitroandinvivo.cancerres2005;65:8256-65.)。laurent等在体外实验中发现,利托那韦对胶质瘤细胞有细胞毒性(laurentn,deboüards,guillamojs,etal.effectsoftheproteasomeinhibitorritonavirongliomagrowthinvitroandinvivo.molcancerther2004;3:129-36.)。蛋白酶抑制剂作为haart的特殊治疗效果已经得到肯定,能否将其用于抗胶质瘤,还有待进一步研究证实。
达匹维林(dapivirine,tmc120)是新一代的非核苷逆转录酶抑制剂(non-nucleosidereversetranscriptaseinhibitor,nnrtis),tmc120是这种化合物的别称代号,化学式写作c20h19n5,全称为4-{{4-[(2,4,6-三甲苯基)-氨基]-2-嘧啶}-氨基}-苯甲腈(4-{{4-[(2,4,6-trimethylphenyl)-amino]-2-pyrimidinyl}-amino}-benzonitrile)。目前,达匹维林主要作为阴道的杀微生物剂,被制成半固体凝胶、弹性硅胶两种剂型置于阴道环内(akil.a.,etal.,developmentandcharacterizationofavaginalfilmcontainingdapivirine,anon-nucleosidereversetranscriptaseinhibitor(nnrti),forpreventionofhiv-1sexualtransmission.drugdelivtranslres,2011.1(3):p.209-222.)。华盛顿大学全球卫生部国际临床研究中心baeten博士等,为此开展了一项随机、安慰剂对照、双盲、3期临床试验,旨在研究含达匹维林的阴道环对女性预防hiv-1感染的作用。结果发现,该暴露前预防方法可适度降低女性hiv感染风险以阴道环的形式在体外实验及间接体内疗法中均能有效地阻止hiv-1的感染(fletcher.p.,etal.inhibitionofhumanimmunodeficiencyvirustype1infectionbythecandidatemicrobicidedapivirine,anonnucleosidereversetranscriptaseinhibitor.antimicrobagentschemother,2009.53(2):p.487-95.)。
目前为止,尚未有相关文献证实达匹维林有抗胶质瘤活性。
技术实现要素:
本发明的目的是提供一种达匹维林的新应用,具体是:达匹维林在制备治疗胶质母细胞瘤的药物中的应用。
本发明采用的gbm细胞是人胶质母细胞瘤细胞株u87,体外细胞毒性实验结果表明,达匹维林对人胶质母细胞瘤细胞株u87的半抑制浓度ic50是10.73μmol/l。
本发明检测了达匹维林在体外对人胶质母细胞瘤细胞株u87的生长抑制作用,达匹维林的有效药物浓度是4μmol/l。
本发明检测了达匹维林对u87迁移侵袭能力的影响,达匹维林的有效药物浓度是4μmol/l。
本发明检测了达匹维林对u87细胞增殖、凋亡、自噬、上皮-间质转化相关蛋白表达的影响,达匹维林的有效药物浓度是8μmol/l。
在达匹维林调节u87细胞内信号通路的实验中,达匹维林的药物浓度是16μmol/l。
本发明还利用裸鼠体内移植瘤模型检测达匹维林体内抗肿瘤活性,所用达匹维林浓度为16mg/kg(溶解于含5%dmso的生理盐水中),每3天腹腔注射给药1次。
在sd大鼠药物毒性试验中,达匹维林组给药剂量为16mg/kg,腹腔注射给药,0、3d各给药1次,共2次,设3w恢复期。
通过上述实验,本发明首次证实了达匹维林具有体外抗胶质瘤细胞的效果;也首次证实了达匹维林具有体内抗胶质瘤细胞的效果,能够延缓肿瘤增长、介导肿瘤凋亡;同时首次证实了达匹维林能够诱导胶质母细胞瘤细胞产生应激反应,通过激活jnk通路和pi3k/akt通路,解除原本肿瘤细胞内凋亡的抑制状态,激活自噬通路,从而抑制胶质母细胞瘤细胞增殖,促进胶质母细胞瘤细胞迁移。
附图说明
图1显示cck-8试验检测达匹维林对gbm细胞u87的细胞毒作用。
图2显示cck-8试验检测达匹维林体外条件下对gbm细胞的增殖抑制作用。
图3显示transwell小室试验检测达匹维林体外条件下对gbm细胞的迁移促进作用。
图4显示westernblotting分析达匹维林作用于gbm细胞,细胞增殖、凋亡、自噬、上皮-间质转化相关蛋白表达变化情况。
图5显示流式细胞术检测达匹维林在体外对gbm细胞的凋亡诱导作用。
图6显示patnscanintracellularsignalingarraykit检测达匹维林体外条件下对gbm细胞内信号通路的影响。
图7显示裸鼠皮下成瘤试验检测达匹维林的体内抗肿瘤活性。
图8显示免疫组化ki67染色检测达匹维林体内条件下对gbm细胞的增殖抑制作用。
图9显示肿瘤组织切片tunel染色检测达匹维林体内条件下对gbm细胞的凋亡诱导作用。
图10显示体内毒性试验检测达匹维林有效抗肿瘤剂量下对肝、肾功能的影响。
具体实施方式
以下是本发明的实施例,但不以任何形式限制本发明。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
本发明进行了以下实验方法来验证达匹维林可以用于制备治疗胶质母细胞瘤药物:
(1)cck8法,检测达匹维林在体外对胶质母细胞瘤细胞株u87的细胞毒作用;
(2)transwell试验,检测达匹维林在体外影响肿瘤细胞迁移侵袭能力;
(3)westernblotting蛋白印迹法,检测达匹维林在体外对u87细胞增殖、凋亡、自噬、上皮-间质转化相关蛋白表达的影响;
(4)流式细胞术,检测达匹维林在体外诱导细胞凋亡情况;
(5)path
(6)裸鼠体内移植瘤模型,研究达匹维林的体内抗胶质母细胞瘤活性;
(7)大鼠毒性试验模型,研究达匹维林在抗肿瘤作用浓度下,生物体对其有无明显毒性反应。
1.检测达匹维林体外条件下对gbm细胞的细胞毒性作用
cck8试验用于检测dapivirine对u87细胞增殖的影响。将处于对数生长期的u87制成细胞悬液后接种于96孔板并培养24h.换为含dapivirine不同浓度(4、8、16、32、64μm)的培养液。以dmso作为阴性对照并每组设5个复孔。孵育48h后加入cck8溶液37℃孵育2h后全自动酶联免疫检测仪上避光振荡混匀并测各孔吸光值(od值),波长490nm,实验重复三次取平均值。采用数据分析软件spss20.0计算分析各组细胞生长抑制率(inhibitionrate,ir)和ic50,采用oneway-anova方法,各组分别与对照组比较采用dunnett检验;p<0.05具有统计学显著性差异。
细胞毒性试验结果显示,ir(%)随dapivirine浓度而增加(p<0.001),ic50计算得10.73μmol/l(图1)。
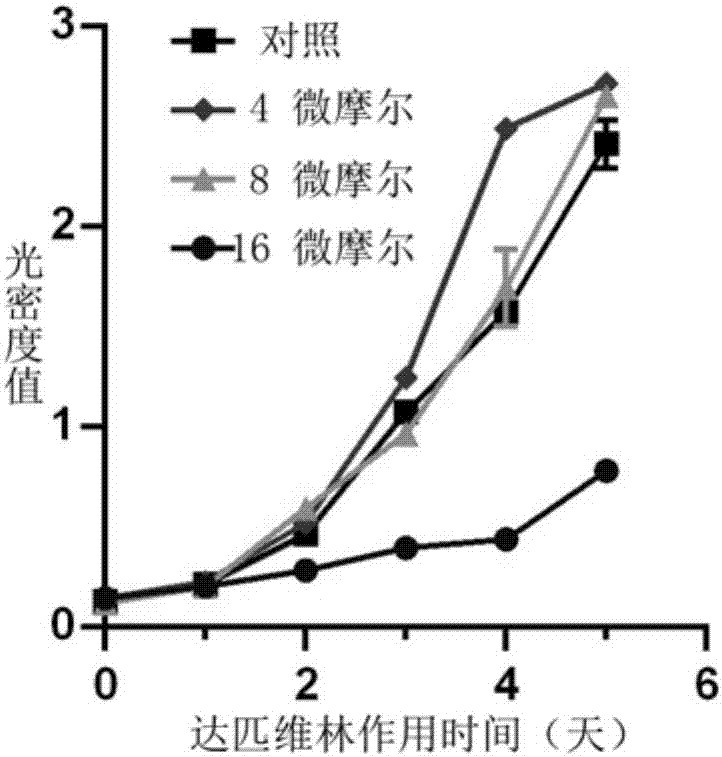
2.检测达匹维林体外条件下对gbm细胞活力的影响
cck8试验用于检测dapivirine对u87细胞增殖的影响。将处于对数生长期的u87制成细胞悬液后接种于96孔板并培养24h.换为含dapivirine不同浓度(4、8、16μmol/l)的培养液,以dmso作为阴性对照并每组设5个复孔,分别培养24,48,72,96,120小时后,加入cck8溶液37℃孵育2h后全自动酶联免疫检测仪上避光振荡混匀并测各孔吸光值(od值),波长490nm,实验重复三次取平均值。采用数据分析软件spss20.0计算分析各组细胞活力,采用oneway-anova方法,各组分别与对照组比较采用dunnett检验;p<0.05具有统计学显著性差异。
细胞活力试验结果如图2所示,16μmol/l浓度的达匹维林作用下,gbm细胞u87的增殖能力受到明显抑制。
3.检测达匹维林体外条件下对gbm细胞迁移的影响
transwell小室试验用于检测细胞迁移能力。在transwell小室(corning公司)的下室中加入含10%fbs的dmem培养基600ul。体外培养u87细胞,待细胞饥饿处理12h以后,加入含不同浓度达匹维林的无血清dmem培养基(药物终浓度分别为0、8、16μmol/l)制成105/ml单细胞悬液,每个上室加入200μl细胞悬液,37℃,5%co2,95%湿度培养箱中培养12h后取出小室,弃去小室内培养液,湿棉签擦去上面未穿过微孔的细胞,甲醇固定1h,pbs洗3遍后置于dapi中染色2min,再用pbs洗3遍后倒置显微镜下观察。随机取5个视野,计数每个视野内的穿过微孔的细胞数,以迁移细胞的相对数目来表示肿瘤细胞的侵袭能力,迁移抑制率(%)=(1-实验组侵袭细胞数/对照组侵袭细胞数)×100%。
结果如图3所示,8μmol/l和16μmol/l浓度的达匹维林作用下,gbm细胞的迁移能力有所增强。
4.检测达匹维林体外条件下对gbm细胞增殖、凋亡、自噬、上皮-间质转化相关蛋白表达的影响
4.1.蛋白样品的提取和制备:将u87细胞培养在25cm2培养瓶中,待细胞生长达60%左右,加入达匹维林终浓度为16μmol/l的dmem培养基(对照组为dmso),孵箱培养0h、12h、24h或48h后分别提取细胞总蛋白。用预冷的pbs轻轻清洗培养瓶2次,每次2ml。用吸引器小心吸出残留瓶中的液体,到吸干为止。每瓶加入150μl细胞裂解液,均匀摇晃,冰上裂解15min后,用细胞刮将细胞刮下,移液器将细胞悬液移入1.5ml离心管,再用1ml注射器对细胞悬液进行反复抽吸20次,利用剪切力切断大片段核酸。4℃,12000rpm离心30min,收集上清液,即为所需蛋白样品。预留10μl用于蛋白定量,其余样品立即冻存于-80℃保存或者加入1/4体积的5×上样缓冲液,沸水中煮5min,保存于-20℃。
4.2.蛋白定量:配制bca工作液使用bca试剂盒(solarbio公司),取适量a液和b液,按50:1的比例将a液和b液混合均匀。稀释标准品(5mg/ml)取20μl标准品,用pbs稀释至100μl,使终浓度为0.5mg/ml,按0、4、8、12、16、20μl分别加入8孔中(96孔板),并用pbs补足每孔至20μl。使每孔蛋白浓度为0、0.1、0.2、0.3、0.4、0.6、0.8、1mg/ml。将2μl提取的蛋白样品加入96孔板中,并加入18μlpbs。每孔加入200μlbca工作液,37℃放置30min。冷却至室温,用酶标仪测定a562吸光度,根据标准曲线计算样品蛋白浓度。
4.3.sds-page电泳与转膜:认真清洗玻璃板,避免残留胶粒,组装好玻璃板,用去离子水确定无渗漏。配制10%分离胶,混合均匀,将溶液平缓地注入两层玻璃板中,高度为距玻璃板上缘1.5cm左右,再在液面上小心注入1ml去离子水,静置20~30min后,待下层胶凝固,将上层液体侧倒出来。配制5%上层胶,混合均匀,以连续平稳的液流注入玻璃板中,随即小心插入成孔器,静置30min,待上层胶凝固完毕。配制电泳缓冲液,称取tris碱3.03g,甘氨酸14.4g,sds1.0g,去离子水定容至1000ml。组装电泳装置、上样、电泳上层胶采用80v,下层胶120v,待蓝色线条移动至玻璃板底端,电泳结束,关闭电源。
转膜:配制转移缓冲液称取tris碱3.03g,甘氨酸14.4g,去离子水定容至800ml溶解,加入甲醇200ml。
组装转膜夹子:将夹子在转移液中展开,向夹子黑面依次放置衬垫,双层滤纸,电泳完毕的凝胶,pvdf膜,双层滤纸,衬垫,小心合上夹子。将组装好的转膜夹子装入转移槽中,夹子黑面在转移槽黑面一侧,白面在转移槽红色一侧。将转移槽倒满转移液,并放入一个冰袋,连接导线,注意正负极,设定电流300ma,,120min。
4.4.免疫反应:配制tbst缓冲液先配制10×tbs500ml(tris碱12.1g;nacl40g;去离子水定容至500ml),取100ml10×tbs用去离子水稀释至1000ml,加入tween-201ml后混匀。根据marker标记剪取目的条带,并用圆珠笔作好标记。在摇床上,用tbst缓冲液洗去膜上残留的转膜液,80rpm,5min×3次,再用tbst配制的5%脱脂奶粉封闭条带1h,设定摇床60rpm。将tbst缓冲液配制的适当浓度的一抗缓冲液和条带置入封口的干净塑料袋子中,摇床60rpm,室温封闭1h后,平整放置于4℃冰箱中过夜。将条带取出,用tbst洗涤,摇床80rpm,5min×3次。再用tbst配制的二抗缓冲液室温封闭1h,摇床60rpm。
4.5显影、定影:已标记上不同蛋白的膜,用ecl发光液覆盖,反应后,于暗室内显影、定影。
结果如图4显示,n-cadherin,间质细胞的标志物之一,表达量随达匹维林作用时间增加而升高,如图4(a)。总caspase-3,细胞凋亡的重要调节蛋白,表达量随达匹维林作用时间增加而降低,同时caspase-3的降解产物,cleavedcaspase-3,表达量随达匹维林作用时间增加而升高,见图4(b)。自噬主要标志物之一的lc3a/b,westernblotting结果显示lc3a/b-ii与lc3a/b-i比值随达匹维林作用时间增加而升高。atg7以及beclin-1,同样作为自噬的标记物,表达量随达匹维林作用时间增加,呈现先升高后降低的表现,作用时间24h时表达量最高,如图4(c)所示。与细胞增殖相关的蛋白akt、p-akt、p-snk/jnk表达量随达匹维林作用时间增加而呈现先升高后降低的表现,akt与p-akt在作用时间24h时表达量最高,p-snk/jnk表达量随达匹维林作用时间增加而升高,结果如图4(d)所示。
5.检测达匹维林在体外诱导细胞凋亡情况
流式细胞仪检测达匹维林在体外诱导细胞凋亡情况:u87细胞在dmem培养基含体积分数为10%胎牛血清,100ku/l青霉素和100mg/l链霉素,37℃,5%co2饱和湿度培养箱中培养,0.25%胰酶消化传代,以2×105/孔接种6孔板,24h后细胞贴壁生长状态良好时开始实验操作。药物设计:设计药物浓度0、8、16μmol/l的达匹维林处理u87细胞,药物处理:弃细胞培养板中原有的培养基,按药物设计的浓度加入含药培养基处理细胞。将上述细胞板置于5%co237℃培养箱内,继续培养12h、24h、48h后停止培养。用不含的胰蛋白酶消化细胞,离心后细胞用pbs洗2次,再将细胞分别转移至流式管。将fitcannexinvapoptosisdetectionkit中的缓冲液用去离子水稀释成1×缓冲液,然后每个流式管中加入100μl的1×缓冲液混悬细胞。每个流式管中分别加入fitcannexinvapoptosisdetectionkit中的fitcannexinv和pi各5μl,避光,室温放置15min。每个流式管中再分别加入400μl的1×缓冲液,充分混匀后于1h内上样,流式细胞仪检测细胞凋亡情况。
结果如图5显示,在药物浓度为16μmol/l时,随着药物作用时间延长,达匹维林诱导u87细胞凋亡的程度增强;在达匹维林浓度为8μmol/l时,对u87细胞无明显凋亡诱导作用。6.检测达匹维林对gbm细胞内信号通路的影响
6.1.制备细胞裂解产物:使用patnscanintracellularsignalingarraykit试剂盒内的1x细胞裂解液,按1ml裂解液加10μlpmsf(100mm)(solarbio公司)或加入蛋白酶磷酸酶抑制剂混合物(solarbio公司)至终浓度为1mm,摇匀置于冰上。倒掉培养液,并将皿(直径10cm)倒扣在吸水纸上使吸水纸吸干培养液。每皿细胞加5ml4℃预冷的pbs(0.01mph7.2~7.3)。平放轻轻摇动1min洗涤细胞,然后弃去洗液。重复以上操作两次,共洗细胞三次以洗去培养液。将pbs弃净后把培养皿置于冰上。每皿细胞加500μl含pmsf的裂解液,于冰上裂解2min,为使细胞充分裂解培养皿要经常来回摇动。裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至1.5ml离心管中。(整个操作尽量在冰上进行。)4℃下12000rpm离心3min。(提前开离心机预冷)将离心后的上清分装转移倒0.5min的离心管中。bca法测蛋白浓度,并用arraydiluentbuffer将所有蛋白浓度调至0.2–1.0mg/ml。
6.2.使用pathscan试剂盒检测细胞蛋白:使用双蒸水将试剂盒内20x的缓冲洗涤液稀释至1x工作浓度。使用试剂盒内的抗体稀释液将20x的抗体混合物稀释成1x工作浓度。将试剂盒内20x的hrp-linkedstreptavidin稀释至1x工作浓度。将试剂盒内有硝酸纤维涂层的玻璃板、分隔栅栏和金属固定夹取出后组装起来,将硝酸纤维膜分隔成16个小格。保证硝酸纤维涂层面朝上。向每格内滴加100μl封闭液,置于摇床上,转速60rpm,室温封闭15min。吸去封闭液,向每格内滴加50-75μl细胞裂解液,置于摇床(60rpm)室温孵育2h。吸去细胞裂解液,每格内滴加100μl1x缓冲洗涤液,置于摇床(80rpm)洗涤5min×3次,吸去洗涤液。每格内加入75μl1x抗体混合物,置于摇床(60rpm)室温孵育1h。吸去抗体混合物,每格内滴加100μl1x缓冲洗涤液,置于摇床(80rpm)洗涤5min×4次,吸去洗涤液。每格内滴加75μl1xhrp-linkedstreptavidin,置于摇床(60rpm)室温孵育30min。吸去hrp-linkedstreptavidin,每格内滴加100μl1x缓冲洗涤液,置于摇床(80rpm)洗涤5min×4次,吸去洗涤液。拆下金属夹及分隔栅栏,将有硝酸纤维素涂层面的玻璃板用用ecl发光液覆盖,反应后,于暗室内显影、定影。
pathscan结果显示,达匹维林作用下,gbm细胞的akt(ser473),bad(ser112)和sapk/jnk(thr183/tyr185)的磷酸化水平较未作用组明显升高。
实施例2检测达匹维林的体内抗肿瘤活性
6.1.4到6周的雄性裸鼠在spf级动物实验室饲养一周,以适应环境。u87细胞在dmem培养基(含体积分数为10%胎牛血清,100ku/l青霉素和100mg/l链霉素),37℃,5%co2,饱和湿度培养箱中培养。接种裸鼠前,用0.25%胰酶消化传代,离心后用pbs吹打混匀,重复离心1次。然后用预冷的pbs吹打均勾细胞成混悬液,置于碎冰上冰浴,备用。将肿瘤细胞悬液接种到裸鼠的右侧背部皮下,每只裸鼠接种肿瘤细胞的个数约5×107,观察成瘤情况,如图7(a)。2周后可见裸鼠右侧背部形成直径0.3cm瘤块,开始给药。给药方案:对照组,含5%dmso的生理盐水,每3天给药1次;达匹维林浓度16mg/kg(溶解于含5%dmso的生理盐水中),每3天给药1次;2组裸鼠均釆用腹腔注射给药,实验全程监测裸鼠体重,见图7(b)。当对照组肿瘤最大者直径超过1cm后结束给药,处死裸鼠取出肿瘤组织,见图7(c)。累计给药4次。用游标卡尺测量肿瘤大小如图7(d),按照以下公式计算:v(体积)=l×w2/2,其中l是肿瘤纵轴的长度,w为肿瘤横轴的长度。切取大小适宜的肿瘤组织,用4%的多聚甲醛固定过夜。将固定组织用酒精进行梯度脱水,后石蜡包埋,制成石蜡块后将包埋肿瘤组织切成厚度5μm的石蜡切片,再用载玻片将石蜡切片捞起、烤片机上烘干。
6.2.he染色、免疫组化、tunel染色
he染色:切片脱蜡脱水:二甲苯、酒精(浓度由高到低),蒸馏水洗净,苏木素染色1min,自来水冲干净,盐酸分化1秒,自来水冲干净,伊红浸染1秒,酒精从低到高脱水,自然晾干,中性树脂封片,显微镜下镜检,如图8(a)。
免疫组化:切片置于二甲苯中脱蜡,梯度酒精洗去二甲苯。蒸馏水洗净,用枸橼酸钠抗原修复液行热抗原修复20min,自然冷却到室温,pbs漂洗5min,重复3次,用3%h2o2室温10min阻断内源性的过氧化物酶,pbs漂洗5min,重复3次,用正常的羊血清封闭非特异性的结合位点,pbs漂洗5min,重复3次,每片玻片滴加50pl稀释为工作液的一抗ki67室温孵育2小时,pbs漂洗5min,重复3次,加入辣根过氧化物标记的二抗,室温30min,pbs漂洗5遍,重复3次,然后滴加dab显色3~10min,显微镜下观察有无显色。苏木素复染,自来水冲干净,盐酸分化1s,自来水冲干净,50-60度水中返蓝,梯度酒精脱水,中性树胶封片,标记然后镜检,结果如图8(b)所示。
tunel染色:使用tunel试剂盒(roche细胞凋亡原位检测试剂盒,pod)。组织切片进行脱腊和水合处理,将组织切片浸入蛋白酶k工作液,21-37℃下反应15-30min。制备tunel反应混合液:滴加50μl酶溶液(管1)至余下的管2标记溶液中(约450μl),得到总体积500μl的tunel反应混合液。设置阴性对照样品:将经固定和通透处理的细胞与50μl/每孔的标记溶液一起孵育,标记溶液中无末端转移酶(非tunel反应混合液)。设置阳性对照样品:将经固定和通透处理的细胞与微球菌核酸酶或重组的dnasei,gradei(3000u/ml-3u/ml,溶于50mmph7.5的tris-hcl,含10mmmgcl2,1mg/mlbsa),15-25℃下处理10min,在标记反应前诱导dna链断裂。使用蛋白酶k预处理组织切片后,用pbs漂洗玻片2次。吸干样品周围的水分,滴加50μltunel反应混合液到样品(对于阴性对照样品,每个样品滴加50μl不含末端转移酶的标记溶液)。加盖,37℃下避光和加湿环境下反应60min。用pbs漂洗玻片3次。荧光显微镜下,加滴pbs,进行样品分析。采用450-500nm激发波长,在515-565nm(绿光)范围内进行荧光信号检测。吸干样品周围的水分,滴加50μlpod转换液(管3)到样品上,37℃加湿环境下反应30min。pbs漂洗玻片3次,滴加50-100μldab底物或者其他的pod底物,显微镜下观察有无显色。pbs漂洗玻片3次。苏木素复染,中性树胶封片镜检,结果如图9所示。
结果显示,达匹维林组he染色切片在显微镜下可见点状坏死灶被伊红着色,对照组的he染色切片在显微镜下未见肿瘤坏死灶;ki67免疫组化染为棕褐色的代表增殖活性强的肿瘤细胞,达匹维林组的ki67阳性率(9.93±1.53%)明显低于对照组(25.78±1.89%);tunel染色染为棕褐色的代表凋亡细胞,达匹维林组的凋亡细胞所占比率(4.00±0.83%)显著高于对照组(1.32%±0.30%)。结果证实,达匹维林能够介导肿瘤组织的细胞凋亡,抑制肿瘤组织增殖。
6.3.毒性试验:取14只6~7周龄sd大鼠,雌雄各半,随机分为2组,分别为达匹维林组和阴性对照组,腹腔注射给药,0、3d各给药1次,共2次,设3w恢复期。其中,达匹维林组每只给药剂量为16mg/kg,阴性对照组则每只给予1ml生理盐水。每次给药次日观察注射部位有无发红、肿胀、化脓、坏死等异常反应。检测指标:初次给药后约1w、恢复期第2w、第3w采血进行血清生化检验,血生化指标包括:肝功能(alt、ast)和肾功能(crea、urea)相关指标,结果如图10所示。
结果显示:临床症状观察结果显示各组动物在给药前后均未见任何异常症状。观察至第3w,全部动物无异常症状,无死亡。达匹维林组与对照组血清生化检验结果显示,给药前(第0d)两组大鼠4项血生化指标均无异常;初次给药后1w时,查alt、ast、urea均无异常,crea结果示达匹维林组高于阴性对照组;恢复期第2、3w复查血生化指标,达匹维林组与对照组4项指标均无异常。试验结果表明在给予大鼠抗肿瘤剂量的达匹维林时,该药物对于肝脏无明显毒性,对于肾脏可能有一过性损伤作用,但并无持久影响。
- 还没有人留言评论。精彩留言会获得点赞!