一种T1‑MRI成像引导下的光动治疗剂制备方法与流程
本发明涉及材料科学与生物医药技术领域,具体为一种t1-mri成像引导下的光动治疗剂制备方法。
背景技术:
目前,恶性肿瘤,也被称为癌症,已经成为威胁人类健康最大的疾病之一。越早发现肿瘤,就越有利于肿瘤的治疗。磁共振成像(mri)是目前临床诊断肿瘤最有力的检测手段之一,其拥有高分辨率、无电离辐射损伤及多参数、多序列成像等优点。为了达到更清晰,更精准的成像,临床上通常使用造影剂来提高成像部位的对比度,而得到病变更全面的信息。因此开发新颖的mri造影剂显得尤为重要。具有顺磁性的物质可用于mri信号增强剂,研究较多的是以钆,锰配合物为主的纵向弛豫造影剂(t1制剂)。肿瘤细胞由于拥有很高的代谢能力,生长旺盛,并且容易转移而威胁患者的生命。因此,开发诊断与治疗一体化的诊疗试剂对于肿瘤的治疗有着重要的研究意义。
光动治疗由于其创伤性小,低毒副作用,简单易行,可重复作用等特点而可作为肿瘤治疗最有前景的治疗方式之一。它是利用特定波长的光照将能量传递给敏化剂而使触动周围氧气产生大量的单基态的氧,使肿瘤细胞产生程序性凋亡。然而光动治疗存在的主要问题是氧气依耐性强、敏化剂达到肿瘤部位的剂量较低且治疗前后的监测难题而限制着其发展。
卟啉分子由于其独特的π电子且是高度共轭的体系而具有对医学光窗口(600-1000nm)光线的广谱吸收,同时可以触发周围氧气产生单基态氧,产生光动效应。利用t1-mri造影效果的金属离子与卟啉分子自组装制备金属有机框架结构的纳米粒子,其纳米粒子具有t1-mri造影及光动治疗的双功能。磺胺嘧啶是一种医学上使用较多的广普抗菌药,同时它可以靶向于肿瘤部位过度表达的碳酸酐酶,提供针对肿瘤靶向的能力,可通过抑制肿瘤部位过度表达的碳酸酐酶的活性,从而可改善肿瘤部位缺氧的状态,也可以提高光动治疗作用。材料的生物相容性是作为医用材料最重要的考虑因素之一,蛋白质是生命体的物质基础,可以充当优异的药物载体。
技术实现要素:
本发明的目的在于提供一种t1-mri成像引导下的光动治疗剂制备方法,将制备出蛋白质/磺胺嘧啶-有机金属框架结构的纳米复合材料作为一种t1-mri成像引导下的光动治疗的诊疗剂,对于肿瘤的有效治疗有深远的意义,以解决上述背景技术中提出的问题。
为实现上述目的,本发明提供如下技术方案:一种t1-mri成像引导下的光动治疗剂制备方法,包括以下步骤:
s1:制备钆(锰)-卟啉金属有机框架结构的纳米粒子;
s2:制备蛋白质/磺胺嘧啶复合物;
s3:制备牛血清蛋白/磺胺嘧啶-钆(锰)卟啉纳米复合材料;
s4:纳米复合材料在t1-mri成像引导下的光动效应即为光动治疗剂。
优选的,所述s1具体制备步骤如下:
s1.1:配制三价钆离子溶液(二价锰离子溶液):称取3.72mggdcl3·6h2o溶于10ml的有机溶剂(1mmol/l),备用;再称取1.98mgmncl2·4h2o溶于10ml的有机溶剂(1mmol/l),备用;
s1.2:配制卟啉溶液:称取7.90mg内消旋-四(4-羧基苯基)卟吩(tcpp,相对分子质量=790g/mol)卟啉溶于10ml的有机溶剂(1mmol/l),备用;
s1.3:分别取上述配制好的1mlgdcl3·6h2o或mncl2·4h2o,tcpp溶液于25ml的三口烧瓶中,加入10ml的有机溶剂,并加入0.4ml的醋酸,室温搅拌2h;
s1.4:将体系升温至80-120℃,反应24h,并冷却至室温;
s1.5:分别用反应溶剂乙醇、去离子水离心洗涤数次,将产品放在60℃的真空干燥箱干燥24h,即制备出nmofs纳米粒子。
优选的,所述s2具体制备步骤如下:
s2.1:配制牛血清蛋白溶液(1×10-5mol/l):称取66.43mg(相对分子质量=66.430kda)的牛血清蛋白,溶于100ml去离子水,备用;
s2.2:配制磺胺嘧啶溶液(2×10-4mol/l):称取磺胺嘧啶钠5.44mg(相对分子质量=272g/mol),溶于100ml去离子水,备用;
s2.3:取3ml已配制好的牛血清蛋白溶液于0.8ml磺胺溶液共混,磁力搅拌12h,即得蛋白质/磺胺嘧啶复合物备用。
优选的,所述s3具体制备步骤如下:
s3.1:称取s1中所制备好的钆(锰)卟啉金属有机框架结构纳米粒子10mg分散于10ml去离子水中,用400w超声仪反复超声2h,至纳米粒子均匀的分散在水溶液中;
s3.2:加入(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/n-羟基琥珀酰亚胺)edc/nhs对s1中的nmofs溶液进行活化处理;
s3.3:将s2中制备的蛋白质/磺胺嘧啶复合物溶液缓慢地滴加到s3.2中已活化处理的钆(锰)卟啉纳米粒子,在室温下反复超声12h;
s3.4:反应完成后,用去离子水离心洗涤数次,弃其上清液;
s3.5:最后的产品分散在水溶液中备用,即得蛋白质/磺胺嘧啶-钆(锰)卟啉金属有机框架结构的纳米复合材料溶液。
优选的,所述s3.2中对nmofs溶液进行活化处理的具体方法为:在溶液中加入1ml的4mg/mledc溶液,室温下磁力搅拌15min后,加入1ml的3mg/mlnhs溶液,室温下磁力搅拌2h,待反应完成后,用去离子水离心洗涤两次后备用。
优选的,所述的三价钆盐为六水合氯化钆、硫酸钆或九水合硝酸钆中的一种;其二价锰盐为四水合氯化锰、四水合硝酸锰、四水合硝酸锰碳酸锰中的一种;其卟啉衍生物为原卟啉、内消旋-四(4-羧基苯基)卟吩中的一种;所述的三价钆盐与卟啉衍生物的摩尔比为1-2:1。
优选的,所述的有机溶剂为n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dmac)、甲醇中的一种或几种。
优选的,所述s3中的牛血清蛋白与磺胺嘧啶与钆卟啉质量比为30-40:1:180-190。
与现有技术相比,本发明的有益效果是:
1、本t1-mri成像引导下的光动治疗剂制备方法,采用简单的方法制备一种t1-mri成像引导下的光动治疗剂,原材料成本低廉且反应条件温和,便于大批量生产。
2、本t1-mri成像引导下的光动治疗剂制备方法,制备的一种t1-mri成像引导下的光动治疗剂,具备t1-mri成像功能,便于肿瘤的筛查,可以用于治疗前后的肿瘤观察,同时具备光动效应而可治疗于肿瘤,拥有治疗与诊断肿瘤的功能,还可以作为用于肿瘤的新颖诊疗试剂。
3、本t1-mri成像引导下的光动治疗剂制备方法,制备的一种t1-mri成像引导下的光动治疗剂其生物相容性较好,细胞毒性低,可以作为潜在的生物医用材料。
4、本t1-mri成像引导下的光动治疗剂制备方法,制备的一种t1-mri成像引导下的光动治疗剂,具有针对肿瘤部位的靶向性,可以减少治疗试剂的剂量,降低对正常组织的毒副作用,也能更好的发挥其治疗作用。
附图说明
图1为本发明蛋白质与磺胺嘧啶相互作用的荧光淬灭研究谱图;
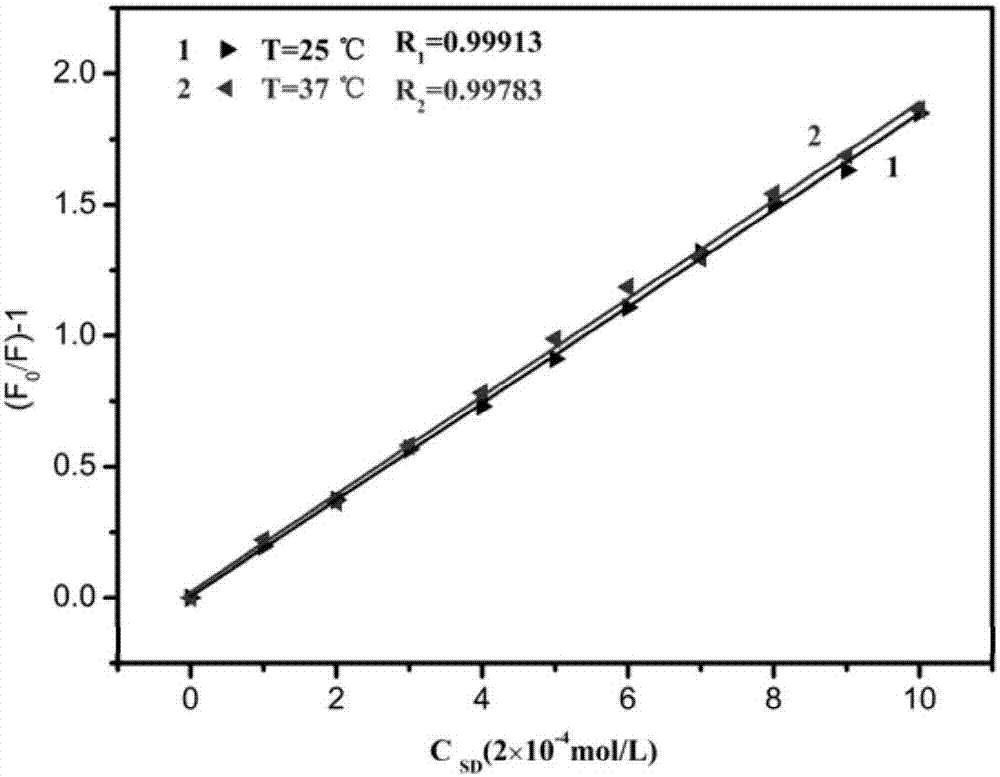
图2为本发明蛋白质与磺胺嘧啶相互作用,在不同温度下的荧光淬灭常数图;
图3为本发明复合材料的紫外可见光吸收光谱;
图4为本发明蛋白质/磺胺嘧啶-金属有机框架结构的纳米复合材料的细胞毒性及光动治疗效果图;
图5为本发明随着样品浓度增加,图像越来越亮的体外t1-mri成像图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例中:一种t1-mri成像引导下的光动治疗剂制备方法,包括以下步骤:
第一步:制备钆(锰)-卟啉金属有机框架结构的纳米粒子;具体制备方法如下:
(1)配制三价钆离子溶液(二价锰离子溶液),其三价钆盐为六水合氯化钆、硫酸钆或九水合硝酸钆中的一种;其二价锰盐为四水合氯化锰、四水合硝酸锰、四水合硝酸锰碳酸锰中的一种;具体为称取3.72mggdcl3·6h2o溶于10ml的有机溶剂(1mmol/l),备用;再称取1.98mgmncl2·4h2o溶于10ml的有机溶剂(1mmol/l),备用,其有机溶剂为n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dmac)、甲醇中的一种或几种;
(2)配制卟啉溶液:称取7.90mg内消旋-四(4-羧基苯基)卟吩(tcpp,相对分子质量=790g/mol)卟啉溶于上述10ml的有机溶剂(1mmol/l),备用;其卟啉衍生物为原卟啉、内消旋-四(4-羧基苯基)卟吩中的一种;
(3)分别取上述配制好的1mlgdcl3·6h2o或mncl2·4h2o,tcpp溶液于25ml的三口烧瓶中,加入10ml的有机溶剂,并加入0.4ml的醋酸,室温搅拌2h;其三价钆盐与卟啉衍生物的摩尔比为1-2:1;
(4)将体系升温至80-120℃,反应24h,并冷却至室温;
(5)分别用反应溶剂乙醇、去离子水离心洗涤数次,将产品放在60℃的真空干燥箱干燥24h,即制备出nmofs纳米粒子。
第二步:制备蛋白质/磺胺嘧啶复合物;具体制备方法如下:
(1)配制牛血清蛋白溶液(1×10-5mol/l):称取66.43mg(相对分子质量=66.430kda)的牛血清蛋白,溶于100ml去离子水,备用;
(2)配制磺胺嘧啶溶液(2×10-4mol/l):称取磺胺嘧啶钠5.44mg(相对分子质量=272g/mol),溶于100ml去离子水,备用;
(3)取3ml已配制好的牛血清蛋白溶液于0.8ml磺胺溶液共混,磁力搅拌12h,即得蛋白质/磺胺嘧啶复合物备用。
第三步:制备牛血清蛋白/磺胺嘧啶-钆(锰)卟啉纳米复合材料;具体制备方法如下:
(1)称取步骤一中所制备好的钆(锰)卟啉金属有机框架结构纳米粒子10mg分散于10ml去离子水中,用400w超声仪反复超声2h,至纳米粒子均匀的分散在水溶液中;
(2)加入(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/n-羟基琥珀酰亚胺)edc/nhs对s1中的nmofs溶液进行活化处理;具体方法为:在溶液中加入1ml的4mg/mledc溶液,室温下磁力搅拌15min后,加入1ml的3mg/mlnhs溶液,室温下磁力搅拌2h,待反应完成后,用去离子水离心洗涤两次后备用;
(3)将步骤二中制备的蛋白质/磺胺嘧啶复合物溶液缓慢地滴加到上述已活化处理的钆(锰)卟啉纳米粒子,在室温下反复超声12h;其牛血清蛋白与磺胺嘧啶与钆卟啉质量比为30-40:1:180-190;
(4)反应完成后,用去离子水离心洗涤数次,弃其上清液;
(5)最后的产品分散在水溶液中备用,即得蛋白质/磺胺嘧啶-钆(锰)卟啉金属有机框架结构的纳米复合材料溶液;
第四步:纳米复合材料在t1-mri成像引导下的光动效应即为光动治疗剂。
综上所述:本t1-mri成像引导下的光动治疗剂制备方法,蛋白质/磺胺嘧啶-钆(锰)卟啉金属有机框架结构纳米复合材料粒径均一,结构稳定,合成条件简单,生物相容性良好,具有t1-mri成像引导下的光动效应,属于材料和生物医药的交叉领域,具有潜在的应用价值。
请参阅图1,蛋白质的荧光淬灭研究可知,蛋白质与磺胺嘧啶分子可以很好的相互作用。
请参阅图2,不同温度下蛋白质荧光淬灭常数研究,证明牛血清蛋白与磺胺嘧啶可能是发生的是静态、动态淬灭,以动态淬灭为主,即相互作用主要以分子亲疏水作用。
请参阅图3,紫外可见光吸收光谱可知,蛋白质/磺胺嘧啶钆(锰)卟啉金属有机框架结构复合材料具有对紫外/可见光/近红外光广普的吸收,也为医学光学窗口触发复合材料产生光动效力提供了可能。
请参阅图5,体外t1-mri成像,随着样品浓度增加,图像越来越亮。
具体实施例:蛋白质/磺胺嘧啶钆(锰)卟啉金属有机框架结构复合材料的性能测试:
实施例一:
细胞毒性测试:将所制备的纳米复合材料与4t1细胞共培养24h后,用mtt法检测细胞的相对存活率,可以发现复合材料有很好的生物相容性,在实验的最大浓度下,细胞的相对存活率依然能达到80%以上。
实施例二:
体外光动治疗:将所制备的纳米复合材料与4t1细胞共培养24h后,用660nm激光在60mw/cm2功率下照射10min,放在细胞培养箱培养8h后,用mtt法检测细胞的相对存活率,结果表明所制备的纳米复合材料对肿瘤细胞有很好的光动治疗作用。
实施例三:
体外t1-mri成像测试:用1.5ml离心管装入所制的纳米复合材料的水溶液,并按一定的复合材料的浓度配制样品,以清水作为对照组,将样品放在3t的医用mri,得到了不同对比度的图像,证明其纳米复合材料具有t1-mri成像功能,且成像能力与复合材料的浓度成正比。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!