一类环状内酯类化合物在制备用于预防和/或治疗亨廷顿病的药物中的用途的制作方法
本发明涉及生物医药领域,具体而言,涉及一类环状内酯类化合物,其药学上可接受的盐、溶剂合物、立体异构体、或互变异构体,在制备作为孤儿g蛋白偶联受体gpr52的拮抗剂的药物中的用途,或者在制备用于预防和/或治疗亨廷顿病的药物中的用途。
背景技术:
神经退行性疾病(neurodegenerativedisorders)是指中枢神经元不正常死亡丧失引起神经系统功能障碍,从而导致的疾病。多见于中老年人,严重影响人类健康及生活质量,并造成巨大的社会负担。随着中国老龄化的趋势,神经退行性疾病研究的重要性也与日俱增。然而迄今为止,国内外都只有减轻症状的手段,而没有可以减缓疾病发展进程的根本性治疗方法。其中,亨廷顿病(huntington’sdisease,hd)是一种重要的单基因遗传的神经退行性疾病,全球范围内男女均有发病,总体发病率约万分之一,在是此类疾病中的重要的一种。
亨廷顿病是一种明确的单基因遗传病,由人类四号染色体所含基因htt(曾被命名为it15)的exon1外显子的cag重复区域的变异引起。变异基因cag重复数目增多(大于等于36),导致合成的变异蛋白的谷氨酰胺重复区域(polyq)扩增。变异蛋白会被剪断、聚集、产生毒性,最终导致主要集中在纹状体(striatum)的神经元死亡,并引起以肢体运动能力异常为特征的一系列神经功能、心理、以及代谢相关症状。
虽然变异htt蛋白导致神经元死亡的机制尚不清楚,直接降低变异htt蛋白水平可以对疾病相关的表型起到显著的延缓发病以及治疗效果,但目前难于实现。在动物及细胞模型中,尽管可以通过表达shrna的反转录病毒、反义寡聚核苷酸(aso)等生物制剂降低变异htt蛋白水平,但是在临床治疗上,这样的手段因为药物抵达及安全性的原因,对神经疾病有着很大的局限性。因此,如果能发现可以降低变异htt蛋白水平的基因及相关信号通路,并在此基础上开发调控其的小分子,将对hd的治疗产生极大的意义。
技术实现要素:
本发明人致力于研究变异htt蛋白的调控。通过遗传学筛选,发明人发现,孤儿g蛋白偶联受体gpr52对变异htt蛋白水平有显著的负向调控作用。通过高通量化合物筛选,发明人发现一类具有环状内酯类结构的化合物具有gpr52拮抗作用,并在多个亨廷顿病模型中可有效降低变异htt水平,并对显著改善疾病相关表型。
因此,本发明的一个目的是提供一种孤儿g蛋白偶联受体gpr52的拮抗剂,同时提供其在制备用于预防和/或治疗亨廷顿病的药物中的用途。
本发明提供了如下通式i所示的环状内酯类化合物,其药学上可接受的盐、溶剂合物、立体异构体、或互变异构体,在制备作为孤儿g蛋白偶联受体gpr52的拮抗剂的药物中用途,或者在制备用于预防和/或治疗亨廷顿病的药物中的用途。
其中:
m为0-9的整数,n为0-9的整数,且m+n<10,
r1选自h,-oh,c1~c3烷基,或-ocor,r为c1~c3烷基,取代或未取代的c2~c4烯基,所述取代是指被选自如下的一种或多种取代基所取代:羟基,羟基c1~c3烷基,c1~c3烷基,-ch2ocor’,r’为被选自羟基、羟基c1~c3烷基中的一种或多种取代的c2~c4烯基;
r2为h,-oh,c1~c3烷基,-cho,-ococh3,-och3,-cooh,-ch2oh,或-(ch3)ch(ch2)iococh3,i为0~3的整数;
r3为h,c1~c3烷基,-cho,-ococh3,-ch2coch3,-ch2ococh(ch3)2,-ococh2-五至八元内酯环;
或者,r2和r3形成未取代或被c2~c4烯基取代的五至八元内酯环;
r4为h,c1~c3烷基,-ch2oh,-oh,或-ch2ococh(ch3)2;
优选地,所述环状内酯类化合物选自以下化合物:
更优选地,本发明所述环状内酯类化合物为(z)-(3ar,4s,12ar,e)-11-methyl-3-methylene-2,7-dioxo-3,3a,4,5,7,9,10,12a-octahydro-2h-6,9-(metheno)furo[2,3-f][1]oxacycloundecin-4-yl2-methylbut-2-enoate(e7)。
本发明的另一个目的是提供一种药物组合物,其包含治疗有效量的通式(ι)所示的环状内酯类化合物或其药学上可接受的盐、溶剂合物、立体异构体、互变异构体,和药学上可接受的载体。
本发明涉及以通式(ι)所示的环状内酯类化合物或其药学上可接受的盐、溶剂合物、立体异构体、互变异构体、前药中的一种或多种的混合物为有效成分制备的预防和/或治疗亨廷顿病的药物。
所述药物可通过注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织;或是被其它物质混合或包裹导入机体。
需要的时候,在上述药物中还可以加入一种或多种药学上可接受的载体。所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。
利用通式(ι)所示的环状内酯类化合物或其药学上可接受的盐、酯、溶剂合物、立体异构体、互变异构体、前药作为活性成分,单独或组合使用或与其它药物、辅料等配制成各种剂型,包括不限于片剂、散剂、丸剂、注射剂、胶囊剂、膜剂、栓剂、膏剂、冲剂等多种形式。上述各种剂型的药物均可以按照药学领域的常规方法制备。
附图说明
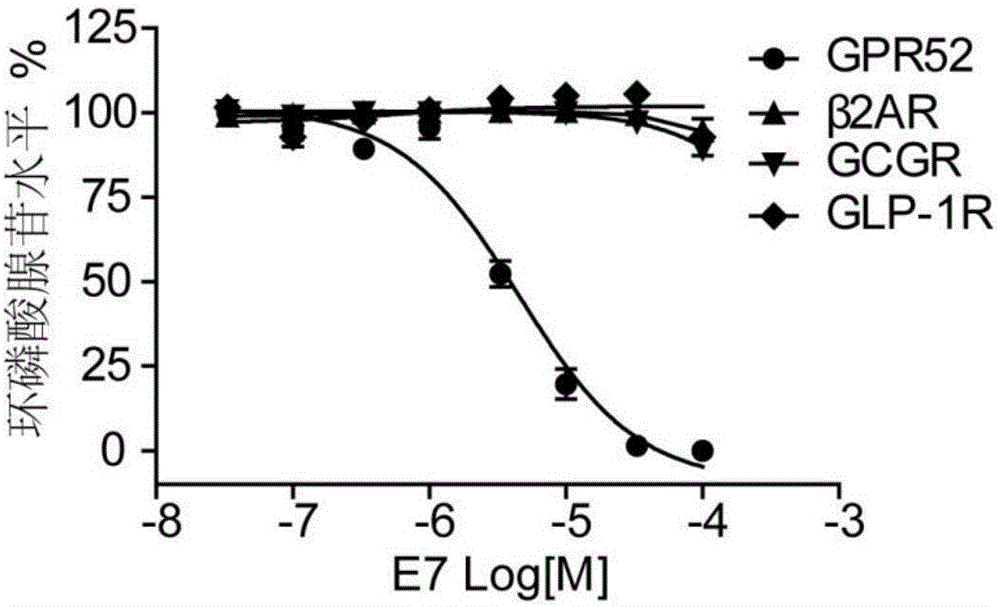
图1为显示化合物e7选择性抑制gpr52的图。e7剂量依赖性的抑制gpr52活性,但对β2ar、gcgr、glp-1r等三个受体无抑制活性。数据来自三次独立实验,每次实验三复孔,表示为平均值±标准误差(mean±sem)。
图2为显示gpr52的拮抗剂对亨廷顿模型中变异htt蛋白水平的作用柱状图。其中:
图2a为显示亨廷顿病病人诱导干细胞分化神经元中e7降低变异htt蛋白水平的图。通过htrf(均相时间分辨荧光技术)测定htt蛋白(亨廷顿蛋白)水平,通过总蛋白浓度控制相同的上样量。生物学重复数如图所示,表示为平均值±标准误差(mean±sem)。统计学分析为one-wayanova和dunnett’sposthoc检测。
图2b为显示亨廷顿病果蝇头部中e7降低变异htt蛋白水平的图。图2b与图2a类似,只是样品为食物给药的亨廷顿病果蝇头部,食物中的药物浓度如图中x轴所示。
图2c为显示亨廷顿病基因敲入小鼠的纹状体组织中e7降低变异htt蛋白水平的图。图2c与图2a类似,只是样品为侧脑室给药亨廷顿病基因敲入小鼠模型的纹状体组织及皮层组织。由于e7的药靶gpr52主要表达于纹状体,因此e7对皮层中的变异htt蛋白水平无明显作用。
图3为显示gpr52的拮抗剂对亨廷顿模型中疾病相关表型的作用的图。
图3a为显示亨廷顿病病人诱导干细胞分化神经元中e7降低无bdnf(脑源性神经营养因子)培养条件下hd神经元凋亡的图。利用nucview488染料显示capase-3的活性,用dapi(4',6-二脒基-2-苯基吲哚)所示细胞核的数目修正不同样品不同视野间细胞数的不同,用以计算每个细胞平均的caspase-3活性信号总强度。生物学重复数如图所示,表示为平均值±标准误差(mean±sem)。统计学分析为one-wayanova和dunnett’sposthoc检测。
图3b为显示亨廷顿病病人诱导干细胞分化神经元中e7降低无bdnf培养条件下hd神经元结构萎缩的图。利用tuj1染色显示神经元形态,用dapi所示细胞核的数目修正不同样品不同视野间细胞数的不同,用以计算每个细胞平均tuj1信号所占面积。其他与a类似。
图3c为显示亨廷顿病基因敲入小鼠的爬笔筒实验中运动功能被e7拯救的图。小鼠基因型及只数如图所示,表示为平均值±标准误差(mean±sem)。统计学分析为双尾t检验。
图3d为显示亨廷顿病基因敲入小鼠的旷场检测中运动功能被e7拯救的图。小鼠基因型及只数如图所示,表示为平均值±标准误差(mean±sem)。统计学分析为双尾t检验。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和生物材料,如无特殊说明,均可从商业途径获得。
实施例1:用于gpr52功能检测的细胞系构建
实验涉及的用于gpr52功能检测的各种稳定表达受体和gα16的细胞系均由实验室内部构建。具体步骤如下:hek293经胰酶消化后,离心,加入200μl电转液(atp200g/l,mgcl2·6h2o120g/l,kh2po412g/l,nahco31.2g/l),以100-200万细胞/200μl电转液的浓度加入表达gpr52受体质粒和表达gα16质粒各2μg,混匀,用scientz-2c基因导入仪(宁波新芝生物科技有限公司)进行电击。电击后的细胞转入培养板或培养皿中继续培养细胞,24小时后即可以用于钙流实验进行检测。培养皿中的细胞24小时后加入抗生素进行筛选,并挑选阳性克隆细胞,建立单克隆细胞系,即稳定表达gpr52的hek293细胞系。
实验涉及的用于变异htt蛋白水平检测的细胞模型包括纹状体细胞系sthdh、病人诱导干细胞(ips)分化的纹状体神经元、原代培养的纹状体细胞。细胞系sthdh来自于coriell疾病中心。病人诱导干细胞分化的神经元由病人的诱导干细胞通过已发表的多步分化流程分化得到。原代培养的纹状体细胞由新生鼠(p0)大脑解剖后所得的纹状体区域进过消化及打散培养得到。
实施例2:环状内酯类化合物对gpr52的阻断作用
将稳定表达gpr52的hek293细胞株用胰酶消化后离心,用不含血清的dmem培养液重悬,加入3-异丁基-1-甲基黄嘌呤(ibmx)(sigma,stbc7632v)(终浓度为0.5mmol/l),按2×103个细胞/孔/5μl细胞密度接种至384孔板;然后加入含有100μm的本发明的环状内酯类化合物的5μl无血清dmem培养液,混合均匀,室温孵育30min;再用相应配体wo-459(按照专利ep2518054a1方法制备)(100nm)刺激30min,然后按照试剂说明书分别加入稀释好的底物5μlcamp-d2和5μlanti-camp-cryptate(cisbio,62am4pej),室温避光反应1h;最后在envision2101多功能微孔板酶标仪读数,检测细胞内camp浓度。
表1:部分化合物对gpr52受体介导的camp反应的抑制作用
a化合物在100μm时对gpr52介导的camp反应抑制率;
“+++”代表抑制率大于等于70%,“++”代表抑制率大于40%小于70%,“+”代表抑制率小于等于40%。
实施例3:化合物e7对gpr52的阻断作用及受体选择性分析
将稳定表达各种g蛋白偶联受体(包括gpr52,β2ar,gcgr和glp-1r)的hek293细胞株用胰酶消化后离心,分别用不含血清培液重悬,加入ibmx(终浓度为0.5mmol/l),按2×103个细胞/孔/5μl细胞密度接种至384孔板;然后加入含有不同浓度e7的5μl无血清培液,混合均匀,室温孵育30min;再用相应配体(wo-459(100nm),isoproterenol(异丙(去甲)肾上腺素)(sigma,i6504)(100nm),glucagon(胰高血糖素)(sigma,g2044)(0.3nm),glp-1(sigma,g9416)(1nm))作为激动剂进行刺激30min,最后分别加入稀释好的5μlcamp-d2和5μlanti-camp-cryptate,离心混合均匀,室温避光反应1h;最后在envision2101多功能微孔板酶标仪读数,检测细胞内camp浓度。如图1及表2所示,e7可以剂量依赖性地抑制gpr52的活性,而对其他受体,如β2ar,gcgr和glp-1r等,均无抑制活性。
表2:e7的受体选择性
a数据来自三次独立实验,每次实验三复孔,表示为平均值±标准误差,ic50为半数抑制浓度,最高抑制率为100μme7对受体抑制活性。
实施例4:亨廷顿病病人诱导干细胞分化的纹状体神经元中变异htt蛋白水平的分析
将亨廷顿病病人诱导干细胞分化的纹状体神经元用1x(1倍原管浓度)的accutase细胞消化液消化后离心,用完全培液重悬,按5×104个细胞/孔/150μl细胞密度接种至gelatin(明胶)包被的96孔板,在37℃,5%co2培养箱内培育一周,然后加入含有不同浓度e7的5μl无血清培液,混合均匀,室温孵育48小时。之后用pbs清洗后,在每孔中50μl加入含1%triton+2x(2x表示2倍推荐浓度;推荐浓度是每个药片稀释至10ml)蛋白酶抑制剂(购买自roche,货号04693159001)+变异htt检测的htrf抗体对(供体抗体2b7,浓度23ng/ml,受体抗体3b5h10,浓度1400ng/ml)的htrfassaybuffer,在4℃避光反应过夜。最后,将每孔反应混合物按10μl转移至384孔板,在envision2104多孔能微孔板酶标仪读数,检测细胞内htt蛋白水平。如图2a所示,e7可以降低变异htt水平。
实施例5:亨廷顿病果蝇模型头部中变异htt蛋白水平的分析
通过elav-gal4处女蝇和uas-httq128_fl或uas-httq72_exon1雄果蝇的杂交,我们获得了表达人类变异htt全长蛋白或n端毒性片段的亨廷顿病果蝇。将果蝇的低熔点海藻糖混合的食物加热至35℃融化,将e7加入以获得不同的最终浓度,分装于各管。每管中随机加入15只刚破茧的亨廷顿病果蝇喂养,每天换食,但保持e7浓度不变,连续喂养6天。第7天,取果蝇头部用1x(1倍标准浓度)pbs+1%(vol/vol)tritonx-100+1x(1倍推荐浓度)蛋白酶抑制剂(购买自roche,货号04693159001)裂解,并测量总蛋白浓度。稀释到相同浓度(0.1μg/μl)后,取0.5μg总蛋白,加入4μl包含htt检测的htrf抗体对的htrfassaybuffer,进行变异htt水平的测量。如图2b所示,e7可以降低果蝇头部的变异htt水平。
实施例6:亨廷顿病基因敲入小鼠纹状体组织中变异htt蛋白水平的分析
对8.5个月龄的q140基因敲入纯合小鼠(menalled,l.b.,sison,j.d.,dragatsis,i.,zeitlin,s.,andchesselet,m.f.(2003).timecourseofearlymotorandneuropathologicalanomaliesinaknock-inmousemodelofhuntington'sdiseasewith140cagrepeats.jcompneurol465,11-26.)进行侧脑室给药,随机数确定实验小鼠分组。小鼠分为两组,dmso对照组和e7给药组。e7给药组每次注射溶解有e7的含25%dmso的人工脑脊液2μl(e7的浓度为2.5mm);dmso对照组每次给于等量的含25%dmso的人工脑脊液2μl。每天一次,持续9天。第10天取小鼠脑组织,共得到四种待测样品:dmso对照组纹状体样品striata-dmso,dmso对照组皮层样品cortices-dmso,e7给药组纹状体样品striata-e7,e7给药组皮层样品cortices-e7。用e7加入小鼠脑组织裂解液(50mmtris,250mmnacl,5mmedta,1%tritonx-100,ph=7.4,加蛋白酶抑制剂(roche,货号04693159001),用组织研磨仪60hz研磨破碎,冰上裂解1h,20000g4℃离心15min,取上清,bca测量总蛋白浓度。稀释到相同浓度后,取0.5μg总蛋白,加入4μl包含变异htt检测的htrf抗体对的htrfassaybuffer,测量mhtt水平。如图2c所示,e7可以降低小鼠纹状体组织中变异htt水平。
图2a,b中,对各组进行单向方差分析及事后比较检验,n.s.表示与dmso对照组无显著差异(p值>0.05),*表示与dmso对照组有显著差异且0.01≤p值<0.05,**示与dmso对照组有显著差异且0.001≤p值<0.01,****示与dmso对照组有显著差异且p值<0.0001。
图2c中,对每条横线下方的两组做双尾非配对学生式t检验,n.s.表示所比较两组间无显著差异(p值>0.05),**表示所比较两组间无显著差异且0.001≤p值<0.01。
实施例7:亨廷顿病病人诱导干细胞分化神经元中亨廷顿病相关神经萎缩凋亡表型的分析
将亨廷顿病病人诱导干细胞分化的纹状体神经元用1xaccutase消化后离心,用完全培液重悬,按5×104个细胞/孔/150μl细胞密度接种至gelatin包被的96孔板,在37℃,5%co2培养箱内培育一周,然后加入含有3.75μme7或溶剂(dmso)的5μl无血清培液,混合均匀,室温孵育24小时。之后,更换为不含bdnf的神经元培养液继续培养48小时,e7的浓度保持不变。之后,加入caspase-3活性检测染料(nucview488),检测凋亡信号。平行样品用多聚甲醛固定后,利用tuj1染色进行免疫荧光分析。如图3a所示,e7可以降低此条件下神经元的凋亡信号。如图3b所示,e7可以降低此条件下神经元的萎缩(即每个细胞tuj1所占的平均面积)。
图3a-b中wt表示野生型诱导干细胞分化神经元,hd表示亨廷顿病人诱导干细胞分化神经元。其中e7表示加入终浓度为3.75μm的e7(含0.0375%dmso),dmso表示加入0.0375%dmso,htt_si表示转染靶向htt基因的sirna。图3a中定量统计了凋亡信号caspase-3活性,图3b中定量统计了每个细胞神经元标志物tuj1所占面积,用以表征神经元萎缩情况。对各组进行单向方差分析及事后比较检验,****表示与dmso对照组有显著差异且p值<0.0001。
实施例8:亨廷顿病小鼠模型中亨廷顿病相关行为学表型的分析
wt(hdhq7/q7)表示野生型小鼠,hd(hdhq140/q140)表示亨廷顿病小鼠。每种基因型随机分为两组(e7组和dmso组),分别用e7及dmso进行侧脑室给药,给药后进行行为学测试。e7给药组每次注射溶解有e72μl的含25%dmso的人工脑脊液2μl(e7的浓度为2.5mm);dmso对照组每次给予等量含25%dmso的人工脑脊液2μl,所有行为学实验均是在小鼠日夜节律的白天进行,行为学房间隔音良好,温度湿度稳定可控,灯光照度可控(昏暗的红光),随机数确定实验小鼠分组,进行盲测。抓取小鼠轻柔,使小鼠精神放松。主要进行旷场实验及爬笔筒实验。旷场实验:将适应环境后的小鼠放入30x30x40cm白色箱体(med-associates),小鼠自由探索15min,仪器记录运动轨迹并拍摄视频。实验结束后分析运动距离和轨迹分布情况。爬笔筒实验:将适应环境后的小鼠放入一个金属笔筒中(高98mmx直径91mm),记录小鼠站立的次数(至少两字爪子举起)。实验结束后统计分析5分钟内出现的站立次数。如图3c-d所示,e7可以改善hd小鼠的运动功能障碍表型。结果用双尾非配对学生式t检验,n.s.表示所比较两组间无显著差异(p值>0.05),*表示所比较两组间有显著差异且0.01≤p值<0.05,**表示所比较两组间无显著差异且0.001≤p值<0.01。
- 还没有人留言评论。精彩留言会获得点赞!