桦树花粉用于制备药物中的应用的制作方法
本发明涉及医学制药
技术领域:
,具体涉及桦树花粉用于制备药物的用途。
背景技术:
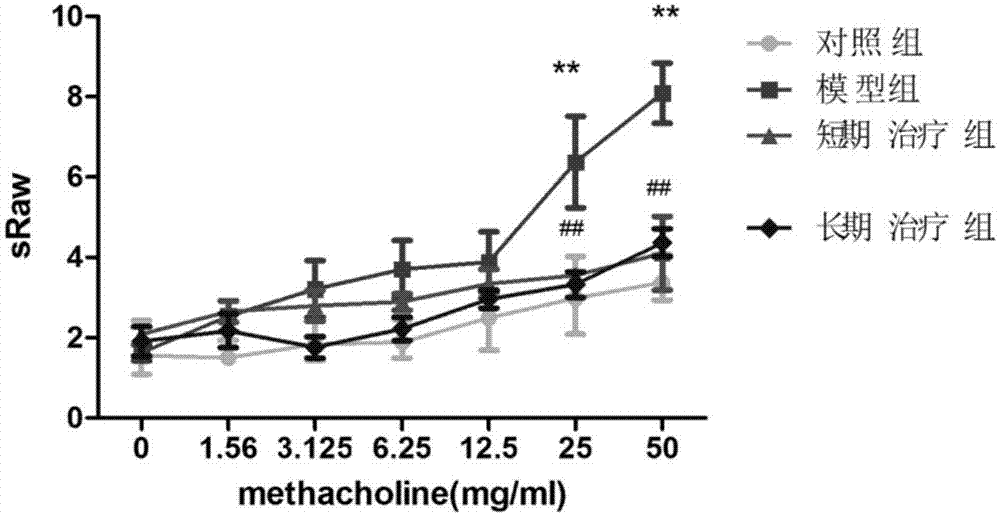
:过敏性哮喘是由吸入变应原引起的复杂的多因素作用的疾病,多种遗传因素、生物介质、环境因素等共同参与了哮喘的发生发展过程。桦树花粉是重要的致敏原,是春季花粉症的重要病因之一。在欧洲,70%的桦树过敏患者会合并有花粉相关的食物过敏。目前除了对症治疗外,尚没有能长期有效控制过敏性哮喘症状,及减少患者吸入激素的用量。目前研究发现,cd4+cd25+foxp3+调节性t细胞与产生il-17的th17细胞的比例失调和功能缺陷,在过敏性哮喘的发生、发展中有重要作用,涉及多种细胞因子和信号通路,已成为目前研究的热点。多数研究认为,过敏性症状的缓解与th2细胞因子减少,th1/th2左偏移密切相关。treg细胞和th17细胞是机体免疫系统中不可或缺的调节细胞,相互拮抗,共同维持机体内环境的平衡。th17细胞受转录因子rorc家族调控,分泌il-17,包括(il-17a~f)6种亚型,主要通过激活促炎因子,引起炎症的发生。treg细胞是体内重要的负调控细胞,生成受转录调控因子foxp3的调控,分泌il-10和tgfβ,主要通过抑制炎性介质及炎性趋化因子的分泌,抑制炎症的发生。还有研究认为,igg4的产生能与ige相互拮抗,抑制ige交联,从而防止肥大细胞脱颗粒。但是对于桦树花粉过敏出现的哮喘症状的机制并不明确,免疫应答的改变也不明确。如何明确我国桦树花粉过敏出现的哮喘症状的机制,及其免疫应答的改变,对临床上过敏性哮喘的治疗有重大意义。技术实现要素:本发明的目的在于提供桦树花粉一种新的用途,用于制备治疗桦树花粉引起过敏等导致的哮喘等一系列疾病的药物。为实现上述目的,本发明采用以下的技术方案为:桦树花粉用于制备治疗桦树花粉过敏药物中的应用。本发明研究发现桦树花粉可采用中国白桦花粉溶于pbs溶液中可用于治疗桦树花粉过敏的症状。白桦花粉能应用于防治与过敏性花粉相关疾病的保健食品、药品等领域。当用于治疗过敏性花粉相关疾病时,所述中国白桦花粉溶于pbs溶液和佐剂中用于针剂使用。进一步的,针对18-20g的小鼠,治疗时,白桦花粉用量为300μg。一种构建桦树花粉过敏的哮喘小鼠模型的方法,包括以下步骤:(1).分别于第1天、第8天和第15天对每只小鼠麻醉后,颈后皮下注射100μl的白桦花粉溶液和100μl氢氧化铝溶液的作为模型组;同时采用注射100μlpbs和100μl氢氧化铝溶液的作为对照组;(2).第22-24天,将所述步骤(1)后的小鼠进行雾化吸入的白桦花粉,连续3天,每天30分钟;(3).第25天,对步骤(2)后的小鼠,测定小鼠的肺功能比气道阻力sraw值,所述比气道阻力sraw值为气道阻力与胸腔气量的乘积胸腔内气体容积值,当乙酰胆碱浓度大于等于25mg/ml时,测得模型组的比气道阻力sraw值高于对照组时,哮喘模型小鼠构建成功。如上所述的方法,优选地,在所述步骤(1)中,所述白桦树花粉溶液中白桦树花粉的浓度为0.25μg/μl,溶液为pbs。如上所述的方法,优选地,在所述步骤(1)中,所述麻醉采用异氟烷。如上所述的方法,优选地,在所述步骤(2)中,所述白桦花粉浓度为1%。本发明通过先构建的桦树花粉过敏的哮喘小鼠模型,通过系统地对肺功能,肺病理,支气管肺泡灌洗液细胞因子量,sige含量等进行综合评定,该模型的建立能更好的贴近临床现象。通过采用白桦花粉对构建的哮喘小鼠模型的治疗获得如下结果:(1)研究发现模型组肺功能比气道阻力sraw值较对照组明显升高,特别是在乙酰胆碱浓度为25mg/ml和50mg/ml时(p<0.01),证明小鼠哮喘模型建立成功。经白桦花粉治疗后,治疗组sraw值较模型组降低,特别是在乙酰胆碱浓独为25mg/ml和50mg/ml时(p<0.01),证明治疗改善了小鼠的气道高反应性。(2)模型组炎症细胞总数,中性粒细胞数,淋巴细胞数,单个核细胞数,嗜酸性粒细胞数数量相比于对照组都明显升高(p<0.01);说明模型组小鼠的气道发生了严重的炎症反应,且炎症细胞的浸润以eos为主,eos%也明显增高(p<0.01),说明建模成功。经过白桦花粉治疗后,治疗组炎症细胞总数,中性粒细胞数,淋巴细胞数,嗜酸性粒细胞数数量相比于模型组都明显降低(p<0.01),eos%也明显下降(p<0.01),说明脱敏治疗有效的抑制小鼠气道炎症,减少细胞浸润。嗜碱性粒细胞数量在各组中均没有明显区别。(3)研究发现模型组小鼠的总ige和桦树花粉sige的表达量均显著高于对照组小鼠(p<0.01),证明本实验建模成功,可以诱导小鼠产生大量ige。经过白桦花粉治疗后,治疗组总ige和桦树花粉sige的表达量相对于模型组明显降低(p<=0.01,证明脱敏治疗成功抑制了ige的产生。(4)肺组织he染色发现模型组小鼠肺部气管和周围血管有大量炎性细胞浸润,形成多层细胞环,同时伴有气道增厚和水肿。对照组未见特殊异常。经特异性免疫治疗后,小鼠肺部气管和周围血管炎症细胞浸润和水肿明显缓解;肺组织ab-pas染色发现:模型组气道壁广泛被染成蓝紫色,气道内也可以看到弥散的蓝紫色,说明产生大量的粘液物质;气道上皮中增生的杯状细胞占气道上皮细胞总数>75%。对照组未见明显异常,气道上皮中增生的杯状细胞占气道上皮细胞总数<25%。治疗组气道壁部分被染成蓝紫色,气道上皮中增生的杯状细胞占气道上皮细胞总数<50%。(5)模型组小鼠脾脏th17的转录因子rorc的表达量(1.23±0.29)较对照组(0.86±0.33)显著升高p<0.05,证明哮喘能激发th17型免疫应答。经治疗后,治疗组th17的转录因子rorc的表达量(0.58±0.17)明显降低p<0.01,有统计学意义,证明白桦花粉治疗能有效缓解th17型免疫应答。模型组小鼠脾脏treg的转录因子foxp3的表达量(1.83±1.18)与对照组(1.53±0.59)无明显区别,经白桦花粉治疗后,治疗组treg的转录因子foxp3的表达量(2.95±1.11)升高,说明脱敏治疗激发了treg型免疫应答。但无统计学意义。模型组小鼠脾脏rorc/foxp3(0.9±0.5)较对照组(0.66±0.33)升高,但没有统计学差异。经特异性免疫治疗后,治疗组rorc/foxp3(0.29±0.33)降低p<0.01,有统计学意义,证明白桦花粉治疗能抑制th17/treg免疫应答左偏移。(6)模型组小鼠脾脏th17百分比(0.3688±0.15905)较对照组(0.1786±0.8576)显著升高p<0.01,证明哮喘能激发th17型免疫应答。经特白桦花粉治疗后,治疗组th17(0.2074±0.21658)降低p<0.05,有统计学意义,证明白桦花粉治疗能有效缓解th17型免疫应答。模型组小鼠脾脏treg百分比(16.3250±1.07271)与对照组(17.1±2.27031)无明显区别,经白桦花粉治疗后,治疗组treg百分比(11.5167±0.80208)明显降低p<0.01,证明白桦花粉治疗进一步抑制treg型免疫应答。模型组小鼠脾脏th17/treg(0.0239±0.00948)较对照组(0.0098±0.00413)显著升高p<0.01,证明哮喘能激发th17/treg免疫应答左偏移。经白桦花粉治疗后,治疗组th17/treg(0.0123±0.01306)降低p<0.01,有统计学意义,证明白桦花粉治疗能抑制th17/treg免疫应答左偏移。(7)激发安全性监测:激发后,每10min检测一次小鼠核心体温,持续三次。小鼠体温恒定在37℃左右,未出现低体温症状。即激发过程中未发生严重过敏反应,且激发浓度安全。每次特异性免疫治疗后30min,通过小鼠直肠进行核心体温检测。小鼠体温恒定在37℃左右,未出现低体温症状。确定脱敏过程中未发生严重过敏反应,且治疗浓度安全。综合上述研究,可将白桦花粉单独或与其它辅料复配制成保健食品、药品,用于花粉过敏相关疾病的防治。花粉过敏性的治疗一直是医学上难以克服的难题,许多患有花粉性过敏症状的人,只能通过尽量少出门,少接触花粉来避免过敏性症状的发生,但是本发明的研究结果为花粉过敏性患者能够摆脱花粉过敏原的治疗带来希望。本发明的优点在于:确定了采用白桦花粉可用于治疗花粉过敏性疾病。并采用白桦花粉构建了桦树花粉过敏的哮喘小鼠模型,为后续用于治疗哮喘等疾病提供实验供体。附图说明图1为白桦花粉变应原国家参考品的sds-page电泳图。图2为小鼠气道高反应检测结果。图3为支气管肺泡灌洗液中细胞分类计数结果。图4为组织病理学he染色结果图,其中,a为对照组,b为模型组,c为短期治疗组,d为长期治疗组c。图5为肺组织ab-pas染色结果图,其中,a为对照组,b为模型组,c为短期治疗组,d为长期治疗组图6为组织病理炎症评分结果。图7为黏液评分结果。图8为rna电泳图。图9为realtimepcr检测小鼠脾脏中目的基因表达量。图10为脾脏rorc/foxp3比值结果。图11为血清中桦树特异性抗体(总ige、sige、sigg1、sigg2a)检测结果。图12为支气管肺泡灌洗液中各细胞因子检测结果。图13为血清中细胞因子检测结果。图14为脾脏t细胞亚群检测的结果。图15为脾脏th17/treg比值结果。图16为本发明实施例4中的气道反应性测定检测结果。图17为本发明实施例4中的支气管肺泡灌洗液细胞计数结果。具体实施方式以下实施例用于进一步说明本发明,但不应理解为对本发明的限制。在不背离本发明精神和实质的前提下,对本发明所作的修饰或者替换,均属于本发明的范畴。实施例1标准化白桦花粉变应原国家参考品鉴定1.桦树花粉蛋白浓度测定采用bradford法测定蛋白浓度,用ddh2o溶解牛血清蛋白bsa至1mg/ml,充分混匀后,依次稀释成0.5mg/ml、0.4mg/ml、0.3mg/ml、0.2mg/ml、0.1mg/ml。在96孔板中加入上述5种bsa蛋白浓度标准以及适当稀释后的桦树标准品,10μl/孔,每种蛋白溶液均作复孔。每孔中加入200μl1:4稀释的染色剂考马斯亮蓝,振荡混匀,酶标仪读取吸光度值a595nm。重复三次检测,去除误差。所用的桦树花粉为白桦花粉变应原国家参考品(北京新华联公司,批号201605c008),最后检测桦树花粉标准品的蛋白浓度为0.274mg/ml。2、主要致敏蛋白betv1含量测定使用indoorbiotechnologies公司的betv1elisakit(4b10/2e10)检测标准化白桦花粉中betv1浓度,betv1elisakit的货号:el-bv1,实验步骤按照说明书。结果是使用1mlddh2o复溶标准化白桦花粉变应原国家参考品(北京新华联公司,批号201605c008)。其主要致敏蛋白betv1浓度0.055609mg/ml。通过检测白桦花粉参考品蛋白浓度,主要致敏蛋白betv1含量,可以标准化致敏、激发和治疗过程中白桦花粉变应原的用量。3、白桦花粉蛋白sds-page分析1).上样:使用ddh2o复溶标准化白桦花粉变应原国家参考品(北京新华联公司,批号201605c008)。加nμpageldssamplebμffer(4*),nμpageredμcingreagent(10*),70℃加热3-5分钟,以充分变性蛋白。把蛋白样品直接上样到sds-page胶加样孔内即可,每孔上样10μl。每块胶预留一个加样孔加入蛋白marker(8μl),以便于观察电泳效果和转膜效果,以及判断蛋白分子量大小。2).电泳:电压设置为200v,35min;通常电泳时溴酚蓝到达胶的底端处附近即可停止电泳,或者可以根据预染marker(蛋白质分子量标准)的电泳情况,预计目的蛋白已经被适当分离后即可停止电泳。电泳时间约35min。设置定时可以避免经常发生的电泳过头。3).染色:染色以观察变应原电泳情况。从电泳装置卸下两块玻璃板,将胶平铺于盛有100ml染色液的培养皿中,通风橱内水平摇床平摇过夜。4).脱色:回收染色液,将凝胶置于脱色液中平摇脱色,期间更换脱色液直至蛋白条带清晰(4h)。照相扫描。结果如图1所示。白桦花粉参考品水溶蛋白条带主要集中在10~130kda之间。sds-page分析显示白桦花粉变应原蛋白成分稳定。综上,标准化白桦花粉变应原国家参考品性质稳定,符合构建标准化桦树花粉过敏的哮喘小鼠模型要求。实施例2使用白桦花粉构建桦树花粉过敏的哮喘小鼠模型一、实验方法将balb/c小鼠随机分成对照组、模型组,每组10只,小鼠体重是18-20g,由北京维通利华实验动物技术有限公司提供,北京协和医院动物房饲养,饲养环境符合spf级实验动物环境设施标准。1.对照组(pbsgroup)1).致敏:分别于第1天、第8天和第15天对每只小鼠异氟烷麻醉后,颈后皮下注射含有按体积比为1:1加入的pbs和佐剂(氢氧化铝佐剂,可采用imjectalumthermo公司试剂)的混合液,总计200μl。2).激发:第22-24天,雾化吸入pbs,连续3天,每天30min;2.模型组(birchpollengroup)1).致敏:分别于第1天、第8天和第15天对每只小鼠异氟烷麻醉后,颈后皮下注射总共200μl含有100μl的0.25μg/μl白桦花粉溶液,(白桦花粉用pbs溶解)和100μl佐剂的混合液,其中佐剂为氢氧化铝佐剂,可采用imjectalumthermo公司试剂2).激发:第22-24天,雾化吸入1%的白桦花粉溶液,连续3天,每天30min。二、模型建立评价方法及结果1.气道反应性测定本次试验小鼠的肺功能检测使用dsi公司的无创肺功能仪器nam(non-invasiveairwaymechanics)进行,主要评价指标是比气道阻力sraw值,为气道阻力与胸腔气量的乘积。按照仪器使用说明进行操作:小鼠末次激发后的24h,将小鼠放入校正好并开通雾化功能的密闭肺功能测定腔内,让其适应环境5分钟后,分别给予pbs,1.56mg/ml,3.125mg/ml,6.25mg/ml,12.5mg/ml,25mg/ml,50mg/ml的乙酰甲胆碱雾化,每次给予100μl,持续30秒,每一个浓度的雾化结束后,记录3分钟内的sraw值。恢复1min后进行下一个浓度的测定。结果表明,模型组sraw值较对照组明显升高,特别是在乙酰胆碱浓度为25mg/ml和50mg/ml时(p<0.01),证明小鼠哮喘模型建立成功。2.标本留取血清标本1).肺功能检测后2h,将老鼠置于饭盒内,待其安静后,采用割尾法收集血液于1.5mlep管中。2).肺功能测定后第二天,用1%戊巴比妥腹腔注射麻醉小鼠,待疼痛反射消失后,固定小鼠于解剖台上。采用眼球摘取取血法,收集血液于1.5mlep管中。3).血清4℃过夜后,4000rpm,4℃离心10min,吸取清亮上清于新的ep管中,-80℃冻存备用。3.支气管肺泡灌洗液收集和细胞计数1).肺功能测定后第二天,用1%戊巴比妥腹腔注射麻醉小鼠,待疼痛反射消失后,固定小鼠于解剖台上。颈前部正中行1cm纵行切口,钝性分离暴露气管。会厌软骨下行一长约1.5ram“t”形切口。将注射器20号针头(磨平针尖)制作的气管插管从横形切口处先垂直然后倾斜插入气管,并缝线结扎固定。2).分别用0.5ml,0.8ml,0.8ml冰浴的pbs行支气管肺泡灌洗,灌洗3次。注入后停留30s、回抽,回收液体量>80%为合格。将回收的支气管肺泡灌洗液(balf)置于2mlep管中。3).进行4000rpm4℃离心10min;离心后取上清装入新的的ep管,-80℃冻存备用。(4).细胞沉淀加入1mlpbs重悬;并放入300目过滤网袋,用200μl枪头吹打,使细胞慢慢渗出过滤网,去除杂质。送至北京协和医院检验科,用西门子公司的全自动血液分析仪(advia2120)做白细胞分类计数。5).收集剩余标本,进行4000rpm4℃离心10min,弃上清;细胞沉淀加入1ml4%多聚甲醛重悬,进行瑞氏染色。结果表明:模型组炎症细胞总数,中性粒细胞数,淋巴细胞数,单个核细胞数,嗜酸性粒细胞数数量相比于对照组都明显升高(p<0.01);说明模型组小鼠的气道发生了严重的炎症反应,且炎症细胞的浸润以eos为主,eos%也明显增高(p<0.01),说明建模成功。4.肺脏组织1).抽取balf后,沿胸骨正中线剪开胸腔,暴露心肺;2).使用10mlpbs进行右心室穿刺,充分冲洗肺组织,直至肺脏颜色变白,分离肺脏。3).将肺脏分为2分,一部分置于冻存管中,-80℃;另一部分至于4%多聚甲醛溶液中,常温固定24h,留做病理检查。结果说明,肺组织he染色发现模型组小鼠肺部气管和周围血管有大量炎性细胞浸润,形成多层细胞环,同时伴有气道增厚和水肿。对照组未见特殊异常。5.脾脏分离暴露小鼠腹腔,摘取脾脏置于冰上,将其一分为二,一部分置于10%fbs的1640培养基中,留做流式细胞试验;另一部分置于冻存管内-80℃冻存,留做qpcr。做了th17和treg检测,21样品是三组小鼠的脾脏总rna图,每组7只鼠做该检测,结果如图8所示rna电泳图,lane1-21对应21个样本,m:dnamarker:dm2000;从下往上依次为100、250、500、750、1000和2000bp、其中750bp为亮带。其中检测所用试剂、仪器及操作方法如下:(1)实验试剂trnzol总rna提取试剂为天根生化科技(北京)有限公司dp405-02,primescripttmrtreagentkitwithgdnaeraser为takara(宝生物)rr047b,premixextaqtmii(tlirnasehplus),roxplus为takara(宝生物)rr82lr,dl2,000dnamarker为takara(宝生物)3427q。(2)实验器材涡旋振荡仪ql-902为海门市其林贝尔仪器制造有限公司,离心机centrifuge5415d,凝胶成像系统tanon1600为上海天能科技有限公司,荧光定量pcr仪abi7500为appliedbiosystems。(3)引物设计(以下引物均在北京invitrogen公司合成)(4)提取小鼠脾脏总rna(trnzol法:实验步骤按照说明书进行)1).把脾脏放入已预冷的研钵中进行研磨,待组织样本成粉末状后;2).加入trizol,室温保存5分钟;3).加氯仿0.2ml,用力振荡离心管,充分混匀,室温下放置5分钟-10分钟;4).12000rpm高速离心15分钟后吸取上层水相(吸70%)到另一新离心管管中,(注意不要吸到两层水相之间的蛋白物质)移入新管,加入等体积的-20℃预冷异丙醇,充分颠倒混匀,置于冰上10分钟;5).12000rpm高速离15分钟后小心弃掉上清液;按比例加入75%depc乙醇洗漆沉淀(4℃保存),洗漆沉淀物,振荡混合,4℃下12000rpm高速离心5分钟;6).弃去乙醇液体,室温下放置5分钟以充分晾干沉淀,加入depc处理过的水溶解沉淀;(5)rna质量检测紫外吸收测定法检测浓度和纯度使用nd-2000测定rna浓度和纯度,测量前先用溶解rna用的depc水调零,操作方法如下:1).滴加1μldepc水或者rna样品至测量基座的表面;2).液滴会自动在上下基座之间形成液柱并自动完成测定,rna浓度及质量的各种参数将在电脑中自动生成文件;3).一次测定完成后,用柔软的擦镜纸擦去上下基座表面上的样本液,便可进行下一个样品的测量。a浓度测定:260nm处读值为1表示40ngrna/μl。样品rna浓度计算公式为:a260×40ng/μl。具体计算如下:rna溶于20μldepc水中,取1μl用于测定,测得a260=65.003:rna浓度=65.003×40ng/μl=2600.12ng/μl取1ul用来测量以后,剩余样品rna为19μl剩余rna总量为:19μl×2600.12ng/μl=49.4μgb纯度测定:rna溶液的a260/a280的比值是一种rna纯度检测方法,比值范围1.8到2.1。变性琼脂糖凝胶电泳a、制胶:1g琼脂糖溶于72ml水中,冷却至60℃,10ml的10×mops电泳缓冲液和18ml的37%甲醛溶液(12.3m);10×mops电泳缓冲液:终浓度成分:0.2mmops,ph7.0;0.02m乙酸钠;0.01medta。灌制凝胶板,预留加样孔至少可以加入25μl溶液。胶凝后取下梳子,将凝胶板放入电泳槽内,加足量的1×mops电泳缓冲液至覆盖胶面几个毫米。b、准备rna样品取1μgrna,加1倍体积的甲醛上样染液,加eb于甲醛上样染液中至终浓度为10μg/ml;加热至70℃孵育5分钟使样品变性。c、电泳上样于胶孔中,5-6v/cm电压下电泳至溴酚兰指示剂进胶至少2-3cm。d、紫外透射光下观察并拍照28s和18s核糖体rna的带非常亮而浓(其大小决定于用于抽提rna的物种类型),上面一条带的密度大约是下面一条带的2倍。还有可能观察到一个更小稍微扩散的带,它由低分子量的rna(trna和5s核糖体rna)组成。在18s和28s核糖体带之间一般可以看到一片弥散的eb染色物质,可能是由mrna和其它异型rna组成。rna制备过程中如果出现dna污染,将会在28s核糖体rna带的上面出现,即更高分子量的弥散迁移物质或者带。rna的降解表现为核糖体rna带的弥散。(6)逆转录合成cdna采用primescripttmrtreagentkitwithgdnaeraser进行cdna反转录,实验操作按产品说明书进行,具体操作如下:1).去除基因组dna反应按如下成分于冰上配制反应混合液,为了保证反应液配制的准确性,进行各项反应时,应先按反应数+2的量配制mastermix,然后再分装到每个反应管中,最后加入rna样品。试剂使用量5×gdnaeraserbuffer2.0μlgdnaeraser1.0μltotalrna1μgrnasefreeh2oupto10μl42℃孵育2分钟2).反转录反应为了保证反应液配制的准确性,进行各项反应时,应先按反应数+2的量配制mastermix,然后再分装10μl到每个反应管中。轻柔混匀后立即进行反转录反应。37℃孵育15分钟,85℃5秒,cdna保存放-20℃冰箱备用(7)realtimepcr样本检测a操作过程如下:1).将所有cdna样品分别配置realtimepcr反应体系。体系配置如下:2×mastermix10μl10μm的pcr特异引物f0.5μl10μm的pcr特异引物r0.5μl加水至总体积为18μl轻弹管底将溶液混合,5000rpm短暂离心2).加样a.将18μl混合液加到96-pcr板对应的每个孔中;b.再加入对应的2μlcdna;c.小心粘上sealingfilm封口膜,短暂离心混合溶液;d.在设置pcr程序前将准备好的pcr板放在冰上。3).将上述96-pcr板置于realtimepcr仪上进行pcr反应。按以下程序进行:95℃,30秒;40个pcr循环(95℃,5秒;60℃,40秒(收集荧光))。为了建立pcr产物的熔解曲线,扩增反应结束后,按(95℃,10秒;60℃,60秒;95℃,15秒);并从60℃缓慢加热到99℃(仪器自动进行-ramprate为0.05℃/秒)。b结果与计算各样品的目的基因和内参分别进行realtimepcr反应,每个样本检测3个复孔。结果表明,模型组小鼠脾脏th17的转录因子rorc的表达量(1.23±0.29)较对照组(0.86±0.33)显著升高p<0.05,证明哮喘能激发th17型免疫应答。6.血清中桦树特异性抗体(sige、sigg1、sigg2a)检测总ige的检测(所用的抗体anti-mouseigecapturemab、purifiedmouseige、anti-mouseige可购自bd公司)sige检测:(a).包被:用包被液溶解标准化白桦花粉变应原国家参考品(北京新华联公司,批号201605c008),稀释至浓度50μg/ml,即含有主要致敏蛋白(betv1)2.5μg/ml;每孔加100μl,4℃过夜。(b).封闭:pbst洗三次后,每孔加入200μl封闭液,室温孵育2h。(c).加样:一抗小鼠血清1:10稀释,37℃孵育2小时。(d).孵育二抗:pbst洗三次后,二抗加入1:1000稀释的二抗,37°孵育1h。(e).显色:pbst洗六次后。用tmb底物显色试剂盒显色,按照说明书每孔添加100μl显色液,室温避光孵育5min,反应产物呈蓝色。(f).每孔加入50μl,0.5mh2so4终止显色,终止反应,此时蓝色立即转为黄色,酶标仪上测定波长450nm处各孔的光密度值(od值)。sigg1检测:(a).包被:用包被液溶解标准化白桦花粉变应原国家参考品(北京新华联公司,批号201605c008),稀释至浓度50μg/ml,即含有主要致敏蛋白(betv1)2.5μg/ml;每孔加100μl,4℃过夜。(b).封闭:pbst洗三次后,每孔加入200μl封闭液,室温孵育2h。(c).加样:一抗小鼠血清1:2000稀释,37℃孵育2小时。(d).孵育二抗:pbst洗三次后,二抗加入1:1000稀释的goatanti-moμseigg1heavychain(hrp)(ab97240),37℃孵育1小时。(e).显色:pbst洗六次后。用tmb底物显色试剂盒显色,按照说明书每孔添加100μl显色液,室温避光孵育5min,反应产物呈蓝色。(f).每孔加入50μl,0.5mh2so4终止显色,终止反应,此时蓝色立即转为黄色,酶标仪上测定波长450nm处各孔的光密度值(od值)。sigg2a检测:(a).包被:用包被液溶解标准化白桦花粉变应原国家参考品(北京新华联公司,批号201605c008),稀释至浓度50μg/ml,即含有主要致敏蛋白(betv1)2.5μg/ml;每孔加100μl,4℃过夜。(b).封闭:pbst洗三次后,每孔加入200μl封闭液,室温孵育2h。(c).加样:一抗小鼠血清1:2000稀释,37℃孵育2小时。(d).孵育二抗:pbst洗三次后,二抗加入1:1000稀释的goatanti-moμseigg2aheavychain(hrp)(ab97245),37℃孵育1h。(e).显色:pbst洗六次后。用tmb底物显色试剂盒显色,按照说明书每孔添加100μl显色液,室温避光孵育5min,反应产物呈蓝色。(f).每孔加入50μl,0.5mh2so4终止显色,终止反应,此时蓝色立即转为黄色,酶标仪上测定波长450nm处各孔的光密度值(od值)。结果表明,模型组小鼠的总ige和桦树花粉sige的表达量均显著高于对照组小鼠(p<0.01),证明本实验建模成功,可以诱导小鼠产生大量ige。7.支气管肺泡灌洗液和血清多因子检测使用milliplexcatalogid.mcytomag-70k-06.moμsecytokinemagnetickit检测小鼠血清和肺泡灌洗液中细胞因子il4、9、10、13、17a、ifnr的水平,具体操作严格按照说明书。模型组小鼠脾脏treg百分比(16.3250±1.07271)与对照组(17.1±2.27031)无明显区别。实施例3白桦花粉对于对桦树花粉过敏的哮喘小鼠的治疗效果本实施例是在实施例2的基础上进行,有些操作与实施例2中相同,在本实施例中将不再赘述。将balb/c小鼠随机分成对照组、模型组、治疗组和新治疗组,每组10只,小鼠体重为18-20g。1.对照组(dz组)对照组,pbsgroup:各项操作与模型组相同,除用pbs代替白桦花粉变应原。2.模型组(birchpollen,bp)1).致敏:分别于第1天、第8天和第15天对每只小鼠异氟烷麻醉后,颈后皮下注射总共200μl含有100μl的0.25μg/μl白桦花粉溶液,(白桦花粉用pbs溶解)和100μl佐剂的混合液,其中佐剂为氢氧化铝佐剂,可采用imjectalumthermo公司试剂2).激发:第22-24天,雾化吸入0.1%的白桦花粉溶液,连续3天,每天30min。3).治疗:从第25天开始,颈后皮下注射pbs150ul,隔天一次,总计8次。4).再次激发:第43-45天,雾化吸入0.1%的白桦花粉变应原,连续3天,每天30min。第46天行肺功能检查;第47天取材。3.治疗组(birchpollentreatmentgroup,bpt1)即短期治疗组1).致敏:同模型组。2).激发:第22-24天,雾化吸入0.1%的白桦花粉,连续3天,每天30min。3).治疗:从第25天开始,颈后皮下注射含有300μg的白桦花粉溶液(2μg/μl,150μl),隔天一次,进行8次。4).再次激发:第43-45天,雾化吸入0.1%的白桦花粉溶液,连续3天,每天30min,第46天行肺功能检查;第47天取材。4.新治疗组(birchpollentreatmentgroup,bpt2)即长期治疗组1).致敏:同模型组。2).激发:第22-24天,雾化吸入0.1%的白桦花粉,连续3天,每天30min。在第27天行肺功能检测;第28天割尾法取老鼠血。3).治疗:从第32天开始,颈后皮下注射含有300μg的白桦花粉溶液(2μg/μl,150μl;3:1加入佐剂50μl,总计200μl),隔周一次,进行8次。4).再次激发:第90-92天,雾化吸入0.1%的的白桦花粉溶液,连续3天,每天30min。第93天行肺功能检查;第94天取材。二、检测方法及结果1.气道反应性测定检测方法同实施例2。检测结果如图2所示,其中**代表模型组vs.对照组,p<0.01;##代表治疗组vs.模型组,p<0.01。结果表明,模型组sraw值较对照组明显升高,特别是在乙酰胆碱浓度为25mg/ml和50mg/ml时(p<0.01),证明小鼠哮喘模型建立成功。经治疗后,即步骤(4)后,经过检测,治疗组(长期与短期)sraw值较模型组降低,特别是在乙酰胆碱浓独为25mg/ml和50mg/ml时(p<0.01),证明治疗降改善了小鼠的气道高反应性。2.标本留取血清标本1).肺功能检测后2h,将老鼠置于饭盒内,待其安静后,采用割尾法收集血液于1.5mlep管中。2).肺功能测定后第二天,用1%戊巴比妥腹腔注射麻醉小鼠,待疼痛反射消失后,固定小鼠于解剖台上。采用眼球摘取取血法,收集血液于1.5mlep管中。3).血清4℃过夜后,4000rpm,4℃离心10min,吸取清亮上清于新的ep管中,-80℃冻存备用。3.支气管肺泡灌洗液收集和细胞计数检测方法同实施例2。支气管肺泡灌洗液中细胞分类计数结果如图3所示,其中(1)为白细胞(wbc)细胞的计数情况,(2)为中性粒细胞(neμt)细胞的计数情况,(3)为嗜酸性粒细胞(eos)细胞的计数情况,(4)为淋巴细胞(lymph)细胞的计数情况,(5)为单个核细胞细胞(mono)的计数情况,(6)为嗜酸性粒细胞百分比(eos%)柱形图。其中**代表模型组vs对照组,p<0.01;##代表治疗组vs模型组,p<0.01。模型组炎症细胞总数,中性粒细胞数,淋巴细胞数,单个核细胞数,嗜酸性粒细胞数数量相比于对照组都明显升高(p<0.01);说明模型组小鼠的气道发生了严重的炎症反应,且炎症细胞的浸润以eos为主,eos%也明显增高(p<0.01),说明建模成功。研究发现,经过治疗后,治疗组炎症细胞总数,中性粒细胞数,淋巴细胞数,嗜酸性粒细胞数数量相比于模型组都明显降低(p<0.01),eos%也明显下降(p<0.01),说明治疗组的治疗有效的抑制小鼠气道炎症,减少细胞浸润。嗜碱性粒细胞数量在各组中均没有明显区别。4.肺脏组织病理切片对肺脏组织进行石蜡包埋切片实验:1.取材:新鲜组织固定于4%多聚甲醛24h以上。将组织从固定液取出在通风橱内用手术刀将目的部位组织修平整,将修切好的组织和对应的标签放于脱水盒内。2.脱水:将脱水盒放进吊篮里于脱水机内依次梯度酒精进行脱水。75%酒精4h-85%酒精2h-90%酒精2h-95%酒精1h-无水乙醇i30min-无水乙醇ii30min-醇苯5-10min-二甲苯i5-10min-二甲苯ii5-10min-蜡i1h-蜡ii1h-蜡iii1h。3.包埋:将浸好蜡的组织于包埋机内进行包埋。先将融化的蜡放入包埋框,待蜡凝固之前将组织从脱水盒内取出按照包埋面的要求放入包埋框并贴上对应的标签。于-20°冻台冷却,蜡凝固后将蜡块从包埋框中取出并修整蜡块。4.切片:将修整好的蜡块置于石蜡切片机上切片,片厚4μm。切片漂浮于摊片机40℃温水上将组织展平,用载玻片将组织捞起,并放进60℃烘箱内烤片。待水烤干蜡烤化后取出常温保存备用。he染色实验步骤如下:1).石蜡切片脱蜡至水:依次将切片放入二甲苯ⅰ20min-二甲苯ⅱ20min-无水乙醇ⅰ10min-无水乙醇ⅱ10min-95%酒精5min-90%酒精5min-80%酒精5min-70%酒精5min-蒸馏水洗。2).苏木素染细胞核:切片入harris苏木素染3-8min,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗。如果细胞浆有蓝色可以延长分化时间3).伊红染细胞质:切片入伊红染液中染色1-3min。不要水洗。4).脱水封片:将切片依次放入95%酒精i5min-95%酒精ii5min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-二甲苯ⅰ5min-二甲苯ⅱ5min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。5).显微镜镜检,图像采集分析。染色结果:细胞核蓝色,细胞质红色。评估气道和血管周围炎症细胞的浸润采用5分制评分法进行计数:0,没有炎症细胞;1,少量细胞;2,单层的细胞环;3,2-4层的细胞环;4,多于4层的细胞环。ab-pas染色实验操作如下:1).石蜡切片脱蜡至水:依次将切片放入二甲苯ⅰ20min-二甲苯ⅱ20min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-75%酒精5min,水洗。2).阿利新蓝染色:切片入阿利新蓝染液中染色5min,水洗后镜检;3).pas染色:切片入高碘酸染液中染色15min,自来水洗,蒸馏水洗两遍;4).切片入雪弗染液30min,避光,流水冲洗五分钟,镜检;5).脱水封片:切片依次放入无水乙醇i5min-无水乙醇ii5min-无水乙醇ⅲ5min-正丁醇5min-二甲苯ⅰ5min-二甲苯ⅱ5min透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。6).显微镜镜检,图像采集分析,结果判读:酸性粘液物质呈蓝色,糖原,中性粘液物质呈紫红色。评估气道黏液产生的程度,ab-pas染色后,在200倍镜下,采用半定量的方法计数气道上皮中增生的杯状细胞占气道上皮细胞总数的比例。采用5分制评分法进行评分:0,没有杯状细胞;1,<25%;2,5-50%;3,50-75%;4,>75%。对每一个肺部切片观察至少3个不同视野,对杯状细胞和炎症细胞的数量进行评分。染色结果见图4和5所示。结果说明,肺组织he染色发现模型组小鼠肺部气管和周围血管有大量炎性细胞浸润,形成多层细胞环,同时伴有气道增厚和水肿。对照组未见特殊异常。经治疗后,小鼠肺部气管和周围血管炎症细胞浸润和水肿明显缓解;肺组织ab-pas染色发现:模型组气道壁广泛被染成蓝紫色,气道内也可以看到弥散的蓝紫色,说明产生大量的粘液物质;气道上皮中增生的杯状细胞占气道上皮细胞总数>75%。对照组未见明显异常,气道上皮中增生的杯状细胞占气道上皮细胞总数<25%。治疗组气道壁部分被染成蓝紫色,气道上皮中增生的杯状细胞占气道上皮细胞总数<50%。小鼠肺组织炎症评分如图6所示,黏液评分结果如图7所示。其中,图6中为炎症评分(inflammationscore),**代表模型组vs.对照组,p<0.01;##代表治疗组vs.模型组,p<0.01。图7中为粘液得分(mucusscore),**代表模型组vs.对照组,p<0.01;#代表治疗组vs.模型组,p<0.05。5.脾脏分离做了th17和treg检测,21样品是三组小鼠的脾脏总rna图,每组7只鼠做该检测,结果如图8所示rna电泳图,lane1-21对应21个样本,m:dnamarker:dm2000;从下往上依次为100、250、500、750、1000和2000bp,其中750bp为亮带。realtimepcr检测小鼠脾脏中目的基因表达量的如图9所示,其中,(1)为脾脏th17的转录因子rorc的表达量,*代表模型组vs.对照组,p<0.05;##代表治疗组vs.模型组,p<0.01;(2)为脾脏treg的转录因子foxp3的表达量,脾脏rorc/foxp3比值结果如图10所示,其中##代表治疗组vs.模型组,p<0.01。其中,步骤包括:提取小鼠脾脏总rna,逆转录合成cdna,realtimepcr样本上机检测。结果表明,模型组小鼠脾脏th17的转录因子rorc的表达量(1.23±0.29)较对照组(0.86±0.33)显著升高p<0.05,证明哮喘能激发th17型免疫应答。经治疗后,短期治疗组th17的转录因子rorc的表达量(0.58±0.17)明显降低p<0.01,有统计学意义,证明特异性免疫治疗能有效缓解th17型免疫应答。模型组小鼠脾脏treg的转录因子foxp3的表达量(1.83±1.18)与对照组(1.53±0.59)无明显区别,经治疗后,治疗组treg的转录因子foxp3的表达量(2.95±1.11)升高,说明脱敏治疗激发了treg型免疫应答。但无统计学意义。模型组小鼠脾脏rorc/foxp3(0.9±0.5)较对照组(0.66±0.33)升高,但没有统计学差异。经白桦花粉治疗后,短期治疗组rorc/foxp3(0.29±0.33)降低p<0.01,有统计学意义,证明白桦花粉治疗能抑制th17/treg免疫应答左偏移。模型组小鼠脾脏th17百分比(0.3688±0.15905)较对照组(0.1786±0.8576)显著升高p<0.01,证明哮喘能激发th17型免疫应答。经白桦花粉治疗后,短期治疗组th17(0.2074±0.21658)降低p<0.05,有统计学意义,证明白桦花粉治疗能有效缓解th17型免疫应答。6.血清中桦树特异性抗体(sige、sigg1、sigg2a)检测方法同实施例2,结果如图11所示,a为sige,b为sigg1,c为sigg2a。结果表明,模型组小鼠的总ige和桦树花粉sige的表达量均显著高于对照组小鼠(p<0.01),证明本实验建模成功,可以诱导小鼠产生大量ige。经过特异性治疗后,治疗组总ige和桦树花粉sige的表达量相对于模型组明显降低(p<0.01),证明脱敏治疗成功抑制了ige的产生。7.支气管肺泡灌洗液和血清多因子检测支气管肺泡灌洗液中各细胞因子检测结果如图12所示,其中,血清中**代表模型组vs.对照组,p<0.01;*代表模型组vs.对照组,p<0.01;##代表治疗组vs.模型组,p<0.01;#代表治疗组vs.模型组,p<0.05。血清中各细胞因子检测如图13所示,其中,**代表模型组vs.对照组,p<0.01;*代表模型组vs.对照组,p<0.01;##代表治疗组vs.模型组,p<0.01;#代表治疗组vs.模型组,p<0.05。脾脏t细胞亚群检测的结果如图14所示,其中,th17细胞检测中**代表模型组vs.对照组,p<0.01;#代表治疗组vs.模型组,p<0.05;treg细胞检测。**代表模型组vs.对照组,p<0.01。如图15为脾脏th17/treg比值结果。**代表模型组vs.对照组,p<0.01;##代表治疗组vs.模型组,p<0.01。模型组小鼠脾脏treg百分比(16.3250±1.07271)与对照组(17.1±2.27031)无明显区别,经治疗后,治疗组treg百分比(11.5167±0.80208)明显降低p<0.01,证明特异性免疫治疗进一步抑制treg型免疫应答。模型组小鼠脾脏th17/treg(0.0239±0.00948)较对照组(0.0098±0.00413)显著升高p<0.01,证明哮喘能激发th17/treg免疫应答左偏移。经治疗后,治疗组th17/treg(0.0123±0.01306)降低p<0.01,有统计学意义,证明白桦花粉的治疗能抑制th17/treg免疫应答左偏移。8.实验安全性(1).每次治疗后30min,通过小鼠直肠进行核心体温检测,确定脱敏针剂对小鼠的生理影响;(2).激发后,每10min检测一次小鼠核心体温,持续三次,避免严重过敏反应的发生;(3).若出现小鼠意外死亡事件,行小鼠解刨,取心脏,肺脏,肝脏,脾脏置于4%多聚甲醛溶液中,应留做病理切片,明确死因。经过测定,小鼠体温恒定在37℃左右,未出现低体温症状。即激发过程中未发生严重过敏反应,且激发浓度安全。每次白桦花粉治疗后30min,通过小鼠直肠进行核心体温检测。小鼠体温恒定在37℃左右,未出现低体温症状。确定脱敏过程中未发生严重过敏反应,且治疗浓度安全。结论:白桦花粉可改善的气道高反应性,可有效抑制气道炎症,减少细胞浸润,可抑制了ige的产生,有效缓解th17型免疫应答,能抑制th17/treg免疫应答左偏移。可将其用于治疗桦树花粉过敏性等药物的开发,用于防治与桦树花粉过敏性相关的疾病。实施例4本实施例是在实施例3的基础上,进一步评价特异性免疫治疗结束后,再次激发情况,选取长期治疗组小鼠,进行治疗后观察。小鼠随机分成对照组、模型组、治疗组、治疗后观察组。对照组,模型组,治疗组的处理同实施例2中的对照组、模型组、长期治疗组。治疗后观察组:1).致敏:分别于第1天、第8天和第15天对每只小鼠异氟烷麻醉后,颈后皮下注射100ul的0.25μg/μl白桦花粉变应原,100μl佐剂(imjectalum),总计200ul。2).激发:第22-24天,雾化吸入0.1%的白桦花粉变应原,连续3天,每天30min。在第27天行肺功能检测;第28天割尾法取老鼠血。3).治疗:从第32天开始,颈后皮下注射150ul白桦花粉变应原(2μg/μl),和50ul佐剂(imjectalum),总计200ul,隔周一次,进行8次。4).再次激发:第90-92天,雾化吸入0.1%的桦树蛋白,连续3天,每天30min;第93天,行肺功能检查;第94天割尾法取老鼠血。5).静止后激发:第95-126天,小鼠正常饮食,不做特殊处理;第127-129天,雾化吸入0.1%的桦树蛋白,连续3天,每天30min。第130天行肺功能检查;第131天取材。实验方法同实施例3中,检测结果:气道反应性测定检测结果见图16;支气管肺泡灌洗液细胞计数结果见图17;通过支气管肺泡灌洗液细胞因子测定及sige,sigg1,sigg2a检测、肺组织he染色、肺组织ab-pas染色,炎症评分的结果,表明桦树花粉治疗后,停止治疗后,仍维持较好的疗效。可以避免停药后哮喘反复。最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1