一种盐酸胍法辛缓释片及其制备方法与流程
本发明属于制药领域,具体涉及一种盐酸胍法辛缓释片及其制备方法。
背景技术:
盐酸胍法辛是迄今在全球范围内获准治疗这一适应证的第一个选择性α-2a肾上腺能受体激动剂,它对这种受体亚型的亲和力与α-2b或α-2c亚型相比高15-20倍。在治疗adhd过程中,盐酸胍法辛的作用机制尚未得到充分确定。临床前研究表明,盐酸胍法辛在前额皮质及基底神经节中通过对α-2肾上腺素能受体中突触去甲肾上腺素传递的直接改性而调节信号。盐酸胍法辛化学名称为n-脒基-2-(2,6-二氯苯基)乙酰胺单盐酸盐,其分子式为:c9h9cl2n3o·hcl,分子量为282.55,结构式为:
盐酸胍法辛为白色至类白色结晶粉末,难溶于水和乙醇,在甲醇中有相对较高的溶解度。
2009.09.02美国fda批准了盐酸胍法辛缓释片(商品名
目前中国专利cn102579381公开了一种盐酸胍法辛缓释制剂及其制备方法,使用湿法制粒工艺,具体方法使活性成分直接暴露于水、过热或高剪切双重作用下,经实验研究发现该制备工艺很难控制药物组合物有关物质且产品的稳定性不好,盐酸胍法辛总杂质也无法满足药用标准。美国专利us6811794和cn103705480分别公开了胍法辛药物组合物的固体口服剂型,片剂使用直接压缩方法而制备,该制备工艺程序仍难有效控制药物组合物的水分,导致杂质稳定性不佳,该固体口服剂型的药品安全性存在担忧。
技术实现要素:
本发明要解决的技术问题是提供一种盐酸胍法辛缓释片及其制备方法,具体在于提供一种盐酸胍法辛缓释片的制备方法,及提高盐酸胍法辛缓释片稳定性的制备方法。
本发明能有效控制盐酸胍法辛缓释片在加速和强制加速条件下的有关物质。利用本发明技术方案使盐酸胍法辛缓释片的水分降低,可在有效的降低药物组合物中的杂质稳定性,并保证药物组合物用药稳定性且制备方法简便,可用于大规模生产。
本发明提供一种制备盐酸胍法辛缓释片的方法,该方法包括将整粒/混合、压片后的盐酸胍法辛药物组合物放入热风装置中,对其进行干燥处理,其中热风装置选自包衣机或烘箱,热风温度范围为30~70℃,经干燥处理后得到盐酸胍法辛缓释片水分重量比≤4.0%,优选所述经干燥处理后得到盐酸胍法辛缓释片水分重量比≤3.5%。
本发明还提供热风装置选自包衣机时,具体步骤包括将整粒/混合、压片后的盐酸胍法辛药物组合物放置包衣锅中,控制包衣锅的进风温度和进风量,调节包衣锅的滚筒转速,进行干燥处理2~8h后,制得稳定的盐酸胍法辛缓释片。
本发明提供优选包衣锅的滚筒转速为2~10转/分;
本发明提供包衣锅的进风温度为30~70℃,优选35~65℃,进一步优选40~60℃;
本发明提供包衣锅的进风量为500~2000m3/h,优选700~1500m3/h;
本发明提供包衣锅干燥处理时间为2~8h。
本发明提供热风装置选自烘箱时,具体步骤包括将整粒/混合、压片后的盐酸胍法辛药物组合物放置烘箱中,控制烘箱温度,进行干燥处理后4-12h,制得稳定的盐酸胍法辛缓释片。
本发明提供烘箱温度为30~70℃,优选40-60℃。
通过以上热风装置选自包衣机或烘箱干燥处理后,本发明还提供一种盐酸胍法辛缓释片,其水分重量比≤4.0%,优选所述经干燥处理后得到盐酸胍法辛缓释片水分重量比≤3.5%。总杂质限量≤1.0%,单个杂质≤0.10%。优选地其总杂质限量≤0.5%,单个杂质≤0.08%。更优选地其总杂质限量≤0.3%,单个杂质≤0.05%。
本发明还提供一种盐酸胍法辛药物组合物含有盐酸胍法辛、乳糖、微晶纤维素、羟丙甲纤维素、甲基丙烯酸共聚物、富马酸、山嵛酸甘油酯、硬脂富马酸钠、微粉硅胶。
本发明还提供一种规格分别为1、2、3、4mg盐酸胍法辛药物组合物,所述药物组合物是通过湿法制粒工艺或直接压片工艺制备得到的,该药物组合物处方组成含有:
本发明还提供优选一种盐酸胍法辛药物组合物,该药物组合物含有1、2、3及4mg规格的处方组成如下:
本发明提供了一种提高盐酸胍法辛缓释片杂质稳定性制备方法,通过本发明的制备方法得到的盐酸胍法辛缓释片的总杂质限量≤1.0%,单个杂质≤0.10%。优选地其总杂质限量≤0.5%,单个杂质≤0.08%。更优选地其总杂质限量≤0.3%,单个杂质≤0.05%。明显降低了现有技术中药物组合物的杂质含量。本发明能得到高纯度、高质量的盐酸胍法辛缓释片。
更为具体的,药品经过强制加速条件(本条件是指温度为60±2℃,相对湿度为75%±5%的条件)下放置10天后,药物组合物总杂含量基本无变化,且部分变化值也均在0.10%以内,另外药品经过加速条件(本条件是指温度为40±2℃,相对湿度为75%±5%的条件,同《中国药典》2015版,9001章节中原料药物与制剂稳定性试验指导原则中规定的加速条件)考察6月后,杂质总杂含量基本无变化,且部分变化值也均在0.10%以内。产品的稳定性好,更便于储存。
本发明还提供的一种盐酸胍法辛药物组合物,辅料为乳糖、微晶纤维素、羟丙甲纤维素、甲基丙烯酸共聚物、富马酸、山嵛酸甘油酯、硬脂富马酸钠、微粉硅胶,优选以上处方与参比制剂在体外释放度一致(见附图1-3),释放度实验条件:溶出度第二法装置,转速为75rpm,温度37℃,释放介质900ml,ph2.2的盐酸缓冲液,检测方法为高效液相色谱。
总之本发明提供的一种盐酸胍法辛缓释片在热风装置中选自包衣机或烘箱干燥处理的新型工艺,通过热风干燥使组合物中的水分降低,从而优化了药物组合物的总杂质含量和药物的稳定性,同时确保药物释放可控性。利用本发明可有效降低盐酸胍法辛缓释片的有关物质风险,提高药物的安全性,制得的药物组合物稳定性好,且制备工艺操作简便,适用于商业化生产。
附图说明
图1本发明实施例3所得样品在ph2.2条件下的体外释放曲线图;
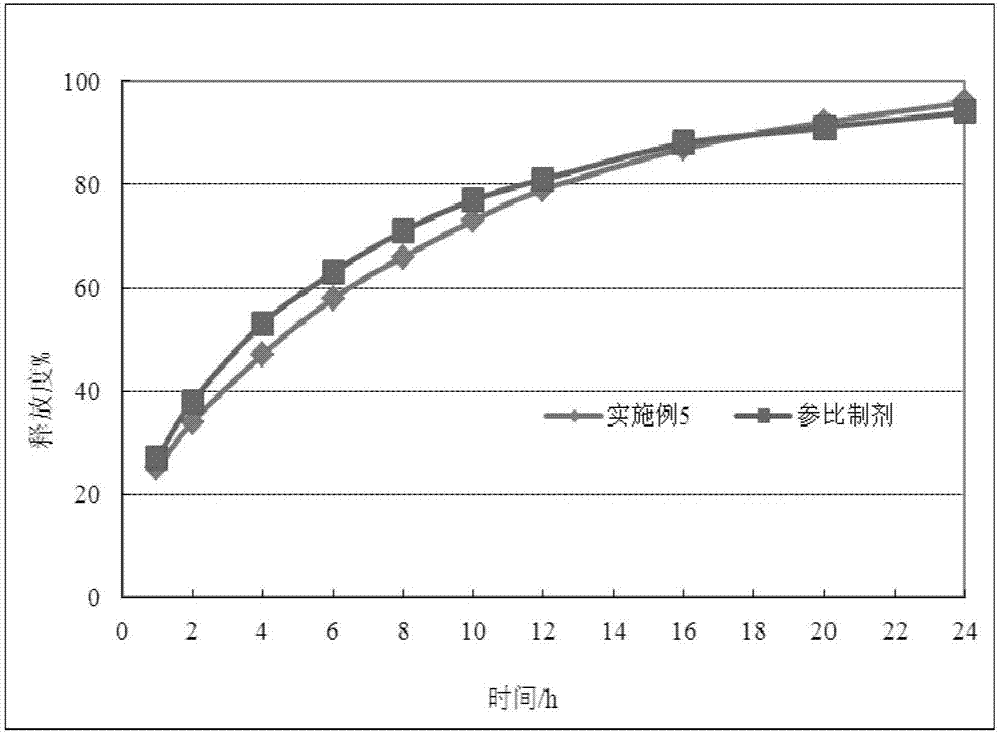
图2本发明实施例5所得样品在ph2.2条件下的体外释放曲线图;
图3本发明实施例6所得样品在ph2.2条件下的体外释放曲线图;
图4本发明实施例8所得样品在ph2.2条件下的体外释放曲线图。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式及保护范围不限于此。
对比实施例1:药物组合物按照下表配方进行混合、压片工艺制得盐酸胍法辛缓释片。
表1盐酸胍法辛缓释片2mg处方
对比实施例2:盐酸胍法辛缓释片的原辅料组成如下表2,按照下表所述盐酸胍法辛缓释片的原辅料组成配置各种原辅料,将配制好的盐酸胍法辛、乳糖、富马酸、羟丙甲纤维素、甲基丙烯酸共聚物通过80目筛网后与高速混合机中搅拌混合30分钟后,得到均匀粉体,接着采用高速剪切机在高速剪切状态下缓慢加入黏合剂纯化水144g,高剪切制粒所得颗粒使用流化床干燥至干颗粒水分含量lod≤5%,将干颗粒通过16目筛网整理,整理后加入配制好的助流剂微粉硅胶3.6g和润滑剂硬脂酸镁3.6g,利用混合机混合至均匀,最后压片包装得盐酸胍法辛缓释片成品。
表2盐酸胍法辛缓释片2mg处方
对比实施例3:盐酸胍法辛缓释片的原辅料组成如下表3,按照下表所述盐酸胍法辛缓释片的原辅料组成配置各种原辅料,首先将主药盐酸胍法辛、预胶化淀粉、柠檬酸、羟丙基纤维素钠、羟乙基纤维素过80目筛,然后将主药盐酸胍法辛、预胶化淀粉、柠檬酸、羟丙基纤维素钠、羟乙基纤维素放入混合机中进行混合均匀,接着依次将润滑剂和崩解剂分别加入混合机中混合均匀得到混合粉体,最后压片包装制得盐酸胍法辛缓释片成品。
表3盐酸胍法辛缓释片1mg处方
实施例1:利用本发明将对比实施例2中制得的片剂放置1kg片剂批量的高效包衣锅中,调节片床温度为40℃,包衣锅转数为6rpm,进风量为1000m3/h,进行干燥处理5h后取样进行包装,制得盐酸胍法辛缓释片成品。
实施例2:利用本发明将对比实施例3中制得的片剂放置1kg片剂批量的高效包衣锅中,调节片床温度为40℃,包衣锅转数为6rpm,进风量为1000m3/h,进行干燥处理6h后取样进行包装,制得盐酸胍法辛缓释片成品。
实施例3:利用本发明将对比实施例1制得片剂放置1kg片剂批量的高效包衣锅中,调节片床温度为30℃,包衣锅转数为6rpm,进风量为1200m3/h,进行干燥处理6h后取样进行包装,制得稳定性的盐酸胍法辛缓释片成品。且制得的稳定性的盐酸胍法辛缓释片与参比制剂在体外释放曲线一致(见图1)。
实施例4:利用本发明将对比实施例1制得片剂放置1kg片剂批量的高效包衣锅中,调节片床温度为60℃,包衣锅转数为3rpm,进风量为1000m3/h,进行干燥处理5h后取样进行包装,制得稳定性的盐酸胍法辛缓释片成品。
实施例5:利用本发明将对比实施例1制得片剂放置1kg片剂批量的高效包衣锅中,调节片床温度为70℃,包衣锅转数为9rpm,进风量为600m3/h,进行干燥处理2h后取样进行包装,制得稳定性的盐酸胍法辛缓释片成品。且制得的稳定性的盐酸胍法辛缓释片与参比制剂在体外释放曲线一致(见图2)。
实施例6:利用本发明将对比实施例1制得片剂放置烘箱中,设置温度为30℃,进行干燥处理12h后进行包装,制得稳定性的盐酸胍法辛缓释片成品。且制得的稳定性的盐酸胍法辛缓释片与参比制剂在体外释放曲线一致(见图3)。
实施例7:利用本发明将对比实施例1制得片剂放置烘箱中,设置温度为60℃,进行干燥处理7h后进行包装,制得稳定性的盐酸胍法辛缓释片成品。
实施例8:利用本发明将对比实施例1制得片剂放置烘箱中,设置温度为70℃,进行干燥处理4h后进行包装,制得稳定性的盐酸胍法辛缓释片成品。且制得的稳定性的盐酸胍法辛缓释片与参比制剂在体外释放曲线一致(见图4)。
注:对比实施例1及实施例3-8均使用同一批盐酸胍法辛缓释片。对比实施例2与实施例1使用同一批盐酸胍法辛缓释片。对比实施例3与实施例2使用同一批盐酸胍法辛缓释片。
实施例9:稳定性考察实验
将对比实施例1-3及实施例1-8所得成品在强制加速条件的恒温恒湿箱中放置10天或者在加速条件的恒温恒湿箱中放置6个月后采用面积归一法检测药物组合物的杂质百分含量(%),采用中国药典记载的费休氏法检测药物组合物的水分(%),所得结果如下:
表4
表5
从上述结果可以得知,强制加速实验10天后,实施例3、4、5、6、7、8通过干燥处理后盐酸胍法辛缓释片成品总杂限量≤1.0%,最大单杂限量≤0.1%,水分控制在≤4.0%。加速试验6月后,实施例3、4、5、6、7、8通过干燥处理后盐酸胍法辛缓释片成品总杂限量≤1.0%,最大单杂限量≤0.1%,水分控制在≤4.0%。实施例经过保存后,总杂质含量变化较小。对于未干燥的制剂在强制加速实验10天后的杂质含量达到1.61%,杂质增长幅较快。使用湿法制粒工艺制备得到的盐酸胍法辛缓释片成品水分控制在5.1%,杂质增长幅度比较大,通过本发明将该工艺制得药物组合物进行干燥处理可以降低杂质增长幅度。所以本发明盐酸胍法辛缓释片通过有效控制杂质限量,制剂稳定性较高,更符合临床用药相关法规的要求。
- 还没有人留言评论。精彩留言会获得点赞!