脂质纳米颗粒mRNA疫苗的制作方法
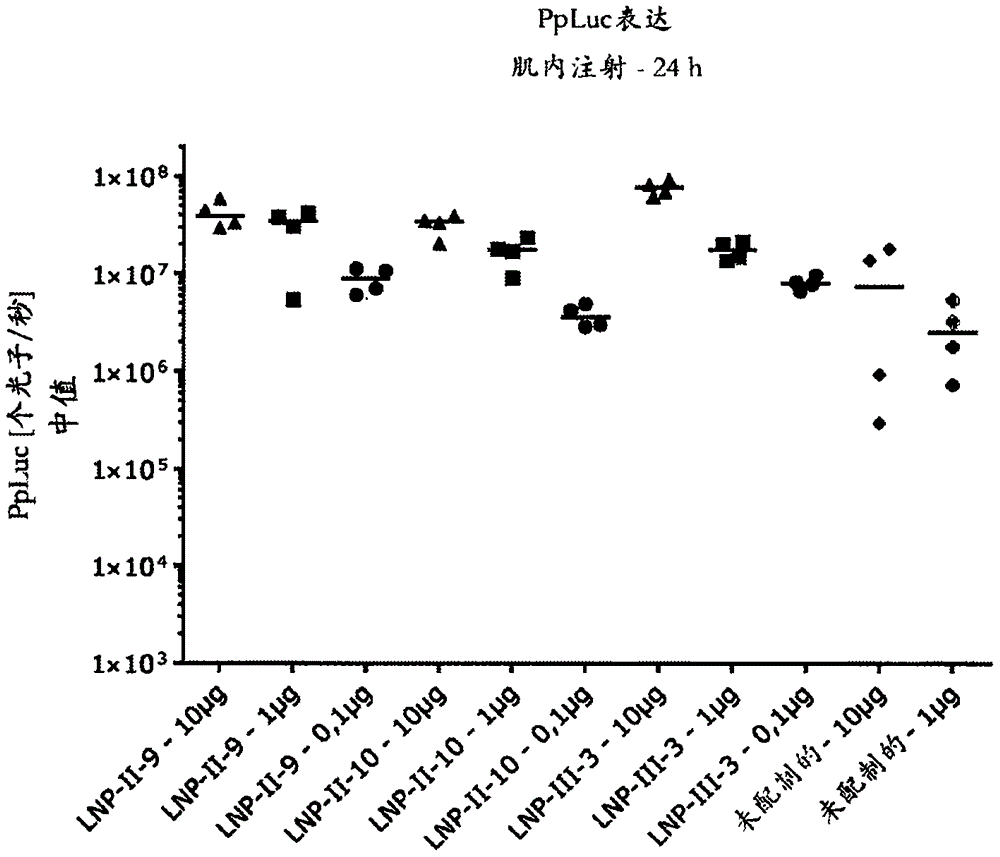
本发明涉及可用作基于mrna的疫苗的含有mrna的脂质纳米颗粒。另外,本发明涉及包含含有mrna的脂质纳米颗粒的组合物,以及这些含有mrna的脂质纳米颗粒或该组合物用于制备药物组合物尤其是疫苗的用途,例如以用于预防或治疗传染病、肿瘤或癌症疾病、过敏或自身免疫性疾病。本发明进一步描述了治疗或预防上述疾病的方法。基因疗法和基因疫苗接种属于现代医学最有前景和快速发展的方法。它们可以为多种多样的疾病的治疗提供高度特异性和个体化的选择。基因疫苗接种允许引起对所选抗原例如细菌表面特征性组分、病毒颗粒、肿瘤抗原等的所需免疫应答。一般来讲,疫苗接种是现代医学的关键成就之一。然而,有效的疫苗目前仅可用于有限数量的疾病。因此,无法通过疫苗接种而预防的感染每年仍会影响数百万人。通常,疫苗可以细分为“第一代”、“第二代”和“第三代”疫苗。“第一代”疫苗典型地是全生物体疫苗。它们基于活的和减毒的或杀死的病原体,例如病毒、细菌等。活疫苗和减毒疫苗的主要缺点是存在恢复成危及生命的变体的风险。因此,虽然此类病原体被减毒,但它们可能仍然固有地具有不可预测的风险。杀死的病原体对于产生特异性免疫应答可能不如期望的那样有效。为了最大限度地降低这些风险,开发了“第二代”疫苗。这些疫苗典型地是亚单位疫苗,它们由限定的抗原或衍生自病原体的重组蛋白组分组成。基因疫苗(即用于基因疫苗接种的疫苗)通常被理解为“第三代”疫苗。它们典型地由基因工程改造的核酸分子组成,这些核酸分子允许在体内表达病原体或肿瘤抗原特有的肽或蛋白(抗原)片段。基因疫苗在施用给患者被靶细胞摄取后表达。施用的核酸的表达导致编码蛋白的产生。如果这些蛋白被患者的免疫系统识别为外来物,则会触发免疫应答。dna以及rna可以作为核酸分子用于在基因疫苗接种的情况下施用。已知dna是相对稳定的且易于处理。然而,dna的使用具有将所施用的dna片段不期望地插入患者基因组中的风险,从而可能导致诱变事件,例如受损基因的功能丧失。作为进一步的风险,出现了不期望的抗dna抗体的生成。另一个缺点是在施用dna时可实现的编码肽或蛋白的表达水平有限,因为dna必须进入细胞核以便在所得mrna可被翻译之前转录。除了其他原因之外,所施用的dna的表达水平将取决于调控dna转录的特定转录因子的存在。在没有此类因子的情况下,dna转录不会产生令人满意的量的rna。因此,所获得的翻译肽或蛋白的水平是有限的。通过使用rna而不是dna进行基因疫苗接种,可以最大限度地减少或避免不希望的基因组整合和生成抗dna抗体的风险。然而,rna被认为是相当不稳定的分子种类,它可能容易地被普遍存在的rna酶降解。包含与鱼精蛋白复合的编码抗原的mrna的mrna疫苗已在现有技术中进行了描述(例如petsch等人,natbiotechnol.[自然-生物技术]2012年12月;30(12):1210-6.,schnee等人,plosnegltropdis.[科学公共图书馆-被忽视的热带病]2016年6月23日;10(6):e0004746.,ep1083232、wo2010/037539、wo2012/116811、wo2012/116810和wo2015/024665)。另外,wo2016/176330描述了包含编码不同抗原的经核苷修饰的rna的脂质纳米颗粒组合物。尽管在过去几年中取得了许多进展,但是本领域仍然需要提供一种有效的用于mrna疫苗接种的方法,该方法允许引发适应性免疫应答,其中施用不会因抗原的早期降解或因细胞中mrna的低效释放导致mrna的低效翻译而严重受损。此外,迫切需要降低mrna疫苗的剂量以减少潜在的安全性问题并使第三世界能够负担得起这些疫苗。存在与递送核酸以在生物系统中实现期望的应答相关的许多挑战。基于核酸的治疗剂(例如疫苗)具有巨大的潜力,但仍然需要更有效地将核酸递送至细胞或生物体内的适当位点以便实现该潜力。然而,在治疗环境中使用寡核苷酸目前面临着两个问题。首先,游离的rna易受血浆中核酸酶消化的影响。其次,游离的rna在进入相关翻译机器(translationmachinery)所在的细胞内区室中的能力方面有限。由阳离子脂质与其他脂质组分(例如中性脂质、胆固醇、peg、peg化脂质和寡核苷酸)形成的脂质纳米颗粒已用于阻断血浆中rna的降解并促进寡核苷酸的细胞摄取。仍然需要用于递送寡核苷酸的改进的阳离子脂质和脂质纳米颗粒。优选地,这些脂质纳米颗粒将提供最佳的药物:脂质比率,避免核酸在血清中降解和清除,适于全身或局部递送,并提供核酸的细胞内递送。另外,这些脂质-核酸颗粒应该是耐受良好的并且提供足够的治疗指数,使得以有效的核酸剂量进行的患者治疗不存在不可接受的毒性和/或患者风险。本发明提供了这些和相关的优点。技术实现要素:本发明提供含有mrna的脂质纳米颗粒或包含所述纳米颗粒的药物组合物及其用途。根据本发明的含有mrna的脂质纳米颗粒包含:(i)具有式(i)的阳离子脂质:或其药学上可接受的盐、互变异构体或立体异构体,其中r1a、r1b、r2a、r2b、r3a、r3b、r4a、r4b、r5、r6、r7、r8、r9、l1、l2、a、b、c、d和e如本文所定义;和/或具有式(ii)的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体,其中r1a、r1b、r2a、r2b、r3a、r3b、r4a、r4b、r5、r6、r7、r8、r9、l1、l2、g1、g2、g3、a、b、c和d如本文所定义;和/或优选地具有式iii的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体,其中r1、r2、r3、l1、l2、g1、g2和g3如本文所定义。和/或具有式(iv)的peg脂质其中r8和r9各自独立地为含有从10至30个碳原子的直链或支链、饱和或不饱和烷基链,其中该烷基链任选地被一个或多个酯键中断;并且w具有从30至60范围内的平均值;以及任选地中性脂质和/或类固醇或类固醇类似物,其中该mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。本发明进一步提供了包含所述脂质纳米颗粒的药物组合物,以及制备所述纳米颗粒的方法。在又一方面,本发明涉及这些脂质纳米颗粒或包含这些脂质纳米颗粒的药物组合物的医学用途。在又一方面,本发明涉及使用所述含有mrna的脂质纳米颗粒进行医学预防或治疗的方法。定义为了清楚和可读性,提供了以下科学背景信息和定义。由此披露的任何技术特征均可以是本发明的每一个实施例的一部分。可以在本披露的上下文中提供另外的定义和解释。除非另外定义,或除非特定上下文另有要求,否则本文使用的所有技术术语具有与相关
技术领域:
的技术人员通常理解的含义相同的含义。除非上下文指出或另有要求,否则词语“包括”、“包含”和“含有”以及类似的表述应在本说明书和权利要求书中以开放性和包含性的含义解释为“包括但不限于”。表述“一个实施例”、“实施例”、“具体实施例”等表示特定的特征、性质或特性,或特征、性质或特性的特定群组或组合(如结合相应的表述所提及的那样)存在于本发明的至少一个实施例中。在此整个说明书中的各个地方出现这些表述不一定是指同一实施例。此外,特定的特征、性质或特性可以在一个或多个实施例中以任何合适的方式组合。除非上下文另有明确规定,否则单数形式“一个/种”和“该”应理解为包括复数指代。数字上下文中的百分比应理解为相对于相应项目的总数。在其他情况下,并且除非上下文另有规定,否则百分比应理解为重量百分比(wt.-%)。在本发明的上下文中,“组合物”是指任何类型的组合物,其中可以掺入规定的配料,任选地与任何进一步的成分一起,通常与至少一种药学上可接受的载剂或赋形剂一起。因此,该组合物可以是干组合物,例如粉末或颗粒,或固体单元,例如冻干形式或片剂。替代性地,该组合物可以呈液体形式,并且每种成分可以以溶解或分散(例如悬浮或乳化)形式独立地掺入。在一个优选的实施例中,将该组合物配制成无菌固体组合物,例如粉末或冻干形式,以用含水液体载剂复原。对于包含如下文进一步详细描述的核酸货物(nucleicacidcargo)的那些组合物形式,这样的制剂也是优选的。如本文所用,“化合物”是指化学物质,它是由具有基本上相同的化学结构和性质的分子组成的材料。对于小分子化合物,这些分子在其原子组成和结构构型方面典型地是相同的。对于大分子或聚合化合物,化合物的分子高度相似,但并非所有分子都必须相同。例如,指定由50个单体单元组成的聚合物片段也可包含具有例如48个或53个单体单元的单独分子。类脂质化合物(也简称为类脂质)是脂质样化合物,即具有脂质样物理性质的两亲化合物。在本发明的上下文中,术语脂质被认为涵盖类脂质。除非从具体的上下文中清楚地看出不同的含义,否则术语“阳离子”是指相应的结构永久地、或非永久地但是响应于某些条件例如ph带有正电荷。因此,术语“阳离子”既涵盖“永久性阳离子”也涵盖“可阳离子化的”。如本文所用,“永久性阳离子”是指相应的化合物或基团或原子在其环境的任何ph值或氢离子活性下均带正电荷。典型地,正电荷因季氮原子的存在而产生。当化合物携带多个这样的正电荷时,它可以被称为永久性聚阳离子,这是永久阳离子的亚类。阳离子组分/化合物:术语“阳离子组分/化合物”典型地是指带电荷的分子,它在典型地为约1至9的ph值下带正电荷(阳离子)。在一些实施例中,阳离子组分/化合物优选地在等于或低于9(例如5至9)、等于或低于8(例如5至8)、等于或低于7(例如5至7)的ph值下,最优选地在生理ph值(例如约7.3至7.4)下带电荷。因此,根据本发明一个实施例的阳离子肽、蛋白、多糖、脂质或聚合物在生理条件下特别是在体内细胞的生理盐条件下带正电荷。在另一个优选的实施例中,根据本发明的脂质纳米颗粒、阳离子肽、蛋白、多糖、脂质或聚合物在生理条件下特别是在体内细胞的生理盐条件下不带电荷、具有中性电荷或分别是电中性的。阳离子肽或蛋白优选地含有较大量的阳离子氨基酸,例如比其他氨基酸残基的数量更大的arg、his、lys或orn(特别是比阴离子氨基酸残基如asp或glu更多的阳离子氨基酸)或含有主要由阳离子氨基酸残基形成的组件。表述“阳离子”也可以指“聚阳离子”组分/化合物。阳离子组分/化合物还可以指能够带正电荷的阳离子脂质。示例性阳离子脂质包括带有正电荷的一个或多个胺基。优选的阳离子脂质是可电离的,使得它们可以根据ph以带正电荷的形式或中性形式存在。阳离子脂质的电离影响脂质纳米颗粒(lnp)在不同ph条件下的表面电荷。这种电荷状态可以影响血浆蛋白吸收、血液清除和组织分布(semple,s.c.等人,adv.drugdelivrev[高级药物递送评论]32:3-17(1998))以及形成对核酸的细胞内递送至关重要的非双层结构的能力(hafez,i.m.等人,genether[基因疗法]8:1188-1196(2001)。如其他地方所述,所配制的阳离子脂质的pka与lnp递送核酸的有效性相关联(参见jayaraman等人,angewandtechemie,internationaledition[应用化学国际版](2012),51(34),8529-8533;semple等人,naturebiotechnology[自然生物技术]28,172-176(2010))。在本发明的一些实施例中,pka的优选范围为约5至约7。在此上下文中,前缀“聚”是指化合物中具有相应性质的多个原子或基团。如果放在括号中,则多个的存在是任选的。例如,(聚)阳离子是指阳离子和/或聚阳离子。然而,不存在该前缀不应解释为排除多个。例如,聚阳离子化合物也是阳离子化合物,并可如此提及。“可阳离子化的”是指化合物或基团或原子在较低ph下带正电荷并且在其环境的较高ph下不带电荷。另外,在不能测定ph值的非水性环境中,可阳离子化的化合物、基团或原子在高氢离子浓度下带正电荷并且在低氢离子浓度或活性下不带电荷。它取决于可阳离子化的或可聚阳离子化的化合物的各个性质,特别是相应的可阳离子化基团或原子的pka,在所述ph或氢离子浓度下它带电荷或不带电荷。在稀释的水性环境中,可以使用所谓的海森巴赫(henderson-hasselbalch)方程来估计带有正电荷的可阳离子化的化合物、基团或原子的分率,该方程是本领域技术人员公知的。例如,在一些实施例中,如果某化合物或部分是可阳离子化的,则优选的是,它在约1至9,优选地4至9、5至8或甚至6至8的ph值下,更优选地在等于或低于9、等于或低于8、等于或低于7的ph值下,最优选地在生理ph值(例如约7.3至7.4)下,即在生理条件下,特别是在体内细胞的生理盐条件下带正电荷。在其他实施例中,优选的是,可阳离子化的化合物或部分在生理ph值(例如约7.0-7.4)下主要是中性的,但在较低ph值下变为带正电荷的。在一些实施例中,可阳离子化的化合物或部分的pka的优选范围是约5至约7。核酸:术语核酸是指任何dna或rna分子。该术语可用于多核苷酸和/或寡核苷酸。在本文中,无论何处提及编码特定蛋白和/或肽的核酸或核酸序列,所述核酸或核酸序列均分别优选地还包含允许其在合适的宿主(例如人类)中表达(即,编码特定蛋白或肽的核酸序列的转录和/或翻译)的调控序列。核苷修饰:在本发明的上下文中,术语核苷修饰是指包含核苷的mrna分子或化合物,这些核苷通常不是mrna的一部分,优选地为非天然核苷。特别地,该术语优选地是指除腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶以及在某些情况下胸腺嘧啶之外的mrna核苷。肽:肽是至少两个氨基酸单体的低聚物或聚合物。通常,单体通过肽键连接。术语“肽”不限制氨基酸的聚合物链的长度。在本发明的一些实施例中,肽可以例如含有少于50个单体单元。较长的肽也称为多肽,典型地具有50个至600个单体单元,更具体地50个至300个单体单元。蛋白:蛋白典型地由折叠成三维形式从而促进生物学功能的一种或多种肽和/或多肽组成。流感大流行或大流行性流感:当非人(新)流感病毒获得有效和持续的人际传播能力,然后在全球传播时,就会发生流感大流行。可能引起大流行的流感病毒被称为“具有大流行潜力的流感病毒”或“大流行性流感病毒”。具有大流行潜力的流感病毒的实例包括甲型禽流感(h5n1)和甲型禽流感(h7n9),它们是两种不同的“鸟流感”病毒。这些病毒是非人类病毒(即,它们在人类中是新的并且在世界的某些地方在鸟类中传播),因此在人群中对这些病毒几乎没有免疫力。这些病毒的人类传染很少发生,但如果这些病毒中的任一种以能够容易地传染人类并且易于在人与人之间传播的方式发生变化,则可能导致流感大流行。用于大流行性流感的疫苗或大流行性流感疫苗:针对大流行性流感病毒的疫苗在本文中称为用于大流行性流感的疫苗或大流行性流感疫苗。流感季节:流感季节是每年重复出现的时期,其特征是流感的流行或爆发。这个季节发生在每个半球的寒冷半年。有时可以预测流感活动,甚至可以在地理上进行跟踪。虽然每个季节的主要流感活动的开始因地点而异,但在任何特定地点,这些轻微的流行通常需要大约3周达到峰值,以及另外3周而显著减弱。流感疫苗接种已被用于减弱流感季节的影响;肺炎疫苗接种还可以减少流感季节的影响和并发症。由于北半球和南半球在一年中的不同时间入冬,因此实际上每年有两个流感季节。用于季节性流感的疫苗或季节性流感疫苗:针对流感季节中季节性出现的流感病毒的疫苗在本文中称为“用于季节性流感的疫苗或季节性流感疫苗”。免疫系统:免疫系统可以保护生物体免受感染。如果病原体突破生物体的物理屏障并进入该生物体,则先天免疫系统提供即时但非特异性的应答。如果病原体逃避这种先天应答,则脊椎动物具有第二层保护,即适应性免疫系统。在这里,免疫系统在感染期间调整其应答以改善其对病原体的识别。这种改善的应答随后在病原体被消除后以免疫记忆的形式保留,并且允许适应性免疫系统在每次遇到该病原体时发起更快和更强的攻击。据此,免疫系统包括先天免疫系统和适应性免疫系统。这两部分中的每一者都包括所谓的体液和细胞组成部分。免疫应答:免疫应答典型地可以是适应性免疫系统对特定抗原的特异性反应(所谓的特异性或适应性免疫应答)或先天免疫系统的非特异性反应(所谓的非特异性或先天性免疫应答)。本发明涉及适应性免疫系统的特定反应(适应性免疫应答)的核心。特别是,它涉及对病毒例如流感病毒的感染的适应性免疫应答。然而,这种特异性应答可以通过另外的非特异性反应(先天免疫应答)来支持。因此,本发明还涉及用于同时刺激先天和适应性免疫系统以引起有效的适应性免疫应答的化合物。适应性免疫系统:适应性免疫系统由高度专业化的系统性细胞和消除或防止病原性生长的过程组成。适应性免疫应答为脊椎动物免疫系统提供识别和记忆特定病原体(以产生免疫力),并在每次遇到该病原体时发起更强攻击的能力。由于体细胞超突变(体细胞突变频率增加的过程)和v(d)j重组(抗原受体基因区段的不可逆基因重组),该系统具有高度适应性。该机制允许少量基因产生大量不同的抗原受体,这些抗原受体然后在每个单独的淋巴细胞上独特地表达。因为基因重排导致每个细胞的dna发生不可逆转的变化,所以该细胞的所有子代(后代)随后将继承编码相同受体特异性的基因,包括作为长期特异性免疫力的关键的记忆b细胞和记忆t细胞。免疫网络理论是适应性免疫系统如何工作的理论,该理论基于t细胞、b细胞的受体的可变区与由t细胞和b细胞产生的具有可变区的分子的可变区之间的相互作用。适应性免疫应答:适应性免疫应答典型地被理解为是抗原特异性的。抗原特异性允许产生针对特定的抗原、病原体或病原体感染细胞而定制的应答。产生这些定制应答的能力在体内由“记忆细胞”维持。如果病原体不止一次感染身体,则这些特定的记忆细胞就会被用来快速消除它。在此上下文中,适应性免疫应答的第一步是激活初始抗原特异性t细胞或能够通过抗原呈递细胞诱导抗原特异性免疫应答的不同免疫细胞。这发生在初始t细胞不断通过的淋巴组织和器官中。可用作抗原呈递细胞的细胞类型尤其是树突细胞、巨噬细胞和b细胞。这些细胞中的每一种在引发免疫应答中具有不同的功能。树突细胞通过吞噬作用和巨胞饮作用摄取抗原,并通过与例如外来抗原接触而刺激以迁移到局部淋巴组织,在那里它们分化成成熟的树突细胞。巨噬细胞摄取颗粒抗原如细菌,并由感染原或其他适当的刺激诱导而表达mhc分子。b细胞经由其受体结合和内化可溶性蛋白抗原的独特能力对于诱导t细胞也可能是重要的。在mhc分子上呈递抗原导致t细胞的激活,从而诱导这些细胞增殖并分化成武装效应t细胞。效应t细胞最重要的功能是通过cd8+细胞毒性t细胞杀灭受感染的细胞并通过th1细胞激活巨噬细胞,它们共同构成细胞介导的免疫;以及通过th2和th1细胞激活b细胞产生不同类别的抗体,从而驱动体液免疫应答。t细胞通过其t细胞受体识别抗原,这些t细胞受体不直接识别和结合抗原,而是识别例如结合到其他细胞表面上的mhc分子的病原体来源的蛋白抗原的短肽片段。细胞免疫/细胞免疫应答:细胞免疫典型地涉及激活巨噬细胞、自然杀伤细胞(nk)、抗原特异性细胞毒性t淋巴细胞以及响应于抗原释放各种细胞因子。更一般地讲,细胞免疫不涉及抗体,而是涉及免疫系统的细胞的激活。细胞免疫应答的特征例如在于:激活能够在身体细胞中诱导凋亡的抗原特异性细胞毒性t淋巴细胞,这些身体细胞在其表面上展示抗原表位,例如被病毒感染的细胞、具有细胞内细菌的细胞和展示肿瘤抗原的癌细胞;激活巨噬细胞和自然杀伤细胞,从而使它们能够破坏病原体;以及刺激细胞分泌多种细胞因子,这些细胞因子影响参与适应性免疫应答和先天免疫应答的其他细胞的功能。体液免疫/体液免疫应答:体液免疫典型地是指抗体的产生和可能伴随的辅助过程。体液免疫应答的典型特征可例如在于:th2激活和细胞因子产生、生发中心形成和同种型转换、亲和力成熟和记忆细胞生成。体液免疫典型地也可以指抗体的效应子功能,这些功能包括病原体和毒素中和、经典补体激活、以及调理素促进吞噬作用和病原体消除。先天免疫系统:先天免疫系统(也称为非特异性免疫系统)包括以非特异性方式保护宿主免受其他生物体感染的细胞和机制。这意味着先天系统的细胞以一般方式识别并响应病原体,但与适应性免疫系统不同,它不会赋予宿主持久或保护性免疫力。先天免疫系统可以例如被病原体相关分子模式(pamp)受体例如toll样受体(tlr)的配体激活,或被其他辅助物质激活,例如脂多糖、tnf-α、cd40配体、或细胞因子、单核因子、淋巴因子、白细胞介素或趋化因子、il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12、il-13、il-14、il-15、il-16、il-17、il-18、il-19、il-20、il-21、il-22、il-23、il-24、il-25、il-26、il-27、il-28、il-29、il-30、il-31、il-32、il-33、ifn-α、ifn-β、ifn-γ、gm-csf、g-csf、m-csf、lt-β、tnf-α、生长因子、和hgh、人toll样受体tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10的配体、鼠toll样受体tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、tlr11、tlr12或tlr13的配体、nod样受体的配体、rig-i样受体的配体、免疫刺激性核酸、免疫刺激性rna(isrna)、cpg-dna、抗菌剂、或抗病毒剂。典型对,先天免疫系统的应答包括通过产生化学因子(包括称为细胞因子的特化化学介体)将免疫细胞募集到感染部位;激活补体级联;通过特化白细胞识别和移除器官、组织、血液和淋巴中存在的外来物质;通过称为抗原呈递的过程激活适应性免疫系统;和/或作为感染原的物理和化学屏障。佐剂/佐剂组分:从最广义上看,佐剂或佐剂组分典型地是可以改变(例如增强)其他药剂(例如药物或疫苗)的功效的(例如药理学或免疫学)药剂或组合物。通常,该术语在本发明的上下文中是指用作免疫原和/或其他药学活性化合物的载剂或辅助物质的化合物或组合物。它应在广义上解释,并且是指能够增加掺入所考虑的佐剂中或与该佐剂共同施用的抗原的免疫原性的广泛物质。在本发明的上下文中,佐剂将优选地增强本发明的活性剂的特异性免疫原性作用。典型地,“佐剂”或“佐剂组分”具有相同的含义并且可以互换使用。佐剂可以分为例如免疫增强剂、抗原递送系统或甚至其组合。术语“佐剂”典型地被理解为不包含自身赋予免疫力的药剂。佐剂通过例如促进抗原向免疫系统的呈递或诱导非特异性先天免疫应答而非特异性地辅助免疫系统增强抗原特异性免疫应答。此外,佐剂可以优选地例如通过例如将占主导的基于th2的抗原特异性应答转变为更基于th1的抗原特异性应答而调节抗原特异性免疫应答,反之亦然。因此,佐剂可以有利地调节细胞因子表达/分泌、抗原呈递、免疫应答类型等。免疫刺激性rna:在本发明上下文中的免疫刺激性rna(isrna)典型地可以是能够自身诱导先天免疫应答的rna。它通常不具有开放阅读框,因此不提供肽-抗原或免疫原,但例如通过与特定种类的toll样受体(tlr)或其他合适的受体结合而引发先天免疫应答。然而,当然的是,具有开放阅读框并编码肽/蛋白(例如抗原功能)的mrna也可以诱导先天免疫应答。抗原:在本发明的上下文中,“抗原”典型地是指这样的物质,它可以被免疫系统识别,优选地被适应性免疫系统识别,并且能够触发抗原特异性免疫应答,例如通过作为适应性免疫应答的一部分形成抗体和/或抗原特异性t细胞。典型地,抗原可以是或可以包含可以由mhc呈递给t细胞的肽或蛋白。在本发明的意义上,抗原可以是所提供的核酸分子(优选地如本文所定义的mrna)的翻译产物。在此上下文中,包含至少一个表位的肽和蛋白的片段、变体和衍生物也被理解为抗原。表位(也称为“抗原决定簇”):在本发明上下文中的蛋白的t细胞表位或部分可包含优选地具有约6个至约20个或甚至更多个氨基酸的长度的片段,例如,由mhci类分子加工和呈递的片段,这些片段优选地具有约8个至约10个氨基酸,例如8个、9个或10个(或甚至11个或12个氨基酸)的长度;或由mhcii类分子加工和呈递的片段,这些片段优选地具有约13个或更多个氨基酸,例如13个、14个、15个、16个、17个、18个、19个、20个或甚至更多个氨基酸的长度,其中这些片段可选自氨基酸序列的任何部分。这些片段典型地由t细胞以由肽片段和mhc分子组成的复合物的形式识别。b细胞表位典型地是位于如本文所定义的(天然)蛋白或肽抗原的外表面上的片段,这些片段优选地具有5个至15个氨基酸,更优选地具有5个至12个氨基酸,甚至更优选地具有6个至9个氨基酸,它们可以被抗体识别,即以其天然形式识别。蛋白或肽的此类表位此外可以选自此类蛋白或肽的任何本文提及的变体。在此上下文中,抗原决定簇可以是构象表位或不连续表位,这些表位由如本文所定义的蛋白或肽的区段组成,这些区段在如本文所定义的蛋白或肽的氨基酸序列中是不连续的,但是以三维结构聚集在一起;或者可以是由单一多肽链组成的连续表位或线性表位。疫苗:疫苗典型地被理解为提供至少一种抗原或抗原功能的预防性或治疗性材料。抗原或抗原功能可以刺激身体的适应性免疫系统提供适应性免疫应答。提供抗原的mrna:在本发明的上下文中,提供抗原的mrna典型地可以是这样的mrna,它具有至少一个可以被提供有该mrna的细胞或生物体翻译的开放阅读框。该翻译的产物是可以作为抗原优选免疫原的肽或蛋白。该产物也可以是由一种以上免疫原组成的融合蛋白,例如由两种或更多种衍生自相同或不同病毒蛋白的表位、肽或蛋白组成的融合蛋白,其中这些表位、肽或蛋白可通过接头序列连接。人工mrna(序列):人工mrna(序列)典型地可以被理解为不是天然存在的mrna分子。换句话说,人工mrna分子可以被理解为非天然mrna分子。这样的mrna分子由于其各个序列(不是天然存在的)和/或由于其他修饰(例如,不是天然存在的核苷酸结构修饰)而可能是非天然的。典型地,可以通过基因工程方法设计和/或产生人工mrna分子,以对应于期望的人工核苷酸序列(异源序列)。在此上下文中,人工序列通常是不天然存在的序列,即它与野生型序列相差至少一个核苷酸。术语“野生型”可以被理解为在自然界中存在的序列。此外,术语“人工核酸分子”不限于表示“一个单一分子”,而是典型地被理解为包含相同分子的整体。因此,它可以涉及等分试样中包含的多个相同分子。双/多顺反子mrna:典型地可具有两个(双顺反子)或更多个(多顺反子)开放阅读框(orf)(编码区或编码序列)的mrna。在此上下文中的开放阅读框是若干核苷酸三联体(密码子)的序列,该序列可以被翻译成肽或蛋白。这样的mrna的翻译产生两个(双顺反子)或更多个(多顺反子)不同的翻译产物(假设orf不同)。为了在真核生物中表达,此类mrna可以例如包含内部核糖体进入位点(ires)序列。单顺反子mrna:单顺反子mrna典型地可以是仅含一个开放阅读框(编码序列或编码区)的mrna。在此上下文中的开放阅读框是若干核苷酸三联体(密码子)的序列,该序列可以被翻译成肽或蛋白。5′-帽结构:5′-帽典型地是添加到mrna分子的5′-末端的经修饰的核苷酸(帽类似物),特别是鸟嘌呤核苷酸。优选地,使用5′-5′-三磷酸键添加5′-帽(也称为m7gpppn)。5′-帽结构的进一步实例包括甘油基、反向脱氧脱碱基残基(部分)、4’,5’亚甲基核苷酸、1-(β-d-赤藓呋喃糖基)核苷酸、4′-硫代核苷酸、碳环核苷酸、1,5-脱水己糖醇核苷酸、l-核苷酸、α-核苷酸、经修饰的碱基核苷酸、苏-戊呋喃糖基核苷酸、无环3’,4’-seco核苷酸、无环3,4-二羟基丁基核苷酸、无环3,5二羟基戊基核苷酸、3’-3’-反向核苷酸部分、3’-3’-反向脱碱基部分、3′-2′-反向核苷酸部分、3′-2′-反向脱碱基部分、1,4-丁二醇磷酸酯、3′-氨基磷酸酯、己基磷酸酯、氨基己基磷酸酯、3′-磷酸酯、3′-硫代磷酸酯、二硫代磷酸酯、或者桥接或非桥接甲基膦酸酯部分。这些经修饰的5′-帽结构可在本发明的上下文中用于修饰本发明组合物的mrna序列。可以在本发明的上下文中使用的进一步的经修饰的5′-帽结构是cap1(m7gpppn的相邻核苷酸的核糖的额外甲基化)、cap2(m7gpppn下游的第2个核苷酸的核糖的额外甲基化)、cap3(m7gpppn下游的第3个核苷酸的核糖的额外甲基化)、cap4(m7gpppn下游的第4个核苷酸的核糖的额外甲基化)、arca(抗反向帽类似物)、经修饰的arca(例如,经硫代磷酸酯修饰的arca)、肌苷、n1-甲基-鸟苷、2′-氟-鸟苷、7-脱氮-鸟苷、8-氧代-鸟苷、2-氨基-鸟苷、lna-鸟苷和2-叠氮基-鸟苷。在本发明的上下文中,5′-帽结构也可以使用ccap类似物在化学rna合成或rna体外转录(共转录加帽)中形成,或者帽结构可以使用加帽酶(例如,可商购获得的加帽试剂盒)在体外形成。帽类似物:帽类似物是指具有帽功能的不可聚合的二核苷酸,因为它促进翻译或定位,和/或当掺入rna分子的5′末端时防止rna分子的降解。不可聚合是指帽类似物将仅在5′端掺入,因为它不具有5′三磷酸,因此不能通过模板依赖性rna聚合酶在3′方向上延伸。帽类似物包括但不限于:选自由m7gpppg、m7gpppa、m7gpppc组成的组的化学结构;未甲基化的帽类似物(例如gpppg);二甲基化帽类似物(例如m2,7gpppg)、三甲基化帽类似物(例如m2,2,7gpppg)、二甲基化对称帽类似物(例如m7gpppm7g)或抗反向帽类似物(例如arca;m7,2’omegpppg、m7,2’dgpppg、m7,3’omegpppg、m7,3’dgpppg及其四磷酸衍生物)(stepinski等人,2001.rna7(10):1486-95)。先前已经描述了进一步的帽类似物(us7,074,596、wo2008/016473、wo2008/157688、wo2009/149253、wo2011/015347和wo2013/059475)。最近描述了n7-(4-氯苯氧基乙基)取代的二核苷酸帽类似物的合成(kore等人(2013)bioorg.med.chem.[生物有机与药物化学]21(15):4570-4)。poly(c)序列:poly-(c)序列典型地是胞嘧啶核苷酸的长序列,典型地约10个至约200个胞嘧啶核苷酸,优选地约10个至约100个胞嘧啶核苷酸,更优选地约10个至约70个胞嘧啶核苷酸,或甚至更优选地约20个至约50个或甚至约20个至约30个胞嘧啶核苷酸。poly(c)序列可以优选地位于核酸所含的编码区的3′。poly-a尾/序列:poly-a尾(也称为“3’-poly(a)尾或poly(a)序列”)典型地是添加到rna的3′-末端的多达约400个腺苷核苷酸的腺苷核苷酸长序列,例如从约25个至约400个,优选地从约50个至约400个,更优选地从约50个至约300个,甚至更优选地从约50个至约250个,最优选地从约60个至约250个腺苷核苷酸。此外,poly(a)序列或poly(a)尾可以通过rna的酶促多聚腺苷酸化在体外生成,例如使用衍生自大肠杆菌(e.coli)或酵母的poly(a)聚合酶。多聚腺苷酸化:多聚腺苷酸化典型地被理解为向核酸分子(例如rna分子,例如向预成熟rna)添加poly(a)序列。多聚腺苷酸化可以通过所谓的多聚腺苷酸化信号诱导。该信号优选地位于核酸分子(例如rna分子)的3′末端的一段核苷酸内,以进行多聚腺苷酸化。多聚腺苷酸化信号典型地包含由腺嘌呤和尿嘧啶/胸腺嘧啶核苷酸组成的六聚体,优选六聚体序列aauaaa。也可以想到其他序列,优选六聚体序列。多聚腺苷酸化典型地在前mrna(也称为预成熟mrna)的加工过程中发生。典型地,rna成熟(从前mrna到成熟mrna)包括多聚腺苷酸化步骤。3′-未翻译区(3′-utr):3′-utr典型地是mrna的一部分,它位于mrna的蛋白编码区(即开放阅读框)与poly(a)序列之间。mrna的3′-utr不翻译成氨基酸序列。3′-utr序列通常由在基因表达过程中转录成相应mrna的基因编码。首先将基因组序列转录成预成熟mrna,它包含任选的内含子。然后在成熟过程中将预成熟mrna进一步加工成成熟mrna。该成熟过程包括以下步骤:5′-加帽,剪接预成熟mrna以切除任选的内含子以及修饰3′-末端,例如预成熟mrna的3′-末端的多聚腺苷酸化和任选的核酸内切酶或核酸外切酶裂解等。在本发明的上下文中,3′-utr对应于成熟mrna的以下序列:该序列位于蛋白编码区的终止密码子的3′,优选地紧邻蛋白编码区的终止密码子的3′,并且延伸到poly(a)序列的5′侧,优选地延伸到紧邻poly(a)序列5′的核苷酸。术语“对应于”是指3′-utr序列可以是rna序列,例如用于限定3′-utr序列的mrna序列,或者可以是对应于这种rna序列的dna序列。在本发明的上下文中,术语“基因的3′-utr”(例如“白蛋白基因的3′-utr”)是对应于衍生自该基因的成熟mrna(即,通过该基因的转录和预成熟mrna的成熟而获得的mrna)的3′-utr的序列。术语“基因的3′-utr”涵盖3′-utr的dna序列和rna序列。5′-未翻译区(5′-utr):5′-utr典型地被理解为信使rna(mrna)的特定部段。它位于mrna的开放阅读框的5′。典型地,5′-utr始于转录起始位点,并终止于开放阅读框的起始密码子之前的一个核苷酸。5′-utr可以包含用于控制基因表达的元件,也称为调控元件。此类调控元件可以是例如核糖体结合位点或5′-端寡嘧啶束(oligopyrimidinetract)。5′-utr可以例如通过添加5′-帽而转录后修饰。在本发明的上下文中,5′-utr对应于成熟mrna的位于5′-帽与起始密码子之间的序列。优选地,5′-utr对应于这样的序列:该序列从位于5′-帽的3′的核苷酸,优选地从紧邻5′-帽的3′的核苷酸延伸至位于蛋白编码区的起始密码子的5′的核苷酸,优选地延伸至紧邻蛋白编码区的起始密码子的5′的核苷酸。紧邻成熟mrna的5′-帽的3′的核苷酸典型地对应于转录起始位点。术语“对应于”是指5′-utr序列可以是rna序列,例如用于限定5′-utr序列的mrna序列,或者可以是对应于这种rna序列的dna序列。在本发明的上下文中,术语“基因的5′-utr”(例如“top基因的5′-utr”)是对应于衍生自该基因的成熟mrna(即,通过该基因的转录和预成熟mrna的成熟而获得的mrna)的5′-utr的序列。术语“基因的5′-utr”涵盖5′-utr的dna序列和rna序列。5′-端寡嘧啶束(top):5’-端寡嘧啶束(top)典型地是位于核酸分子的5′-端区域(例如某些mrna分子的5′-端区域或某些基因的功能实体例如转录区的5′-端区域)的一段嘧啶核苷酸。该序列以通常对应于转录起始位点的胞苷开始,然后是一段通常约3个至30个的嘧啶核苷酸。例如,top可包括3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或甚至更多个核苷酸。该嘧啶段并因此5′-top终止于位于top下游的第一个嘌呤核苷酸5′的一个核苷酸。含有5′-端寡嘧啶束的信使rna通常称为topmrna。因此,提供此类信使rna的基因被称为top基因。已例如在编码肽延伸因子和核糖体蛋白的基因和mrna中发现了top序列。top基序:在本发明的上下文中,top基序是对应于如上所定义的5′-top的核酸序列。因此,在本发明的上下文中top基序优选地是具有3个至30个核苷酸长度的一段嘧啶核苷酸。优选地,top基序由至少3个嘧啶核苷酸,优选至少4个嘧啶核苷酸,优选至少5个嘧啶核苷酸,更优选至少6个核苷酸,更优选至少7个核苷酸,最优选至少8个嘧啶核苷酸组成,其中嘧啶核苷酸段优选地在其5′-末端始于胞嘧啶核苷酸。在top基因和topmrna中,top基序优选地在其5′-末端始于转录起始位点,并终止于所述基因或mrna中的第一个嘌呤残基5′的一个核苷酸。本发明意义上的top基序优选地位于序列的代表5′-utr的5′-末端,或位于序列的编码5′-utr的5′-末端。因此,优选地,在本发明的意义上,如果3个或更多个嘧啶核苷酸的段位于相应序列(例如本发明的mrna、本发明的mrna的5’-utr元件、或衍生自如本文所述的top基因的5′-utr的核酸序列)的5′末端,则该段被称为“top基序”。换句话说,不位于5′-utr或5′-utr元件的5′-末端而是位于5′-utr或5′-utr元件内的任何位置的3个或更多个嘧啶核苷酸的段优选地不称为“top基序”。top基因:top基因典型地特征在于存在5′-端寡嘧啶束。此外,大多数top基因的特征在于与生长相关的翻译调控。然而,具有组织特异性翻译调控的top基因也是已知的。如上所定义,top基因的5′-utr对应于衍生自top基因的成熟mrna的5′-utr的序列,该序列优选地从位于5′-帽的3’的核苷酸延伸到位于起始密码子的5′的核苷酸。top基因的5′-utr典型地不包含任何起始密码子,优选地无上游aug(uaug)或上游开放阅读框(uorf)。其中,上游aug和上游开放阅读框典型地被理解为出现在应翻译的开放阅读框的起始密码子(aug)的5′的aug和开放阅读框。top基因的5′-utr通常相当短。top基因的5′-utr的长度可以在20个核苷酸直至500个核苷酸之间变化,并且典型地小于约200个核苷酸,优选地小于约150个核苷酸,更优选地小于约100个核苷酸。本发明意义上的top基因的示例性5′-utr是在根据国际专利申请wo2013/143700的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422的序列或其同源物或变体中从第5位的核苷酸延伸到紧邻起始密码子(例如atg)的5′的核苷酸的核酸序列,该专利申请的披露内容以援引方式并入本文。在此上下文中,top基因的5′-utr的特别优选的片段是缺少5′-top基序的top基因的5′-utr。术语“top基因的5′-utr”优选地是指天然存在的top基因的5′-utr。核酸序列特别是mrna的片段:核酸序列的片段由一段连续核苷酸组成,该段连续核苷酸对应于作为该片段的核酸序列的基础的全长核酸序列中的一段连续核苷酸,它占该全长核酸序列的至少20%、优选至少30%、更优选至少40%、更优选至少50%、甚至更优选至少60%、甚至更优选至少70%、甚至更优选至少80%并且最优选至少90%。在本发明的意义上,这样的片段优选地是全长核酸序列的功能片段。在此上下文中,“核酸序列的片段”(例如mrna序列的片段)优选地是编码如本文所述的蛋白或其变体的片段的核酸序列。更优选地,表述“核酸序列的片段”是指与相应的全长核酸序列具有至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%,优选至少70%,更优选至少80%,甚至更优选至少85%,甚至更优选至少90%并且最优选至少95%或甚至97%的序列同一性的核酸序列。核酸序列特别是mrna的变体:核酸序列的变体是指形成核酸序列的基础的核酸序列的变体。例如,与衍生出变体的核酸序列相比,变体核酸序列可以表现出一个或多个核苷酸缺失、插入、添加和/或置换。优选地,核酸序列的变体与衍生出该变体的核酸序列至少40%、优选至少50%、更优选至少60%、更优选至少70%、甚至更优选至少80%、甚至更优选至少90%、最优选至少95%相同。优选地,变体是功能变体。核酸序列的“变体”在这样的核酸序列的10个、20个、30个、50个、75个或100个核苷酸的段上可具有至少70%、75%、80%、85%、90%、95%、98%或99%的核苷酸同一性。稳定化的核酸,优选mrna:稳定化的核酸,优选mrna,典型地表现出增加对体内降解(例如核酸外切酶或核酸内切酶降解)和/或离体降解(例如,被施用疫苗前的制造过程降解,例如,在制备待施用的疫苗溶液的过程中)的抗性的修饰。rna的稳定化可以例如通过提供5′-帽结构、poly-a尾或任何其他utr修饰来实现。它也可以通过化学修饰或对核酸的g/c含量的修饰来实现。各种其他方法在本领域中是已知的并且在本发明的上下文中是可想到的。rna体外转录:术语“rna体外转录”或“体外转录”涉及rna在无细胞系统中(体外)合成的过程。dna,特别是质粒dna,被用作生成rna转录物的模板。rna可以通过适当dna模板的dna依赖性体外转录获得,根据本发明,该模板优选地是线性化的质粒dna模板。用于控制体外转录的启动子可以是任何dna依赖性rna聚合酶的任何启动子。dna依赖性rna聚合酶的特定实例是t7、t3和sp6rna聚合酶。用于体外rna转录的dna模板可以通过以下方式获得:克隆核酸,特别是对应于待体外转录的相应rna的cdna,然后将其导入适当的体外转录载体中,例如导入质粒dna中。在本发明的优选实施例中,在体外转录之前,用合适的限制酶将dna模板线性化。cdna可以通过mrna的逆转录或通过化学合成获得。此外,用于体外rna合成的dna模板也可以通过基因合成获得。用于体外转录的方法是本领域已知的(参见例如geall等人(2013)semin.immunol.[免疫学研讨文辑]25(2):152-159;brunelle等人(2013)methodsenzymol.[酶学方法]530:101-14)。所述方法中使用的试剂典型地包括:1)具有启动子序列的线性化dna模板,该启动子序列具有针对其相应的rna聚合酶(例如噬菌体编码的rna聚合酶)的高结合亲和力;2)四种碱基(腺嘌呤、胞嘧啶、鸟嘌呤和尿嘧啶)的核糖核苷三磷酸(ntp);3)任选地,如上所定义的帽类似物(例如m7g(5’)ppp(5’)g(m7g));4)能够与线性化dna模板内的启动子序列结合的dna依赖性rna聚合酶(例如t7、t3或sp6rna聚合酶);5)任选地,灭活任何污染性核糖核酸酶(rna酶)的rna酶抑制剂;6)任选地,降解焦磷酸盐的焦磷酸酶,焦磷酸盐可能会抑制转录;7)mgcl2,它提供mg2+离子作为聚合酶的辅因子;8)保持合适ph值的缓冲剂,它也可以含有最佳浓度的抗氧化剂(例如dtt)和/或多胺(例如亚精胺)。全长蛋白:如本文所用的术语“全长蛋白”典型地是指基本上包含天然存在的蛋白的整个氨基酸序列的蛋白。然而,氨基酸的置换(例如,由于蛋白的突变)也包括在术语全长蛋白中。蛋白片段:在本发明的上下文中蛋白或肽的“片段”典型地可包含如本文所定义的蛋白或肽的序列,就其氨基酸序列(或其编码的核酸分子)而言,与原始(天然)蛋白的氨基酸序列(或其编码的核酸分子)相比,n端和/或c端被截短。因此,这种截短可以在氨基酸水平上或相应地在核酸水平上发生。因此,关于如本文所定义的这种片段的序列同一性可优选地指如本文所定义的完整蛋白或肽或指这种蛋白或肽的完整(编码)核酸分子。在此上下文中,蛋白片段典型地可包含具有与相应的天然存在的全长蛋白的氨基酸序列至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%,优选至少70%,更优选至少80%,甚至更优选至少85%,甚至更优选至少90%,并且最优选至少95%或甚至97%的序列同一性的氨基酸序列。在本发明的上下文中,蛋白或肽的片段还可包含如本文所定义的蛋白或肽的序列,它具有例如至少5个氨基酸的长度,优选至少6个氨基酸的长度,优选至少7个氨基酸,更优选至少8个氨基酸,甚至更优选至少9个氨基酸;甚至更优选至少10个氨基酸;甚至更优选至少11个氨基酸;甚至更优选至少12个氨基酸;甚至更优选至少13个氨基酸;甚至更优选至少14个氨基酸;甚至更优选至少15个氨基酸;甚至更优选至少16个氨基酸;甚至更优选至少17个氨基酸;甚至更优选至少18个氨基酸;甚至更优选至少19个氨基酸;甚至更优选至少20个氨基酸;甚至更优选至少25个氨基酸;甚至更优选至少30个氨基酸;甚至更优选至少35个氨基酸;甚至更优选至少50个氨基酸;或最优选至少100个氨基酸。例如,这样的片段可具有约6个至约20个或甚至更多个氨基酸的长度,例如,由mhci类分子加工和呈递的片段,这些片段优选地具有约8个至约10个氨基酸,例如8个、9个或10个(或甚至6个、7个、11个或12个氨基酸)的长度;或由mhcii类分子加工和呈递的片段,这些片段优选地具有约13个或更多个氨基酸,例如13个、14个、15个、16个、17个、18个、19个、20个或甚至更多个氨基酸的长度,其中这些片段可选自氨基酸序列的任何部分。这些片段典型地由t细胞以由肽片段和mhc分子组成的复合物的形式识别,即,这些片段典型地不以其天然形式识别。蛋白或肽的片段可包含那些蛋白或肽的至少一个表位。此外,蛋白的结构域(如细胞外结构域、细胞内结构域或跨膜结构域)以及蛋白的缩短或截短形式也可以被理解为包括蛋白的片段。蛋白的变体:可以产生如本发明上下文中所定义的蛋白或肽的“变体”,这些变体的氨基酸序列与原始序列存在一个或多个突变的差异,例如一个或多个置换的、插入的和/或缺失的氨基酸。优选地,与全长天然蛋白相比,这些片段和/或变体具有相同的生物学功能或特异性活性,例如其特异性抗原特性。如本发明上下文中所定义的蛋白或肽的“变体”可包含与其天然(即非突变的生理学)序列相比的一个或多个保守氨基酸置换。那些氨基酸序列以及特别是它们的编码核苷酸序列归入如本文所定义的术语变体中。源自相同类别的氨基酸彼此交换的置换称为保守置换。特别地,这些是具有脂族侧链的氨基酸、具有带正电荷或带负电荷的侧链的氨基酸、侧链或氨基酸中具有芳族基团的氨基酸、其侧链可以进入氢桥(例如具有羟基官能团的侧链)的氨基酸。这意味着,例如,具有极性侧链的氨基酸被具有同样极性侧链的另一种氨基酸取代,或者例如,特征在于疏水性侧链的氨基酸被具有同样疏水性侧链的另一种氨基酸置换(例如丝氨酸(苏氨酸)被苏氨酸(丝氨酸)置换,或亮氨酸(异亮氨酸)被异亮氨酸(亮氨酸)置换)。特别地,插入和置换可以位于不引起对三维结构的修饰或不影响结合区的那些序列位置。由一个或多个插入或者一个或多个缺失对三维结构的修饰可以容易地例如使用cd光谱(圆二色谱)确定(urry,1985,absorption,circulardichroismandordofpolypeptides[多肽的吸收、圆二色性和ord],载于:modernphysicalmethodsinbiochemistry[生物化学中的现代物理],neuberger等人(编),阿姆斯特丹爱思唯尔出版社(elsevier,amsterdam))。蛋白或肽的“变体”在这样的蛋白或肽的10个、20个、30个、50个、75个或100个氨基酸的段上可具有至少70%、75%、80%、85%、90%、95%、98%或99%的氨基酸同一性。此外,可以由核酸分子编码的如本文所定义的蛋白或肽的变体也可以包含那些序列,其中编码核酸序列的核苷酸根据遗传密码的简便性进行交换,而不会导致蛋白或肽的相应氨基酸序列的改变,即氨基酸序列或其至少部分不会与原始氨基酸相比存在上述含义内的一个或多个突变的差异。序列的同一性:为了确定两个序列(例如,如本文所定义的核酸序列或氨基酸序列,优选地由本文定义的聚合物载剂的核酸序列编码的氨基酸序列、或氨基酸序列本身)相同的百分比,可以对序列进行比对以便随后相互比较。因此,例如,可以将第一序列的某位置与第二序列的对应位置进行比较。如果第一序列中的某位置被与第二序列中的某位置处的组分(残基)相同的组分(残基)占据,则这两个序列在该位置是相同的。如果不是这种情况,则序列在此位置不同。如果与第一序列相比在第二序列中发生插入,则可以将间隙插入第一序列以允许进一步比对。如果与第一序列相比在第二序列中发生缺失,则可以将间隙插入第二序列以允许进一步比对。两个序列相同的百分比则是相同位置的数量除以位置总数(包括仅在一个序列中占据的那些位置)的函数。可以使用数学算法确定两个序列相同的百分比。可以使用的数学算法的优选但非限制性的实例是karlin等人(1993),pnasusa[美国国家科学院院刊],90:5873-5877或altschul等人(1997),nucleicacidsres.[核酸研究],25:3389-3402的算法。这样的算法集成在blast程序中。可以通过该程序鉴定在一定程度上与本发明的序列相同的序列。蛋白或肽的衍生物:肽或蛋白的衍生物典型地被理解为衍生自另一分子(例如所述肽或蛋白)的分子。肽或蛋白的“衍生物”还涵盖含有本发明中使用的肽或蛋白的融合体。例如,融合体包含标记,例如表位,例如flag表位或v5表位。例如,表位是flag表位。这样的标签可用于例如纯化融合蛋白。药学有效量:在本发明上下文中的药学有效量典型地被理解为足以诱导免疫应答的量。载剂/聚合物载剂:在本发明上下文中的载剂典型地可以是促进另一种化合物的转运和/或复合的化合物。所述载剂可与所述另一种化合物形成复合物。聚合物载剂是由聚合物形成的载剂。媒介物:一种药剂,例如载剂,它通常可以在药物组合物或疫苗中使用,以便于将药物组合物或疫苗的组分施用给个体。喷射注射:如本文所用,术语“喷射注射”是指一种无针注射方法,其中迫使含有至少一种本发明的mrna序列和任选地其他合适的赋形剂的流体通过孔口,从而产生高压超细液流,该液流能够穿透哺乳动物皮肤,并且取决于注射设置,穿透皮下组织或肌肉组织。原则上,液流在皮肤中形成孔,液流通过该孔被推入目标组织。优选地,喷射注射用于皮内、皮下或肌内注射根据本发明的mrna序列。在优选的实施例中,喷射注射用于肌内注射根据本发明的mrna序列。在进一步优选的实施例中,喷射注射用于皮内注射根据本发明的mrna序列。具体实施方式本发明基于发明人惊奇的发现,即包含在脂质纳米颗粒(lnp)中的编码至少一种抗原肽或蛋白的mrna以非常低的剂量和不需要频繁施用的给药方案诱导针对所编码的抗原肽或蛋白的非常有效的抗原特异性免疫应答。包含在脂质纳米颗粒(lnp)中的编码至少一种抗原肽或蛋白的本发明的mrna的进一步优点是:-诱导强烈的体液免疫应答-诱导b细胞记忆-免疫保护起效更快-所诱导的免疫应答的长期性-诱导广泛的细胞t细胞应答-诱导(局部和瞬时)促炎性环境-不诱导全身细胞因子或趋化因子应答-耐受良好、无副作用、无毒-有利的稳定性特征-制剂与许多不同的抗原相容:基于相同的(生产)技术可行的更大抗原混合物-没有载体免疫,即技术可用于针对多种(不同的)抗原多次接种相同的受试者-生产的速度、适应性、简易性和可扩展性特别地,本发明涉及含有mrna的脂质纳米颗粒及其用途。为了适合于本发明,脂质纳米颗粒至少包含:(i)如下定义的阳离子脂质和/或peg-脂质;和(ii)包含编码抗原肽或蛋白的mrna序列的mrna化合物。含有mrna的脂质纳米颗粒可包含进一步的化合物,例如一种或多种中性脂质、类固醇、和所述化合物的组合。合适的化合物将在下面详细描述。包含编码抗原肽或蛋白的mrna序列的mrna化合物可以是mrna分子。在本发明的一个实施例中,mrna化合物是天然和未修饰的mrna。在本发明的上下文中,天然和未修饰的mrna涵盖体外生成的mrna,没有化学修饰或序列的改变。在本发明的替代性实施例中,mrna化合物包括人工mrna。在本发明的上下文中,人工mrna涵盖具有化学修饰、序列修饰或非天然序列的mrna。在本发明的优选实施例中,mrna化合物不包含核苷修饰,特别是没有碱基修饰。在进一步的实施例中,mrna化合物不包含1-甲基假尿苷修饰。在一个优选的实施例中,mrna仅包含天然存在的核苷。在进一步优选的实施例中,mrna化合物不包含任何化学修饰并且任选地包含序列修饰。在本发明的进一步优选的实施例中,mrna化合物仅包含天然存在的核苷腺嘌呤、尿嘧啶、鸟嘌呤和胞嘧啶。根据本发明的某些实施例,mrna序列是单顺反子、双顺反子或多顺反子的,优选地如本文所定义。双顺反子或多顺反子mrna中的编码序列优选地编码如本文所定义的不同肽或蛋白或者其片段或变体。优选地,编码两种或更多种肽或蛋白的编码序列可以在双顺反子或多顺反子mrna中被至少一个ires(内部核糖体进入位点)序列分开,如下文所定义。因此,术语“编码两种或更多种肽或蛋白”可以意指但不限于:双顺反子或甚至多顺反子mrna可以编码例如至少两种、三种、四种、五种、六种或更多种(优选不同的)在本文所提供的定义内的肽或蛋白或者其片段或变体。更优选地,但不限于此,双顺反子或甚至多顺反子mrna可以编码例如至少两种、三种、四种、五种、六种或更多种(优选不同的)如本文所定义的肽或蛋白或者其如本文所定义的片段或变体。在此上下文中,如上所定义的所谓的ires(内部核糖体进入位点)序列可以作为唯一的核糖体结合位点起作用,但是它也可以用于提供如上所定义的双顺反子或甚至多顺反子mrna,该mrna编码将由核糖体彼此独立地翻译的多种肽或蛋白。可根据本发明使用的ires序列的实例是来自以下病毒的那些:小核糖核酸病毒(例如fmdv)、瘟病毒(cffv)、脊髓灰质炎病毒(pv)、脑心肌炎病毒(ecmv)、口蹄疫病毒(fmdv)、丙型肝炎病毒(hcv)、经典猪瘟病毒(csfv)、小鼠白血病病毒(mlv)、猴免疫缺陷病毒(siv)或蟋蟀麻痹病毒(crpv)。根据进一步的实施例,根据本发明的mrna序列的该至少一个编码区可以编码至少两种、三种、四种、五种、六种、七种、八种和更多种如本文所定义的连接有或没有氨基酸接头序列的肽或蛋白(或其片段和衍生物),其中所述接头序列可包括刚性接头、柔性接头、可切割接头(例如自切割肽)或其组合。其中,这些肽或蛋白可以是相同的或不同的或其组合。特定的肽或蛋白组合可以由编码至少两种如本文所解释的肽或蛋白的所述mrna编码(在本文中也称为“多抗原构建体/mrna”)。在本发明的特定方面,脂质纳米颗粒包含mrna化合物,该mrna化合物包含编码抗原肽或蛋白、或者其片段、变体或衍生物的mrna序列。这些抗原肽或蛋白可以衍生自病原性抗原、肿瘤抗原、过敏性抗原或自身免疫性自身抗原,优选地如本文所定义。在本发明的上下文中,抗原肽或蛋白优选地排除荧光素酶。病原性抗原:此类病原性抗原衍生自病原性生物体,特别是细菌、病毒或原生动物(多细胞)病原性生物体,这些生物体引起受试者,特别是哺乳动物受试者,更特别是人的免疫反应。更具体地,病原性抗原优选是表面抗原,例如位于病毒或细菌或原生动物生物体的表面上的蛋白(或蛋白片段,例如表面抗原的外部部分)。病原性抗原是优选地衍生自与传染病相关的病原体的肽或蛋白抗原,这些肽或蛋白抗原优选地选自衍生自以下病原体的抗原:鲍氏不动杆菌(acinetobacterbaumannii)、无形体属(anaplasma)、嗜吞细胞无形体(anaplasmaphagocytophilum)、巴西钩虫(ancylostomabraziliense)、十二指肠钩虫(ancylostomaduodenale)、溶血隐秘杆菌(arcanobacteriumhaemolyticum)、人蛔虫(ascarislumbricoides)、曲霉菌属(aspergillus)、星状病毒科(astroviridae)、巴贝虫属(babesia)、炭疽芽孢杆菌(bacillusanthracis)、蜡状芽孢杆菌(bacilluscereus)、汉氏巴尔通体(bartonellahenselae)、bk病毒、人芽囊原虫(blastocystishominis)、皮炎芽生菌(blastomycesdermatitidis)、百日咳博德特氏菌(bordetellapertussis)、伯氏疏螺旋体(borreliaburgdorferi)、疏螺旋体属(borrelia)、疏螺旋体属物种(borreliaspp)、布鲁氏菌属(brucella)、马来布鲁线虫(brugiamalayi)、布尼亚病毒科(bunyaviridae)、洋葱伯克氏菌(burkholderiacepacia)和其他伯克氏菌属物种、鼻疽伯克氏菌(burkholderiamallei)、类鼻疽伯克氏菌(burkholderiapseudomallei)、杯状病毒科、弯曲杆菌属(campylobacter)、白色念珠菌(candidaalbicans)、念珠菌属物种、沙眼衣原体(chlamydiatrachomatis)、肺炎衣原体(chlamydophilapneumoniae)、鹦鹉热衣原体(chlamydophilapsittaci)、cjd朊病毒、华支睾吸虫(clonorchissinensis)、肉毒梭菌(clostridiumbotulinum)、艰难梭菌(clostridiumdifficile)、产气荚膜梭菌(clostridiumperfringens)、产气荚膜梭菌、梭菌属物种(clostridiumspp)、破伤风梭菌(clostridiumtetani)、球孢菌属物种(coccidioidesspp)、冠状病毒、白喉棒杆菌(corynebacteriumdiphtheriae)、伯纳特氏立克次氏体(coxiellaburnetii)、克里米亚-刚果出血热病毒、新型隐球菌(cryptococcusneoformans)、隐孢子虫属(cryptosporidium)、巨细胞病毒(cmv)、登革热病毒(den-1、den-2、den-3和den-4)、脆弱双核阿米巴(dientamoebafragilis)、埃博拉病毒(ebov)、棘球属(echinococcus)、中查菲埃立克体(ehrlichiachaffeensis)、伊氏埃立克体(ehrlichiaewingii)、埃立克体属(ehrlichia)、溶组织内阿米巴(entamoebahistolytica)、肠球菌属(enterococcus)、肠道病毒、肠道病毒、主要为柯萨奇病毒a和肠道病毒71(ev71)、表皮癣菌属物种(epidermophytonspp)、eb病毒(ebv)、大肠杆菌(escherichiacoli)o157:h7、o111和o104:h4、肝片吸虫(fasciolahepatica)和巨片吸虫(fasciolagigantica)、ffi朊病毒、丝虫目超家族(filarioideasuperfamily)、黄病毒、土拉热弗朗西丝菌(francisellatularensis)、梭菌属(fusobacterium)、念珠地丝菌(geotrichumcandidum)、肠贾第虫(giardiaintestinalis)、颚口线虫属物种(gnathostomaspp)、gss朊病毒、瓜纳里托病毒、杜克雷嗜血杆菌(haemophilusducreyi)、流感嗜血菌(haemophilusinfluenzae)、幽门螺杆菌(helicobacterpylori)、亨尼病毒(亨德拉病毒,尼帕病毒)、甲型肝炎病毒、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、丁型肝炎病毒、戊型肝炎病毒、单纯疱疹病毒1和2(hsv-1和hsv-2)、荚膜组织胞浆菌(histoplasmacapsulatum)、hiv(人类免疫缺陷病毒)、威尼克外瓶霉(hortaeawerneckii)、人博卡病毒(hbov)、人疱疹病毒6(hhv-6)和人疱疹病毒7(hhv-7)、人偏肺病毒(hmpv)、人乳头瘤病毒(hpv)、人副流感病毒(hpiv)、日本脑炎病毒、jc病毒、胡宁病毒、金氏金氏菌(kingellakingae)、肉芽肿杆菌(klebsiellagranulomatis)、克鲁朊病毒(kuruprion)、拉沙病毒、嗜肺军团病杆菌(legionellapneumophila)、利什曼原虫属(leishmania)、钩端螺旋体属(leptospira)、单核细胞增多性李斯特菌(listeriamonocytogenes)、淋巴细胞性脉络丛脑膜炎病毒(lcmv)、马丘波病毒、马拉色霉菌属物种(malasseziaspp)、马尔堡病毒、麻疹病毒、横川后殖吸虫(metagonimusyokagawai)、微孢子虫门(microsporidiaphylum)、接触传染性软疣病毒(mcv)、腮腺炎病毒、麻风分枝杆菌(mycobacteriumleprae)和弥漫型麻风分枝杆菌(mycobacteriumlepromatosis)、结核分枝杆菌(mycobacteriumtuberculosis)、溃疡分枝杆菌(mycobacteriumulcerans)、肺炎支原体(mycoplasmapneumoniae)、福氏耐格里阿米巴原虫(naegleriafowleri)、美洲板口线虫(necatoramericanus)、淋病奈瑟氏菌(neisseriagonorrhoeae)、脑膜炎奈瑟氏菌(neisseriameningitidis)、星状诺卡氏菌(nocardiaasteroides)、诺卡氏菌属物种(nocardiaspp)、盘尾丝虫(onchocercavolvulus)、恙虫病立克次氏体(orientiatsutsugamushi)、正粘病毒科(orthomyxoviridae)(流感)、巴西副球孢子菌(paracoccidioidesbrasiliensis)、并殖吸虫属物种(paragonimusspp)、卫氏并殖吸虫(paragonimuswestermani)、细小病毒b19、巴斯德菌属(pasteurell)、疟原虫属(plasmodiu)、杰氏肺囊虫(pneumocystisjirovecii)、脊髓灰质炎病毒、狂犬病毒、呼吸道合胞病毒(rsv)、鼻病毒、鼻病毒、小蛛立克次氏体(rickettsiaakari)、立克次氏体属(rickettsia)、普氏立克次氏体(rickettsiaprowazekii)、立氏立克次氏体(rickettsiarickettsii)、斑疹伤寒立克次氏体(rickettsiatyphi)、裂谷热病毒、轮状病毒、风疹病毒、萨比亚病毒、沙门菌属(salmonella)、疥螨(sarcoptesscabiei)、sars冠状病毒、血吸虫属(schistosoma)、志贺氏菌属(shigella)、辛诺柏病毒、汉坦病毒、申克孢子丝菌(sporothrixschenckii)、葡萄球菌属(staphylococcus)、葡萄球菌属、无乳链球菌(streptococcusagalactiae)、肺炎链球菌(streptococcuspneumoniae)、酿脓链球菌(streptococcuspyogenes)、粪类圆线虫(strongyloidesstercoralis)、绦虫属(taenia)、猪肉绦虫(taeniasolium)、蜱传脑炎病毒(tbev)、犬弓蛔虫(toxocaracanis)或猫弓蛔虫(toxocaracati)、刚地弓形虫(toxoplasmagondii)、苍白密螺旋体(treponemapallidum)、旋毛虫(trichinellaspiralis)、阴道毛滴虫(trichomonasvaginalis)、发癣菌属物种(trichophytonspp)、鞭形鞭虫(trichuristrichiura)、布氏锥虫(trypanosomabrucei)、克氏锥虫(trypanosomacruzi)、解脲支原体(ureaplasmaurealyticum)、水痘-带状疱疹病毒(vzv)、水痘-带状疱疹病毒(vzv)、大天花或小天花、vcjd朊病毒、委内瑞拉马脑炎病毒、霍乱弧菌(vibriocholerae)、西尼罗河病毒、西部马脑炎病毒、班氏吴策线虫(wuchereriabancrofti)、黄热病病毒、小肠结肠炎耶尔森氏菌(yersiniaenterocolitica)、鼠疫耶尔森氏菌(yersiniapestis)和假结核耶尔森氏菌(yersiniapseudotuberculosis)。在此上下文中,特别优选的是来自选自以下的病原体的抗原:流感病毒、呼吸道合胞病毒(rsv)、单纯疱疹病毒(hsv)、人乳头瘤病毒(hpv)、人免疫缺陷病毒(hiv)、疟原虫(plasmodium)、金黄色葡萄球菌(staphylococcusaureus)、登革热病毒、沙眼衣原体(chlamydiatrachomatis)、巨细胞病毒(cmv)、乙型肝炎病毒(hbv)、结核分枝杆菌(mycobacteriumtuberculosis)、狂犬病毒和黄热病病毒。此外,该病原性抗原(衍生自与传染病相关的病原体的抗原)可以优选地选自以下抗原:外膜蛋白aompa、生物膜相关蛋白bap、转运蛋白muck(鲍氏不动杆菌(acinetobacterbaumannii),不动杆菌感染);可变表面糖蛋白vsg、微管相关蛋白mapp15、反式唾液酸酶tsa(布氏锥虫(trypanosomabrucei),非洲昏睡病(非洲锥虫病));hivp24抗原、hiv包膜蛋白(gp120、gp41、gp160)、多蛋白gag、负调控因子蛋白nef、转录的反式激活剂tat(hiv(人类免疫缺陷病毒),aids(获得性免疫缺陷综合征));半乳糖抑制性粘附蛋白giap、29kda抗原eh29、gal/galnac凝集素、蛋白crt、125kda免疫显性抗原、蛋白m17、粘附素adh112、蛋白stirp(溶组织内阿米巴(entamoebahistolytica),阿米巴病);主要表面蛋白1-5(msp1a、msp1b、msp2、msp3、msp4、msp5)、iv型分泌系统蛋白(virb2、virb7、virb11、vird4)(无形体属(anaplasma),无形体病);保护性抗原pa、水肿因子ef、致死因子lf、s-层同源蛋白slh(炭疽芽孢杆菌(bacillusanthracis),炭疽病);acranolysin、磷脂酶d、胶原蛋白结合蛋白cbpa(溶血隐秘杆菌(arcanobacteriumhaemolyticum),溶血隐秘杆菌感染);核壳蛋白np、糖蛋白前体gpc、糖蛋白gp1、糖蛋白gp2(胡宁病毒,阿根廷出血热);壳多糖-蛋白层蛋白、14kda表面抗原a14、主要精子蛋白msp、msp聚合-组织蛋白mpop、msp纤维蛋白2mfp2、msp聚合-激活激酶mpak、aba-1样蛋白alb、蛋白aba-1、表皮质cut-1(人蛔虫(ascarislumbricoides),蛔虫病);41kda变应原aspv13、变应原aspf3、主要分生孢子棒状表面蛋白a(majorconidialsurfaceproteinrodleta)、蛋白酶pep1p、gpi-锚定蛋白gel1p、gpi-锚定蛋白crf1p(曲霉菌属(aspergillus),曲霉菌病);家族vp26蛋白、vp29蛋白(星状病毒科(astroviridae),星状病毒感染);棒状体相关蛋白1rap-1、裂殖子表面抗原msa-1、msa-2(a1、a2、b、c)、12d3、11c5、21b4、p29、变体红细胞表面抗原vesa1、顶膜抗原1ama-1(巴贝虫属(babesia),巴贝虫病);溶血素、肠毒素c、pxo1-51、葡糖酸氧化酶、abc-转运蛋白、青霉素-结合蛋白、锌转运蛋白家族蛋白、假尿苷合酶rsu、质粒复制蛋白repx、寡内肽酶f、前噬菌体膜蛋白、蛋白hemk、鞭毛抗原h、28.5-kda细胞表面抗原(蜡状芽孢杆菌(bacilluscereus),蜡状芽孢杆菌感染);大t抗原lt、小t抗原、衣壳蛋白vp1、衣壳蛋白vp2(bk病毒,bk病毒感染);29kda-蛋白、半胱天冬酶-3样抗原、糖蛋白(人芽囊原虫(blastocystishominis),人芽囊原虫感染);酵母表面粘附素wi-1(皮炎芽生菌(blastomycesdermatitidis),芽生菌病);核蛋白n、聚合酶l、基质蛋白z、糖蛋白gp(马丘波病毒,玻利维亚出血热);外表面蛋白aospa、外表面蛋白ospb、外表面蛋白ospc、核心蛋白聚糖结合蛋白adbpa、核心蛋白聚糖结合蛋白bdbpb、鞭毛丝41kda核心蛋白fla、碱性膜蛋白a前体bmpa(免疫显性抗原p39)、外表面22kda脂蛋白前体(抗原ipla7)、可变表面脂蛋白vlse(疏螺旋体属(borrelia),疏螺旋体感染);肉毒杆菌神经毒素bont/a1、bont/a2、bont/a3、bont/b、bont/c、bont/d、bont/e、bont/f、bont/g、重组肉毒杆菌毒素fhc结构域fhc(肉毒梭菌(clostridiumbotulinum),肉毒中毒(和婴儿型肉毒中毒));核壳蛋白、糖蛋白前体(萨比亚病毒,巴西出血热);铜/锌超氧化物歧化酶sodc、细菌铁蛋白bfr、50s核糖体蛋白rpll、含有ompa样跨膜结构域的蛋白omp31、免疫原性39-kda蛋白m5p39、锌abc转运蛋白周质锌-结合蛋白znua、周质免疫原性蛋白bp26、30s核糖体蛋白s12rpsl、甘油醛-3-磷酸脱氢酶gap、25kda外膜免疫原性蛋白前体omp25、侵袭蛋白blalb、触发因子tig、分子伴侣dnak、推定的肽基-脯氨酰顺反异构酶sura、脂蛋白omp19、外膜蛋白motyomp16、保守的外膜蛋白d15、苹果酸脱氢酶mdh、iv型分泌系统的组分(t4ss)virj、未知功能的脂蛋白bab1_0187(布鲁氏菌属(brucella),布鲁氏菌病);abc转运蛋白家族成员(lolc、oppa和potf)、推定的脂蛋白释放系统跨膜蛋白lolc/e、鞭毛蛋白flic、伯克氏菌胞内运动性abima、细菌延伸因子-tuef-tu、17kdaompa样蛋白、boaa编码蛋白、boab编码蛋白(洋葱伯克氏菌(burkholderiacepacia)和其他伯克氏菌属物种,伯克氏菌感染);分枝酰转移酶ag85a、热休克蛋白hsp65、蛋白tb10.4、19kda抗原、蛋白psts3、热休克蛋白hsp70(溃疡分枝杆菌(mycobacteriumulcerans),布路里溃疡);诺如病毒主要和次要病毒衣壳蛋白vp1和vp2、基因组多蛋白、沙波病毒(sapoviurus)衣壳蛋白vp1、蛋白vp3、基因组多蛋白(杯状病毒科,杯状病毒感染(诺如病毒和沙波病毒));主要外膜蛋白pora、鞭毛蛋白flaa、表面抗原cjaa、纤连蛋白结合蛋白cadf、天冬氨酸/谷氨酸-结合abc转运蛋白peb1a、蛋白fspa1、蛋白fspa2(弯曲菌属(campylobacter),弯曲菌病);糖酵解酶烯醇化酶、分泌的天冬氨酰蛋白酶sap1-10、糖磷脂酰肌醇(gpi)-连接的细胞壁蛋白、蛋白hyr1、补体受体3-相关蛋白cr3-rp、粘附素als3p、热休克蛋白90kdahsp90、细胞表面疏水性蛋白csh(通常是白色念珠菌(candidaalbicans)和其他念珠菌属物种,念珠菌病);17-kda抗原、蛋白p26、三聚体自发转运蛋白粘附素taa、巴尔通氏体粘附素abada、可变表达的外膜蛋白vomp、蛋白pap3、蛋白hbpa、包膜相关蛋白酶htra、蛋白omp89、蛋白groel、蛋白lalb、蛋白omp43、二氢硫辛酰胺琥珀酰转移酶sucb(汉氏巴尔通体(bartonellahenselae),猫抓病);无鞭毛体表面蛋白-2、无鞭毛体-特异性表面蛋白ssp4、cruzipain、反式唾液酸酶ts、锥鞭毛体表面糖蛋白tsa-1、补体调控蛋白crp-10、蛋白g4、蛋白g2、paraxonemal杆状蛋白par2、副鞭毛体杆状组分par1、粘蛋白相关表面蛋白mpsp(克氏锥虫(trypanosomacruzi),查加斯病(美洲锥虫病));包膜糖蛋白(gb、gc、ge、gh、gi、gk、gl)(水痘-带状疱疹病毒(vzv),水痘);主要外膜蛋白momp、可能的外膜蛋白pmpc、外膜复合物蛋白bomcb、热休克蛋白hsp60hsp10、蛋白inca、来自iii型分泌系统的蛋白、核糖核苷酸还原酶小链蛋白nrdb、质粒蛋白pgp3、衣原体外蛋白ncopn、抗原ct521、抗原ct425、抗原ct043、抗原tc0052、抗原tc0189、抗原tc0582、抗原tc0660、抗原tc0726、抗原tc0816、抗原tc0828(沙眼衣原体(chlamydiatrachomatis),衣原体属(chlamydia));低钙响应蛋白elcre、衣原体外蛋白ncopn、丝氨酸/苏氨酸-蛋白激酶pknd、酰基载体蛋白s-丙二酰转移酶fabd、单链dna结合蛋白ssb、主要外膜蛋白momp、外膜蛋白2omp2、多形膜蛋白家族(pmp1、pmp2、pmp3、pmp4、pmp5、pmp6、pmp7、pmp8、pmp9、pmp10、pmp11、pmp12、pmp13、pmp14、pmp15、pmp16、pmp17、pmp18、pmp19、pmp20、pmp21)(肺炎衣原体(chlamydophilapneumoniae),肺炎衣原体感染);霍乱毒素bctb、毒素共调菌毛蛋白atcpa、毒素共调菌毛蛋白tcpf、毒素共调菌毛生物合成蛋白ftcpf、霍乱肠毒素亚基a、霍乱肠毒素亚基b、热稳定性肠毒素st、甘露糖敏感性血凝素msha、外膜蛋白uporinompu、poringb蛋白、多形膜蛋白-d(霍乱弧菌(vibriocholerae),霍乱);丙酰辅酶a羧化酶pcc、14-3-3蛋白、抑制素、半胱氨酸蛋白酶、谷胱甘肽转移酶、凝溶胶蛋白、组织蛋白酶l蛋白酶catl、皮层蛋白20.8kdatp20.8、皮层蛋白31.8kdatp31.8、溶血磷脂酸磷酸酶lpap、(华支睾吸虫(clonorchissinensis),华支睾吸虫病);表面层蛋白slp、谷氨酸脱氢酶抗原gdh、毒素a、毒素b、半胱氨酸蛋白酶cwp84、半胱氨酸蛋白酶cwp13、半胱氨酸蛋白酶cwp19、细胞壁蛋白cwpv、鞭毛蛋白flic、鞭毛蛋白flid(艰难梭菌(clostridiumdifficile),艰难梭菌感染);鼻病毒:衣壳蛋白vp1、vp2、vp3、vp4;冠状病毒:sprike蛋白s、包膜蛋白e、膜蛋白m、核壳蛋白n(通常是鼻病毒和冠状病毒,感冒(急性病毒性鼻咽炎;急性鼻卡他));朊病毒蛋白prp(cjd朊病毒,克-雅病(cjd));包膜蛋白gc、包膜蛋白gn、核壳蛋白(克里米亚-刚果出血热病毒,克里米亚-刚果出血热(cchf));毒力相关dead盒rna解旋酶vad1、半乳甘露聚糖(galactoxylomannan)-蛋白galxm、葡萄糖醛酸木糖甘露聚糖(glucuronoxylomannan)gxm、甘露糖蛋白mp(新型隐球菌(cryptococcusneoformans),隐球菌病);酸性核糖体蛋白p2cpp2、粘蛋白抗原muc1、muc2、muc3、muc4、muc5、muc6、muc7、表面粘附蛋白cp20、表面蛋白cp23、表面蛋白cp12、表面蛋白cp21、表面蛋白cp40、表面蛋白cp60、表面蛋白cp15、表面相关糖肽gp40、表面相关糖肽gp15、卵囊壁蛋白ab、抑制蛋白prf、腺苷三磷酸双磷酸酶(隐孢子虫属(cryptosporidium),隐孢子虫病);脂肪酸和视黄醇结合蛋白-1far-1、金属蛋白酶组织抑制剂timp(tmp)、半胱氨酸蛋白酶acey-1、半胱氨酸蛋白酶accp-1、表面抗原ac-16、分泌蛋白2asp-2、金属蛋白酶1mtp-1、天冬氨酰蛋白酶抑制剂api-1、表面相关抗原saa-1、成年人特异性分泌因子xa、丝氨酸蛋白酶抑制剂抗凝血剂ap、组织蛋白酶d样天冬氨酸蛋白酶arr-1(通常是巴西钩虫(ancylostomabraziliense);多种其他寄生虫,皮肤幼虫移行症(clm));组织蛋白酶l样蛋白酶、53/25-kda抗原、8kda家族成员、具有边缘胰蛋白酶样活性的囊尾幼虫蛋白tsag5、六钩蚴蛋白tsol18、六钩蚴蛋白tsol45-1a、乳酸脱氢酶aldha、乳酸脱氢酶bldhb(猪肉绦虫(taeniasolium),囊尾幼虫病);pp65抗原、膜蛋白pp15、邻近衣壳的被膜蛋白(capsid-proximaltegumentprotein)pp150、蛋白m45、dna聚合酶ul54、解旋酶ul105、糖蛋白gm、糖蛋白gn、糖蛋白h、糖蛋白bgb、蛋白ul83、蛋白ul94、蛋白ul99(巨细胞病毒(cmv),巨细胞病毒感染);衣壳蛋白c、前膜蛋白prm、膜蛋白m、包膜蛋白e(结构域i、结构域ii、结构域ii)、蛋白ns1、蛋白ns2a、蛋白ns2b、蛋白ns3、蛋白ns4a、蛋白2k、蛋白ns4b、蛋白ns5(登革热病毒(den-1、den-2、den-3和den-4)-黄病毒,登革热);39kda蛋白(脆弱双核阿米巴(dientamoebafragilis),双核阿米巴病);白喉毒素前体tox、白喉毒素dt、菌毛蛋白特异性分拣酶srta、轴菌毛蛋白spaa、tip菌毛蛋白spac、次要菌毛蛋白spab、表面相关蛋白dip1281(白喉棒杆菌(corynebacteriumdiphtheriae),白喉);糖蛋白gp、核蛋白np、次要基质蛋白vp24、主要基质蛋白vp40、转录激活剂vp30、聚合酶辅因子vp35、rna聚合酶l(埃博拉病毒(ebov),埃博拉病毒出血热);朊病毒蛋白(vcjd朊病毒,变异克-雅病(vcjd,nvcjd));uvrabc系统蛋白b、蛋白flp1、蛋白flp2、蛋白flp3、蛋白tada、血红蛋白受体hgba、外膜蛋白tdha、蛋白cpsra、调节剂cpxr、蛋白sapa、18kda抗原、外膜蛋白ncaa、蛋白lspa、蛋白lspa1、蛋白lspa2、蛋白lspb、外膜组分dsra、凝集素dlta、脂蛋白hlp、主要外膜蛋白omp、外膜蛋白ompa2(杜克雷嗜血杆菌(haemophilusducreyi),软性下疳);天冬氨酰蛋白酶1pep1、磷脂酶bplb、α-甘露糖苷酶1amn1、葡聚糖基转移酶(glucanosyltransferase)gel1、脲酶ure、过氧化物酶体基质蛋白pmp1、富含脯氨酸的抗原pra、人t-细胞反应性蛋白tcrp(粗球孢子菌(coccidioidesimmitis)和波萨达斯球孢子菌(coccidioidesposadasii),球孢子菌病);变应原trir2、热休克蛋白60hsp60、真菌肌动蛋白act、抗原trir2、抗原trir4、抗原trit1、蛋白iv、甘油-3-磷酸脱氢酶gpd1、渗透感受器(osmosensor)hwsho1a、渗透感受器hwsho1b、组氨酸激酶hwhhk7b、变应原malas1、变应原malas11、硫氧还蛋白trxmalas13、变应原malaf、变应原malas(通常是发癣菌属物种(trichophytonspp)、表皮癣菌属物种(epidermophytonspp.)、马拉色霉菌属物种(malasseziaspp.)、威尼克外瓶霉(hortaeawerneckii,皮癣病);蛋白eg95、蛋白eg10、蛋白eg18、蛋白ega31、蛋白em18、抗原epc1、抗原b、抗原5、蛋白p29、蛋白14-3-3、8-kda蛋白、亲肌肉抗原、热休克蛋白20hsp20、糖蛋白gp-89、脂肪酸结合蛋白fapb(棘球属(echinococcus),棘球蚴病);主要表面蛋白2msp2、主要表面蛋白4msp4、msp变体sgv1、msp变体sgv2、外膜蛋白omp、外膜蛋白19omp-19、主要抗原蛋白map1、主要抗原蛋白map1-2、主要抗原蛋白map1b、主要抗原蛋白map1-3、erum2510编码蛋白、蛋白groel、蛋白groes、30-kda主要外膜蛋白、ge100-kda蛋白、ge130-kda蛋白、ge160-kda蛋白(埃立克体属(ehrlichia),埃立克体病);分泌抗原saga、saga样蛋白sala和salb、胶原蛋白粘附素scm、表面蛋白fms1(ebpa(fm)、fms5(ebpb(fm)、fms9(epbc(fm)和fms10、蛋白ebpc(fm)、96kda免疫保护性糖蛋白g1(肠球菌属(enterococcus),肠球菌感染);基因组多蛋白、聚合酶3d、病毒衣壳蛋白vp1、病毒衣壳蛋白vp2、病毒衣壳蛋白vp3、病毒衣壳蛋白vp4、蛋白酶2a、蛋白酶3c(肠病毒属(enterovirus),肠病毒感染);外膜蛋白om、60kda外膜蛋白、细胞表面抗原ompa、细胞表面抗原ompb(sca5)、134kda外膜蛋白、31kda外膜蛋白、29.5kda外膜蛋白、细胞表面蛋白sca4、细胞表面蛋白adr1(rp827)、细胞表面蛋白adr2(rp828)、细胞表面蛋白sca1、侵袭蛋白inva、细胞分裂蛋白fts、分泌蛋白sec0家族、毒力蛋白virb、tlya、tlyc、细蛋白样蛋白plp、前蛋白转位酶seca、120-kda表面蛋白抗原spa、138kd复合物抗原、主要100-kd蛋白(蛋白i)、胞质内蛋白d、保护性表面蛋白抗原spa(普氏立克次氏体(rickettsiaprowazekii),流行性斑疹伤寒);eb病毒核抗原(ebna-1、ebna-2、ebna-3a、ebna-3b、ebna-3c、ebna-前导蛋白(ebna-lp))、潜伏膜蛋白(lmp-1、lmp-2a、lmp-2b)、早期抗原ebv-ea、膜抗原ebv-ma、病毒衣壳抗原ebv-vca、碱性核酸酶ebv-an、糖蛋白h、糖蛋白gp350、糖蛋白gp110、糖蛋白gp42、糖蛋白ghgl、糖蛋白gb(eb病毒(ebv),eb病毒感染性单核细胞增多症);衣壳蛋白vp2、衣壳蛋白vp1、主要蛋白ns1(细小病毒b19,传染性红斑(第五病));pp65抗原、糖蛋白105、主要衣壳蛋白、包膜糖蛋白h、蛋白u51(人疱疹病毒6(hhv-6)和人疱疹病毒7(hhv-7),幼儿急疹);硫氧还-谷胱甘肽蛋白还原酶tgr、组织蛋白酶l1和l2、kunitz-型蛋白ktm、亮氨酸氨基肽酶lap、半胱氨酸蛋白酶fas2、皂化蛋白样蛋白-2sap-2、硫氧还蛋白过氧化物酶tpx、prx-1、prx-2、组织蛋白酶1半胱氨酸蛋白酶cl3、蛋白酶组织蛋白酶lcl1、磷酸甘油激酶pgk、27-kda分泌蛋白、60kda蛋白hsp35α、谷胱甘肽转移酶gst、28.5kda表膜抗原28.5kdata、组织蛋白酶b3蛋白酶catb3、i型半胱氨酸蛋白酶抑制剂stefin-1、组织蛋白酶l5、组织蛋白酶l1g和组织蛋白酶b、脂肪酸结合蛋白fabp、亮氨酸氨基肽酶lap(肝片吸虫(fasciolahepatica)和巨片吸虫(fasciolagigantica),片吸虫病);朊病毒蛋白(ffi朊蛋白,致命性家族性失眠症(ffi));毒液变应原同源物样蛋白val-1、冗余幼虫转录物alt-1、冗余幼虫转录物alt-2、硫氧还蛋白过氧化物酶tpx、黄蜂变应原同源物vah、硫氧还蛋白过氧化物酶2tpx-2、抗原蛋白sxp(肽n、n1、n2和n3)、激活相关蛋白-1asp-1、硫氧还蛋白trx、谷氨酰胺转移酶bmtga、谷胱甘肽-s-转移酶gst、肌球蛋白、黄蜂变应原同源物vah、175kda胶原酶、甘油醛-3-磷酸脱氢酶gapdh、表皮胶原col-4、分泌的幼虫酸性蛋白slap、壳多糖酶chi-1、麦芽糖结合蛋mbp、糖酵解酶果糖-1,6-二磷酸醛缩酶fba、原肌球蛋白tmy-1、线虫特异性基因产物ovb20、癌半胱氨酸蛋白酶抑制剂(onchocystatin)cpi-2、cox-2(丝虫目超家族(filarioideasuperfamily),丝虫病);磷脂酶cplc、热不稳定肠毒素b、ι毒素组分ib、蛋白cpe1281、丙酮酸铁氧还蛋白氧化还原酶、延伸因子gef-g、产气荚膜梭菌细胞溶素opfo、甘油醛-3-磷酸脱氢酶gapc、果糖-二磷酸醛缩酶alf2、产气荚膜梭菌(clostridiumperfringens)肠毒素cpe、α毒素at、α类毒素atd、ε-类毒素etd、蛋白hp、大细胞毒素tpel、内-β-n-乙酰氨基葡糖苷酶naglu、磷酸甘油酸变位酶pgm(产气荚膜梭菌,产气荚膜梭菌引起的食物中毒);白细胞毒素lkta、粘附素fada、外膜蛋白radd、高分子量精氨酸结合蛋白(梭菌属(fusobacterium),梭菌感染);磷脂酶cplc、热不稳定肠毒素b、ι毒素组分ib、蛋白cpe1281、丙酮酸铁氧还蛋白氧化还原酶、延伸因子gef-g、产气荚膜梭菌细胞溶素opfo、甘油醛-3-磷酸脱氢酶gapc、果糖-二磷酸醛缩酶alf2、产气荚膜梭菌(clostridiumperfringens)肠毒素cpe、α毒素at、α类毒素atd、ε-类毒素etd、蛋白hp、大细胞毒素tpel、内-β-n-乙酰氨基葡糖苷酶naglu、磷酸甘油酸变位酶pgm(通常为产气荚膜梭菌;其他梭菌属物种,气性坏疽(clostridialmyonecrosis));脂酶a、脂酶b、过氧化物酶decl(念珠地丝菌(geotrichumcandidum),地丝菌病);朊病毒蛋白(gss朊病毒,格-施-沙综合征(gss));cyst壁蛋白cwp1、cwp2、cwp3、变体表面蛋白vsp、vsp1、vsp2、vsp3、vsp4、vsp5、vsp6、56kda抗原、丙酮酸铁氧还蛋白氧化还原酶pfor、醇脱氢酶eadhe、α-贾地虫蛋白、α8-贾地虫蛋白、α1-贾地虫蛋白、β-贾地虫蛋白、半胱氨酸蛋白酶、谷胱甘肽-s-转移酶gst、精氨酸脱亚氨基酶adi、果糖-1,6-二磷酸醛缩酶fba、贾地虫滋养体抗原gta(gta1、gta2)、鸟氨酸羧基转移酶oct、纹状纤维组装样蛋白(striatedfiber-asseblin-likeprotein)salp、尿苷磷酰基样蛋白upl、α-微管蛋白、β-微管蛋白(肠贾第虫(giardiaintestinalis),贾第虫病);abc转运蛋白家族成员(lolc、oppa和potf)、推定的脂蛋白释放系统跨膜蛋白lolc/e、鞭毛蛋白flic、伯克氏菌胞内运动性abima、细菌延伸因子-tuef-tu、17kdaompa样蛋白、boaa编码蛋白(鼻疽伯克氏菌(burkholderiamallei),马鼻疽);亲环素cyp、24kda三期幼虫蛋白gs24、排泄-分泌产物esp(40kda、80kda、120kda和208kda)(棘颚口线虫(gnathostomaspinigerum)和刚棘颚口线虫(gnathostomahispidum),颚口线虫病);菌毛蛋白、次要菌毛蛋白相关亚基pilc、主要菌毛蛋白亚基和变体pile、pils、相变异蛋白pora、孔蛋白bporb、蛋白trad、奈瑟球菌外膜抗原h.8、70kda抗原、主要外膜蛋白pi、外膜蛋白pla和plb、w抗原、表面蛋白anspa、转铁蛋白结合蛋白tbpa、转铁蛋白结合蛋白tbpb、pbp2、mtrr编码蛋白、pona编码蛋白、膜通透酶fbpbc、fbpabc蛋白系统、lbpab蛋白、外膜蛋白opa、外膜转运蛋白feta、铁抑制调控因子mper(淋病奈瑟氏菌(neisseriagonorrhoeae),淋病);外膜蛋白aompa、外膜蛋白compc、外膜蛋白k17ompk17(肉芽肿杆菌(klebsiellagranulomatis),腹股沟肉芽肿(杜诺凡病));纤连蛋白结合蛋白sfb、纤连蛋白/纤连蛋白结合蛋白fbp54、纤连蛋白结合蛋白fbaa、1型m蛋白emm1、6型m蛋白emm6、免疫球蛋白结合蛋白35sib35、表面蛋白r28spr28、超氧化物歧化酶sod、c5a肽酶scpa、抗原i/iiagi/ii、粘附素aspa、g相关α2-巨球蛋白结合蛋白grab、表面纤维状蛋白m5(酿脓链球菌(streptococcuspyogenes),a组链球菌感染);c蛋白β抗原、精氨酸脱亚氨基酶蛋白、粘附素biba、105kda蛋白bps、表面抗原c、表面抗原r、表面抗原x、胰蛋白酶抗性蛋白r1、胰蛋白酶抗性蛋白r3、胰蛋白酶抗性蛋白r4、表面免疫原性蛋白sip、表面蛋白rib、富含亮氨酸的重复蛋白lrrg、富含丝氨酸的重复蛋白srr-2、c蛋白α-抗原bca、β抗原bag、表面抗原ε、α样蛋白alp1、α样蛋白alp5表面抗原δ、α样蛋白alp2、α样蛋白alp3、α样蛋白alp4、cβ蛋白bac(无乳链球菌(streptococcusagalactiae),b组链球菌感染);转铁蛋白结合蛋白2tbp2、磷酸酶p4、外膜蛋白p6、肽多糖相关脂蛋白pal、蛋白d、蛋白e、粘附和穿透蛋白hap、外膜蛋白26omp26、外膜蛋白p5(fimbrin)、外膜蛋白d15、外膜蛋白ompp2、5′-核苷酸酶nuca、外膜蛋白p1、外膜蛋白p2、外膜脂蛋白pcp、脂蛋白e、外膜蛋白p4、岩藻酮糖激酶fuck、[cu,zn]-超氧化物歧化酶sodc、蛋白酶htra、蛋白o145、α-半乳糖苷基神经酰胺(流感嗜血菌(haemophilusinfluenzae),流感嗜血菌感染);聚合酶3d、病毒衣壳蛋白vp1、病毒衣壳蛋白vp2、病毒衣壳蛋白vp3、病毒衣壳蛋白vp4、蛋白酶2a、蛋白酶3c(肠道病毒,主要是柯萨奇病毒a和肠道病毒71(ev71),手足口病(hfmd));rna聚合酶l、蛋白l、糖蛋白gn、糖蛋白gc、核壳蛋白s、包膜糖蛋白g1、核蛋白np、蛋白n、多蛋白m(辛诺柏病毒,汉坦病毒,汉坦病毒肺综合征(hps));热休克蛋白hspa、热休克蛋白hspb、梓檬酸合酶glta、蛋白ureb、热休克蛋白hsp60、中性粒细胞激活蛋白nap、过氧化氢酶kata、空泡细胞毒素vaca、尿素酶αurea、尿素酶βureb、蛋白cpn10、蛋白groes、热休克蛋白hsp10、蛋白mopb、细胞毒素相关10kda蛋白cag、36kda抗原、β-内酰胺酶hcpa、β-内酰胺酶hcpb(幽门螺杆菌(helicobacterpylori),幽门螺杆菌感染);完整膜蛋白、凝集倾向蛋白、o-抗原、毒素-抗原stx2b、毒素-抗原stx1b、粘附-抗原片段int28、蛋白espa、蛋白espb、亲密素、蛋白tir、蛋白intc300、蛋白eae(大肠杆菌(escherichiacoli)o157:h7、o111和o104:h4,溶血性尿毒症综合征(hus));rna聚合酶l、蛋白l、糖蛋白gn、糖蛋白gc、核壳蛋白s、包膜糖蛋白g1、核蛋白np、蛋白n、多蛋白m(布尼亚病毒科(bunyaviridae),出血热伴有肾综合征(hfrs));糖蛋白g、基质蛋白m、核蛋白n、融合蛋白f、聚合酶l、蛋白w、蛋白c、磷蛋白p、非结构蛋白v(亨尼巴病毒(亨德拉病毒,尼帕病毒),亨尼巴病毒感染);多蛋白、糖蛋白gp2、甲型肝炎表面抗原hbag、蛋白2a、病毒蛋白vp1、病毒蛋白vp2、病毒蛋白vp3、病毒蛋白vp4、蛋白p1b、蛋白p2a、蛋白p3ab、蛋白p3d(甲型肝炎病毒,甲型肝炎);乙型肝炎表面抗原hbsag、乙型肝炎核心抗原hbcag、聚合酶、蛋白hbx、pres2中表面蛋白、表面蛋白l、大s蛋白、病毒蛋白vp1、病毒蛋白vp2、病毒蛋白vp3、病毒蛋白vp4(乙型肝炎病毒(hbv),乙型肝炎);包膜糖蛋白e1gp32gp35、包膜糖蛋白e2ns1gp68gp70、衣壳蛋白c、核心蛋白核、多蛋白、病毒蛋白vp1、病毒蛋白vp2、病毒蛋白vp3、病毒蛋白vp4、抗原g、蛋白ns3、蛋白ns5a、(丙型肝炎病毒,丙型肝炎);病毒蛋白vp1、病毒蛋白vp2、病毒蛋白vp3、病毒蛋白vp4、大肝炎δ抗原、小肝炎δ抗原(丁型肝炎病毒,丁型肝炎);病毒蛋白vp1、病毒蛋白vp2、病毒蛋白vp3、病毒蛋白vp4、衣壳蛋白e2(戊型肝炎病毒,戊型肝炎);糖蛋白lul1、尿嘧啶-dna糖基化酶ul2、蛋白ul3、蛋白ul4、dna复制蛋白ul5、门户蛋白ul6、病毒体成熟蛋白ul7、dna解旋酶ul8、复制起点结合蛋白ul9、糖蛋白mul10、蛋白ul11、碱性核酸外切酶ul12、丝氨酸-苏氨酸蛋白激酶ul13、被膜蛋白ul14、终止酶ul15、被膜蛋白ul16、蛋白ul17、衣壳蛋白vp23ul18、主要衣壳蛋白vp5ul19、膜蛋白ul20、被膜蛋白ul21、糖蛋白h(ul22)、胸苷激酶ul23、蛋白ul24、蛋白ul25、衣壳蛋白p40(ul26、vp24、vp22a)、糖蛋白b(ul27)、icp18.5蛋白(ul28)、主要dna结合蛋白icp8(ul29)、dna聚合酶ul30、核基质蛋白ul31、包膜糖蛋白ul32、蛋白ul33、内核膜蛋白ul34、衣壳蛋白vp26(ul35)、大被膜蛋白ul36、衣壳装配蛋白ul37、vp19c蛋白(ul38)、核糖核苷酸还原酶(大亚基)ul39、核糖核苷酸还原酶(小亚基)ul40、被膜蛋白/病毒体宿主关闭vhs蛋白(ul41)、dna聚合酶持续因子ul42、膜蛋白ul43、糖蛋白c(ul44)、膜蛋白ul45、被膜蛋白vp11/12(ul46)、被膜蛋白vp13/14(ul47)、病毒体成熟蛋白vp16(ul48,α-tif)、包膜蛋白ul49、dutp二磷酸酶ul50、被膜蛋白ul51、dna解旋酶/引物酶复合蛋白ul52、糖蛋白k(ul53)、转录调控蛋白ie63(icp27,ul54)、蛋白ul55、蛋白ul56、病毒复制蛋白icp22(ie68,us1)、蛋白us2、丝氨酸/苏氨酸蛋白激酶us3、糖蛋白g(us4)、糖蛋白j(us5)、糖蛋白d(us6)、糖蛋白i(us7)、糖蛋白e(us8)、被膜蛋白us9、衣壳/被膜蛋白us10、vmw21蛋白(us11)、icp47蛋白(ie12,us12)、主要转录激活因子icp4(ie175,rs1)、e3泛素连接酶icp0(ie110)、潜伏相关蛋白1lrp1、潜伏相关蛋白2lrp2、神经毒力因子rl1(icp34.5)、潜伏相关转录物lat(单纯疱疹病毒1和2(hsv-1和hsv-2),单纯疱疹);热休克蛋白hsp60、细胞表面蛋白h1c、iv型二肽基肽酶dppiv、m抗原、70kda蛋白、17kda组蛋白样蛋白(荚膜组织胞浆菌,组织胞浆菌病);脂肪酸和视黄醇结合蛋白-1far-1、金属蛋白酶组织抑制剂timp(tmp)、半胱氨酸蛋白酶acey-1、半胱氨酸蛋白酶accp-1、表面抗原ac-16、分泌蛋白2asp-2、金属蛋白酶1mtp-1、天冬氨酰蛋白酶抑制剂api-1、表面相关抗原saa-1、表面相关抗原saa-2、成年人特异性分泌因子xa、丝氨酸蛋白酶抑制剂抗凝血剂ap、组织蛋白酶d样天冬氨酸蛋白酶arr-1、谷胱甘肽s-转移酶gst、天冬氨酸蛋白酶apr-1、乙酰胆碱酯酶ache(十二指肠钩虫(ancylostomaduodenale)和美洲板口线虫(necatoramericanus),钩虫感染);蛋白ns1、蛋白np1、蛋白vp1、蛋白vp2、蛋白vp3(人博卡病毒(hbov),人博卡病毒感染);主要表面蛋白2msp2、主要表面蛋白4msp4、msp变体sgv1、msp变体sgv2、外膜蛋白omp、外膜蛋白19omp-19、主要抗原性蛋白map1、主要抗原性蛋白map1-2、主要抗原性蛋白map1b、主要抗原性蛋白map1-3、erum2510编码蛋白、蛋白groel、蛋白groes、30-kda主要外膜蛋白、ge100-kda蛋白、ge130-kda蛋白、ge160-kda蛋白(伊氏埃立克体(ehrlichiaewingii),人伊氏埃立克体病(humanewingiiehrlichiosis));主要表面蛋白1-5(msp1a、msp1b、msp2、msp3、msp4、msp5)、iv型分泌系统蛋白virb2、virb7、virb11、vird4(嗜吞细胞无形体(anaplasmaphagocytophilum),人粒细胞无形体病(humangranulocyticanaplasmosis,hga));蛋白ns1、小疏水蛋白ns2、sh蛋白、融合蛋白f、糖蛋白g、基质蛋白m、基质蛋白m2-1、基质蛋白m2-2、磷蛋白p、核蛋白n、聚合酶l(人偏肺病毒(hmpv),人偏肺病毒感染);主要表面蛋白2msp2、主要表面蛋白4msp4、msp变体sgv1、msp变体sgv2、外膜蛋白omp、外膜蛋白19omp-19、主要抗原性蛋白map1、主要抗原性蛋白map1-2、主要抗原性蛋白map1b、主要抗原性蛋白map1-3、erum2510编码蛋白、蛋白groel、蛋白groes、30-kda主要外膜蛋白、ge100-kda蛋白、ge130-kda蛋白、ge160-kda蛋白(中查菲埃立克体(ehrlichiaewingii),人单核细胞埃立克体病(humanewingiiehrlichiosis));复制蛋白e1、调控蛋白e2、蛋白e3、蛋白e4、蛋白e5、蛋白e6、蛋白e7、蛋白e8、主要衣壳蛋白l1、次要衣壳蛋白l2(人乳头瘤病毒(hpv),人乳头瘤病毒(hpv)感染);融合蛋白f、血凝素-神经酰胺酶hn、糖蛋白g、基质蛋白m、磷蛋白p、核蛋白n、聚合酶l(人副流感病毒(hpiv),人副流感病毒感染);血凝素(ha)、神经酰胺酶(na)、核蛋白(np)、m1蛋白、m2蛋白、ns1蛋白、ns2蛋白(nep蛋白;核输出蛋白)、pa蛋白、pb1蛋白(聚合酶碱性1蛋白)、pb1-f2蛋白和pb2蛋白(正粘病毒科(orthomyxoviridae),流感病毒(flu));基因组多蛋白、蛋白e、蛋白m、衣壳蛋白c(日本脑炎病毒,日本脑炎);rtx毒素、iv型菌毛、主要菌毛亚基pila、调控转录因子pils和pilr、蛋白σ54、外膜蛋白(金氏金氏菌(kingellakingae),金氏金氏菌感染);朊病毒蛋白(克鲁朊病毒(kuruprion),克鲁病);核蛋白n、聚合酶l、基质蛋白z、糖蛋白gp(拉沙病毒,拉沙热);肽多糖相关脂蛋白pal、60kda伴侣蛋白cpn60(groel、hspb)、iv型菌毛蛋白pile、外膜蛋白mip、主要外膜蛋白momps、锌金属蛋白酶msp(嗜肺军团病杆菌(legionellapneumophila),军团杆菌病(军团病、庞蒂亚克热));p4核酸酶、蛋白wd、核糖核苷酸还原酶m2、表面膜糖蛋白pg46、半胱氨酸蛋白酶cp、葡萄糖调控蛋白78grp-78、阶段特异性s抗原样蛋白a2、atp酶f1、β-微管蛋白、热休克蛋白70hsp70、kmp-11、糖蛋白gp63、蛋白bt1、核苷水解酶nh、细胞表面蛋白b1、核糖体蛋白p1样蛋白p1、固醇24-c-甲基转移酶smt、lack蛋白、组蛋白h1、spb1蛋白、硫醇特异性抗氧化剂tsa、蛋白抗原stl1、信号肽酶sp、组蛋白h2b、表面抗原psa-2、半胱氨酸蛋白酶bcpb(利什曼原虫属(leishmania),利什曼病);主要膜蛋白i、富含丝氨酸的抗原-45kda、10kdacaperoningroes、hspkda抗原、氨基-氧代壬酸酯合酶aons、蛋白重组酶areca、乙酰基-/丙酰基-辅酶a羧化酶α、丙氨酸消旋酶、60kda伴侣蛋白2、esat-6样蛋白ecxb(l-esat-6)、蛋白lsr2、蛋白ml0276、肝素-结合血凝素hbha、热休克蛋白65hsp65、mycp1或ml0041编码蛋白、htra2或ml0176编码蛋白、htra4或ml2659编码蛋白、gcp或ml0379编码蛋白、clpc或ml0235编码蛋白(麻风分枝杆菌(mycobacteriumleprae)和弥漫型麻风分枝杆菌(mycobacteriumlepromatosis),麻风);外膜蛋白lipl32、膜蛋白lic10258、膜蛋白lp30、膜蛋白lic12238、ompa样蛋白lsa66、表面蛋白liga、表面蛋白ligb、主要外膜蛋白ompl1、外膜蛋白lipl41、蛋白ligani、表面蛋白lcpa、粘附蛋白lipl53、外膜蛋白upl32、表面蛋白lsa63、鞭毛蛋白flab1、膜脂蛋白lipl21、膜蛋白pl40、钩端螺旋体表面粘附素lsa27、外膜蛋白ompl36、外膜蛋白ompl37、外膜蛋白ompl47、外膜蛋白ompl54、酰基转移酶lpxa(钩端螺旋体属(leptospira),钩端螺旋体病);李斯特菌溶菌素o前体hly(llo)、侵袭相关蛋白iap(p60)、李斯特菌溶菌素调控蛋白prfa、锌金属蛋白酶mpl、磷脂酰肌醇-特异性磷脂酶cplc(plca,plcb)、o-乙酰基转移酶oat、abc-转运蛋白通透酶im.g_1771、粘附蛋白lap、lap受体hsp60、粘附素lapb、溶血素李斯特菌溶菌素ollo、蛋白acta、内化蛋白ainla、蛋白lnlb(单核细胞增多性李斯特菌(listeriamonocytogenes),李斯特菌病);外表面蛋白aospa、外表面蛋白ospb、外表面蛋白ospc、核心蛋白聚糖结合蛋白adbpa、核心蛋白聚糖结合蛋白bdbpb、鞭毛丝41kda核心蛋白fla、碱性膜蛋白abmpa(免疫显性抗原p39)、外表面22kda脂蛋白前体(抗原ipla7)、可变表面脂蛋白vlse(通常是伯氏疏螺旋体(borreliaburgdorferi)和其他疏螺旋体属物种,莱姆病(莱姆疏螺旋体病));毒液变应原同源物样蛋白val-1、冗余幼虫转录物alt-1、冗余幼虫转录物alt-2、硫氧还蛋白过氧化物酶tpx、黄蜂变应原同源物vah、硫氧还蛋白过氧化物酶2tpx-2、抗原蛋白sxp(肽n、n1、n2和n3)、激活相关蛋白-1asp-1、硫氧还蛋白trx、谷氨酰胺转移酶bmtga、谷胱甘肽-s-转移酶gst、肌球蛋白、黄蜂变应原同源物vah、175kda胶原酶、甘油醛-3-磷酸脱氢酶gapdh、表皮胶原col-4、分泌的幼虫酸性蛋白slap、壳多糖酶chi-1、麦芽糖结合蛋mbp、糖酵解酶果糖-1,6-二磷酸醛缩酶fba、原肌球蛋白tmy-1、线虫特异性基因产物ovb20、癌半胱氨酸蛋白酶抑制剂(onchocystatin)cpi-2、cox-2(班氏吴策线虫(wuchereriabancrofti)和马来布鲁线虫(brugiamalayi),淋巴丝虫病(象皮病));糖蛋白gp、基质蛋白z、聚合酶l、核蛋白n(淋巴细胞性脉络丛脑膜炎病毒(lcmv),淋巴细胞性脉络丛脑膜炎);血小板反应蛋白相关匿名蛋白trap、ssp2子孢子表面蛋白2、顶膜抗原1ama1、棒状体膜抗原rma1、酸性碱性重复抗原abra、细胞穿越蛋白pf、蛋白pvs25、裂殖子表面蛋白1msp-1、裂殖子表面蛋白2msp-2、环状体感染红细胞表面抗原resa肝阶段抗原3lsa-3、蛋白eba-175、丝氨酸重复抗原5sera-5、环子孢子蛋白cs、裂殖子表面蛋白3msp3、裂殖子表面蛋白8msp8、烯醇化酶pf10、肝细胞红细胞蛋白17kdahep17、红细胞膜蛋白1emp1、蛋白kβ裂殖子表面蛋白4/5msp4/5、热休克蛋白hsp90、富含谷氨酸的蛋白glurp、裂殖子表面蛋白4msp-4、蛋白starp、环子孢子蛋白相关抗原前体cra(疟原虫属(plasmodium),疟疾);核蛋白n、膜相关蛋白vp24、次要核蛋白vp30、聚合酶辅因子vp35、聚合酶l、基质蛋白vp40、包膜糖蛋白gp(马尔堡病毒,马尔堡出血热(mhf));蛋白c、基质蛋白m、磷蛋白p、非结构蛋白v、血凝素糖蛋白h、聚合酶l、核蛋白n、融合蛋白f(麻疹病毒,麻疹);abc转运蛋白家族成员(lolc、oppa和potf)、推定的脂蛋白释放系统跨膜蛋白lolc/e、鞭毛蛋白flic、伯克氏菌胞内运动性abima、细菌延伸因子-tuef-tu、17kdaompa样蛋白、boaa编码蛋白、boab编码蛋白(类鼻疽伯克氏菌(burkholderiapseudomallei),类鼻疽(惠特莫尔氏病));菌毛蛋白、次要菌毛蛋白相关亚基pilc、主要菌毛蛋白亚基和变体pile、pils、相变异蛋白pora、孔蛋白bporb、蛋白trad、奈瑟球菌外膜抗原h.8、70kda抗原、主要外膜蛋白pi、外膜蛋白pla和plb、w抗原、表面蛋白anspa、转铁蛋白结合蛋白tbpa、转铁蛋白结合蛋白tbpb、pbp2、mtrr编码蛋白、pona编码蛋白、膜通透酶fbpbc、fbpabc蛋白系统、lbpab蛋白、外膜蛋白opa、外膜转运蛋白feta、铁抑制调控因子mper、因子h-结合蛋白fhbp、粘附素nada、蛋白nhba、阻遏蛋白farr(脑膜炎奈瑟氏菌(neisseriameningitidis),脑膜炎球菌病);66kda蛋白、22kda蛋白(通常是横川后殖吸虫(metagonimusyokagawai),后殖吸虫病);极性管蛋白(吞微孢子属(glugea)中的34kda、75kda和170kda,脑炎微孢子虫属(encephalitozoon)中的35kda、55kda和150kda)、驱动蛋白相关蛋白、rna聚合酶ii最大亚基、相似或完整的膜蛋白yipa、抗沉默蛋白1、热休克转录因子hsf、蛋白激酶、胸苷激酶、nop-2样核仁蛋白(微孢子门(microsporidiaphylum),微孢子虫病);casp8和fadd样凋亡调控因子、谷胱甘肽过氧化酶gpx1、rna解旋酶nph-iinph2、poly(a)聚合酶催化亚基papl、主要包膜蛋白p43k、早期转录因子70kda亚基vetfs、早期转录因子82kda亚基vetfl、g1型金属内肽酶、核苷三磷酸酶inph1、复制蛋白a28样mc134l、rna聚合酶7kda亚基rpo7(接触传染性软疣病毒(mcv),接触传染性软疣(mc));基质蛋白m、磷蛋白p/v、小疏水蛋白sh、核蛋白n、蛋白v、融合糖蛋白f、血凝素-神经氨酸酶hn、rna聚合酶l(腮腺炎病毒,腮腺炎);外膜蛋白om、细胞表面抗原ompa、细胞表面抗原ompb(sca5)、细胞表面蛋白sca4、细胞表面蛋白sca1、胞质内蛋白d、晶状表面层蛋白slp、保护性表面蛋白抗原spa(斑疹伤寒立克次氏体(rickettsiatyphi),鼠型斑疹伤寒(地方性斑疹伤寒));粘附素p1、粘附p30、蛋白p116、蛋白p40、细胞骨架蛋白hmw1、细胞骨架蛋白hmw2、细胞骨架蛋白hmw3、mpn152编码蛋白、mpn426编码蛋白、mpn456编码蛋白、mpn-500编码蛋白(肺炎支原体(mycoplasmapneumoniae),支原体肺炎);noca、铁依赖性调控蛋白、vapa、vapd、vapf、vapg、酪蛋白水解蛋白酶、丝端相关43-kda蛋白、蛋白p24、蛋白p61、15-kda蛋白、56-kda蛋白(通常是星状诺卡氏菌(nocardiaasteroides)和其他诺卡氏菌属物种,诺卡氏菌病);毒液变应原同源物样蛋白val-1、冗余幼虫转录物alt-1、冗余幼虫转录物alt-2、硫氧还蛋白过氧化物酶tpx、黄蜂变应原同源物vah、硫氧还蛋白过氧化物酶2tpx-2、抗原蛋白sxp(肽n、n1、n2和n3)、激活相关蛋白-1asp-1、硫氧还蛋白trx、谷氨酰胺转移酶bmtga、谷胱甘肽-s-转移酶gst、肌球蛋白、黄蜂变应原同源物vah、175kda胶原酶、甘油醛-3-磷酸脱氢酶gapdh、表皮胶原col-4、分泌的幼虫酸性蛋白slap、壳多糖酶chi-1、麦芽糖结合蛋mbp、糖酵解酶果糖-1,6-二磷酸醛缩酶fba、原肌球蛋白tmy-1、线虫特异性基因产物ovb20、癌半胱氨酸蛋白酶抑制剂(onchocystatin)cpi-2、cox-2(盘尾丝虫(onchocercavolvulus),盘尾丝虫病(河盲症));43kda分泌糖蛋白、糖蛋白gp0、糖蛋白gp75、抗原pb27、抗原pb40、热休克蛋白hsp65、热休克蛋白hsp70、热休克蛋白hsp90、蛋白p10、磷酸丙糖异构酶tpi、n-乙酰基-葡糖胺-结合凝集素paracoccin、28kda蛋白pb28(巴西副球孢子菌(paracoccidioidesbrasiliensis),副球孢子菌病(南美芽生菌病));28-kdacruzipain样半胱氨酸蛋白酶pw28ccp(通常是卫氏并殖吸虫(paragonimuswestermani)和其他并殖吸虫属物种,并殖吸虫病);外膜蛋白omph、外膜蛋白omp28、蛋白pm1539、蛋白pm0355、蛋白pm1417、修复蛋白mutl、蛋白bcbc、蛋白pm0305、甲酸脱氢酶-n、蛋白pm0698、蛋白pm1422、dna旋转酶、脂蛋白plpe、粘附蛋白cp39、血红素获得系统受体hasr、39kda荚膜蛋白、铁调控的ompiromp、外膜蛋白ompa87、伞毛蛋白ptf、伞毛亚基蛋白ptfa、转铁蛋白结合蛋白tbpl、酯酶mesa、多杀巴斯德菌(pasteurellamultocida)毒素pmt、粘附蛋白cp39(巴斯德菌属(pasteurella),巴斯德菌病);“丝状血凝素fhab、腺苷酸环化酶cyaa、百日咳毒素亚基4前体ptxd、百日咳杆菌粘附素前体prn、毒素亚基1ptxa、蛋白cpn60、蛋白brka、百日咳毒素亚基2前体ptxb、百日咳毒素亚基3前体ptxc、百日咳毒素亚基5前体ptxe、百日咳杆菌粘附素prn、蛋白fim2、蛋白fim3;”(百日咳博德特氏菌(bordetellapertussis),百日咳(whoopingcough));“f1荚膜抗原、毒力相关v抗原、分泌效应蛋白lcrv、v抗原、外膜蛋白酶pla、分泌效应蛋白yopd、推定的分泌蛋白-酪氨酸磷酸酶yoph、针状复合物主要亚基yscf、蛋白激酶yopo、推定的自发转运蛋白yapf、内膜abc-转运蛋白ybtq(irp7)、推定的糖结合蛋白ypo0612、热休克蛋白90htpg、推定的硫酸酯酶蛋白yden、外膜脂蛋白载体蛋白lola、分泌伴侣蛋白yera、推定的脂蛋白ypo0420、溶血素激活蛋白hpmb、鼠疫菌素/耶尔森氏菌素外膜受体psn、分泌效应蛋白yope、分泌效应蛋白yopf、分泌效应蛋白yopk、外膜蛋白yopn、外膜蛋白yopm、凝固酶/纤溶酶前体pla;”(鼠疫耶尔森氏菌(yersiniapestis),鼠疫);蛋白phpa、表面粘附素psaa、肺炎球菌溶血素ply、atp-依赖性蛋白酶clp、硫辛酸-蛋白连接酶lpla、细胞壁表面锚定蛋白psrp、分拣酶srta、谷氨酰基-trna合成酶gltx、胆碱结合蛋白acbpa、肺炎球菌表面蛋白apspa、肺炎球菌表面蛋白cpspc、6-磷酸葡糖酸脱氢酶gnd、铁结合蛋白piaa、胞壁质水解酶lytb、蛋白lytc、蛋白酶a1(肺炎链球菌(streptococcuspneumoniae),肺炎球菌感染);主要表面蛋白b、kexin样蛋白酶kex1、蛋白a12、55kda抗原p55、主要表面糖蛋白msg(杰氏肺囊虫(pneumocystisjirovecii),肺囊虫肺炎(pcp));基因组多蛋白、聚合酶3d、病毒衣壳蛋白vp1、病毒衣壳蛋白vp2、病毒衣壳蛋白vp3、病毒衣壳蛋白vp4、蛋白酶2a、蛋白酶3c(脊髓灰质炎病毒,脊髓灰质炎);蛋白nfa1、毒蜥外泌肽-3、分泌性脂酶、组织蛋白酶b样蛋白酶、半胱氨酸蛋白酶、组织蛋白酶、过氧化物氧还蛋白、蛋白cry1ac(通常是福氏耐格里阿米巴原虫(naegleriafowleri),原发性阿米巴脑膜脑炎(pam));未知蛋白(agnoprotein)、大t抗原、小t抗原、主要衣壳蛋白vp1、次要衣壳蛋白vp2(jc病毒,进行性多灶性白质脑病);低钙响应蛋白elcre、衣原体外蛋白ncopn、丝氨酸/苏氨酸-蛋白激酶pknd、酰基载体蛋白s-丙二酰转移酶fabd、单链dna结合蛋白ssb、主要外膜蛋白momp、外膜蛋白2omp2、多形膜蛋白家族(pmp1、pmp2、pmp3、pmp4、pmp5、pmp6、pmp7、pmp8、pmp9、pmp10、pmp11、pmp12、pmp13、pmp14、pmp15、pmp16、pmp17、pmp18、pmp19、pmp20、pmp21)(鹦鹉热衣原体(chlamydophilapsittaci),鹦鹉热);外膜蛋白p1、热休克蛋白bhspb、肽abc转运蛋白、gtp-结合蛋白、蛋白icmb、核糖核酸酶r、磷酸酶sixa、蛋白dsbd、外膜蛋白tolc、dna-结合蛋白phob、atp酶dotb、热休克蛋白bhspb、膜蛋白com1、28kda蛋白、dna-3-甲基腺嘌呤糖苷酶i、外膜蛋白omph、外膜蛋白adaa、甘氨酸裂解系统t-蛋白(伯纳特氏立克次氏体(coxiellaburnetii),q热);核蛋白n、大结构蛋白l、磷蛋白p、基质蛋白m、糖蛋白g(狂犬病毒,狂犬病);融合蛋白f、核蛋白n、基质蛋白m、基质蛋白m2-1、基质蛋白m2-2、磷蛋白p、小疏水蛋白sh、主要表面糖蛋白g、聚合酶l、非结构蛋白1ns1、非结构蛋白2ns2(呼吸道合胞病毒(rsv),呼吸道合胞病毒感染);基因组多蛋白、聚合酶3d、病毒衣壳蛋白vp1、病毒衣壳蛋白vp2、病毒衣壳蛋白vp3、病毒衣壳蛋白vp4、蛋白酶2a、蛋白酶3c(鼻病毒属,鼻病毒感染);外膜蛋白om、细胞表面抗原ompa、细胞表面抗原ompb(sca5)、细胞表面蛋白sca4、细胞表面蛋白sca1、蛋白ps120、胞质内蛋白d、保护性表面蛋白抗原spa(立克次氏体属(rickettsia),立克次氏体感染);外膜蛋白om、细胞表面抗原ompa、细胞表面抗原ompb(sca5)、细胞表面蛋白sca4、细胞表面蛋白sca1、胞质内蛋白d(小蛛立克次氏体(rickettsiaakari),立克次氏体痘);包膜糖蛋白gp、聚合酶l、核蛋白n、非结构蛋白nss(裂谷热病毒,裂谷热(rvf));外膜蛋白om、细胞表面抗原ompa、细胞表面抗原ompb(sca5)、细胞表面蛋白sca4、细胞表面蛋白sca1、胞质内蛋白d(立氏立克次氏体(rickettsiaakari),落基山斑疹热(rmsf));非结构蛋白6ns6、非结构蛋白2ns2、中间体衣壳蛋白vp6、内部衣壳蛋白vp2、非结构蛋白3ns3、rna-定向rna聚合酶l、蛋白vp3、非结构蛋白1ns1、非结构蛋白5ns5、外衣壳糖蛋白vp7、非结构糖蛋白4ns4、外衣壳蛋白vp4(轮状病毒属,轮状病毒感染);多蛋白p200、糖蛋白e1、糖蛋白e2、蛋白ns2、衣壳蛋白c(风疹病毒,风疹);伴侣蛋白groel(mopa)、磷酸肌醇磷酸酶sopb、热休克蛋白hslu、伴侣蛋白dnaj、蛋白tvib、蛋白iron、鞭毛蛋白flic、侵袭蛋白sipc、糖蛋白gp43、外膜蛋白lamb、外膜蛋白pagc、外膜蛋白tolc、外膜蛋白nmpc、外膜蛋白fadl、转运蛋白sada、转移酶wgap、效应蛋白sifa、stec、ssel、ssej和ssef(沙门菌属(salmonella),沙门菌病);“蛋白14、非结构蛋白ns7b、非结构蛋白ns8a、蛋白9b、蛋白3a、核蛋白n、非结构蛋白ns3b、非结构蛋白ns6、蛋白7a、非结构蛋白ns8b、膜蛋白m、包膜小膜蛋白esm、复制酶多蛋白1a、spike糖蛋白s、复制酶多蛋白1ab;sars冠状病毒,sars(严重急性呼吸综合征));丝氨酸蛋白酶、非典型疥螨抗原1asa1、谷胱甘肽s-转移酶gst、半胱氨酸蛋白酶、丝氨酸蛋白酶、载脂蛋白(疥螨(sarcoptesscabiei),疥疮);谷胱甘肽s-转移酶gst、副肌球蛋白、血红蛋白酶sm32、主要卵抗原、14kda脂肪酸-结合蛋白sm14、主要幼虫表面抗原p37、22,6kda表膜抗原、钙蛋白酶canp、三磷酸异构酶tim、表面蛋白9b、外衣壳蛋白vp2、23kda完整膜蛋白sm23、cu/zn-超氧化物歧化酶、糖蛋白gp、肌球蛋白(血吸虫属(schistosoma),血吸虫病(裂体吸虫病));60kda伴侣蛋白、56kda型特异性抗原、丙酮酸磷酸二激酶、4-羟基苯甲酸辛异戊二烯基转移酶(恙虫病立克次氏体(orientiatsutsugamushi),恙虫病);脱氢酶guab、侵袭蛋白spa32、侵袭素ipaa、侵袭素ipab、侵袭素ipac、侵袭素ipad、侵袭素ipah、侵袭素ipaj(志贺氏菌属(shigella),志贺氏菌病(杆菌性痢疾));蛋白p53、病毒体蛋白us10同源物、转录调控因子ie63、转录反式激活因子ie62、蛋白酶p33、α反式诱导因子74kda蛋白、脱氧尿苷5′-三磷酸核苷酸水解酶、转录反式激活因子ie4、膜蛋白ul43同源物、核磷蛋白ul3同源物、核蛋白ul4同源物、复制起点结合蛋白、膜蛋白2、磷蛋白32、蛋白57、dna聚合酶持续因子、门户蛋白54、dna引物酶、被膜蛋白ul14同源物、被膜蛋白ul21同源物、被膜蛋白ul55同源物、三分末端酶(tripartiteterminase)亚基ul33同源物、三分末端酶亚基ul15同源物、衣壳结合蛋白44、病毒体包装蛋白43(水痘-带状疱疹病毒(vzv),带状疱疹(herpeszoster));截短的3-β羟基-5-烯类固醇脱氢酶同源物、病毒体膜蛋白a13、蛋白a19、蛋白a31、截短的蛋白a35同源物、蛋白a37.5同源物、蛋白a47、蛋白a49、蛋白a51、脑信号蛋白样蛋白a43、丝氨酸蛋白酶抑制剂1、丝氨酸蛋白酶抑制剂2、丝氨酸蛋白酶抑制剂3、蛋白a6、蛋白b15、蛋白c1、蛋白c5、蛋白c6、蛋白f7、蛋白f8、蛋白f9、蛋白f11、蛋白f14、蛋白f15、蛋白f16(大天花或小天花,天花(痘症));粘附素/糖蛋白gp70、蛋白酶(申克孢子丝菌(sporothrixschenckii),孢子丝菌病);血红素-铁结合蛋白isdb、胶原粘附素cna、聚集因子aclfa、蛋白meca、纤连蛋白-结合蛋白afnba、a型肠毒素enta、b型肠毒素entb、c型肠毒素entc1、c型肠毒素entc2、d型肠毒素entd、e型肠毒素ente、中毒性休克综合征毒素-1tsst-1、葡激酶、青霉素结合蛋白2apbp2a(meca)、分泌抗原sssa(葡萄球菌属(staphylococcus),葡萄球菌食物中毒);血红素-铁结合蛋白isdb、胶原粘附素cna、聚集因子aclfa、蛋白meca、纤连蛋白-结合蛋白afnba、a型肠毒素enta、b型肠毒素entb、c型肠毒素entc1、c型肠毒素entc2、d型肠毒素entd、e型肠毒素ente、中毒性休克综合征毒素-1tsst-1、葡激酶、青霉素结合蛋白2apbp2a(meca)、分泌抗原sssa(葡萄球菌属,例如金黄色葡萄球菌,葡萄球菌感染);抗原ss-ir、抗原nie、strongylastacin、na+-k+atp酶sseat-6、原肌球蛋白sstmy-1、蛋白lec-5、41kda抗原p5、41-kda幼虫蛋白、31-kda幼虫蛋白、28-kda幼虫蛋白(粪类圆线虫(strongyloidesstercoralis),类圆线虫病);甘油磷酸二酯磷酸二酯酶glpq(gpd)、外膜蛋白tmpb、蛋白tp92、抗原tpf1、重复蛋白tpr、重复蛋白ftprf、重复蛋白gtprg、重复蛋白itpri、重复蛋白jtprj、重复蛋白ktprk、密螺旋体膜蛋白atmpa、脂蛋白、15kdatpp15、47kda膜抗原、小铁蛋白tpf1、粘附素tp0751、脂蛋白tp0136、蛋白tpn17、蛋白tpn47、外膜蛋白tp0136、外膜蛋白tp0155、外膜蛋白tp0326、外膜蛋白tp0483、外膜蛋白tp0956(苍白密螺旋体(treponemapallidum),梅毒);组织蛋白酶l样蛋白酶、53/25-kda抗原、8kda家族成员、具有边缘胰蛋白酶样活性的囊尾幼虫蛋白tsag5、六钩蚴蛋白tsol18、六钩蚴蛋白tsol45-1a、乳酸脱氢酶aldha、乳酸脱氢酶bldhb(绦虫属(taenia),绦虫病);破伤风毒素tetx、破伤风毒素cttc、140kdas层蛋白、黄素蛋白β-亚基ct3、磷脂酶(卵磷脂酶)、磷载体蛋白hpr(破伤风梭菌(clostridiumtetani),破伤风(牙关紧闭症));基因组多蛋白、蛋白e、蛋白m、衣壳蛋白c(蜱传脑炎病毒(tbev),蜱传脑炎);58-kda抗原、68-kda抗原、弓蛔虫幼虫排泄-分泌抗原tes、32-kda糖蛋白、糖蛋白tes-70、糖蛋白gp31、排泄-分泌抗原tces-57、肠周液抗原pe、可溶性提取物抗原ex、排泄/分泌幼虫抗原es、抗原tes-120、多蛋白变应原tba-1、组织蛋白酶l样半胱氨酸蛋白酶c-cpl-1、26-kda蛋白(犬弓蛔虫(toxocaracanis)或猫弓蛔虫(toxocaracati),弓蛔虫病(眼幼虫移行症(olm)和内脏幼虫移行症(vlm));微丝蛋白(mic1、mic2、mic3、mic4、mic5、mic6、mic7、mic8)、棒状蛋白rop2、棒状蛋白(rop1、rop2、rop3、rop4、rop5、rop6、rop7、rop16、rjop17)、蛋白sr1、表面抗原p22、主要抗原p24、主要表面抗原p30、致密颗粒蛋白(gra1、gra2、gra3、gra4、gra5、gra6、gra7、gra8、gra9、gra10)、28kda抗原、表面抗原sag1、sag2相关抗原、核苷三磷酸酶1、核苷三磷酸酶2、蛋白stt3、含有hesb样结构域的蛋白、菱形样蛋白酶5、toxomepsin1(刚地弓形虫(toxoplasmagondii),弓形虫病);43kda分泌糖蛋白酶、53kda分泌糖蛋白酶、副肌球蛋白、抗原ts21、抗原ts87、抗原p46000、tsl-1抗原、小窝蛋白-1cav-1、49kda新生幼虫抗原、鞘脂激活蛋白原(prosaposin)同源物、丝氨酸蛋白酶、丝氨酸蛋白酶抑制剂、45-kda糖蛋白gp45(旋毛虫(trichinellaspiralis),旋毛虫病);myb样转录因子(myb1、myb2、myb3)、粘附蛋白ap23、粘附蛋白ap33、粘附素蛋白ap33-3、粘附素ap51、粘附素ap65、粘附蛋白ap65-1、α-辅肌动蛋白、驱动蛋白相关蛋白、teneurin、62kda蛋白酶、枯草杆菌蛋白酶样丝氨酸蛋白酶sub1、半胱氨酸蛋白酶基因3cp3、α-烯醇化酶eno1、半胱氨酸蛋白酶cp30、热休克蛋白(hsp70、hsp60)、免疫原性蛋白p270、(阴道毛滴虫(trichomonasvaginalis),滴虫病);β-微管蛋白、47-kda蛋白、分泌性白细胞样蛋白酶-1slp-1、50-kda蛋白tt50、17kda抗原、43/47kda蛋白(鞭形鞭虫(trichuristrichiura),鞭虫病(鞭虫感染));蛋白esat-6(esxa)、10kda滤液抗原esxb、分泌抗原85-bfbpb、纤连蛋白结合蛋白afbpa(ag85a)、丝氨酸蛋白酶pepa、ppe家族蛋白ppe18、纤连蛋白结合蛋白dfbpd、免疫原性蛋白mpt64、分泌蛋白mpt51、过氧化氢酶-过氧化物酶-过氧亚硝酸酶(peroxynitritase)tkatg、周质磷酸结合脂蛋白psts3(pbp-3、phos-1)、铁调控肝素结合血凝素hbha、ppe家族蛋白ppe14、ppe家族蛋白ppe68、蛋白mtb72f、蛋白apa、免疫原性蛋白mpt63、周质磷酸结合脂蛋白psts1(pbp-1)、分子伴侣dnak、细胞表面脂蛋白mpt83、脂蛋白p23、磷酸转运系统通透酶蛋白psta、14kda抗原、纤连蛋白结合蛋白cfbpc1、丙氨酸脱氢酶tb43、谷氨酰胺合酶1、esx-1蛋白、蛋白cfp10、tb10.4蛋白、蛋白mpt83、蛋白mtb12、蛋白mtb8、rpf样蛋白、蛋白mtb32、蛋白mtb39、晶体蛋白、热休克蛋白hsp65、蛋白pst-s(通常是结核分枝杆菌(mycobacteriumtuberculosis),肺结核);外膜蛋白foba、外膜蛋白fobb、胞内生长基因座lglc1、胞内生长基因座iglc2、氨基转移酶wbtl、伴侣蛋白groel、17kda主要膜蛋白tul4、脂蛋白lpna、壳多糖酶家族18蛋白、异柠檬酸脱氢酶、nif3家族蛋白、iv型菌毛糖基化蛋白、外膜蛋白tolc、fad结合家族蛋白、iv型菌毛多聚体外膜蛋白、双组分传感蛋白kdpd、伴侣蛋白dnak、蛋白tolq(土拉热弗朗西丝菌(francisellatularensis),土拉菌病);“mb抗原、尿素酶、蛋白gyra、蛋白gyrb、蛋白parc、蛋白pare、脂质相关膜蛋白lamp、胸苷激酶tk、磷脂酶pl-a1、磷脂酶pl-a2、磷脂酶pl-c、表面表达的96-kda抗原;”(解脲支原体(ureaplasmaurealyticum),解脲支原体感染);非结构多蛋白、结构多蛋白、衣壳蛋白cp、蛋白e1、蛋白e2、蛋白e3、蛋白酶p1、蛋白酶p2、蛋白酶p3(委内瑞拉马脑炎病毒,委内瑞拉马脑炎);糖蛋白gp、基质蛋白z、聚合酶l、核蛋白n(瓜纳里托病毒,委内瑞拉出血热);多蛋白、蛋白e、蛋白m、衣壳蛋白c、蛋白酶ns3、蛋白ns1、蛋白ns2a、蛋白as2b、蛋白ns4a、蛋白ns4b、蛋白ns5(西尼罗河病毒,西尼罗热);衣壳蛋白cp、蛋白e1、蛋白e2、蛋白e3、蛋白酶p2(西部马脑炎病毒,西部马脑炎);基因组多蛋白、蛋白e、蛋白m、衣壳蛋白c、蛋白酶ns3、蛋白ns1、蛋白ns2a、蛋白as2b、蛋白ns4a、蛋白ns4b、蛋白ns5(黄热病病毒,黄热病);推定的yop靶向蛋白yobb、效应蛋白yopd、效应蛋白yope、蛋白yoph、效应蛋白yopj、蛋白易位蛋白yopk、效应蛋白yopt、蛋白ypka、鞭毛生物合成蛋白flha、肽酶m48、钾流出系统kefa、转录调控因子rova、粘附素ifp、易位蛋白lcrv、蛋白pcrv、侵袭素inv、外膜蛋白ompf样孔蛋白、粘附素yada、蛋白激酶c、磷脂酶c1、蛋白psaa、甘露糖基转移酶样蛋白wbyk、蛋白yscu、抗原ypma(假结核耶尔森氏菌(yersiniapseudotuberculosis),假结核耶尔森氏菌感染);效应蛋白yopb、60kda伴侣蛋白、蛋白wbcp、酪氨酸-蛋白磷酸酶yoph、蛋白yopq、肠毒素、半乳糖苷通透酶、还原酶nrde、蛋白yasn、侵袭素inv、粘附素yada、外膜孔蛋白fompf、蛋白uspa1、蛋白eiba、蛋白hia、细胞表面蛋白ail、伴侣蛋白sycd、蛋白lcrd、蛋白lcrg、蛋白lcrv、蛋白syce、蛋白yope、调控蛋白tyea、蛋白yopm、蛋白yopn、蛋白yopo、蛋白yopt、蛋白yopd、蛋白酶clpp、蛋白myfa、蛋白fila和蛋白psaa(小肠结肠炎耶尔森氏菌(yersiniaenterocolitica),耶尔森氏菌病)。前一节中的括号表示抗原衍生自的特定病原体或病原体家族以及与该病原体相关的传染病。流感:在本发明的第一方面的特别优选的实施例中,mrna化合物包含mrna序列,该mrna序列包含编码区,该编码区编码衍生自流感病毒的血凝素(ha)、神经氨酸酶(na)、核蛋白(np)、基质蛋白1(m1)、基质蛋白2(m2)、非结构蛋白1(ns1)、非结构蛋白2(ns2)、核输出蛋白(nep)、聚合酶酸性蛋白(pa)、聚合酶碱性蛋白pb1、pb1-f2或聚合酶碱性蛋白2(pb2)或者其片段或变体的至少一种抗原肽或蛋白。在此上下文中,该至少一种抗原肽或蛋白的氨基酸序列可选自衍生自流感病毒的血凝素(ha)、神经氨酸酶(na)、核蛋白(np)、基质蛋白1(m1)、基质蛋白2(m2)、非结构蛋白1(ns1)、非结构蛋白2(ns2)、核输出蛋白(nep)、聚合酶酸性蛋白(pa)、聚合酶碱性蛋白pb1、pb1-f2或聚合酶碱性蛋白2(pb2)或者其片段或变体或衍生自任何合成工程化的流感病毒肽或蛋白的任何肽或蛋白。在本发明的优选实施例中,编码区编码衍生自流感病毒的血凝素(ha)和/或神经氨酸酶(na)或者其片段或变体的至少一种抗原肽或蛋白。在此上下文中,血凝素(ha)和神经氨酸酶(na)可以选自相同的流感病毒或不同的流感病毒。在此上下文中,特别优选的是,该至少一个编码区编码流感病毒的血凝素(ha)、神经氨酸酶(na)、核蛋白(np)、基质蛋白1(m1)、基质蛋白2(m2)、非结构蛋白1(ns1)、非结构蛋白2(ns2)、核输出蛋白(nep)、聚合酶酸性蛋白(pa)、聚合酶碱性蛋白pb1、pb1-f2或聚合酶碱性蛋白2(pb2)的至少一种全长蛋白或者其片段或变体。在特别优选的实施例中,该至少一个编码区编码流感病毒的血凝素(ha)的至少一种全长蛋白和/或神经氨酸酶(na)的至少一种全长蛋白或者其变体。如本文所用的术语“全长蛋白”典型地是指基本上包含天然存在的蛋白的整个氨基酸序列的蛋白。如本文所用,术语“全长蛋白”优选地涉及如在本发明的序列表中所指出的蛋白的全长序列,即,涉及序列表中所列出的seqidno中的任一个所定义的氨基酸序列(seqidno:1-30504或seqidno:224269或seqidno:224309)或涉及在数据库中以相应的数据库登录号提供的氨基酸。本发明的优选序列:在此上下文中,进一步优选的是,本发明的mrna序列的至少一个编码序列编码衍生自以下的至少一种抗原肽或蛋白甲型流感病毒的血凝素(ha)蛋白;或者乙型流感病毒的血凝素(ha)蛋白;或者甲型流感病毒的神经氨酸酶(na)蛋白;或者乙型流感病毒的神经氨酸酶(na)蛋白;或者或其片段或变体,其中甲型流感病毒的血凝素(ha)蛋白或乙型流感病毒的血凝素(ha)蛋白或甲型流感病毒的神经氨酸酶(na)蛋白或乙型流感病毒的神经氨酸酶(na)蛋白选自如在本发明的序列表中列出的血凝素(ha)蛋白或神经氨酸酶(na)蛋白。序列表披露了本发明优选的所有甲型流感病毒或乙型流感病毒血凝素(ha)蛋白和所有甲型流感病毒或乙型流感病毒神经氨酸酶(na)蛋白。可以用数字标识符<223>下显示的数据元素标识每种优选的抗原肽或蛋白及其编码序列。换句话说,通过通读数字标识符<223>下的序列表条目,可以通过特定的数据库登录号(即genbank蛋白或核酸登录号)鉴定来自甲型流感或乙型流感病毒的每种优选的血凝素(ha)或神经氨酸酶(na)序列。总之,每个优选的序列由其genbank蛋白或核酸登录号描述,该登录号又用序列表中的七个不同的优选seqidno描述(蛋白、核酸野生型、核酸优化1至5)。这从数字标识符<223>中显而易见。即,在序列表中在数字标识符<223>下的特定genbank蛋白或核酸登录号的第一个连续条目表示对应于相应氨基酸序列的seqidno:(即蛋白序列野生型seqidno)。进一步地,在序列表中在数字标识符<223>下的genbank蛋白或核酸登录号的第二个连续条目对应于编码蛋白的野生型mrna的核酸序列(即核苷酸序列野生型seqidno)。进一步地,在序列表中在数字标识符<223>下的genbank蛋白或核酸登录号的下五个连续条目提供对应于如本文所述的序列的五种不同的修饰/优化核酸序列的seqidno,这些核酸序列编码优选地具有序列表中特定genbank蛋白或核酸登录号的第一个连续条目所定义的氨基酸序列的蛋白(即,优化的核苷酸序列seqidno)。因此,对特定genbank蛋白或核酸登录号的提及等于对如上所述的七个序列的块的提及(蛋白=1、核酸=2、优化序列=3-7)。一个实例将是序列表中提到的第一个genbank蛋白或核酸登录号,即在seqidno:1数字标识符<223>:aaa16879下。如果在整个序列表中搜索登录号aaa16879,则显然的是,如上所述,以下七个seqidno连接到该登录号:seqidno:1、seqidno:32013、seqidno:64025、seqidno:96037、seqidno:128049、seqidno:160061和seqidno:192073。按照上面的解释,对于seqidno:1,数字标识符<223>读取“衍生和/或修饰的蛋白序列(wt),来自血凝素_甲型流感__aaa16879”;对于seqidno:32013,数字标识符<223>读取“衍生和/或修饰的cds序列(wt),来自血凝素_甲型流感__aaa16879”;对于seqidno:64025,数字标识符<223>读取“衍生和/或修饰的cds序列(opt1),来自血凝素__甲型流感__aaa16879”;对于seqidno:96037,数字标识符<223>读取“衍生和/或修饰的cds序列(opt2),来自血凝素__甲型流感__aaa16879”;对于seqidno:128049,数字标识符<223>读取“衍生和/或修饰的cds序列(opt3),来自血凝素__甲型流感__aaa16879”;对于seqidno:160061,数字标识符<223>读取“衍生和/或修饰的cds序列(opt4),来自血凝素__甲型流感__aaa16879”;以及对于seqidno:192073,数字标识符<223>读取“衍生和/或修饰的cds序列(opt5),来自血凝素__甲型流感__aaa16879”。因此,对aaa16879的提及等于对如上所述的七个序列的提及(蛋白=第1个序列,核酸=第2个序列,五个不同的优化序列=第3个至第7个序列)。第二个实例将是序列表中提到的第二个genbank蛋白或核酸登录号,即在seqidno:2数字标识符<223>:“aaa16880”下。登录号aaa16880与序列表中的这七个序列连接:seqidno:2(蛋白)、32014(核酸野生型)、64026(优化1)、96038(优化2)、128050(优化3)、160062(优化4)和192074(优化5)。因此,对aaa16880的提及等于对如上所述的七个序列的提及。在示例性附图20-24中可以看到对这种情况的进一步说明,这些图通过举例说明甲型流感和乙型流感病毒的血凝素(ha)蛋白和神经氨酸酶(na)蛋白以及狂犬病毒的糖蛋白来显示序列表的结构:-甲型流感病毒的示例性血凝素(ha)蛋白(图20);-乙型流感病毒的示例性血凝素(ha)蛋白(图21);-甲型流感病毒的示例性神经氨酸酶(na)蛋白(图22);-乙型流感病毒的示例性神经氨酸酶(na)蛋白(图23);-狂犬病毒的示例性糖蛋白(图24)。本文参考2016年10月26日提交的pct/ep2016/075843(即本国际专利申请的优先权申请)的图20-24的内容,该专利以援引方式并入本文。在具体的实施例中,流感病毒肽或蛋白衍生自甲型、乙型或丙型流感病毒(株)。甲型流感病毒可选自特征在于选自由h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15、h16、h17和h18组成的组的血凝素(ha)的甲型流感病毒。优选地,甲型流感病毒选自特征在于选自由h1、h3、h5或h9组成的组的血凝素(ha)的流感病毒。此外,特别优选的是特征在于选自由n1、n2、n3、n4、n5、n6、n7、n8、n9、n10和n11组成的组的神经氨酸酶(na)的甲型流感病毒。最优选地,甲型流感病毒的特征在于选自由n1、n2和n8组成的组的神经氨酸酶(na)。在特别优选的实施例中,甲型流感病毒选自由h1n1、h1n2、h2n2、h3n1、h3n2、h3n8、h5n1、h5n2、h5n3、h5n8、h5n9、h7n1、h7n2、h7n3、h7n4、h7n7、h7n9、h9n2、h10n8和h10n7组成的组,优选地选自h1n1、h3n2、h5n1和h5n8。在此上下文中,特别优选的是,本发明的mrna序列的至少一个编码区编码衍生自甲型流感病毒的血凝素(ha)或者其片段或变体的至少一种抗原肽或蛋白和/或衍生自甲型流感病毒的神经氨酸酶(na)或者其片段或变体的至少一种抗原肽或蛋白,该甲型流感病毒选自由h1n1、h1n2、h2n2、h3n1、h3n2、h3n8、h5n1、h5n2、h5n3、h5n8、h5n9、h7n1、h7n2、h7n3、h7n4、h7n7、h7n9、h9n2、h10n8和h10n7组成的组,优选地选自h1n1、h3n2、h5n1、h5n8。在本发明的上下文中,由根据本发明的mrna序列的至少一个编码区编码的蛋白或其变体的片段典型地可以包含具有与相应的天然存在的全长蛋白或其变体的、优选地根据seqidno:1-30504的氨基酸序列至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%,优选至少70%,更优选至少80%,甚至更优选至少85%,甚至更优选至少90%,并且最优选至少95%或甚至97%的序列同一性的氨基酸序列。在具体的实施例中,抗原肽或蛋白衍生自根据seqidno:1-14031的甲型流感病毒的血凝素(ha)蛋白。在此上下文中,进一步优选的是,本发明的mrna序列的至少一个编码序列编码衍生自甲型流感病毒的血凝素(ha)蛋白或者其片段或其变体的至少一种抗原肽或蛋白,其中甲型流感病毒的血凝素(ha)蛋白选自序列表中列出的血凝素(ha)蛋白(参见seqidno:1-32012或seqidno:224269或seqidno:224309和章节“本发明的优选序列”下的解释)。其中,每种血凝素(ha)通过相应蛋白的数据库登录号来标识(参见指示蛋白或核酸登录号(genbank)的序列表数字标识符<223>)。如果在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示所述蛋白或核酸登录号(genbank)的下一个seqidno:对应于编码所述蛋白的野生型mrna的核酸序列。如果再次在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示相应蛋白或核酸登录号的下五个seqidno对应于如本文所述的mrna的五种修饰的/优化的核酸序列,这些核酸序列编码优选地具有如前所述的相应氨基酸序列的蛋白(具有相应蛋白或核酸登录号(genbank)的第一个条目)。在此上下文中特别优选的是以下ha蛋白序列:甲型流感/越南/1203/2004(h5n1)的ha蛋白(seqidno:13861-13871)-甲型流感/越南/1194/2004(h5n1)的ha蛋白;(seqidno:13859-13860)-甲型流感/香港/4801/2014(h3n2)的ha蛋白(seqidno:13853-13856)-甲型流感/荷兰/602/2009(h1n1)的ha蛋白(seqidno:13848-13850)-甲型流感/加利福尼亚州/07/2009(h1n1)的ha蛋白(seqidno:13836-13844)-甲型流感/密歇根州/45/2015(h1n1)的ha蛋白(seqidno:13845-13847)在具体的实施例中,抗原肽或蛋白衍生自根据seqidno:26398-28576的乙型流感病毒的血凝素(ha)蛋白。在此上下文中,进一步优选的是,本发明的mrna序列的至少一个编码序列编码衍生自乙型流感病毒的血凝素(ha)蛋白或者其片段或其变体的至少一种抗原肽或蛋白,其中乙型流感病毒的血凝素(ha)蛋白选自序列表中列出的血凝素(ha)蛋白(参见seqidno:1-32012或seqidno:224269或seqidno:224309和章节“本发明的优选序列”下的解释)。其中,每种血凝素(ha)通过相应蛋白的数据库登录号来标识(参见指示蛋白或核酸登录号(genbank)的序列表数字标识符<223>)。如果在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示所述蛋白或核酸登录号(genbank)的下一个seqidno:对应于编码所述蛋白的野生型mrna的核酸序列。如果再次在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示相应蛋白或核酸登录号的下五个seqidno对应于如本文所述的mrna的五种修饰的/优化的核酸序列,这些核酸序列编码优选地具有如前所述的相应氨基酸序列的蛋白(具有相应蛋白或核酸登录号(genbank)的第一个条目)。在此上下文中特别优选的是以下ha蛋白序列:-乙型流感/普吉岛/3037/2013的ha蛋白(epi540671;seqidno:28530-28532)-乙型流感/布里斯班/60/2008的ha蛋白(seqidno:28524-28529)在进一步的具体实施例中,抗原肽或蛋白衍生自根据seqidno:14032-26397、224309或224310的甲型流感病毒的神经氨酸酶(na)蛋白。在此上下文中,进一步优选的是,本发明的mrna序列的至少一个编码序列编码衍生自甲型流感病毒的神经氨酸酶(na)蛋白或者其片段或其变体的至少一种抗原肽或蛋白,其中甲型流感病毒的神经氨酸酶(na)蛋白选自序列表中列出的神经氨酸酶(na)蛋白(参见seqidno:1-32012或seqidno:224269或seqidno:224309和章节“本发明的优选序列”下的解释)。其中,每种神经氨酸酶(na)通过相应蛋白的数据库登录号来标识(参见指示蛋白或核酸登录号(genbank)的序列表数字标识符<223>)。如果在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示所述蛋白或核酸登录号(genbank)的下一个seqidno:对应于编码所述蛋白的野生型mrna的核酸序列。如果再次在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示相应蛋白或核酸登录号的下五个seqidno对应于如本文所述的mrna的五种修饰的/优化的核酸序列,这些核酸序列编码优选地具有如前所述的相应氨基酸序列的蛋白(具有相应蛋白或核酸登录号(genbank)的第一个条目)。在此上下文中特别优选的是以下na蛋白序列:-甲型流感/香港/4801/2014(h3n2)的na蛋白:seqidno:26251-26254-甲型流感/加利福尼亚州/7/2009(h1n1)pdm09的na蛋白:seqidno:26238-26243-甲型流感/越南/1194/2004(h5n1)的na蛋白:seqidno:224310-甲型流感/越南/1203/2004的na蛋白(h5n1):seqidno:26255-26257-甲型流感/荷兰/602/2009(h1n1)的na蛋白:seqidno:26246-26250-甲型流感/密歇根州/45/2015(h1n1)的na蛋白(seqidno:26244-26245)在进一步的具体实施例中,抗原肽或蛋白衍生自根据seqidno:28577-30504的乙型流感病毒的神经氨酸酶(na)蛋白。在此上下文中,进一步优选的是,本发明的mrna序列的至少一个编码序列编码衍生自乙型流感病毒的神经氨酸酶(na)蛋白或者其片段或其变体的至少一种抗原肽或蛋白,其中乙型流感病毒的神经氨酸酶(na)蛋白选自序列表中列出的神经氨酸酶(na)蛋白(参见seqidno:1-32012或seqidno:224269或seqidno:224309和章节“本发明的优选序列”下的解释)。其中,每种神经氨酸酶(na)通过相应蛋白的数据库登录号来标识(参见指示蛋白或核酸登录号(genbank)的序列表数字标识符<223>)。如果在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示所述蛋白或核酸登录号(genbank)的下一个seqidno:对应于编码所述蛋白的野生型mrna的核酸序列。如果再次在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示相应蛋白或核酸登录号的下五个seqidno对应于如本文所述的mrna的五种修饰的/优化的核酸序列,这些核酸序列编码优选地具有如前所述的相应氨基酸序列的蛋白(具有相应蛋白或核酸登录号(genbank)的第一个条目)。在此上下文中特别优选的是以下na蛋白序列:-乙型流感/布里斯班/60/2008的na蛋白:seqidno:30455-30460-乙型流感/普吉岛/3037/2013的na蛋白:seqidno:30461-30462此外,在此上下文中,编码衍生自流感病毒的血凝素(ha)和/或神经氨酸酶(na)或者其片段、变体或衍生物的至少一种抗原肽或蛋白的编码区可选自包含编码衍生自任何流感病毒分离株的血凝素(ha)或神经氨酸酶(na)或者其片段或变体的编码区的任何核酸序列。在优选的实施例中,本发明因此提供包含至少一个编码区的mrna序列,其中编码甲型流感病毒的血凝素(ha)的编码区包含如在序列表中(即seqidno:32013-46043;64025-78055、224085-224106、96037-110067、128049-142079、160061-174091、192073-206103;参见上文解释和在章节“本发明的优选序列”下的解释)所披露的核酸序列中的任一种,或这些序列中任一种的片段或变体,或由其组成。在这些上下文中,特别优选的是,根据本发明的mrna序列包含编码甲型流感病毒的血凝素(ha)的至少一个编码区,该至少一个编码区包含rna序列,该rna序列选自与在序列表中(参见上文解释和在章节“本发明的优选序列”下的解释,seqidno:32013-46043、64025-78055、224085-224106、96037-110067、128049-142079、160061-174091、192073-206103)所披露的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。在特别优选的实施例中,该mrna序列包含编码甲型流感病毒的血凝素(ha)的至少一个编码区,该至少一个编码区包含选自以下rna序列的rna序列:-编码甲型流感/越南/1203/2004(h5n1)的ha蛋白的mrna,优选地根据seqidno:45873-45883、77885-77895、109897-109907、141909-141919、173921-173931、205933-205943的mrna序列。-编码甲型流感/越南/1194/2004(h5n1)的ha蛋白的mrna,优选地根据seqidno:45871、45872、77883、77884、109895、109896、141907、141908、173919、173920、205931、205932的mrna序列。-编码甲型流感/香港/4801/2014(h3n2)的ha蛋白的mrna,优选地根据seqidno:45865-45868、77877-77877、109889-109889、141901-141901、173913-173913、205925-205925的mrna序列。-编码甲型流感/荷兰/602/2009(h1n1)的ha蛋白的mrna,优选地根据seqidno:45860-45862、77872-77874、109884-109886、173908-173910、205920-205922的mrna序列。-编码甲型流感/加利福尼亚州/07/2009(h1n1)的ha蛋白的mrna,优选地根据seqidno:45848-45856、77860-77868、109872-109880、141884-141892、173896-173904、205908-205916的mrna序列-编码甲型流感/密歇根州/45/2015(h1n1)的ha蛋白的mrna,优选地根据seqidno:45857-45859、77869-77871、109881-109883、141893-141895、173905-173907、205917-205919的mrna序列。在优选的实施例中,本发明因此提供包含至少一个编码区的mrna序列,其中编码乙型流感病毒的血凝素(ha)的编码区包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表2或图21的“b列”或“c列”即seqidno:58410-60588、90422-92600、224107-224112、122434-124612、154446-156624、186458-188636、218470-220648披露的核酸序列中的任一种或这些序列中任一种的片段或变体,或由其组成。在这些上下文中,特别优选的是,根据本发明的mrna序列包含编码乙型流感病毒的血凝素(ha)的至少一个编码区,该至少一个编码区包含rna序列,该rna序列选自与如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表2或图21的“b列”或“c列”即seqidno:58410-60588、90422-92600、224107-224112、122434-124612、154446-156624、186458-188636、218470-220648披露的rna序列或这些序列中任一种的片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。在特别优选的实施例中,该mrna序列包含编码乙型流感病毒的血凝素(ha)的至少一个编码区,该至少一个编码区包含选自以下rna序列的rna序列:-编码乙型流感病毒/普吉岛/3037/2013的ha蛋白的mrna,优选地根据seqidno:60542-60544、92554-92556、124566-124568、156578-156580、188590-188592、220602-220604的mrna序列。-编码乙型流感/布里斯班/60/2008的ha蛋白的mrna(gi:223950973;fj766840.1),优选地根据seqidno:60536-60541、92548-92553、124560-124565、156572-156577、188584-188589、220596-220601的mrna序列。在优选的实施例中,本发明因此提供包含至少一个编码区的mrna序列,其中编码甲型流感病毒的神经氨酸酶(na)的编码区包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表3或图22的“b列”或“c列”即seqidno:46044-58409、224311、224312、78056-90421、224113、224313-224317、110068-122433、142080-154445、174092-186457、206104-218469披露的核酸序列中的任一种或这些序列中任一种的片段或变体,或由其组成。在这些上下文中,特别优选的是,根据本发明的mrna序列包含编码甲型流感病毒的神经氨酸酶(na)的至少一个编码区,该至少一个编码区包含rna序列,该rna序列选自与如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表3或图22的“b列”或“c列”即seqidno:46044-58409、224311、224312、78056-90421、224113、224313-224317、110068-122433、142080-154445、174092-186457、206104-218469披露的rna序列或这些序列中任一种的片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。在特别优选的实施例中,该mrna序列包含编码甲型流感病毒的神经氨酸酶(na)的至少一个编码区,该至少一个编码区包含选自以下rna序列的rna序列:-编码甲型流感/香港/4801/2014(h3n2)的na蛋白的mrna:seqidno:58263-58266、90275-90278、122287-122290、154299-154302、186311-186314、218323-218326。-编码甲型流感/加利福尼亚州/7/2009(h1n1)pdm09的na蛋白的mrna:seqidno:58250-58255、90262-90267、122274-122279、154286-154291、186298-186303、218310-218315。-编码甲型流感/越南/1194/2004(h5n1)的na蛋白的mrna:seqidno:224312。-编码甲型流感/越南/1203/2004(h5n1)的na蛋白的mrna:seqidno:58267-58269、90279-90281、122291-122293、154303-154305、186315-186317、218327-218329。-编码甲型流感/密歇根州/45/2015(h1n1)的na蛋白的mrna,优选地根据seqidno:58256-58257、90268-90269、122280-122281、154292-154293、186304-186305、218316-218317的mrna序列。-编码甲型流感/荷兰/602/2009(h1n1)的na蛋白的mrna,优选地根据seqidno:58258-58262、90270-90274、122282-122286、154294-154298、186306-186310、218318-218322的mrna序列。在优选的实施例中,本发明因此提供包含至少一个编码区的mrna序列,其中编码乙型流感病毒的神经氨酸酶(na)的编码区包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表4或图23的“b列”或“c列”即seqidno:60589-62516、92601-94528、124613-126540、156625-158552、188637-190564、220649-222576披露的核酸序列中的任一种或这些序列中任一种的片段或变体,或由其组成。在这些上下文中,特别优选的是,根据本发明的mrna序列包含编码乙型流感病毒的神经氨酸酶(na)的至少一个编码区,该至少一个编码区包含rna序列,该rna序列选自与如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表4或图23的“b列”或“c列”即seqidno:60589-62516、92601-94528、124613-126540、156625-158552、188637-190564、220649-222576披露的rna序列或这些序列中任一种的片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。在特别优选的实施例中,该mrna序列包含编码乙型流感病毒的神经氨酸酶(na)的至少一个编码区,该至少一个编码区包含选自以下rna序列的rna序列:-编码乙型流感/布里斯班/60/2008的na蛋白的mrna(gi:223950973;fj766840.1):seqidno:62467-62472、94479-94484、126491-126496、158503-158508、190515-190520、222527-222532。-编码乙型流感病毒/普吉岛/3073/2013的na蛋白的mrna:seqidno:62473-62474、94485-94486、126497-126498、158509-158510、190521-190522、222533-222534。狂犬病:在本发明的第一方面的特别优选的实施例中,含有mrna序列的mrna化合物包含编码区,该编码区编码衍生自狂犬病毒的糖蛋白g或者其片段或变体的至少一种抗原肽或蛋白。在此上下文中,该至少一种抗原肽或蛋白的氨基酸序列可以选自衍生自狂犬病毒的糖蛋白或者片段或变体的任何肽或蛋白、或选自任何合成工程化的狂犬病毒肽或蛋白。在本发明的优选实施例中,该编码区编码衍生自狂犬病毒的糖蛋白或者其片段或变体的至少一种抗原肽或蛋白。在此上下文中,特别优选的是,该至少一个编码区编码狂犬病毒的糖蛋白的至少一种全长蛋白或其变体。如本文所用,术语“全长蛋白”优选地涉及本发明的序列表中所指出的全长蛋白序列。更优选地,术语“全长蛋白”优选地是指序列表(seqidno:30505-32012)中列出的seqidno中的任一个所定义的氨基酸序列或指在数据库中在相应的数据库登录号下提供的氨基酸。在此上下文中,进一步优选的是,本发明的mrna序列的至少一个编码序列编码衍生自狂犬病毒的糖蛋白或者其片段或变体的至少一种抗原肽或蛋白,其中狂犬病毒的糖蛋白选自序列表中列出的狂犬病毒蛋白的糖蛋白(参见seqidno:1-32012或seqidno:224269或seqidno:224309以及在章节“本发明的优选序列”下的解释)。其中,狂犬病毒的每种糖蛋白通过相应蛋白的数据库登录号来标识(参见指示蛋白或核酸登录号(genbank)的序列表数字标识符<223>)。如果在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示所述蛋白或核酸登录号(genbank)的下一个seqidno:对应于编码所述蛋白的野生型mrna的核酸序列。如果再次在序列表中更进一步搜索相应的蛋白或核酸登录号(genbank),则在数字标识符<223>下显示相应蛋白或核酸登录号的下五个seqidno对应于如本文所述的mrna的五种修饰的/优化的核酸序列,这些核酸序列编码优选地具有如前所述的相应氨基酸序列的蛋白(具有相应蛋白或核酸登录号(genbank)的第一个条目)。在此上下文中特别优选的是以下糖蛋白序列:seqidno:31986、31073、31102。此外,在此上下文中,编码衍生自狂犬病毒的糖蛋白或者其片段、变体或衍生物的至少一种抗原肽或蛋白的编码区可选自包含编码衍生自任何狂犬病毒分离株的糖蛋白或者其片段或变体的编码区的任何核酸序列。在优选的实施例中,本发明因此提供包含至少一个编码区的mrna序列,其中编码狂犬病毒的糖蛋白的编码区包含如在序列表中(参见上文解释;优选地seqidno:62517-64024;224270、224274、94529-96036、224271-224273、126541-128048、158553-160060、190565-192072、222577-224084)所披露的核酸序列中的任一种,或这些序列中任一种的片段或变体,或由其组成。在这些上下文中,特别优选的是,根据本发明的mrna序列包含编码衍生自狂犬病毒的糖蛋白的至少一个编码区,该至少一个编码区包含rna序列,该rna序列选自与在序列表中(参见上文解释;优选地seqidno:62517-64024;224270、224274、94529-96036、224271-224273、126541-128048、158553-160060、190565-192072、222577-224084)所披露的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。在特别优选的实施例中,该mrna序列包含编码狂犬病毒的糖蛋白(rabv-g)的至少一个编码区,该至少一个编码区包含选自以下rna序列的rna序列:编码狂犬病毒(巴斯德株)的糖蛋白的mrna,优选地根据seqidno:63998、96010、128022、160034、192046、224058的mrna序列。埃博拉:埃博拉病毒:埃博拉病毒和遗传相关性马尔堡病毒是导致严重疾病的人类病原体。埃博拉病毒和马尔堡病毒是丝状病毒,它们是具有负链rna基因组的包膜病毒。丝状病毒科包括三个属:埃博拉病毒属、马尔堡病毒属和奎瓦病毒属。奎瓦病毒属和马尔堡病毒属仅包括一个种,即分别为lloviucuevavirus(lloviu病毒-llov)和marburgmarburgvirus,后者又细分为马尔堡病毒(marv)和拉夫病毒(ravv)。埃博拉病毒属包括五个已知的种,即本迪布焦埃博拉病毒(bundibugyoebolavirus)(本迪布焦病毒-bdbv)、雷斯顿埃博拉病毒(restonebolavirus)(雷斯顿病毒-restv)、苏丹埃博拉病毒(sudanebolavirus)(苏丹病毒-sudv)、塔伊森林埃博拉病毒(塔伊森林病毒-tafv)(=d′ivoireebolavirus)和扎伊尔埃博拉病毒(埃博拉病毒-ebov)。虽然奎瓦病毒已从蝙蝠中分离并且它们作为人类病原体的可能性仍然未知,但埃博拉病毒和马尔堡病毒都是分别引起特征在于出血热和极高死亡率的埃博拉病毒病(evd)和马尔堡病毒病的人类病原体。在本发明的上下文中,属于上列科和属的病毒或与之相关或由其衍生的任何病毒、病毒成员、病毒株、病毒类型、病毒亚型、病毒分离株、病毒变体或病毒血清型或病毒基因重配株均被认为是“埃博拉病毒”。在本发明的第一方面的特别优选的实施例中,含有mrna序列的mrna化合物包含编码区,该编码区编码衍生自埃博拉病毒属或马尔堡病毒属的病毒的糖蛋白(gp)和/或基质蛋白40(vp40)和/或核蛋白(np)或者其片段、变体或衍生物的至少一种抗原肽或蛋白。在此上下文中,该至少一种抗原肽或蛋白的氨基酸序列可以选自衍生自埃博拉病毒的糖蛋白(gp)和/或基质蛋白40(vp40)和/或核蛋白(np)或者片段或变体或者衍生自任何合成工程化的埃博拉病毒肽或蛋白的任何肽或蛋白。在本发明的优选实施例中,该编码区编码衍生自埃博拉病毒的糖蛋白或者其片段或变体的至少一种抗原肽或蛋白。在此上下文中,特别优选的是,该至少一个编码区编码埃博拉病毒的糖蛋白的至少一种全长蛋白或其变体。在此上下文中特别优选的是以下埃博拉糖蛋白氨基酸序列:专利申请wo2016097065的seqidno:1至6,或者这些序列的片段或变体。在此上下文中,wo2016097065的seqidno:1至6以及与wo2016097065的seqidno:1至6相关的披露内容以援引方式并入本文。在此上下文中特别优选的是以下埃博拉vp40氨基酸序列:专利申请wo2016097065的seqidno:7至12,或者这些序列的片段或变体。在此上下文中,wo2016097065的seqidno:7至12以及与wo2016097065的seqidno:7至12相关的披露内容以援引方式并入本文。在此上下文中特别优选的是以下埃博拉np氨基酸序列:专利申请wo2016097065的seqidno:13至18,或者这些序列的片段或变体。在此上下文中,wo2016097065的seqidno:13至18以及与wo2016097065的seqidno:13至18相关的披露内容以援引方式并入本文。在优选的实施例中,本发明提供包含至少一个编码区的mrna序列,其中编码埃博拉病毒的如本文所规定的抗原肽或蛋白的编码区包含根据专利申请wo2016097065的seqidno:20至27的核酸序列中的任一种,或这些序列的片段或变体,或由其组成。在此上下文中,wo2016097065的seqidno:20至27以及与wo2016097065的seqidno:20至27相关的披露内容以援引方式并入本文。在特别优选的实施例中,该mrna序列包含编码埃博拉病毒的糖蛋白的至少一个编码区。在特别优选的实施例中,该mrna序列包含编码埃博拉病毒的vp40的至少一个编码区。在特别优选的实施例中,该mrna序列包含编码埃博拉病毒的np的至少一个编码区。在特别优选的实施例中,该mrna序列包含编码埃博拉病毒的抗原肽或蛋白的至少一个编码区,该至少一个编码区包含选自以下rna序列的rna序列:-编码埃博拉病毒的gp蛋白的mrna:专利申请wo2016097065的seqidno:37-39,或这些序列的片段或变体。在此上下文中,wo2016097065的seqidno:37-39和涉及wo2016097065的seqidno:37-39的披露内容以援引方式并入本文。-编码埃博拉病毒的vp40的mrna:专利申请wo2016097065的seqidno:40-42,或这些序列的片段或变体。在此上下文中,wo2016097065的seqidno:40-42和涉及wo2016097065的seqidno:40-42的披露内容以援引方式并入本文。-编码埃博拉病毒的np的mrna:专利申请wo2016097065的seqidno:43-44,或这些序列的片段或变体。在此上下文中,wo2016097065的seqidno:43-44和涉及wo2016097065的seqidno:43-44的披露内容以援引方式并入本文。特别优选的是根据seqidno:224362的包含编码gp的编码序列的mrna序列。肿瘤抗原:优选地,根据本发明的含有mrna序列的mrna化合物的至少一个编码序列编码肿瘤抗原,优选如本文所定义的肿瘤抗原,或者其片段或变体,其中该肿瘤抗原优选地选自由以下组成的组:1a01_hla-a/m;1a02;5t4;acrbp;afp;akap4;α-辅肌动蛋白-_4/m;α-甲基酰基-辅酶_a_消旋酶;andr;art-4;artc1/m;aurkb;b2mg;b3gn5;b4gn1;b7h4;bage-1;basi;bcl-2;bcr/abl;β-连环蛋白/m;bing-4;birc7;brca1/m;by55;钙网蛋白;camel;casp-8/m;caspa;组织蛋白酶_b;组织蛋白酶_l;cd1a;cd1b;cd1c;cd1d;cd1e;cd20;cd22;cd276;cd33;cd3e;cd3z;cd44_同种型_1;cd44_同种型_6;cd4;cd52;cd55;cd56;cd80;cd86;cd8a;cdc27/m;cde30;cdk4/m;cdkn2a/m;cea;ceam6;ch3l2;clca2;cml28;cml66;coa-1/m;毛状样_蛋白;胶原_xxiii;cox-2;cp1b1;csag2;ct45a1;ct55;ct-_9/brd6;ctag2_同种型_lage-1a;ctag2_同种型_lage-1b;ctcfl;cten;细胞周期蛋白_b1;细胞周期蛋白_d1;cyp-b;dam-10;dep1a;e7;ef1a2;eftud2/m;egfr;egln3;elf2/m;emmprin;epcam;epha2;epha3;erbb3;erbb4;erg;etv6;ews;ezh2;fabp7;fcgr3a_版本_1;fcgr3a_版本_2;fgf5;fgfr2;纤连蛋白;fos;foxp3;fut1;g250;gage-1;gage-2;gage-3;gage-4;gage-5;gage-6;gage7b;gage-8_(gage-2d);gasr;gnt-v;gpc3;gpnmb/m;grm3;hage;hepsin;her2/neu;hla-a2/m;同源框_nkx3.1;hom-tes-85;hpg1;hs71a;hs71b;hst-2;htert;ice;if2b3;il10;il-13ra2;il2-ra;il2-rb;il2-rg;il-5;imp3;ita5;itb1;itb6;激肽释放酶-2;激肽释放酶-4;ki20a;kiaa0205;kif2c;kk-lc-1;ldlr;lgmn;lirb2;ly6k;maga5;maga8;magab;mage-a10;mage-a12;mage-a1;mage-a2;mage-a3;mage-a4;mage-a6;mage-a9;mage-b10;mage-b16;mage-b17;mage-_b1;mage-b2;mage-b3;mage-b4;mage-b5;mage-b6;mage-c1;mage-c2;mage-c3;mage-d1;mage-d2;mage-d4;mage-_e1;mage-e1_(mage1);mage-e2;mage-f1;mage-h1;magel2;乳腺珠蛋白_a;mart-1/melan-a;mart-2;mc1_r;m-csf;间皮素;mitf;mmp1_1;mmp7;muc-1;mum-1/m;m[um-2/m;mycn;myo1a;myo1b;myo1c;myo1d;myo1e;myo1f;myo1g;myo1h;na17;na88-a;neo-pap;nfyc/m;ngep;npm;nrcam;nse;nuf2;ny-eso-1;oa1;ogt;os-9;骨钙蛋白;骨桥蛋白;p53;page-4;pai-1;pai-2;pap;pate;pax3;pax5;pd1l1;pdcd1;pdef;peca1;pgcb;pgfrb;pim-1_-激酶;pin-1;plac1;pmel;pml;potef;pote;prame;prdx5/m;prm2;prostein;蛋白酶-3;psa;psb9;psca;psgr;psm;ptprc;rab8a;rage-1;rara;rash;rask;rasn;rgs5;rhamm/cd168;rhoc;rssa;ru1;ru2;runx1;s-100;sage;sart-_1;sart-2;sart-3;sepr;serpinb5;sia7f;sia8a;siat9;sirt2/m;sox10;sp17;spnxa;spxn3;ssx-1;ssx-2;ssx3;ssx-4;st1a1;stag2;stamp-1;steap-1;存活素-2b;存活素;sycp1;syt-ssx-1;syt-ssx-2;tarp;tcrg;tf2aa;tgfb1;tgfr2;tgm-4;tie2;tktl1;tpi/m;trgv11;trgv9;trpc1;trp-p8;tsg10;tspy1;tvc_(trgv3);tx101;酪氨酸酶;tyrp1;tyrp2;upa;vegfr1;wt1;以及xage1。可用于本发明的进一步的抗原如下文所示(基因名称后面是括号,括号中是蛋白登录号):1a01_hla-a/m(uniprotkb:p30443);1a02(uniprotkb:p01892);5t4(uniprotkb:q13641);acrbp(uniprotkb:q8neb7);afp(uniprotkb:p02771);akap4(uniprotkb:q5jqc9);α-辅肌动蛋白-_4/m(uniprotkb:b4dsx0);α-辅肌动蛋白-_4/m(uniprotkb:b4e337);α-辅肌动蛋白-_4/m(uniprotkb:o43707);α-甲基酰基-辅酶_a_消旋酶(uniprotkb:a0a024re16);α-甲基酰基-辅酶_a_消旋酶(uniprotkb:a8kac3);andr(uniprotkb:p10275);art-4(uniprotkb:q9ulx3);artc1/m(uniprotkb:p52961);aurkb(uniprotkb:q96gd4);b2mg(uniprotkb:p61769);b3gn5(uniprotkb:q9byg0);b4gn1(uniprotkb:q00973);b7h4(uniprotkb:q7z7d3);bage-1(uniprotkb:q13072);basi(uniprotkb:p35613);bcl-2(uniprotkb:a9qxg9);bcr/abl(uniprotkb:a9uez4);bcr/abl(uniprotkb:a9uez7);bcr/abl(uniprotkb:a9uez8);bcr/abl(uniprotkb:a9uez9);bcr/abl(uniprotkb:a9uf00);bcr/abl(uniprotkb:a9uf01);bcr/abl(uniprotkb:a9uf03);bcr/abl(uniprotkb:a9uf04);bcr/abl(uniprotkb:a9uf05);bcr/abl(uniprotkb:a9uf06);bcr/abl(uniprotkb:a9uf08);β-连环蛋白/m(uniprotkb:p35222);β-连环蛋白/m(uniprotkb:q8wya6);bing-4(uniprotkb:o15213);birc7(uniprotkb:q96ca5);brca1/m(uniprotkb:a0a024r1v0);brca1/m(uniprotkb:a0a024r1v7);brca1/m(uniprotkb:a0a024r1z8);brca1/m(uniprotkb:a0a068bfx7);brca1/m(uniprotkb:c6yb45);brca1/m(uniprotkb:c6yb47);brca1/m(uniprotkb:g3xac3);by55(uniprotkb:o95971);钙网蛋白(uniprotkb:b4dhr1);钙网蛋白(uniprotkb:b4e2y9);钙网蛋白(uniprotkb:p27797);钙网蛋白(uniprotkb:q96l12);camel(uniprotkb:o95987);casp-8/m(uniprotkb:q14790);caspa(uniprotkb:q92851-4);组织蛋白酶_b(uniprotkb:a0a024r374);组织蛋白酶_b(uniprotkb:p07858);组织蛋白酶_l(uniprotkb:a0a024r276);组织蛋白酶_l(uniprotkb:p07711);组织蛋白酶_l(uniprotkb:q9hbq7);cd1a(uniprotkb:p06126);cd1b(uniprotkb:p29016);cd1c(uniprotkb:p29017);cd1d(uniprotkb:p15813);cd1e(uniprotkb:p15812);cd20(uniprotkb:p11836);cd22(uniprotkb:o60926);cd22(uniprotkb:p20273);cd22(uniprotkb:q0eaf5);cd276(uniprotkb:q5zpr3);cd33(uniprotkb:b4df51);cd33(uniprotkb:p20138);cd33(uniprotkb:q546g0);cd3e(uniprotkb:p07766);cd3z(uniprotkb:p20963);cd44_同种型_1(uniprotkb:p16070);cd44_同种型_6(uniprotkb:p16070-6);cd4(uniprotkb:p01730);cd52(uniprotkb:p31358);cd52(uniprotkb:q6ibd0);cd52(uniprotkb:v9hwn9);cd55(uniprotkb:b1ap15);cd55(uniprotkb:d3dt85);cd55(uniprotkb:d3dt86);cd55(uniprotkb:p08174);cd56(uniprotkb:p13591);cd80(uniprotkb:a0n0p2);cd80(uniprotkb:p33681);cd86(uniprotkb:p42081);cd8a(uniprotkb:p01732);cdc27/m(uniprotkb:g5ea36);cdc27/m(uniprotkb:p30260);cde30(uniprotkb:p28908);cdk4/m(uniprotkb:a0a024rbb6);cdk4/m(uniprotkb:p11802);cdk4/m(uniprotkb:q6lc83);cdk4/m(uniprotkb:q96be9);cdkn2a/m(uniprotkb:d1lyx3);cdkn2a/m(uniprotkb:g3xag3);cdkn2a/m(uniprotkb:k7pml8);cdkn2a/m(uniprotkb:l8e941);cdkn2a/m(uniprotkb:q8n726);cea(refseq:np_004354);ceam6(uniprotkb:p40199);ch3l2(uniprotkb:q15782);clca2(uniprotkb:q9uqc9);cml28(uniprotkb:q9nqt4);cml66(uniprotkb:q96rs6);coa-1/m(uniprotkb:q5t124);毛状样_蛋白(uniprotkb:q14019);胶原_xxiii(uniprotkb:l8eas4);胶原_xxiii(uniprotkb:q86y22);cox-2(uniprotkb:q6zyk7);cp1b1(uniprotkb:q16678);csag2(uniprotkb:q9y5p2-2);csag2(uniprotkb:q9y5p2);ct45a1(uniprotkb:q5hyn5);ct55(uniprotkb:q8wue5);ct-_9/brd6(uniprotkb:q58f21);ctag2_同种型_lage-1a(uniprotkb:q75638-2);ctag2_同种型_lage-1b(uniprotkb:o75638);ctcfl(uniprotkb:q8ni51);cten(uniprotkb:q8izw8);细胞周期蛋白_b1(uniprotkb:p14635);细胞周期蛋白_d1(uniprotkb:p24385);cyp-b(uniprotkb:p23284);dam-10(uniprotkb:p43366);dep1a(uniprotkb:q5tb30);e7(uniprotkb:p03129);e7(uniprotkb:p06788);e7(uniprotkb:p17387);e7(uniprotkb:p06429);e7(uniprotkb:p27230);e7(uniprotkb:p24837);e7(uniprotkb:p21736);e7(uniprotkb:p26558);e7(uniprotkb:p36831);e7(uniprotkb:p36833);e7(uniprotkb:q9qcz1);e7(uniprotkb:q81965);e7(uniprotkb:q80956);ef1a2(uniprotkb:q05639);eftud2/m(uniprotkb:q15029);egfr(uniprotkb:a0a0b4j1y5);egfr(uniprotkb:e7bsv0);egfr(uniprotkb:l0r6g1);egfr(uniprotkb:p00533-2);egfr(uniprotkb:p00533);egfr(uniprotkb:q147t7);egfr(uniprotkb:q504u8);egfr(uniprotkb:q8ndu8);egln3(uniprotkb:q9h6z9);elf2/m(uniprotkb:b7z720);emmprin(uniprotkb:q54a51);epcam(uniprotkb:p16422);epha2(uniprotkb:p29317);epha3(uniprotkb:p29320);epha3(uniprotkb:q6p4r6);erbb3(uniprotkb:b3kwg5);erbb3(uniprotkb:b4dgq7);erbb4(uniprotkb:q15303);erg(uniprotkb:p11308);etv6(uniprotkb:p41212);ews(uniprotkb:q01844);ezh2(uniprotkb:f2ymm1);ezh2(uniprotkb:g3xal2);ezh2(uniprotkb:l0r855);ezh2(uniprotkb:q15910);ezh2(uniprotkb:s4s3r8);fabp7(uniprotkb:o15540);fcgr3a_版本_1(uniprotkb:p08637);fcgr3a_版本_2(ccds:ccds1232.1);fgf5(uniprotkb:p12034);fgf5(uniprotkb:q60518);fgfr2(uniprotkb:p21802);纤连蛋白(uniprotkb:a0a024r5i6);纤连蛋白(uniprotkb:a0a024rb01);纤连蛋白(uniprotkb:a0a024rdt9);纤连蛋白(uniprotkb:a0a024rdv5);纤连蛋白(uniprotkb:a6nh44);纤连蛋白(uniprotkb:a8k6a5);纤连蛋白(uniprotkb:b2r627);纤连蛋白(uniprotkb:b3kxm5);纤连蛋白(uniprotkb:b4dic5);纤连蛋白(uniprotkb:b4dn21);纤连蛋白(uniprotkb:b4ds98);纤连蛋白(uniprotkb:b4dth2);纤连蛋白(uniprotkb:b4dtk1);纤连蛋白(uniprotkb:b4du16);纤连蛋白(uniprotkb:b7z3w5);纤连蛋白(uniprotkb:b7z939);纤连蛋白(uniprotkb:g5e9x3);纤连蛋白(uniprotkb:q9h382);fos(uniprotkb:p01100);foxp3(uniprotkb:q9bzs1);fut1(uniprotkb:p19526);g250(uniprotkb:q16790);gage-1(genbank:aaa82744);gage-2(uniprotkb:q6nt46);gage-3(uniprotkb:q13067);gage-4(uniprotkb:q13068);gage-5(uniprotkb:q13069);gage-6(uniprotkb:q13070);gage7b(uniprotkb:o76087);gage-8_(gage-2d)(uniprotkb:q9ueu5);gasr(uniprotkb:p32239);gnt-v(uniprotkb:q09328);gpc3(uniprotkb:i6qtg3);gpc3(uniprotkb:p51654);gpc3(uniprotkb:q8iyg2);gpnmb/m(uniprotkb:a0a024ra55);gpnmb/m(uniprotkb:q14956);gpnmb/m(uniprotkb:q8ixj5);gpnmb/m(uniprotkb:q96f58);grm3(uniprotkb:q14832);hage(uniprotkb:q9nxz2);hepsin(uniprotkb:b2zdq2);hepsin(uniprotkb:p05981);her2/neu(uniprotkb:b4dtr1);her2/neu(uniprotkb:l8e8g2);her2/neu(uniprotkb:p04626);her2/neu(uniprotkb:q9uk79);hla-a2/m(uniprotkb:q95387);hla-a2/m(uniprotkb:q9myf8);同源框_nkx3.1(uniprotkb:q99801);hom-tes-85(uniprotkb:b2rbq6);hom-tes-85(uniprotkb:q9p127);hpg1(pubmed:12543784);hs71a(uniprotkb:p0dmv8);hs71b(uniprotkb:p0dmv9);hst-2(uniprotkb:p10767);htert(uniprotkb:o94807);ice(uniprotkb:o00748);if2b3(uniprotkb:o00425);il10(uniprotkb:p22301);il-13ra2(uniprotkb:q14627);il2-ra(uniprotkb:p01589);il2-rb(uniprotkb:p14784);il2-rg(uniprotkb:p31785);il-5(uniprotkb:p05113);imp3(uniprotkb:q9nv31);ita5(uniprotkb:p08648);itb1(uniprotkb:p05556);itb6(uniprotkb:p18564);激肽释放酶-2(uniprotkb:a0a024r4j4);激肽释放酶-2(uniprotkb:a0a024r4n3);激肽释放酶-2(uniprotkb:b0azu9);激肽释放酶-2(uniprotkb:b4du77);激肽释放酶-2(uniprotkb:p20151);激肽释放酶-2(uniprotkb:q6t774);激肽释放酶-2(uniprotkb:q6t775);激肽释放酶-4(uniprotkb:a0a0c4dfq5);激肽释放酶-4(uniprotkb:q5bqa0);激肽释放酶-4(uniprotkb:q96pt0);激肽释放酶-4(uniprotkb:q96pt1);激肽释放酶-4(uniprotkb:q9y5k2);ki20a(uniprotkb:o95235);kiaa0205(uniprotkb:q92604);kif2c(uniprotkb:q99661);kk-lc-1(uniprotkb:q5h943);ldlr(uniprotkb:p01130);lgmn(uniprotkb:q99538);lirb2(uniprotkb:q8n423);ly6k(uniprotkb:q17ry6);maga5(uniprotkb:p43359);maga8(uniprotkb:p43361);magab(uniprotkb:p43364);mage-a10(uniprotkb:a0a024rc14);mage-a12(uniprotkb:p43365);mage-a1(uniprotkb:p43355);mage-a2(uniprotkb:p43356);mage-a3(uniprotkb:p43357);mage-a4(uniprotkb:a0a024rc12);mage-a4(uniprotkb:p43358);mage-a4(uniprotkb:q1rn33);mage-a6(uniprotkb:a8k072);mage-a6(uniprotkb:p43360);mage-a6(uniprotkb:q6fhi5);mage-a9(uniprotkb:p43362);mage-b10(uniprotkb:q96lz2);mage-b16(uniprotkb:a2a368);mage-b17(uniprotkb:a8mxt2);mage-_b1(uniprotkb:q96tg1);mage-b2(uniprotkb:o15479);mage-b3(uniprotkb:o15480);mage-b4(uniprotkb:o15481);mage-b5(uniprotkb:q9bz81);mage-b6(uniprotkb:q8n7x4);mage-c1(uniprotkb:o60732);mage-c2(uniprotkb:q9ubf1);mage-c3(uniprotkb:q8td91);mage-d1(uniprotkb:q9y5v3);mage-d2(uniprotkb:q9unf1);mage-d4(uniprotkb:q96jg8);mage-_e1(uniprotkb:q6iai7);mage-e1_(mage1)(uniprotkb:q9hci5);mage-e2(uniprotkb:q8td90);mage-f1(uniprotkb:q9hay2);mage-h1(uniprotkb:q9h213);magel2(uniprotkb:q9uj55);乳腺珠蛋白_a(uniprotkb:q13296);乳腺珠蛋白_a(uniprotkb:q6nx70);mart-1/melan-a(uniprotkb:q16655);mart-2(uniprotkb:q5vty9);mc1_r(uniprotkb:q01726);mc1_r(uniprotkb:q1jul4);mc1_r(uniprotkb:q1jul6);mc1_r(uniprotkb:q1jul8);mc1_r(uniprotkb:q1jul9);mc1_r(uniprotkb:q1jum0);mc1_r(uniprotkb:q1jum2);mc1_r(uniprotkb:q1jum3);mc1_r(uniprotkb:q1jum4);mc1_r(uniprotkb:q1jum5);mc1_r(uniprotkb:q6ur92);mc1_r(uniprotkb:q6ur94);mc1_r(uniprotkb:q6ur95);mc1_r(uniprotkb:q6ur96);mc1_r(uniprotkb:q6ur97);mc1_r(uniprotkb:q6ur98);mc1_r(uniprotkb:q6ur99);mc1_r(uniprotkb:q6ura0);mc1_r(uniprotkb:q86yw1);mc1_r(uniprotkb:v9q5s2);mc1_r(uniprotkb:v9q671);mc1_r(uniprotkb:v9q783);mc1_r(uniprotkb:v9q7f1);mc1_r(uniprotkb:v9q8n1);mc1_r(uniprotkb:v9q977);mc1_r(uniprotkb:v9q9p5);mc1_r(uniprotkb:v9q9r8);mc1_r(uniprotkb:v9qae0);mc1_r(uniprotkb:v9qar2);mc1_r(uniprotkb:v9qaw3);mc1_r(uniprotkb:v9qb02);mc1_r(uniprotkb:v9qb58);mc1_r(uniprotkb:v9qby6);mc1_r(uniprotkb:v9qc17);mc1_r(uniprotkb:v9qc66);mc1_r(uniprotkb:v9qcq4);mc1_r(uniprotkb:v9qdf4);mc1_r(uniprotkb:v9qdn7);mc1_r(uniprotkb:v9qdq6);m-csf(uniprotkb:p09603);间皮素(uniprotkb:q13421);mitf(uniprotkb:o75030-8);mitf(uniprotkb:o75030-9);mitf(uniprotkb:o75030);mmp1_1(uniprotkb:b3kqs8);mmp7(uniprotkb:p09237);muc-1(genbank:aaa60019);mum-1/m(refseq:np_116242);mum-2/m(uniprotkb:q9y5r8);mycn(uniprotkb:p04198);myo1a(uniprotkb:q9ubc5);myo1b(uniprotkb:o43795);myo1c(uniprotkb:o00159);myo1d(uniprotkb:o94832);myo1e(uniprotkb:q12965);myo1f(uniprotkb:o00160);myo1g(uniprotkb:b0i1t2);myo1h(refseq:np_001094891);na17(uniprotkb:q3v5l5);na88-a(pubmed:10790436);neo-pap(uniprotkb:q9bwt3);nfyc/m(uniprotkb:q13952);ngep(uniprotkb:q6iwh7);npm(uniprotkb:p06748);nrcam(uniprotkb:q92823);nse(uniprotkb:p09104);nuf2(uniprotkb:q9bzd4);ny-eso-1(uniprotkb:p78358);oa1(uniprotkb:p51810);ogt(uniprotkb:o15294);os-9(uniprotkb:b4dh11);os-9(uniprotkb:b4e321);os-9(uniprotkb:b7z8e7);os-9(uniprotkb:q13438);骨钙蛋白(uniprotkb:p02818);骨桥蛋白(uniprotkb:a0a024rde2);骨桥蛋白(uniprotkb:a0a024rde6);骨桥蛋白(uniprotkb:a0a024rdj0);骨桥蛋白(uniprotkb:b7z351);骨桥蛋白(uniprotkb:f2yq21);骨桥蛋白(uniprotkb:p10451);p53(uniprotkb:p04637);page-4(uniprotkb:o60829);pai-1(uniprotkb:p05121);pai-2(uniprotkb:p05120);pap(uniprotkb:q06141);pap(uniprotkb:q53s56);pate(uniprotkb:q8wxa2);pax3(uniprotkb:p23760);pax5(uniprotkb:q02548);pd1l1(uniprotkb:q9nzq7);pdcd1(uniprotkb:q15116);pdef(uniprotkb:o95238);peca1(uniprotkb:p16284);pgcb(uniprotkb:q96gw7);pgfrb(uniprotkb:p09619);pim-1_-激酶(uniprotkb:a0a024rd25);pin-1(uniprotkb:o15428);pin-1(uniprotkb:q13526);pin-1(uniprotkb:q49ar7);plac1(uniprotkb:q9hbj0);pmel(uniprotkb:p40967);pml(uniprotkb:p29590);potef(uniprotkb:a5a3e0);pote(uniprotkb:q86yr6);prame(uniprotkb:a0a024r1e6);prame(uniprotkb:p78395);prdx5/m(uniprotkb:p30044);prm2(uniprotkb:p04554);prostein(uniprotkb:q96jt2);蛋白酶-3(uniprotkb:d6che9);蛋白酶-3(uniprotkb:p24158);psa(uniprotkb:p55786);psb9(uniprotkb:p28065);psca(uniprotkb:d3dwi6);psca(uniprotkb:o43653);psgr(uniprotkb:q9h255);psm(uniprotkb:q04609);ptprc(refseq:np_002829);rab8a(uniprotkb:p61006);rage-1(uniprotkb:q9uq07);rara(uniprotkb:p10276);rash(uniprotkb:p01112);rask(uniprotkb:p01116);rasn(uniprotkb:p01111);rgs5(uniprotkb:o15539);rhamm/cd168(uniprotkb:o75330);rhoc(uniprotkb:p08134);rssa(uniprotkb:p08865);ru1(uniprotkb:q9uhj3);ru2(uniprotkb:q9uhg0);runx1(uniprotkb:q01196);s-100(uniprotkb:v9hw39);sage(uniprotkb:q9nxz1);sart-_1(uniprotkb:o43290);sart-2(uniprotkb:q9ul01);sart-3(uniprotkb:q15020);sepr(uniprotkb:q12884);serpinb5(uniprotkb:p36952);sia7f(uniprotkb:q969x2);sia8a(uniprotkb:q92185);siat9(uniprotkb:q9unp4);sirt2/m(uniprotkb:a0a024r0g8);sirt2/m(uniprotkb:q8ixj6);sox10(uniprotkb:p56693);sp17(uniprotkb:q15506);spnxa(uniprotkb:q9ns26);spxn3(uniprotkb:q5mj09);ssx-1(uniprotkb:q16384);ssx-2(uniprotkb:q16385);ssx3(uniprotkb:q99909);ssx-4(uniprotkb:o60224);st1a1(uniprotkb:p50225);stag2(uniprotkb:q8n3u4-2);stamp-1(uniprotkb:q8nft2);steap-1(uniprotkb:a0a024ra63);steap-1(uniprotkb:q9uhe8);存活素-2b(uniprotkb:o15392-2);存活素(uniprotkb:o15392);sycp1(uniprotkb:a0a024r0i2);sycp1(uniprotkb:b7zls9);sycp1(uniprotkb:q15431);sycp1(uniprotkb:q3mhc4);syt-ssx-1(uniprotkb:a4piv7);syt-ssx-1(uniprotkb:a4piv8);syt-ssx-2(uniprotkb:a4piv9);syt-ssx-2(uniprotkb:a4piw0);tarp(uniprotkb:q0vgm3);tcrg(uniprotkb:a2jgv3);tf2aa(uniprotkb:p52655);tgfb1(uniprotkb:p01137);tgfr2(uniprotkb:p37173);tgm-4(uniprotkb:b2r7d1);tie2(uniprotkb:q02763);tktl1(uniprotkb:p51854);tpi/m(uniprotkb:p60174);trgv11(uniprotkb:q99601);trgv9(uniprotkb:a4d1x2);trgv9(uniprotkb:q99603);trgv9(uniprotkb:q99604);trpc1(uniprotkb:p48995);trp-p8(uniprotkb:q7z2w7);tsg10(uniprotkb:q9bzw7);tspy1(uniprotkb:q01534);tvc_(trgv3)(genbank:m13231.1);tx101(uniprotkb:q9by14-2);酪氨酸酶(uniprotkb:a0a024dbg7);酪氨酸酶(uniprotkb:l8b082);酪氨酸酶(uniprotkb:l8b086);酪氨酸酶(uniprotkb:l8b0b9);酪氨酸酶(uniprotkb:o75767);酪氨酸酶(uniprotkb:p14679);酪氨酸酶(uniprotkb:u3m8n0);酪氨酸酶(uniprotkb:u3m9d5);酪氨酸酶(uniprotkb:u3m9j2);tyrp1(uniprotkb:p17643);tyrp2(uniprotkb:p40126);upa(uniprotkb:q96nz9);vegfr1(uniprotkb:b5a924);wt1(uniprotkb:a0a0h5auy0);wt1(uniprotkb:p19544);wt1(uniprotkb:q06250);xage1(uniprotkb:q9hd64)。检查点抑制剂发现了负调控t细胞表面分子,这些分子在激活的t细胞中上调以抑制这些细胞的活性,从而降低所述激活的t细胞在杀伤肿瘤细胞中的有效性。这些抑制性分子由于与t细胞共刺激分子cd28的同源性而被称为负共刺激分子。这些蛋白(也称为免疫检查点蛋白)在多种途径中起作用,这些途径包括早期激活信号的减弱、正共刺激的竞争以及抗原呈递细胞的直接抑制(bour-jordan等人,2011,immunolrev.[免疫学综述]241(1):180-205)。在本发明的上下文中,检查点调节剂典型地是调节免疫检查点蛋白的功能的分子,例如蛋白(例如抗体)、显性负性受体、诱饵受体、或配体或者其片段或变体,例如它抑制或降低检查点抑制剂(或抑制性检查点分子)的活性或者它刺激或增强检查点刺激剂(或刺激性检查点分子)的活性。因此,如本文所定义的检查点调节剂影响检查点分子的活性。在此上下文中,抑制性检查点分子被定义为检查点抑制剂并且可以同义使用。此外,刺激性检查点分子被定义为检查点刺激剂并且可以同义使用。优选地,检查点调节剂选自激动性抗体、拮抗性抗体、配体、显性负性受体和诱饵受体或其组合。生成和使用mrna编码的抗体的方法是本领域已知的(例如wo2008/083949或pct/ep2017/060226)。在本发明的上下文中可被检查点调节剂抑制的优选的抑制性检查点分子是pd-1、pd-l1、ctla-4、pd-l2、lag3、tim3/havcr2、2b4、a2ar、b7h3、b7h4、btla、cd30、cd160、cd155、gal9、hvem、ido1、ido2、kir、lair1和vista。在本发明的上下文中可由检查点调节剂刺激的优选的刺激性检查点分子是cd2、cd27、cd28、cd40、cd137、cd226、cd276、gitr、icos、ox40和cd70。根据优选的实施例,本发明的包含rna的药物组合物或疫苗用于如本文所述的用途,其中该用途包括作为另外的药物活性成分的选自由检查点调节剂组成的组的检查点调节剂,该检查点调节剂选自由pd-1抑制剂、pd-l1抑制剂、pd-l2抑制剂、ctla-4抑制剂、lag3抑制剂、tim3抑制剂、tigit抑制剂、ox40刺激剂、4-1bb刺激剂、cd40l刺激剂、cd28刺激剂和gitr刺激剂组成的组。根据优选的实施例,如本文所用的检查点调节剂靶向pd-1途径的成员。pd-1途径的成员典型地为与pd-1信号传导相关的蛋白。一方面,该组包括在pd-1上游诱导pd-1信号传导的蛋白,例如pd-1、pd-l1和pd-l2的配体,以及信号转导受体pd-1。另一方面,该组包括pd-1受体下游的信号转导蛋白。在本发明的上下文中作为pd-1途径的成员,特别优选的是pd-1、pd-l1和pd-l2。在本发明的上下文中,pd-1途径拮抗剂(或pd-1抑制剂)优选地在本文中被定义为能够损害pd-1途径信号传导(优选地由pd-1受体介导的信号传导)的化合物。因此,pd-1途径拮抗剂可以是针对pd-1途径的任何成员的能够拮抗pd-1途径信号传导的任何拮抗剂。在优选的实施例中,本文使用的检查点调节剂是pd-1抑制剂或pd-l1抑制剂,其中pd-1抑制剂优选地是针对pd-1的拮抗性抗体,并且pd-l1抑制剂优选地是针对pd-l1的拮抗性抗体。在此上下文中,拮抗剂可以是如本文所定义的靶向pd-1途径的任何成员的拮抗性抗体,优选地针对pd-1受体、pd-l1或pd-l2的拮抗性抗体。这样的拮抗性抗体也可以由核酸编码。而且,pd-1途径拮抗剂可以是阻断pd1配体活性的pd-1受体的片段。b7-1或其片段也可以作为pd1拮抗配体。另外,pd-1途径拮抗剂可以是包含能够结合pd-1但阻止pd-1信号传导(例如,通过抑制pd-1和b7-h1或b7-dl相互作用)的氨基酸序列的蛋白(或其编码核酸)(wo2014/127917、wo2012062218)。特别优选的是抗pd1抗体纳武单抗(nivolumab)(mdx-1106/bms-936558/ono-4538),(brahmer等人,2010.jclinoncol.[临床肿瘤学杂志]28(19):3167-75;pmid:20516446);皮地利珠单抗(pidilizumab)(ct-011),(berger等人,2008.clincancerres.[临床癌症研究]14(10):3044-51;pmid:18483370);帕博利珠单抗(pembrolizumab)(mk-3475、sch900475);amp-224以及medi0680(amp-514)。特别优选的还有抗pd-l1抗体mdx-1105/bms-936559(brahmer等人2012.nengljmed.[新英格兰医学杂志]366(26):2455-65;pmid:22658128);阿特殊单抗(atezolizumab)(mpdl3280a/rg7446);度伐单抗(durvalumab)(medi4736);以及阿维鲁单抗(avelumab)(msb0010718)。根据另一个实施例,本文使用的检查点调节剂是ox40刺激剂。ox40是受体的tnfr超家族的成员,并且在抗原激活的哺乳动物cd4+和cd8+t淋巴细胞的表面上表达。ox40配体(ox40l,也称为gp34、act-4-l和cd252)是与ox40受体特异性相互作用的蛋白。术语ox40l包括完整的ox40配体、可溶性ox40配体和融合蛋白,这些融合蛋白包含与第二部分(例如蛋白结构域)共价连接的ox40配体的功能活性部分。包括在ox40l的定义中的还有变体,其氨基酸序列与天然存在的ox40l不同,但保留与ox40受体特异性结合的能力。进一步包括在ox40l的定义中的是增强ox40的生物活性的变体。ox40激动剂是诱导或增强ox40的生物活性(例如由ox40介导的信号转导)的分子。ox40激动剂优选地在本文中定义为能够特异性结合ox40的结合分子。因此,ox40激动剂可以是与ox40结合并且能够刺激ox40信号传导的任何激动剂。在此上下文中,ox40激动剂可以是结合ox40的激动性抗体。ox40激动剂和抗ox40单克隆抗体在wo1995/021251、wo1995/012673和wo1995/21915中进行了描述。特别优选的是抗ox40抗体9b12,这是一种针对人ox40的细胞外结构域的鼠抗ox40单克隆抗体(weinberg等人,2006.j.immunother.[免疫疗法杂志]29(6):575-585)。在另一个实施例中,如本文所用的检查点调节剂是拮抗性抗体,它选自由抗-ctla4、抗-pd1、抗-pd-l1、抗-vista、抗-tim-3、抗-tigit、抗-lag-3和抗btla组成的组。优选地,可用作检查点调节剂的抗-ctla4抗体针对细胞毒性t淋巴细胞抗原-4(ctla-4)。ctla-4主要在t细胞的细胞内区室中表达。在经由t细胞受体(tcr)对初始t细胞进行强效或持久的刺激后,ctla-4被转运至细胞表面并在免疫突触处集中。然后ctla-4与cd28竞争cd80/cd86,并经由对akt信号传导的影响下调tcr信号传导。因此,ctla-4在生理学上起到信号抑制剂的作用(weber,j.2010.semin.oncol.[肿瘤学研讨文辑]37(5):430-9)。在优选的实施例中,本发明的包含rna的药物组合物或疫苗用于如本文所述的用途,其中该用途包括作为另外的药物活性成分的ctla4拮抗剂,该拮抗剂优选地是针对ctla4的拮抗性抗体(抗ctla4抗体)。如本文所用的术语“ctla4拮抗剂”包括拮抗ctla4的生理功能的任何化合物,例如抗体。在本发明的上下文中,术语“抗-ctla4抗体”可以指针对ctla4的拮抗性抗体(或所述抗体的功能片段或变体)或指编码所述拮抗性抗体(或其功能片段)的核酸,优选rna。抗-ctla4抗体的功能片段或变体优选地充当ctla4拮抗剂。更优选地,术语“抗-ctla4抗体”是指针对ctla4(或这种抗体的功能片段或变体)的单克隆抗体或指编码针对ctla4的单克隆抗体(或这种抗体的功能片段或变体)的核酸。如本文所用的术语“抗-ctla4抗体”可以分别指抗体重链或轻链,或者也指两条抗体链(重链和轻链),或指这些链中的任一条的片段或变体。优选地,如本文所用的抗-ctla4抗体的片段或变体是功能片段或变体,优选地如本文所述。特别优选的是抗-ctla-4抗体易普利单抗曲美利木单抗(tremelimumab)和agen-1884。如本文所用的进一步优选的抗-ctla4抗体包括bms734016;bms-734016;bms734016;mdx010;mdx101;mdx-010;mdx-101;mdx-ctla-4;mdxctla-4;mdx010;winglore;和yervoy,或这些抗体中的任一种的功能片段或变体。根据进一步的实施例,如本文所用的检查点调节剂是表1中描述的至少一种抗体或者其片段或变体表1:针对检查点分子的抗体标准疗法更优选地,接受包含本发明的rna的药物组合物或疫苗、其组合或包含所述rna的药物组合物或疫苗的受试者是患有如本文所述的肿瘤或癌症疾病且接受了或正在接受化疗(如一线或二线化疗)、放疗、化放疗(化疗和放疗联合)、激酶抑制剂、抗体治疗和/或检查点调节剂(如ctla4抑制剂、pd1通路抑制剂)的患者;或在接受了上述一种或多种治疗后达到部分反应或稳定疾病的患者。更优选地,受试者是患有如本文所述的肿瘤或癌症疾病并且接受了或正在接受通常用于如本文所述的任何这些疾病的化合物的患者,更优选地接受了或正在接受检查点调节剂的患者。以下化合物是优选地用于标准疗法且可与本发明的含有rna的药物组合物或疫苗结合应用的优选化合物:西妥昔单抗(erbitux)、白蛋白结合型紫杉醇(abraxane)、(吉美拉西+奥替拉西+替加氟)(ts-1)、多西他赛(docetaxel、doxel、taxotere、docetaxelan、docel、nanoxelm、tautax、docetaxel-as、docetaxel-m、qvidadotax、relidoce、taxelo、oncodocel、doxotel、pacancer、docetrust、dodetax、dodabur、soulaxein、taxedol、docefim、docetaxel、ribodocel、critidoc、asodoc、chemodoc、docelibbs、docenat、dincilezan、dostradixinol、docefrez、camitotic、oncotaxel、somatixel、belotaxel、qvidadotax、taxceus、cetadocure、docetaxelct、tevaxter、docirena、eurotere、axtere、celotax、taxanit、drobanos、cetado、doxocad、taxceus、egidox、tedocad、docecad、docelex、docetax、docetaxel、docetere、dotax、taxuba、monotaxel、taceedo、detaxl、docet、docetaxel、ferdotax、wintaxel)、(替加氟+尿嘧啶)(uft、ufte、tefudex、unitoral、luporal、tagracil)、氟尿嘧啶(5-fu)、(吉美拉西+奥替拉西+替加氟)odt(ts-1组合od)、硫酸博来霉素(tecnomicina、cinaleo、bleomycin、bloicin-s、bonar、bleocin、bleomycinsulfate、bleo、bleocel、bleotex、oncobleo、bleonco、bleosol、lyoble、bleomycinsulfate、blenamax、bleomycin、blenoxane、bleomicina、bleomycinebellon、bleoprim)、卡铂(carboplatin、plataminecs、carbaccord、carboplatina、carboplatino、paraplatin、carbosin、tecnocarb、carbomerck、paract、carboplatinectrs、carboplatineintselchimos、carboplatin、carbokem、carbotinol、fauldcarbo、evocarb、citoplatina、platin)、环丙沙星(hypoflox、ufexil)、盐酸环丙沙星(ciprofloxacinpharma、prodin、ciproxin)、顺铂(cisplatin、stritin、ifapla、accocit、unistin、cancertin、cisplan、citoplax、nuoxin、placis、cisplatino、displanor、randa、cispla、fauldcispla、briplatin、platinex、platinol、platinex、riboplatin、cisplatine、platistinecs、platosin、accocit、cisplatino)、环磷酰胺(endoxan、cvclophosphamide)、去氧氟尿苷(doxifluridine、mavvladimir)、多柔比星(盐酸多柔比星、adriamycinrdf、doxorubicin、doxorubicinpfs)、盐酸表柔比星(brecila、cloridratodeepirrubicina、epirubicin、farmorubicina、nuovodox、adnexa、4-eppedo、favicin)、氟尿嘧啶(agicil、fluorouracil、fauldfluor、oncourcil、flocil、5flucel)、叶酸+甲氨蝶呤(truxofol)、人5型腺病毒(重组)(oncorine)、羟基脲(oxyrea、durea、myelostat、riborea、unidrea、ondrea、hydran、leukocel、hydroxyurea、hydrea)、异环磷酰胺(holoxan、ifosfamideeg)、左旋咪唑(zirsol)、甲氨蝶呤(tratoben、methotrexate、fresexate、neometho、fauldmetro、methotrexatesodium、methocel、hytas、methaccord、methofill、metotrexato、traxacord、plastomet、tevatrex、metrex、caditrex、carditrex、vibzi、imutrex、biotrexate、methorex、mexate、neotrexate、oncotrex、remtrex、trixilem、hi-trex、metorex、trex、unitrexate、ebetrexac、fauldexato、lantarel、maxtrex、miantrexcs、rheumatrex、folex、folexpfs、abitrexate、tevametho、trexall、emthexate、abitrexate、meadow)、丝裂霉素(丝裂霉素c、mitomycin、mitonco、lyomit)、奈达铂(jiebaishu、aoxianda、aqupla)、尼美舒利(nimulid)、尼妥珠单抗(biomabegfr、laedemab)、呋喃妥因(furatsilin)、氧氟沙星(entof)、紫杉醇(paclitaxel、taxol)、硫酸培来霉素(pepleo)、沙培林(picibanil)、吡柔比星(盐酸吡柔比星、therarubicin、pinorubin)、甘氨双唑钠(cmna)、替加氟(utefos、icarus、futraful、替加氟-吉美拉西-奥替拉西钾)、替莫泊芬(foscan)、盐酸拓扑替康(topotecan)、乌苯美司(ubenimex)、硫酸长春碱(长春碱、vblastin)、硫酸长春新碱(长春新碱、vincristinesulfate、vincristin、sutivin、vindesinesulfate(eldisine)、卡铂(carboplatinequalimed、carboplatine、carboplatino、carboplatin)、顺铂(cisplatin)、多西他赛(kamdocon、naltoxater、docetaxel)、氟尿嘧啶(fluorouracil、fluorouracile、fluorouracil)、甲氨蝶呤(甲氨蝶呤钠、mexate、mexateaq、biometrox、medsatrexate、otaxem)、硫酸长春新碱(oncovin)、氟尿嘧啶、苹果酸舒尼替尼、维生素a酸、纤维蛋白封闭剂、西妥昔单抗、西妥昔单抗、埃罗替尼、顺铂;多西他赛;氟尿嘧啶、未披露的抗癌药物、吉非替尼、普伐他汀钠、西罗莫司、未披露的化疗、顺铂;多西他赛;氟尿嘧啶、西罗莫司、氟尿嘧啶;未披露的紫杉烷、氨基戊酮酸甲酯盐酸盐、顺铂;多西他赛;氟尿嘧啶、盐酸埃罗替尼、西妥昔单抗、咪喹莫特、未披露的中草药、阿司匹林;马来酸依那普利、未披露的化疗、西妥昔单抗、(吉美拉西+奥替拉西+替加氟);卡铂;顺铂、顺铂;氟尿嘧啶;尼妥珠单抗、卡铂;白蛋白结合型紫杉醇、顺铂;奈达铂、博莱霉素、奈达铂、顺铂;紫杉醇、白蛋白结合型紫杉醇、(吉美拉西+奥替拉西+替加氟)、博来霉素;未披露的化疗、阿帕替尼;多西他赛、未披露的免疫调节补充剂、bcm-95、盐酸氨酮戊酸、奈达铂、顺铂;帕利夫明、西妥昔单抗、吉非替尼、贝伐单抗、belagenpumatucel-l、顺铂;替拉扎明、顺铂;替拉扎明、顺铂;吉西他滨;紫杉醇;拓扑替康;长春瑞滨、顺铂;氟尿嘧啶、帕尼单抗、卡铂;多西他赛;盐酸吉西他滨;酒石酸长春瑞滨、氨磷汀;氟尿嘧啶、顺铂;氟尿嘧啶、卡铂;紫杉醇、替拉扎明、顺铂;阿法依泊汀、芬妥木单抗(figitumumab)、美法仑;肿瘤坏死因子alf、顺铂、顺铂;氟尿嘧啶、顺铂;未披露的化疗、多西他赛、拉康舒集(contusugeneladenovec)、顺铂;氟尿嘧啶;紫杉醇、多西他赛、人乳头瘤病毒[血清型16、18](二价)疫苗、异维甲酸、顺铂;氟尿嘧啶、米索硝唑、紫杉醇、帕利夫明(palifermin)、内皮抑素、毛果芸香碱、顺铂;多西他赛;非格司亭;氟尿嘧啶;紫杉醇、顺铂;多西他赛;非格司亭;氟尿嘧啶;紫杉醇、顺铂;盐酸伊立替康、顺铂;吉西他滨、顺铂;表阿霉素;氟尿嘧啶;未披露的化疗、氨基戊酮酸甲酯盐酸盐、卡铂;紫杉醇、卡波金(carbogen);二氧化碳;烟酰胺、顺铂;氟尿嘧啶、拉他莫金冻干混悬剂(talimogenelaherparepvec)、阿法依泊汀、顺铂;氟尿嘧啶;帕尼单抗、顺铂;氟尿嘧啶、顺铂;氟尿嘧啶、阿地白介素、顺铂;氟尿嘧啶、顺铂;紫杉醇、顺铂;氟尿嘧啶、氟尿嘧啶;甲酰四氢叶酸;洛铂、顺铂、顺铂;乙硫醇;异环磷酰胺;美司纳;二溴卫矛醇、多柔比星;左旋咪唑、(替加氟+尿嘧啶)、顺铂;氟尿嘧啶、顺铂;长春瑞滨、卡铂;顺铂;盐酸吉西他滨、小棒状杆菌(corynebacteriumparvum);多柔比星、卡培他滨;顺铂;氟尿嘧啶;紫杉醇、氟尿嘧啶;甲酰四氢叶酸;甲氨蝶呤、rad-p53、西妥昔单抗;顺铂;多西他赛、pv-10、氨基戊酮酸甲酯盐酸盐、顺铂;氟尿嘧啶、紫杉醇;盐酸托扑替康、卡铂;顺铂;紫杉醇、顺铂;盐酸托扑替康、顺铂;依托泊苷、多西他赛;氟尿嘧啶、阿司匹林、顺铂;吉西他滨、短乳杆菌(lactobacillusbrevis)cd2、顺铂;多西他赛、康普瑞汀磷酸二钠氨丁三醇(fosbretabulintromethamine)、帕尼单抗、氟尿嘧啶、紫杉醇、卡铂;顺铂;多西他赛;氟尿嘧啶、氟尿嘧啶、盐酸埃罗替尼、顺铂;未披露的化疗;长春瑞滨、(吉美拉西+奥替拉西+替加氟);卡铂、西妥昔单抗、拉康舒集(contusugeneladenovec)、西妥昔单抗、氨基戊酮酸甲酯盐酸盐、环磷酰胺、(吉美拉西+奥替拉西+替加氟);顺铂、紫杉醇白蛋白结合、卡铂;紫杉醇、顺铂;吉西他滨、卡培他滨;顺铂、多西他赛、z-100、顺铂;异环磷酰胺;紫杉醇、尼妥珠单抗、盐酸伊立替康、塞来昔布;甲氨蝶呤、能全力(nutrison)、卡铂;顺铂;氟尿嘧啶;紫杉醇、顺铂;紫杉醇、顺铂;多西他赛;长春瑞滨、紫杉醇、(吉美拉西+奥替拉西+替加氟);顺铂、卡铂;紫杉醇、氨基酮戊酸甲酯盐酸盐、艾宾(aibin)、顺铂;氟尿嘧啶、卟吩姆钠、卡铂;顺铂;生育三烯酚;长春瑞滨、(吉美拉西+奥替拉西+替加氟);顺铂;紫杉醇、多西他赛、易普利单抗、顺铂、vb-4847、塞来昔布;沙利度胺、顺铂;表阿霉素;氟尿嘧啶、顺铂;氟尿嘧啶、氟尿嘧啶、卡铂;紫杉醇、西妥昔单抗;顺铂;多西他赛、自体细胞因子诱导的杀伤细胞、顺铂;多西他赛;氟尿嘧啶、顺铂;表阿霉素;氟尿嘧啶、tergenpumatucel-l、西妥昔单抗;顺铂;多西他赛、爱伦多(elental)、顺铂;尼妥珠单抗;紫杉醇、二十碳五烯酸;未披露的营养补充剂、帕博西林、帕博利珠单抗(keytruda)、尼妥珠单抗、apatorsen和达克替尼(dacomitinib)。肿瘤适应症如本文所用,术语“肿瘤”、“癌症”或“癌症疾病”是指优选地选自由以下组成的组的恶性疾病;腺样囊性癌(腺囊癌)、肾上腺皮质癌、aids相关癌症、aids相关淋巴瘤、肛门癌、附件癌、星形细胞瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、骨肉瘤/恶性纤维组织细胞瘤、脑干胶质瘤、脑肿瘤、小脑星形细胞瘤、脑星形细胞瘤/恶性胶质瘤、室管膜瘤、成神经管细胞瘤、幕上原始神经外胚层肿瘤、视觉通路和下丘脑神经胶质瘤、乳腺癌、支气管腺瘤/类癌、伯基特淋巴瘤、儿童类癌瘤、胃肠道类癌瘤、原发灶不明癌、原发性中枢神经系统淋巴瘤、儿童小脑星形细胞瘤、儿童脑星形细胞瘤/恶性胶质瘤、宫颈癌、儿童癌症、慢性淋巴细胞白血病、结肠癌、皮肤t细胞淋巴瘤(包括蕈样霉菌病和塞扎里综合征)、增生性小圆细胞瘤、子宫内膜癌、室管膜瘤、食道癌、尤文氏肿瘤家族中的尤文氏肉瘤、儿童颅外生殖细胞瘤、性腺外生殖细胞瘤、肝外胆管癌、眼内黑色素瘤、视网膜母细胞瘤、胆囊癌、胃癌、胃肠道类癌瘤、胃肠道间质瘤(gist)、颅外、性腺外或卵巢生殖细胞瘤、妊娠滋养细胞肿瘤、脑干胶质瘤、儿童脑星形细胞瘤、儿童视觉通路和下丘脑神经胶质瘤、胃类癌、毛细胞白血病、头颈癌、心脏癌、肝细胞癌(肝癌)、霍奇金淋巴瘤、人乳头瘤病毒(hpv)相关癌症、下咽癌、儿童下丘脑和视觉通路胶质瘤、眼内黑色素瘤、胰岛细胞癌(内分泌胰腺)、卡波西肉瘤、肾癌(肾细胞癌)、喉癌、唇和口腔癌、脂肪肉瘤、肝癌、非小细胞肺癌、小细胞肺癌、淋巴瘤、aids相关淋巴瘤、伯基特淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、原发性中枢神经系统淋巴瘤、骨恶性纤维组织细胞瘤/骨肉瘤、儿童成神经管细胞瘤、黑色素瘤、眼内(眼)黑色素瘤、梅克尔细胞癌、成人恶性间皮瘤、儿童间皮瘤、头颈癌、口腔癌、儿童多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞肿瘤、多发性骨髓瘤(骨髓癌)、鼻腔和鼻窦癌、鼻咽癌、神经母细胞瘤、口腔癌、口咽癌、骨肉瘤/骨恶性纤维组织细胞瘤、卵巢癌、卵巢上皮癌(表面上皮间质肿瘤)、卵巢生殖细胞肿瘤、卵巢低恶性潜能瘤、胰腺癌、胰岛细胞胰腺癌、鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体星形细胞瘤、松果体生殖细胞瘤、儿童松果体细胞瘤和幕上原始神经外胚层肿瘤、垂体腺瘤、浆细胞肿瘤/浆细胞瘤/多发性骨髓瘤、胸膜肺母细胞瘤、原发性中枢神经系统淋巴瘤、前列腺癌、直肠癌、肾细胞癌(肾癌)、肾盂和输尿管癌、视网膜母细胞瘤、儿童横纹肌肉瘤、唾液腺癌、尤文氏肿瘤家族肉瘤、卡波西肉瘤、软组织肉瘤、子宫肉瘤、皮肤癌(非黑色素瘤)、皮肤癌(黑色素瘤)、梅克尔细胞皮肤癌、小肠癌、鳞状细胞癌、原发不明的转移性鳞状细胞颈癌(metastaticsquamousneckcancerwithoccultprimary)、软组织肉瘤(sts)、儿童幕上原始神经外胚层肿瘤、睾丸癌(精原细胞瘤和非精原细胞瘤)、喉癌、儿童胸腺瘤、胸腺瘤和胸腺癌、甲状腺癌、儿童甲状腺癌、肾盂和输尿管移行细胞癌、妊娠滋养细胞肿瘤、尿道癌、子宫内膜癌、子宫肉瘤、阴道癌、儿童视觉通路和下丘脑神经胶质瘤、外阴癌和儿童肾母细胞瘤(肾癌)。过敏性抗原:与过敏或过敏性疾病相关的抗原(过敏原或过敏性抗原)优选地衍生自选自由以下组成的列表的来源:粉螨属种(acarusspp)(acas1、acas10、acas10.0101、acas13、acas13.0101、acas2、acas3、acas7、acas8)、刺鲅属种(acanthocybiumspp)(acaso1)、棘唇线虫属种(acanthocheilonemaspp)(acav3、acav3.0101)、毛虾属种(acetesspp)(aceja1)、猕猴桃属种(actinidiaspp)(acta1、actc1、actc10、actc10.0101、actc2、actc4、actc5、actc5.0101、actc8、actc8.0101、actc几丁质酶、actd1、actd1.0101、actd10、actd10.0101、actd10.0201、actd11、actd11.0101、actd2、actd2.0101、actd3、actd3.0101、actd3.02、actd4、actd4.0101、actd5、actd5.0101、actd6、actd6.0101、actd7、actd7.0101、actd8、actd8.0101、actd9、actd9.0101、actd几丁质酶、acte1、acte5)、无网管蚜属种(acyrthosiphonspp)(acypi7、acypi7.0101、acypi7.0102)、蒴莲属种(adeniaspp)(adevrip)、伊蚊属种(aedesspp)(aeda1、aeda1.0101、aeda2、aeda2.0101、aeda3、aeda3.0101、aeda4、aeda7、aeda7.0101、aeda7.0102、aeda7.0103、aeda7.0104、aeda7.0105、aeda7.0106、aeda7.0107、aeda7.0108、aeda7.0109、aeda7.0110、aeda7.0111、aedal1、aedal3、aedal37kd、aedv37kd、aedv63kd)、山羊草属种(aegilopsspp)(aegta28、aegtaα_麦醇溶蛋白、aegum28、aegun28)、烟鲈属种(aethalopercaspp)(aetro1)、冰草属种(agropyronspp)(agrc7)、翦股颖属种(agrostisspp)(agrca1、agrca5、agrg1、agrg4、agrs5)、农杆菌属种(agrobacteriumspp)(agrspcp4epsps)、熊猫属种(ailuropodaspp)(ailme卵黄高磷蛋白、ailmetctp)、鸳鸯属种(aixspp)(aixga1、aixsp1)、食粉螨属种(aleuroglyphusspp)(aleo1、aleo10、aleo10.0101、aleo10.0102、aleo13、aleo14、aleo2、aleo20、aleo3、aleo5、aleo7、aleo8、aleo9)、葱属种(alliumspp)(alla3、allaalliin裂合酶、allc3、allc30kd、allc4、allcalliin裂合酶、allpalliin裂合酶、allsalliin裂合酶)、桤木属种(alnusspp)(alng1、alng1.0101、alng1/betv1/cora1tpc7、alng1/betv1/cora1tpc9、alng2、alng4、alng4.0101)、埃及雁属种(alopoehenspp)(aloae1)、看麦娘属种(alopecurusspp)(alop1、alop5)、链格孢属种(alternariaspp)(alta1、alta1.0101、alta1.0102、alta10、alta10.0101、alta12、alta12.0101、alta13、alta13.0101、alta2、alta3、alta3.0101、alta4、alta4.0101、alta5、alta5.0101、alta6、alta6.0101、alta7、alta7.0101、alta70kd、alta8、alta8.0101、alta9、altamnsod、altantf2、altatctp、altar1、altarg1、altb1、altbl1、altbr1、altc1、altca1、altce1、altch1、altci1、altco1、altcr1、altct1、altcu1、altcv1、altd1、altdu1、alte1、altet1、alteu1、altga1、altgr1、altj1、altl1、altlo1、altm1、altme1、altmi1、altmo1、alto1、altp1、altph1、altpo1、altps1、altr1、alts1、altse1、altsm1、altso1、altsu1、altt1、altte1、altto1)、苋属种(amaranthusspp)(amar2、amar2.0101、amav2、amav2.0101、amav2.0201)、豚草属种(ambrosiaspp)(amba1、amba1.0101、amba1.0201、amba1.0202、amba1.0301、amba1.0302、amba1.0303、amba1.0304、amba1.0305、amba1.0401、amba1.0402、amba1.0501、amba1.0502、amba10、amba10.0101、amba3、amba3.0101、amba4、amba4.0101、amba5、amba5.0101、amba6、amba6.0101、amba7、amba7.0101、amba8、amba8.0101、amba8.0102、amba9、amba9.0101、amba9.0102、ambacpi、ambp1、ambp5、ambp5.0101、ambp5.0201、ambt5、ambt5.0101、ambt8)、ammotheaspp(ammh7、ammh7.0101)、粗饰蚶属种(anadaraspp)(anabr1)、凤梨属种(ananasspp)(anac1、anac1.0101、anac2、anac2.0101、anac2.0101(muxf3))、鸭属种(anasspp)(anaca1)、狼鱼属种(anarhichasspp)(anal1)、槚如树属种(anacardiumspp)(anao1、anao1.0101、anao1.0102、anao2、anao2.0101、anao3、anao3.0101)、鸭属种(anasspp)(anap1、anap2、anap3)、鳗鲡属种(anguillaspp)(anga1、angj1)、异尖属种(anisakisspp)(anis1、anis1.0101、anis10、anis10.0101、anis11、anis11.0101、anis12、anis12.0101、anis2、anis2.0101、anis24kd、anis3、anis3.0101、anis4、anis4.0101、anis5、anis5.0101、anis6、anis6.0101、anis7、anis7.0101、anis8、anis8.0101、anis9、anis9.0101、anisccos3、anis细胞色素b、anisfbpp、anisnadhds4l、anisnaras、anispepb、anis肌钙蛋白)、番荔枝属种(annonaspp)(annc几丁质酶)、按蚊属种(anophelesspp)(anoda17、anoda17.0101、anoda27、anoda27.0101、anoda7、anoda7.0101、anog7、anog7.0101)、雁属种(anserspp)(ansa1、ansa2、ansa3、ansin1)、黄花茅属种(anthoxanthumspp)(anto1、anto1.0101、anto12、anto13、anto2、anto4、anto5、anto6、anto7)、蜜蜂属种(apisspp)(apic1、apic1.0101、apic10、apic2、apic4、apid1、apid1.0101、apid4、apifl4)、芹菜属种(apiumspp)(apig1、apig1.0101、apig1.0201、apig2、apig2.0101、apig3、apig3.0101、apig4、apig4.0101、apig5、apig5.0101、apig6、apig6.0101)、蜜蜂属种(apisspp)(apim1、apim1.0101、apim10、apim10.0101、apim11、apim11.0101、apim11.0201、apim13kd、apim2、apim2.0101、apim3、apim3.0101、apim4、apim4.0101、apim5、apim5.0101、apim6、apim6.0101、apim7、apim7.0101、apim8、apim8.0101、apim9、apim9.0101、apima1-a2、apima1-a2-a3、apimapalbumin1、apimapalbumin2、apime1、apime4)、落花生属种(arachisspp)(arad2、arad6、araf3、araf4、arah1、arah1.0101、arah10、arah10.0101、arah10.0102、arah11、arah11.0101、arah2、arah2.0101、arah2.0102、arah2.0201、arah2.0202、arah3、arah3.0101、arah4、arah4.0101、arah5、arah5.0101、arah6、arah6.0101、arah7、arah7.0101、arah7.0201、arah7.0202、arah8、arah8.0101、arah8.0201、arah9、arah9.0101、arah9.0201、arah凝集素、arah油质蛋白18kd、arai2、arai6)、拟南芥属种(arabidopsisspp)(arat3、arat8、aratglp)、羊鲷属种(archosargusspp)(arcpr1)、archaeopotamobiusspp(arcs8、arcs8.0101)、女王扇贝属种(aequipectenspp)(argi1)、锐缘蜱属种(argasspp)(argr1、argr1.0101)、拟海鲶属种(ariopsisspp)(arife1)、辣根属种(armoraciaspp)(armrhrp)、燕麦草属种(arrhenatherumspp)(arre1、arre5)、艾属种(artemisiaspp)(arta1、artap1)、卤虫属种(artemiaspp)(artfr1、artfr1.0101、artfr5、artfr5.0101)、节细菌属种(arthrobacterspp)(artglco)、头癣菌属种(achorionspp)(artgy7)、木菠萝属种(artocarpusspp)(arth17kd、arth4)、节螺藻属种(arthrospiraspp)(artplβ_藻胆蛋白)、艾属种(artemisiaspp)(artv1、artv1.0101、artv1.0102、artv1.0103、artv1.0104、artv1.0105、artv1.0106、artv1.0107、artv2、artv2.0101、artv3、artv3.0101、artv3.0201、artv3.0202、artv3.0301、artv4、artv4.0101、artv4.0201、artv47kd、artv5、artv5.0101、artv6、artv6.0101、artv60kd)、节皮菌属种(arthrodermaspp)(artva4)、蛔虫属种(ascarisspp)(ascl3、ascl3.0101、asc13.0102、ascl34kd、ascs1、ascs1.0101、ascs3、ascs3.0101、ascsgst)、曲霉属种(aspergillusspp)(aspaw葡糖淀粉酶、aspc22、aspf1、aspf1.0101、aspf10、aspf10.0101、aspf11、aspf11.0101、aspf12、aspf12.0101、aspf13、aspf13.0101、aspf15、aspf15.0101、aspf16、aspf16.0101、aspf17、aspf17.0101、aspf18、aspf18.0101、aspf2、aspf2.0101、aspf22、aspf22.0101、aspf23、aspf23.0101、aspf27、aspf27.0101、aspf28、aspf28.0101、aspf29、aspf29.0101、aspf3、aspf3.0101、aspf34、aspf34.0101、aspf4、aspf4.0101、aspf5、aspf5.0101、aspf56kd、aspf6、aspf6.0101、aspf7、aspf7.0101、aspf8、aspf8.0101、aspf9、aspf9.0101、aspfafcalap、aspfat_v、aspf过氧化氢酶、aspf脱乙酰几丁质酶、aspfcp、aspfdppv、aspffdh、aspfγ_肌动蛋白、aspf葡糖苷酶、aspfgpi、aspfgst、aspfgt、aspfiao、aspfipmi、aspflpl1、aspflpl3、aspf甘露糖苷酶、aspfmdh、aspfpl、aspfpup、aspfrps3、aspfsxr、aspfl13、aspfl13.0101、aspfl18、aspfl2、aspfl21、aspfl3、aspfl4、aspfl7、aspfl8、aspfl9、aspme蜂蜜曲霉蛋白酶、aspn14、aspn14.0101、aspn18、aspn18.0101、aspn25、aspn25.0101、aspn30、aspn葡糖淀粉酶、aspn半纤维素酶、aspn果胶酶、aspo13、aspo13.0101、aspo21、aspo21.0101、aspo3、aspo4、aspo7、aspo8、aspo乳糖酶、aspo脂肪酶、aspoc13、aspr1、aspsaap、aspsp葡糖淀粉酶、aspsp葡萄糖氧化酶、aspsppl、aspsppme、aspsy13、aspv13、aspv13.0101、aspv过氧化氢酶a、aspv烯醇酶、aspvgapdh、aspvmdh、aspvsxr)、天门冬属种(asparagusspp)(aspao1、aspao1.01、aspao1.02、aspao17kd、aspao4)、曲霉属种(aspergillusspp)(aspeni2、aspeni3、aspeni4、aspeni7、aspeni8、aspeni9)、燕麦属种(avenaspp)(aves1、aves12、aves13、aves2、aves4、aves5、aves7)、巴比伦属种(babyloniaspp)(babja1)、芽孢杆菌属种(bacillusspp)(bacal枯草杆菌蛋白酶、baccl枯草杆菌蛋白酶、bacl枯草杆菌蛋白酶、bacliaa、bacli枯草杆菌蛋白酶)、果实蝇属种(bactroceraspp)(bacol27、bacol27.0101)、芽孢杆菌属种(bacillusspp)(bacspaa1、bacspaa3、bacsp脱羧酶、bacstamym、bacsu枯草杆菌蛋白酶、bactcty1ab、bactcry1fa、bactcry3bb1、bactcry9c)、海鲿属种(bagrespp)(bagma1)、鳞鲀属种(balistesspp)(balca1)、藤壶属种(balanusspp)(ba1r1、balr1.0101)、白僵菌属种(beauveriaspp)(beabald、beabenol、beabf2、beabhex)、巴西栗属种(bertholletiaspp)(bere1、bere1.0101、bere2、bere2.0101)、金眼鲷种(beryxspp)(bersp1)、桦木属种(betulaspp)(betab1、betal1、betch1、betco1、betda1、betgr1、bethu1、betle1、betme1、betn1、betp1、betpa1、betpo1、betpu1、betpu2、betpu4、betpu6、betpu7、betsc1、betut1、betv1、betv1b1-b1-b1、betv1fvmal4x、betv1.0101、betv1.0102、betv1.0103、betv1.0201、betv1.0301、betv1.0401、betv1.0402、betv1.0501、betv1.0601、betv1.0602、betv1.0701、betv1.0801、betv1.0901、betv1.1001、betv1.1101、betv1.1201、betv1.1301、betv1.1401、betv1.1402、betv1.1501、betv1.1502、betv1.1601、betv1.1701、betv1.1801、betv1.1901、betv1.2001、betv1.2101、betv1.2201、betv1.2301、betv1.2401、betv1.2501、betv1.2601、betv1.2701、betv1.2801、betv1.2901、betv1.3001、betv1.3101、betv2、betv2.0101、betv3、betv3.0101、betv4、betv4.0101、betv6、betv6.0101、betv6.0102、betv7、betv7.0101、betv8、betv葡聚糖酶)、甜菜属种(betaspp)(betav1、betav1.0101、betav2、betav2.0101)、小蠊属种(blattellaspp)(blag1、blag1.0101、blag1.0102、blag1.0103、blag1.0201、blag1.0202、blag2、blag2.0101、blag2.0201、blag36kd、blag4、blag4.0101、blag4.0201、blag5、blag5.0101、blag5.0201、blag6、blag6.0101、blag6.0201、blag6.0301、blag7、blag7.0101、blag8、blag8.0101、blag9、blag烯醇酶、blaggstd1、blagrack1、blagtpi、blag胰蛋白酶、blag卵黄蛋白原)、蠊属种(blattaspp)(blao1、blao7)、无爪螨属种(blomiaspp)(blot1、blot1.0101、blot1.0201、blot10、blot10.0101、blot10.0102、blot11、blot11.0101、blot12、blot12.0101、blot12.0102、blot13、blot13.0101、blot14、blot15、blot18、blot19、blot19.0101、blot2、blot2.0101、blot2.0102、blot2.0103、blot20、blot21、blot21.0101、blot3、blot3.0101、blot4、blot4.0101、blot5、blot5.0101、blot6、blot6.0101、blot7、blot8、blot9、blothsp70)、熊蜂属种(bombusspp)(bomar4、bomhy4、bomp1、bomp1.0101、bomp2、bomp3、bomp4、bomp4.0101、bomt1、bomt1.0101、bomt4、bomt4.0101)、蚕属种(bombyxspp)(bombm1、bombm1.0101、bombm7、bombm7.0101、bombm7.0102、bombm7.0103、bombm7.0104、bombm7.0105、bombm7.0106)、牛蜱属种(boophilusspp)(boom1、boom7、boom7.0101)、牛属种(bosspp)(bosd2、bosd2.0101、bosd2.0102、bosd2.0103、bosd3、bosd3.0101、bosd4、bosd4.0101、bosd5、bosd5.0101、bosd5.0102、bosd6、bosd6(mda)、bosd6.0101、bosd7、bosd7.0101、bosd8、bosd8αs1、bosd8αs2、bosd8β、bosd8κ、bosdα2i、bosdα2i.0101、bosd凝乳酶、bosd纤维蛋白、bosd明胶、bosdhg、bosd胰岛素、bosd乳铁蛋白、bosd乳过氧化物酶、bosd肌红蛋白、bosdobp、bosdoscp、bosd卵黄高磷蛋白、bosdpla2、bosdprvb、bosd凝血酶、bosdti、bosgrala、bosgr肌红蛋白)、矛头蝮属种(bothropsspp)(botas1、botat1)、垂穗草属种(boutelouaspp)(boug1)、bitingspp(bovov1)、乌鲂属种(bramaspp)(bradu1)、芸苔属种(brassicaspp)(braj1、braj1.0101、bran1、bran1.0101、bran4、bran7、bran8、branpg、brani8、brao3、brao3.0101、brar1、brar1.0101、brar2、brar2.0101、brar3、brar4、brar7)、雀麦属种(bromusspp)(broa1、broa4)、单鳍鳕属种(brosmespp)(brobr1)、雀麦属种(bromusspp)(broi1、broi5、broi7)、布鲁格丝虫属种(brugiaspp)(brum3、brum3.0101、brumbm33)、水牛属种(bubalusspp)(bubbala、bubbblg、bubb酪蛋白、bubb酪蛋白αs1、bubb酪蛋白αs2、bubb酪蛋白β、bubb酪蛋白κ)、隐杆线虫属种(caenorhabditisspp)(caeb3、caeb3.0101、caebr3、caebr3.0101、caee3、caee3.0101、caee3.0102、caere13、caere13.0101)、木豆属种(cajanusspp)(cajc1)、鱼虱属种(caligusspp)(calcl1、calcl1.0101、calcl1.0102)、省藤属种(calamusspp)(calle1)、美青蟹属种(callinectesspp)(cals2)、骆驼属种(camelusspp)(camdala、camd酪蛋白、camd酪蛋白αs1、camd酪蛋白αs2、camd酪蛋白β、camd酪蛋白κ)、弓背蚁属种(camponotusspp)(camfl7、camfl7.0101)、犬属种(canisspp)(canf1、canf1.0101、canf2、canf2.0101、canf3、canf3.0101、canf4、canf4.0101、canf5、canf5.0101、canf6、canf6.0101、canffeld1样、canfhoms2样、canf卵黄高磷蛋白、canftctp)、疣鳞鲀属种(canthidermisspp)(canma1)、黄道蟹属种(cancerspp)(canmg2、canp1)、大麻属种(cannabisspp)(cans3)、假丝酵母属种(candidaspp)(canda1、canda1.0101、canda3、canda3.0101、candacaap、candacyp、canda烯醇酶、candafpa、candamnsod、candapgk、candb2、candb2.0101、candbfdh、candr脂肪酶)、辣椒属种(capsicumspp)(capa1、capa1.0101、capa17kd、capa2、capa2.0101、capa30kd、capa葡聚糖酶、capch17kd)、麦杆虫属种(caprellaspp)(cape1)、山羊属种(capraspp)(caphala、caphblg、caph酪蛋白、caph酪蛋白αs1、caph酪蛋白αs2、caph酪蛋白β、caph酪蛋白κ、caphgsa)、龟足属种(capitulumspp)(capm1)、鲫属种(carassiusspp)(carau1)、鹅耳枥属种(carpinusspp)(carb1、carb1.0101、carb1.0102、carb1.0103、carb1.0104、carb1.0105、carb1.0106、carb1.0107、carb1.0108、carb1.0109、carb1.0110、carb1.0111、carb1.0112、carb1.0113、carb1.0201、carb1.0301、carb1.0302、carb2、carb4)、鲹属种(caranxspp)(carcr1)、山核桃属种(caryaspp)(cari1、cari1.0101、cari2、cari4、cari4.0101)、滨蟹属种(carcinusspp)(carma2)、鱼尾葵属种(caryotaspp)(carmi2)、番木瓜属种(caricaspp)(carp1、carp几丁质酶、carp木瓜乳凝蛋白酶、carp胞内蛋白酶)、栗属种(castaneaspp)(casc24kd、cass1、cass1.0101、cass1.0102、cass1.0103、cass2、cass5、cass5.0101、cass8、cass8.0101、cass9、cass9.0101)、长春花属种(catharanthusspp)(catr1、catr1.0101、catr17kd、catr2)、茎方头鱼属种(caulolatilusspp)(cauch1)、豚鼠属种(caviaspp)(cavp1、cavp1.0101、cavp2、cavp2.0101、cavp3、cavp3.0101、cavp明胶、cavpgsa)、锯鮨属种(centropristisspp)(cens1)、九棘鲈属种(cephalopholisspp)(cepso1)、蟳属种(charybdisspp)(chaf1、chaf1.0101)、棘白鲳属种(chaetodipterusspp)(chafa1)、扁柏属种(chamaecyparisspp)(chao1、chao1.0101、chao2、chao2.0101)、藜属种(chenopodiumspp)(chea1、chea1.0101、chea2、chea2.0101、chea3、chea3.0101)、摇蚊属种(chironomusspp)(chik1、chik10、chik10.0101)、毛丝鼠属种(chinchillaspp)(chil21kd_a、chil21kd_b)、雪蟹属种(chionoecetesspp)(chio1、chio1.0101、chio2、chio4、chio6、chioα_肌动蛋白、chioserca)、摇蚊属种(chironomusspp)(chit1、chit1.0101、chit1.0201、chit2、chit2.0101、chit2.0102、chit3、chit3.0101、chit4、chit4.0101、chit5、chit5.0101、chit6、chit6.0101、chit6.0201、chit7、chit7.0101、chit8、chit8.0101、chit9、chit9.0101)、锦海扇蛤属种(chlamysspp)(chln1)、草雁属种(chloephagaspp)(chlpi1)、嗜渣螨属种(chortoglyphusspp)(choa10)、金花虫属种(chrysomelaspp)(chrtr7、chrtr7.0101)、鹰咀豆属种(cicerspp)(cica2s白蛋白、cica白蛋白)、菊苣属种(cichoriumspp)(cici1)、臭虫属种(cimexspp)(ciml载氮蛋白(nitrophorin))、柑橘属种(citrusspp)(citl1、citl3、citl3.0101)、西瓜属种(citrullusspp)(citla2、citlamdh、citlatpi)、柑橘属种(citrusspp)(citr3、citr3.0101、cits1、cits1.0101、cits2、cits2.0101、cits3、cits3.0101、cits3.0102、citsifr)、枝孢属种(cladosporiumspp)(clac14、clac14.0101、clac9、clac9.0101、clah1、clah10、clah10.0101、clah12、clah12.0101、clah2、clah2.0101、clah42kd、clah5、clah5.0101、clah6、clah6.0101、clah7、clah7.0101、clah8、clah8csp、clah8.0101、clah9、clah9.0101、clahabh、clahgst、clahhch1、clahhsp70、clahntf2、clahtctp)、梭菌属种(clostridiumspp)(clohi胶原酶、clot类毒素)、鲱属种(clupeaspp)(cluh1、cluh1.0101、cluh1.0201、cluh1.0301)、椰子属种(cocosspp)(cocn2、cocn4、cocn5)、球孢子菌属种(coccidioidesspp)(cocpo8)、咖啡属种(coffeaspp)(cofa1、cofa1.0101)、鸽属种(columbaspp)(col1psa)、鬼伞属种(coprinusspp)(copc1、copc1.0101、copc2、copc2.0101、copc3、copc3.0101、copc4、copc5、copc5.0101、copc6、copc7、copc7.0101)、榛属种(corylusspp)(cora1、cora1.0101、cora1.0102、cora1.0103、cora1.0104、cora1.0201、cora1.0301、cora1.0401、cora1.0402、cora1.0403、cora1.0404、cora10、cora10.0101、cora11、cora11.0101、cora12、cora12.0101、cora13、cora13.0101、cora14、cora14.0101、cora2、cora2.0101、cora2.0102、cora8、cora8.0101、cora9、cora9.0101)、棒状杆菌属种(corynebacteriumspp)(cord类毒素)、榛属种(corylusspp)(corhe1)、鲯鳅属种(coryphaenaspp)(corhi1)、芫荽属种(coriandrumspp)(cors1、cors11kd、cors2)、栒子属种(cotoneasterspp)(cotl3)、褐虾属种(crangonspp)(crac1、crac1.0101、crac2、crac2.0101、crac4、crac4.0101、crac5、crac5.0101、crac6、crac6.0101、crac8、crac8.0101)、巨蛎属种(crassostreaspp)(crag1)、仓鼠属种(cricetusspp)(crichsa)、crivelliaspp(cripa1)、番红花属种(crocusspp)(cros1、cros1.0101、cros2、cros2.0101、cros3、cros3.01、cros3.02)、柳杉属种(cryptomeriaspp)(cryj1、cryj1.0101、cryj1.0102、cryj1.0103、cryj2、cryj2.0101、cryj2.0102、cryj3、cryj3.1、cryj3.2、cryj3.3、cryj3.4、cryj3.5、cryj3.6、cryj3.7、cryj3.8、cryj4、cryjap、cryj几丁质酶、cryjcpa9、cryjifr、cryjltp、cryjp1-p2)、栗疫属种(cryphonectriaspp)(crypap)、栉首蚤属种(ctenocephalidesspp)(ctef1、ctef1.0101、ctef2、ctef2.0101、ctef3、ctef3.0101)、草鱼属种(ctenopharyngodonspp)(cteid1)、黄瓜属种(cucumisspp)(cucm1、cucm1.0101、cucm2、cucm2.0101、cucm3、cucm3.0101、cucmlec17、cucmmdh)、南瓜属种(cucurbitaspp)(cucma18kd、cucma2、cucp2、cucpasco)、黄瓜属种(cucumisspp)(cucs2)、库蠓属种(culicoidesspp)(culn1、culn10、culn11、culn2、culn3、culn4、culn5、culn6、culn7、culn8、culn9、culnhsp70)、库蚊属种(culexspp)(culq28kd、culq35kd、culq7、culq7.0101、culq7.0102)、库蠓属种(culicoidesspp)(culso1)、孜然芹属种(cuminumspp)(cumc1、cumc2)、柏木属种(cupressusspp)(cupa1、cupa1.0101、cupa1.02、cupa2、cupa3、cupa4、cupa4.0101、cups1、cups1.0101、cups1.0102、cups1.0103、cups1.0104、cups1.0105、cups3、cups3.0101、cups3.0102、cups3.0103、cups8)、旋孢腔菌属种(cochliobolusspp)(curl1、curl1.0101、curl2、curl2.0101、curl3、curl3.0101、curl4、curl4.0101、curladh、curlgst、curlmnsod、curl稻米醇蛋白(oryzin)、curltrx、curlzps1)、蓝翅雁属种(cyanochenspp)(cyacy1)、犬牙石首鱼属种(cynoscionspp)(cynar1)、洋狗尾草属种(cynosurusspp)(cyncr1、cyncr5)、狗芽根属种(cynodonspp)(cynd1、cynd1.0101、cynd1.0102、cynd1.0103、cynd1.0104、cynd1.0105、cynd1.0106、cynd1.0107、cynd1.0201、cynd1.0202、cynd1.0203、cynd1.0204、cynd10、cynd11、cynd12、cynd12.0101、cynd13、cynd15、cynd15.0101、cynd2、cynd22、cynd22.0101、cynd23、cynd23.0101、cynd24、cynd24.0101、cynd4、cynd5、cynd6、cynd7、cynd7.0101)、犬牙石首鱼属种(cynoscionspp)(cynne1)、草原犬鼠属种(cynomysspp)(cynsp脂质运载蛋白)、鲤属种(cyprinusspp)(cypc1、cypc1.01、cypc1.02)、山蝰属种(daboiaspp)(dabru1)、鸦茅属种(dactylisspp)(dacg1、dacg1.01、dacg1.0101、dacg1.02、dacg12、dacg13、dacg2、dacg2.0101、dacg3、dacg3.0101、dacg4、dacg4.0101、dacg5、dacg5.0101、dacg7)、黇鹿属种(damaspp)(damdcsa)、鱼丹属种(daniospp)(danre1、danre2、danreα2i、danreck)、魟属种(dasyatisspp)(dasak1、dasam1、dassa1)、胡萝卜属种(daucusspp)(dauc1、dauc1.0101、dauc1.0102、dauc1.0103、dauc1.0104、dauc1.0105、dauc1.0201、dauc1.0301、dauc3、dauc4、dauc4.0101、dauccyp)、圆鲹属种(decapterusspp)(decru1)、棘穗软珊瑚属种(dendronephthyaspp)(denn1、denn1.0101)、尘螨属种(dermatophagoidesspp)(derf1、derf1.0101、derf1.0102、derf1.0103、derf1.0104、derf1.0105、derf1.0106、derf1.0107、derf1.0108、derf1.0109、derf1.0110、derf10、derf10.0101、derf10.0102、derf11、derf11.0101、derf13、derf13.0101、derf14、derf14.0101、derf15、derf15.0101、derf16、derf16.0101、derf17、derf17.0101、derf18、derf18.0101、derf2、derf2.0101、derf2.0102、derf2.0103、derf2.0104、derf2.0105、derf2.0106、derf2.0107、derf2.0108、derf2.0109、derf2.0110、derf2.0111、derf2.0112、derf2.0113、derf2.0114、derf2.0115、derf2.0116、derf2.0117、derf20、derf21、derf22、derf22.0101、derf3、derf3.0101、derf4、derf5、derf6、derf6.0101、derf7、derf7.0101、derf8、derf9、derfhsp70)、皮刺螨属种(dermanyssusspp)(derg10、derg10.0101)、尘螨属种(dermatophagoidesspp)(derm1、derm1.0101、derp1、derp1.0101、derp1.0102、derp1.0103、derp1.0104、derp1.0105、derp1.0106、derp1.0107、derp1.0108、derp1.0109、derp1.0110、derp1.0111、derp1.0112、derp1.0113、derp1.0114、derp1.0115、derp1.0116、derp1.0117、derp1.0118、derp1.0119、derp1.0120、derp1.0121、derp1.0122、derp1.0123、derp1.0124、derp10、derp10.0101、derp10.0102、derp10.0103、derp11、derp11.0101、derp13、derp14、derp14.0101、derp15、derp18、derp2、derp2.0101、derp2.0102、derp2.0103、derp2.0104、derp2.0105、derp2.0106、derp2.0107、derp2.0108、derp2.0109、derp2.0110、derp2.0111、derp2.0112、derp2.0113、derp2.0114、derp2.0115、derp20、derp20.0101、derp21、derp21.0101、derp23、derp23.0101、derp3、derp3.0101、derp4、derp4.0101、derp5、derp5.0101、derp5.0102、derp6、derp6.0101、derp7、derp7.0101、derp8、derp8.0101、derp9、derp9.0101、derp9.0102、derpp1-p2、derpp2-p1、ders1、ders2、ders3)、石竹属种(dianthusspp)(diacrip)、芒萁属种(dicranopterisspp)(dicl2s白蛋白)、柿属种(diospyrosspp)(diok17kd、diok4、diokifr)、薯蓣属种(dioscoreaspp)(dioptsp)、重牙鲷属种(diplodusspp)(dipho1)、盐草属种(distichlisspp)(diss1、diss7)、海鲋属种(ditremaspp)(ditte1)、黄蜂属种(dolichovespulaspp)(dola1、dola2、dola5、dola5.0101)、镰扁豆属种(dolichosspp)(dolb凝集素)、黄蜂属种(dolichovespulaspp)(dolm1、dolm1.0101、dolm1.02、dolm2、dolm2.0101、dolm5、dolm5.0101、dolm5.02)、果蝇属种(drosophilaspp)(droan7、droan7.0101、droer7、droer7.0101、droer7.0102、drogr7、drogr7.0101、drogr7.0102、drom7、drom7.0101、drom7.0102、drom7.0103、drom7.0104、drom7.0105、drom7.0106、drom7.0107、drom7.0108、drom7.0109、drom7.0110、drom7.0111、drom7.0112、drom7.0113、drom9、drommnsod、dromo7、dromo7.0101、dropp7、dropp7.0101、drose7、drose7.0101、drosi7、drosi7.0101、drosi7.0102、drovi7、drovi7.0101、drowi7、drowi7.0101、droy7、droy7.0101、droy7.0102、droy7.0103)、蓝蓟属种(echiumspp)(echp细胞色素c)、油棕属种(elaeisspp)(elag2、elagbd31kd)、海鲢属种(elopsspp)(elosa1)、埃里格孢属种(embellisiaspp)(emba1、embi1、embnz1、embt1)、鳀属种(engraulisspp)(enge1)、肠腕蛸属种(enteroctopusspp)(entd1)、石斑鱼属种(epinephelusspp)(epibl1、epico1、epifl1、epimc1、epimo1)、附球菌属种(epicoccumspp)(epip1、epip1.0101、epip12kd、epipgst)、石斑鱼属种(epinephelusspp)(epipo1、epiun1)、木贼属种(equisetumspp)(equa17kd)、马属种(equusspp)(equas4、equasdsa、equbu4、equc1、equc1.0101、equc2、equc2.0101、equc2.0102、equc3、equc3.0101、equc4、equc4.0101、equc5、equc5.0101、equcala、equcblg、equc酪蛋白、equc酪蛋白β、equc酪蛋白κ、equcprvb、equhe4、equzzsa)、毛甲蟹属种(erimacrusspp)(erii1、erii1.0101、erii1.0102)、绒螯蟹属种(eriocheirspp)(eris1、eris1.0101、eris2)、欧文氏菌属种(erwiniaspp)(erwch天冬酰胺酶)、埃希氏杆菌属种(escherichiaspp)(escc天冬酰胺酶、esccβgal)、狗鱼种(esoxspp)(esol1)、磷虾属种(euphausiaspp)(eupp1、eupp1.0101)、磷虾属种(euphasiaspp)(eups1、eups1.0101)、嗜霉螨属种(euroglyphusspp)(eurm1、eurm1.0101、eurm1.0102、eurm1.0103、eurm10、eurm14、eurm14.0101、eurm2、eurm2.0101、eurm2.0102、eurm3、eurm3.0101、eurm4、eurm4.0101)、犁齿鲷属种(evynnisspp)(evyj1)、荞麦属种(fagopyrumspp)(fage1、fage1.0101、fage10kd、fage19kd、fage2、fage2.0101、fageti)、水青冈属种(fagusspp)(fags1、fags1.0101、fags2、fags4)、荞麦属种(fagopyrumspp)(fagt1、fagt10kd、fagt2、fagt2.0101)、猫属种(felisspp)(feld1、feld1.0101、feld2、feld2.0101、feld3、feld3.0101、feld4、feld4.010l、feld5、feld5.0101、feld6、feld6.0101、feld7、feld7.0101、feld8、feld8.0101、feldigg)、明对虾属种(fenneropenaeusspp)(fenc1、fenc2、fenme1、fenme1.0101)、羊茅属种(festucaspp)(fese1、fese13、fese4、fese5、fese7、fesp1、fesp13、fesp4、fesp4.0101、fesp5、fesr1、fesr5)、无花果属种(ficusspp)(ficc17kd、ficc4、ficc无花果蛋白酶)、茴香属种(foeniculumspp)(foev1、foev2)、连翘属种(forsythiaspp)(fors1)、铗蠓属种(forcipomyiaspp)(fort1、fort1.0101、fort2、fort2.0101、fort7、fortfpa、fort肌球蛋白、forttpi)、草莓-属种(fragariaspp)(fraa1、fraa1.0101、fraa3、fraa3.0101、fraa3.0102、fraa3.0201、fraa3.0202、fraa3.0203、fraa3.0204、fraa3.0301、fraa4、fraa4.0101、frac1)、白蜡树属种(fraxinusspp)(frae1、frae1.0101、frae1.0102、frae1.0201、frae12、frae2、frae3、frae9)、草莓属种(fragariaspp)(frav1)、镰刀菌属种(fusariumspp)(fusc1、fusc1.0101、fusc2、fusc2.0101、fusc3、fuss1、fuss45kd、fussp脂肪酶)、鳕属种(gadusspp)(gadc1、gadc1.0101、gadcapdh、gadm1、gadm1.0101、gadm1.0102、gadm1.0201、gadm1.0202、gadm45kd、gadm明胶、gadma1)、原鸡属种(gallusspp)(gald1、gald1.0101、gald2、gald2.0101、gald3、gald3.0101、gald4、gald4.0101、gald5、gald5.0101、gald6、gald6.0101、galdapoi、galdapovi、galdgpi、galdhg、galdigy、galdl-pgds、gald卵粘蛋白、gald卵黄高磷蛋白、galdprvb、galla4)、galleriaspp(galm18kd、galm24kd)、原鸡属种(gallusspp)(galso4)、钩虾属种(gammarusspp)(gamstm)、白树属种(geloniumspp)(gelmrip)、泽蟹属种(geothelphusaspp)(geode1)、舌蝇属种(glossinaspp)(glom5、glom5.0101、glom7、glom7.0101、glom7.0102、glom7.0103)、大豆属种(glycinespp)(glyabd30k、glyarbd30k、glycabd30k、glyclbd30k、glycubd30k、glycybd30k)、食甜螨属种(glycyphagusspp)(glyd10、glyd10.0101、glyd13、glyd2、glyd2.0101、glyd2.0201、glyd2.03、glyd2/lepd2l1、glyd2/lepd2l2、glyd2/lepd2l3、glyd2/lepd2l4、glyd2/lepd2r1、glyd2/lepd2r2、glyd2/lepd2r3、glyd2/lepd2r4、glyd2/lepd2r5、glyd20、glyd3、glyd5、glyd5.01、glyd5.02、glyd7、glyd8)、大豆属种(glycinespp)(glyfbd30k、glylbd30k、glym1、glym1.0101、glym1.0102、glym2、glym2.0101、glym2s白蛋白、glym3、glym3.0101、glym3.0102、glym39kd、glym4、glym4.0101、glym5、glym5.0101、glym5.0201、glym5.0301、glym5.0302、glym50kd、glym6、glym6.0101、glym6.0201、glym6.0301、glym6.0401、glym6.0501、glym68kd、glym凝集素、glymbd28k、glymbd30k、glymbd60k、glymcpi、glymeap、glymti、glymibd30k、glysbd30k、glytbd30k、glytobd30k)、棉属种(gossypiumspp)(gosh豌豆球蛋白)、嗜血杆菌属种(haemophilusspp)(haeinp6)、血蜱属种(haemaphysalisspp)(hael7、hael7.0101、haeq7、haeq7.0101)、鲍属种(haliotisspp)(hala1、hald1、haldi1、haldipm、halm1、halm1.0101、halr1、halr49kd、halru1)、harmoniaspp(hara1、hara1.0101、hara2、hara2.0101)、掠猛蚁属种(harpegnathosspp)(harsa7、harsa7.0101、harsa7.0102)、向日葵属种(helianthusspp)(hela1、hela1.0101、hela2、hela2.0101、hela2s白蛋白、hela3、hela3.0101、hela4)、蜗牛属种(helixspp)(helap1、helas1、helas1.0101)、螺旋线虫属种(heligmosomoidesspp)(help3、help3.0101)、向日葵属种(helianthusspp)(heltu1)、银花鮨属种(hemanthiasspp)(hemle1)、角螺属种(hemifususspp)(hemt1)、异皮线虫属种(heteroderaspp)(hetg3、hetg3.0101)、橡胶树属种(heveaspp)(hevb1、hevb1.0101、hevb10、hevb10.0101、hevb10.0102、hevb10.0103、hevb11、hevb11.0101、hevb11.0102、hevb12、hevb12.0101、hevb13、hevb13.0101、hevb14、hevb14.0101、hevb2、hevb2.0101、hevb3、hevb3.0101、hevb4、hevb4.0101、hevb5、hevb5.0101、hevb6、hevb6.01、hevb6.02、hevb6.0202、hevb6.03、hevb7、hevb7.01、hevb7.02、hevb7.d2、hevb7.s2、hevb8、hevb8.0101、hevb8.0102、hevb8.0201、hevb8.0202、hevb8.0203、hevb8.0204、hevb9、hevb9.0101、hevb柠檬酸盐结合蛋白、hevbgapdh、hevbhsp80、hevbifr、hevb蛋白酶体亚基、hevb旋转异构酶、hevbspi、hevbtrx、hevbudpgp)、六线鱼属种(hexagrammosspp)(hexot1)、庸鲽属种(hippoglossusspp)(hiph1)、拟庸鲽属种(hippoglossoidesspp)(hippl1)、庸鲽属种(hippoglossusspp)(hipst1)、蛭属种(hirudospp)(hirme水蛭素)、绒毛草属种(holcusspp)(holl1、holl1.0101、holl1.0102、holl2、holl4、holl5、holl5.0101、holl5.0201)、holocnemusspp(holpl9、holpl血蓝蛋白)、螯龙虾属种(homarusspp)(homa1、homa1.0101、homa1.0102、homa1.0103、homa3、homa3.0101、homa4、homa6、homa6.0101、homg1、homg2)、人属种(homospp)(homs1、homs1.0101、homs2、homs2.0101、homs3、homs3.0101、homs4、homs4.0101、homs5、homs5.0101、homsaat、homsacth、homs阿达木单抗、homsala、homsα_肌动蛋白、homsα-半乳糖苷酶、homsapdh、homs芳基硫酸酯酶b、homs酪蛋白、homscypa、homscypb、homscypc、homsdsf70、homsdsg3、homseif6、homs依那西普、homs因子ix、homs因子vii、homs因子viii、homsg-csf、homs葡糖脑苷脂酶、homs葡糖苷酶、homshla-dr-α、homshsa、homs艾杜糖醛酸酶、homs艾度硫酸酯酶、homsiga、homs胰岛素、homs乳铁蛋白、homs层粘连蛋白γ_2、homsmnsod、homs催产素、homsp2、homs卵黄高磷蛋白、homs抑制蛋白、homspsa、homsrp1、homstctp、homstl、homstpa、homstpo、homs转醛醇酶、homstrx、homs微管蛋白-α、homs/musm巴利昔单抗、homs/musm西妥昔单抗、homs/musm西妥昔单抗(gal-gal)、homs/musm英夫利西单抗、homs/musm那他珠单抗、homs/musm奥马珠单抗、homs/musm帕利珠单抗、homs/musm利妥昔单抗、homs/musm托珠单抗、homs/musm曲妥珠单抗)、胸棘鲷属种(hoplostethusspp)(hopa1)、大麦属种(hordeumspp)(horv1、horv12、horv12.0101、horv13、horv14、horv15、horv15.0101、horv16、horv16.0101、horv17、horv17.0101、horv18kd、horv2、horv21、horv21.0101、horv28、horv33、horv4、horv5、horv5.0101、horvbdai、horvbti)、腐质霉属种(humico1aspp)(纤维素酶中的hum)、葎草属种(humulusspp)(humj1、humj1.0101、humj10kd、humj2)、鳇属种(husospp)(hush1)、量天尺属种(hylocereusspp)(hylunltp)、膜首鳕属种(hymenocephalusspp)(hymst1)、栉鲳属种(hyperoglyphespp)(hypby1)、鲢属种(hypophthalmichthysspp)(hypmo1)、鲢属种(hypophthalmichthyspp)(hypno1)、真鮰属种(ictalurusspp)(ictfu1、ictp1)、白茅属种(imperataspp)(impc4、impc5、impcviiie1)、硬蜱属种(ixodesspp)(ixor2、ixosc7、ixosc7.0101)、龙虾属种(jasusspp)(jasla1、jasla1.0101、jasla1.0102)、胡桃属种(juglansspp)(jugca1、jugca2、jugci1、jugci2、jugn1、jugn1.0101、jugn2、jugn2.0101、jugr1、jugr1.0101、jugr2、jugr2.0101、jugr3、jugr3.0101、jugr4、jugr4.0101、jugr5)、刺柏属种(juniperusspp)(juna1、juna1.0101、juna1.0102、juna2、juna2.0101、juna3、juna3.0101、junc1、juno1、juno4、juno4.0101、junr3、junr3.1、junr3.2、junv1、junv1.0101、junv1.0102、junv3、junv3.0101、junv3.0102、junv4)、鲣属种(katsuwonusspp)(katp1)、舵鱼属种(kyphosusspp)(kypse1)、毛唇隆头鱼属种(lachnolaimusspp)(lacma1)、巨蝮属种(lachesisspp)(lacmu1)、莴苣属种(lactucaspp)(lacs1、lacs1.0101)、兔头鲀属种(lagocephalusspp)(lagla1)、鸥属种(larusspp)(lara1、lara2、lara3)、黄鱼属种(larimichthysspp)(larpo1)、尖吻鲈属种(latesspp)(latc1)、花鲈属种(lateolabraxspp)(latja1)、山黧豆属种(lathyrusspp)(latoc凝集素)、平口石首鱼属种(leiostomusspp)(leixa1)、兵豆属种(lensspp)(lenc1、lenc1.0101、lenc1.0102、lenc1.0103、lenc2、lenc2.0101、lenc3、lenc3.0101、lenc凝集素)、虎猫属种(leopardusspp)(leop1)、嗜鳞螨属种(lepidoglyphusspp)(lepd10、lepd10.0101、lepd12、lepd13、lepd13.0101、lepd2、lepd2.0101、lepd2.0102、lepd2.0201、lepd2.0202、lepd3、lepd39kd、lepd5、lepd5.0101、lepd5.0102、lepd5.0103、lepd7、lepd7.0101、lepd8、lepdα微管蛋白)、太阳鱼属种(lepomisspp)(lepgi1)、黑体马鲅属种(leptomelanosomaspp)(lepi1)、太阳鱼属种(lepomisspp)(lepma1)、衣鱼属种(lepismaspp)(leps1、leps1.0101、leps1.0102)、疮痂鱼虱属种(lepeophtheirusspp)(lepsa1、lepsa1.0101、lepsa1.0102、lepsa1.0103)、薮猫属种(leptailurusspp)(lepse1)、鳞鲆属种(lepidorhombusspp)(lepw1、lepw1.0101)、田鳖属种(lethocerusspp)(letin7、letin7.0101、letin7.0102)、雅罗鱼属种(leuciseusspp)(leuce1)、lewiaspp(lewin1)、女贞属种(ligustrumspp)(ligv1、ligv1.0101、ligv1.0102、ligv2)、百合属种(liliumspp)(lill2、lillpg)、黄盖鲽属种(limandaspp)(limfe1)、大头蛙属种(limnonectesspp)(limm1)、鲎属种(limulusspp)(limp1、limp1.0101、limp2、limplpa)、书虱属种(liposcelisspp)(lipb1、lipb1.0101)、荔枝属种(litchispp)(litc1、litc1.0101、litcifr、litctpi)、牛蛙属种(lithobatesspp)(litca1)、滨对虾属种(litopenaeusspp)(litse1、litv1、litv1.0101、litv2、litv2.0101、litv3、litv3.0101、litv4、litv4.0101)、丝虫属种(filiariaspp)(loalo3、loalo3.0101)、松鲷属种(lobotesspp)(lobsu1)、飞蝗属种(locustaspp)(locm7、locm7.0101)、枪乌贼属种(loligospp)(lolb1、lole1)、毒麦属种(loliumspp)(lolm2、lolm5、lolp1、lolp1.0101、lolp1.0102、lolp1.0103、lolp10、lolp11、lolp11.0101、lolp12、lolp13、lolp2、lolp2.0101、lolp3、lolp3.0101、lolp4、lolp4.0101、lolp5、lolp5.0101、lolp5.0102、lolp7、lolpcyp、lolpft、lolp豆球蛋白(legumin))、lonomiaspp(lono7、lono7.0101)、棕胁秋沙鸭属种(lophodytesspp)(lopcu1)、冠鸭属种(lophonettaspp)(lopsp1)、羽扇豆属种(lupinusspp)(lupa1、lupaα_蓝豆蛋白、lupaδ_蓝豆蛋白、lupaγ_蓝豆蛋白、lupan1、lupan1.0101、lupanα_蓝豆蛋白、lupanδ_蓝豆蛋白、lupanγ_蓝豆蛋白、lupl17kd)、笛鲷属种(lutjanusspp)(luta1、lutc1、lutcy1、lutgr1、lutgu1、lutjo1)、獭蛤属种(lutrariaspp)(lutp1)、笛鲷属种(lutjanusspp)(lutpu1、lutsy1)、番茄属种(lycopersiconspp)(lyce1、lyce1.0101、lyce11s球蛋白、lyce2、lyce2.0101、lyce2.0102、lyce3、lyce3.0101、lyce4、lyce4.0101、lycearp60s、lyce几丁质酶、lyee葡聚糖酶、lyce过氧化物酶、lycepg、lycepme、lycepr23、lyce豌豆球蛋白)、曼粉蚧属种(maconellicoccusspp)(mach7、mach7.0101)、尖尾无须鳕属种(macruronusspp)(macma1、macn1)、桑橙属种(macluraspp)(macpo17kd)、沼虾属种(macrobrachiumspp)(macro1、macro1.0101、macro血蓝蛋白)、大袋鼠属种(macropusspp)(macrs明胶)、苹果属种(malusspp)(mald1、mald1.0101、mald1.0102、mald1.0103、mald1.0104、mald1.0105、mald1.0106、mald1.0107、mald1.0108、mald1.0109、mald1.0201、mald1.0202、mald1.0203、mald1.0204、mald1.0205、mald1.0206、mald1.0207、mald1.0208、mald1.0301、mald1.0302、mald1.0303、mald1.0304、mald1.0401、mald1.0402、mald1.0403、mald2、mald2.0101、mald3、mald3.0101、mald3.0102、mald3.0201、mald3.0202、mald3.0203、mald4、mald4.0101、mald4.0102、mald4.0201、mald4.0202、mald4.0301、mald4.0302)、金虎尾属种(malpighiaspp)(malg4、malg橡胶蛋白)、苹果属种(malusspp)(malp1)、马拉色氏霉菌属种(malasseziaspp)(malaf2、malaf2.0101、malaf3、malaf3.0101、malaf4、malaf4.0101、malag10、malas1、malas1.0101、malas10、malas10.0101、malas11、malas11.0101、malas12、malas12.0101、malas13、malas13.0101、malas5、malas5.0101、malas6、malas6.0101、malas7、malas7.0101、malas8、malas8.0101、malas9、malas9.0101)、木薯属种(manihotspp)(mane5、mane5.0101、manefpa、manegapdh)、芒果属种(mangiferaspp)(mani1、mani14kd、mani2、mani3、mani3.01、mani3.02、mani几丁质酶)、囊对虾属种(marsupenaeusspp)(marj1、marj1.0101、marj2、marj4)、母菊属种(matricariaspp)(matc17kd)、纺织娘属种(mecopodaspp)(mece7)、鲂属种(megalobramaspp)(megam2、megamck)、megathuraspp(megc血蓝蛋白)、大海鲢属种(megalopsspp)(megsp1)、黑线鳕属种(melanogrammusspp)(mela1)、火鸡属种(meleagrisspp)(melg1、melg2、melg3、melgprvb、melgtsa)、沟对虾属种(melicertusspp)(mell1)、无鳔石首鱼属种(menticirrhusspp)(menam1)、山靛属种(mercurialisspp)(mera1、mera1.0101)、无须鳕属种(merlucciusspp)(merap1、merau1、merbi1、merca1、merga1、merhu1)、牙鳕属种(merlangiusspp)(merme1)、无须鳕属种(merlucciusspp)(mermr1、merpa1、merpo1、merpr1、merse1)、沙鼠属种(merionesspp)(merun23kd)、绿僵菌属种(metarhiziumspp)(meta30)、赤虾属种(metapenaeopsisspp)(metba1)、新对虾属种(metapenaeusspp)(mete1、mete1.0101、mete2)、水杉属种(metasequoiaspp)(metgl2)、新对虾属种(metapenaeusspp)(metj1、metj2)、后海螯虾属种(metanephropsspp)(metja1)、赤虾属种(metapenaeopsisspp)(metla1)、后海螯虾属种(metanephropsspp)(mett2)、蓝鳕属种(micromesistiusspp)(micpo1)、绒须石首鱼属种(micropogoniasspp)(micun1)、类栉孔扇贝属种(mimachlamysspp)(mimn1)、苦瓜属种(momordicaspp)(momcrip)、桑属种(morusspp)(mora17kd、mora4)、狼鲈属种(moronespp)(moram1)、桑属种(morusspp)(morn3、morn3.0101)、狼鲈属种(moronespp)(morsa1、morsc1)、鲻属种(mugilspp)(mugc1)、鳗鳞鳕属种(muraenolepisspp)(murmi1)、芭蕉属种(musaspp)(musa1、musa1.0101、musa2、musa2.0101、musa3、musa3.0101、musa4、musa4.0101、musa5、musa5.0101、musa5.0102)、小鼠属种(musspp)(musm1、musm1.0101、musm1.0102、musm2、musm明胶、musmigg、musmmsa、musm莫罗单抗、musm卵黄高磷蛋白)、鼬属种(mustelaspp)(musp17kd)、芭蕉属种(musaspp)(musxp1、musxp2、musxp5)、喙鲈属种(mycteropercaspp)(mycbo1、mycmi1、mycph1)、毁丝霉属种(myceliophthoraspp)(mycsplaccase)、斗牛犬蚁属种(myrmeciaspp)(myrp1、myrp1.0101、myrp2、myrp2.0101、myrp2.0102、myrp3、myrp3.0101)、贻贝属种(mytilusspp)(myte1、mytg1、mytgpm)、瘤蚜属种(myzusspp)(myzp7、myzp7.0101)、斑羚属种(nemorhedusspp)(naegohya)、板口线虫属种(necatorspp)(neca钙网蛋白)、金线鱼属种(nemipterusspp)(nemvi1)、新萨托菌属种(neosartoryaspp)(neofi1、neofi22)、绿翅雁属种(neochenspp)(neoju1)、新园蛛属种(neosconaspp)(neon7、neon7.0101)、韶子属种(nepheliumspp)(neplgapdh)、挪威海螯虾属种(nephropsspp)(nepn1、nepndf9)、香螺属种(neptuneaspp)(neppo1、neppo1.0101)、烟草属种(nicotianaspp)(nict8、nict渗调蛋白、nict绒毛蛋白)、假格链格孢属种(nimbyaspp)(nimc1、nims1)、鼠钩口属种(nippostrongylusspp)(nipbag1)、懒猴属种(nycticebusspp)(nycc1)、章鱼属种(octopusspp)(octf1、octl1、octv1、octv1.0101、octvpm)、敏尾笛鲷属种(ocyurusspp)(ocych1)、木犀榄属种(oleaspp)(olee1、olee1.0101、olee1.0102、olee1.0103、olee1.0104、olee1.0105、olee1.0106、olee1.0107、olee10、olee10.0101、olee11、olee11.0101、olee11.0102、olee12、olee13、olee2、olee2.0101、olee3、olee3.0101、olee36kd、olee4、olee4.0101、olee5、olee5.0101、olee6、olee6.0101、olee7、olee7.0101、olee8、olee8.0101、olee9、olee9.0101)、赤鱿属种(ommastrephesspp)(ommb1、ommb1.0101)、大麻哈鱼属种(oncorhynchusspp)(oncke1、oncke18kd、onckeα2i、oncke卵黄蛋白原、oncm1、oncm1.0101、oncm1.0201、oncmα2i、oncm鱼精蛋白、oncm卵黄蛋白原、oncma1、oncmafpa、oncmafsa、oncmatpi、oncn1)、盘尾属种(onchocercaspp)(onco3、onco3.0101)、大麻哈鱼属种(oncorhynchusspp)(oncts1)、盘尾属种(onchocercaspp)(oncv3、oncv3.0101)、口虾蛄属种(oratosquillaspp)(orao1、orao1.0101)、丽鲷属种(oreochromisspp)(orea1、oremo1、oremo2、oremofpa、oremoscaf7145、oreni1、oreni18kd、oreni45kd)、禽刺螨属种(ornithonyssusspp)(ornsy10、ornsy10.0101、ornsy10.0102)、穴兔属种(oryctolagusspp)(oryc1、oryc1.0101、oryc2、oryc酪蛋白、oryc卵黄高磷蛋白、orycrsa)、稻属种(oryzaspp)(orys1、orys1.0101、orys11、orys12、orys12.0101、orys13、orys14、orys17kd、orys19kd、orys2、orys23、orys3、orys7、orysaa_ti、orysglp52、orysglp63、orys乙二醛酶i、orysnra)、铁木属种(ostryaspp)(ostc1、ostc1.0101)、羊属种(ovisspp)(oviaala、oviablg、ovia酪蛋白、ovia酪蛋白αs1、ovia酪蛋白αs2、ovia酪蛋白β、ovia酪蛋白κ、ovia卵黄高磷蛋白、oviassa)、厚结猛蚁属种(pachycondylaspp)(pacc3)、赤鲷属种(pagrusspp)(pagm1、pagpa1)、鲳属种(pampusspp)(pamar1、pamc1)、长额虾属种(pandalusspp)(panb1、panb1.0101)、巨鲶属种(pangasiusspp)(panbo1)、长额虾属种(pandalusspp)(pane1、pane1.0101、pane4)、龙虾属种(panulirusspp)(panh1、panhy1)、巨鲶属种(pangasiusspp)(panhy18kd、panhy45kd)、龙虾属种(panulirusspp)(panj1)、豹属种(pantheraspp)(panl1、pano1、panp1)、龙虾属种(panulirusspp)(pans1、pans1.0101)、豹属种(pantheraspp)(pant1)、黑猩猩属种(panspp)(pantrtctp)、罂粟属种(papaverspp)(paps17kd、paps2、paps34kd)、凤蝶属种(papiliospp)(papxu7、papxu7.0101、papxu7.0102)、牙鲆属种(paralichthysspp)(para1)、鲇属种(parasilurusspp)(paras1、parc1)、拟石蟹属种(paralithodesspp)(parc1.0101、parc1.0102、parf1)、银胶菊属种(partheniumspp)(parh1)、墙草属种(parietariaspp)(parj1、parj1.0101、parj1.0102、parj1.0103、parj1.0201、parj2、parj2.0101、parj2.0102、parj3、parj3.0101、parj3.0102、parj4、parj4.0101、parjj1-j2)、牙鲆属种(paralichthysspp)(parle1)、墙草属种(parietariaspp)(parm1、paro1、paro1.0101)、牙鲆属种(paralichthysspp)(parol1、parolα2i)、parahuchospp(parpe卵黄蛋白原)、西番莲属种(passifloraspp)(pase几丁质酶、pase橡胶蛋白)、雀稗属种(paspalumspp)(pasn1、pasn1.0101、pasn13)、盘海扇属种(patinopectenspp)(paty1)、虱属种(pediculusspp)(pedh7、pedh7.0101)、对虾属种(penaeusspp)(pena1、pena1.0101、pena1.0102、pena1.0102(103-117)、pena1.0102(109-123)、pena1.0102(1-15)、pena1.0102(115-129)、pena1.0102(121-135)、pena1.0102(127-141)、pena1.0102(13-27)、pena1.0102(133-147)、pena1.0102(139-153)、pena1.0102(145-159))、美对虾属种(farfantepenaeusspp)(pena1.0102(151-165))、对虾属种(penaeusspp)(pena1.0102(157-171)、pena1.0102(163-177)、pena1.0102(169-183)、pena1.0102(175-189)、pena1.0102(181-195)、pena1.0102(187-201)、pena1.0102(193-207)、pena1.0102(19-33)、pena1.0102(199-213)、pena1.0102(205-219)、pena1.0102(211-225)、pena1.0102(217-231)、pena1.0102(223-237)、pena1.0102(229-243))、美对虾属种(farfantepenaeusspp)(pena1.0102(235-249))、对虾属种(penaeusspp)(pena1.0102(241-255)、pena1.0102(247-261)、pena1.0102(253-267)、pena1.0102(25-39)、pena1.0102(259-273)、pena1.0102(265-279)、pena1.0102(270-284)、pena1.0102(31-45)、pena1.0102(37-51)、pena1.0102(43-57)、pena1.0102(49-63))、美对虾属种(farfantepenaeusspp)(pena1.0102(55-69))、对虾属种(penaeusspp)(pena1.0102(61-75)、pena1.0102(67-81)、pena1.0102(7-21)、pena1.0102(73-87)、pena1.0102(79-93)、pena1.0102(85-99)、pena1.0102(91-105)、pena1.0102(97-111)、pena1.0103)、青霉菌属种(penicilliumspp)(penb13、penb13.0101、penb26、penb26.0101、penc1、penc13、penc13.0101、penc18、penc19、penc19.0101、penc2、penc22、penc22.0101、penc24、penc24.0101、penc3、penc3.0101、penc30、penc30.0101、penc32、penc32.0101、pencmnsod、pench13、pench13.0101、pench18、pench18.0101、pench20、pench20.0101、pench31、pench31.0101、pench33、pench33.0101、pench35、pench35.0101、penchmnsod)、对虾属种(penaeusspp)(peni1、peni1.0101、penm1、penm1.0101、penm1.0102、penm2、penm2.0101、penm3、penm3.0101、penm4、penm4.0101、penm6、penm6.0101)、青霉菌属种(penicilliumspp)(peno18、peno18.0101)、对虾属种(penaeusspp)(penao1、penao1.0101)、大蠊属种(periplanetaspp)(pera1、pera1.0101、pera1.0102、pera1.0103、pera1.0104、pera1.0105、pera1.0201、pera10、pera10.0101、pera2、pera3、pera3.0101、pera3.0201、pera3.0202、pera3.0203、pera4、pera5、pera6、pera6.0101、pera7、pera7.0101、pera7.0102、pera7.0103、pera9、pera9.0101、pera组织蛋白酶、perafabp、pera胰蛋白酶、perf1、perf7、perf7.0101)、股贻贝属种(pernaspp)(perv1)、鳄梨属种(perseaspp)(persa1、persa1.0101、persa4)、欧芹属种(petroselinumspp)(petc1、petc2、petc3)、虉草属种(phalarisspp)(phaa1、phaa1.0101、phaa5、phaa5.0101、phaa5.02、phaa5.03、phaa5.04)、菜豆属种(phaseolusspp)(phav3、phav3.0101、phav3.0201、phavaai、phavaai.0101、phav几丁质酶、phavpha、phav菜豆球蛋白)、梯牧草属种(phleumspp)(phlp1、phlp1.0101、phlp1.0102、phlp11、phlp11.0101、phlp12、phlp12.0101、phlp12.0102、phlp12.0103、phlp13、phlp13.0101、phlp2、phlp2.0101、phlp3、phlp3.0101、phlp3.0102、phlp4、phlp4.0101、phlp4.0102、phlp4.0201、phlp4.0202、phlp4.0203、phlp4.0204、phlp5、phlp5.0101、phlp5.0102、phlp5.0103、phlp5.0104、phlp5.0105、phlp5.0106、phlp5.0107、phlp5.0108、phlp5.0109、phlp5.0201、phlp5.0202、phlp5.0203、phlp5.0204、phlp5.0205、phlp5.0206、phlp5.0207、phlp6、phlp6.0101、phlp6.0102、phlp7、phlp7.0101、phlpp1-p2-p5-p6、phlpp2-p6、phlpp5-p1、phlpp6-p2)、刺葵属种(phoenixspp)(phod2、phod2.0101、phod40kd、phod90kd)、毛足鼠属种(phodopusspp)(phos21kd)、茎点霉属种(phomaspp)(phot1)、芦苇属种(phragmitesspp)(phra1、phra12、phra13、phra4、phra5)、商陆属种(phytolaccaspp)(phyarip)、茴芹属种(pimpinellaspp)(pima1、pima2)、江珧蛤属种(pinnaspp)(pina1)、胡椒属种(piperspp)(pipn14kd、pipn28kd)、豌豆属种(pisumspp)(piss1、piss1.0101、piss1.0102、piss2、piss2.0101、piss5、piss凝集素、piss白蛋白)、黄连木属种(pistaciaspp)(pisv1、pisv1.0101、pisv2、pisv2.0101、pisv2.0201、pisv3、pisv3.0101、pisv4、pisv4.0101、pisv5、pisv5.0101)、悬铃木属种(platanusspp)(plaa1、plaa1.0101、plaa2、plaa2.0101、plaa3、plaa3.0101、plaa8)、川鲽属种(platichthysspp)(plaf1)、车前属种(plantagospp)(plal1、plal1.0101、plal1.0102、plal1.0103、plal细胞色素c)、悬铃木属种(platanusspp)(plaoc1、plaor1、plaor1.0101、plaor2、plaor2.0101、plaor3、plaor3.0101、plaor4、plaorcyp、plar1)、鳃棘鲈属种(plectropomusspp)(plear1)、格孢菌属种(pleosporaspp)(pleh1)、鳃棘鲈属种(plectropomusspp)(plele1)、谷斑螟属种(plodiaspp)(ploi1、ploi1.0101、ploi2、ploi2.0101)、早熟禾属种(poaspp)(poap1、poap1.0101、poap10、poap12、poap13、poap2、poap4、poap5、poap5.0101、poap6、poap7)、马蜂属种(polistesspp)(pola1、pola1.0101、pola2、pola2.0101、pola5、pola5.0101、pold1、pold1.0101、pold1.0102、pold1.0103、pold1.0104、pold4、pold4.0101、pold5、pold5.0101、pole1、pole1.0101、pole2、pole4、pole4.0101、pole5、pole5.0101、polf5、polf5.0101、polg1、polg1.0101、polg2、polg4、polg5、polg5.0101、polhemlt、polm5、polm5.0101)、素摇蚊属种(polypedilumspp)(poln1)、龟足属种(pollicipesspp)(polpo1)、青鳕属种(pollachiusspp)(polvi1)、polybiaspp(polyp1、polyp1.0101、polyp2、polyp5、polys5、polys5.0101)、扁鲹种(pomatomusspp)(pomsa1)、猩猩属种(pongospp)(ponabhsa)、pontastacusspp(ponl4、ponl4.0101、ponl7、ponl7.0101)、梭子蟹属种(portunusspp)(pors1、pors1.0101、pors1.0102、portr1、portr1.0101)、protortoniaspp(proca38kd)、原螯虾属种(procumbarusspp)(procl1、procl1.0101、procl21kd)、牧豆树属种(prosopisspp)(proj20kd)、李属种(prunusspp)(pruar1、pruar1.0101、pruar3、pruar3.0101、pruav1、pruav1.0101、pruav1.0201、pruav1.0202、pruav1.0203、pruav2、pruav2.0101、pruav3、pruav3.0101、pruav4、pruav4.0101、pruc1、prud1、prud2、prud3、prud3.0101、prud4、prudu1、prudu2、prudu2s白蛋白、prudu3、prudu3.0101、prudu4、prudu4.0101、prudu4.0102、prudu5、prudu5.0101、prudu6、prudu6.0101、prudu6.0201、prudu蓝豆蛋白、prup1、prup1.0101、prup2、prup2.0101、prup2.0201、prup2.0301、prup3、prup3.0101、prup3.0102、prup4、prup4.0101、prup4.0201、prusa3)、裸盖菇属种(psilocybespp)(psic1、psic1.0101、psic2、psic2.0101)、痒螨属种(psoroptesspp)(psoo1、psoo10、psoo10.0101、psoo11、psoo13、psoo14、psoo2、psoo21、psoo3、psoo5、psoo7)、美洲金猫属种(pumaspp)(pumc1)、石榴属种(punicaspp)(pung3)、梨属种(pyrusspp)(pyrc1、pyrc1.0101、pyrc3、pyrc3.0101、pyrc4、pyrc4.0101、pyrc5、pyrc5.0101、pyrpy2)、栎属种(quercusspp)(quea1、quea1.0101、quea1.0201、quea1.0301、quea1.0401、quea2、quea4)、海鲡属种(rachycentronspp)(racca1)、蛙属种(ranaspp)(rane1、rane1.010l、rane2、rane2.0101)、旭蟹属种(raninaspp)(ranra1)、驯鹿属种(rangiferspp)(rantblg)、家鼠属种(rattusspp)(ratn1、ratn1.0101、ratn酪蛋白、ratn明胶、ratnigg、ratn卵黄高磷蛋白、ratnrsa、ratn转铁蛋白)、根毛霉属种(rhizomucorspp)(rhimap)、根霉属种(rhizopusspp)(rhinv脂肪酶、rhio脂肪酶)、翼齿鲷属种(rhomboplitesspp)(rhoau1)、红酵母属种(rhodotorulaspp)(rhom1、rhom1.0101、rhom2、rhom2.0101)、蓖麻属种(ricinusspp)(ricc1、ricc1.0101、ricc2、ricc3、ricc8、riccrip)、溪鳉属种(rivulusspp)(rivma1)、刺槐属种(robiniaspp)(robp2、robp4、robp葡聚糖酶)、蔷薇属种(rosaspp)(rosr3)、王棕属种(roystoneaspp)(roye2)、悬钩子属种(rubusspp)(rubi1、rubi1.0101、rubi3、rubi3.0101、rubi几丁质酶、rubicyp)、酵母属种(saccharomycesspp)(sacc羧肽酶y、sacccyp、sacc烯醇酶、sacc葡糖苷酶、sacc转化酶、saccmnsod、saccp2、sacc抑制蛋白)、红点鲑属种(salvelinusspp)(salf1)、猪毛菜属种(salsolaspp)(salk1、salk1.0101、salk1.0201、salk1.0301、salk1.0302、salk2、salk2.0101、salk3、salk3.0101、salk4、salk4.0101、salk4.0201、salk5、salk5.0101)、红点鲑属种(salvelinusspp)(salle卵黄蛋白原)、斑鳟属种(salmospp)(sals1、sals1.0101、sals1.0201、sals2、sals2.0101、sals明胶)、接骨木属种(sambucusspp)(samn1)、梭吻鲈属种(sanderspp)(san1u1)、肥皂草属种(saponariaspp)(saporip)、拟沙丁属种(sardinopsspp)(sarm1)、瘤鸭属种(sarkidiornisspp)(sarml1)、沙丁鱼属种(sardinaspp)(sarp1)、疥螨属种(sarcoptesspp)(sars1、sars14、sars3、sarsgst、sarspm)、拟沙丁属种(sardinopsspp)(sarsa1、sarsa1.0101)、血吸虫属种(schistosomaspp)(schjgst、schjpm、schjsj22、schjsj67、schmasm20、schmasm21、schmasm22、schmasm31)、拟石首鱼属种(sciaenopsspp)(scioc1)、鲭鱼属种(scomberspp)(scoa1)、马鲛属种(scombermorusspp)(scoca1)、马鲛属种(scomberomorusspp)(scog1)、鲭属种(scomberspp)(scoj1、scoma1、scos1)、蜈蚣属种(scolopendraspp)(scoy7、scoy7.0101)、青蟹属种(scyllaspp)(scyo1、scyo1.0101、scyo2、scypa1、scypa2、scys1、scys1.0101、scys2)、平鲉属种(sebastesspp)(sebfa1、sebin1、sebm1、sebm1.0101、sebm1.0201)、黑麦属种(secalespp)(secc1、secc12、secc13、secc2、secc20、secc20.0101、secc20.0201、secc28、secc3、secc4、secc4.0101、secc4.0201、secc5、secc5.0101、seccaa_ti、seccaa_ti.0101)、黄菀属种(seneciospp)(senjmdh、senjpl)、乌贼属种(sepiaspp)(sepe1、sepe1.0101)、拟乌贼属种(sepioteuthisspp)(sepl1、sepl1.0101)、乌贼属种(sepiaspp)(sepm1)、属种(seriolaspp)(serd1、serla1)、霞虾属种(sergestesspp)(serlu1)、属种(seriolaspp)(serq1、serri1)、胡麻属种(sesamumspp)(sesi1、sesi1.0101、sesi2、sesi2.0101、sesi3、sesi3.0101、sesi4、sesi4.0101、sesi5、sesi5.0101、sesi6、sesi6.0101、sesi7、sesi7.0101、sesi8)、志贺氏菌属种(shigellaspp)(shibogst、shidygst)、蚋属种(simuliaspp)(simvi1、simvi2、simvi3、simvi4、simvi70kd)、欧白芥属种(sinapisspp)(sina1、sina1.0101、sina1.0104、sina1.0105、sina1.0106、sina1.0107、sina1.0108、sina2、sina2.0101、sina3、sina3.0101、sina4、sina4.0101)、缢蛏属种(sinonovaculaspp)(sinc1、sinc1.0101)、火蚁属种(solenopsisspp)(solg2、solg2.0101、solg3、solg3.0101、solg4、solg4.0101、solg4.0201、soli1、soli1.0101、soli2、soli2.0101、soli3、soli3.0101、soli4、soli4.0101)、管鞭虾属种(solenoceraspp)(solme1)、火蚁属种(solenopsisspp)(solr1、solr2、solr2.0101、solr3、solr3.0101、sols2、sols2.0101、sols3、sols3.0101、sols4)、鳎属种(soleaspp)(solso1、solsotpi)、茄属种(solanumspp)(solat1、solat1.0101、solat2、solat2.0101、solat3、solat3.0101、solat3.0102、solat4、solat4.0101、solat8、solat葡聚糖酶)、高粱属种(sorghumspp)(sorb1、sorh1、sorh1.0101、sorh12、sorh7)、鲷属种(sparusspp)(spaa1)、双髻鲨属种(sphyrnaspp)(sphti1)、螺旋藻属种(spirulinaspp)(spimxβ_藻蓝蛋白)、菠菜属种(spinaciaspp)(spio2、spiorubisco)、虾蛄属种(squillaspp)(squac1、squac1.0101、squo1、squo1.0101)、葡萄球菌属种(staphylococcusspp)(staafbp、staasea、staaseb、staasec、staased、staasee、staatsst)、葡萄穗霉属种(stachybotrysspp)(stac3、stac3.0101、stac纤维素酶、stac溶血素、stacschs34、stacstachyrasea)、匍柄霉属种(stemphyliumspp)(steb1、stec1、stev1)、小公鱼属种(stolephorusspp)(stoi1)、鸵鸟属种(struthiospp)(strc1、strc2、strc3)、链球菌属种(streptococcusspp)(strdy链激酶)、链霉菌属种(streptomycesspp)(strg链霉蛋白酶)、链球菌属种(streptococcusspp)(strpnpspc)、球海胆属种(strongylocentrotusspp)(strpu18kd、strpu卵黄蛋白原)、链球菌属种(streptococcusspp)(strpyspea、strpyspec、strpy链激酶)、类圆线虫属种(strongyloidesspp)(strst45kd)、链霉菌属种(streptomycesspp)(strvpat)、柄海鞘属种(styelaspp)(styp1)、皱皮螨属种(suidasiaspp)(suim1、suim13、suim2、suim3、suim5、suim5.01、suim5.02、suim5.03、suim6、suim7、suim8、suim9)、猪属种(susspp)(sussacth、sussala、suss淀粉酶、sussblg、suss酪蛋白、suss酪蛋白αs1、suss酪蛋白αs2、suss酪蛋白β、suss酪蛋白κ、suss明胶、susshg、suss胰岛素、suss脂肪酶、suss胃蛋白酶、suss卵黄高磷蛋白、sussprvb、susspsa、susstctp)、syntelopodeumaspp(syny7、syny7.0101)、丁香属种(syringaspp)(syrv1、syrv1.0101、syrv1.0102、syrv1.0103、syrv2、syrv3、syrv3.0101)、虻属种(tabanusspp)(taby1、taby1.0101、taby2、taby2.0101、taby5、taby5.0101)、麻鸭属种(tadornaspp)(tadra1)、篮状菌属种(talaromycesspp)(talst22、talst3、talst8)、蒲公英属种(taraxacumspp)(taro18kd)、落羽松属种(taxodiumspp)(taxd2)、隅蛛属种(tegenariaspp)(tegd血蓝蛋白)、背带属种(teladorsagiaspp)(telci3)、异舟蛾属种(thaumetopoeaspp)(thap1、thap1.0101、thap2、thap2.0101)、狭鳕属种(theragraspp)(thec1)、嗜热真菌属种(thermomycesspp)(thel脂肪酶、thesp脂肪酶、thesp木聚糖酶)、金枪鱼属种(thunnusspp)(thua1、thua1.0101、thua胶原蛋白、thual1、thuat1、thuo1、thuo胶原蛋白)、崖柏属种(thujaspp)(thuoc3、thup1)、金枪鱼属种(thunnusspp)(thut1、thuto1)、杖蛇鲭属种(thyrsitesspp)(thyat1)、thyrophygusspp(thyy7、thyy7.0101)、北鱿属种(todarodesspp)(todp1、todp1.010l、todp1.0102)、桔蚜属种(toxopteraspp)(toxc7、toxc7.0101)、弓首属种(toxocaraspp)(toxcatesl20、toxcates26、toxcates30)、弓形虫属种(toxoplasmaspp)(toxghsp70)、鹰爪虾属种(trachypenaeusspp)(trac1)、鲳鲹属种(trachinotusspp)(traca1)、竹鱼属种(trachurusspp)(traj1、traj明胶、tratr明胶)、小麦属种(triticumspp)(tria1、tria10kd、tria12、tria12.0101、tria12.0102、tria12.0103、tria12.0104、tria13、tria14、tria14.0101、tria14.0201、tria15、tria15.0101、tria18、tria18.0101、tria19、tria19.0101、tria2、tria21、tria21.0101、tria23kd、tria25、tria25.0101、tria26、tria26.0101、tria27、tria27.0101、tria28、tria28.0101、tria29、tria29.0101、tria29.0201、tria3、tria30、tria30.0101、tria31、tria31.0101、tria32、tria32.0101、tria33、tria33.0101、tria34、tria34.0101、tria35、tria35.0101、tria36、tria36.0101、tria37、tria37.0101、tria4、tria4.0101、tria4.0201、tria5、tria7、triaaa_si、triaα_麦醇溶蛋白、triaba、triabd36k、triaβ_麦醇溶蛋白、tria几丁质酶、triacm16、triadh、tria内切几丁质酶、triaγ_麦醇溶蛋白、tria萌发素、tria麦醇溶蛋白、triagst、trialmwglu、trialmw-gsb16、trialmw-gsp42、trialmw-gsp73、trialtp2、triaω2_麦醇溶蛋白、tria过氧化物酶、tria过氧化物酶1、triaspi、triatlp、tria麦芽凝集素、triaxi)、麦轴梗霉属种(tritirachiumspp)(trial蛋白酶k)、拟谷盗属种(triboliumspp)(trica17、trica17.0101、trica7、trica7.0101)、毛圆线虫属种(trichostrongylusspp)(trico3、trico3.0101)、毛癣菌属种(trichophytonspp)(trieq4)、胡芦巴属种(trigonellaspp)(trifg1、trifg2、trifg3、trifg4)、栝楼属种(trichosanthesspp)(trikrip)、带鱼属种(trichiurusspp)(trile1)、小麦属种(triticumspp)(trim过氧化物酶)、毛癣菌属种(trichophytonspp)(trime2、trime4)、三毛草属种(trisetumspp)(trip1、trip5)、毛形属种(trichinellaspp)(trips3、trips3.0101)、毛癣菌属种(trichophytonspp)(trir2、trir2.0101、trir4、trir4.0101)、木霉属种(trichodermaspp)(trirs纤维素酶)、小麦属种(triticumspp)(tris14)、毛癣菌属种(trichophytonspp)(trisc2、trisc4、triso2)、毛形属种(trichinellaspp)(trisp3、trisp3.0101、trisp3.0102、trisp3.0103、trisp3.0104、trisp3.0105、trisp3.0106)、毛癣菌属种(trichophytonspp)(trit1、trit1.0101、trit4、trit4.0101)、小麦属种(triticumspp)(tritd14、tritdaa_ti)、木霉属种(trichodermaspp)(triv纤维素酶)、毛癣菌属种(trichophytonspp)(trive4)、锥猎蝽属种(triatomaspp)(triap1、triap1.0101)、白梧桐属种(triplochitonspp)(trips1)、蝾螺属种(turbospp)(turc1、turcpm)、食酪螨属种(tyrophagusspp)(tyrp1、tyrp10、tyrp10.0101、tyrp10.0102、tyrp13、tyrp13.0101、tyrp2、tyrp2.0101、tyrp24、tyrp24.0101、tyrp3、tyrp3.0101、tyrp4、tyrp5、tyrp5.01、tyrp5.02、tyrp5.03、tyrp7、tyrpα微管蛋白)、细基格孢属种(ulocladiumspp)(uloa1、uloat1、ulob1、uloc1、uloco1、ulocu1、ulomu1、uloob1、ulose1、ulosu1、ulotu1)、雪豹属种(unciaspp)(uncu1)、长鳍鳕属种(urophycisspp)(urote1)、越桔属种(vacciniumspp)(vacm3)、瓦螨属种(varroaspp)(varj13kd)、蛤仔属种(venerupisspp)(venph1、venph1.0101)、黄胡蜂属种(vespulaspp)(vesf1、vesf2、vesf5、vesf5.0101、vesg1、vesg2、vesg5、vesg5.0101、vesm1、vesm1.0101、vesm2、vesm2.0101、vesm5、vesm5.0101、vesmmlt、vesp1、vesp2、vesp5、vesp5.0101、vess1、vess1.0101、vess2、vess5、vess5.0101、vesv1、vesv1.0101、vesv2、vesv2.0101、vesv2.0201、vesv3、vesv3.0101、vesv5、vesv5.0101、vesv5-pola5、vesvi5、vesvi5.0101)、虎头蜂属种(vespaspp)(vespc1、vespc1.0101、vespc2、vespc5、vespc5.0101、vespc5.0102、vespm1、vespm1.0101、vespm5、vespm5.0101、vespma1、vespma2、vespma5、vespmamlt、vespvmlt)、豇豆属种(vignaspp)(vigr1、vigr1.0101、vigr17kd、vigr5、vigr8s球蛋白、vigr白蛋白、vigrβ-伴大豆球蛋白)、葡萄属种(vitisspp)(vitv1、vitv1.0101、vitv4、vitv5、vitv葡聚糖酶、vitvtlp)、旗鱼属种(xiphiasspp)(xipg1、xipg1.0101、xipg25kd)、玉蜀黍属种(zeaspp)(zeam1、zeam1.0101、zeam11、zeam12、zeam12.0101、zeam12.0102、zeam12.0103、zeam12.0104、zeam12.0105、zeam13、zeam14、zeam14.0101、zeam14.0102、zeam2、zeam20s、zeam22、zeam25、zeam25.0101、zeam27kdzein、zeam3、zeam4、zeam5、zeam50kdzein、zeam7、zeam几丁质酶、zeamg1、zeamg2、zeampao、zeamzm13)、海鲂属种(zeusspp)(zeufa1)、枣属种(ziziphusspp)(zizm1、zizm1.0101)、绵鳚属种(zoarcesspp)(zoaaispiii)、霸王属种(zygophyllumspp)(zygf2)。在此上下文中,括号中的术语表示来自特定来源的特别优选的过敏性抗原(过敏原)。最优选地,过敏性抗原优选地衍生自一定的来源,例如植物(例如草或树)、天然产物(例如牛奶、坚果等)、真菌来源(例如曲霉菌属)或细菌来源,或衍生自动物来源或动物毒物(例如猫、狗、蜜蜂毒液等),优选地选自由以下组成的列表;草的花粉(例如黑麦的花粉)、树的花粉(例如榛树、桦树、桤木、白蜡树的花粉)、花的花粉、草本植物的花粉(例如艾蒿的花粉)、尘螨(例如derf1、derp1、eurm1、derm1derf2、derp2、eurm2、tyrp2、lepd2)、霉菌(例如枝顶孢属(acremonium)、曲霉菌属、芽枝霉属(cladosporium)、镰刀菌属(fusarium)、毛霉菌属(mucor)、青霉菌属(penicillium)、根霉菌属(rhizopus)、葡萄穗霉属(stachybotrys)、木霉菌(trichoderma)或链格孢属(alternaria)的过敏原)、动物(例如猫的feld1、feld2、feld3或feld4)、食物(例如鱼(例如鲈鱼、鳕鱼、比目鱼)、海鲜(例如螃蟹、龙虾、虾)、鸡蛋、小麦、坚果(例如花生、杏仁、腰果、核桃)、大豆、牛奶等的过敏原)或昆虫毒液(例如来自胡蜂、蜜蜂、大黄蜂、蚂蚁、蚊子或扁虱的毒液的过敏原)。自身免疫性自身抗原:自身免疫性自身抗原(即与自身免疫性疾病或自体抗原相关的抗原)可能与影响至少一种或多种下列器官系统的自身免疫性疾病相关:循环系统、消化系统、内分泌系统、排泄系统、免疫系统、皮被系统、肌肉系统、神经系统、生殖系统、呼吸系统、骨骼系统,优选心血管系统、神经内分泌系统、肌肉骨骼系统或胃肠系统。其中,循环系统是使得能够通过心脏、血液和血管泵送和引导血液进出身体和肺部的器官系统。消化系统使得能够通过唾液腺、食道、胃、肝、胆囊、胰腺、肠、结肠、直肠和肛门来消化和加工食物。内分泌系统利用由内分泌腺诸如下丘脑、脑垂体或脑垂腺、松果体或松果腺、甲状腺、甲状旁腺和肾上腺制造的激素使得能够在体内进行交流。排泄系统包括肾、输尿管、膀胱和尿道,并参与液体平衡、电解质平衡和尿液排泄。免疫系统包括涉及组织与血流之间的淋巴转移的结构、淋巴和淋巴结以及可能负责免疫系统的细胞和体液组分转运的血管。它负责防御致病因子,并包括白细胞、扁桃体、腺样体、胸腺和脾等。皮被系统包括皮肤、毛发和指甲。肌肉系统使肌肉能够与包括骨骼、软骨、韧带和肌腱并提供结构支撑的骨骼系统一起运动。神经系统负责收集、转移和处理信息,并包括脑、脊髓和神经。生殖系统包括性器官,例如卵巢、输卵管、子宫、阴道、乳腺、睾丸、输精管、精囊、前列腺和阴茎。呼吸系统包括用于呼吸的器官、咽、喉、气管、支气管、肺和隔膜,并与循环系统一起起作用。自身免疫性自身抗原(与自身免疫性疾病相关的抗原或自体抗原)选自与从以下疾病中选择的自身免疫性疾病相关的自体抗原:艾迪生病(自身免疫性肾上腺炎、morbusaddison)、斑秃、艾迪生贫血症(morbusbiermer)、自身免疫性溶血性贫血(aiha)、冷型自身免疫性溶血性贫血(aiha)(冷血凝素病、冷自身免疫性溶血性贫血(aiha)(冷凝集素病)、(chad))、热型自身免疫性溶血性贫血(aiha)(热aiha、热自身免疫性溶血性贫血(aiha))、自身免疫性溶血性多-兰贫血(autoimmunehemolyticdonath-landsteineranemia)(阵发性冷血红蛋白尿)、抗磷脂综合征(aps)、动脉粥样硬化、自身免疫性关节炎、颞动脉炎、大动脉炎(takayasuarteriitis)(高安氏病、主动脉弓病)、颞动脉炎/巨细胞动脉炎、自身免疫性慢性胃炎、自身免疫性不孕症、自身免疫性内耳疾病(aied)、巴塞多氏病(morbusbasedow)、bechterew病(morbusbechterew、僵直性脊椎炎、强直性脊柱炎)、白塞综合征(morbusbehcet)、肠道疾病(包括自身免疫性炎性肠病(包括溃疡性结肠炎(morbuscrohn、克罗恩病))、心肌病(特别是自身免疫性心肌病、特发性扩张型心肌病(dcm))、口炎性腹泻皮炎(谷蛋白介导的肠病)、慢性疲劳免疫功能障碍综合征(cfids)、慢性炎症性脱髓鞘性多发性神经病(cidp)、慢性多发性关节炎、查格-施特劳斯综合征(churg-strausssyndrome)、瘢痕性类天疱疮、科干综合征(cogansyndrome)、肢端硬皮综合征(crestsyndrome)(皮肤钙化综合征(syndromwithcalcinosiscutis)、雷诺现象、食道运动障碍、sklerodaktylia和teleangiectasia)、克罗恩病(morbuscrohn、溃疡性结肠炎)、疱疹样皮炎、皮肤自身免疫性疾病、皮肌炎、糖尿病、1型糖尿病(i型糖尿病、胰岛素依赖型糖尿病)、2型糖尿病(ii型糖尿病)、原发性混合型冷球蛋白血症(essentialmixedcryoglobulinemia)、原发性混合型冷球蛋白血症、纤维肌痛、纤维肌炎、古德帕斯丘综合征(goodpasturesyndrome)(抗gbm介导的肾小球肾炎)、移植物抗宿主病、格林-巴利综合征(guillain-barrésyndrome)(gbm、polyradikuloneuritis)、血液自身免疫性疾病、桥本甲状腺炎、血友病、获得性血友病、肝炎、自身免疫性肝炎(特别是慢性肝炎的自身免疫形式)、特发性肺纤维化(ipf)、特发性血小板减少性紫癜、免疫性血小板减少性紫癜(morbuswerlhof、itp)、iga肾病、不孕症、自身免疫性不孕症、青少年类风湿性关节炎(morbusstill、斯蒂尔综合征)、兰伯特-伊顿综合征(lambert-eatonsyndrome)、扁平苔癣、硬化性苔藓、红斑狼疮、系统性红斑狼疮(sle)、红斑狼疮(盘状)、莱姆关节炎(莱姆病、疏螺旋体关节炎)、梅尼埃病(morbusménierè);混合性结缔组织病(mctd)、多发性硬化症(ms、弥散性脑脊髓炎、夏科氏病(charcot’sdisease))、重症肌无力(肌无力、mg)、肌炎(myosits)、多发性肌炎、神经自身免疫性疾病、神经性皮炎、寻常型天疱疮、大疱性类天疱疮、瘢痕形成类天疱疮;结节性多动脉炎(结节性动脉周围炎)、多软骨炎(全软骨炎)、多腺体(自身免疫性)综合征(pga综合征、施密特氏综合征(schmidt’ssyndrome))、风湿性多肌痛、原发性无丙种球蛋白血症、原发性胆汁性肝硬化pbc、原发性自身免疫性胆管炎)、进行性系统性硬化症(pss)、银屑病、寻常型银屑病、雷诺现象、赖特综合征(reiter’ssyndrome)(morbusreiter、尿道结合滑膜综合征))、类风湿性关节炎(ra、慢性多关节炎、关节风湿病、风湿热)、肉状瘤病(morbusboeck、贝-伯-肖三氏病(besnier-boeck-schaumanndisease))、僵人综合征、硬皮病(sclerodermia)、硬皮症(scleroderma)、干燥综合征(syndrome)、交感性眼炎;短暂性谷蛋白耐受不良、移植器官排斥、葡萄膜炎、自身免疫性葡萄膜炎、血管炎、白癜风(白斑病、花斑皮肤(pieboldskin))和韦格纳病(morbuswegner、韦格纳肉芽肿)。作为自身免疫性自身抗原的这些和其他蛋白被认为是治疗性的,因为它们意在通过用自身抗原接种来治疗受试者,特别是哺乳动物,更特别是人类,该自身抗原由哺乳动物(例如人)自身表达并触发不会在健康受试者中产生的不期望的免疫应答。因此,此类作为自身抗原的蛋白典型地是哺乳动物、特别是人类来源的。在此上下文中特别优选的是选自以下的自身免疫性自身抗原(自体抗原):-髓鞘碱性蛋白(mbp)、蛋白脂质蛋白(plp)和髓鞘少突胶质细胞糖蛋白(mog),在每种情况下与多发性硬化症(ms)相关;-cd44、前胰岛素原、胰岛素原、胰岛素、谷氨酸脱羧酶(gad65)、酪氨酸磷酸酶样胰岛素瘤抗原2(ia2)、锌转运蛋白(znt8)和热休克蛋白60(hsp60),在每种情况下与i型糖尿病相关;-与自身免疫性葡萄膜炎相关的光感受器间维生素a类结合蛋白(irbp);-乙酰胆碱受体achr和胰岛素样生长因子-1受体(igf-1r),在每种情况下与重症肌无力相关;-来自β-溶血性链球菌的与风湿热相关的m蛋白(假自体抗原);-与关节炎相关的巨噬细胞游走抑制因子;-ro/larnp复合物、α-和β-胞衬蛋白、胰岛细胞自体抗原、聚(adp)核糖聚合酶(parp)、numa、nor-90、ro60自体抗原和p27抗原,在每种情况下与干燥综合征相关;-ro60自体抗原、低密度脂蛋白、u-1小核核糖核蛋白复合物的sm抗原(b/b′、d1、d2、d3、e、f、g)和rnp核糖核蛋白,在每种情况下与红斑狼疮相关;-oxldl、β(2)gpi、hsp60/65和oxldl/β(2)gpi,在每种情况下与动脉粥样硬化相关;-与特发性扩张型心肌病(dcm)相关的心脏β(1)-肾上腺素能受体;-与肌炎相关的组氨酰-trna合成酶(hisrs);-与硬皮病相关的拓扑异构酶i。此外,在其他实施例中,所述自身免疫性自身抗原与相应的自身免疫性疾病相关,例如il-17、热休克蛋白和/或由参与所述自身免疫性疾病(例如本文所述的任何自身免疫性疾病)中的自身免疫应答的免疫细胞表达的任何独特型致病性t细胞或趋化因子受体。优选地,根据本发明的含有mrna序列的mrna化合物的至少一个编码区包含至少两个、三个、四个、五个、六个、七个、八个或更多个与序列表中(或分别在pct/ep2016/075843的表1-5或图20-24中)披露的核酸序列中的任一种、或所述核酸序列中任一种的片段或变体相同或具有至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%、优选至少70%、更优选至少80%、甚至更优选至少85%、甚至更优选至少90%且最优选至少95%或甚至97%的序列同一性的核酸序列。优选地,包含至少一个如本文所定义的编码区的mrna序列典型地包含约50个至约20000个、或100个至约20000个、优选地约250个至约20000个核苷酸、更优选地约500个至约10000个、甚至更优选地约500个至约5000个核苷酸的长度。根据进一步的实施例,根据本发明的mrna序列是如本文所定义的人工mrna序列。根据进一步的实施例,根据本发明的含有mrna序列的mrna化合物是修饰的mrna序列,优选如本文所述的修饰的mrna序列。在此上下文中,如本文所定义的修饰优选地导致根据本发明的mrna序列的稳定化。更优选地,本发明因此提供稳定的mrna序列,该mrna序列包含至少一个如本文所定义的编码区。根据一个实施例,本发明的含有mrna序列的mrna化合物因此可以作为“稳定化的mrna序列”提供,也就是说,作为基本上耐体内降解(例如,被核酸外切酶或核酸内切酶降解)的mrna提供。这种稳定化可以例如通过本发明的mrna的经修饰的磷酸骨架实现。与本发明有关的骨架修饰是这样一种修饰,其中mrna中所含的核苷酸骨架的磷酸被化学修饰。在这方面可以优选使用的核苷酸包含例如硫代磷酸酯修饰的磷酸骨架,优选地磷酸骨架中所含的至少一个磷酸氧被硫原子取代。稳定化的mrna可以进一步包括例如非离子磷酸酯类似物,例如烷基和芳基膦酸酯,其中带电荷的膦酸氧被烷基或芳基取代;或磷酸二酯和烷基磷酸三酯,其中带电荷的氧残基以烷基化形式存在。这种骨架修饰典型地包括(但不意味着任何限制)来自由甲基膦酸酯、氨基磷酸酯和硫代磷酸酯(例如胞苷-5′-o-(1-硫代磷酸酯))组成的组的修饰。在下文中,描述了具体的修饰,这些修饰优选地能够“稳定”如本文所定义的mrna。化学修饰:如本文所用的术语“mrna修饰”可以指包括骨架修饰以及糖修饰或碱基修饰的化学修饰。在此上下文中,如本文所定义的经修饰的mrna(序列)可以包含核苷酸类似物/修饰,例如,骨架修饰、糖修饰或碱基修饰。与本发明有关的骨架修饰是这样一种修饰,其中含有如本文所定义的mrna序列的mrna化合物中所含的核苷酸骨架的磷酸被化学修饰。与本发明有关的糖修饰是含有如本文所定义的mrna序列的mrna化合物的核苷酸的糖的化学修饰。此外,与本发明有关的碱基修饰是含有mrna序列的mrna化合物的核苷酸的碱基部分的化学修饰。在此上下文中,核苷酸类似物或修饰优选地选自适用于转录和/或翻译的核苷酸类似物。糖修饰:可以在糖部分中修饰经修饰的核苷和核苷酸,这些核苷和核苷酸可以掺入含有如本文所述的mrna序列的经修饰的mrna化合物中。例如,2′羟基(oh)可以被许多不同的“氧基”或“脱氧”取代基修饰或取代。“氧基”-2′-羟基修饰的实例包括但不限于烷氧基或芳氧基(-or,例如r=h、烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(peg)、-o(ch2ch2o)nch2ch2or;“锁”核酸(lna),其中2′羟基例如通过亚甲基桥连接到相同核糖的4′碳上;氨基(-o-氨基,其中氨基例如nrr可以是烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺、聚氨基)或氨基烷氧基。“脱氧”修饰包括氢、氨基(例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基、二杂芳基氨基或氨基酸);或者氨基可以通过接头与糖附连,其中该接头包含原子c、n和o中的一者或多者。糖基团还可以包含一个或多个具有与核糖中的相应碳相反的立体化学构型的碳。因此,经修饰的mrna可以包括含有例如阿拉伯糖作为糖的核苷酸。骨架修饰:可以在经修饰的核苷和核苷酸中进一步修饰磷酸骨架,这些核苷和核苷酸可以掺入到含有如本文所述的mrna序列的经修饰的mrna化合物中。骨架的磷酸基团可以通过用不同的取代基取代一个或多个氧原子而修饰。此外,经修饰的核苷和核苷酸可包括用如本文所述的经修饰的磷酸完全取代未修饰的磷酸部分。经修饰的磷酸基团的实例包括但不限于硫代磷酸、磷酸硒酸、硼烷磷酸、硼烷磷酸酯、氢膦酸、氨基磷酸、烷基或芳基膦酸和磷酸三酯。二硫代磷酸的两个非连接氧被硫取代。磷酸接头也可以通过用氮(桥连的氨基磷酸)、硫(桥连的硫代磷酸)和碳(桥连的亚甲基-膦酸)取代连接氧而修饰。碱基修饰:可以掺入包含如本文所述的mrna序列的经修饰的mrna化合物中的经修饰的核苷和核苷酸可以在核碱基部分中被进一步修饰。在mrna中发现的核碱基的实例包括但不限于腺嘌呤、鸟嘌呤、胞嘧啶和尿嘧啶。例如,本文所述的核苷和核苷酸可在大沟面上进行化学修饰。在一些实施例中,大沟化学修饰可包括氨基、硫醇基团、烷基或卤素基团。在本发明的特别优选的实施例中,核苷酸类似物/修饰选自碱基修饰,这些碱基修饰优选地选自2-氨基-6-氯嘌呤核苷-5′-三磷酸、2-氨基嘌呤-核苷-5′-三磷酸;2-氨基腺苷-5’-三磷酸、2’-氨基-2’-脱氧胞苷-三磷酸、2-硫代胞苷-5’-三磷酸、2-硫代尿苷-5’-三磷酸、2’-氟胸苷-5’-三磷酸、2’-o-甲基-肌苷-5’-三磷酸、4-硫代尿苷-5’-三磷酸、5-氨基烯丙基胞苷-5’-三磷酸、5-氨基烯丙基尿苷-5’-三磷酸、5-溴胞苷-5’-三磷酸、5-溴尿苷-5’-三磷酸、5-溴-2’-脱氧胞苷-5’-三磷酸、5-溴-2’-脱氧尿苷-5’-三磷酸、5-碘胞苷-5’-三磷酸、5-碘-2’-脱氧胞苷-5’-三磷酸、5-碘尿苷-5’-三磷酸、5-碘-2’-脱氧尿苷-5’-三磷酸、5-甲基胞苷-5’-三磷酸、5-甲基尿苷-5’-三磷酸、5-丙炔基-2’-脱氧胞苷-5’-三磷酸、5-丙炔基-2’-脱氧尿苷-5’-三磷酸、6-氮杂胞苷-5’-三磷酸、6-氮杂尿苷-5’-三磷酸、6-氯嘌呤核苷-5’-三磷酸、7-脱氮腺苷-5’-三磷酸、7-脱氮尿苷-5’-三磷酸、8-氮杂腺苷-5’-三磷酸、8-叠氮腺苷-5’-三磷酸、苯并咪唑-核苷-5’-三磷酸、n1-甲基腺苷-5’-三磷酸、n1-甲基鸟苷-5’-三磷酸、n6-甲基腺苷-5’-三磷酸、o6-甲基鸟苷-5’-三磷酸、假尿苷-5’-三磷酸、或嘌呤霉素-5’-三磷酸、黄苷-5’-三磷酸。核苷酸的特别优选的碱基修饰选自由以下组成的碱基修饰核苷酸组:5-甲基胞苷-5′-三磷酸、7-脱氮鸟苷-5′-三磷酸、5-溴胞苷-5′-三磷酸、和假尿苷-5′-三磷酸。在一些实施例中,修饰的核苷包括吡啶-4-酮核糖核苷、5-氮杂-尿苷、2-硫代-5-氮杂-尿苷、2-硫代尿苷、4-硫代-假尿苷、2-硫代-假尿苷、5-羟基尿苷、3-甲基尿苷、5-羧甲基-尿苷、1-羧基甲基-假尿苷、5-丙炔基-尿苷、1-丙炔基-假尿苷、5-牛磺酰甲基尿苷、1-牛磺酰甲基-假尿苷、5-牛磺酰甲基-2-硫代尿苷、1-牛磺酰甲基-4-硫代尿苷、5-甲基-尿苷、1-甲基-假尿苷、4-硫代-1-甲基-假尿苷、2-硫代-1-甲基-假尿苷、1-甲基-1-脱氮-假尿苷、2-硫代-1-甲基-1-脱氮-假尿苷、二氢尿苷、二氢假尿苷、2-硫代二氢尿苷、2-硫代二氢假尿苷、2-甲氧基尿苷、2-甲氧基-4-硫代尿苷、4-甲氧基-假尿苷、和4-甲氧基-2-硫代-假尿苷。在一些实施例中,经修饰的核苷包括5-氮杂-胞苷、假异胞苷、3-甲基-胞苷、n4-乙酰基胞苷、5-甲酰基胞苷、n4-甲基胞苷、5-羟甲基胞苷、1-甲基-假异胞苷、吡咯并胞苷、吡咯并假异胞苷、2-硫代-胞苷、2-硫代-5-甲基-胞苷、4-硫代-假异胞苷、4-硫代-1-甲基-假异胞苷、4-硫代-1-甲基-1-脱氮-假异胞苷、1-甲基-1-脱氮-假异胞苷、折布拉林(zebularine)、5-氮杂-折布拉林、5-甲基-折布拉林、5-氮杂-2-硫代-折布拉林、2-硫代-折布拉林、2-甲氧基-胞苷、2-甲氧基-5-甲基-胞苷、4-甲氧基-假异胞苷、和4-甲氧基-1-甲基-假异胞苷。在其他实施例中,经修饰的核苷包括2-氨基嘌呤、2,6-二氨基嘌呤、7-脱氮-腺嘌呤、7-脱氮-8-氮杂-腺嘌呤、7-脱氮-2-氨基嘌呤、7-脱氮-8-氮杂-2-氨基嘌呤、7-脱氮-2,6-二氨基嘌呤、7-脱氮-8-氮杂-2,6-二氨基嘌呤、1-甲基腺苷、n6-甲基腺苷、n6-异戊烯基腺苷、n6-(顺式-羟基异戊烯基)腺苷、2-甲硫基-n6-(顺式-羟基异戊烯基)腺苷、n6-甘氨酰氨基甲酰基腺苷、n6-苏氨酰氨基甲酰基腺苷、2-甲硫基-n6-苏氨酰氨基甲酰基腺苷、n6,n6-二甲基腺苷、7-甲基腺嘌呤、2-甲硫基-腺嘌呤、和2-甲氧基-腺嘌呤。在其他实施例中,经修饰的核苷包括肌苷、1-甲基-肌苷、怀俄苷、怀丁苷、7-脱氮-鸟苷、7-脱氮-8-氮杂-尿苷、6-硫代-尿苷、6-硫代-7-脱氮-尿苷、6-硫代-7-脱氮-8-氮杂-尿苷、7-甲基-尿苷、6-硫代-7-甲基-尿苷、7-甲基肌苷、6-甲氧基-尿苷、1-甲基尿苷、n2-甲基尿苷、n2,n2-二甲基鸟苷、8-氧代-鸟苷、7-甲基-8-氧代-鸟苷、1-甲基-6-硫代-鸟苷、n2-甲基-6-硫代-鸟苷、和n2,n2-二甲基-6-硫代-鸟苷。在一些实施例中,核苷酸可以在大沟面上进行修饰,并且可以包括用甲基或卤素基团取代尿嘧啶的c-5上的氢。在具体的实施例中,经修饰的核苷是5′-o-(1-硫代磷酸)-腺苷、5′-o-(1-硫代磷酸)-胞苷、5′-o-(1-硫代磷酸)-鸟苷、5′-o-(1-硫代磷酸)-尿苷或5′-o-(1-硫代磷酸)-假尿苷。在进一步的具体实施例中,经修饰的mrna可包含选自以下的核苷修饰:6-氮杂-胞苷、2-硫代-胞苷、α-硫代-胞苷、假异胞苷、5-氨基烯丙基-尿苷、5-碘-尿苷、n1-甲基-假尿苷、5,6-二氢尿苷、α-硫代-尿苷、4-硫代-尿苷、6-氮杂-尿苷、5-羟基-尿苷、脱氧-胸苷、5-甲基-尿苷、吡咯并胞苷、肌苷、α-硫代鸟苷、6-甲基鸟苷、5-甲基-胞苷、8-氧代-鸟苷、7-脱氮-鸟苷、n1-甲基-腺苷、2-氨基-6-氯-嘌呤、n6-甲基-2-氨基-嘌呤、假异胞苷、6-氯-嘌呤、n6-甲基-腺苷、α-硫代-腺苷、8-叠氮基-腺苷、7-脱氮-腺苷。在本发明的非常具体的实施例中,mrna化合物不包含如上所述的碱基修饰。脂质修饰:根据进一步的实施例,包含如本文所定义的mrna序列的经修饰的mrna化合物可以包含脂质修饰。这种脂质修饰的mrna典型地包含如本文所定义的mrna。如本文所定义的这种脂质修饰的mrna典型地还包含与该mrna共价连接的至少一个接头以及与相应接头共价连接的至少一种脂质。替代性地,脂质修饰的mrna包含如本文所定义的至少一种mrna以及与该mrna共价连接(没有接头)的至少一种(双功能)脂质。根据第三种替代方案,脂质修饰的mrna包含如本文所定义的mrna分子、与该mrna共价连接的至少一个接头、以及与相应接头共价连接的至少一种脂质、以及还有与该mrna共价连接(没有接头)的至少一种(双功能)脂质。在此上下文中,特别优选的是,脂质修饰存在于线性mrna序列的末端。序列修饰:g/c含量修饰:根据另一个实施例,含有mrna的脂质纳米颗粒包含mrna化合物,该mrna化合物包含mrna序列,该mrna序列可以通过修饰mrna序列的鸟苷/胞嘧啶(g/c)含量来修饰并因此稳定,优选地该mrna化合物的至少一个编码区包含本发明的mrna序列。在本发明的特别优选的实施例中,本发明的包含mrna序列的mrna化合物的编码区的g/c含量与相应野生型mrna(即未修饰的mrna)的编码区的g/c含量相比被修饰,特别是增加。由该mrna编码的氨基酸序列与由相应野生型mrna编码的氨基酸序列相比优选地不被修饰。本发明的mrna序列的这种修饰基于以下事实:待翻译的任何mrna区的序列对于该mrna的有效翻译是重要的。因此,mrna的组成和各种核苷酸的序列是重要的。特别地,具有增加的g(鸟苷)/c(胞嘧啶)含量的序列比具有增加的a(腺苷)/u(尿嘧啶)含量的序列更稳定。因此,根据本发明,mrna的密码子与相应野生型mrna相比发生变化,同时保留翻译的氨基酸序列,使得它们包含增加量的g/c核苷酸。关于多个密码子编码同一个氨基酸(所谓的遗传密码简并性)的事实,可以确定对稳定性最有利的密码子(所谓的替代密码子使用)。取决于将由mrna编码的氨基酸,与野生型序列相比,存在修饰mrna序列的各种可能性。就由仅含g或c核苷酸的密码子编码的氨基酸而言,不需要修饰密码子。因此,pro(ccc或ccg)、arg(cgc或cgg)、ala(gcc或gcg)和gly(ggc或ggg)的密码子不需要修饰,因为不存在a或u。相反,含有a和/或u核苷酸的密码子可以通过编码相同氨基酸但不含a和/或u的其他密码子的置换而修饰。它们的实例是:pro的密码子可以从ccu或cca修饰为ccc或ccg;arg的密码子可以从cgu或cga或aga或agg修饰为cgc或cgg;ala的密码子可以从gcu或gca修饰为gcc或gcg;gly的密码子可以从ggu或gga修饰为ggc或ggg。在其他情况下,尽管不能从密码子中除去a或u核苷酸,但是可以通过使用含有较低含量的a和/或u核苷酸的密码子来降低a和u含量。它们的实例是:phe的密码子可以从uuu修饰为uuc;leu的密码子可以从uua、uug、cuu或cua修饰为cuc或cug;ser的密码子可以从ucu或uca或agu修饰为ucc、ucg或agc;tyr的密码子可以从uau修饰为uac;cys的密码子可以从ugu修饰为ugc;his的密码子可以从cau修饰为cac;gln的密码子可以从caa修饰为cag;ile的密码子可以从auu或aua修饰为auc;thr的密码子可以从acu或aca修饰为acc或acg;asn的密码子可以从aau修饰为aac;lys的密码子可以从aaa修饰为aag;val的密码子可以从guu或gua修饰为guc或gug;asp的密码子可以从gau修饰为gac;glu的密码子可以从gaa修饰为gag;终止密码子uaa可以修饰为uag或uga。另一方面,就met(aug)和trp(ugg)的密码子而言,不存在序列修饰的可能性。上面列出的置换可以单独使用或以所有可能的组合使用,以与特定的野生型mrna(即原始序列)相比增加本发明的mrna序列的g/c含量。因此,例如,野生型序列中出现的thr的所有密码子可以修饰为acc(或acg)。然而,优选地,例如,使用上述置换可能性的组合:将编码原始序列(野生型mrna)中的thr的所有密码子置换为acc(或acg)以及将最初编码ser的所有密码子置换为ucc(或ucg或agc);将编码原始序列中的ile的所有密码子置换为auc以及将最初编码lys的所有密码子置换为aag以及将最初编码tyr的所有密码子置换为uac;将编码原始序列中的val的所有密码子置换为guc(或gug)以及将最初编码glu的所有密码子置换为gag以及将最初编码ala的所有密码子置换为gcc(或gcg)以及将最初编码arg的所有密码子置换为cgc(或cgg);将编码原始序列中的val的所有密码子置换为guc(或gug)以及将最初编码glu的所有密码子置换为gag以及将最初编码ala的所有密码子置换为gcc(或gcg)以及将最初编码gly的所有密码子置换为ggc(或ggg)以及将最初编码asn的所有密码子置换为aac;将编码原始序列中的val的所有密码子置换为guc(或gug)以及将最初编码phe的所有密码子置换为uuc以及将最初编码cys的所有密码子置换为ugc以及将最初编码leu的所有密码子置换为cug(或cuc)以及将最初编码gln的所有密码子置换为cag以及将最初编码pro的所有密码子置换为ccc(或ccg);等等。优选地,与编码如本文所定义的抗原或者其片段或变体的野生型rna的编码区的g/c含量相比,本发明的含有mrna序列的mrna化合物的编码区的g/c含量增加至少7%、更优选至少15%、特别优选至少20%。根据具体实施例,如本文所定义的肽或蛋白或者其片段或变体的编码区或野生型mrna序列的整个序列中的可置换密码子的至少5%、10%、20%、30%、40%、50%、60%、更优选至少70%、甚至更优选至少80%且最优选至少90%、95%或甚至100%被置换,从而增加所述序列的g/c含量。在此上下文中,特别优选的是与野生型序列相比将本发明的mrna序列的g/c含量,优选地根据本发明的mrna序列的至少一个编码区的g/c含量增至最大值(即,可置换的密码子的100%)。根据本发明,本发明的mrna序列的进一步优选的修饰基于以下发现:翻译效率也由细胞中不同的trna出现频率决定。因此,如果所谓的“稀有密码子”在本发明的mrna序列中以增加的程度存在,则相应的经修饰的mrna序列被翻译为比存在编码相对“频繁”的trna的密码子的情况明显更差的程度。根据本发明,在本发明的经修饰的mrna序列中,与野生型mrna序列的相应区域相比,编码如本文所定义的肽或蛋白或者其片段或变体的区域被修饰,使得编码在细胞中相对稀有的trna的野生型序列的至少一个密码子被交换为编码在细胞中相对频繁且携带与相对稀有的trna相同的氨基酸的trna的密码子。通过该修饰,对本发明的mrna的序列进行修饰,使得插入频繁出现的trna可用的密码子。换句话说,根据本发明,通过该修饰,编码在细胞中相对稀有的trna的野生型序列的所有密码子可以在每种情况下被交换为编码在细胞中相对频繁并且在每种情况下携带与相对稀有的trna相同的氨基酸的trna的密码子。在细胞中相对频繁地出现以及相反地相对稀有地出现的那些trna是本领域技术人员已知的;参见例如akashi,curr.opin.genet.dev.[遗传学与发育新见]2001,11(6):660-666。对于特定氨基酸使用最频繁出现的trna的密码子(例如,使用在(人类)细胞中最频繁出现的trna的gly密码子)是特别优选的。根据本发明,特别优选的是,将在本发明的经修饰的mrna序列中增加的(特别是最大化的)连续g/c含量与“频繁”密码子联系起来而不修饰由mrna序列的编码区编码的蛋白的氨基酸序列。该优选实施例允许提供本发明的特别有效翻译和稳定化(修饰)的mrna序列。可使用在wo02/098443中解释的计算机程序执行对如上所述的本发明的经修饰的mrna序列的测定(增加的g/c含量;trna交换),该专利的披露内容整体包括在本发明中。使用该计算机程序,可以借助于遗传密码或其简并性并结合使用编码在细胞中尽可能频繁出现的trna的密码子来修饰任何所需mrna序列的核苷酸序列,以使得产生最大g/c含量,由经修饰的rna序列编码的氨基酸序列与未修饰的序列相比优选地不被修饰。替代性地,也可以与原始序列相比仅修饰g/c含量或仅修饰密码子使用。visualbasic6.0中的源代码(使用的开发环境:带有servicepack3的microsoftvisualstudioenterprise6.0)也在wo02/098443中进行了描述。在本发明的进一步优选的实施例中,本发明的mrna序列的核糖体结合位点环境中的a/u含量与其相应野生型mrna的核糖体结合位点环境中的a/u含量相比增加。这种修饰(核糖体结合位点周围的a/u含量增加)增加核糖体与mrna结合的效率。核糖体与核糖体结合位点(kozak序列:seqidno:224307或seqidno:224308,aug形成起始密码子)的有效结合又具有有效翻译mrna的作用。根据本发明的又一个实施例,可以针对潜在的去稳定序列元件修饰本发明的mrna序列。特别地,该mrna序列的编码区和/或5′和/或3′未翻译区与相应的野生型mrna相比可以被修饰,使得它不包含去稳定序列元件,经修饰的mrna的所编码氨基酸序列与其相应的野生型mrna相比优选地不被修饰。已知的是,例如在真核mrna的序列中,存在去稳定序列元件(dse),这些去稳定序列元件与信号蛋白结合并在体内调控mrna的酶促降解。为了进一步稳定经修饰的mrna序列,任选地在编码至少一种如本文所定义的肽或蛋白或者其片段或变体的区域中,因此可以与野生型mrna的相应区域相比进行一个或多个此类修饰,以使得在那里不包含或基本上不包含去稳定序列元件。根据本发明,存在于未翻译区(3’-和/或5’-utr)中的dse也可以通过此类修饰从本发明的mrna序列中消除。此类去稳定序列例如是富含au的序列(aures),它们存在于许多不稳定mrna的3′-utr区段中(caput等人,proc.natl.acad.sci.usa[美国国家科学院院刊]1986,83:1670至1674)。因此,与相应的野生型mrna相比,优选地修饰本发明的mrna序列,以使得本发明的mrna序列不包含此类去稳定序列。这也适用于那些被可能的核酸内切酶识别的序列基序,例如序列gaacaag,该序列包含在编码转铁蛋白受体的基因的3′-utr区段中(binder等人,emboj.[欧洲分子生物学学会会刊]1994,13:1969至1980)。这些序列基序也优选地在本发明的mrna序列中移除。根据优选的实施例,本发明提供含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的含有至少一个编码区的mrna序列,其中该编码区包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(optl)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表1-5或图20-24的“c列”披露的(经修饰的)rna序列中的任一种或这些序列中任一种的片段或变体,或由其组成。根据特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:64025-78055、224085-224106、192073-206103的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步的特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自乙型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:90422-92600、224107-224112、218470-220648的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步的特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:78056-90421、224113、224313-224317、206104-218469的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自乙型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:92601-94528、220649-222576的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据进一步的特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自狂犬病毒的糖蛋白的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:94529-96036、224271-224273、222577-224084的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。在进一步优选的实施例中,根据本发明的mrna序列的至少一个编码区包含rna序列或由其组成,该rna序列与根据seqidno:64025-96036、192073-224084的(经修饰的)rna序列中的任一种或这些序列中的任一种的片段或变体至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%、优选至少70%、更优选至少80%、甚至更优选至少85%、甚至更优选至少90%且最优选至少95%或甚至97%相同或具有以上序列同一性。根据特别优选的实施例,根据本发明的mrna序列的至少一个编码区包含rna序列或由其组成,该rna序列与根据seqidno:64025-96036、192073-224084的(经修饰的)rna序列中的任一种或这些序列中的任一种的片段或变体具有至少80%的序列同一性。适应于人类密码子使用的序列:根据本发明,含有包含在本发明的含有mrna的脂质纳米颗粒的mrna中的mrna序列的mrna化合物的进一步优选的修饰基于以下发现:编码相同氨基酸的密码子典型地以不同的频率出现。根据本发明,在本发明的含有mrna序列的经修饰的mrna化合物中,如本文所定义的编码区与相应野生型mrna的相应编码区相比优选地进行修饰,以使得根据如例如表1a(人类密码子使用表)所示的人类密码子使用,编码相同氨基酸的密码子的频率对应于该密码子的天然存在的频率。例如,就由根据本发明的含有mrna序列的mrna化合物的至少一个编码区编码的氨基酸序列中存在的氨基酸丙氨酸(ala)而言,野生型编码区的适应方式优选地使得密码子“gcc”的使用频率为0.40,密码子“gct”的使用频率为0.28,密码子“gca”的使用频率为0.22,以及密码子“gcg”的使用频率为0.10等(参见表1a)。表1a:人类密码子使用表氨基酸密码子分率/1000氨基酸密码子分率/1000alagcg0.107.4proccg0.116.9alagca0.2215.8procca0.2716.9alagct0.2818.5procct0.2917.5alagcc*0.4027.7proccc*0.3319.8cystgt0.4210.6glncag*0.7334.2cystgc*0.5812.6glncaa0.2712.3aspgat0.4421.8argagg0.2212.0aspgac*0.5625.1argaga*0.2112.1g1ugag*0.5939.6argcgg0.1911.4glugaa0.4129.0argcga0.106.2phettt0.4317.6argcgt0.094.5phettc*0.5720.3argcgc0.1910.4glyggg0.2316.5seragt0.1412.1glygga0.2616.5seragc*0.2519.5glyggt0.1810.8sertcg0.064.4glyggc*0.3322.2sertca0.1512.2hiscat0.4110.9sertct0.1815.2hiscac*0.5915.1sertcc0.2317.7ileata0.147.5thracg0.126.1ileatt0.3516.0thraca0.2715.1ileatc*0.5220.8thract0.2313.1lysaag*0.6031.9thracc*0.3818.9lysaaa0.4024.4valgtg*0.4828.1leuttg0.1212.9valgta0.107.1leutta0.067.7valgtt0.1711.0leuctg*0.4339.6valgtc0.2514.5leucta0.077.2trptgg*113.2leuctt0.1213.2tyrtat0.4212.2leuctc0.2019.6tyrtac*0.5815.3metatg*122.0终止tga*0.611.6asnaat0.4417.0终止tag0.170.8asnaac*0.5619.1终止taa0.221.0*最常见的密码子根据优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,其中该编码区包含根据seqidno:128049-160060的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:128049-142079的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自乙型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:154446-156624的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:142080-154445的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自乙型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:156625-158552的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自狂犬病毒的糖蛋白的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:158553-160060的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自埃博拉病毒的至少一种抗原肽或蛋白,其中该编码区包含根据专利申请wo2016097065的seqidno:20-44的(经修饰的)rna序列中的任一种、或者这些序列的片段或变体,或由其组成。在此上下文中,wo2016097065的seqidno:20-44和涉及wo2016097065的seqidno:20-44的披露内容以援引方式并入本文。在进一步优选的实施例中,根据本发明的mrna序列的至少一个编码区包含rna序列或由其组成,该rna序列与根据seqidno:128049-160060的(经修饰的)rna序列中的任一种或这些序列中的任一种的片段或变体至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%、优选至少70%、更优选至少80%、甚至更优选至少85%、甚至更优选至少90%且最优选至少95%或甚至97%相同或具有以上序列同一性。根据特别优选的实施例,根据本发明的mrna序列的至少一个编码区包含rna序列或由其组成,该rna序列与根据seqidno:128049-160060的(经修饰的)rna序列中的任一种或这些序列中的任一种的片段或变体具有至少80%的序列同一性。密码子优化的序列:如上所述,根据本发明优选的是,编码在细胞中相对稀有的trna的野生型序列的所有密码子被交换为编码在细胞中相对频繁并且在每种情况下携带与相对稀有的trna相同的氨基酸的trna的密码子。因此,特别优选的是,将最频繁的密码子用于每个编码的氨基酸(参见表1a,“人类密码子使用表”,最频繁的密码子用星号标记)。这种优化程序增加密码子适应指数(cai)并最终使cai最大化。在本发明的上下文中,具有增加的或最大化的cai的序列典型地被称为“密码子优化的”序列和/或cai增加的和/或最大化的序列。根据优选的实施例,本发明的含有mrna序列的mrna化合物包含至少一个编码区,其中该编码区/序列如本文所述进行密码子优化。更优选地,该至少一个编码序列的密码子适应指数(cai)为至少0.5、至少0.8、至少0.9或至少0.95。最优选地,该至少一个编码序列的密码子适应指数(cai)为1。例如,就存在于由根据本发明的rna的至少一个编码序列编码的氨基酸序列中的氨基酸丙氨酸(ala)而言,野生型编码序列以最频繁的人类密码子“gcc”总是用于所述氨基酸的方式适应,或者对于氨基酸半胱氨酸(cys)而言,野生型序列以最频繁的人类密码子“tgc”总是用于所述氨基酸的方式适应,等等。根据优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,其中该编码区包含根据seqidno:160061-192072的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:160061-174091的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自乙型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:186458-188636的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:174092-186457的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自乙型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:188637-190564的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自狂犬病毒的糖蛋白的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:190565-192072的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。在进一步优选的实施例中,根据本发明的mrna序列的至少一个编码区包含rna序列或由其组成,该rna序列与根据seqidno:160061-192072的(经修饰的)rna序列中的任一种或这些序列中的任一种的片段或变体至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%、优选至少70%、更优选至少80%、甚至更优选至少85%、甚至更优选至少90%且最优选至少95%或甚至97%相同或具有以上序列同一性。根据特别优选的实施例,根据本发明的mrna序列的至少一个编码区包含rna序列或由其组成,该rna序列与根据seqidno:160061-192072的(经修饰的)rna序列中的任一种或这些序列中的任一种的片段或变体具有至少80%的序列同一性。c优化的序列:根据另一个实施例,本发明的含有mrna序列的mrna化合物可以通过改变,优选地增加mrna序列(优选地mrna序列的编码区)的胞嘧啶(c)含量来修饰。在本发明的特别优选的实施例中,与相应野生型mrna(即,未修饰的mrna)的编码区的c含量相比,本发明的mrna序列的编码区的c含量被修饰,优选增加。与由相应野生型mrna编码的氨基酸序列相比,优选地不修饰由本发明的mrna序列的至少一个编码区编码的氨基酸序列。在本发明的优选实施例中,经修饰的mrna序列被修饰成使得实现至少10%、20%、30%、40%、50%、60%、70%或80%、或至少90%的理论上可能的最大胞嘧啶含量或甚至最大胞嘧啶含量。在进一步优选的实施例中,靶mrna野生型序列的作为“胞嘧啶含量可优化的”密码子的至少10%、20%、30%、40%、50%、60%、70%、80%、90%或甚至100%被胞嘧啶含量比野生型序列中存在的密码子更高的密码子取代。在进一步优选的实施例中,可以另外修饰野生型编码序列的一些密码子,使得细胞中相对稀有的trna的密码子被细胞中相对频繁的trna的密码子交换,条件是相对频繁的trna的取代密码子携带与原始野生型相对稀有的trna的密码子相同的氨基酸。优选地,相对稀有的trna的所有密码子被细胞中相对频繁的trna的密码子取代,但以下情况除外:编码仅由不含任何胞嘧啶的密码子编码的氨基酸的密码子,或由各自含有相同数量的胞嘧啶的两个密码子编码的谷氨酰胺(gln)。在本发明的进一步优选的实施例中,经修饰的靶mrna被修饰,使得借助编码细胞中相对频繁的trna的密码子来实现理论上可能的最大胞嘧啶含量的至少80%、或至少90%,或甚至最大胞嘧啶含量,其中氨基酸序列保持不变。由于遗传密码的天然存在的简并性,不止一个密码子可编码一种特定的氨基酸。因此,20种天然存在的氨基酸中的18种由多于一个密码子编码(tryp和met除外),例如由2个密码子(例如cys、asp、glu)、3个密码子(例如ile)、4个密码子(例如al、gly、pro)或6个密码子(例如leu、arg、ser)编码。然而,并非所有编码相同氨基酸的密码子在体内条件下都以相同的频率使用。根据每种单一生物,确立典型的密码子使用概况。如在本发明的上下文中使用的术语“胞嘧啶含量可优化的密码子”是指表现出比编码相同氨基酸的其他密码子更低的胞嘧啶含量的密码子。因此,可被另一个编码相同氨基酸并在其中表现出更高数量的胞嘧啶的密码子取代的任何野生型密码子均被认为是胞嘧啶可优化的(c可优化的)。在野生型编码区内通过特定的c优化密码子对c可优化的野生型密码子的任何此类置换增加了其总c含量并反映了富含c的经修饰的mrna序列。根据优选的实施例,本发明的mrna序列,优选地本发明的mrna序列的至少一个编码区包含c最大化的mrna序列或由其组成,该c最大化的mrna序列含有针对所有可能的c可优化的密码子的c优化密码子。因此,100%或全部理论上可取代的c可优化密码子优选地在编码区的整个长度上被c优化密码子替换。在此上下文下,胞嘧啶含量可优化的密码子是含有比编码相同氨基酸的其他密码子更少数量的胞嘧啶的密码子。密码子gcg、gca、gcu中的任一种均编码氨基酸ala,它们可以由编码相同氨基酸的密码子gcc交换,和/或编码cys的密码子ugu可以由编码相同氨基酸的密码子ugc交换,和/或编码asp的密码子gau可以由编码相同氨基酸的密码子gac交换,和/或编码phe的密码子uuu可以被交换成编码相同氨基酸的密码子uuc,和/或编码gly的密码子ggg、gga、ggu中的任一种可以由编码相同氨基酸的密码子ggc交换,和/或编码his的密码子cau可以由编码相同氨基酸的密码子cac交换,和/或编码ile的密码子aua、auu中的任一种可以由密码子auc交换,和/或编码leu的密码子uug、uua、cug、cua、cuu中的任一种可以由编码相同氨基酸的密码子cuc交换,和/或编码asn的密码子aau可以由编码相同氨基酸的密码子aac交换,和/或编码pro的密码子ccg、cca、ccu中的任一种可以由编码相同氨基酸的密码子ccc交换,和/或编码arg的密码子agg、aga、cgg、cga、cgu中的任一种可以由编码相同氨基酸的密码子cgc交换,和/或编码ser的密码子agu、agc、ucg、uca、ucu中的任一种可以由编码相同氨基酸的密码子ucc交换,和/或编码thr的密码子acg、aca、acu中的任一种可以由编码相同氨基酸的密码子acc交换,和/或编码val的密码子gug、gua、guu中的任一种可以由编码相同氨基酸的密码子guc交换,和/或编码tyr的密码子uau可以由编码相同氨基酸的密码子uac交换。在任何上述情况中,胞嘧啶的数量每个交换的密码子增加1。编码区的所有非c优化的密码子(对应于c可优化的密码子)的交换产生c-最大化的编码序列。在本发明的上下文中,在根据本发明的mrna序列的至少一个编码区内的至少70%、优选至少80%、更优选至少90%的非c优化的密码子被c优化的密码子取代。可能优选的是,对于一些氨基酸而言,c可优化的密码子被c优化的密码子取代的百分比小于70%,而对于其他氨基酸而言,替换的密码子的百分比高于70%以满足编码区的所有c可优化的野生型密码子的至少70%的总体c优化百分比。优选地,在本发明的c优化的mrna序列中,对于任何给定的氨基酸,至少50%的c可优化的野生型密码子被c优化的密码子取代,例如,任何经修饰的富含c的mrna序列优选地在编码上述氨基酸ala、cys、asp、phe、gly、his、ile、leu、asn、pro、arg、ser、thr、val和tyr中的任一者的c可优化的野生型密码子位置含有至少50%的c优化的密码子,优选地至少60%。在此上下文中,可以使用编码不是胞嘧啶含量可优化的但由至少两个密码子编码的氨基酸的密码子,而无需任何进一步的选择过程。然而,野生型序列的编码细胞(例如,人细胞)中相对稀有的trna的密码子可以被交换为编码细胞中相对频繁的trna的密码子,其中两者都编码相同的氨基酸。因此,编码glu的相对稀有的密码子gaa可以被编码相同氨基酸的相对频繁的密码gag交换,和/或编码lys的相对稀有的密码子aaa可以被编码相同氨基酸的相对频繁的密码子aag交换,和/或编码gln的相对稀有的密码子caa可以被交换为编码相同氨基酸的相对频繁的密码子cag。在此上下文中,各自仅由一个密码子编码的氨基酸met(aug)和trp(ugg)保持不变。终止密码子不是胞嘧啶含量优化的,然而,相对稀有的终止密码子琥珀密码子、赭石密码子(uaa、uag)可以被相对频繁的终止密码子乳白密码子(uga)交换。上面列出的单个置换可以单独使用以及以所有可能的组合来使用,以便与野生型mrna序列相比优化经修饰的mrna序列的胞嘧啶含量。因此,如本文所定义的至少一个编码序列与相应野生型mrna的编码区相比可以被改变,以使得氨基酸由至少两个或更多个密码子编码,其中一个包含一个另外的胞嘧啶,这样的密码子可以被包含一个另外的胞嘧啶的c优化密码子交换,其中氨基酸与野生型序列相比优选地不改变。根据优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,其中该编码区包含根据seqidno:96037-128048的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:96037-110067的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自乙型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:122434-124612的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:110068-122433的(经修饰的)rna序列中的任一种、或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自乙型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:124613-126540的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。根据进一步特别优选的实施例,本发明提供了含有mrna的脂质纳米颗粒,其中该mrna包含如本文所定义的mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自狂犬病毒的糖蛋白的至少一种抗原肽或蛋白,其中该编码区包含根据seqidno:126541-128048的(经修饰的)rna序列中的任一种或者这些序列中的任一种的片段或变体,或由其组成。在进一步优选的实施例中,根据本发明的mrna序列的至少一个编码区包含rna序列或由其组成,该rna序列与根据seqidno:96037-128048的(经修饰的)rna序列中的任一种或这些序列中的任一种的片段或变体至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%、优选至少70%、更优选至少80%、甚至更优选至少85%、甚至更优选至少90%且最优选至少95%或甚至97%相同或具有以上序列同一性。根据特别优选的实施例,根据本发明的含有mrna序列的mrna化合物的至少一个编码区包含rna序列或由其组成,该rna序列与根据seqidno:96037-128048的(经修饰的)rna序列中的任一种或这些序列中的任一种的片段或变体具有至少80%的序列同一性。根据特别优选的实施例,本发明提供含有mrna的脂质纳米颗粒,其中该mrna包含mrna序列,该mrna序列包含至少一个如本文所定义的编码区,其中该mrna序列的至少一个编码区的g/c含量与相应野生型mrna的相应编码区的g/c含量相比增加,和/或其中该mrna序列的至少一个编码区的c含量与相应野生型mrna的相应编码区的c含量相比增加,和/或其中该mrna序列的至少一个编码区中的密码子适应人类密码子使用,其中密码子适应指数(cai)优选地在该mrna序列的至少一个编码区中增加或最大化,并且其中由该mrna序列编码的氨基酸序列与由相应野生型mrna编码的氨基酸序列相比优选地不被修饰。5′-帽结构:根据本发明的另一个优选实施例,可以通过添加所谓的“5′-帽结构”来修饰如本文所定义的经修饰的mrna序列,该结构优选地稳定如本文所述的mrna。5′-帽是通常在成熟mrna的5′-末端“加帽”的实体,典型地是经修饰的核苷酸实体。5′-帽典型地可以由经修饰的核苷酸形成,特别是由鸟嘌呤核苷酸的衍生物形成。优选地,5′-帽经由5′-5′-三磷酸键连接到5′-端。5′-帽可以被甲基化,例如m7gpppn,其中n是携带5′-帽的核酸的末端5′核苷酸,典型地是mrna的5′-末端。m7gpppn是5′-帽结构,它天然存在于由聚合酶ii转录的mrna中并因此优选地在此上下文中不被认为是包含在经修饰的mrna中的修饰。因此,本发明的经修饰的mrna序列可包含m7gpppn作为5′-帽,但另外,经修饰的mrna序列典型地包含至少一种如本文所定义的进一步修饰。5′-帽结构的进一步实例包括甘油基、反向脱氧脱碱基残基(部分)、4’,5’亚甲基核苷酸、1-(β-d-赤藓呋喃糖基)核苷酸、4′-硫代核苷酸、碳环核苷酸、1,5-脱水己糖醇核苷酸、l-核苷酸、α-核苷酸、经修饰的碱基核苷酸、苏-戊呋喃糖基核苷酸、无环3’,4’-seco核苷酸、无环3,4-二羟基丁基核苷酸、无环3,5二羟基戊基核苷酸、3’-3’-反向核苷酸部分、3’-3’-反向脱碱基部分、3′-2′-反向核苷酸部分、3′-2′-反向脱碱基部分、1,4-丁二醇磷酸酯、3′-氨基磷酸酯、己基磷酸酯、氨基己基磷酸酯、3′-磷酸酯、3′-硫代磷酸酯、二硫代磷酸酯、或者桥接或非桥接甲基膦酸酯部分。这些经修饰的5′-帽结构在此上下文中被视为至少一种修饰。特别优选的经修饰的5′-帽结构是cap1(m7g的相邻核苷酸的核糖的甲基化)、cap2(m7g下游的第2个核苷酸的核糖的额外甲基化)、cap3(m7g下游的第3个核苷酸的核糖的额外甲基化)、cap4(m7g下游的第4个核苷酸的核糖的甲基化)、arca(抗反向帽类似物)、经修饰的arca(例如,经硫代磷酸酯修饰的arca)、肌苷、n1-甲基-鸟苷、2′-氟-鸟苷、7-脱氮-鸟苷、8-氧代-鸟苷、2-氨基-鸟苷、lna-鸟苷和2-叠氮基-鸟苷。因此,根据本发明的rna优选地包含5′-帽结构。poly(a)序列/尾:根据进一步优选的实施例,本发明的含有mrna序列的mrna化合物可在3′-端包含典型地为约10个至200个腺苷核苷酸、优选地约10个至100个腺苷核苷酸、更优选地约40个至80个腺苷核苷酸或甚至更优选地约50个至70个腺苷核苷酸的poly-a尾。优选地,本发明的含有mrna序列的mrna化合物中的poly(a)序列通过rna体外转录从dna模板衍生。替代性地,poly(a)序列也可以通过一般的化学合成方法在体外获得,而不必从祖代dna转录。此外,poly(a)序列或poly(a)尾可以使用市售聚腺苷酸化试剂盒和本领域已知的相应方案通过根据本发明的rna的酶促多聚腺苷酸化而产生。替代性地,如本文所述的mrna任选地包含多聚腺苷酸化信号,该信号在本文中定义为通过特定的蛋白因子(例如,裂解和多聚腺苷酸化特异性因子(cpsf)、裂解刺激因子(cstf)、裂解因子i和ii(cfi和cfii)、poly(a)聚合酶(pap))将多聚腺苷酸化传递至(经转录的)rna的信号。在此上下文中,包含nn(u/t)ana共有序列的共有多聚腺苷酸化信号是优选的。在特别优选的方面,多聚腺苷酸化信号包含以下序列之一:aa(u/t)aaa或a(u/t)(u/t)aaa(其中尿苷通常存在于rna中,而胸苷通常存在于dna中)。poly(c)序列:根据进一步优选的实施例,本发明的含有mrna序列的mrna化合物可以在3′末端含有典型地为约10个至200个胞嘧啶核苷酸、优选地约10个至100个胞嘧啶核苷酸、更优选地约20个至70个胞嘧啶核苷酸、或甚至更优选地约20个至60个或甚至10个至40个胞嘧啶核苷酸的poly(c)尾。在一个优选的实施例中,包含mrna序列的mrna化合物优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)编码至少一种抗原肽或蛋白的至少一个编码区,c)任选地,poly(a)序列,它优选地包含64个腺苷;d)任选地,poly(c)序列,它优选地包含30个胞嘧啶。在更优选的实施例中,mrna序列优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)编码至少一种抗原肽或蛋白的至少一个编码区,该抗原肽或蛋白衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体,c)任选地,poly(a)序列,它优选地包含64个腺苷;d)任选地,poly(c)序列,它优选地包含30个胞嘧啶。在特别优选的实施例中,mrna序列优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)编码至少一种抗原肽或蛋白的至少一个编码区,该抗原肽或蛋白衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体,该至少一个编码区优选地包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(optl)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表1-5或图20-24的“b列”或“c列”即seqidno:32013-64024或seqidno:64025-224084披露的核酸序列中的任一种或这些序列中任一种的片段或变体,或由其组成,c)任选地,poly(a)序列,它优选地包含64个腺苷;d)任选地,poly(c)序列,它优选地包含30个胞嘧啶。utr:在优选的实施例中,根据本发明的含有mrna序列的mrna化合物包含至少一个5′-或3′-utr元件。在此上下文中,utr元件包含核酸序列或由其组成,该核酸序列衍生自任何天然存在的基因的5′-或3′-utr或衍生自基因的5’-或3’-utr的片段、同源物或变体。优选地,根据本发明使用的5′-或3′-utr元件与本发明的mrna序列的至少一个编码区是异源的。虽然衍生自天然存在的基因的5′-或3′-utr元件是优选的,但是也可以在本发明的上下文中使用合成工程化的utr元件。3′-utr元件:术语“3′-utr元件”典型地是指核酸序列,它包含衍生自3′-utr或衍生自3′-utr的变体的核酸序列或由其组成。在本发明意义上的3′-utr元件可以表示rna(优选mrna)的3′-utr。因此,在本发明的意义上,优选地,3′-utr元件可以是rna、优选mrna的3′utr,或者它可以是rna的3′-utr的转录模板。因此,3′-utr元件优选地是对应于rna的3′-utr、优选地对应于mrna的3′-utr的核酸序列,例如通过基因工程改造的载体构建体的转录而获得的mrna。优选地,3′-utr元件实现3′-utr的功能或编码实现3′-utr功能的序列。优选地,该至少一个3′-utr元件包含核酸序列或由其组成,该核酸序列衍生自脊索动物基因、优选脊椎动物基因、更优选哺乳动物基因、最优选人基因的3′-utr,或衍生自脊索动物基因、优选脊椎动物基因、更优选哺乳动物基因、最优选人基因的3′-utr的变体。优选地,本发明的含有mrna序列的mrna化合物包含3′-utr元件,该元件可以衍生自与具有延长的半衰期(提供稳定的mrna)的mrna相关的基因,例如,如下定义和描述的3′-utr元件。优选地,3′-utr元件是衍生自优选地编码稳定mrna的基因的3′-utr、或衍生自所述基因的同源物、片段或变体的核酸序列。在特别优选的实施例中,3′-utr元件包含核酸序列或由其组成,该核酸序列衍生自选自由白蛋白基因、α-珠蛋白基因、β-珠蛋白基因、酪氨酸羟化酶基因、脂氧合酶基因和胶原α基因(例如胶原α1(i)基因)组成的组的基因的3′-utr、或衍生自选自由根据专利申请wo2013/143700(该专利的披露内容以援引方式并入本文)的seqidno:1369-1390的白蛋白基因、α-珠蛋白基因、β-珠蛋白基因、酪氨酸羟化酶基因、脂氧合酶基因和胶原α基因(例如胶原α1(i)基因)组成的组的基因的3′-utr的变体,或者衍生自其同源物、片段或变体。在特别优选的实施例中,3′-utr元件包含核酸序列或由其组成,该核酸序列衍生自白蛋白基因、优选脊椎动物白蛋白基因、更优选哺乳动物白蛋白基因、最优选根据seqidno:224301或seqidno:224303的人白蛋白基因或相应rna序列seqidno:224300或seqidno:224304的3’-utr。人白蛋白3’-utrseqidno224301catcacatttaaaagcatctcagcctaccatgagaataagagaaagaaaatgaagatcaaaagcttattcatctgtttttctttttcgttggtgtaaagccaacaccctgtctaaaaaacataaatttctttaatcattttgcctcttttctctgtgcttcaattaataaaaaatggaaagaatct(对应于专利申请wo2013/143700的seqidno:1369)。在此上下文中,特别优选的是,根据本发明的含有mrna序列的mrna化合物包含3′-utr元件,该3′-utr元件包含衍生自根据专利申请wo2013/143700的seqidno:1369-1390的核酸或者其片段、同源物或变体的相应rna序列。最优选地,3′-utr元件包含衍生自根据seqidno:224303的人白蛋白基因的片段的核酸序列。白蛋白73’-utrcatcacatttaaaagcatctcagcctaccatgagaataagagaaagaaaatgaagatcaatagcttattcatctctttttctttttcgttggtgtaaagccaacaccctgtctaaaaaacataaatttctttaatcattttgcctcttttctctgtgcttcaattaataaaaaatggaaagaacct(seqidno:224303,对应于专利申请wo2013143700的seqidno:1376)。在此上下文中,特别优选的是,根据本发明的mrna序列的3′-utr元件包含根据seqidno:224301或seqidno:224303的核酸序列的相应rna序列(如seqidno:224302或seqidno:224304所示)或由其组成。在另一个特别优选的实施例中,3′-utr元件包含核酸序列或由其组成,该核酸序列衍生自α-或β-珠蛋白基因、优选脊椎动物α-或β-珠蛋白基因、更优选哺乳动物α-或β-珠蛋白基因、最优选根据seqidno:224291、224293、224295、224297的人α-或β珠蛋白基因或相应rna序列seqidno:224292、224294、224296、224298的3’-utr。智人血红蛋白α1(hba1)的3’-utrgctggagcctcggtggccatgcttcttgccccttgggcctccccccagcccctcctccccttcctgcacccgtacccccgtggtctttgaataaagtctgagtgggcggc(seqidno:224291,对应于专利申请wo2013/143700的seqidno:1370)。智人血红蛋白α2(hba2)的3’-utrgctggagcctcggtagccgttcctcctgcccgctgggcctcccaacgggccctcctcccctccttgcaccggcccttcctggtctttgaataaagtctgagtgggcag(seqidno:224293,对应于专利申请wo2013/143700的seqidno:1371)。智人血红蛋白β(hbb)的3′-utrgctcgctttcttgctgtccaatttctattaaaggttcctttgttccctaagtccaactactaaactgggggatattatgaagggccttgagcatctggattctgcctaataaaaaacatttattttcattgc(seqidno:224295,对应于专利申请wo2013/143700的seqidno:1372)。例如,3′-utr元件可包含α-珠蛋白基因(例如人α-珠蛋白基因或者α-珠蛋白基因的同源物、片段或变体)的3′-utr的中心α-复合物结合部分(优选地根据seqidno:224297)或由其组成。α-珠蛋白基因的3′-utr的中心α-复合物结合部分(在本文中也称为“muag”)gcccgatgggcctcccaacgggccctcctcccctccttgcaccg(seqidno:224297,对应于专利申请wo2013/143700的seqidno:1393)。在此上下文中,特别优选的是,根据本发明的mrna序列的3′-utr元件包含根据seqidno:224297的核酸序列的相应rna序列(如seqidno:224298所示)、或者其同源物、变体或片段或由其组成。术语“衍生自[...]基因的3′-utr的核酸序列”优选地是指基于[...]基因的3′-utr序列或基于其部分的核酸序列,例如,基于白蛋白基因、α-珠蛋白基因、β-珠蛋白基因、酪氨酸羟化酶基因、脂氧合酶基因或胶原α基因(例如胶原α1(i)基因),优选白蛋白基因的3′-utr或基于其部分。该术语包括对应于整个3′-utr序列的序列,即基因的全长3′-utr序列,和对应于基因3′-utr序列片段的序列,该基因诸如为白蛋白基因、α-珠蛋白基因、β-珠蛋白基因、酪氨酸羟化酶基因、脂氧合酶基因或胶原α基因,例如胶原α1(i)基因,优选白蛋白基因。术语“衍生自[...]基因的3′-utr的变体的核酸序列”优选地是指基于基因的3′-utr序列的变体的核酸序列,例如,基于白蛋白基因、α-珠蛋白基因、β-珠蛋白基因、酪氨酸羟化酶基因、脂氧合酶基因或胶原α基因(例如胶原蛋白α1(i)基因)的3′-utr的变体,或基于如上所述的其部分。该术语包括对应于基因的3′-utr的变体的完整序列的序列,即基因的全长变体3′-utr序列,和对应于基因的变体3′-utr序列的片段的序列。在此上下文中的片段优选地由对应于全长变体3′-utr中的连续核苷酸段的连续核苷酸段组成,该全长变体3′-utr中的连续核苷酸段占全长变体3′-utr的至少20%、优选至少30%、更优选至少40%、更优选至少50%、甚至更优选至少60%、甚至更优选至少70%、甚至更优选至少80%且最优选至少90%。在本发明的意义上,这样的变体片段优选地是如本文所述的变体的功能片段。根据优选的实施例,根据本发明的含有mrna序列的mrna化合物包含5′-帽结构和/或至少一个3′-未翻译区元件(3′-utr元件),优选地如本文所定义。更优选地,该rna进一步包含如本文所定义的5′-utr元件。在一个优选的实施例中,包含mrna序列的mrna化合物优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)编码至少一种抗原肽或蛋白的至少一个编码区,c)任选地3′-utr元件,它优选地包含衍生自α珠蛋白基因的核酸序列或由其组成,优选地包含根据seqidno:224297的核酸序列的相应rna序列(如seqidno:224298所示)、其同源物、片段或变体;d)任选地,poly(a)序列,它优选地包含64个腺苷;e)任选地,poly(c)序列,它优选地包含30个胞嘧啶。在优选的实施例中,mrna序列优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)编码至少一种抗原肽或蛋白的至少一个编码区,该抗原肽或蛋白优选地衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体,c)任选地3′-utr元件,它优选地包含衍生自α珠蛋白基因的核酸序列或由其组成,优选地包含根据seqidno:224297的核酸序列的相应rna序列(如seqidno:224298所示)、其同源物、片段或变体;d)任选地,poly(a)序列,它优选地包含64个腺苷;e)任选地,poly(c)序列,它优选地包含30个胞嘧啶。在特别优选的实施例中,mrna序列优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)编码至少一种抗原肽或蛋白的至少一个编码区,该抗原肽或蛋白优选地衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体,该至少一个编码区优选地包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表1-5或图20-24的“b列”或“c列”即seqidno:32013-64024或seqidno:64025-224084披露的核酸序列中的任一种或这些序列中任一种的片段或变体,或由其组成,c)任选地3′-utr元件,它优选地包含衍生自α珠蛋白基因的核酸序列或由其组成,优选地包含根据seqidno:224297的核酸序列的相应rna序列(如seqidno:224298所示)、其同源物、片段或变体;d)任选地,poly(a)序列,它优选地包含64个腺苷;e)任选地,poly(c)序列,它优选地包含30个胞嘧啶;和5′-utr元件:在特别优选的实施例中,含有mrna序列的至少一种mrna化合物包含至少一个5′-未翻译区元件(5′-utr元件)。优选地,该至少一个5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自top基因的5′-utr或衍生自top基因的5′-utr的片段、同源物或变体。特别优选的是,5′-utr元件不包含如上所定义的top基序或5′-top。在一些实施例中,衍生自top基因的5′-utr的5′-utr元件的核酸序列在其3′末端以位于它所衍生自的基因或mrna的起始密码子(a(u/t)g)上游的第1、2、3、4、5、6、7、8、9或10位的核苷酸终止。因此,5′-utr元件不包含蛋白编码区的任何部分。因此,优选地,编码区仅提供该至少一种mrna序列的蛋白编码部分。衍生自top基因的5′-utr的核酸序列优选地衍生自真核top基因,优选地植物或动物top基因,更优选地脊索动物top基因,甚至更优选地脊椎动物top基因,最优选地哺乳动物top基因,例如人top基因。例如,5′-utr元件优选地选自包含以下核酸序列或由其组成的5′-utr元件,该核酸序列衍生自选自由专利申请wo2013/143700(该专利的披露内容以援引方式并入本文)的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422组成的组的核酸序列,衍生自专利申请wo2013/143700的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422的同源物,衍生自其变体,或优选地衍生自相应rna序列。术语“专利申请wo2013/143700的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422的同源物”是指除了智人之外的其他物种的序列,这些序列与根据专利申请wo2013/143700的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422的序列同源。在优选的实施例中,根据本发明的含有mrna序列的mrna化合物的5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自从以下核酸序列的核苷酸位置5(即,位于序列中的第5位的核苷酸)至紧邻起始密码子(位于序列的3′末端)5′的核苷酸位置(例如,紧邻atg序列的5’的核苷酸位置)延伸的核酸序列:该核酸序列选自专利申请wo2013/143700的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422,选自专利申请wo2013/143700的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422的同源物,选自其变体或对应的rna序列。特别优选的是,5′-utr元件衍生自从以下核酸序列的紧邻5’-top的3′的核苷酸位置至紧邻起始密码子(位于序列的3’末端)5’的核苷酸位置(例如,紧邻atg序列的5’的核苷酸位置)延伸的核酸序列:该核酸序列选自专利申请wo2013/143700的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422,选自专利申请wo2013/143700的seqidno:1-1363、seqidno:1395、seqidno:1421和seqidno:1422的同源物,选自其变体或对应的rna序列。在特别优选的实施例中,5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自编码核糖体蛋白的top基因的5′-utr或者衍生自编码核糖体蛋白的top基因的5’-utr的变体。例如,5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自根据专利申请wo2013/143700的seqidno:67、170、193、244、259、554、650、675、700、721、913、1016、1063、1120、1138和1284-1360中的任一者的核酸序列的5′-utr、对应的rna序列、其同源物、或其如本文所述的变体,优选地缺少5′-top基序。如上所述,从位置5延伸至紧邻atg(位于序列的3′末端)5′的核苷酸延伸的序列对应于所述序列的5′-utr。优选地,5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自编码核糖体大蛋白(rpl)的top基因的5′-utr或衍生自编码核糖体大蛋白(rpl)的top基因的5′-utr的同源物或变体。例如,5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自根据专利申请wo2013/143700的seqidno:67、259、1284-1318、1344、1346、1348-1354、1357、1358、1421和1422中的任一者的核酸序列的5′-utr、对应的rna序列、其同源物、或其如本文所述的变体,优选地缺少5′-top基序。在特别优选的实施例中,5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自核糖体蛋白大32基因的5′-utr,优选地衍生自脊椎动物核糖体蛋白大32(l32)基因,更优选地衍生自哺乳动物核糖体蛋白大32(l32)基因,最优选地衍生自人核糖体蛋白大32(l32)基因,或衍生自核糖体蛋白大32基因的5′utr的变体,优选地衍生自脊椎动物核糖体蛋白大32(l32)基因,更优选地衍生自哺乳动物核糖体蛋白大32(l32)基因,最优选地衍生自人核糖体蛋白大32(l32)基因,其中优选地,5′-utr元件不包含所述基因的5′-top。因此,在特别优选的实施例中,5′-utr元件包含核酸序列或由核酸序列组成,该核酸序列与根据seqidno:224287或seqidno:224288(缺少5′-端寡嘧啶束的人核糖体蛋白大32的5′-utr:ggcgctgcctacggaggtggcagccatctccttctcggcatc;对应于专利申请wo2013/143700的seqidno:1368)的核酸序列或优选地与对应的rna序列具有至少约40%、优选至少约50%、优选至少约60%、优选至少约70%、更优选至少约80%、更优选至少约90%、甚至更优选至少约95%、甚至更优选至少约99%的同一性,或者其中该至少一个5′-utr元件包含核酸序列的片段或由其组成,该核酸序列的片段与根据seqidno:224287的核酸序列或与对应的rna序列(seqidno:224288)具有至少约40%、优选至少约50%、优选至少约60%、优选至少约70%、更优选至少约80%、更优选至少约90%、甚至更优选至少约95%、甚至更优选至少约99%的同一性,其中优选地,该片段如上所述,即,是占全长5′-utr的至少20%等的连续核苷酸段。优选地,该片段表现出至少约20个或更多个核苷酸、优选至少约30个或更多个核苷酸、更优选至少约40个或更多个核苷酸的长度。优选地,该片段是如本文所述的功能片段。在一些实施例中,根据本发明的含有mrna序列的mrna化合物包含5′-utr元件,该元件包含核酸序列或由其组成,该核酸序列衍生自脊椎动物top基因(例如哺乳动物,例如人top基因)的5′-utr,该基因选自rpsa、rps2、rps3、rps3a、rps4、rps5、rps6、rps7、rps8、rps9、rps10、rps11、rps12、rps13、rps14、rps15、rps15a、rps16、rps17、rps18、rps19、rps20、rps21、rps23、rps24、rps25、rps26、rps27、rps27a、rps28、rps29、rps30、rpl3、rpl4、rpl5、rpl6、rpl7、rpl7a、rpl8、rpl9、rpl10、rpl10a、rpl11、rpl12、rpl13、rpl13a、rpl14、rpl15、rpl17、rpl18、rpl18a、rpl19、rpl21、rpl22、rpl23、rpl23a、rpl24、rpl26、rpl27、rpl27a、rpl28、rpl29、rpl30、rpl31、rpl32、rpl34、rpl35、rpl35a、rpl36、rpl36a、rpl37、rpl37a、rpl38、rpl39、rpl40、rpl41、rplp0、rplp1、rplp2、rplp3、rplp0、rplp1、rplp2、eef1a1、eef1b2、eef1d、eef1g、eef2、eif3e、eif3f、eif3h、eif2s3、eif3c、eif3k、eif3eip、eif4a2、pabpc1、hnrnpa1、tpt1、tubb1、uba52、npm1、atp5g2、gnb2l1、nme2、uqcrb,或衍生自其同源物或变体,其中优选地,5′-utr元件不包含所述基因的top基序或5′-top,并且其中任选地,5′-utr元件在其5′末端以位于5′-端寡嘧啶束(top)下游的第1、2、3、4、5、6、7、8、9或10位的核苷酸终止,并且其中进一步任选地,衍生自top基因的5′-utr的5′-utr元件在其3′末端以位于它所衍生自的基因的起始密码子(a(u/t)g)上游的第1、2、3、4、5、6、7、8、9或10位的核苷酸终止。在进一步的特别优选的实施例中,5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自核糖体蛋白大32基因(rpl32)、核糖体蛋白大35基因(rpl35)、核糖体蛋白大21基因(rpl21)、atp合酶、h+转运、线粒体f1复合物、α亚基1、心肌(atp5a1)基因、羟基类固醇(17-β)脱氢酶4基因(hsd17b4)、雄激素诱导的1基因(aig1)、细胞色素c氧化酶亚基vic基因(cox6c)或n-酰基鞘氨醇酰胺水解酶(酸性神经酰胺酶)1基因(asah1)的5’-utr或衍生自其变体,优选地衍生自脊椎动物核糖体蛋白大32基因(rpl32)、脊椎动物核糖体蛋白大35基因(rpl35)、脊椎动物核糖体蛋白大21基因(rpl21)、脊椎动物atp合酶、h+转运、线粒体f1复合物、α亚基1、心肌(atp5a1)基因、脊椎动物羟基类固醇(17-β)脱氢酶4基因(hsd17b4)、脊椎动物雄激素诱导的1基因(aig1)、脊椎动物细胞色素c氧化酶亚基vic基因(cox6c)或脊椎动物n-酰基鞘氨醇酰胺水解酶(酸性神经酰胺酶)1基因(asah1)或衍生自其变体,更优选地衍生自哺乳动物核糖体蛋白大32基因(rpl32)、核糖体蛋白大35基因(rpl35)、核糖体蛋白大21基因(rpl21)、哺乳动物atp合酶、h+转运、线粒体f1复合物、α亚基1、心肌(atp5a1)基因、哺乳动物羟基类固醇(17-β)脱氢酶4基因(hsd17b4)、哺乳动物雄激素诱导的1基因(aig1)、哺乳动物细胞色素c氧化酶亚基vic基因(cox6c)或哺乳动物n-酰基鞘氨醇酰胺水解酶(酸性神经酰胺酶)1基因(asah1)或衍生自其变体,最优选地衍生自人核糖体蛋白大32基因(rpl32)、人核糖体蛋白大35基因(rpl35)、人核糖体蛋白大21基因(rpl21)、人atp合酶、h+转运、线粒体f1复合物、α亚基1、心肌(atp5a1)基因、人羟基类固醇(17-β)脱氢酶4基因(hsd17b4)、人雄激素诱导的1基因(aig1)、人细胞色素c氧化酶亚基vic基因(cox6c)或人n-酰基鞘氨醇酰胺水解酶(酸性神经酰胺酶)1基因(asah1)或衍生自其变体,其中优选地,5′-utr元件不包含所述基因的5′-top。因此,在特别优选的实施例中,5′-utr元件包含核酸序列或由其组成,该核酸序列与根据专利申请wo2013/143700的seqidno:1368或seqidno:1412-1420的核酸序列或相应rna序列具有至少约40%、优选至少约50%、优选至少约60%、优选至少约70%、更优选至少约80%、更优选至少约90%、甚至更优选至少约95%、甚至更优选至少约99%的同一性,或者其中该至少一个5′-utr元件包含核酸序列的片段或由其组成,该片段与根据专利申请wo2013/143700的seqidno:1368或seqidno:1412-1420的核酸序列具有至少约40%、优选至少约50%、优选至少约60%、优选至少约70%、更优选至少约80%、更优选至少约90%、甚至更优选至少约95%、甚至更优选至少约99%的同一性,其中优选地,该片段如上所述,即,是占全长5′-utr的至少20%等的连续核苷酸段。优选地,该片段表现出至少约20个或更多个核苷酸、优选至少约30个或更多个核苷酸、更优选至少约40个或更多个核苷酸的长度。优选地,该片段是如本文所述的功能片段。因此,在特别优选的实施例中,5′-utr元件包含核酸序列或由核酸序列组成,该核酸序列与根据seqidno:224289(缺少5′-端寡嘧啶束的atp5a1的5′-utr:gcggctcggccattttgtcccagtcagtccggaggctgcggctgcagaagtaccgcctgcggagtaactgcaaag;对应于专利申请wo2013/143700的seqidno:224289)的核酸序列或优选地与对应的rna序列(seqidno:224290)具有至少约40%、优选至少约50%、优选至少约60%、优选至少约70%、更优选至少约80%、更优选至少约90%、甚至更优选至少约95%、甚至更优选至少约99%的同一性,或者其中该至少一个5′-utr元件包含核酸序列的片段或由其组成,该核酸序列的片段与根据seqidno:224289的核酸序列或与对应的rna序列(seqidno:224290)具有至少约40%、优选至少约50%、优选至少约60%、优选至少约70%、更优选至少约80%、更优选至少约90%、甚至更优选至少约95%、甚至更优选至少约99%的同一性,其中优选地,该片段如上所述,即,是占全长5′-utr的至少20%等的连续核苷酸段。优选地,该片段表现出至少约20个或更多个核苷酸、优选至少约30个或更多个核苷酸、更优选至少约40个或更多个核苷酸的长度。优选地,该片段是如本文所述的功能片段。优选地,该至少一个5′-utr元件和至少一个3′-utr元件协同作用以增加从如上所述的至少一种mrna序列的蛋白产量。根据优选的实施例,根据本发明的含有mrna序列的mrna化合物优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)任选地5′-utr元件,它优选地包含衍生自top基因的5′-utr的核酸序列或由其组成,更优选地包含根据seqidno:224287的核酸序列的相应rna序列(如seqidno:224288所示)、其同源物、片段或变体,或由其组成;c)编码至少一种抗原肽或蛋白的至少一个编码区,该抗原肽或蛋白优选地衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体,该至少一个编码区优选地包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表1-5或图20-24的“b列”或“c列”即seqidno:32013-64024或seqidno:64025-224084披露的核酸序列中的任一种或这些序列中任一种的片段或变体,或由其组成,d)任选地3′-utr元件,它优选地包含衍生自提供稳定mrna的基因的核酸序列或由其组成,优选地包含根据seqidno:224291、224293、224295、224297、224299、224301或224303,优选地根据seqidno:224297或seqidno:224303的核酸序列的相应rna序列、其同源物、片段或变体,或由其组成;e)任选地poly(a)序列,它优选地包含64个腺苷;和f)任选地poly(c)序列,它优选地包含30个胞嘧啶。组蛋白茎-环:在特别优选的实施例中,根据本发明的mrna化合物的mrna序列包含组蛋白茎-环序列/结构。此类组蛋白茎-环序列优选地选自如wo2012/019780中所披露的组蛋白茎-环序列,该专利的披露内容以援引方式并入本文。适合在本发明中使用的组蛋白茎-环序列优选地选自下式(v)或(vi)中的至少一种:式(v)(没有茎边界元件的茎-环序列):式(vi)(具有茎边界元件的茎-环序列):其中:茎1或茎2边界元件n1-6是1个至6个、优选2个至6个、更优选2个至5个、甚至更优选3个至5个、最优选4个至5个或5个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;茎1[n0-2gn3-5]与元件茎2反向互补或部分反向互补,并且是5个至7个核苷酸的连续序列;其中n0-2是0个至2个、优选0个至1个、更优选1个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;其中n3-5是3个至5个、优选4个至5个、更优选4个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物,并且其中g是鸟苷或其类似物,并且可以任选地被胞苷或其类似物取代,条件是其在茎2中的互补核苷酸胞苷被鸟苷取代;环序列[n0-4(u/t)n0-4]位于元件茎1与茎2之间,并且是3个至5个核苷酸、更优选4个核苷酸的连续序列;其中每个n0-4彼此独立地是0个至4个、优选1个至3个、更优选1个至2个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;并且其中u/t代表尿苷或任选地胸苷;茎2[n3-5cn0-2]与元件茎1反向互补或部分反向互补,并且是5个至7个核苷酸的连续序列;其中n3-5是3个至5个、优选4个至5个、更优选4个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;其中n0-2是0个至2个、优选0个至1个、更优选1个n的连续序列,其中每个n彼此独立地选自从a、u、t、g或c中选择的核苷酸、或其核苷酸类似物;并且其中c是胞苷或其类似物,并且可以任选地被鸟苷或其类似物取代,条件是其在茎1中的互补核苷鸟苷被胞苷取代;其中茎1和茎2能够彼此碱基配对形成反向互补序列,其中碱基配对可以在茎1与茎2之间发生,例如通过核苷酸a和u/t或g和c的沃森-克里克(watson-crick)碱基配对或通过非沃森-克里克碱基配对,例如摆动碱基配对、反向沃森-克里克碱基配对、胡斯坦(hoogsteen)碱基配对、反向胡斯坦碱基配对;或能够彼此碱基配对形成部分反向互补序列,其中不完全碱基配对可基于以下情况在茎1与茎2之间可能发生:一个茎中的一个或多个碱基在另一个茎的反向互补序列中不具有互补碱基。根据进一步优选的实施例,本发明的mrna化合物的mrna序列可以包含根据以下特定式(va)或(via)中的至少一者的至少一个组蛋白茎-环序列:式(va)(没有茎边界元件的茎-环序列):式(via)(具有茎边界元件的茎-环序列):其中:n、c、g、t和u如上所定义。根据进一步的更特别优选的实施例,本发明的组合物的至少一种mrna可包含根据以下特定式(vb)或(vib)中的至少一者的至少一个组蛋白茎-环序列:式(vb)(没有茎边界元件的茎-环序列):式(vib)(具有茎边界元件的茎-环序列):其中:n、c、g、t和u如上所定义。特别优选的组蛋白茎-环序列是序列caaaggctcttttcagagccacca(根据seqidno:224305)或更优选地相应rna序列caaaggcucuuuucagagccacca(根据seqidno:224306)。任何上述修饰均可应用于本发明的含有mrna序列的mrna化合物,并且进一步应用于本发明上下文中使用的任何mrna,并且如果合适或必要,可以以任何组合彼此组合,这些修饰组合在相应mrna序列中不会彼此干扰。本领域的技术人员将能够相应地做出他的选择。含有根据本发明的mrna序列(它包含如本文所定义的至少一个编码区)的mrna化合物可优选地包含优选地含有至少一个组蛋白茎-环的5′-utr和/或3′-utr。根据本发明的mrna序列的3′-utr优选地还包含如本文所定义的poly(a)和/或poly(c)序列。3′-utr的单一元件可以沿着本发明的mrna序列的序列从5′至3’以任何顺序出现在其中。此外,还可以包含如本文所述的进一步的元件,例如如本文所定义的稳定序列(例如衍生自珠蛋白基因的utr)、ires序列等。每种元件也可以在根据本发明的mrna序列中重复至少一次(特别是在双顺反子或多顺反子构建体中),优选地两次或更多次。例如,单个元件可以按照以下顺序存在于根据本发明的mrna序列中:5′-编码区-组蛋白茎-环-poly(a)/(c)序列-3′;或者5′-编码区-poly(a)/(c)序列-组蛋白茎-环-3′;或者5′-编码区-组蛋白茎-环-多聚腺苷酸化信号-3′;或者5′-编码区-多聚腺苷酸化信号-组蛋白茎-环-3′;或者5′-编码区-组蛋白茎-环-组蛋白茎-环-poly(a)/(c)序列-3′;或者5′-编码区-组蛋白茎-环-组蛋白茎-环-多聚腺苷酸化信号-3′;或者5′-编码区-稳定序列-poly(a)/(c)序列-组蛋白茎-环-3′;或者5′-编码区-稳定序列-poly(a)/(c)序列-poly(a)/(c)序列-组蛋白茎-环-3′;等等。根据进一步的实施例,本发明的含有mrna序列的mrna化合物优选地包含以下结构元件中的至少一种:优选地包含衍生自top基因的5′-utr或衍生自其片段、同源物或变体的核酸序列或由其组成的5′-和/或3′-未翻译区元件(utr元件),特别是5’-utr元件;或可优选地衍生自提供稳定mrna的基因或衍生自其同源物、片段或变体的5′-和/或3′-utr元件;组蛋白-茎-环结构,优选地在其3′未翻译区中的组蛋白-茎-环;5′-帽结构;poly-a尾;或poly(c)序列。在一个实施例中,含有mrna序列的mrna化合物优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)编码至少一种抗原肽或蛋白的至少一个编码区,c)任选地3′-utr元件,它包含衍生自α珠蛋白基因的核酸序列或由其组成,优选地包含根据seqidno:224291、224293或224297优选地根据seqidno:224297的核酸序列的相应rna序列、其同源物、片段或变体;d)任选地,poly(a)序列,它优选地包含64个腺苷;e)任选地,poly(c)序列,它优选地包含30个胞嘧啶;并且f)任选地,组蛋白茎-环,它优选地包含根据seqidno:224306的rna序列。在特别优选的实施例中,含有mrna序列的mrna化合物优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)编码至少一种抗原肽或蛋白的至少一个编码区,该抗原肽或蛋白衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体,该至少一个编码区优选地包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表1-5或图20-24的“b列”或“c列”即seqidno:32013-64024或seqidno:64025-224084披露的核酸序列中的任一种或这些序列中任一种的片段或变体,或由其组成,c)任选地3′-utr元件,它包含衍生自α珠蛋白基因的核酸序列或由其组成,优选地包含根据seqidno:224291、224293或224297优选地根据seqidno:224297的核酸序列的相应rna序列、其同源物、片段或变体;d)任选地,poly(a)序列,它优选地包含64个腺苷;e)任选地,poly(c)序列,它优选地包含30个胞嘧啶;并且f)任选地,组蛋白茎-环,它优选地包含根据seqidno:224306的rna序列。根据另一个特别优选的实施例,根据本发明的含有mrna序列的mrna化合物优选地以5′至3′方向包含:a)5′-帽结构,优选m7gpppn;b)任选地5′-utr元件,它包含衍生自top基因的5′-utr的核酸序列或由其组成,优选地包含根据seqidno:224287或seqidno:224289的核酸序列的相应rna序列(如seqidno:224288或seqidno:224290所示)、其同源物、片段或变体,或由其组成;c)编码至少一种抗原肽或蛋白的至少一个编码区,该抗原肽或蛋白优选地衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体,该至少一个编码区优选地包含如序列表中所披露的具有以“衍生和/或修饰的cds序列(wt)”或“衍生和/或修饰的cds序列(opt1)”、“衍生和/或修饰的cds序列(opt2)”、“衍生和/或修饰的cds序列(opt3)”、“衍生和/或修饰的cds序列(opt4)”或“衍生和/或修饰的cds序列(opt5)”开始的数字标识符<223>的或分别在pct/ep2016/075843的表1-5或图20-24的“b列”或“c列”即seqidno:32013-64024或seqidno:64025-224084披露的核酸序列中的任一种或这些序列中任一种的片段或变体,或由其组成,d)任选地3′-utr元件,它包含衍生自提供稳定mrna的基因的核酸序列或由其组成,优选地包含根据seqidno:224301或seqidno:224303的核酸序列的相应rna序列(如seqidno:224302或seqidno:224304所示)、其同源物、片段或变体,或由其组成;e)任选地poly(a)序列,它优选地包含64个腺苷;f)任选地poly(c)序列,它优选地包含30个胞嘧啶;并且g)任选地,组蛋白茎-环,它优选地包含根据seqidno:224306的rna序列。在特别优选的实施例中,根据本发明的含有mrna序列的mrna化合物包含以下mrna序列(或与以下rna序列相同或者至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列):甲型流感ha:-根据seqidno:224198-224201、224203-224210的编码甲型流感/越南/1194/2004(h5n1)的ha蛋白的mrna。-根据seqidno:224181-224194的编码甲型流感/香港/4801/2014(h3n2)的ha蛋白的mrna。-根据seqidno:224163-224175的编码甲型流感/荷兰/602/2009(h1n1)的ha蛋白的mrna。-根据seqidno:224117-224126、224129、224130、224131、224132的编码甲型流感/加利福尼亚州/07/2009(h1n1)的ha蛋白的mrna-根据seqidno:224133-224142-224162的编码甲型流感/密歇根州/45/2015(h1n1)pdm09样病毒的ha蛋白的mrna。乙型流感ha:-根据seqidno:224246-224255、224256、224257的编码乙型流感/普吉岛/3037/2013的ha蛋白的mrna。-根据seqidno:224236-224245的编码乙型流感/布里斯班/60/2008的ha蛋白的mrna(gi:223950973;fj766840.1)。甲型流感:-根据seqidno:224319-224323的编码甲型流感/加利福尼亚州/07/2009(h1n1)的na蛋白的mrna。-根据seqidno:224324-224325的编码甲型流感/密歇根州/45/2015(h1n1)pdm09样病毒的na蛋白的mrna。-根据seqidno:224326-224335的编码甲型流感/荷兰/602/2009(h1n1)的na蛋白的mrna。-根据seqidno:224336-224339的编码甲型流感/香港/4801/2014(h3n2)的na蛋白的mrna。-根据seqidno:224342-224343的编码甲型流感/越南/1194/2004(h5n1)的na蛋白的mrna。-根据seqidno:224344-224345的编码甲型流感/越南/1203/2004(h5n1)的na蛋白的mrna。乙型流感:-根据seqidno:224348-224349的编码乙型流感/布里斯班/60/2008的na蛋白的mrna(gi:223950973;fj766840.1)。-根据seqidno:224350-224351的编码乙型流感/普吉岛/3037/2013的na蛋白的mrna。最优选的mrna序列包括:包含至少一个编码区的mrna序列,该编码区编码至少一种根据seqidno:1-14031的衍生自甲型流感病毒的血凝素(ha)的抗原肽或蛋白或者其片段或变体。与根据seqidno:32013-46043、64025-78055、224085-224106、96037-110067、128049-142079、160061-174091、192073-206103的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的mrna序列。包含至少一个编码区的mrna序列,该编码区编码至少一种根据seqidno:26398-28576的衍生自乙型流感病毒的血凝素(ha)的抗原肽或蛋白或者其片段或变体。与根据seqidno:58410-60588、90422-92600、224107-224112、122434-124612、154446-156624、186458-188636、218470-220648的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的mrna序列。包含至少一个编码区的mrna序列,该编码区编码至少一种根据seqidno:14032-26397、224309或224310的衍生自甲型流感病毒的神经氨酸酶(na)的抗原肽或蛋白或者其片段或变体。与根据seqidno:110068-122433、78056-90421、224113、224313-224317、110068-122433、142080-154445、174092-186457、206104-218469的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的mrna序列。包含至少一个编码区的mrna序列,该编码区编码至少一种根据seqidno:28577-30504的衍生自乙型流感病毒的神经氨酸酶(na)的抗原肽或蛋白或者其片段或变体。与根据seqidno:60589-62516、92601-94528、124613-126540、156625-158552、188637-190564、220649-222576的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的mrna序列。包含至少一个编码区的mrna序列,该编码区编码至少一种衍生自狂犬病毒的糖蛋白g(rav-g、ravbv-g或rabv-g)、核蛋白n(rav-n)、磷酸化蛋白p(rav-p)、基质蛋白m(rav-m)或rna聚合酶l(rav-l)或其片段、变体的至少一种抗原肽或蛋白。包含至少一个编码区的mrna序列,该编码区编码衍生自根据seqidno:30505-32012的狂犬病毒的糖蛋白g(rav-g、ravbv-g或rabv-g)或者其片段或变体的至少一种抗原肽或蛋白。包含至少一种rna序列的mrna序列,该rna序列选自与根据seqidno:62517-64024、224270、224274、94529-96036、224271-224273、126541-128048、158553-160060、190565-192072、222577-224084的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。信号肽:根据另一个特别优选的实施例,根据本发明的mrna序列可以另外地或替代性地编码分泌信号肽。此类信号肽是典型地表现出约15个至30个氨基酸的长度的序列,并且优选地位于所编码的肽的n端,但不限于此。如本文所定义的信号肽优选地允许将由至少一种mrna序列编码的抗原、抗原蛋白或抗原肽转运至限定的细胞区室,优选地细胞表面、内质网(er)或内体-溶酶体区室。如本文所定义的分泌信号肽序列的实例包括但不限于经典或非经典mhc分子的信号序列(例如mhci和ii分子的信号序列,例如mhci类分子的信号序列hla-a*0201),如本文所定义的细胞因子或免疫球蛋白的信号序列,如本文所定义的免疫球蛋白或抗体的恒定链的信号序列,lamp1、tap相关蛋白(tapasin)、erp57、calretikulin、calnexin和进一步的膜相关蛋白或与内质网(er)或内体-溶酶体区室相关的蛋白的信号肽。最优选地,根据本发明可以使用mhci类分子的信号序列hla-a*0201。例如,优选地使用衍生自hla-a的信号肽以促进如本文所定义的编码抗原或者其片段或变体的分泌。更优选地,hla-a信号肽与如本文所定义的编码抗原或者与其片段或变体融合。mrna的产生:根据本发明的mrna可以使用本领域已知的任何方法制备,这些方法包括合成方法,例如固相rna合成,以及体外方法,例如rna体外转录反应,特别是如实例中所述。如上所述,根据本发明的mrna化合物包封在脂质纳米颗粒中或与脂质纳米颗粒相关联。术语“脂质纳米颗粒”(也称为lnp)是指具有至少一个纳米级(例如,1-1,000nm)的维度的颗粒,它包含一种或多种脂质,例如式(i)、(ii)或(iii)的脂质。在一些实施例中,此类脂质纳米颗粒包含阳离子脂质(例如,式(i)、(ii)或(iii)的脂质)和一种或多种选自中性脂质、带电脂质、类固醇和聚合物缀合脂质(例如,聚乙二醇化脂质,例如式(iv)的聚乙二醇化脂质)的赋形剂。在一些实施例中,mrna或其部分包封在脂质纳米颗粒的脂质部分中或由脂质纳米颗粒的一些或全部脂质部分包封的水性空间中,从而使其免于酶促降解或由宿主生物体或细胞的机制所诱导的其他不期望的作用,例如不良免疫应答。在一些实施例中,mrna或其部分与脂质纳米颗粒相关联。在本发明的上下文中,脂质纳米颗粒不限于任何特定的形态,并且应该被解释为包括当阳离子脂质以及任选地一种或多种进一步的脂质例如在水性环境中和/或在核酸化合物存在下组合时所产生的任何形态。例如,脂质体、脂质复合物、脂质体复合物等在脂质纳米颗粒的范围内。在多种实施例中,脂质纳米颗粒具有从约30nm至约150nm、从约40nm至约150nm、从约50nm至约150nm、从约60nm至约130nm、从约70nm至约110nm、从约70nm至约100nm、从约80nm至约100nm、从约90nm至约100nm、从约70至约90nm、从约80nm至约90nm、从约70nm至约80nm、或约30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、75nm、80nm、85nm、90nm95nm、100nm、105nm、110nm、115nm、120nm、125nm、130nm、135nm、140nm、145nm或150nm的平均直径,并且基本上无毒。在某些实施例中,mrna当存在于脂质纳米颗粒中时在水溶液中耐核酸酶降解。如本文所用,平均直径可由通过动态光散射测定的z-平均值表示。lnp可包含能够形成一种或多种核酸分子附接到其上的或一种或多种核酸分子被包封在其中的颗粒的任何脂质。术语“脂质”是指一组有机化合物,它们是脂肪酸的衍生物(例如酯)并且特征通常在于不溶于水但可溶于许多有机溶剂。脂质通常分为至少三类:(1)包括脂肪和油以及蜡的“简单脂质”;(2)包括磷脂和糖脂的“复合脂质”;(3)诸如类固醇的“衍生脂质”。在一个实施例中,含有mrna的lnp包含一种或多种如本文所定义的阳离子脂质以及一种或多种稳定脂质。稳定脂质包括中性脂质和聚乙二醇化脂质。如上所述,lnp包含阳离子脂质。阳离子脂质优选地为可阳离子化的,即当ph降低到脂质的可电离基团的pka以下时它变成质子化的,但在更高的ph值下逐渐更呈中性。当带正电荷时,脂质然后能够与带负电荷的核酸缔合。在某些实施例中,阳离子脂质包括在ph降低时呈正电荷的两性离子脂质。lnp可包含能够形成一种或多种核酸分子附接到其上的或一种或多种核酸分子被包封在其中的颗粒的任何脂质。在某些实施例中,lnp可包含任何进一步的阳离子脂质或可阳离子化的脂质,即,在选择性ph(例如生理ph)下带有净正电荷的许多脂质物质中的任一种。此类脂质包括但不限于n,n-二油基-n,n-二甲基氯化铵(dodac);n-(2,3-二油氧基)丙基)-n,n,n-三甲基氯化铵(dotma);n,n-二硬脂基-n,n-二甲基溴化铵(ddab);n-(2,3-二油酰基氧基)丙基)-n,n,n-三甲基氯化铵(dotap);3-(n-(n′,n′-二甲基氨基乙烷)-氨基甲酰基)胆固醇(dc-chol)、n-(1-(2,3-二油酰基氧基)丙基)n-2-(精胺甲酰胺基)乙基)-n,n-二甲基三氟乙酸铵(dospa)、双十八烷基酰胺基甘氨酰基羧基精胺(dogs)、1,2-二油酰基-3-二甲基丙胺(dodap)、n,n-二甲基-2,3-二油酰氧基)丙胺(dodma)以及n-(1,2-二肉豆蔻基氧基丙-3-基)-n,n-二甲基-n-羟乙基溴化铵(dmrie)。另外,可获得许多可用于本发明的阳离子脂质的商业制备物。这些包括例如(市售阳离子脂质体,它包含dotma和1,2-二油酰基-sn-3磷酸乙醇胺(dope),来自纽约州格兰德艾兰的gibco/brl公司(gibco/brl,grandisland,n.y.));(市售阳离子脂质体,它包含n-(1-(2,3-二油酰氧基)丙基)-n-(2-(精胺甲酰胺基)乙基)-n,n-二甲基三氟乙酸铵(dospa)和(dope),来自gibco/brl公司);以及(市售阳离子脂质,它在乙醇中包含双十八烷基酰胺基甘氨酰基羧基精胺(dogs),来自威斯康星州麦迪逊的普洛麦格公司(promegacorp.,madison,wis.))。以下脂质是阳离子的并且在低于生理ph的条件下具有正电荷:dodap、dodma、dmdma、1,2-二亚油基氧基-n,n-二甲基氨基丙烷(dlindma)、1,2-二亚麻基氧基-n,n-二甲基氨基丙烷(dlendma)。在一个实施例中,进一步的阳离子脂质是氨基脂质。可用于本发明的合适的氨基脂质包括wo2012/016184中描述的那些,该专利的全部内容以援引方式并入本文。代表性氨基脂质包括但不限于1,2-二亚油基氧基-3-(二甲基氨基)乙酰氧基丙烷(dlin-dac)、1,2-二亚油基氧基-3-吗啉代丙烷(dlin-ma)、1,2-二亚油酰基-3-二甲基氯基丙烷(dlindap)、1,2-二亚油基硫基-3-二甲基氨基丙烷(dlin-s-dma)、1-亚油酰基-2-亚油基氧基-3-二甲基氨基丙烷(dlin-2-dmap)、1,2-二亚油基氧基-3-三甲基氨基丙烷氯化物盐(dlin-tma.cl)、1,2-二亚油酰基-3-三甲基氨基丙烷氯化物盐(dlin-tap.cl)、1,2-二亚油基氧基-3-(n-甲基哌嗪基)丙烷(dlin-mpz)、3-(n,n-二亚油基氨基)-1,2-丙二醇(dlinap)、3-(n,n-二油基氨基)-1,2-丙二醇(doap)、1,2-二亚油基氧代-3-(2-n,n-二甲氨基)乙氧基丙烷(dlin-eg-dma)和2,2-二亚油基-4-二甲基氨基甲基-[1,3]-二氧戊环(dlin-k-dma)。合适的氨基脂质包括具有下式的那些:其中r1和r2是相同或不同的并且独立地为任选取代的c10-c24烷基、任选取代的c10-c24烯基、任选取代的c10-c24炔基、或任选取代的c10-c24酰基;r3和r4是相同或不同的并且独立地为任选取代的c1-c6烷基、任选取代的c2-c6烯基、或任选取代的c2-c6炔基,或者r3和r4可以连接形成4个至6个碳原子和1个或2个选自氮和氧的杂原子的任选取代的杂环;r5不存在或存在,并且当存在时是氢或c1-c6烷基;m、n和p是相同或不同的并且独立地为0或1,条件是m、n和p不同时为0;q为0、1、2、3或4;并且y和z是相同或不同的并且独立地为o、s或nh。在一个实施例中,r1和r2各自为亚油基,并且氨基脂质是二亚油基氨基脂质。在一个实施例中,氨基脂质是二亚油基氨基脂质。代表性的有用的二亚油基氨基脂质具有下式:其中n为0、1、2、3或4。在一个实施例中,阳离子脂质是dlin-k-dma。在一个实施例中,阳离子脂质是dlin-kc2-dma(上述dlin-k-dma,其中n为2)。在一个实施例中,lnp包含(i)如下所定义的式(i)的阳离子脂质组分:或其药学上可接受的盐、互变异构体、前药或立体异构体,以及(ii)包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中该mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。关于mrna化合物、mrna序列和抗原肽或蛋白,参考对这些特征的描述,包括上述相应的选项和偏好。在一个优选的实施例中,mrna化合物不包含核苷修饰。在另一个实施例中,它不包含碱基修饰。在进一步的实施例中,它不包含l-甲基假尿苷修饰。在进一步的实施例中,mrna化合物仅包含天然核苷腺嘌呤、鸟嘌呤、胞嘧啶和尿嘧啶。此外,如果阳离子脂质是如下定义的化合物i-6,则脂质纳米颗粒不是包封编码流感pr8或cal/7/2009血凝素或hiv-1cd4非依赖性r3a包膜蛋白的未修饰的、1-甲基假尿苷修饰的或密码子优化的mrna的,以约50∶10∶38.5∶1.5的比率包含式i-6、dspc、胆固醇和式(iva)的peg脂质的脂质纳米颗粒。关于式(i):l1和l2各自独立地为-o(c=o)-、-(c=o)o-或碳-碳双键;r1a和r1b在每次出现时独立地为(a)h或c1-c12烷基,或者(b)r1a是h或c1-c12烷基,并且r1b和它所结合的碳原子一起与相邻r1b和它所结合的碳原子合在一起形成碳-碳双键;r2a和r2b在每次出现时独立地为(a)h或c1-c12烷基,或者(b)r2a是h或c1-c12烷基,并且r2b和它所结合的碳原子一起与相邻r2b和它所结合的碳原子合在一起形成碳-碳双键;r3a和r3b在每次出现时独立地为(a)h或c1-c12烷基,或者(b)r3a是h或c1-c12烷基,并且r3b和它所结合的碳原子一起与相邻r3b和它所结合的碳原子合在一起形成碳-碳双键;r4a和r4b在每次出现时独立地为(a)h或c1-c12烷基,或者(b)r4a是h或c1-c12烷基,并且r4b和它所结合的碳原子一起与相邻r4b和它所结合的碳原子合在一起形成碳-碳双键;r5和r6各自独立地为甲基或环烷基;r7在每次出现时独立地为h或c1-c12烷基;r8和r9各自独立地为c1-c12烷基;或者r8和r9与它们所附接的氮原子一起形成包含一个氮原子的5、6或7元杂环;a和d各自独立地为从0至24的整数;b和c各自独立地为从1至24的整数;并且e为1或2。在式(i)的某些实施例中,r1a、r2a、r3a或r4a中的至少一者是c1-c12烷基,或者l1或l2中的至少一者是-o(c=o)-或-(c=o)o-。在其他实施例中,r1a和r1b在a为6时不是异丙基,或在a为8时不是正丁基。在式(i)的另外的进一步的实施例中,r1a、r2a、r3a或r4a中的至少一者是c1-c12烷基,或者l1或l2中的至少一者是-o(c=o)-或-(c=o)o-;并且r1a和r1b在a为6时不是异丙基,或在a为8时不是正丁基。在式(i)的其他实施例中,r8和r9各自独立地为未取代的c1-c12烷基;或者r8和r9与它们所附接的氮原子一起形成包含一个氮原子的5、6或7元杂环;在式(i)的某些实施例中,l1或l2中的任一者可以是-o(c=o)-或碳-碳双键。l1和l2可以各自为-o(c=o)-或者可以各自为碳-碳双键。在式(i)的一些实施例中,l1或l2中的一者为-o(c=o)-。在其他实施例中,l1和l2均为-o(c=o)-。在式(i)的一些实施例中,l1或l2中的一者为-(c=o)o-。在其他实施例中,l1和l2均为-(c=o)o-。在式(i)的一些其他实施例中,l1或l2中的一者为碳-碳双键。在其他实施例中,l1和l2均为碳-碳双键。在式(i)的另外其他实施例中,l1或l2中的一者为-o(c=o)-并且l1或l2中的另一者为-(c=o)o-。在更多实施例中,l1或l2中的一者为-o(c=o)-并且l1或l2中的另一者为碳-碳双键。在还更多的实施例中,l1或l2中的一者为-(c=o)o-并且l1或l2中的另一者为碳-碳双键。应当理解,如在整个说明书中使用的“碳-碳”双键是指以下结构之一:其中ra和rb在每次出现时独立地为h或取代基。例如,在一些实施例中,ra和rb在每次出现时独立地为h、c1-c12烷基或环烷基,例如h或c1-c12烷基。在其他实施例中,式(i)的脂质化合物具有以下结构(ia):在其他实施例中,式(i)的脂质化合物具有以下结构(ib):在另外其他实施例中,式(i)的脂质化合物具有以下结构(ic):在式(i)的脂质化合物的某些实施例中,a、b、c和d各自独立地为从2至12的整数或从4至12的整数。在其他实施例中,a、b、c和d各自独立地为从8至12或5至9的整数。在某些实施例中,a为0。在一些实施例中,a为1。在其他实施例中,a为2。在更多实施例中,a为3。在另外其他实施例中,a为4。在一些实施例中,a为5。在其他实施例中,a为6。在更多实施例中,a为7。在另外其他实施例中,a为8。在一些实施例中,a为9。在其他实施例中,a为10。在更多实施例中,a为11。在另外其他实施例中,a为12。在一些实施例中,a为13。在其他实施例中,a为14。在更多实施例中,a为15。在另外其他实施例中,a为16。在式(i)的一些其他实施例中,b为1。在其他实施例中,b为2。在更多实施例中,b为3。在另外其他实施例中,b为4。在一些实施例中,b为5。在其他实施例中,b为6。在更多实施例中,b为7。在另外其他实施例中,b为8。在一些实施例中,b为9。在其他实施例中,b为10。在更多实施例中,b为11。在另外其他实施例中,b为12。在一些实施例中,b为13。在其他实施例中,b为14。在更多实施例中,b为15。在另外其他实施例中,b为16。在式(i)的一些更多实施例中,c为1。在其他实施例中,c为2。在更多实施例中,c为3。在另外其他实施例中,c为4。在一些实施例中,c为5。在其他实施例中,c为6。在更多实施例中,c为7。在另外其他实施例中,c为8。在一些实施例中,c为9。在其他实施例中,c为10。在更多实施例中,c为11。在另外其他实施例中,c为12。在一些实施例中,c为13。在其他实施例中,c为14。在更多实施例中,c为15。在另外其他实施例中,c为16。在式(i)的一些其他实施例中,d为0。在一些实施例中,d为1。在其他实施例中,d为2。在更多实施例中,d为3。在另外其他实施例中,d为4。在一些实施例中,d为5。在其他实施例中,d为6。在更多实施例中,d为7。在另外其他实施例中,d为8。在一些实施例中,d为9。在其他实施例中,d为10。在更多实施例中,d为11。在另外其他实施例中,d为12。在一些实施例中,d为13。在其他实施例中,d为14。在更多实施例中,d为15。在另外其他实施例中,d为16。在式(i)的一些其他多种实施例中,a和d是相同的。在一些其他实施例中,b和c是相同的。在一些其他具体实施例中,a和d是相同,b和c是相同的。式(i)中a和b的总和以及c和d的总和是可以改变以获得具有所需性质的式i的脂质的因子。在一个实施例中,选择a和b使得它们的总和为14至24范围内的整数。在其他实施例中,选择c和d使得它们的总和为14至24范围内的整数。在进一步的实施例中,a和b的总和以及c和d的总和是相同的。例如,在一些实施例中,a和b的总和以及c和d的总和均为可以在14至24范围内的相同整数。在另外更多实施例中,选择a、b、c和d,使得a和b的总和以及c和d的总和为12或更大。在式(i)的一些实施例中,e为1。在其他实施例中,e为2。式(i)的r1a、r2a、r3a和r4a的取代基没有特别限制。在某些实施例中,r1a、r2a、r3a和r4a在每次出现时为h。在某些其他实施例中,r1a、r2a、r3a和r4a中的至少一者为c1-c12烷基。在某些其他实施例中,r1a、r2a、r3a和r4a中的至少一者为c1-c8烷基。在某些其他实施例中,r1a、r2a、r3a和r4a中的至少一者为c1-c6烷基。在一些前述实施例中,c1-c8烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正己基或正辛基。在式(i)的某些实施例中,r1a、r1b、r4a和r4b在每次出现时为c1-c12烷基。在式(i)的进一步实施例中,r1b、r2b、r3b和r4b中的至少一者为h,或r1b、r2b、r3b和r4b在每次出现时均为h。在式(i)的某些实施例中,r1b和它所结合的碳原子一起与相邻r1b和它所结合的碳原子合在一起形成碳-碳双键。在其他实施例中,前述r4b和它所结合的碳原予一起与相邻r4b和它所结合的碳原子合在一起形成碳-碳双键。式(i)的r5和r6的取代基在前述实施例中没有特别限制。在某些实施例中,r5或r6中的一者或两者为甲基。在某些其他实施例中,r5或r6中的一者或两者为环烷基,例如环己基。在这些实施例中,环烷基可以是取代的或不是取代的。在某些其他实施例中,环烷基被c1-c12烷基(例如叔丁基)取代。r7的取代基在式(i)的前述实施例中没有特别限制。在某些实施例中,至少一个r7为h。在一些其他实施例中,r7在每次出现时均为h。在某些其他实施例中,r7为c1-c12烷基。在式(i)的某些其他前述实施例中,r8或r9中的一者为甲基。在其他实施例中,r8和r9均为甲基。在式(i)的一些不同实施例中,r8和r9与它们所附接的氮原子一起形成5、6或7元杂环。在前述一些实施例中,r8和r9与它们所附接的氮原子一起形成5元杂环,例如吡咯烷基环。在多种不同的实施例中,式(i)的脂质具有下表7(“式(i)的代表性脂质”)中列出的结构之一。表7:式(i)的代表性脂质在一些实施例中,lnp包含式(i)的脂质、如本文所定义的mrna化合物和一种或多种选自中性脂质、类固醇和聚乙二醇化脂质的赋形剂。在一些实施例中,式(i)的脂质是化合物i-5。在一些实施例中,式(i)的脂质是化合物i-6。在另一个实施例中,脂质纳米颗粒包含(i)如下进一步定义的具有式(ii)的结构的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体,以及(ii)包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。关于mrna化合物、mrna序列和抗原肽或蛋白,参考对这些特征的描述,包括上述相应的选项和偏好。在一个优选的实施例中,mrna化合物不包含核苷修饰。在另一个实施例中,它不包含碱基修饰。在进一步的实施例中,它不包含1-甲基假尿苷修饰。在进一步的实施例中,mrna化合物仅包含天然存在的核苷腺嘌呤、鸟嘌呤、胞嘧啶和尿嘧啶。式(ii)进一步定义为:l1和l2各自独立地为-o(c=o)-、-(c=o)o-、-c(=o)-、-o-、-s(o)x-、-s-s-、-c(=o)s-、-sc(=o)-、-nrac(=o)-、-c(=o)nra-、-nrac(=o)nra、-oc(=o)nra-、-nrac(=o)o-或直接键;g1为c1-c2亚烷基、-(c=o)-、-o(c=o)-、-sc(=o)-、-nrac(=o)-或直接键;g2为-c(=o)-、-(c=o)o-、-c(=o)s-、-c(=o)nra或直接键;g3为c1-c6亚烷基;ra为h或c1-c12烷基;r1a和r1b在每次出现时独立地为:(a)h或c1-c12烷基;或(b)r1a为h或c1-c12烷基,并且r1b和它所结合的碳原子一起与相邻r1b和它所结合的碳原子合在一起形成碳-碳双键;r2a和r2b在每次出现时独立地为:(a)h或c1-c12烷基;或(b)r2a为h或c1-c12烷基,并且r2b和它所结合的碳原子一起与相邻r2b和它所结合的碳原子合在一起形成碳-碳双键;r3a和r3b在每次出现时独立地为:(a)h或c1-c12烷基;或(b)r3a为h或c1-c12烷基,并且r3b和它所结合的碳原子一起与相邻r3b和它所结合的碳原子合在一起形成碳-碳双键;r4a和r4b在每次出现时独立地为:(a)h或c1-c12烷基;或(b)r4a为h或c1-c12烷基,并且r4b和它所结合的碳原子一起与相邻r4b和它所结合的碳原子合在一起形成碳-碳双键;r5和r6各自独立地为h或甲基;r7为c4-c20烷基;r8和r9各自独立地为c1-c12烷基;或者r8和r9与它们所附接的氮原子一起形成5、6或7元杂环;a、b、c和d各自独立地为从1至24的整数;并且x为0、1或2。在式(ii)的一些实施例中,l1和l2各自独立地为-o(c=o)-、-(c=o)o-或直接键。在其他实施例中,g1和g2各自独立地为-(c=o)-或直接键。在一些不同的实施例中,l1和l2各自独立地为-o(c=o)-、-(c=o)o-或直接键;并且g1和g2各自独立地为-(c=o)-或直接键。在式(ii)的一些不同实施例中,l1和l2各自独立地为-c(=o)-、-o-、-s(o)x-、-s-s-、-c(=o)s-、-sc(=o)-、-nra-、-nrac(=o)-、-c(=o)nra-、-nrac(=o)nra、-oc(=o)nra-、-nrac(=o)o-、-nras(o)xnra-、-nras(o)x-或-s(o)xnra-。在式(ii)的其他前述实施例中,脂质化合物具有以下结构(iia)或(iib)之一:在式(ii)的一些实施例中,脂质化合物具有结构(iia)。在其他实施例中,脂质化合物具有结构(iib)。在任何前述式(ii)的实施例中,l1或l2中的一者为-o(c=o)-。例如,在一些实施例中,l1和l2中的每一者为-o(c=o)-。在式(ii)的一些不同实施例中,l1或l2中的一者为-(c=o)o-。例如,在一些实施例中,l1和l2中的每一者为-(c=o)o-。在式(ii)的不同实施例中,l1或l2中的一者为直接键。如本文所用,“直接键”是指不存在基团(例如,l1或l2)。例如,在一些实施例中,l1和l2中的每一者为直接键。在式(ii)的其他不同实施例中,对于r1a和r1b的至少一次出现,r1a为h或c1-c12烷基,并且r1b和它所结合的碳原子一起与相邻r1b和它所结合的碳原子合在一起形成碳-碳双键。在式(ii)的另外其他不同实施例中,对于r4a和r4b的至少一次出现,r4a为h或c1-c12烷基,并且r4b和它所结合的碳原子一起与相邻r4b和它所结合的碳原子合在一起形成碳-碳双键。在式(ii)的更多实施例中,对于r2a和r2b的至少一次出现,r2a为h或c1-c12烷基,并且r2b和它所结合的碳原子一起与相邻r2b和它所结合的碳原子合在一起形成碳-碳双键。在式(ii)的其他不同实施例中,对于r3a和r3b的至少一次出现,r3a为h或c1-c12烷基,并且r3b和它所结合的碳原子一起与相邻r3b和它所结合的碳原子合在一起形成碳-碳双键。在式(ii)的多种其他实施例中,脂质化合物具有以下结构(iic)或(iid)之一:其中e、f、g和h各自独立地为从1至12的整数。在式(ii)的一些实施例中,脂质化合物具有结构(iic)。在其他实施例中,脂质化合物具有结构(iid)。在结构(iic)或(iid)的多种实施例中,e、f、g和h各自独立地为从4至10的整数。在式(ii)的某些实施例中,a、b、c和d各自独立地为从2至12的整数或从4至12的整数。在其他实施例中,a、b、c和d各自独立地为从8至12或5至9的整数。在某些实施例中,a为0。在一些实施例中,a为1。在其他实施例中,a为2。在更多实施例中,a为3。在另外其他实施例中,a为4。在一些实施例中,a为5。在其他实施例中,a为6。在更多实施例中,a为7。在另外其他实施例中,a为8。在一些实施例中,a为9。在其他实施例中,a为10。在更多实施例中,a为11。在另外其他实施例中,a为12。在一些实施例中,a为13。在其他实施例中,a为14。在更多实施例中,a为15。在另外其他实施例中,a为16。在式(ii)的一些实施例中,b为1。在其他实施例中,b为2。在更多实施例中,b为3。在另外其他实施例中,b为4。在一些实施例中,b为5。在其他实施例中,b为6。在更多实施例中,b为7。在另外其他实施例中,b为8。在一些实施例中,b为9。在其他实施例中,b为10。在更多实施例中,b为11。在另外其他实施例中,b为12。在一些实施例中,b为13。在其他实施例中,b为14。在更多实施例中,b为15。在另外其他实施例中,b为16。在式(ii)的一些实施例中,c为1。在其他实施例中,c为2。在更多实施例中,c为3。在另外其他实施例中,c为4。在一些实施例中,c为5。在其他实施例中,c为6。在更多实施例中,c为7。在另外其他实施例中,c为8。在一些实施例中,c为9。在其他实施例中,c为10。在更多实施例中,c为11。在另外其他实施例中,c为12。在一些实施例中,c为13。在其他实施例中,c为14。在更多实施例中,c为15。在另外其他实施例中,c为16。在式(ii)的某些实施例中,d为0。在一些实施例中,d为1。在其他实施例中,d为2。在更多实施例中,d为3。在另外其他实施例中,d为4。在一些实施例中,d为5。在其他实施例中,d为6。在更多实施例中,d为7。在另外其他实施例中,d为8。在一些实施例中,d为9。在其他实施例中,d为10。在更多实施例中,d为11。在另外其他实施例中,d为12。在一些实施例中,d为13。在其他实施例中,d为14。在更多实施例中,d为15。在另外其他实施例中,d为16。在式(ii)的一些实施例中,e为1。在其他实施例中,e为2。在更多实施例中,e为3。在另外其他实施例中,e为4。在一些实施例中,e为5。在其他实施例中,e为6。在更多实施例中,e为7。在另外其他实施例中,e为8。在一些实施例中,e为9。在其他实施例中,e为10。在更多实施例中,e为11。在另外其他实施例中,e为12。在式(ii)的一些实施例中,f为1。在其他实施例中,f为2。在更多实施例中,f为3。在另外其他实施例中,f为4。在一些实施例中,f为5。在其他实施例中,f为6。在更多实施例中,f为7。在另外其他实施例中,f为8。在一些实施例中,f为9。在其他实施例中,f为10。在更多实施例中,f为11。在另外其他实施例中,f为12。在式(ii)的一些实施例中,g为1。在其他实施例中,g为2。在更多实施例中,g为3。在另外其他实施例中,g为4。在一些实施例中,g为5。在其他实施例中,g为6。在更多实施例中,g为7。在另外其他实施例中,g为8。在一些实施例中,g为9。在其他实施例中,g为10。在更多实施例中,g为11。在另外其他实施例中,g为12。在式(ii)的一些实施例中,h为1。在其他实施例中,e为2。在更多实施例中,h为3。在另外其他实施例中,h为4。在一些实施例中,e为5。在其他实施例中,h为6。在更多实施例中,h为7。在另外其他实施例中,h为8。在一些实施例中,h为9。在其他实施例中,h为10。在更多实施例中,h为11。在另外其他实施例中,h为12。在式(ii)的一些其他多种实施例中,a和d是相同的。在一些其他实施例中,b和c是相同的。在一些其他具体实施例中,a和d是相同的,并且b和c是相同的。式(ii)的a和b的总和以及c和d的总和是可以改变以获得具有所需性质的脂质的因子。在一个实施例中,选择a和b使得它们的总和为14至24范围内的整数。在其他实施例中,选择c和d使得它们的总和为14至24范围内的整数。在进一步的实施例中,a和b的总和以及c和d的总和是相同的。例如,在一些实施例中,a和b的总和以及c和d的总和均为可以在14至24范围内的相同整数。在另外更多实施例中,选择a、b、c和d,使得a和b的总和以及c和d的总和为12或更大。式(ii)的r1a、r2a、r3a和r4a的取代基没有特别限制。在一些实施例中,r1a、r4a、r3a和r4a中的至少一者为h。在某些实施例中,r1a、r2a、r3a和r4a在每次出现时为h。在某些其他实施例中,r1a、r2a、r3a和r4a中的至少一者为c1-c12烷基。在某些其他实施例中,r1a、r2a、r3a和r4a中的至少一者为c1-c8烷基。在某些其他实施例中,r1a、r2a、r3a和r4a中的至少一者为c1-c6烷基。在一些前述实施例中,c1-c8烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正己基或正辛基。在式(ii)的某些实施例中,r1a、r1b、r4a和r4b在每次出现时为c1-c12烷基。在式(ii)的进一步实施例中,r1b、r2b、r3b和r4b中的至少一者为h,或r1b、r2b、r3b和r4b在每次出现时均为h。在式(ii)的某些实施例中,r1b和它所结合的碳原子一起与相邻r1b和它所结合的碳原子合在一起形成碳-碳双键。在其他实施例中,前述r4b和它所结合的碳原子一起与相邻r4b和它所结合的碳原子合在一起形成碳-碳双键。式(ii)的r5和r6的取代基在前述实施例中没有特别限制。在某些实施例中,r5或r6中的一者为甲基。在其他实施例中,r5或r6中的每一者为甲基。式(ii)的r7的取代基在前述实施例中没有特别限制。在某些实施例中,r7为c6-c16烷基。在一些其他实施例中,r7为c6-c9烷基。在这些实施例的一些中,r7被-(c=o)orb、-o(c=o)rb、-c(=o)rb、-orb、-s(o)xrb、-s-srb、-c(=o)srb、-sc(=o)rb、-nrarb、-nrac(=o)rb、-c(=o)nrarb、-nrac(=o)nrarb、-oc(=o)nrarb、-nrac(=o)orb、-nras(o)xnrarb、-nras(o)xrb或-s(o)xnrarb取代,其中:ra为h或c1-c12烷基;rb为c1-c15烷基;并且x为0、1或2。例如,在一些实施例中,r7被-(c=o)orb或-o(c=o)rb取代。在式(ii)的多种前述实施例中,rb是支化的c1-c15烷基。例如,在一些实施例中,rb具有以下结构之一:在式(ii)的某些其他前述实施例中,r8或r9中的一者为甲基。在其他实施例中,r8和r9均为甲基。在式(ii)的一些不同实施例中,r8和r9与它们所附接的氮原子一起形成5、6或7元杂环。在前述一些实施例中,r8和r9与它们所附接的氮原子一起形成5元杂环,例如吡咯烷基环。在前述一些不同实施例中,r8和r9与它们所附接的氮原子一起形成6元杂环,例如哌嗪基环。在前述式(ii)的脂质的另外其他实施例中,g3为c2-c4亚烷基,例如c3亚烷基。在多种不同的实施例中,脂质化合物具有下表8(“式(ii)的代表性脂质”)中列出的结构之一。表8:式(ii)的代表性脂质在一些实施例中,lnp包含式(ii)的脂质、如上所述的mrna化合物和一种或多种选自中性脂质、类固醇和聚乙二醇化脂质的赋形剂。在一些实施例中,式(ii)的脂质是化合物ii-9。在一些实施例中,式(ii)的脂质是化合物ii-10。在一些实施例中,式(ii)的脂质是化合物ii-11。在一些实施例中,式(ii)的脂质是化合物ii-12。在一些实施例中,式(ii)的脂质是化合物ii-32。在进一步的实施例中,lnp包含(i)如下进一步定义的式(iii)的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体,以及(ii)包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。关于mrna化合物、mrna序列和抗原肽或蛋白,参考对这些特征的描述,包括上述相应的选项和偏好。在一个优选的实施例中,mrna化合物不包含核苷修饰。在另一个实施例中,它不包含碱基修饰。在进一步的实施例中,它不包含1-甲基假尿苷修饰。在又一个进一步的实施例中,mrna化合物仅包含天然核苷腺嘌呤、鸟嘌呤、胞嘧啶和尿嘧啶。式(iii)进一步定义为:l1或l2中的一者为-o(c=o)-、-(c=o)o-、-c(=o)-、-o-、-s(o)x-、-s-s-、-c(=o)s-、sc(=o)-、-nrac(=o)-、-c(=o)nra-、-nrac(=o)nra-、-oc(=o)nra-或-nrac(=o)o-,并且l1或l2中的另一者为-o(c=o)-、-(c=o)o-、-c(=o)-、-o-、-s(o)x-、-s-s-、-c(=o)s-、sc(=o)-、-nrac(=o)-、-c(=o)nra-、-nrac(=o)nra-、-oc(=o)nra-或-nrac(=o)o-或直接键;g1和g2各自独立地为未取代的c1-c12亚烷基或c1-c12亚烯基;g3为c1-c24亚烷基、c1-c24亚烯基、c3-c8亚环烷基、c3-c8亚环烯基;ra为h或c1-c12烷基;r1和r2各自独立地为c6-c24烷基或c6-c24烯基;r3为h、or5、cn、-c(=o)or4、-oc(=o)r4或-nr5c(=o)r4;r4为c1-c12烷基;r5为h或c1-c6烷基;并且x为0、1或2。在一些前述式(iii)的实施例中,脂质具有以下结构(iiia)或(iiib)之一:其中:a为3至8元环烷基或亚环烷基环;r6在每次出现时独立地为h、oh或c1-c24烷基;n为从1至15范围内的整数。在一些前述式(iii)的实施例中,脂质具有结构(iiia),并且在其他实施例中,脂质具有结构(iiib)。在式(iii)的其他实施例中,脂质具有以下结构(iiic)或(iiid)之一:其中y和z各自独立地为从1至12范围内的整数。在任何前述式(iii)的实施例中,l1或l2中的一者为-o(c=o)-。例如,在一些实施例中,l1和l2中的每一者为-o(c=o)-。在任何前述一些不同的实施例中,l1和l2各自独立地为-(c=o)o-或-o(c=o)-。例如,在一些实施例中,l1和l2中的每一者为-(c=o)o-。在式(iii)的一些不同实施例中,脂质具有以下结构(iiie)或(iiif)之一:在一些前述式(iii)的实施例中,脂质具有以下结构(iiig)、(iiih)、(iiii)或(iiij)之一:在一些前述式(iii)的实施例中,n为从2至12范围内的整数,例如从2至8或从2至4。例如,在一些实施例中,n为3、4、5或6。在一些实施例中,n为3。在一些实施例中,n为4。在一些实施例中,n为5。在一些实施例中,n为6。在前述式(iii)的一些其他实施例中,y和z各自独立地为从2至10范围内的整数。例如,在一些实施例中,y和z各自独立地为从4至9或从4至6范围内的整数。在一些前述式(iii)的实施例中,r6为h。在其他前述实施例中,r6为c1-c24烷基。在其他实施例中,r6为oh。在式(iii)的一些实施例中,g3是未取代的。在其他实施例中,g3被取代。在多种不同的实施例中,g3为线性c1-c24亚烷基或线性c1-c24亚烯基。在式(iii)的一些其他前述实施例中,r1或r2、或两者为c6-c24烯基。例如,在一些实施例中,r1和r2各自独立地具有以下结构:其中:r7a和r7b在每次出现时独立地为h或c1-c12烷基;并且a为从2至12的整数,其中r7a、r7b和a各自的选择使得r1和r2各自独立地包含从6个至20个碳原子。例如,在一些实施例中,a为从5至9或从8至12范围内的整数。在一些前述式(iii)的实施例中,r7a的至少一次出现为h。例如,在一些实施例中,r7a在每次出现时均为h。在前述其他不同实施例中,r7b的至少一次出现为c1-c8烷基。例如,在一些实施例中,c1-c8烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正己基或正辛基。在式(iii)的不同实施例中,r1或r2或两者具有以下结构之一:在一些前述式(iii)的实施例中,r3为oh、cn、-c(=o)or4、-oc(=o)r4或-nhc(=o)r4。在一些实施例中,r4为甲基或乙基。在多种不同的实施例中,式(iii)的阳离子脂质具有下表9(“式(iii)的代表性化合物”)中列出的结构之一。表9:式(iii)的代表性化合物在一些实施例中,lnp包含式(iii)的脂质、如本文所述的mrna化合物和一种或多种选自中性脂质、类固醇和聚乙二醇化脂质的赋形剂。在一些实施例中,式(iii)的脂质是化合物iii-3。在一些实施例中,式(iii)的脂质是化合物iii-7。在本发明的上下文中,根据上表,lnp-iii-3是指包含阳离子脂质化合物iii-3的如本文所定义的脂质纳米颗粒。其他脂质纳米颗粒以类似形式提及。在某些实施例中,相对于lnp的总脂质含量,式(i)、(ii)或(iii)的阳离子脂质以从约30摩尔%至约95摩尔%的量存在于lnp中。如果在lnp内掺入一种以上的阳离子脂质,则此类百分比适用于组合的阳离子脂质。在一个实施例中,阳离子脂质以从约30摩尔%至约70摩尔%的量存在于lnp中。在一个实施例中,阳离子脂质分别以从约40摩尔%至约60摩尔%的量存在于lnp中,例如约40摩尔%、41摩尔%、42摩尔%、43摩尔%、44摩尔%、45摩尔%、46摩尔%、47摩尔%、48摩尔%、49摩尔%、50摩尔%、51摩尔%、52摩尔%、53摩尔%、54摩尔%、55摩尔%、56摩尔%、57摩尔%、58摩尔%、59摩尔%或60摩尔%。在本发明的一些实施例中,lnp包含上述任何脂质的组合或混合物。在一个优选的实施例中,脂质纳米颗粒包含选自下组的阳离子脂质:在进一步的实施例中,本发明涉及含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含:(i)具有式(iv)的peg脂质其中r8和r9各自独立地为含有从10至30个碳原子的直链或支链、饱和或不饱和烷基链,其中该烷基链任选地被一个或多个酯键中断;并且w具有从30至60范围内的平均值;并且(ii)包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物;其中该mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。关于mrna化合物、mrna序列和抗原肽或蛋白,参考对这些特征的描述,包括上述相应的选项和偏好。在一个优选的实施例中,mrna化合物不包含核苷修饰。在另一个实施例中,它不包含碱基修饰。在进一步的实施例中,它不包含1-甲基假尿苷修饰。此外,如果peg脂质是化合物(iva),则脂质纳米颗粒不是包封编码流感pr8或cal/7/2009血凝素或hiv-1cd4非依赖性r3a包膜蛋白的未修饰的、1-甲基假尿苷修饰的或密码子优化的mrna的,以约50∶10∶38.5∶1.5的比率包含化合物i-6、dspc、胆固醇和peg脂质(iva)的脂质纳米颗粒。在一个优选的实施例中,脂质纳米颗粒包含(i)如上所定义的根据式(i)、(ii)或(iii)的阳离子脂质,(ii)如本文所述的包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,以及(iii)式(iv)的peg脂质;其中该mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。还应考虑核酸货物的量来选择永久性阳离子脂质或类脂质的量。在一个实施例中,选择这些量以使得纳米颗粒或组合物的n/p比在从约0.1至约20的范围内。在此上下文下,n/p比定义为脂质或类脂质的碱性含氮基团的氮原子(“n”)与用作货物的核酸的磷酸基团(“p”)的摩尔比。可以基于例如1μgrna典型地含有约3nmol的磷酸残基来计算n/p比,条件是rna表现出碱基的统计分布。脂质或类脂质的“n”值可以基于其分子量和永久阳离子基团与若存在的可阳离子化基团的相对含量来计算。通常认为此类低n/p比率对此类载剂-货物复合物或核酸负载的纳米颗粒的性能和体内功效是有害的。然而,发明人发现此类n/p比率确实可用在本发明的上下文中,特别是当意图进行纳米颗粒的局部或血管外施用时。在此,已发现相应的纳米颗粒是有效的同时具有良好的耐受性。在某些实施例中,lnp包含一种或多种另外的脂质,所述脂质在颗粒形成期间稳定颗粒的形成。合适的稳定脂质包括中性脂质和阴离子脂质。术语“中性脂质”是指在生理ph下以不带电或中性两性离子形式存在的许多脂质物质中的任一种。代表性的中性脂质包括二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、二氢鞘磷脂、脑磷脂和脑苷脂。示例性中性脂质包括例如二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二棕榈酰磷脂酰胆碱(dppc)、二油酰磷脂酰甘油(dopg)、二棕榈酰磷脂酰甘油(dppg)、二油酰磷脂酰乙醇胺(dope)、棕榈酰油酰磷脂酰胆碱(popc)、棕榈酰油酰磷脂酰乙醇胺(pope)和二油酰磷脂酰乙醇胺4-(n-马来酰亚胺甲基)-环己烷-1-羧酸酯(dope-mal)、二棕榈酰磷脂酰乙醇胺(dppe)、二肉豆蔻酰磷酸乙醇胺(dmpe)、二硬脂酰磷脂酰乙醇胺(dspe)、16-o-单甲基pe、16-o-二甲基pe、18-1-反式pe、1-硬脂酰-2-油酰磷脂酰乙醇胺(sope)和1,2-二油酰-sn-甘油-3-磷酸乙醇胺(反式dope)。在一个实施例中,中性脂质是1,2-二硬脂酰基-sn-甘油基-3磷酸胆碱(dspc)。在一些实施例中,lnp包含选自dspc、dppc、dmpc、dopc、popc、dope和sm的中性脂质。在多种实施例中,阳离子脂质(例如,式(i)、(ii)或(iii)的脂质)与中性脂质的摩尔比在从约2∶1至约8∶1的范围内。在多种实施例中,lnp进一步包含类固醇或类固醇类似物。“类固醇”是包含以下碳骨架的化合物:在某些实施例中,类固醇或类固醇类似物是胆固醇。在这些实施例的一些中,阳离子脂质(例如,式(i)、(ii)或(iii)的脂质)与胆固醇的摩尔比在从约5∶1至1∶1的范围内。术语“阴离子脂质”是指在生理ph下带负电荷的任何脂质。这些脂质包括磷脂酰甘油、心磷脂、二酰基磷脂酰丝氨酸、二酰基磷脂酸、n-癸酰基磷脂酰乙醇胺、n-琥珀酰基磷脂酰乙醇胺、n-戊二酰基磷脂酰乙醇胺、赖氨酰磷脂酰甘油、棕榈酰油酰基磷脂酰甘油(popg)和与中性脂质连接的其他阴离子修饰基团。在某些实施例中,lnp包含糖脂(例如,单唾液酸神经节苷脂gm1)。在一些实施例中,lnp包含聚合物缀合的脂质。术语“聚合物缀合的脂质”是指包含脂质部分和聚合物部分两者的分子。聚合物缀合的脂质的实例是聚乙二醇化的脂质。术语“聚乙二醇化脂质”是指包含脂质部分和聚乙二醇部分两者的分子。聚乙二醇化脂质是本领域已知的,并且包括1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻酰基甘油(peg-s-dmg)等。在某些实施例中,lnp包含另外的稳定脂质,它是聚乙二醇-脂质(聚乙二醇化脂质)。合适的聚乙二醇脂质包括peg修饰的磷脂酰乙醇胺、peg修饰的磷脂酸、peg修饰的神经酰胺(例如peg-cerc14或peg-cerc20)、peg修饰的二烷基胺、peg修饰的二酰基甘油、peg修饰的二烷基甘油。代表性的聚乙二醇-脂质包括peg-c-domg、peg-c-dma和peg-s-dmg。在一个实施例中,聚乙二醇-脂质是n-[(甲氧基聚(乙二醇)2000)氨基甲酰基]-1,2-二肉豆蔻基氧基丙基-3-胺(peg-c-dma)。在一个实施例中,聚乙二醇-脂质是peg-c-domg。在其他实施例中,lnp包含聚乙二醇化二酰基甘油(peg-dag),例如1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻酰基甘油(peg-dmg);聚乙二醇化磷脂酰乙醇胺(peg-pe);peg琥珀酸二酰基甘油(peg-s-dag),例如4-o-(2′,3′-二(十四烷酰氧基)丙基-1-o-(ω-甲氧基(聚乙氧基)乙基)丁二酸酯(peg-s-dmg);聚乙二醇化神经酰胺(peg-cer);或peg-二烷氧基丙基氨基甲酸酯,例如ω-甲氧基(聚乙氧基)乙基-n-(2,3-二(十四烷氧基)丙基)氨基甲酸酯或2,3-二(十四烷氧基)丙基-n-(ω-甲氧基)聚乙氧基)乙基)氨基甲酸酯。在多种实施例中,阳离子脂质与聚乙二醇化脂质的摩尔比在从约100∶1至约25∶1的范围内。如上所述,含有mrna的脂质纳米颗粒可包含具有式(iv)的结构的聚乙二醇化脂质:或其药学上可接受的盐、互变异构体或立体异构体,其中:r8和r9各自独立地为含有从10至30个碳原子的直链或支链、饱和或不饱和烷基链,其中该烷基链任选地被一个或多个酯键中断;并且w具有从30至60范围内的平均值。在聚乙二醇化脂质(iv)的一些前述实施例中,当w为42时,r8和r9不都是正十八烷基。在一些其他实施例中,r8和r9各自独立地为含有从10个至18个碳原子的直链或支链、饱和或不饱和的烷基链。在一些实施例中,r8和r9各自独立地为含有从12个至16个碳原子的直链或支链、饱和或不饱和的烷基链。在一些实施例中,r8和r9各自独立地为含有12个碳原子的直链或支链、饱和或不饱和的烷基链。在一些实施例中,r8和r9各自独立地为含有14个碳原子的直链或支链、饱和或不饱和的烷基链。在其他实施例中,r8和r9各自独立地为含有16个碳原子的直链或支链、饱和或不饱和的烷基链。在另外更多实施例中,r8和r9各自独立地为含有18个碳原子的直链或支链、饱和或不饱和的烷基链。在另外其他实施例中,r8为含有12个碳原子的直链或支链、饱和或不饱和的烷基链,并且r9为含有14个碳原子的直链或支链、饱和或不饱和的烷基链。在多种实施例中,w横跨一定的范围,该范围的选择使得(iv)的peg部分具有约400g/mol至约6000g/mol的平均分子量。在一些实施例中,平均w为约50。在优选的实施例中,r8和r9为饱和烷基链。在进一步优选的实施例中,peg脂质具有式(iva)其中n具有从30至60范围内的平均值,例如约30±2、32±2、34±2、36±2、38±2、40±2、42±2、44±2、46±2、48±2、50±2、52±2、54±2、56±2、58±2或60±2。在最优选的实施例中,n为约49。在其他实施例中,聚乙二醇化脂质具有以下结构之一:其中n为整数,其选择使得聚乙二醇化脂质的平均分子量为约2500g/mol,最优选n为约49。在某些实施例中,相对于纳米颗粒的总脂质含量,peg脂质以从约1摩尔%至约10摩尔%的量存在于lnp中。在一个实施例中,peg脂质以从约1摩尔%至约5摩尔%的量存在于lnp中。在一个实施例中,peg脂质以约1摩尔%或约1.5摩尔%存在于lnp中。在某些实施例中,lnp包含一个或多个能够将lnp靶向细胞或细胞群的靶向部分。例如,在一个实施例中,靶向部分是将lnp导向细胞表面上发现的受体的配体。在某些实施例中,lnp包含一个或多个内化结构域。例如,在一个实施例中,lnp包含一个或多个结合到细胞以诱导lnp内化的结构域。例如,在一个实施例中,一个或多个内化结构域与细胞表面上发现的受体结合,以诱导受体介导的lnp摄取。在某些实施例中,lnp能够在体内结合生物分子,其中lnp结合的生物分子然后可被细胞表面受体识别以诱导内化。例如,在一个实施例中,lnp结合全身性apoe,这导致lnp和相关货物的摄取。其他示例性lnp及其制造在本领域中有所描述,例如在以下文献中有所描述:美国专利申请公布no.us20120276209;semple等人,2010,natbiotechnol.[自然-生物技术],28(2):172-176;akinc等人,2010,molther.[分子疗法],18(7):1357-1364;basha等人,2011,molther[分子疗法],19(12):2186-2200;leung等人,2012,jphyschemcnanomaterinterfaces[物理化学杂志,c辑:纳米材料与界面],116(34):18440-18450;lee等人,2012,intjcancer.[国际癌症杂志],131(5):e781-90;belliveau等人,2012,molthernucleicacids[分子疗法-核酸],1:e37;jayaraman等人,2012,angewchemintedengl.[应用化学英文国际版],51(34):8529-8533;mui等人,2013,molthernucleicacids[分子疗法-核酸],2,e139;maier等人,2013,molther.[分子疗法],21(8):1570-1578;以及tam等人,2013,nanomedicine[纳米医学],9(5):665-74,这些文献中的每一者整体以援引方式并入。在优选的实施例中,脂质纳米颗粒具有从约30nm至约150nm、从约40nm至约150nm、从约50nm至约150nm、从约60nm至约130nm、从约70nm至约110nm、从约70nm至约100nm、从约80nm至约100nm、从约90nm至约100nm、从约70至约90nm、从约80nm至约90nm、从约70nm至约80nm、或约30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、75nm、80nm、85nm、90nm、95nm、100nm、105nm、110nm、115nm、120nm、125nm、130nm、135nm、140nm、145nm、或150nm的平均直径,并且基本上无毒。如上所述,平均直径可以对应于由动态光散射确定的z-平均值。在本发明的另一个优选实施例中,脂质纳米颗粒分别具有从约50nm至约300nm、或从约60nm至约250nm、从约60nm至约150nm、或从约60nm至约120nm范围内的流体动力学直径。在某些实施例中,mrna当存在于脂质纳米颗粒中时在水溶液中耐核酸酶降解。脂质纳米颗粒中的mrna的总量可以变化,并且可以根据mrna与总脂质的w/w比来定义。在本发明的一个实施例中,mrna与总脂质比率小于0.06w/w,优选在0.03w/w与0.04w/w之间。在一些实施例中,lnp包含式(i)、(ii)或(iii)的脂质、如上所定义的mrna化合物、中性脂质、类固醇和聚乙二醇化脂质。在一些实施例中,式(i)的脂质是化合物i-6,或式(iii)的脂质是化合物iii-3,中性脂质是dspc,类固醇是胆固醇,并且聚乙二醇化脂质是式(iva)的化合物。在某些实施例中,lnp包含一个或多个能够将lnp靶向细胞或细胞群的靶向部分。例如,在一个实施例中,靶向部分是将lnp导向细胞表面上发现的受体的配体。在某些实施例中,lnp包含一个或多个内化结构域。例如,在一个实施例中,lnp包含一个或多个结合到细胞以诱导lnp内化的结构域。例如,在一个实施例中,一个或多个内化结构域与细胞表面上发现的受体结合,以诱导受体介导的lnp摄取。在某些实施例中,lnp能够在体内结合生物分子,其中lnp结合的生物分子然后可被细胞表面受体识别以诱导内化。例如,在一个实施例中,lnp结合全身性apoe,这导致lnp和相关货物的摄取。特别地,本发明涉及以下非限制性具体实施例。在优选的实施例中,本发明涉及含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含如上所定义的根据式(i)、(ii)或(ii)的阳离子脂质和如上所定义的包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中,如果阳离子脂质具有式i-6,则脂质纳米颗粒不是包封编码流感pr8或cal/7/2009血凝素或hiv-1cd4非依赖性r3a包膜蛋白的未修饰的、1-甲基假尿苷修饰的或密码子优化的mrna的,以约50∶10∶38.5∶1.5的比率包含式i-6、dspc、胆固醇和式(iva)的peg脂质的脂质纳米颗粒。进一步优选的实施例涉及含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含如上所定义的根据式(iv)的peg脂质和包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中,如果阳离子脂质具有式i-6,则脂质纳米颗粒不是包封编码流感pr8或cal/7/2009血凝素或hiv-1cd4非依赖性r3a包膜蛋白的未修饰的、1-甲基假尿苷修饰的或密码子优化的mrna的,以约50∶10∶38.5∶1.5的比率包含式i-6、dspc、胆固醇和式(iva)的peg脂质的脂质纳米颗粒。在具体的优选实施例中,本发明涉及含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含根据式(i)、(ii)或(iii)的阳离子脂质、根据式(iv)的peg脂质、包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物、类固醇和中性脂质,其中优选地,如果阳离子脂质具有式i-6,则脂质纳米颗粒不是包封编码流感pr8或cal/7/2009血凝素或hiv-1cd4非依赖性r3a包膜蛋白的未修饰的、1-甲基假尿苷修饰的或密码子优化的mrna的,以约50∶10∶38.5∶1.5的比率包含式i-6、dspc、胆固醇和式(iva)的peg脂质的脂质纳米颗粒,优选地该抗原肽或蛋白衍生自病原性抗原、肿瘤抗原、过敏性抗原或自身免疫性自身抗原或者其片段或变体,更优选地该病原性抗原衍生自流感病毒或狂犬病毒。在进一步优选的实施例中,本发明涉及含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含:选自以下的阳离子脂质具有以下结构的peg脂质其中n具有从30至60范围内、优选约49的平均值,任选地中性脂质,优选1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)以及任选地类固醇,优选胆固醇,其中阳离子脂质与dspc的摩尔比任选地在从约2∶1至8∶1的范围内,其中阳离子脂质与胆固醇的摩尔比任选地在从约2∶1至1∶1的范围内。在一个优选的实施例中,本发明涉及含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含:具有式(i)、(ii)或(iii)的阳离子脂质和/或具有式(iv)的peg脂质,任选地中性脂质,优选1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)以及任选地类固醇,优选胆固醇,其中阳离子脂质与dspc的摩尔比任选地在从约2∶1至8∶1的范围内,其中阳离子脂质与胆固醇的摩尔比任选地在从约2∶1至1∶1的范围内,以及涉及包含编码抗原肽或蛋白的mrna序列的mrna组合物,其中mrna序列另外优选地以5′至3′方向包含以下元件:a)5′-帽结构,优选m7gpppn,b)编码至少一种抗原肽或蛋白的至少一个编码区,c)poly(a)尾,它优选地由10个至200个、10个至100个、40个至80个或50个至70个腺苷核苷酸组成,d)任选地poly(c)尾,它优选地由10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸组成,以及e)任选地组蛋白茎-环,f)以及任选地3′-utr元件。在更优选的实施例中,本发明涉及含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含:选自以下的阳离子脂质和/或具有以下结构的peg脂质其中n具有从30至60范围内,优选地约49的平均值,以及包含编码抗原肽或蛋白的mrna序列的mrna化合物,其中优选地其中该抗原肽或蛋白衍生自病原性抗原、肿瘤抗原、过敏性抗原或自身免疫性自身抗原或者其片段或变体,更优选地该抗原衍生自流感病毒或狂犬病毒,任选地中性脂质,优选1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)以及任选地类固醇,优选胆固醇,其中阳离子脂质与dspc的摩尔比任选地在从约2∶1至8∶1的范围内,其中阳离子脂质与胆固醇的摩尔比任选地在从约2∶1至1∶1的范围内,其中该mrna序列任选地包含a)5′-帽结构,和/或b)poly(a)序列,和/或c)poly(c)序列。在更优选的实施例中,mrna序列包含编码至少一种抗原肽或蛋白的编码区,其中该mrna序列包含选自序列的g/c含量修饰、密码子修饰、密码子优化或c-优化的序列修饰。在具体的优选实施例中,本发明涉及含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含:选自以下的阳离子脂质任选地,具有以下结构的peg脂质其中n具有从30至60范围内,优选地约49的平均值,以及含有mrna序列的mrna化合物任选地中性脂质,优选1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)以及任选地类固醇,优选胆固醇,其中阳离子脂质与dspc的摩尔比任选地在从约2∶1至8∶1的范围内,其中阳离子脂质与胆固醇的摩尔比任选地在从约2∶1至1∶1的范围内,其中mrna序列另外优选地以5′至3′方向包含以下元件:a)5′-帽结构,优选m7gpppn,b)编码至少一种抗原肽或蛋白的至少一个编码区,优选地该抗原肽或蛋白衍生自病原性抗原、肿瘤抗原、过敏性抗原或自身免疫性自身抗原或者其片段或变体,更优选地该病原性抗原衍生自流感病毒或狂犬病毒;c)poly(a)尾,它优选地由10个至200个、10个至100个、40个至80个或50个至70个腺苷核苷酸组成,d)任选地poly(c)尾,它优选地由10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸组成,以及e)任选地组蛋白茎-环,f)以及任选地3′-utr元件。在特别优选的实施例中,根据本发明的包含mrna的(药物)组合物或疫苗包含脂质纳米颗粒,其摩尔比为约50∶10∶38.5∶1.5、优选47.5∶10∶40.8∶1.7或更优选47.4∶10∶40.9∶1.7(即,阳离子脂质、dspc、胆固醇和peg-脂质的比例(mol%);溶解在乙醇中)。在特别优选的实施例中,脂质纳米颗粒是如上所定义的含有mrna的脂质纳米颗粒,其中优选地,抗原肽或蛋白衍生自流感病毒的血凝素(ha)、神经氨酸酶(na)、核蛋白(np)、基质蛋白1(m1)、基质蛋白2(m2)、非结构蛋白1(ns1)、非结构蛋白2(ns2)、核输出蛋白(nep)、聚合酶酸性蛋白(pa)、聚合酶碱性蛋白pb1、pb1-f2或聚合酶碱性蛋白2(pb2)或者其片段或变体。更优选地,抗原肽或蛋白衍生自流感病毒的血凝素(ha)或神经氨酸酶(na)或者其片段或变体。甚至更优选地,抗原肽或蛋白是流感病毒的血凝素(ha)的至少一种全长蛋白和/或神经氨酸酶(na)的至少一种全长蛋白或其变体。在进一步优选的实施例中,流感病毒选自甲型、乙型或丙型流感病毒。在特别优选的实施例中,甲型流感病毒选自特征在于选自由h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15、h16、h17和h18组成的组的血凝素(ha)的流感病毒和/或甲型流感病毒选自特征在于选自由n1、n2、n3、n4、n5、n6、n7、n8、n9、n10和n11组成的组的神经氨酸酶(na)的流感病毒。优选地,甲型流感病毒选自由h1n1、h1n2、h2n2、h3n1、h3n2、h3n8、h5n1、h5n2、h5n3、h5n8、h5n9、h7n1、h7n2、h7n3、h7n4、h7n7、h7n9、h9n2和h10n7组成的组,优选地选自h1n1、h3n2、h5n1。最优选地,mrna序列包含至少一个编码区,该至少一个编码区编码衍生自流感病毒的血凝素(ha)或者其片段或变体的至少一种抗原肽或蛋白以及衍生自流感病毒的神经氨酸酶(na)或者其片段或变体的至少一种抗原肽或蛋白。在特别优选的实施例中,mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的血凝素(ha)或者其片段或变体的至少一种抗原肽或蛋白和/或衍生自甲型流感病毒的神经氨酸酶(na)或者其片段或变体的至少一种抗原肽或蛋白,该甲型流感病毒选自由h1n1、h1n2、h2n2、h3n1、h3n2、h3n8、h5n1、h5n2、h5n3、h5n8、h5n9、h7n1、h7n2、h7n3、h7n4、h7n7、h7n9、h9n2和h10n7组成的组,优选地选自h1n1、h3n2、h5n1。本发明进一步涉及制备所述脂质纳米颗粒的方法,该方法包括以下步骤:(i)提供如上所定义的式(i)的阳离子脂质或其药学上可接受的盐、互变异构体、前药或立体异构体,和/或如上所定义的式(ii)的阳离子脂质或其药学上可接受的盐、互变异构体、前药或立体异构体,和/或如上所定义的式iii的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体;和/或b)具有式(iv)的peg脂质:如上所定义;c)包含编码至少一种抗原肽或蛋白的mrna序列的至少一种mrna化合物;以及d)任选地类固醇;以及e)任选地中性脂质;(ii)将该阳离子脂质和/或该peg脂质以及任选地该中性脂质和/或该类固醇或类固醇衍生物溶解在乙醇中;(iii)将该乙醇脂质溶液与包含该mrna多核苷酸的水溶液混合(iv)除去乙醇,以形成包封该mrna多核苷酸或与该mrna多核苷酸相关联的脂质纳米颗粒;以及任选地(v)分离或纯化这些脂质纳米颗粒。可以通过不会对脂质或形成脂质纳米颗粒产生负面影响的任何合适的方法除去乙醇。在本发明的一个实施例中,通过透析除去乙醇。在替代性实施例中,通过渗滤除去乙醇。脂质纳米颗粒的分离和任选的纯化也可以通过任何合适的方法进行。优选地,对脂质纳米颗粒进行过滤,更优选地,通过无菌过滤器过滤而分离或纯化脂质纳米颗粒。本发明进一步涉及包含至少一种根据本发明的脂质纳米颗粒的药物组合物。该脂质纳米颗粒可包含如本文所定义的编码至少一种抗原肽或蛋白的序列的mrna化合物。在本发明的一个实施例中,该mrna序列编码一种抗原肽或蛋白。在本发明的替代性实施例中,该mrna序列编码一种以上的抗原肽或蛋白。在本发明的一个实施例中,该药物组合物包含根据本发明的脂质纳米颗粒,其中该脂质纳米颗粒包含一种以上的mrna化合物,每种mrna化合物包含编码抗原肽或蛋白的不同mrna序列。在本发明的替代性实施例中,该药物组合物包含第二脂质纳米颗粒,其中该第二脂质纳米颗粒包含的mrna化合物不同于第一脂质纳米颗粒包含的mrna化合物。在进一步的方面,本发明涉及药物组合物,该组合物包含如本文所定义的含有mrna的脂质纳米颗粒以及药学上可接受的载剂,其中该mrna包含mrna序列,该mrna序列包含至少一个编码区。根据本发明的组合物优选地作为药物组合物或作为疫苗提供。根据优选的实施例,根据本发明的(药物)组合物或疫苗包含如上所定义的含有mrna的脂质纳米颗粒,该脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,其中该至少一种mrna序列的至少一个编码区编码至少一种抗原肽或蛋白,该抗原肽或蛋白优选地衍生自流感病毒或狂犬病毒的蛋白,优选地血凝素(ha)或神经氨酸酶(na)蛋白或糖蛋白中的任一种,如在本发明的序列表中或分别在pct/ep2016/075843的表1-5或图20-24中所披露的那样,或这些蛋白中的任一种的片段或变体。优选地,根据本发明的(药物)组合物或疫苗包含如上所定义的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,其中该至少一种mrna序列的至少一个编码序列包含编码至少一种抗原肽或蛋白的核酸序列或由其组成,该抗原肽或蛋白优选地衍生自流感病毒的蛋白,优选地血凝素(ha)或神经氨酸酶(na)蛋白中的任一种,如在序列表中或分别在pct/ep2016/075843的表1-4或图20-23中所定义的那样,或它们的片段或变体,其中衍生自流感病毒蛋白的蛋白优选地包含在序列表中或分别在pct/ep2016/075843的表1-4或图20-23中定义的氨基酸序列中的任一种或由其组成,优选地序列表的seqidno:1-30504或分别在pct/ep2016/075843的表1-4或图20-23中,或这些序列中任一种的片段或变体。替代性地,抗原肽或蛋白衍生自狂犬病毒,优选地衍生自狂犬病毒的糖蛋白,该糖蛋白优选地包含在序列表中或分别在pct/ep2016/075843的表5或图24中(优选地序列表的seqidno:30505-32012)披露的氨基酸序列中的任一种,或这些序列中任一种的片段或变体,或由其组成。优选地,根据本发明的(药物)组合物或疫苗包含如上所定义的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,其中该mrna序列的至少一个编码序列包含核酸序列或由其组成,该核酸序列编码衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体的至少一种抗原肽或蛋白,其中衍生自流感病毒或狂犬病毒的蛋白的抗原肽或蛋白优选地包含氨基酸序列或由其组成,该氨基酸序列与在序列表优选地seqidno:1-32012中,或分别在pct/ep2016/075843的表1-5或图20-24的“a列”中披露的氨基酸序列中的任一种,或这些序列中的任一种的片段或变体具有至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%、优选地至少70%、更优选地至少80%、甚至更优选地至少85%、甚至更优选地至少90%且最优选地至少95%或甚至97%的序列同一性。更优选地,根据本发明的(药物)组合物或疫苗包含如上所定义的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,其中该至少一种mrna序列的至少一个编码序列包含核酸序列或由其组成,该核酸序列编码衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体的至少一种抗原肽或蛋白,其中衍生自流感病毒或狂犬病毒的蛋白的抗原肽或蛋白优选地包含氨基酸序列或由其组成,该氨基酸序列与在序列表中优选地在seqidno:1-32012中,或分别在pct/ep2016/075843的表1-5或图20-24的“a列”中披露的氨基酸序列中的任一种,或这些序列中的任一种的片段或变体具有至少80%的序列同一性。在优选的实施例中,根据本发明的(药物)组合物或疫苗包含如上所定义的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,其中该至少一种mrna序列的至少一个编码序列包含在序列表优选地seqidno:32013-64024或seqidno:64025-224084中或在pct/ep2016/075843的表1-5或图20-24的“b”或“c”列中披露的核酸序列中的任一种、或这些序列中的任一种的片段或变体,或由其组成。根据另一个实施例,根据本发明的(药物)组合物或疫苗包含如上所定义的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,其中该至少一种mrna序列的至少一个编码序列包含核酸序列或由其组成,该核酸序列与在序列表优选地seqidno:32013-64024或seqidno:64025-224084中,或分别在pct/ep2016/075843的表1-5或图20-24的“b列”或“c列”中披露的核酸序列中的任一种,或这些序列中的任一种的片段或变体具有至少5%、10%、20%、30%、40%、50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%、优选地至少70%、更优选地至少80%、甚至更优选地至少85%、甚至更优选地至少90%且最优选地至少95%或甚至97%的序列同一性。根据特别优选的实施例,根据本发明的(药物)组合物或疫苗包含如上所定义的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,其中该至少一种mrna序列的至少一个编码序列包含核酸序列或由其组成,该核酸序列与在序列表优选地在seqidno:32013-64024或seqidno:64025-224084中,或分别在pct/ep2016/075843的表1-5或图20-24的“b列”或“c列”中披露的核酸序列中的任一种,或这些序列中的任一种的片段或变体具有至少80%的序列同一性。更优选地,根据本发明的(药物)组合物或疫苗包含如上所定义的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,其中该至少一种mrna序列的至少一个编码序列包含在序列表中、或分别在pct/ep2016/075843的表1-5或图20-24的“c列”中、或在seqidno:64025-224084中披露的核酸序列中的任一种,或这些序列中的任一种的片段或变体,或由其组成。在本发明的上下文中,(药物)组合物或疫苗可包含如本文所定义的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含编码一种或多种抗原肽或蛋白的mrna,这些抗原肽或蛋白优选地衍生自如本文所定义的流感病毒或狂犬病毒的蛋白或者其片段或变体。因此,根据本发明的(药物)组合物或疫苗可包含含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna,该mrna包含至少一种mrna序列,该mrna序列包含至少一个编码区,该至少一个编码区编码至少一种抗原肽或蛋白,该抗原肽或蛋白优选地衍生自流感病毒或狂犬病毒的蛋白或者其片段或变体,其中该至少一种mrna序列的至少一个编码区编码一种特异性抗原肽或蛋白,该特异性抗原肽或蛋白例如衍生自本文定义的流感病毒的蛋白或者其片段或变体。替代性地,本发明的(药物)组合物或疫苗可包含根据本发明的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna化合物,该mrna化合物包含至少一种mrna序列,其中该至少一种mrna序列编码至少两种、三种、四种、五种、六种、七种、八种、九种、十种、十一种或十二种不同的抗原肽或蛋白,这些抗原肽或蛋白例如衍生自如本文所定义的流感病毒的蛋白或者其片段或变体。在此上下文中,特别优选的是,(药物)组合物或疫苗中包含的至少一种mrna化合物是如本文所定义的双或多顺反子mrna,该mrna编码至少两种、三种、四种、五种、六种、七种、八种、九种、十种、十一种或十二种不同的抗原肽或蛋白,这些抗原肽或蛋白例如衍生自流感病毒的蛋白。还设想了这些实施例之间的混合物,例如包含一种以上的mrna序列的组合物,其中至少一种mrna序列可以是单顺反子的,而至少一种其他mrna序列可以是双顺反子或多顺反子的。因此,根据本发明的(药物)组合物或疫苗,优选地其中所含的mrna序列的至少一个编码序列,可以包含如本文所定义的核酸序列的任何组合。优选地,(药物)组合物或疫苗包含根据本发明的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含多种或多于一种mrna序列,其中每种mrna序列包含至少一个编码区,该至少一个编码区编码衍生自流感病毒的蛋白或者其片段或变体的至少一种抗原肽或蛋白。在特别优选的实施例中,该组合物包含至少2、3、4、5、6、7、6、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60、70、80或100种不同的mrna序列,每种mrna序列编码至少一种抗原肽或蛋白,该抗原肽或蛋白优选地衍生自如上所定义的流感病毒的蛋白或者其片段或变体,优选地衍生自流感病毒的血凝素(ha)或神经氨酸酶(na)或者其片段或变体。在最优选的实施例中,该组合物包含4种不同的mrna序列,每种mrna序列编码至少一种抗原肽或蛋白,该抗原肽或蛋白优选地衍生自如上所定义的流感病毒的蛋白或者其片段或变体,优选地衍生自流感病毒的血凝素(ha)或神经氨酸酶(na)或者其片段或变体。在此上下文中,特别优选的是,每种mrna序列编码至少一种不同的抗原肽或蛋白,该抗原肽或蛋白衍生自相同病原体例如流感病毒的蛋白,其中特别优选的是,该抗原肽或蛋白衍生自相同病原体例如流感病毒的不同蛋白。优选地,该组合物包含至少两种mrna序列,其中至少一种mrna序列编码衍生自流感病毒的血凝素(ha)的至少一种抗原肽或蛋白,并且至少一种mrna序列编码衍生自相同流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白。在另一个优选的实施例中,每种mrna序列编码至少一种不同的衍生自不同病原体例如蛋流感病毒的蛋白的抗原肽或蛋白。优选地,每种mrna序列编码至少一种衍生自不同流感病毒的血凝素(ha)和/或神经氨酸酶(na)的抗原肽或蛋白。优选地,根据本发明的(药物)组合物或疫苗包含多种mrna序列,每种mrna序列编码衍生自流感病毒的血凝素(ha)和/或神经氨酸酶(na)的至少一种抗原肽或蛋白,其中衍生自2、3、4、5、6、7、6、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60、70、80或100种不同流感病毒的血凝素(ha)和/或神经氨酸酶(na)的至少一种抗原肽或蛋白由多种mrna序列编码。在此上下文中,特别优选的是,该(药物)组合物或疫苗包含含有至少一种mrna的脂质纳米颗粒,该脂质纳米颗粒包含mrna化合物,该mrna化合物包含:编码衍生自甲型流感病毒h1的蛋白(优选血凝素(ha)和/或神经氨酸酶(na))的至少一种抗原肽或蛋白的mrna序列,编码衍生自甲型流感病毒h3的蛋白(优选血凝素(ha)和/或神经氨酸酶(na))的至少一种抗原肽或蛋白的至少一种mrna序列,编码衍生自甲型流感病毒h5的蛋白(优选血凝素(ha)和/或神经氨酸酶(na))的至少一种抗原肽或蛋白的至少一种mrna序列,以及任选地编码衍生自甲型流感病毒h7的蛋白(优选血凝素(ha)和/或神经氨酸酶(na))的至少一种抗原肽或蛋白的至少一种mrna序列,和/或任选地编码衍生自甲型流感病毒h9的蛋白(优选血凝素(ha)和/或神经氨酸酶(na))的至少一种抗原肽或蛋白的至少一种mrna序列。优选地,该(药物)组合物或疫苗包含含有至少一种mrna的脂质纳米颗粒,该脂质纳米颗粒包含mrna化合物,该mrna化合物包含:编码衍生自甲型流感病毒h1的血凝素(ha)的至少一种抗原肽或蛋白的mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列,编码衍生自甲型流感病毒h3的血凝素(ha)的至少一种抗原肽或蛋白的至少一种mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列,编码衍生自甲型流感病毒h5的血凝素(ha)的至少一种抗原肽或蛋白的至少一种mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列,以及任选地编码衍生自甲型流感病毒h7的血凝素(ha)的至少一种抗原肽或蛋白的至少一种mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列,和/或任选地编码衍生自甲型流感病毒h9的血凝素(ha)的至少一种抗原肽或蛋白的至少一种mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列。在一个具体实施例中,该(药物)组合物或疫苗包含含有至少一种mrna的脂质纳米颗粒,该脂质纳米颗粒包含mrna化合物,该mrna化合物包含:编码衍生自甲型流感病毒h1n1的血凝素(ha)的至少一种抗原肽或蛋白的mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列,编码衍生自甲型流感病毒h3n2的血凝素(ha)的至少一种抗原肽或蛋白的至少一种mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列,编码衍生自甲型流感病毒h5n1的血凝素(ha)的至少一种抗原肽或蛋白的至少一种mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列。另外,该(药物)组合物或疫苗优选地进一步包含含有至少一种mrna的脂质纳米颗粒,该脂质纳米颗粒包含mrna化合物,该mrna化合物包含编码衍生自至少一种乙型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白的mrna序列和/或编码衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的至少一种mrna序列,该mrna化合物用根据本发明的含有mrna的脂质纳米颗粒包封或与之相关联。在此上下文中,特别优选的是,该(药物)组合物或疫苗包含含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含mrna,该mrna包含编码衍生自以下流感病毒的血凝素(ha)的至少一种抗原肽或蛋白和/或衍生自神经氨酸酶(na)的至少一种抗原肽或蛋白的多种mrna序列:-甲型流感/荷兰/602/2009和/或甲型流感/加利福利亚州/7/2009,-甲型流感/香港/4801/2014,-乙型流感/布里斯班/60/2008,和-甲型流感/越南/1203/2004;或以下流感病毒-甲型流感/加利福利亚州/07/2009(h1n1),-甲型流感/香港/4801/2014(h3n2),-乙型流感/布里斯班/60/2008,-乙型流感/普吉岛/3073/2013,-以及任选地甲型流感/密歇根州/45/2015(h1n1)pdm09样病毒。在更优选的实施例中,药物组合物或疫苗包含至少4种不同的如上所定义的衍生自流感病毒抗原的mrna序列,这些mrna序列包封在根据本发明的含有mrna的脂质纳米颗粒内或与这些脂质纳米颗粒相关联。优选地,在此上下文中,mrna序列包含以下表11(“优选的rna序列”)的rna序列或由其组成:表11:优选的rna序列在特别优选的实施例中,药物组合物或疫苗是包含脂质纳米颗粒的四价流感疫苗,这些脂质纳米颗粒包含如上所定义的mrna化合物。在此上下文中特别优选的是编码以下蛋白序列的mrna的组合(例如,用于制备四价混合物):-甲型流感/香港/4801/2014(h3n2)的ha蛋白(优选地选自由seqidno:13853、13854、13855和13856组成的组);和/或-甲型流感/加利福尼亚州/07/2009(h1n1)的ha蛋白(优选地选自由seqidno:13836、13837、13838、13839、13840、13841、13842、13843和13844组成的组);和/或-乙型流感/普吉岛/3037/2013(epi540671)的ha蛋白(优选地选自由seqidno:28530、28531和28532组成的组);和/或-乙型流感/布里斯班/60/2008的ha蛋白(优选地选自由seqidno:28524、28525、28526、28527、28528和28529组成的组)。在此上下文中进一步特别优选的是编码以下蛋白序列的mrna的组合(例如,用于制备三价混合物):-甲型流感/香港/4801/2014(h3n2)的na蛋白(优选地选自由seqidno:26251、26252、26253和26254组成的组);和/或-甲型流感/加利福尼亚州/7/2009(h1n1)pdm09的na蛋白(优选地选自由seqidno:26238、26239、26240、26241、26242和26243组成的组);和/或-乙型流感/布里斯班/60/2008的na蛋白(优选地选自由seqidno:30455、30456、30457、30458、30459和30460组成的组)。在此上下文中甚至进一步特别优选的是编码以下蛋白序列的mrna的组合(例如,用于制备四价混合物):-甲型流感/荷兰/602/2009(h1n1)的ha蛋白(优选地选自由seqidno:13848、13849和13850组成的组);和/或-甲型流感/香港/4801/2014(h3n2)的ha蛋白(优选地选自由seqidno:13853、13854、13855和13856组成的组);和/或-乙型流感/布里斯班/60/2008的ha蛋白(优选地选自由seqidno:28524、28525、28526、28527、28528和28529组成的组);和/或-甲型流感/越南/1194/2004(h5n1)的ha蛋白(优选地选自由seqidno:13859和13860组成的组)。在此上下文中还特别优选的是编码以下蛋白序列的mrna的组合(例如,用于制备七价混合物):-甲型流感/香港/4801/2014(h3n2)的ha蛋白(优选地选自由seqidno:13853、13854、13855和13856组成的组);和/或-甲型流感/加利福尼亚州/07/2009(h1n1)的ha蛋白(优选地选自由seqidno:13836、13837、13838、13839、13840、13841、13842、13843和13844组成的组);和/或-乙型流感/普吉岛/3037/2013(epi540671)的ha蛋白(优选地选自由seqidno:28530、28531和28532组成的组);和/或-乙型流感/布里斯班/60/2008的ha蛋白(优选地选自由seqidno:28524、28525、28526、28527、28528和28529组成的组);和/或-甲型流感/香港/4801/2014(h3n2)的na蛋白(优选地选自由seqidno:26251、26252、26253和26254组成的组);和/或-甲型流感/加利福尼亚州/7/2009(h1n1)pdm09的na蛋白(优选地选自由seqidno:26238、26239、26240、26241、26242和26243组成的组);和/或-乙型流感/布里斯班/60/2008的na蛋白(优选地选自由seqidno:30455、30456、30457、30458、30459和30460组成的组)。根据本发明的组合物还可包含合适的药学上可接受的佐剂和赋形剂。在优选的实施例中,优选添加佐剂以增强组合物的免疫刺激性质。在此上下文中,佐剂可以被理解为适于支持根据本发明的组合物的施用和递送的任何化合物。此外,这种佐剂可以在不与其结合的情况下引发或增加先天免疫系统的免疫应答,即非特异性免疫应答。换句话说,当施用时,根据本发明的组合物典型地由于如本文所定义的抗原或者其片段或变体而引发适应性免疫应答,该抗原由包含在本发明组合物中的本发明的mrna的至少一个编码序列编码。另外,根据本发明的组合物可以由于向根据本发明的组合物中添加如本文所定义的佐剂而产生(支持性)先天免疫应答。这种佐剂可选自技术人员已知的并适用于目前的情况(即支持在哺乳动物中诱导免疫应答)的任何佐剂。优选地,该佐剂可以选自由以下组成的组但不限于此:tdm、mdp、胞壁酰二肽、普朗尼克类(pluronics)、明矾溶液、氢氧化铝、adjumertm(聚磷腈);磷酸铝凝胶;来自藻类的葡聚糖;algammulin;氢氧化铝凝胶(明矾);高蛋白吸附性氢氧化铝凝胶;低粘度氢氧化铝凝胶;af或spt(角鲨烷(5%)、tween80(0.2%)、pluronicl121(1.25%)、磷酸盐缓冲盐水ph7.4的乳液);avridinetm(丙二胺);bayr1005tm((n-(2-脱氧-2-l-亮氨酰氨基-b-d-吡喃葡糖基)-n-十八烷基-十二烷酰基-酰胺氢乙酸盐);calcitrioltm(1-α,25-二羟基-维生素d3);磷酸钙凝胶;captm(磷酸钙纳米颗粒);霍乱全毒素、霍乱毒素-a1-蛋白-a-d-片段融合蛋白、霍乱毒素的亚基b;crl1005(嵌段共聚物p1205);含细胞因子的脂质体;dda(二甲基双十八烷基溴化铵);dhea(脱氢表雄酮);dmpc(二肉豆蔻酰磷脂酰胆碱);dmpg(二肉豆蔻酰磷脂酰甘油);doc/明矾复合物(脱氧胆酸钠盐);弗氏完全佐剂;弗氏不完全佐剂;γ菊粉;gerbu佐剂(以下物质的混合物;i)n-乙酰葡糖胺基-(p1-4)-n-乙酰胞壁酰-l-丙氨酰-d-谷氨酰胺(gmdp)、ii)二甲基双十八烷基氯化铵(dda)、iii)锌-l-脯氨酸盐复合物(znpro-8);gm-csf);gmdp(n-乙酰葡糖胺基-(b1-4)-n-乙酰基胞壁酰基-l-丙氨酰-d-异谷氨酰胺);咪喹莫特(1-(2-甲基丙基)-1h-咪唑并[4,5-c]喹啉-4-胺);immthertm(n-乙酰葡糖胺基-n-乙酰基胞壁酰-l-ala-d-异glu-l-ala-甘油二棕榈酸酯);drv(由脱水-复水囊泡制备的免疫脂质体);干扰素-γ;白细胞介素-1β;白细胞介素-2;白细胞介素-7;白细胞介素-12;iscomstm;iscoprep7.0.3.tm;脂质体;loxoribinetm(7-烯丙基-8-氧代鸟嘌呤);lt口服佐剂(大肠杆菌不稳定肠毒素-原毒素);任何组成的微球和微粒;mf59tm;(角鲨烯-水乳液);montanideisa51tm(纯化的弗氏不完全佐剂);montanideisa720tm(可代谢的油佐剂);mpltm(3-q-去酰基-4′-单磷酰基脂质a);mtp-pe和mtp-pe脂质体((n-乙酰基-l-丙氨酰基-d-异谷氨酰胺酰基-l-丙氨酸-2-(1,2-二棕榈酰基-sn-甘油-3-(羟基磷酰氧基))-乙基酰胺单钠盐);murametidetm(nac-mur-l-ala-d-gln-och3);murapalmitinetm和d-murapalmitinetm(nac-mur-l-thr-d-异gin-sn-sn-甘油二棕榈酰基);nago(神经氨酸酶-半乳糖氧化酶);任何组成的纳米球或纳米颗粒;nisv(非离子表面活性剂囊泡);pleurantm(β-葡聚糖);plga、pga和pla(乳酸和乙醇酸的均聚物和共聚物;微球/纳米球);pluronicl121tm;pmma(聚甲基丙烯酸甲酯);poddstm(类蛋白微球);聚乙烯氨基甲酸酯衍生物;poly-ra:聚-ru(聚腺苷酸-聚尿苷酸复合物);聚山梨醇酯80(tween80);螺旋蛋白(proteincochleates)(亚拉巴马州阿拉巴斯特的阿文蒂极性脂质有限公司(avantipolarlipids,inc.,alabaster,al));stimulontm(qs-21);quil-a(quil-a皂苷);s-28463(4-氨基-otec-2-乙氧基甲基-1h-咪唑并[4,5c]喹啉-1-乙醇);saf-1tm(“syntex佐剂制剂”);仙台病毒蛋白脂质体(sendaiproteoliposome)和含仙台病毒的脂质基质;span-85(脱水山梨糖醇三油酸酯);specol(marcol52、span85和tween85的乳液);角鲨烯或(2,6,10,15,19,23-六甲基二十四碳烷和2,6,10,15,19,23-六甲基-2,6,10,14,18,22-二十四碳六烯);硬脂基酪氨酸(十八烷基酪氨酸盐酸盐);(n-乙酰葡糖胺基-n-乙酰基胞壁酰-l-ala-d-异glu-l-ala-二棕榈酰氧基丙基酰胺);苏氨酰基-mdp(termurtidetm或[thr1]-mdp;n-乙酰胞壁酰-l-苏氨酰-d-异谷氨酰胺);ty颗粒(ty-vlp或病毒样颗粒);walter-reed脂质体(含有吸附在氢氧化铝上的脂质a的脂质体)和脂肽,包括pam3cys,特别是铝盐,诸如adju-phos、alhydrogel、rehydragel;乳液,包括cfa、saf、ifa、mf59、provax、titermax、montanide、vaxfectin;共聚物,包括optivax(crl1005)、l121、poloaxmer4010等;脂质体,包括stealth,脂质卷(cochleate),包括bioral;植物衍生的佐剂,包括qs21、quila、iscomatrix、iscom;适于共刺激的佐剂,包括番茄碱(tomatine),生物聚合物,包括plg、pmm、菊粉;微生物衍生的佐剂,包括罗莫肽(romurtide)、detox、mpl、cws、甘露糖、cpg核酸序列、cpg7909、人tlr1-10的配、鼠tlr1-13的配体、iss-1018、ic31、咪唑喹啉、ampligen、ribi529、imoxine、iriv、vlp、霍乱毒素、热不稳定毒素、pam3cys、鞭毛蛋白、gpi锚定蛋白、lnfpiii/lewisx、抗微生物肽、uc-1v150、rsv融合蛋白、cdigmp;以及适合作为拮抗剂的佐剂,包括cgrp神经肽。特别优选的是,佐剂可以选自支持诱导初始t细胞的th1免疫应答或成熟的佐剂,例如gm-csf、il-12、ifnγ、如上所定义的任何免疫刺激性核酸,优选免疫刺激性rna、cpgdna等。在进一步优选的实施例中,还可能的是,本发明的组合物除了提供抗原的mrna之外还包含选自下组的进一步的组分,该组包括:进一步的抗原(例如,以肽或蛋白的形式)或进一步的编码抗原的核酸;进一步的免疫治疗剂;一种或多种辅助物质;或任何进一步的已知由于与人toll样受体的结合亲和力(作为配体)而具有免疫刺激作用的化合物;和/或佐剂核酸,优选免疫刺激性rna(isrna)。如果需要,本发明的组合物可另外含有一种或多种辅助物质,以便增加其免疫原性或免疫刺激能力。由此优选地实现如本文所定义的mrna和可任选地包含在本发明组合物中的辅助物质的协同作用。取决于辅助物质的各种类型,在这方面可以考虑各种机制。例如,允许树突细胞(dc)成熟的化合物(例如脂多糖、tnf-α或cd40配体)形成第一类合适的辅助物质。一般来讲,可以使用任何以“危险信号”(lps、gp96等)或细胞因子(如gm-cfs)的方式影响免疫系统的药剂作为辅助物质,这些“危险信号”或细胞因子允许以靶向方式增强和/或影响免疫应答。特别优选的辅助物质是细胞因子,例如单核因子、淋巴因子、白细胞介素或趋化因子,这些细胞因子进一步促进先天免疫应答,例如il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12、il-13、il-14、il-15、il-16、il-17、il-18、il-19、il-20、il-21、il-22、il-23、il-24、il-25、il-26、il-27、il-28、il-29、il-30、il-31、il-32、il-33、ifn-α、ifn-β、ifn-γ、gm-csf、g-csf、m-csf、lt-β或tnf-α、生长因子如hgh。合适的佐剂还可以选自具有式glxmgn的核酸,其中:g是鸟苷、尿嘧啶或者鸟苷或尿嘧啶的类似物;x是鸟苷、尿嘧啶、腺苷、胸苷、胞嘧啶或上述核苷酸的类似物;l是从1至40的整数,其中当l=1时,g是鸟苷或其类似物时,当l>1时,至少50%的核苷酸是鸟苷或其类似物;m是整数且至少为3;其中当m=3时,x是尿嘧啶或其类似物,当m>3时,出现至少3个连续的尿嘧啶或尿嘧啶类似物;n是从1至40的整数,其中当n=1时,g是鸟苷或其类似物,当n>1时,至少50%的核苷酸是鸟苷或其类似物;或式(nuglxmgnnv)a的核酸,其中:g是鸟苷(鸟嘌呤)、尿苷(尿嘧啶)或者鸟苷(鸟嘌呤)或尿苷(尿嘧啶)的类似物,优选鸟苷(鸟嘌呤)或其类似物;x是鸟苷(鸟嘌呤)、尿苷(尿嘧啶)、腺苷(腺嘌呤)、胸苷(胸腺嘧啶)、胞苷(胞嘧啶)或这些核苷酸(核苷)的类似物,优选尿苷(尿嘧啶)或其类似物;n是长度为约4个至50个、优选约4个至40个、更优选约4个至30个或4个至20个核酸的核酸序列,每个n独立地选自鸟苷(鸟嘌呤)、尿苷(尿嘧啶)、腺苷(腺嘌呤)、胸苷(胸腺嘧啶)、胞苷(胞嘧啶)或这些核苷酸(核苷)的类似物;a是从1至20、优选从1至15、最优选从1至10的整数;l是从1至40的整数,其中当l=1时,g是鸟苷(鸟嘌呤)或其类似物,当l>1时,这些核苷酸(核苷)中的至少50%是鸟苷(鸟嘌呤)或其类似物;m是整数且至少为3;其中当m=3时,x是尿苷(尿嘧啶)或其类似物,当m>3时,出现至少3个连续的尿苷(尿嘧啶)或尿苷(尿嘧啶)类似物;n是从1至40的整数,其中当n=1时,g是鸟苷(鸟嘌呤)或其类似物,当n>1时,这些核苷酸(核苷)中的至少50%是鸟苷(鸟嘌呤)或其类似物;u、v可以彼此独立地为从0至50的整数,优选地其中当u=0,v≥1时,或当v=0时,u≥1;其中式(nuglxmgnnv)a的核酸分子具有至少50个核苷酸、优选至少100个核苷酸、更优选至少150个核苷酸、甚至更优选至少200个核苷酸且最优选至少250个核苷酸的长度。其他合适的佐剂还可以选自具有下式的核酸:clxmcn,其中:c是胞嘧啶、尿嘧啶或者胞嘧啶或尿嘧啶的类似物;x是鸟苷、尿嘧啶、腺苷、胸苷、胞嘧啶或上述核苷酸的类似物;l是从1至40的整数,其中当l=1时,c是胞嘧啶或其类似物,当l>1时,至少50%的核苷酸是胞嘧啶或其类似物;m是整数且至少为3;其中当m=3时,x是尿嘧啶或其类似物,当m>3时,出现至少3个连续的尿嘧啶或尿嘧啶类似物;n是从1至40的整数,其中当n=1时,c是胞嘧啶或其类似物,当n>1时,至少50%的核苷酸是胞嘧啶或其类似物。在此上下文中,wo2008/014979和wo2009/095226的披露内容也以援引方式并入本文。在又一方面,本发明提供了一种疫苗,该疫苗基于如本文所定义的根据本发明的含有mrna的脂质纳米颗粒,这些脂质纳米颗粒包含至少一种mrna化合物,该mrna化合物包含含有编码区的mrna序列。根据本发明的疫苗优选地是如本文所定义的(药物)组合物。因此,根据本发明的疫苗基于与本文所述的(药物)组合物相同的组分。就此而言,可以参考如本文所提供的对(药物)组合物的描述。优选地,根据本发明的疫苗包含如本文所定义的含有至少一种mrna的脂质纳米颗粒、和药学上可接受的载剂,该mrna包含至少一种mrna序列。在疫苗包含多于一种包封在含有mrna的脂质纳米颗粒中的mrna序列(例如根据本发明的多种rna序列,其中每一种优选地编码不同的抗原肽或蛋白)的实施例中,该疫苗可以物理分离的形式提供,并且可以通过单独的施用步骤施用。根据本发明的疫苗可以对应于如本文所述的(药物)组合物,尤其是mrna序列由单一组合物提供的情况。然而,本发明的疫苗也可以物理分离地提供。例如,在疫苗包含多于一种包封在如本文所定义的含有mrna的脂质纳米颗粒中的mrna序列/种类的实施例中,可以提供这些rna种类,使得例如提供两种、三种、四种、五种或六种单独的组合物,这些组合物各自可以包含至少一种mrna种类/序列(例如三种不同的mrna种类/序列),每种mrna种类/序列编码不同的抗原肽或蛋白,这些组合物可以组合或不组合。另外,本发明的疫苗可以是至少两种不同组合物的组合,每种组合物包含至少一种编码至少一种本文定义的抗原肽或蛋白的mrna。替代性地,疫苗可以作为至少一种mrna,优选至少两种、三种、四种、五种、六种或更多种mrna的组合而提供,每种mrna编码本文定义的一种抗原肽或蛋白。疫苗可以在使用之前加以组合以提供单一组合物,或者其使用方式可以使得需要不止一次施用来施用包封在如本文所定义的含有mrna的脂质纳米颗粒中的编码任何抗原肽或蛋白的不同mrna序列/种类。如果疫苗包含含有至少一种mrna的脂质纳米颗粒(典型地含有至少两种编码本文定义的抗原组合的mrna序列),则它可以例如通过单次施用(组合所有mrna种类/序列)、通过至少两次单独施用而施用。因此,编码如本文所定义的至少一种抗原肽或蛋白或者任何抗原组合(以及任选地进一步的抗原)的单、双或多顺反子mrna的任意组合被视为根据本发明的疫苗,这些mrna作为单独的实体(含有一种mrna种类)或作为组合的实体(含有多于一种mrna种类)提供。根据本发明的疫苗的特别优选的实施例,至少一种抗原,优选地由本发明的组合物作为一个整体而编码的至少两种、三种、四种、五种、六种或更多种抗原的如本文所定义的组合,作为单独的(单顺反子)mrna提供,且单独施用。与根据本发明的(药物)组合物一样,疫苗的实体可以以液体和/或干燥(例如冻干)的形式提供。它们可以含有进一步的组分,特别是允许其药物用途的进一步的组分。疫苗或(药物)组合物可以例如另外包含药学上可接受的载剂和/或进一步的辅助物质和添加剂和/或佐剂。疫苗或(药物)组合物典型地包含安全有效量的如本文所定义的根据本发明的mrna化合物,该mrna化合物编码如本文所定义的抗原肽或蛋白、或者其片段或变体、或者抗原的组合且包封在脂质纳米颗粒内和/或与脂质纳米颗粒相关联。如本文所用,“安全有效量”是指足以显著引起癌症或与癌症相关的疾病或病症的积极改变的mrna的量。然而,与此同时,“安全有效量”足够小,以避免严重的副作用,也就是说,允许在优势与风险之间建立合理的关系。确定这些限制典型地在合理的医学判断范围内。关于本发明的疫苗或(药物)组合物,表述“安全有效量”优选地意指适于刺激适应性免疫系统的mrna的量(并因此而言,所编码的抗原的量),刺激方式使得不会产生过度或破坏性免疫反应,但优选地,此类免疫反应也不低于可测量水平。此外,如本文所定义的(药物)组合物或疫苗的mrna的这种“安全有效量”可以根据mrna的类型(例如单顺反子、双顺反子或甚至多顺反子mrna)来选择,因为与使用等量的单顺反子mrna相比,双顺反子或甚至多顺反子mrna可导致所编码的抗原的明显更高的表达。如上所定义的(药物)组合物或疫苗的mrna的“安全有效量”此外将根据待治疗的特定病状以及待治疗患者的年龄和身体状况、病状的严重程度、治疗的持续时间、伴随治疗的性质、所用的特定的药学上可接受的载剂以及类似的因素在相关医生的知识和经验内变化。根据本发明的疫苗或组合物可以根据本发明作为药物组合物或作为疫苗用于人类和兽医医学目的。在优选的实施例中,以冻干形式提供根据本发明的(药物)组合物、疫苗或多部分试剂盒(kitofparts)的含有mrna的脂质纳米颗粒。优选地,将冻干的含有mrna的脂质纳米颗粒在施用前在合适的缓冲液中复原,该缓冲液有利地基于含水载剂,例如,乳酸林格氏溶液、林格氏溶液、磷酸盐缓冲溶液。在优选的实施例中,根据本发明的(药物)组合物、疫苗或多部分试剂盒包含至少一种、两种、三种、四种、五种、六种或更多种mrna化合物,这些mrna化合物可以作为单一脂质纳米颗粒种类提供,或针对每个lnp种类单独提供,任选地以冻干形式(任选地与至少一种进一步的添加剂一起)提供,并且优选地在使用之前在合适的缓冲液(例如乳酸林格氏溶液)中单独复原,以允许单独施用每种(单顺反子)mrna。根据本发明的疫苗或(药物)组合物典型地可包含药学上可接受的载剂。如本文所用的表述“药学上可接受的载剂”优选地包括本发明的疫苗的液体或非液体基础部分。如果本发明的疫苗以液体形式提供,则载剂将是水,典型地是无热原的水;等渗盐水或缓冲(含水)溶液,例如磷酸盐、柠檬酸盐等缓冲溶液。特别是对于本发明的疫苗的注射,可以使用水或优选缓冲液,更优选含水缓冲液,其含有钠盐,优选至少50mm的钠盐,钙盐,优选至少0.01mm的钙盐以及任选地钾盐,优选至少3mm的钾盐。根据优选的实施例,钠盐、钙盐和任选地钾盐可以以其卤化物形式(例如氯化物、碘化物或溴化物),以其氢氧化物、碳酸盐、碳酸氢盐或硫酸盐等形式存在。不进行限制,钠盐的实例包括例如nacl、nai、nabr、na2co3、nahco3、na2so4,任选的钾盐的实例包括例如kcl、ki、kbr、k2co3、khco3、k2so4,并且钙盐的实例包括例如cacl2、cai2、cabr2、caco3、caso4、ca(oh)2。此外,上述阳离子的有机阴离子可以包含在缓冲液中。根据更优选的实施例,如上所定义的适于注射目的的缓冲液可以包含选自氯化钠(nacl)、氯化钙(cacl2)和任选地氯化钾(kcl)的盐,其中除了氯化物外还可以存在进一步的阴离子。cacl2也可以被另一种盐如kcl代替。典型地,注射缓冲液中的盐以至少50mm氯化钠(nacl)、至少3mm氯化钾(kcl)和至少0.01mm氯化钙(cacl2)的浓度存在。注射缓冲液关于特定参比介质可以是高渗的、等渗的或低渗的,即缓冲液关于特定参比介质可以具有更高、相同或更低的盐含量,其中优选地,可以使用前述盐的不会由于渗透或其他浓度效应导致细胞损伤的此类浓度。参比介质是例如在“体内”方法中存在的液体,例如血液、淋巴液、胞质液或其他体液,或者例如可在“体外”方法中用作参比介质的液体,例如常见缓冲液或液体。此类常见缓冲液或液体是技术人员已知的。然而,也可以使用适于对人施用的一种或多种相容的固体或液体填充剂或稀释剂或包封化合物。如本文所用的术语“相容”是指本发明的疫苗的成分能够与如本文所定义的根据本发明的mrna混合,该混合不会导致发生将显著降低本发明的疫苗在典型使用条件下的药效的反应。当然,药学上可接受的载剂、填充剂和稀释剂必须具有足够高的纯度和足够低的毒性,以使它们适于向待治疗的人施用。可用作药学上可接受的载剂、填充剂或其成分的化合物的一些实例是糖类,例如乳糖、葡萄糖、海藻糖和蔗糖;淀粉,例如玉米淀粉或马铃薯淀粉;右旋糖;纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素、乙酸纤维素;黄芪胶粉;麦芽;明胶;牛脂;固体助流剂,例如硬脂酸、硬脂酸镁;硫酸钙;植物油,例如花生油、棉籽油、芝麻油、橄榄油、玉米油和来自可可属的油;多元醇,例如聚丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸。原则上,通过施用根据本发明的药物组合物或疫苗的方式来确定药学上可接受的载剂的选择。组合物或疫苗可以例如全身或局部施用。用于全身施用的途径一般包括例如透皮、口服、肠胃外途径,包括皮下、静脉内、肌肉内、动脉内、皮内和腹膜内注射和/或鼻内施用途径。用于局部施用的途径一般包括例如外用途径,但也包括皮内、透皮、皮下或肌内注射或病灶内、颅内、肺内、心脏内和舌下注射。更优选地,根据本发明的组合物或疫苗可以通过皮内、皮下或肌内途径施用,优选地通过注射施用,该注射可以是无针注射和/或针头注射。因此,组合物/疫苗优选地配制成液体或固体形式。待施用的根据本发明的疫苗或组合物的合适量可以通过常规实验确定,例如,通过使用动物模型确定。此类模型包括(但不意味着任何限制)兔、绵羊、小鼠、大鼠、狗和非人灵长类动物模型。用于注射的优选单位剂型包括无菌水溶液、生理盐水溶液或其混合物。应将此类溶液的ph调至生理上可耐受的ph,例如约7.4。适于注射的载剂包括水凝胶、用于控制或延迟释放的装置、聚乳酸和胶原基质。适于外用的药学上可接受的载剂包括适用于洗剂、乳膏、凝胶等的那些。如果本发明的组合物或疫苗将经口施用,则片剂、胶囊等是优选的单位剂型。用于制备可用于口服的单位剂型的药学上可接受的载剂在现有技术中是众所周知的。其选择将取决于诸如味道、成本和可储存性之类的次要考虑因素,这对于本发明的目的而言不是关键性的,并且本领域技术人员可以毫无困难地进行选择。本发明的疫苗或组合物可另外含有一种或多种辅助物质,以便进一步提高免疫原性。由此优选地实现本发明组合物中所含的mrna和辅助物质的协同作用,该辅助物质可任选地与如上所述的本发明的疫苗或组合物共同配制(或单独配制)。取决于辅助物质的各种类型,各种机制可在这方面发挥作用。例如,允许树突细胞(dc)成熟的化合物(例如脂多糖、tnf-α或cd40配体)形成第一类合适的辅助物质。一般来讲,可以使用任何以“危险信号”(lps、gp96等)或细胞因子(如gm-cfs)的方式影响免疫系统的药剂作为辅助物质,这些“危险信号”或细胞因子允许以靶向方式增强和/或影响由根据本发明的免疫刺激性佐剂产生的免疫应答。特别优选的辅助物质是细胞因子,例如单核因子、淋巴因子、白细胞介素或趋化因子,这些细胞因子除了通过编码的至少一种抗原诱导适应性免疫应答之外还促进先天免疫应答,例如il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12、il-13、il-14、il-15、il-16、il-17、il-18、il-19、il-20、il-21、il-22、il-23、il-24、il-25、il-26、il-27、il-28、il-29、il-30、il-31、il-32、il-33、inf-α、ifn-β、inf-γ、gm-csf、g-csf、m-csf、lt-β或tnf-α、生长因子如hgh。优选地,此类免疫原性增加剂或化合物分开提供(不与本发明的疫苗或组合物共同配制)并单独施用。可以包含在本发明的疫苗或组合物中的进一步的添加剂是乳化剂,例如tween;润湿剂,例如十二烷基硫酸钠;着色剂;味道赋予剂、药物载剂;片剂形成剂;稳定剂;抗氧化剂;防腐剂。本发明的疫苗或组合物还可以另外含有任何进一步的化合物,该化合物由于与人toll样受体tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10的结合亲和力(作为配体),或由于与鼠toll样受体tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、tlr11、tlr12或tlr13的结合亲和力(作为配体)而已知为免疫刺激性的。在此上下文中可以添加到本发明的疫苗或组合物中的另一类化合物可以是cpg核酸,特别是cpg-rna或cpg-dna。cpg-rna或cpg-dna可以是单链cpg-dna(sscpg-dna)、双链cpg-dna(dsdna)、单链cpg-rna(sscpg-rna)或双链cpg-rna(dscpg-rna)。cpg核酸优选呈cpg-rna的形式,更优选呈单链cpg-rna(sscpg-rna)的形式。cpg核酸优选含有至少一个或多个(促有丝分裂的)胞嘧啶/鸟嘌呤二核苷酸序列(一个或多个cpg基序)。根据第一个优选的替代方案,这些序列中包含的至少一个cpg基序即cpg基序的c(胞嘧啶)和g(鸟嘌呤)是未甲基化的。这些序列中任选包含的所有进一步的胞嘧啶或鸟嘌呤可以是甲基化的或未甲基化的。然而,根据进一步优选的替代方案,cpg基序的c(胞嘧啶)和g(鸟嘌呤)也可以按甲基化形式存在。根据本发明的另一方面,本发明还提供试了一种剂盒,特别是多部分试剂盒,该试剂盒包含如本文所定义的含有mrna序列的mrna化合物和如上所定义的根据式(i)、(ii)、(iii)或(iv)的至少一种脂质。在进一步的实施例中,该试剂盒包含如上所定义的脂质纳米颗粒或含有如上所定义的脂质纳米颗粒的(药物)组合物,和/或根据本发明的疫苗,任选地用于溶解的液体媒介物以及任选地技术说明,这些技术说明具有关于以下方面的信息:含有mrna的脂质纳米颗粒、组合物和/或疫苗的施用和剂量。这些技术说明可包含关于含有mrna的脂质纳米颗粒、组合物和/或疫苗的施用和剂量的信息。此类试剂盒(优选多部分试剂盒)可以应用于例如任何上述应用或用途,优选地应用于根据本发明的脂质纳米颗粒(用于制备本发明的药物,优选疫苗)在治疗或预防流感病毒感染或与其相关的疾病或病症方面的用途。这些试剂盒还可以应用于如本文所定义的脂质纳米颗粒、组合物或疫苗(用于制备本发明的疫苗)在治疗或预防流感病毒感染或与其相关的疾病或病症方面的用途,其中该脂质纳米颗粒、组合物和/或疫苗可以能够在如上所定义的哺乳动物中诱导或增强免疫应答。此类试剂盒可进一步应用于如本文所定义的脂质纳米颗粒、组合物或疫苗(用于制备本发明的疫苗)在调节(优选引发,例如诱导或增强)如上所定义的哺乳动物中的免疫应答方面的用途,以及优选地在支持治疗或预防流感病毒感染或与其相关的疾病或病症方面的用途。多部分试剂盒(作为试剂盒的特殊形式)可以在试剂盒的不同部分中包含如本文所述的一种或多种相同或不同的组合物和/或一种或多种相同或不同的疫苗。多部分试剂盒也可以在试剂盒的不同部分中包含根据本发明的(例如一种)组合物、(例如一种)疫苗和/或含有mrna的脂质纳米颗粒,例如,试剂盒的每个部包含如本文所定义的含有mrna的脂质纳米颗粒,该mrna优选地编码不同的抗原。优选地,试剂盒或多部分试剂盒包含作为其一部分的用于溶解根据本发明的mrna的媒介物,该媒介物任选地是乳酸林格氏溶液。任何上述试剂盒均可用于如上所定义的治疗或预防。在该方面的另一个实施例中,根据本发明的试剂盒可另外含有至少一种佐剂。在另一个实施例中,根据本发明的试剂盒可另外含有至少一种进一步的药物活性组分,优选适于治疗和/或预防癌症或相关病症的治疗性化合物。此外,在另一个实施例中,该试剂盒可另外含有对施用根据本发明的组合物或疫苗是必要的和/或合适的部分和/或装置,包括针、施用装置、贴片、注射装置。在又一方面,本发明涉及含有mrna的脂质纳米颗粒或药物组合物作为药物的用途。在替代性实施例中,本发明涉及该药物组合物或含有mrna的脂质在制备药物中的用途。特别地,所述药物用于治疗性或预防性地提高有需要的受试者的免疫应答。在优选的实施例中,该药物用于预防或治疗癌症或肿瘤疾病、传染病、过敏症或自身免疫性疾病或与其相关的病症。特别地,该药物用于治疗受试者,优选脊椎动物。在优选的实施例中,受试者是哺乳动物,该哺乳动物优选地选自包括山羊、牛、猪、狗、猫、驴、猴、猿,诸如小鼠、仓鼠、兔子的啮齿类动物,特别是人的组。在特别优选的实施例中,药物是疫苗,优选肿瘤、流感或狂犬病疫苗。在具体实施例中,该药物是狂犬病治疗中使用的狂犬病疫苗。该药物可以以任何合适的方式施用。优选地,该药物用于肠胃外施用,特别是注射。本发明进一步涉及在有需要的受试者中提高免疫应答的方法,包括向该受试者施用如上所定义的脂质纳米颗粒或如上所定义的药物组合物。在又一方面,本发明涉及在有需要的受试者中预防或治疗癌症或肿瘤疾病、传染病、过敏或自身免疫性疾病或与其相关的病症的方法,该方法包括向该受试者施用如上所定义的脂质纳米颗粒或如上所定义的药物组合物。根据本发明的一个方面,包含mrna的脂质纳米颗粒、(药物)组合物或疫苗可根据本发明(用于制备药物)用于治疗或预防癌症或肿瘤疾病、传染病、过敏或自身免疫性疾病或与其相关的病症。在此上下文中,特别优选的是治疗或预防流感病毒或狂犬病毒感染。此外,本发明还包括通过向有需要的受试者施用药学有效量的根据本发明的含有mrna的脂质纳米颗粒、(药物)组合物或疫苗来治疗或预防癌症或肿瘤疾病、传染病、过敏或自身免疫性疾病或与其相关的病症的方法,优选地如本文所定义。这种方法典型地包括制备本发明的含有mrna的脂质纳米颗粒、组合物或疫苗的任选的第一步骤,以及包括向有需要的患者/受试者施用(药学有效量的)所述组合物或疫苗的第二步骤。有需要的受试者典型地将是哺乳动物。在本发明的上下文中,哺乳动物优选地选自包括(但不限于此)例如山羊、牛、猪、狗、猫、驴、猴、猿,诸如小鼠、仓鼠、兔子的啮齿类动物,特别是人的组。在本发明的一些实施例中,受试者是鸟,优选鸡。在此上下文中,优选包括在本发明中的是治疗或预防流感病毒或狂犬病毒感染或与其相关的病症的方法。本发明还涉及根据本发明的含有mrna的脂质纳米颗粒、组合物或疫苗的用途,优选地用于在哺乳动物中引发免疫应答,优选地用于治疗或预防癌症或肿瘤疾病、传染病、过敏或自身免疫性疾病或与其相关的病症,优选地如本文所定义的流感病毒或狂犬病毒感染或相关病状。本发明还包括如本文所定义的根据本发明的含有mrna的脂质纳米颗粒、(药物)组合物或疫苗的用途,用于调节,优选地用于诱导或增强如本文所定义的哺乳动物中的免疫应答,更优选地用于预防和/或治疗流感病毒感染或与其相关的疾病或病症。在此上下文中,支持治疗或预防流感病毒感染可以是以下治疗的任何组合:常规流感治疗方法,例如用抗病毒剂如神经氨酸酶抑制剂(例如奥司他韦和扎那米韦)和m2蛋白抑制剂(例如金刚烷衍生物)的治疗;以及使用如本文所定义的rna或药物组合物的治疗。在本文定义的任何其他实施例中也可以设想支持治疗或预防流感病毒感染。因此,根据本发明的含有mrna的脂质纳米颗粒、(药物)组合物或疫苗在与任何其他方法(优选一种或多种上述治疗方法,特别是与抗病毒剂组合)的共同治疗中的任何用途都在本发明的范围内。对于施用,优选地可以使用如本文所定义的任何施用途径。特别地,使用这样的施用途径,它适于通过以下方式来治疗或预防如本文所定义的流感病毒感染或与其相关的疾病或病症:基于由根据本发明的含有mrna的脂质纳米颗粒编码的抗原来诱导或增强适应性免疫应答。然后,根据本发明的组合物和/或疫苗可以在施用如本文所定义的另一种组合物和/或疫苗之前、同时和/或之后施用,该另一种组合物和/或疫苗另外可以包含另一种含有mrna的脂质纳米颗粒或含有mrna的脂质纳米颗粒的组合,该mrna编码不同的抗原或抗原组合,其中由根据本发明的mrna序列编码的每种抗原优选地适于治疗或预防流感病毒感染和与其相关的疾病或病症。在此上下文中,如本文所定义的治疗还可以包括调节与流感病毒感染相关的疾病和与其相关的疾病或病症。根据本发明的该方面的优选实施例,根据本发明的(药物)组合物或疫苗通过注射而施用。可以采用本领域已知的任何合适的注射技术。优选地,本发明的组合物通过注射而施用,优选地通过无针注射(例如通过喷射注射)而施用。在一个实施例中,本发明的组合物包含至少一种、两种、三种、四种、五种、六种、七种、八种、九种、十一种、十一种、十二种或更多种如本文所定义的mrna,每种mrna优选地分别注射,优选地通过无针注射方式注射。替代性地,本发明的组合物包含至少一种、两种、三种、四种、五种、六种、七种、八种、九种、十种、十一种、十二种或更多种mrna,其中该至少一种、两种、三种、四种、五种、六种、七种、八种、九种、十种、十一种、十二种或更多种mrna优选地通过如本文所定义的注射以混合物形式施用。在又一方面,本发明涉及针对一种抗原或针对抗原组合免疫受试者的方法。针对一种抗原或针对至少两种、三种、四种、五种、六种、七种、八种、九种、十一种、十二种或更多种抗原的组合免疫受试者的免疫方案典型地包括根据本发明的(药物)组合物或疫苗的一系列单一剂量或用量。如本文所用,单一剂量分别指初始/第一剂量、第二剂量或任何进一步的剂量,它们优选地施用以“增强”免疫应答。在此上下文中,每个单一剂量优选地包括施用如本文所定义的相同抗原或相同抗原组合,其中两个单一剂量的施用之间的间隔可以从至少一天,优选2天、3天、4天、5天、6天或7天,到至少一周,优选2周、3周、4周、5周、6周、7周或8周变化。单一剂量之间的间隔可以是恒定的或在免疫方案的过程中变化,例如,这些间隔可以在开始时较短,而在方案即将结束时较长。取决于单剂量的总数和单剂量之间的间隔,免疫方案可以延伸一段时间,优选持续至少一周,更优选数周(例如2周、3周、4周、5周、6周、7周、8周、9周、10周、11周或12周),甚至更优选数月(例如3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、18个月或24个月)。每个单剂量优选地包括施用一种抗原,优选地至少两种、三种、四种、五种、六种、七种、八种、九种、十种、十一种、十二种或更多种如本文所定义的抗原的组合,并因此可以涉及至少一次,优选地1次、2次、3次、4次、5次、6次、7次、8次、9次、10次、11次或12次注射。在一些情况下,根据本发明的组合物或疫苗典型地在一次注射中以单剂量施用。在根据本发明的疫苗包含编码如本文所定义的不同抗原的单独mrna制剂的情况下,在单剂量施用期间进行的最小注射次数对应于疫苗的单独组分的数量。在某些实施例中,单剂量的施用可以包括针对疫苗(例如,包含编码例如本文定义的一种抗原肽或蛋白的mrna的特定mrna制剂)的每种组分多于一次的注射。例如,疫苗的各个组分的总体积的多个部分可以注射到不同的身体部位中,因此涉及多于一次注射。在更具体的实例中,包含四种单独的mrna制剂(每种mrna制剂在两个不同的身体部位施用)的疫苗的单一剂量包括八次注射。典型地,单一剂量包括施用疫苗的所有组分所需的所有注射,其中单一组分可包括如上所述的多于一次注射。在根据本发明的疫苗的单一剂量的施用包括多于一次注射的情况下,注射基本上同时或并行地进行,即,典型地在执业医生执行单一注射步骤所需的时间范围内以时间交错的方式一个接一个地进行。因此,单一剂量的施用优选地延续几分钟的时间段,例如2分钟、3分钟、4分钟、5分钟、10分钟、15分钟、30分钟或60分钟。根据本发明的如本文所定义的含有mrna的脂质纳米颗粒、(药物)组合物或疫苗的施用可以在时间交错的处理中进行。时间交错的处理可以是例如在流感病毒感染或与其相关的疾病或病症的常规疗法之前、同时和/或之后施用含有mrna的脂质纳米颗粒、组合物或疫苗,例如,通过在适于治疗或预防流感病毒感染或与其相关的疾病或病症的疗法或治疗剂施用之前、同时和/或之后施用含有mrna的脂质纳米颗粒、组合物或疫苗。这种时间交错处理可以使用例如试剂盒,优选如本文所定义的多部分试剂盒进行。时间交错处理可以另外或替代性地还包括以一定的形式施用根据本发明的如本文所定义的含有mrna的脂质纳米颗粒、(药物)组合物或疫苗,其中编码如本文所定义的抗原肽或蛋白或者其片段或变体、优选地形成该组合物或疫苗的一部分的mrna与如上所定义的另一种含有mrna的脂质纳米颗粒(优选地形成本发明的同一组合物或疫苗的一部分)平行地、在其之前或之后施用。优选地,(所有含有mrna的脂质纳米颗粒的)施用在一小时内,更优选在30分钟内,甚至更优选在15分钟、10分钟、5分钟、4分钟、3分钟或2分钟内或甚至在1分钟内进行。这种时间交错处理可以使用例如试剂盒,优选如本文所定义的多部分试剂盒进行。在优选的实施例中,重复施用本发明的药物组合物或疫苗,其中每次施用优选地包括单独施用本发明的组合物或疫苗的含有至少一种mrna的脂质纳米颗粒。在每个施用时间点,该至少一种mrna可以施用不止一次(例如2次或3次)。在本发明的特别优选的实施例中,至少两种、三种、四种、五种、六种或更多种mrna序列(各自编码如本文所定义的一种不同抗原)包封在如上所定义的含有mrna的脂质纳米颗粒内或与之相关联,其中这些mrna序列是相同或不同脂质纳米颗粒的mrna化合物的部分,在每个时间点施用,其中每种mrna通过注射施用两次,分布在四肢上。以下反应方案说明制备式(i)、(ii)或(iii)的脂质的方法。一般反应方案1式(i)的脂质的实施例(例如化合物a-5)可以根据一般反应方案1(“方法a”)制备,其中r为饱和或不饱和的c1-c24烷基或者饱和或不饱和的环烷基,m为0或1,并且n为从1至24的整数。参考一般反应方案1,结构a-1的化合物可以从商业来源购买或根据本领域普通技术人员熟悉的方法制备。用dcc处理a-1、a-2和dmap的混合物,得到溴化物a-3。将溴化物a-3、碱(例如n,n-二异丙基乙胺)和n,n-二甲基二胺a-4的混合物在足以在任何必要的后处理和/或纯化步骤后产生a-5的温度和时间下加热。一般反应方案2式(i)的化合物的其他实施例(例如化合物b-5)可以根据一般反应方案2(“方法b”)制备,其中r为饱和或不饱和的c1-c24烷基或者饱和或不饱和的环烷基,m为0或1,并且n为从1至24的整数。如一般反应方案2中所示,结构b-1的化合物可以从商业来源购买或根据本领域普通技术人员熟悉的方法制备。用酰氯b-2(1当量)和碱(例如三乙胺)处理b-1(1当量)溶液。用氧化剂(例如氯铬酸吡啶)处理粗产物,回收中间产物b-3。然后用还原剂(例如三乙酰氧基硼氢化钠)处理粗b-3、酸(例如乙酸)和n,n-二甲基氨基胺b-4的溶液,以在任何必要的后处理和/或纯化之后获得b-5。应当注意,尽管起始材料a-1和b-1在上面描述为仅包含饱和亚甲基碳,但是包含碳-碳双键的起始材料也可用于制备包含碳-碳双键的化合物。一般反应方案3式(i)的脂质的不同实施例(例如化合物c-7或c9)可以根据一般反应方案3(“方法c”)制备,其中r为饱和或不饱和的c1-c24烷基或者饱和或不饱和的环烷基,m为0或1,并且n为从1至24的整数。参考一般反应方案3,结构c-1的化合物可以从商业来源购买或根据本领域普通技术人员熟悉的方法制备。一般反应方案4式(ii)的化合物的实施例(例如化合物d-5和d-7)可根据一般反应方案4(“方法d”)制备,其中r1a、r1b、r2a、r2b、r3a、r3b、r4a、r4b、r5、r6、r8、r9、l1、l2、g1、g2、g3、a、b、c和d如本文所定义,并且r7’代表r7或c3-c19烷基。参考一般反应方案1,结构d-1和d-2的化合物可以从商业来源购买或根据本领域普通技术人员熟悉的方法制备。用还原剂(例如三乙酰氧基硼氢化钠)处理d-1和d-2的溶液,在任何必要的后处理后得到d-3。用酰氯d-4(或羧酸和dcc)处理d-3和碱(例如三甲胺,dmap)的溶液,以在任何必要的后处理和/或纯化之后获得d-5。可以用lialh4d-6还原d-5,以在任何必要的后处理和/或纯化后获得d-7。一般反应方案5式(ii)的脂质的实施例(例如化合物e-5)可根据一般反应方案5(“方法e”)制备,其中r1a、r1b、r2a、r2b、r3a、r3b、r4a、r4b、r5、r6、r7、r8、r9、l1、l2、g3、a、b、c和d如本文所定义。参考一般反应方案2,结构e-1和e-2的化合物可以从商业来源购买或根据本领域普通技术人员熟悉的方法制备。加热e-1(过量)、e-2和碱(例如碳酸钾)的混合物,以在任何必要的后处理之后获得e-3。用酰氯e-4(或羧酸和dcc)处理e-3和碱(例如三甲胺,dmap)的溶液,以在任何必要的后处理和/或纯化之后获得e-5。一般反应方案6根据一般反应方案6(方法f)制备式(ii)的化合物的其他实施例(例如f-9)。如一般反应方案6中所示,经适当保护的酮(f-1)在还原胺化条件下与胺f-2反应,得到f-3。用酰氯f-4酰化f-3,得到酰化产物f-5。除去f-5上的醇保护基团,然后与f-7和/或f-8以及适当的活化试剂(例如dcc)反应,得到所需的化合物f-9。一般反应方案7一般反应方案7提供了用于制备式(iii)的脂质的示例性方法(方法g)。一般反应方案7中的g1、g3、r1和r3如本文针对式(iii)所定义,并且g1′是指g1的一碳较短同系物。购买或根据本领域已知的方法制备结构g-1的化合物。在适当的缩合条件(例如dcc)下,g-1与二醇g-2反应得到酯/醇g-3,然后可将其(例如,pcc)氧化成醛g-4。在还原胺化条件下g-4与胺g-5的反应产生式(iii)的脂质。应注意,用于制备式(iii)的脂质的各种替代性策略是本领域的普通技术人员可得到的。例如,l1和l2不是酯的式(iii)的其他脂质可以使用适当的起始材料根据类似方法制备。此外,一般反应方案6描述了g1和g2是相同的式(iii)的脂质的制备;然而,这不是本发明的必需方面,并且对上述反应方案的修改可以产生g1和g2不同的化合物。本领域技术人员应理解,在本文所述的方法中,中间体化合物的官能团可能需要通过合适的保护基团保护。此类官能团包括羟基、氨基、巯基和羧酸。适用于羟基的保护基团包括三烷基甲硅烷基或二芳基烷基甲硅烷基(例如,叔丁基二甲基甲硅烷基、叔丁基二苯基甲硅烷基或三甲基甲硅烷基)、四氢吡喃基、苄基等。适用于氨基、脒基和胍基的保护基团包括叔丁氧基羰基、苄氧基羰基等。适用于巯基的保护基团包括-c(o)-r″(其中r″是烷基、芳基或芳烷基)、对甲氧基苄基、三苯甲基等。适用于羧酸的保护基团包括烷基、芳基或芳烷基酯。可以根据标准技术添加或去除保护基团,这些技术是本领域技术人员已知的并且如本文所述。在green,t.w.和p.g.m.wutz,protectivegroupsinorganicsynthesis[有机合成中的保护基团](1999),第3版,wiley中详细描述了保护基团的使用。如本领域技术人员所理解的,保护基团也可以是聚合物树脂,例如wang树脂、rink树脂或2-氯三苯甲基氯树脂。脂质纳米颗粒组合物的制备:lnp如下制备。将阳离子脂质、dspc、胆固醇和peg-脂质溶解在乙醇中。以大约10∶1至30∶1的总脂质与mrna重量比制备脂质纳米颗粒(lnp)。简而言之,将mrna在10mm至50mm的柠檬酸盐缓冲液(ph4)中稀释至0.05mg/ml至0.2mg/ml。使用注射泵将乙醇脂质溶液与mrna水溶液以约1∶5至1∶3(体积/体积)的比率混合,总流速高于15ml/min。然后除去乙醇,通过透析用pbs替换外部缓冲液。最后,通过0.2μm孔无菌过滤器过滤脂质纳米颗粒。使用malvernzetasizernano(英国马尔文公司(malvern,uk))通过准弹性光散射测定,脂质纳米颗粒的粒径为70nm至90nm。项目项目1.一种脂质纳米颗粒,该脂质纳米颗粒包含(i)具有式i的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体,其中:l1和l2各自独立地为-o(c=o)-、-(c=o)o-或碳-碳双键;r1a和r1b在每次出现时独立地为(a)h或c1-c12烷基,或者(b)r1a是h或c1-c12烷基,并且r1b和它所结合的碳原子一起与相邻r1b和它所结合的碳原子合在一起形成碳-碳双键;r2a和r2b在每次出现时独立地为(a)h或c1-c12烷基,或者(b)r2a是h或c1-c12烷基,并且r2b和它所结合的碳原子一起与相邻r2b和它所结合的碳原子合在一起形成碳-碳双键;r3a和r3b在每次出现时独立地为(a)h或c1-c12烷基,或者(b)r3a是h或c1-c12烷基,并且r3b和它所结合的碳原子一起与相邻r3b和它所结合的碳原子合在一起形成碳-碳双键;r4a和r4b在每次出现时独立地为(a)h或c1-c12烷基,或者(b)r4a是h或c1-c12烷基,并且r4b和它所结合的碳原子一起与相邻r4b和它所结合的碳原子合在一起形成碳-碳双键;r5和r6各自独立地为甲基或环烷基;r7在每次出现时独立地为h或c1-c12烷基;r8和r9各自独立地为c1-c12烷基;或者r8和r9与它们所附接的氮原子一起形成包含一个氮原子的5、6或7元杂环;a和d各自独立地为从0至24的整数;b和c各自独立地为从1至24的整数;并且e为1或2;(ii)包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中该mrna化合物任选地不包含核苷修饰,特别是不包含碱基修饰,其中该mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。项目2.一种脂质纳米颗粒,该脂质纳米颗粒包含(i)具有式ii的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体,其中:l1和l2各自独立地为o(c=o)、(c=o)o、c(=o)、o、s(o)x、ss、c(=o)s、sc(=o)、nrac(=o)、c(=o)nra、nrac(=o)nra、oc(=o)nra、nrac(=o)o或直接键;g1为c1-c2亚烷基、-(c=o)、-o(c=o)、sc(=o)、-nrac(=o)-或直接键g2为-c(=o)、(c=o)o-、c(=o)s-、c(=o)nra或直接键;g3为c1-c6亚烷基;ra为h或c1-c12烷基;r1a和r1b在每次出现时独立地为:(a)h或c1-c12烷基;或(b)r1a为h或c1-c12烷基,并且r1b和它所结合的碳原子一起与相邻r1b和它所结合的碳原子合在一起形成碳-碳双键;r2a和r2b在每次出现时独立地为:(a)h或c1-c12烷基;或(b)r2a为h或c1-c12烷基,并且r2b和它所结合的碳原子一起与相邻r2b和它所结合的碳原子合在一起形成碳-碳双键;r3a和r3b在每次出现时独立地为:(a)h或c1-c12烷基;或(b)r3a为h或c1-c12烷基,并且r3b和它所结合的碳原子一起与相邻r3b和它所结合的碳原子合在一起形成碳-碳双键;r4a和r4b在每次出现时独立地为:(a)h或c1-c12烷基;或(b)r4a为h或c1-c12烷基,并且r4b和它所结合的碳原子一起与相邻r4b和它所结合的碳原子合在一起形成碳-碳双键;r5和r6各自独立地为h或甲基;r7为c4-c20烷基;r8和r9各自独立地为c1-c12烷基;或者r8和r9与它们所附接的氮原子一起形成5、6或7元杂环;a、b、c和d各自独立地为从1至24的整数;并且x为0、1或2;(ii)包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中该mrna化合物任选地不包含核苷修饰,特别是不包含碱基修饰;其中该mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。项目3.一种脂质纳米颗粒,该脂质纳米颗粒包含(i)具有式iii的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体,其中:l1或l2各自独立地为-o(c=o)-、-(c=o)o-、-c(=o)-、-o-、-s(o)x-、-s-s-、c(=o)s-、sc(=o)-、-nrac(=o)-、-c(=o)nra-、nrac(=o)nra、-oc(=o)nra-或nrac(=o)o-,优选地l1或l2为-o(c=o)-或-(c=o)o-;g1和g2各自独立地为未取代的c1-c12亚烷基或c1-c12亚烯基;g3为c1-c24亚烷基、c1-c24亚烯基、c3-c8亚环烷基、或c3-c8亚环烯基;ra为h或c1-c12烷基;r1和r2各自独立地为c6-c24烷基或c6-c24烯基;r3为h、or5、cn、c(=o)or4、oc(=o)r4或-nr5c(=o)r4;r4为c1-c12烷基;r5为h或c1-c6烷基;并且x为0、1或2;(ii)包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中该mrna化合物任选地不包含核苷修饰,特别是不包含碱基修饰;其中该mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。项目4.一种脂质纳米颗粒,该脂质纳米颗粒包含:(i)具有式(iv)的peg脂质其中r8和r9各自独立地为含有从10至30个碳原子的直链或支链、饱和或不饱和烷基链,其中该烷基链任选地被一个或多个酯键中断;并且w具有从30至60范围内的平均值;并且(ii)包含编码至少一种抗原肽或蛋白的mrna序列的mrna化合物,其中该mrna化合物任选地不包含核苷修饰,特别是不包含碱基修饰;其中该mrna化合物包封在所述脂质纳米颗粒中或与所述脂质纳米颗粒相关联。项目5.根据项目1至3中任一项所述的脂质纳米颗粒,该脂质纳米颗粒另外包含(iii)具有式(iv)的peg脂质:其中r8和r9各自独立地为含有从10至30个碳原子的直链或支链、饱和或不饱和烷基链,其中该烷基链任选地被一个或多个酯键中断;并且w具有从30至60范围内的平均值。项目6.根据项目3或5所述的脂质纳米颗粒,其中该阳离子脂质是式iii的化合物,并且其中:l1和l2各自独立地为-o(c=o)-或(c=o)-o-;g3为c1-c24亚烷基或c1-c24亚烯基;并且r3为h或or5。项目7.根据项目3、5或6中任一项所述的脂质纳米颗粒,其中该阳离子脂质是式iii的化合物,并且其中:l1和l2各自独立地为-o(c=o)-或(c=o)-o-;r1和r2各自独立地具有以下结构之一:项目8.根据项目3或5至7中任一项所述的脂质纳米颗粒,其中该阳离子脂质是式iii的化合物,并且其中r3为oh。项目9.根据项目1至3或5至8中任一项所述的脂质纳米颗粒,其中该阳离子脂质选自结构i-1至i-41、ii-1至ii-34或iii-1至iii-36,或者表7:式(i)的代表性脂质、表8:式(ii)的代表性脂质、或表9:式(iii)的代表性脂质。项目10.根据项目1至3或5至9中任一项所述的脂质纳米粒,其中该阳离子脂质选自:项目11.根据项目4至10中任一项所述的脂质纳米颗粒,其中在该peg脂质中r8和r9为饱和烷基链。项目12.根据项目11所述的脂质纳米颗粒,其中该peg脂质为其中n具有从30至60范围内的平均值。项目13.根据项目1至12中任一项所述的脂质纳米颗粒,其中该mrna化合物包含至少一种化学修饰,并且其中该mrna化合物优选地不包含核苷修饰,其中所述核苷修饰任选地为碱基修饰,并且其中所述碱修饰任选地为1-甲基假尿苷修饰。项目14.根据项目13所述的脂质纳米颗粒,其中该化学修饰选自包括糖修饰、骨架修饰和脂质修饰的组。项目15.根据项目1至14中任一项所述的脂质纳米颗粒,其中该mrna序列是人工mrna序列。项目16.根据项目1至15中任一项所述的脂质纳米颗粒,其中该编码至少一种抗原肽或蛋白的mrna序列的编码区包含序列修饰。项目17.根据项目16所述的脂质纳米颗粒,其中该序列修饰选自该序列的g/c含量修饰、密码子修饰、密码子优化或c-优化。项目18.根据项目17所述的脂质纳米颗粒,其中该mrna序列的编码区的g/c含量与野生型mrna的相应编码序列的g/c含量相比增加,或者其中该mrna序列的编码区的c含量与野生型mrna的相应编码序列的c含量相比增加,或者其中该mrna序列的编码区中的密码子使用适应人类密码子使用,或者其中密码子适应指数(cai)在该mrna序列的编码区中增加或最大化,其中该mrna序列的所编码氨基酸序列与野生型mrna的所编码氨基酸序列相比优选地不被修饰。项目19.根据项目1至18中任一项所述的脂质纳米颗粒,其中该mrna序列另外包含a)5′-帽结构,和/或b)poly(a)序列,和/或c)poly(c)序列。项目20.根据项目19所述的脂质纳米颗粒,其中该mrna序列包含poly(a)序列,其中该poly(a)序列包含约25个至约400个腺苷核苷酸的序列,优选约50个至约400个腺苷核苷酸的序列,更优选约50个至约300个腺苷核苷酸的序列,甚至更优选约50个至约250个腺苷核苷酸的序列,最优选约60个至约250个腺苷核苷酸的序列。项目21.根据项目1至19中任一项所述的脂质纳米颗粒,其中该mrna序列另外包含至少一个组蛋白茎环。项目22.根据项目21所述的脂质纳米颗粒,其中该至少一个组蛋白茎-环包含根据下式(v)或(vi)的核酸序列:式(v)(没有茎边界元件的茎-环序列):式(vi)(具有茎边界元件的茎-环序列):其中茎1或茎2边界元件n1-6是1个至6个、优选2个至6个、更优选2个至5个、甚至更优选3个至5个、最优选4个至5个或5个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;茎1[n0-2gn3-5]与元件茎2反向互补或部分反向互补,并且是5个至7个核苷酸的连续序列;其中n0-2是0个至2个、优选0个至1个、更优选1个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;其中n3-5是3个至5个、优选4个至5个、更优选4个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物,并且环序列[n0-4(u/t)n0-4]位于元件茎1与茎2之间,并且是3个至5个核苷酸、更优选4个核苷酸的连续序列;其中每个n0-4彼此独立地是0个至4个、优选1个至3个、更优选1个至2个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;并且其中u/t代表尿苷或任选地胸苷;茎2[n3-5cn0-2]与元件茎1反向互补或部分反向互补,并且是5个至7个核苷酸的连续序列;其中n3-5是3个至5个、优选4个至5个、更优选4个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;其中n0-2是0个至2个、优选0个至1个、更优选1个n的连续序列,其中每个n彼此独立地选自从a、u、t、g和c中选择的核苷酸、或其核苷酸类似物;并且其中c是胞苷或其类似物,并且可以任选地被鸟苷或其类似物取代,条件是其在茎1中的互补核苷酸鸟苷被胞苷取代。项目23.根据项目21或22所述的脂质纳米颗粒,其中该至少一个组蛋白茎环包含根据seqidno:224305的核酸序列和/或最优选地根据seqidno:224306的rna序列。项目24.根据项目19至23中任一项所述的脂质纳米颗粒,其中该mrna序列包含poly(a)序列,该poly(a)序列优选地包含10个至200个、10个至100个、40个至80个或50个至70个腺苷核苷酸,和/或poly(c)序列,该poly(c)序列优选地包含10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸。项目25.根据项目1至24中任一项所述的脂质纳米颗粒,其中该mrna序列优选地以5′至3′方向包含以下元件:a)5′-帽结构,优选m7gpppn,b)编码至少一种抗原肽或蛋白的至少一个编码区,c)poly(a)尾,它优选地由10个至200个、10个至100个、40个至80个或50个至70个腺苷核苷酸组成,d)任选地poly(c)尾,它优选地由10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸组成,以及e)任选地组蛋白茎-环,它优选地包含根据seqidno:224306的rna序列项目26.根据项目1至25中任一项所述的脂质纳米颗粒,其中该mrna序列包含3′-utr元件。项目27.根据项目26所述的脂质纳米颗粒,其中该至少一个3′-utr元件包含衍生自提供稳定mrna的基因的3′-utr或衍生自其同源物、片段或变体的核酸序列,或由该核酸序列组成。项目28.根据项目26或27所述的脂质纳米颗粒,其中该3′-utr元件包含衍生自α-珠蛋白基因的3′-utr的核酸序列,优选地包含根据seqidno:224297的核酸序列的相应rna序列、其同源物、片段或变体。项目29.根据项目26至28中任一项所述的脂质纳米颗粒,其中该至少一个3′-utr元件包含核酸序列,该核酸序列衍生自脊椎动物白蛋白基因的3′-utr或衍生自其变体,优选地衍生自哺乳动物白蛋白基因的3′-utr或衍生自其变体,更优选地衍生自人白蛋白基因的3′-utr或衍生自其变体,甚至更优选地衍生自根据genbank登录号nm_000477.5的人白蛋白基因的3′utr或衍生自其片段或变体。项目30.根据项目26至29中任一项所述的脂质纳米颗粒,其中该3-′utr元件衍生自根据seqidno:224301或224303的核酸序列,优选地衍生自相应rna序列,或者其同源物、片段或变体。项目31.根据项目1至30中任一项所述的脂质纳米颗粒,其中该mrna序列优选地以5′至3′方向包含以下元件:a)5′-帽结构,优选m7gpppn,b)编码至少一种抗原肽或蛋白的至少一个编码区,c)3′-utr元件,它包含衍生自α珠蛋白基因的核酸序列或由其组成,优选地包含根据seqidno:224297的核酸序列的相应rna序列、其同源物、片段或变体;d)poly(a)尾,它优选地由10个至200个、10个至100个、40个至80个或50个至70个腺苷核苷酸组成,e)任选地poly(c)尾,它优选地由10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸组成,以及f)任选地组蛋白茎-环,它优选地包含根据seqidno:224306的rna序列。项目32.根据项目1至31中任一项所述的脂质纳米颗粒,其中该mrna序列包含5′-utr元件。项目33.根据项目32所述的脂质纳米颗粒,其中该5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自top基因的5′-utr,优选地衍生自相应rna序列、其同源物、片段或变体,优选地缺少5′top基序。项目34.根据项目33所述的脂质纳米颗粒,其中该5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自编码核糖体蛋白的top基因的5′-utr,优选地衍生自相应rna序列或衍生自其同源物、片段或变体,优选地缺少5′top基序。项目35.根据项目34所述的脂质纳米颗粒,其中该5′-utr元件包含核酸序列或由其组成,该核酸序列衍生自编码核糖体大蛋白(rpl)的top基因的5′-utr或衍生自其同源物、片段或变体,优选地缺少5′top基序,更优选地包含根据seqidno:224287的核酸序列的相应rna序列或由其组成。项目36.根据项目35所述的脂质纳米颗粒,其中该衍生自top基因的5′-utr的5′-utr元件包含根据seqidno:224287或224289的核酸序列的相应rna序列或由其组成。项目37.根据项目1至36中任一项所述的脂质纳米颗粒,其中该mrna序列优选地以5′至3′方向包含以下元件:a)5′-帽结构,优选m7gpppn,b)5′-utr元件,它包含衍生自top基因的5′-utr的核酸序列或由其组成,优选地包含根据seqidno:224287或224289的核酸序列的相应rna序列、其同源物、片段或变体或者由其组成;c)编码至少一种抗原肽或蛋白的至少一个编码区;d)3′-utr元件,它包含衍生自白蛋白基因的核酸序列或由其组成,优选地包含根据seqidno:224303的核酸序列的相应rna序列、其同源物、片段或变体;e)poly(a)尾,它优选地由10个至200个、10个至100个、40个至80个或50个至70个腺苷核苷酸组成,f)任选地poly(c)尾,它优选地由10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸组成,以及g)任选地组蛋白茎-环,它优选地包含根据seqidno:224306的rna序列。项目38.根据项目1至37中任一项所述的脂质纳米颗粒,其中该抗原肽或蛋白衍生自病原性抗原、肿瘤抗原、过敏性抗原或自身免疫性自身抗原或者其片段或变体。项目39.根据项目38所述的脂质纳米颗粒,其中该病原性抗原衍生自流感病毒或狂犬病毒。项目40.根据项目39所述的脂质纳米颗粒,其中该抗原肽或蛋白衍生自流感病毒的血凝素(ha)、神经氨酸酶(na)、核蛋白(np)、基质蛋白1(m1)、基质蛋白2(m2)、非结构蛋白1(ns1)、非结构蛋白2(ns2)、核输出蛋白(nep)、聚合酶酸性蛋白(pa)、聚合酶碱性蛋白pb1、pb1-f2或聚合酶碱性蛋白2(pb2)或者其片段或变体。项目41.根据项目40所述的脂质纳米颗粒,其中该抗原肽或蛋白衍生自流感病毒的血凝素(ha)或神经氨酸酶(na)或者其片段或变体。项目42.根据项目41所述的脂质纳米颗粒,其中该抗原肽或蛋白是流感病毒的血凝素(ha)的至少一种全长蛋白和/或神经氨酸酶(na)的至少一种全长蛋白或其变体。项目43.根据项目39至41中任一项所述的脂质纳米颗粒,其中该流感病毒选自甲型、乙型或丙型流感病毒。项目44.根据项目43所述的脂质纳米颗粒,其中该甲型流感病毒选自特征在于选自由h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15、h16、h17和h18组成的组的血凝素(ha)的流感病毒。项目45.根据项目43或44所述的脂质纳米颗粒,其中该甲型流感病毒选自特征在于选自由n1、n2、n3、n4、n5、n6、n7、n8、n9、n10和n11组成的组的神经氨酸酶(na)的流感病毒。项目46.根据项目43至45中任一项所述的脂质纳米颗粒,其中该甲型流感病毒选自由h1n1、h1n2、h2n2、h3n1、h3n2、h3n8、h5n1、h5n2、h5n3、h5n8、h5n9、h7n1、h7n2、h7n3、h7n4、h7n7、h7n9、h9n2和h10n7组成的组,优选地选自h1n1、h3n2、h5n1。项目47.根据项目39至46中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自流感病毒的血凝素(ha)或者其片段或变体的至少一种抗原肽或蛋白以及衍生自流感病毒的神经氨酸酶(na)或者其片段或变体的至少一种抗原肽或蛋白。项目48.根据项目39至47中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自甲型流感病毒的血凝素(ha)或者其片段或变体的至少一种抗原肽或蛋白和/或衍生自甲型流感病毒的神经氨酸酶(na)或者其片段或变体的至少一种抗原肽或蛋白,该甲型流感病毒选自由h1n1、h1n2、h2n2、h3n1、h3n2、h3n8、h5n1、h5n2、h5n3、h5n8、h5n9、h7n1、h7n2、h7n3、h7n4、h7n7、h7n9、h9n2和h10n7组成的组,优选地选自h1n1、h3n2、h5n1。项目49.根据项目39至48中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一个编码区,该至少一个编码区编码根据seqidno:1-14031的衍生自甲型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白或者其片段或变体。项目50.根据项目39-49中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一种rna序列,该至少一种rna序列选自与根据seqidno:32013-46043、64025-78055、96037-110067、128049-142079、160061-174091、192073-206103的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。项目51.根据项目39-50中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一个编码区,该至少一个编码区编码根据seqidno:26398-28576的衍生自乙型流感病毒的血凝素(ha)的至少一种抗原肽或蛋白或者其片段或变体。项目52.根据项目39至51中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一种rna序列,该至少一种rna序列选自与根据seqidno:58410-60588、90422-92600、122434-124612、154446-156624、186458-188636、218470-220648的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。项目53.根据项目39至52中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一个编码区,该至少一个编码区编码根据seqidno:14032-26397的衍生自甲型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白或者其片段或变体。项目54.根据项目39至53中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一种rna序列,该至少一种rna序列选自与根据seqidno:46044-58409、78056-90421、110068-122433、142080-154445、174092-186457、206104-218469的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。项目55.根据项目39至54中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一个编码区,该至少一个编码区编码根据seqidno:28577-30504的衍生自乙型流感病毒的神经氨酸酶(na)的至少一种抗原肽或蛋白或者其片段或变体。项目56.根据项目39至55中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一种rna序列或rna序列的混合物,该rna序列选自与根据seqidno:60589-62516、92601-94528、124613-126540、156625-158552、188637-190564、220649-222576的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。项目57.根据项目39至56中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自狂犬病毒的糖蛋白g(rav-g、ravbv-g或rabv-g)、核蛋白n(rav-n)、磷酸化蛋白p(rav-p)、基质蛋白m(rav-m)或rna聚合酶l(rav-l)或其片段、变体的至少一种抗原肽或蛋白。项目58.根据项目39至57中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一个编码区,该至少一个编码区编码衍生自根据seqidno:30505-32012的狂犬病毒的糖蛋白g(rav-g、ravbv-g或rabv-g)或者其片段或变体的至少一种抗原肽或蛋白。项目59.根据项目39至58中任一项所述的脂质纳米颗粒,其中该mrna序列包含至少一种rna序列,该至少一种rna序列选自与根据seqidno:62517-64024、94529-96036、126541-128048、158553-160060、190565-192072、222577-224084的rna序列或者其片段或变体相同或至少50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的rna序列。项目60.根据项目1至59中任一项所述的脂质纳米颗粒,其中该mrna化合物包含至少两个mrna序列,其中该至少两个mrna序列编码两种不同的抗原肽和/或蛋白。项目61.根据项目1至59中任一项所述的脂质纳米颗粒,该脂质纳米颗粒包含至少两种不同的mrna化合物,每种化合物包含编码至少一种抗原肽或蛋白的mrna序列。项目62.根据项目1至61中任一项所述的脂质纳米颗粒,该脂质纳米颗粒另外包含:(iv)中性脂质;和/或(v)类固醇或类固醇类似物。项目63.根据项目62所述的脂质纳米颗粒,其中该中性脂质选自包括以下项的组:二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二棕榈酰磷脂酰胆碱(dppc)、二油酰磷脂酰甘油(dopg)、二棕榈酰磷脂酰甘油(dppg)、二油酰磷脂酰乙醇胺(dope)、棕榈酰油酰磷脂酰胆碱(popc)、棕榈酰油酰磷脂酰乙醇胺(pope)和二油酰磷脂酰乙醇胺4-(n-马来酰亚胺甲基)-环己烷-1-羧酸酯(dope-mal)、二棕榈酰磷脂酰乙醇胺(dppe)、二肉豆蔻酰磷酸乙醇胺(dmpe)、二硬脂酰磷脂酰乙醇胺(dspe)、16-o-单甲基pe、16-o-二甲基pe、18-1-反式pe、1-硬脂酰-2-油酰磷脂酰乙醇胺(sope)和1,2-二油酰-sn-甘油-3-磷酸乙醇胺(反式dope)。项目64.根据项目63所述的脂质纳米颗粒,其中该中性脂质是1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dspc),并且其中该阳离子脂质与dspc的摩尔比任选地在从约2∶1至8∶1的范围内。项目65.根据项目62至64中任一项所述的脂质纳米颗粒,其中该类固醇是胆固醇,并且其中该阳离子脂质与胆固醇的摩尔比任选地在从约2∶1至1∶1的范围内。项目66.一种用于制备根据项目5至67中任一项所述的脂质纳米颗粒的方法,该方法包括以下步骤:(i)提供a)如上所定义的式(i)的阳离子脂质或其药学上可接受的盐、互变异构体、前药或立体异构体,和/或如上所定义的式(ii)的阳离子脂质或其药学上可接受的盐、互变异构体、前药或立体异构体,和/或如上所定义的式iii的阳离子脂质:或其药学上可接受的盐、互变异构体、前药或立体异构体;和/或b)具有式(iv)的peg脂质:如上所定义;c)包含编码至少一种抗原肽或蛋白的mrna序列的至少一种mrna化合物,其中该mrna化合物任选地不包含核苷修饰,特别是不包含碱基修饰,以及d)任选地类固醇;以及e)任选地中性脂质;(ii)将该阳离子脂质和/或该peg脂质以及任选地该中性脂质和/或该类固醇或类固醇衍生物溶解在乙醇中;(iii)将该乙醇脂质溶液与包含该mrna多核苷酸的水溶液混合(iv)除去乙醇;以及任选地(v)分离或纯化这些脂质纳米颗粒。项目67.根据项目66所述的方法,其中在步骤(iv)中,通过透析或渗滤除去乙醇。项目68.根据项目66或67所述的方法,其中在步骤(v)中,这些脂质纳米颗粒通过过滤,优选地通过无菌过滤器过滤而纯化。项目69.一种包含至少一种根据项目1至65中任一项所述的脂质纳米颗粒的药物组合物。项目70.根据项目69所述的药物组合物,该药物组合物至少包含根据项目1至65中任一项所述的第一脂质纳米颗粒和第二脂质纳米颗粒,其中该第二脂质纳米颗粒包含的mrna化合物不同于该第一脂质纳米颗粒包含的mrna化合物。项目71.根据项目69或70所述的药物组合物,该药物组合物另外包含药学上可接受的佐剂或赋形剂。项目72.根据项目1至65中任一项所述的脂质纳米颗粒或根据项目69至71中任一项所述的药物组合物作为药物使用。项目73.根据项目72所述使用的脂质纳米颗粒或药物组合物,其中该药物用于治疗性或预防性地提高有需要的受试者的免疫应答。项目74.根据项目72或73所述使用的脂质纳米颗粒或药物组合物,其中该药物用于预防或治疗癌症或肿瘤疾病、传染病、过敏或自身免疫性疾病或与其相关的病症。项目75.根据项目72至74中任一项所述使用的脂质纳米颗粒或药物组合物,其中该药物是疫苗。项目76.根据项目75所述使用的脂质纳米颗粒或药物组合物,其中该药物是肿瘤、流感或狂犬病疫苗。项目77.根据项目76所述使用的脂质纳米颗粒或药物组合物,其中该药物是用于狂犬病治疗的狂犬病疫苗。项目78.根据项目72至77中任一项所述使用的脂质纳米颗粒或药物组合物,其中该受试者是脊椎动物,优选哺乳动物。项目79.根据项目72至78中任一项所述使用的脂质纳米颗粒或药物组合物,其中该药物用于肠胃外施用,并且其中肠胃外施用包括注射。项目80.根据项目78至79中任一项所述使用的脂质纳米颗粒或药物组合物,其中该受试者是鸟,优选鸡,或哺乳动物,该哺乳动物优选地选自包括山羊、牛、猪、狗、猫、驴、猴、猿,诸如小鼠、仓鼠、兔子的啮齿类动物,特别是人的组。项目81.一种用于在有需要的受试者中提高免疫应答的方法,该方法包括向该受试者施用根据项目1至65中任一项所述的脂质纳米颗粒或根据项目69至72中任一项所述的药物组合物。项目82.一种用于在有需要的受试者中预防或治疗癌症或肿瘤疾病、传染病、过敏或自身免疫性疾病或与其相关的障碍的方法,该方法包括向该受试者施用根据项目1至65中任一项所述的脂质纳米颗粒或根据项目69至72中任一项所述的药物组合物。附图说明以下所示的附图仅仅是说明性的,并且将以进一步的方式描述本发明。这些附图不应被解释为将本发明限制于此。图1a-1b:显示腹膜内荧光素注射后24小时(图1a)和48小时(图1b)小鼠的生物发光成像结果。与相同量的未配制的mrna相比,在肌内应用后,mrna的lnp制剂导致了显著增加的和剂量依赖性的蛋白表达。图2a-2g:显示在肌内注射后48小时在器官裂解物中测得的ppluc表达。报告了每组的来自各个器官的荧光素酶相对光单位(rlu)(图2a=脑、图2b=心脏、图2c=肾、图2d=肝、图2e=肺、图2f=肌肉、图2g=脾)。图3a-3b:显示在用三种不同的lnp配制的ha-mrna初免接种后21天(图3a)和加强接种后14天(图3b)的hi滴度。虚线指示1∶40的常规定义的保护性hi滴度。图4a-4d:显示在用三种不同的lnp配制的ha-mrna初免接种后21天和加强接种后14天以及加强接种后14天的elisa测定结果(初免后第21天的igg1亚型显示于图4a中,加强后第14天的igg1亚型显示于图4b中,初免后第21天的igg2a亚型显示于图4c中,加强后第14天的igg2a亚型显示于图4d中)。图5a-5c:显示在使用细胞内细胞因子染色诱导抗原特异性t细胞后的t细胞测定结果。图5a显示产ifnγ/tnfα的cd4t细胞,图5b显示产ifnγ/tnfα的cd8t细胞,图5c显示产ifnγ/cd107+的cd8t细胞。图6a-6b:显示在用三种不同的lnp配制的ha-mrna初免接种后21天(图6a)和加强接种后14天(图6b)的hi滴度。虚线指示1∶40的常规定义的保护性hi滴度。图7a-7d:显示在用三种不同的lnp配制的ha-mrna初免接种后21天和加强接种后14天以及加强接种后14天的elisa测定结果(初免后第21天的igg1亚型显示于图7a中,加强后第14天的igg1亚型显示于图7b中,初免后第21天的igg2a亚型显示于图7c中,加强后第14天的igg2a亚型显示于图7d中)。图8a-8c:显示在使用细胞内细胞因子染色诱导抗原特异性t细胞后的t细胞测定结果。图8a显示产ifnγ/tnfα的cd4t细胞,图5b显示产ifnγ/tnfα的cd8t细胞,图8c显示产ifnγ/cd107+的cd8t细胞。图9a-9b:显示在用三种不同的lnp配制的ha-mrna初免接种后21天(图6a)和仅使用1μglnp-配制的ha-mrna加强接种后14天(图6b)的hi滴度。虚线指示1∶40的常规定义的保护性hi滴度。图10a-10d:显示在用三种不同的lnp配制的ha-mrna初免接种后21天和加强接种后14天以及加强接种后14天的elisa测定结果(初免后第21天的igg1亚型显示于图10a中,加强后第14天的igg1亚型显示于图10b中,初免后第21天的igg2a亚型显示于图10c中,加强后第14天的igg2a亚型显示于图10d中)。图11:显示使用elispot通过ifnγ产量所度量的t细胞免疫应答。图12:显示在用lnp-iii-3配制的编码ha的mrna肌内接种nhp后抗体滴度分析的结果。图13:显示在用lnp-iii-3配制的编码rabv-g的mrna肌内接种nhp后的狂犬病毒中和滴度(vnt)。图14:显示在用lnp-iii-3配制的ha-mrna接种后的hi滴度分析。图15a-15d:显示在用lnp-iii-3配制的mrna接种后的细胞因子分析的结果(图15a=ifnγ,图15b=il-6,图15c=il-8,图15d=tnf)。图16a-16b:显示在用lnp-iii-3配制的编码rabv-g的mrna肌内接种小鼠后的狂犬病毒中和滴度(vnt)(图16a=第21天的vnt;图16b=第35天的vnt)。图17a-17c:显示在第35天用5μg、1μg和0.5μglnp配制的mrna免疫两次的小鼠的t细胞测定的结果(图17a显示产ifnγ/tnfα的cd4t细胞,图17b显示产ifnγ/tnfα的cd8t细胞,图17c显示产ifnγ/cd107+的cd8t细胞)。阴性dmso对照在图中用虚线表示。图18a-18d:显示肝损伤分析的结果,即第1天和第21天的ast水平(图18a-18b)以及第1天和第21天的alt水平(图18c-18d)的测定。图19a-19d:显示通过检测针对特定流感病毒的igg2a抗体来检测ha特异性免疫应答(b细胞免疫应答),这些病毒即甲型流感/加利福尼亚州/7/2009(h1n1;图19a),甲型流感/香港/4801/2014(h3n2;图19b),乙型流感/布里斯班/60/2008(b;图19c)和甲型流感/越南/1203/2004(h5n1;图19d)。图20:显示甲型流感病毒的示例性血凝素(ha)蛋白(参见章节“本发明的优选序列”;图例:第一列:蛋白或核酸登录号(genbank);第二列(a):蛋白序列野生型seqidno:;第三列(b):核苷酸序列野生型seqidno:;第四列(c):优化的核苷酸序列seqidno:)图21:显示乙型流感病毒的示例性血凝素(ha)蛋白(参见章节“本发明的优选序列”;图例:第一列:蛋白或核酸登录号(genbank);第二列(a):蛋白序列野生型seqidno:;第三列(b):核苷酸序列野生型seqidno:;第四列(c):优化的核苷酸序列seqidno:)图22:显示甲型流感病毒的示例性神经氨酸酶(na)蛋白(参见章节“本发明的优选序列”;图例:第一列:蛋白或核酸登录号(genbank);第二列(a):蛋白序列野生型seqidno:;第三列(b):核苷酸序列野生型seqidno:;第四列(c):优化的核苷酸序列seqidno:)图23:显示乙型流感病毒的示例性神经氨酸酶(na)蛋白(参见章节“本发明的优选序列”;图例:第一列:蛋白或核酸登录号(genbank);第二列(a):蛋白序列野生型seqidno:;第三列(b):核苷酸序列野生型seqidno:;第四列(c):优化的核苷酸序列seqidno:)图24:显示狂犬病毒的示例性糖蛋白(参见章节“本发明的优选序列”;图例:第一列:蛋白或核酸登录号(genbank);第二列(a):蛋白序列野生型seqidno:;第三列(b):核苷酸序列野生型seqidno:;第四列(c):优化的核苷酸序列seqidno:)图25:显示与注射rila(a)或influsplit(b)的对照相比,在用编码不同流感抗原(c-f)的四种mrna的组合接种的小鼠中,存在h1n1流感(甲型流感/加利福利亚州/7/2009)特异性总igg1和igg2抗体。对于每个设置(a-f),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表a。实例12中提供了实验的详细描述。图26:显示与注射rila(a)或influsplit(b)的对照相比,在用编码不同流感抗原(c-f)的四种mrna的组合接种的小鼠中的h1n1流感(甲型流感/加利福利亚州/7/2009)特异性hi滴度。对于每个设置(a-f),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表a。实例12中提供了实验的详细描述。图27:显示与注射rila(a)或influsplit(b)的对照相比,在用编码不同流感抗原(c-f)的四种mrna的组合接种的小鼠中,存在h3n2流感(甲型流感/香港/4801/2014)特异性总igg1和igg2抗体。对于每个设置(a-f),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表a。实例12中提供了实验的详细描述。图28:显示与注射rila(a)或influsplit(b)的对照相比,在用编码不同流感抗原(c-f)的四种mrna的组合接种的小鼠中的h3n2流感(甲型流感/香港/4801/2014)特异性hi滴度。对于每个设置(a-f),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表a。实例12中提供了实验的详细描述。图29:显示与注射rila(a)或influsplit(b)的对照相比,在用编码不同流感抗原(c-f)的四种mrna的组合接种的小鼠中,存在乙型流感(乙型流感/布里斯班/60/2008)特异性总igg1和igg2抗体。对于每个设置(a-f),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表a。实例12中提供了实验的详细描述。图30:显示与注射rila(a)或influsplit(b)的对照相比,在用编码不同流感抗原(c-f)的四种mrna的组合接种的小鼠中,存在乙型流感(乙型流感/普吉岛/3073/2013)特异性总igg1和igg2抗体。对于每个设置(a-f),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表a。实例12中提供了实验的详细描述。图31:显示用编码不同流感抗原(c-f)的四种mrna的组合接种小鼠诱导了针对h1n1(甲型流感/加利福利亚州/7/2009)、h3n2(甲型流感/香港/4801/2014)、乙型流感(乙型流感/布里斯班/60/2008)、乙型流感(乙型流感/普吉岛/3073/2013)的cd4+t细胞应答(分别为1-4)。作为对照,用缓冲液刺激细胞(5)。作为进一步的对照,给小鼠注射rila(a)或influsplit(b)。接种方案,参见表a。实例12中提供了实验的详细描述。图32:显示用编码不同流感抗原(c-f)的四种mrna的组合接种小鼠诱导了针对h1n1(甲型流感/加利福利亚州/7/2009)的cd8+t细胞应答(1)。作为对照,用缓冲液刺激细胞(5)。作为进一步的对照,给小鼠注射rila(a)或influsplit(b)。接种方案,参见表a。实例12中提供了实验的详细描述。图33:显示与注射rila(a)或fluarix(b)的对照相比,在用编码不同流感抗原(c-e)的四种mrna的组合接种的小鼠中,存在h1n1流感(甲型流感/加利福利亚州/7/2009)特异性总igg1和igg2抗体。对于每个设置(a-e),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表b。实例13中提供了实验的详细描述。图34:显示与注射rila(a)或fluarix(b)的对照相比,在用编码不同流感抗原(c-e)的四种mrna的组合接种的小鼠中的h1n1流感(甲型流感/加利福利亚州/7/2009)特异性hi滴度。对于每个设置(a-e),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表b。实例13中提供了实验的详细描述。图35:显示与注射rila(a)或fluarix(b)的对照相比,在用编码不同流感抗原(c-e)的四种mrna的组合接种的小鼠中,存在h3n2流感(甲型流感/香港/4801/2014)特异性总igg1和igg2抗体。对于每个设置(a-e),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表b。实例13中提供了实验的详细描述。图36:显示与注射rila(a)或fluarix(b)的对照相比,在用编码不同流感抗原(c-e)的四种mrna的组合接种的小鼠中的h3n2流感(甲型流感/香港/4801/2014)特异性hi滴度。对于每个接种设置(a-e),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表b。实例13中提供了实验的详细描述。图37:显示与注射rila(a)或fluarix(b)的对照相比,在用编码不同流感抗原(c-e)的四种mrna的组合接种的小鼠中,存在乙型流感(乙型流感/布里斯班/60/2008)特异性总igg1和igg2抗体。对于每个设置(a-e),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表b。实例13中提供了实验的详细描述。图38:显示与注射rila(a)或fluarix(b)的对照相比,在用编码不同流感抗原(c-e)的四种mrna的组合接种的小鼠中,存在h5n1流感(甲型流感/越南/1203/2004)特异性总igg1和igg2抗体。对于每个设置(a-e),显示三个不同的时间点(第21天、第35天和第49天)。接种方案,参见表b。实例13中提供了实验的详细描述。图39:显示用编码不同流感抗原(c-e)的四种mrna的组合接种小鼠诱导了针对h1n1(甲型流感/加利福利亚州/7/2009)、h3n2(甲型流感/香港/4801/2014)、乙型流感(乙型流感/布里斯班/60/2008)、h5n1(甲型流感/越南/1203/2004)的cd4+t细胞应答(分别为1-4)。作为对照,用缓冲液刺激细胞(5)。作为进一步的对照,给小鼠注射rila(a)或influsplit(b)。接种方案,参见表b。实例13中提供了实验的详细描述。图40:显示用编码不同流感抗原(c-f)的四种mrna的组合接种小鼠诱导了针对h1n1(甲型流感/加利福利亚州/7/2009)、h5n1(甲型流感/越南/1203/2004)的cd8+t细胞应答(1和2)。作为对照,用缓冲液刺激细胞(3)。作为进一步的对照,给小鼠注射rila(a)或influsplit(b)。接种方案,参见表b。实例13中提供了实验的详细描述。图41:显示与注射rila(a)或(b)的对照相比,在用lnp配制的编码n1流感(甲型流感/加利福利亚州/7/2009)神经氨酸酶的mrna接种的小鼠的血清样品中,存在结合性n1流感(甲型流感/加利福利亚州/7/2009)神经氨酸酶特异性抗体和ella滴度(50%抑制滴度)(c和d)。接种方案,参见表c。实例14中提供了实验的详细描述。图42:显示用编码n1流感(甲型流感/加利福利亚州/7/2009)神经氨酸酶的mrna接种小鼠诱导了针对神经氨酸酶的cd4+t细胞应答(c和d)。作为对照,给小鼠注射rila(a)或(b)。接种方案,参见表c。实例14中提供了实验的详细描述。图43:显示用编码n1流感(甲型流感/加利福利亚州/7/2009)神经氨酸酶的mrna接种小鼠诱导了针对神经氨酸酶的cd8+t细胞应答(c和d)。作为对照,给小鼠注射rila(a)或(b)。接种方案,参见表c。实例14中提供了实验的详细描述。图44:显示lnp配制的编码ravbv-g的mrna诱导促炎性环境。显示了肌肉中四个不同时间点(4小时、14小时、24小时和96小时)的细胞因子水平(tnf、il6)。箭头表示用lnp配制的mrna接种的小鼠的数据系列。值代表具有sd的6个样品的平均值。实例15中提供了实验的详细描述。图45:显示lnp配制的编码ravbv-g的mrna诱导促炎性环境。显示了dln中四个不同时间点(4小时、14小时、24小时和96小时)的细胞因子水平(tnf、il6)。箭头表示用lnp配制的mrna接种的小鼠的数据系列。值代表具有sd的6个样品的平均值。实例15中提供了实验的详细描述。图46:显示在用lnp配制的编码ravbv-g的mrnai.m.接种后没有tnf的全身释放。显示了血清中四个不同时间点(4小时、14小时、24小时和96小时)的细胞因子水平(tnf、il6)。箭头表示用lnp配制的mrna接种的小鼠的数据系列。值代表具有sd的6个样品的平均值。实例15中提供了实验的详细描述。图47:显示lnp配制的编码ravbv-g的mrna诱导促炎性环境。显示了肌肉中四个不同时间点(4小时、14小时、24小时和96小时)的趋化因子水平(mip-1β、cxcl9)。箭头表示用lnp配制的mrna接种的小鼠的数据系列。值代表具有sd的6个样品的平均值。实例15中提供了实验的详细描述。图48:显示lnp配制的编码ravbv-g的mrna诱导促炎性环境。显示了dln中四个不同时间点(4小时、14小时、24小时和96小时)的趋化因子水平(mip-1β、cxcl9)。箭头表示用lnp配制的mrna接种的小鼠的数据系列。值代表具有sd的6个样品的平均值。实例15中提供了实验的详细描述。图49:显示lnp配制的编码ravbv-g的mrna诱导促炎性环境。显示了血清中四个不同时间点(4小时、14小时、24小时和96小时)的趋化因子水平(mip-1β、cxcl9)。箭头表示用lnp配制的mrna接种的小鼠的数据系列。值代表具有sd的6个样品的平均值。实例15中提供了实验的详细描述。图50a-50b:显示lnp配制的f*mrna诱导dln内先天和适应性免疫细胞的数量和活化的增加。在图50a中,显示了dln中三个不同时间点(4小时、24小时和48小时)的cd4+t细胞、nk细胞、cd11b+grl+细胞(单核细胞和粒细胞)和总细胞的数量。在图50b中,显示了三个不同时间点(4小时、24小时和48小时)的表达活化标记物cd69的cd4+t细胞、cd8+t细胞、b细胞和nk细胞的频率。箭头表示用lnp配制的mrna注射的小鼠的数据系列。值代表具有sd的6个样品的平均值。实例15中提供了实验的详细描述。图51:显示用lnp配制的编码rabv-g的mrna接种猴在单次i.m.接种后诱导了狂犬病毒中和滴度(vnt)。显示了在接种前(“给药前”)和第一次接种后(“初免后”)的两种mrna浓度(1μg和10μg)。虚线表示常规定义的vnt保护性滴度。实例16中提供了实验的详细描述。图52:显示用lnp配制的编码rabv-g的mrna接种猴(第0天初免接种,第28天加强接种)后vnt的动力学。虚线表示常规定义的vnt保护性滴度。实例16中提供了实验的详细描述。图53:显示了在加强前(“回忆前(prerecall)”)和加强接种后(“回忆后(postrecall)”)的两种mrna浓度(1μg和10μg)。虚线表示常规定义的vnt保护性滴度。实例16中提供了实验的详细描述。图54:lnp配制的ravbv-gmrna疫苗比nhp中的许可疫苗诱导了针对狂犬病的更强的功能性免疫应答。在第0天和第28天用lnp配制的rabv-gmrna、或在第0天和第28天用灭活狂犬病毒疫苗(一次加强)接种的nhp(n=2只雄性/组,2只雌性/组)的血清中的狂犬病vnt。虚线表示常规定义的vnt保护性滴度。实例16中提供了实验的详细描述。图55:lnp配制的ravbv-gmrna疫苗在猴中诱导了rabv-g特异性cd4+t细胞。显示了最后一次接种后7天(第35天)血液中rabv-g特异性ifnγ+/il-2+cd4+细胞的频率。将pbmc用覆盖rabv-g蛋白(rabv-g肽)的重叠肽文库刺激、或不进行刺激(介质)并通过ics进行分析。实例16中提供了实验的详细描述。图56:lnp配制的ravbv-gmrna疫苗在猴中诱导了rabv-g特异性cd8+t细胞。显示了最后一次接种后7天(第35天)血液中rabv-g特异性ifnγ+/grzb+cd8t细胞的频率。将pbmc用覆盖rabv-g蛋白(rabv-g肽)的重叠肽文库刺激、或不进行刺激(介质)并通过ics进行分析。实例16中提供了实验的详细描述。图57:显示用lnp配制的编码h1n1或h3n2株的流感ha抗原的mrna接种猴在单次i.m.接种后诱导了功能性抗体。显示了接种前(“给药前”)和第一次接种后(“初免后”)的hi滴度。虚线表示常规定义的hi保护性滴度。实例17中提供了实验的详细描述。图58:显示用lnp配制的编码h1n1ha的mrna接种猴(第0天初免接种,第28天加强接种)后hi滴度的动力学(具有sem的平均值)。显示了长达544天的hi滴度的时间进程。虚线表示常规定义的hi保护性滴度。三角形:用10μg接种的猴的数据点;矩形:用1μg接种的猴的数据点。实例17中提供了实验的详细描述。图59:lnp配制的h3n2-hamrna疫苗比nhp中的许可疫苗诱导了针对流感的更强的功能性免疫应答。显示了在第0天和第28天用lnp配制的h3n2-hamrna或佐剂化疫苗接种的nhp的血清中的h3n2-hi滴度。虚线表示常规定义的hi保护性滴度。实例17中提供了实验的详细描述。图60:lnp配制的h3n2-hamrna疫苗在猴中诱导了h3n2特异性cd4+t细胞。将pbmc用覆盖h3n2-ha蛋白(h3n2-ha肽)的重叠肽文库刺激、或不进行刺激(介质)并通过ics进行分析。图60a:显示了最后一次接种后7天(第35天)血液中h3n2-ha特异性ifnγ+/il-2+cd4+细胞的频率。图60b:显示了最后一次接种后7天(第35天)血液中h3n2-ha特异性tnfα+/il-2+cd4+细胞的频率。实例17中提供了实验的详细描述。图61a-61b:显示在用lnp-iii-3配制的编码rabv-g的mrna肌内接种小鼠后的狂犬病毒中和滴度(vnt)(图60a=第21天的vnt;图60b=第35天的vnt)。实例7中提供了实验的详细描述。图62a-62b:显示在用lnp-iii-3配制的编码rabv-g的mrna肌内接种小鼠后的狂犬病毒中和滴度(vnt)(图60a=第21天的vnt;图60b=vnt第35天),其中应用在5℃下储存了三个月的lnp。实例20中提供了实验的详细描述。图63a-63d:显示用lnp配制的四价mrna疫苗接种雪貂诱导了功能性抗体。对于所指示的组(a-d组),显示了分别在第0天、第21天、第35天和第49天测得的数据。图63a:ha甲型流感/加利福利亚州/07/09的hi滴度;图63a:ha甲型流感/香港/4801/2014的hi滴度;图63c:ha乙型流感/布里斯班/60/2008的hi滴度;图63d:ha乙型流感/普吉岛/3073/2013的mn滴度。未显示阳性对照(d组,fluad),因为fluad不含ha乙型流感/普吉岛。实例22中提供了实验的详细描述。图64:显示用lnp配制的三价namrna疫苗接种小鼠诱导了结合性流感na抗体。显示了ella(50%抑制滴度)。图64a显示针对所指示的组的n1流感甲型流感/加利福利亚州/7/2009的ella滴度;图64b显示针对所指示的组的n1流感甲型流感/香港/4801/2014的ella滴度;图64c显示针对所指示的组的na乙型流感/布里斯班/60/2008的ella滴度。1=mrna疫苗,2=对照;3=缓冲液对照。实例24中提供了实验的详细描述。图65:显示在用lnp配制的七价ha/namrna疫苗接种的小鼠中存在h1n1甲型流感/加利福尼亚州/7/2009的ha特异性的总igg1和igg2a抗体。对于每个设置(第1-6组),显示三个不同的时间点(第21天、第35天和第49天)(elisa)。实例25中提供了实验的详细描述。图66:显示在用lnp配制的七价ha/namrna疫苗接种的小鼠中存在h3n2甲型流感/香港/4801/2014的ha特异性的总igg1和igg2a抗体。对于每个设置(第1-6组),显示三个不同的时间点(第21天、第35天和第49天)(elisa)。实例25中提供了实验的详细描述。图67:显示在用七价ha/namrna疫苗接种的小鼠中存在乙型流感/布里斯班/60/2008的ha特异性的总igg1和igg2a抗体(elisa)。对于每个设置(第1-6组),显示三个不同的时间点(第21天、第35天和第49天)。实例25中提供了实验的详细描述。图68:显示在用lnp配制的七价ha/namrna疫苗接种的小鼠中存在乙型流感/普吉岛/3073/2013的ha的总igg1和igg2a抗体(elisa)。对于每个设置(第1组-第6组),显示三个不同的时间点(第21天、第35天和第49天)。实例25中提供了实验的详细描述。图69:显示在用lnp配制的七价ha/namrna疫苗接种的小鼠中存在h1n1甲型流感/加利福利亚州/7/2009的na特异性抗体。对于每个设置(第1组-第6组),显示三个不同的时间点(第21天、第35天和第49天)。图69a:h1n1甲型流感/加利福利亚州/7/2009的na特异性抗体;图69b:h3n2甲型流感/香港/4801/2014的na特异性抗体;图69c:乙型流感/布里斯班/60/2008的na特异性抗体。实例25中提供了实验的详细描述。图70:显示用lnp配制的七价ha/namrna疫苗接种小鼠诱导了功能性抗体。对于所指示的组(第1组-第6组),显示了在第49天测得的数据。图63a:ha甲型流感/加利福利亚州/07/09的hi滴度;图63a:ha甲型流感/香港/4801/2014的hi滴度。实例25中提供了实验的详细描述。图71:显示lnp配制的gp(埃博拉)mrna疫苗在小鼠中诱导强烈的igg1和igg2a抗体应答。实例26中提供了实验的详细描述。图72:显示lnp配制的mrna疫苗当皮下施用时诱导了强烈且耐久的hi滴度。实例27中提供了实验的详细描述。图73:显示用1μglnp配制的ovamrna(组分a)和32μg鱼精蛋白配制的ovamrna(组分b)接种后第7天血液中ova特异性cd8阳性t细胞的比较。1μglnp配制的ovamrna(组分a)在皮内施用后诱导了更高水平的循环抗原特异性cd8阳性t细胞。实例28中提供了实验的详细描述。图74:显示在用1μglnp配制的ovamrna(组分a)和32μg鱼精蛋白配制的ovamrna(组分b)加强接种动物后第21天血液中ova特异性cd8阳性t细胞的比较。在皮内施用后,1μglnp配制的ovamrna(组分a)诱导了可增强水平的循环抗原特异性cd8阳性t细胞。实例28中提供了实验的详细描述。图75:显示用1μglnp配制的ovamrna(组分a)和32μg鱼精蛋白配制的ovamrna(组分b)接种后血液中多功能ova特异性cd8阳性t细胞的比较。1μglnp配制的ovamrna疫苗(组分a)在皮内施用后诱导了高水平的多功能cd8阳性t细胞。实例28中提供了实验的详细描述。图76:显示用1μglnp配制的ovamrna(组分a)和32μg鱼精蛋白配制的ova-mrna(组分b)接种后ova特异性igg2c滴度的比较。1μglnp配制的ovamrna疫苗(组分a)在皮内施用后导致ova特异性igg2c滴度增加。实例28中提供了实验的详细描述。图77:显示用1μglnp配制的ovamrna(组分a)和无关lnp配制的pplucmrna(组分b)接种后荷瘤小鼠的中值肿瘤生长的比较。与使用无关mrna(组分b)的其他治疗相比,1μglnp配制的ovamrna(组分a)强烈降低了肿瘤体积中值。实例29中提供了实验的详细描述。图78:显示用1μglnp配制的ovamrna(组分a)和无关lnp配制的pplucmrna(组分b)接种后肿瘤挑战小鼠的总存活率的比较。与其他处理(组分b和缓冲液)相比,1μglnp配制的ovamrna(组分a)大大增加了肿瘤挑战小鼠的存活率。实例29中提供了实验的详细描述。图79:显示用1μglnp配制的trp2mrna(组分a)和无关lnp配制的pplucmrna(组分b)与两种检查点抑制剂抗-pd1和抗-ctla4相结合接种后荷瘤小鼠的中位肿瘤生长的比较。与使用无关mrna(组分b)与检查点抑制剂或对照抗体相结合的其他治疗相比,1μglnp配制的trp2mrna(组分a)强烈降低了肿瘤体积中值。实例30中提供了实验的详细描述。图80:显示用1μglnp配制的trp2mrna(组分a)和无关lnp配制的pplucmrna(组分b)与两种检查点抑制剂抗-pd1和抗-ctla4相结合接种后肿瘤挑战小鼠的存活率的比较。与其他治疗(组分b与检查点抑制剂或对照抗体相结合)相比,1μglnp配制的trp2mrna(组分a)增加了肿瘤挑战小鼠的存活率。实例30中提供了实验的详细描述。实例通过参考以下实验实例进一步详细描述本发明。提供这些实例仅用于说明的目的,除非另有说明,否则无意为限制性的。因此,本发明决不应被解释为限于以下实例,而是应该被解释为涵盖由于本文提供的传授内容而变得明显的任何和所有变化。无需进一步描述,据信,本领域的普通技术人员可使用前面的描述和以下说明性实例完成且利用本发明并实施所要求保护的方法。因此,以下工作实例具体指出了本发明的优选实施例,并且不应解释为以任何方式限制本披露的其余部分。实例1:mrna构建体的制备对于本实例,制备了编码不同蛋白的dna序列并将其用于随后的rna体外转录反应。编码蛋白的dna序列通过引入gc优化的稳定序列来修饰野生型编码dna序列而制备。将序列引入衍生的puc19载体中。为了进一步稳定化和/或增加翻译,在编码区的5′和/或3′引入utr元件。在实例中使用了以下mrna构建体:萤火虫(photinuspvralis)荧光素酶:-衍生自32l4核糖体蛋白的5′-top-utr-富含gc的编码ppluc的编码序列-衍生自白蛋白基因的3′-utr-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224286)。流感血凝素(ha):-衍生自32l4核糖体蛋白的5′-top-utr-富含gc的编码甲型流感/加利福利亚州/07/2009(h1n1)的ha的编码序列-衍生自白蛋白基因的3′-utr-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224118)-富含gc的编码甲型流感/加利福利亚州/07/2009(h1n1)的ha的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224117)-富含gc的编码甲型流感/香港/4801/2014(h3n2)的ha的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224181)-富含gc的编码乙型流感/布里斯班/60/2008的ha的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224236)-富含gc的编码甲型流感/越南/1203/2004(h5n1)的ha的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224200)-富含gc的编码甲型流感/荷兰/602/2009(h1n1)的ha的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224166)-富含gc的编码乙型流感/布里斯班/60/2008的ha的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224236)-富含gc的编码乙型流感/普吉岛/3073/2013的ha的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224246)流感神经氨酸酶(na):-富含gc的编码甲型流感/加利福利亚州/07/2009(h1n1)的na的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224318)-富含gc的编码甲型流感/香港/4801/2014(h3n2)的na的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224336)-富含gc的编码乙型流感/布里斯班/60/2008的na的编码序列-衍生自人α珠蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224348)狂犬病:-rabv-ga:富含gc的编码巴斯德株的糖蛋白(rabv-g)(genbank登录号:aaa47218.1)的编码序列-衍生自人α殊蛋白的3′-utr(muag)-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224276)-rabv-gb:衍生自32l4核糖体蛋白的5′-top-utr-富含gc的编码巴斯德株的糖蛋白(rabv-g)(genbank登录号:aaa47218.1)的编码序列-衍生自白蛋白基因的3′-utr-64个腺苷的段-30个胞嘧啶的段-组蛋白茎-环序列(seqidno:224280)。埃博拉:-埃博拉病毒的gp:富含gc的编码zebov塞拉利昂2014的糖蛋白的编码序列;衍生自32l4核糖体蛋白的5′-top-utr-衍生自白蛋白基因的3′-utr(seqidno:224362)。使用本领域已知的常用方案,将获得的质粒dna构建体转化并在细菌(大肠杆菌)中繁殖。随后,使用ecori将dna质粒酶促线性化,并在合适的缓冲条件下在核苷酸混合物和帽类似物(m7gpppg)存在下,使用dna依赖性t7rna聚合酶体外全长转录(invitrorun-offtranscription)而转录。使用(德国蒂宾根curevac公司(curevac,tübingen,germany);wo2008/077592a1)纯化所得的mrna,并用于进一步的实验。向nhp施用作为鱼精蛋白制剂的rabv-ga和作为lnp制剂的rabv-gb。包含多于一种编码不同流感蛋白/抗原的mrna的组合物也可以根据pct申请pct/ep2016/082487中披露的程序制备。示例lnp制剂根据pct公开号wo2015/199952、wo2017/004143和wo2017/075531中所述的一般程序制备脂质纳米颗粒、阳离子脂质和聚合物缀合的脂质(peg-脂质),并进行了测试,这些专利的全部披露内容以援引方式并入本文。使用可电离的氨基脂质(阳离子脂质)、磷脂、胆固醇和peg化脂质制备了脂质纳米颗粒(lnp)配制的mrna。lnp如下制备。将阳离子脂质、dspc、胆固醇和peg-脂质以大约50∶10∶38.5∶1.5或47.5∶10∶40.8∶1.7的摩尔比溶解在乙醇中。用于实例的lnp包括例如阳离子脂质化合物iii-3和前述组分。包含化合物iii-3的脂质纳米颗粒(lnp)以0.03-0.04w/w的mrna与总脂质比率制备。简而言之,将mrna在10mm至50mm的柠檬酸盐缓冲液(ph4)中稀释至0.05mg/ml至0.2mg/ml。使用注射泵将乙醇脂质溶液与mrna水溶液以约1∶5至1∶3(体积/体积)的比率混合,总流速高于15ml/min。然后除去乙醇,通过透析用pbs替换外部缓冲液。最后,通过0.2μm孔无菌过滤器过滤脂质纳米颗粒。使用malvernzetasizernano(英国马尔文公司)通过准弹性光散射测定,脂质纳米颗粒的粒径为60nm至90nm。对于本说明书中提到的其他阳离子脂质化合物,配制过程类似。实例2:i.m.施用lnp配制的mrna后的ppluc表达在经肌内注射(i.m.)到胫骨肌后24小时和48小时测定balb/c小鼠中荧光素酶(ppluc)的表达。因此,根据表i将0.1μg、1μg和10μg编码ppluc的mrna用lnp配制得到相应的lnp制剂。作为对照,提供未配制的pplucmrna(10μg和1μg)。在0小时的时间点,按照表i中所示的方案,用pplucmrna转染每组四只小鼠。表i(实例2):转染方案在24小时和48小时后,使用60秒的暴露时间,在腹膜内荧光素注射后10分钟用ivisluminaii成像系统进行小鼠的体内生物发光成像。通过测量感兴趣区域中的光子通量(光子数/秒)来量化生物发光值。48小时后,处死小鼠并收集肌肉、肺、肝、脾、脑、肾和心脏,在干冰中快速冷冻并储存在-80℃下用于进一步分析。将器官样品在组织裂解器(德国希尔登凯杰公司(qiagen,hilden,germany))中全速裂解3分钟。然后添加800μl裂解缓冲液,将所得溶液在组织裂解器中全速再处理6分钟。在4℃下以13500rpm离心10分钟后,将上清液与荧光素缓冲液(25mm双甘氨肽、15mmmgso4、5mmatp、62.5μm荧光素)混合,并使用chameleon酶标仪(海达斯公司(hidex))检测发光。结果:如在图1a和图1b中可以看出,在肌内施用后24小时(图1a)和48小时(图1b),与相同量的未配制的mrna相比,mrna的lnp制剂导致了显著增加的蛋白表达。观察到ppluc的剂量依赖性表达。如图2a-2g中所示,在肌内注射后48小时在器官裂解物中测量ppluc表达。报告了每组的各个器官的荧光素酶相对光单位(rlu)。正如预料的那样,在注射部位观察到强荧光素酶表达。值得注意的是,仅在10μg的最高剂量的lnp配制的mrna下,在脾脏中检测到荧光素酶表达,在肝、肾和肺中检测到的量较低(图2a=脑、图2b=心脏、图2c=肾、图2d=肝、图2e=肺、图2f=肌肉、图2g=脾)。实例3:肌内(i.m.)施用lnp配制的mrna后的免疫原性将lnp配制的ha-mrna用于测试肌内(i.m.)施用后的免疫原性。具体地,如上所述施用作为lnp制剂的富含gc的h1n1(荷兰2009)-hamrna序列。对于接种,根据表ii中所示的接种方案,向8只balb/c小鼠肌内注射到双腿的胫骨肌(每条腿25μl)中。显然,将10μg编码流感ha的mrna用lnp配制(如上所述)得到用于接种的相应lnp制剂;未配制的mrna(10μg)用作对照。表ii(实例3):接种方案在第0天,进行初免接种。用缓冲液接种的动物用作阴性对照。在第21天,从球后窦采集血样并施用加强接种。35天后,处死小鼠并采集血液和器官样品(脾)用于进一步分析。在第35天分离脾细胞,并用ha肽文库刺激以用于t细胞分析。对于免疫原性测定,在初免后3周和加强后2周分析血清中的血凝抑制(hi)滴度。通过细胞内染色和流式细胞术测量了激活的、ha特异性的多功能cd4+和cd8+t细胞(ifn-γ+/tnf+)的频率。应用elisa测定抗体滴度。血凝抑制测定:血凝抑制(hi)测定用于分析功能性抗ha抗体滴度。将小鼠血清热灭活(56℃,30分钟),与高岭土(德国卡尔罗斯公司(carlroth,germany))一起温育,然后预先吸附到鸡红细胞(crbc;德国罗曼畜产公司(lohmanntierzucht,germany))上。将50μl2倍稀释的预处理血清与4个血凝单位(hau)的灭活甲型流感/加利福尼亚州/7/2009(h1n1)病毒(英国国家生物制品检定所(nibsc,uk))一起温育45分钟,然后添加50μl0.5%crbc。通过能够抑制血凝的血清的最高稀释度的倒数来确定hi滴度。elisa:通过检测流感特异性igg1和igg2a抗体来进行抗原特异性免疫应答(b细胞免疫应答)的检测。因此,在初免后21天和加强后14天从接种小鼠中获取血样,并制备血清。将maxisorb板(耐洁纽恩克国际公司(nalgenenuncinternational))用灭活病毒包被。用含有0.05%tween-20和1%bsa的1xpbs阻断后,将板与稀释的小鼠血清(如所示)一起温育。随后添加生物素偶联的二抗(抗小鼠-igg1和igg2a,pharmingen公司)。洗涤后,将板与辣根过氧化物酶-链霉亲和素一起温育,随后测量abts底物(2,2′-联氮-双(3-乙基-苯并噻唑啉-6-磺酸))的转化。细胞内细胞因子染色:在加强后14天使用细胞内细胞因子染色(ics)测定抗原特异性t细胞的诱导。分离来自接种小鼠和对照小鼠的脾细胞,并用ha肽文库(pepmixtm甲型流感(ha/加利福尼亚州(h1n1)),jpt公司)和抗cd28抗体(bd生物科学公司(bdbiosciences))在37℃在含有蛋白转运抑制剂brefeldina的golgiplug(bd生物科学公司)存在下刺激6小时。刺激后,使用cytofix/cytoperm试剂(bd生物科学公司)根据制造商说明洗涤细胞并针对细胞内细胞因子染色。将以下抗体用于染色:cd8-apch7(1∶100)、cd4-bdhorizonv450(1∶200)(bd生物科学公司)、thy1.2-fitc(1∶300)、tnfα-pe(1∶100)、ifn-γ-apc(1∶100)(ebioscience公司),并与1∶100稀释的fcγr阻断剂(fcγr-block)一起温育。将aqua染料用于区分活细胞/死细胞(英杰公司(invitrogen))。使用cantoii流式细胞仪(bd生物科学公司)获取细胞,并使用flowjo软件(树星公司(treestar))分析流式细胞术数据。结果:血凝抑制(hi)测定结果:如从图3a中显而易见的是,lnp配制的ha-mrna在初免接种后已经导致了非常高的hi滴度,即,在10μg剂量下的包含hamrna的所有3种不同的lnp在初免接种后21天诱导了高于1∶40的阈值的hi滴度。相反,未配制的mrna未达到1∶40的阈值。如从图3b中显而易见的是,加强接种后hi滴度甚至进一步增加(加强接种后14天)。虚线指示1∶40的常规定义的保护性hi滴度。elisa测定结果:lnp配制的ha-mrna与未配制的mrna相比在单次i.m.注射后已经诱导了显著更高的功能性抗体(igg1和igg2a亚型)滴度,如从图4a-4d中显而易见的是,在初免接种后21天以及在加强接种后14天。t细胞测定结果:如从图5a-5c中显而易见的是,观察到与未配制的mrna相比,lnp配制的ha-mrna显著诱导了更高水平的抗原特异性多功能cd4+t细胞和cd8+t细胞。介质对照如预料的那样从未产生应答。实例4:皮内(i.d.)施用lnp配制的mrna后的免疫原性将lnp配制的ha-mrna用于测试皮内(i.d.)施用后的免疫原性。具体地,如上所述施用lnp配制的富含gc的h1n1(荷兰2009)-hamrna序列。因此,根据表iii中所示的接种方案,每组8只小鼠各自进行皮内接种。显然,将10μgha-mrna用lnp配制(如上所述),以产生用于接种的相应lnp制剂;未配制的hamrna(10μg)用作对照。表iii(实例4):接种方案组处理rna剂量途径(体积)小鼠数量alnp-ii-9配制的hamrna10μgi.d.(25μl)8blnp-ii-10配制的ha-mrna10μgi.d.(25μl)8clnp-iii-3配制的ha-mrna10μgi.d.(25μl)8d未配制的ha-mrna10μgi.d.(25μl)8erila缓冲液-i.d.(25μl)8在0天的时间点,对每组8只小鼠施用初免接种。在第21天,采集血样并施用加强接种。35天后,处死小鼠并采集血液和器官样品(脾)用于进一步分析。对于免疫原性测定,测量hi滴度。应用elisa测定抗体滴度。此外,在加强接种后14天评估了cd4t细胞免疫应答(产ifnγ/tnfα的cd4t细胞)和cd8t细胞免疫应答(产ifnγ/tnfα的cd8t细胞和产cd107+ifnγ的cd8t细胞)。使用细胞内细胞因子染色(ics)测定抗原特异性t细胞的诱导。如上所述进行测定。结果:血凝抑制(hi)测定结果:如从图6a中显而易见的是,与未配制的mrna相比,lnp配制的ha-mrna在初免接种后已经导致了非常高的hi滴度。如从图6b中显而易见的是,加强接种后hi滴度甚至进一步增加。elisa测定结果:如从图7a-7d中显而易见的是,与未配制的mrna相比,在单次i.d.注射后,lnp配制的ha-mrna诱导了显著更高的功能性抗体(igg1和igg2a亚型)滴度。t细胞测定结果:如从图8a-8c中显而易见的是,观察到与未配制的mrna相比,lnp配制的ha-mrna显著诱导了更高水平的抗原特异性多功能cd4+t和cd8+t细胞。介质对照如预料的那样从未产生应答。实例5:肌内(i.m.)施用1μglnp配制的mrna后的免疫原性在以下实例中,将1μg的量的ha-mrna(h1n1(荷兰2009)-hamrna序列lnp制剂)用于如上所述测试肌内(i.m.)施用后的免疫原性。因此,根据表iv中所示的接种方案,每组8只balb/c小鼠各自在一条腿中肌内接种。显然,将1μgha-mrna用lnp配制(如上所述),以产生用于接种的相应lnp制剂;未配制的hamrna(10μg)用作对照。表iv(实例5):接种方案在0天的时间点,对每组8只小鼠施用初免接种。在第21天,采集血样并施用加强接种。35天后,处死小鼠并采集血液和器官样品(脾)用于进一步分析。对于免疫原性测定,测量hi滴度。应用elisa测定抗体滴度。进一步地,用ha重叠肽文库刺激冷冻的脾细胞,并通过使用elispot测量ifnγ产量来评估t细胞免疫应答。结果:免疫原性测定结果:如从图9a中显而易见的是,1μgha-mrna(lnp配制的)在初免接种后已经诱导了高于1∶40的阈值的hi滴度。如从图9b中显而易见的是,加强接种后hi滴度甚至进一步增加。elisa测定结果:与未配制的mrna相比,在单次i.m.注射后,1μgha-mrna(lnp配制的)诱导了显著更高的功能性抗体(igg1和igg2a亚型)滴度(参见图10a-10d)。t细胞测定结果:与未配制的mrna相比,1μgha-mrna(lnp配制的)导致了ifnγ的产生增加。介质对照如预料的那样从未产生应答(参见图11)。实例6:猴的ha-mrna和rabv-gmrna接种狂犬病mrna疫苗编码巴斯德株的糖蛋白(rabv-g)(genbank登录号:aaa47218.1)。使用经优化的mrna构建体(rabv-ga和b),它们含有相同的orf但具有不同的utr。鱼精蛋白配制的rabv-gmrna疫苗含有rabv-gmrnaa。如果没有另外说明,则未配制的或lnp配制的rabv-gmrna疫苗含有rabv-gmrnab(如上所述)。鱼精蛋白rna制剂为了制备鱼精蛋白复合的mrna(“制剂”),在用于体内接种实验之前,将获得的抗原mrna构建体与鱼精蛋白复合。mrna复合由50%的游离mrna和50%的与鱼精蛋白以2∶1的重量比复合的mrna的混合物组成。首先,通过向mrna添加鱼精蛋白-乳酸林格氏溶液,而使mrna与鱼精蛋白复合。温育10分钟后,当稳定地产生复合物时,添加游离mrna,并用乳酸林格氏溶液调节疫苗的最终浓度。将lnp配制的ha-mrna和如在前面的实例中制备的rabv-gmrna疫苗用于接种。在第1天和第29天,用lnp-iii-3配制的ha-mrna或rabv-gmrna(1μg或10μg如上所述的mrna)或鱼精蛋白配制的ha-mrna或rabv-gmrna(240μg)通过向股二头肌(500μl)中肌内注射而接种四只未产未孕的食蟹猴(macacafascicularis)。作为阴性对照,注射缓冲液。在第0天、第29天和第50天从股静脉采集血清样品。在第0天、第29天和第50天进行抗原特异性免疫应答的检测。血凝抑制测定:血凝抑制(hi)测定用于分析功能性抗ha抗体滴度。将非人灵长类动物(nhp)血清与受体破坏酶(rdeii,日本生研公司(denkaseiken,japan))在37℃下温育过夜,灭活(56℃,60分钟)然后与高岭土一起温育。将50μl2倍稀释的预处理血清与4个血凝单位(hau)的灭活甲型流感/加利福尼亚州/7/2009(h1n1)病毒(英国国家生物制品检定所(nibsc,uk))一起温育45分钟,然后添加50μl0.5%crbc。通过能够抑制血凝的血清的最高稀释度的倒数来确定hi滴度。抗体分析:使用灭活的甲型流感/加利福利亚州/7/2009(h1n1)病毒进行包被(1μg/ml)并使用抗人总igg-hrp(免疫研究公司(immunoresearch))作为检测抗体,通过elisa测量nhp血清中的ha特异性igg滴度。根据who方案,使用favn试验(荧光抗体病毒中和试验)和标准挑战病毒cvs-11,由德国hygiene-laborgmbh分析血清中的抗狂犬病毒中和滴度(vnt)。细胞因子分析:对于ha免疫在第1天和第29天以及对于rabv-g免疫在第1天在施用前以及给药后6和24小时从所有nhp采集nhp血样,以测定炎症生物标志物(g-csf、ifnγ、il-1β、il-2、il4、il-5、il-6、il-8和tnf)。使用基于luminex的prcytomag-40k试剂盒(md密理博公司(mdmillipore))分析血浆。体温:就在每次给药之前以及在每次给药后0.5小时、2小时、6小时和24小时通过直肠测量确定nhp的体温。结果:作为一般结果,单次肌内施用1μgmrna剂量(lnp-iii-3配制的)令人惊讶地在两种适应症狂犬病和流感中在所有接种的非人灵长类动物中均诱导了保护性抗体滴度。抗体滴度分析结果:中和抗体滴度分析的结果显示在图12中。用lnp-iii-3配制的编码ha的mrna肌内接种nhp令人惊讶地已经在用lnp-iii-3配制的ha-mrna初免接种后以剂量依赖性方式导致了中和抗体的强烈诱导。狂犬病毒中和滴度(vnt)结果:如图13所示,用lnp-iii-3配制的编码rabv-g的mrna肌内接种nhp在仅用1μglnp-iii-3配制的rabv-g-mrna初免接种后已令人惊讶地以剂量依赖性方式导致了中和抗体的强烈诱导,显示出在初免接种后>1iu/ml的vnt(中值)和在加强接种后约50iu/ml的vnt(中值)(等于或大于who规定的0.5iu/ml的抗体滴度的vnt被认为是保护相关的)。用10μglnp-iii-3配制的rabv-g-mrna单次接种诱导了17iu/ml的中值抗体滴度。在第二次接种后,滴度达到了419ui/ml的中值。hi滴度结果:如从图14中显而易见的是,lnp-iii-3配制的ha-mrna在初免接种后导致了非常高的hi滴度。详细地讲,用10μglnp-iii-3配制的ha-mrna接种在所有动物中均诱导了等于或高于1∶40的hi滴度的hi滴度,这在人类中被认为是保护性的。同样,如从图14中显而易见的是,hi滴度在第二次(加强)接种后甚至进一步增加。接受1μglnp-iii-3配制的ha-mrna的动物需要第二次接种在4只动物的3只中达到了保护性滴度,而接受240μg鱼精蛋白配制的ha-mrna的动物中没有一只表现出可检测的hi滴度。细胞因子分析结果:用lnp-iii-3配制的mrna接种后系统性细胞因子浓度保持低于il-1β、il4、il-5、il-6、ifn-γ和tnf的检测水平,或对于il-2、il-8和g-csf而言未增加(图15a-15d)。重要的是,与通常在人体中耐受良好的鱼精蛋白制剂相比,lnp制剂诱导了更低浓度的促炎性细胞因子tnf、ifn-γ和il-6。体温结果和其他结果:在非人灵长类动物中肌内施用lnp-iii-3配制的mrna未显示出对体温或体重的影响[数据未显示]。在接受lnp-iii-3配制的ha-mrna的每个组中的4只动物中仅有1只在注射部位显示出轻微的红斑和/或肿胀,在注射后24小时至96小时消退,在用rabv-g-mrna制剂接种后没有注射部位反应[数据未显示]。总之,nhp对lnp-iii-3配制的mrna耐受良好。实例7:肌内(i.m.)施用低剂量的lnp配制的rabv-gmrna后的免疫原性将量为0.5μg的lnp配制的rabv-g-mrna用于测试肌内(i.m.)施用后的免疫原性。使用的序列显示在seqidno:224276中。因此,balb/c小鼠各自根据表va中所示的接种方案在一条腿中肌内接种。未配制的rabv-gmrna(40μg)用作对照。表va(实例7):接种方案在0天的时间点,对每组8只小鼠施用初免接种,并在一天后取血样。在第21天,采集血样并施用加强接种。初免和加强接种分别在不同的腿即左腿和右腿进行。35天后,处死小鼠并收集血液和器官样品(脾脏和肝脏)以用于进一步分析。对于免疫原性测定,如前所述测量vnt,即根据who方案,使用favn试验(荧光抗体病毒中和试验)和标准挑战病毒cvs-11,由德国hygiene-laborgmbh分析血清中的抗狂犬病毒中和滴度(vnt)。评估了cd4t细胞免疫应答(产ifnγ/tnfα的cd4t细胞)和cd8t细胞免疫应答(产ifnγ/tnfα的cd8t细胞和产cd107+ifnγ的cd8t细胞)。如前所述进行测定。检查来自用5μglnp或缓冲液对照接种的动物的肝脏样本的组织学。在从第1天和第21天采集的血清样品中检测血清alt/ast水平。由德国mfd诊断公司(mfddiagnosticsgmbh)分析ast/alt和肝脏。结果:狂犬病毒中和滴度(vnt)结果:如图16a-16b所示,用lnp-iii-3配制的编码rabv-g的mrna对小鼠进行肌内接种令人惊讶地已经在已用0.5μglnp-iii-3配制的rabv-g-mrna初免接种后以剂量依赖性方式导致了中和抗体的强烈诱导。0.5iu/ml的who标准在图中用虚线表示。因此,5μg、1μg以及令人惊讶地还有0.5μg剂量的lnp-iii-3配制的rabv-gmrna在初免接种后诱导了与40μg未配制的mrna相比显著更高的应答(图16a)。用0.05μg和0.01μglnp-iii-3配制的mrna初免接种后未诱导vnt。0.1μglnp-iii-3配制的mrna在初免接种后诱导的vnt在10只动物的5只中等于或高于who标准。在加强接种后,vnt甚至增加(图16b)。由于图16a/16b的vnt水平看起来甚至更高但通过实验vnt检测却有限(稀释的样品仍然看起来处于饱和状态),进行了类似的实验并产生了新的vnt分析(参见表vb中所示的接种方案)。pbs缓冲液用作对照。表vb(实例7):接种方案如图61a-61b所证明,用lnp-iii-3配制的编码rabv-g的mrna对小鼠进行肌内接种令人惊讶地已经在已用0.1μg、0.3μg和0.9μglnp-iii-3配制的rabv-g-mrna初免接种后以剂量依赖性方式导致了中和抗体的极强诱导。0.5iu/ml的who标准在图中用虚线表示。因此,0.1μg、0.3μg和0.9μg剂量的lnp-iii-3配制的rabv-gmrna在初免接种后诱导的应答显著高于采用未配制的mrna的先前实验。加强接种后,vnt甚至增加(图60b;数据显示中位数-用曼-惠特尼法(mann-whitney)检验)。结果:t细胞测定结果:如从图17a-17c中显而易见的是,在用5μg、1μg和0.5μg免疫两次的小鼠中观察到了t细胞应答。因此,与未配制的mrna相比,0.5μg的lnp配制的mrna已显著诱导了高水平的抗原特异性多功能cd4+t和cd8+t细胞。阴性dmso对照如预料的那样从未产生应答,如图中的虚线所示。肝损害分析结果:进行了施用rabv-glnp5μgmrna的动物和施用缓冲液的对照动物的组织学研究。在任何受试动物中均未观察到病理学发现。ast水平在用最高剂量的lnp(5μg)接种后的第1天升高,但随时间的推移降低并在第21天恢复到背景水平(参见图18a-18d)。虚线指示标准的鼠ast/alt水平。在第21天,只有一些动物的ast水平升高,在所有其他动物中,ast/alt水平没有病理学发现。实例8:用编码四种不同流感病毒的ha的mrna的组合进行的接种实验对于接种,将每组9只小鼠用含有lnp配制的mrna的组合物肌内注射两次,该mrna编码以下4种不同流感病毒株的ha:甲型流感/加利福利亚州/7/2009(h1n1)、甲型流感/香港/4801/2014(h3n2)、乙型流感/布里斯班/60/2008(b)和甲型流感/越南/1203/2004(h5n1)。因此,将四种mrna以1∶1∶1∶1的比率混合,然后如上所述配制。作为对照,注射了fluarixquadrivalent2015-2016,这是一种包含4种不同的灭活流感病毒株(甲型流感/加利福利亚州/7/2009、甲型流感/瑞士/9715293/2013、乙型流感/普吉岛/3073/2013和乙型流感/布里斯班/60/2008)的裂解病毒疫苗,适用于主动免疫以用于预防由甲型流感亚型病毒和乙型流感病毒引起的疾病。作为阴性对照,注射乳酸林格氏缓冲液。通过检测针对特定流感病毒的igg2a抗体来进行ha特异性免疫应答(b细胞免疫应答)的检测。因此,在接种三周后从接种小鼠中获取血样并制备血清。将maxisorb板(耐洁纽恩克国际公司)用特定的重组ha蛋白包被。用含有0.05%tween-20和1%bsa的1xpbs阻断后,将板与稀释的小鼠血清(如所示)一起温育。随后添加生物素偶联的二抗(抗小鼠-igg2a,pharmingen公司)。洗涤后,将板与辣根过氧化物酶-链霉亲和素一起温育,然后添加amplexultrared试剂(英杰公司),随后对荧光产物定量。结果:图19a-19d中显示的结果表明,针对不同流感病毒的ha特异性igg抗体可以在以下基于lnp的疫苗单次肌内接种后检出,该疫苗包含四种不同的mrna,每种mrna编码不同流感病毒(甲型流感/加利福利亚州/7/2009(h1n1;图19a)、甲型流感/香港/4801/2014(h3n2;图19b)、乙型流感/布里斯班/60/2008(b,图19c)和甲型流感/越南/1203/2004(h5n1,图19d))的ha抗原。这些数据证明,编码例如不同流感病毒的抗原的mrna可以组合在一种组合物/疫苗中。与fluarix相比,lnp-iii-3配制的mrna多价疫苗在初始动物中诱导了针对所有亚型的igg2a抗体应答,并且低剂量的mrna在单次肌内注射后令人惊讶地在小鼠中具有免疫原性。实例9:用编码不同流感病毒的ha和na的mrna的组合进行的接种实验对于接种,将每组8只小鼠用包含lnp配制的mrna的组合物进行肌内注射,该mrna编码4种不同流感病毒株的ha:甲型流感/加利福利亚州/7/2009(h1n1)和/或甲型流感/荷兰/602/2009(h1n1)、甲型流感/香港/4801/2014(h3n2)、乙型流感/布里斯班/60/2008和甲型流感/越南/1203/2004(h5n1),并编码3种不同流感病毒株的na:甲型流感/加利福利亚州/7/2009(h1n1)、甲型流感/香港/4801/2014(h3n2)和乙型流感/布里斯班/60/2008。在另一个接种实验中,将每组8只小鼠用包含mrna序列的组合物进行肌内注射,这些mrna序列编码甲型流感/加利福尼亚州/7/2009(h1n1)和/或甲型流感/荷兰/602/2009(h1n1)、甲型流感/香港/4801/2014(h3n2)、乙型流感/布里斯班/60/2008和乙型流感/普吉岛/3073/2013的ha,并编码3种不同流感病毒株的na:甲型流感/加利福利亚州/7/2009(h1n1)、甲型流感/香港/4801/2014(h3n2)和乙型流感/布里斯班/60/2008。作为对照,注射了tetravalent2016-2017,这是一种包含4种不同的灭活流感病毒株(甲型流感/加利福利亚州/7/2009、甲型流感/香港/4801/2014、乙型流感/普吉岛/3073/2013和乙型流感/布里斯班/60/2008)的裂解病毒疫苗,适用于主动免疫以用于预防由甲型流感亚型病毒和乙型流感病毒引起的疾病。作为阴性对照,注射乳酸林格氏缓冲液。如上所述,通过检测针对特定流感病毒的igg2a抗体来进行ha特异性免疫应答(b细胞免疫应答)的检测。使用na抑制测定法(nai)测定针对特定流感病毒的na特异性免疫应答(b细胞免疫应答)。实例10:化合物i-3的合成用三乙酰氧基硼氢化钠(1.3g)处理6-(2′-己基癸酰氧基)己-1-醛(2.4g)、乙酸(0.33g)和4-氨基丁-1-醇(0.23g)的二氯甲烷(20ml)溶液两小时。将溶液用碳酸氢钠水溶液洗涤。将有机相经无水硫酸镁干燥、过滤并除去溶剂。使用甲醇/二氯甲烷(0-8/100-92%)梯度使残余物通过硅胶柱,得到呈无色油状物的化合物3(0.4g)。实例11:代表性peg脂质的合成制备了聚乙二醇化脂质iva(“peg-dma”),其中n接近聚乙二醇化脂质中环氧乙烷重复单元范围的中心。iva-1和iva-2的合成:在室温下,向肉豆蔻酸(6g,26mmol)的甲苯(50ml)溶液中加入草酰氯(39mmol,1.5当量,5g)。因此,39mmol草酰氯相对于起始材料肉豆蔻酸为1.5倍摩尔当量(26mmol×1.5=39mmol)。将所得混合物在70℃下加热2小时后,浓缩混合物。将残余物溶于甲苯并再次浓缩。经由注射器将残余油加到10℃的浓氨溶液(20ml)中。过滤反应混合物并用水洗涤。将白色固体真空干燥。得到呈白色固体的所需产物(3.47g,15mmol,58.7%)。iva-3的合成:在室温下在30分钟的时间段内向20-2(3.47g,15mmol)的thf(70ml)悬浮液中分批加入氢化铝锂(1.14g,30mmol)。然后将混合物温和加热至回流(65℃的油浴)过夜。将混合物冷却至5℃并添加硫酸钠9水合物。将混合物搅拌2小时,通过硅藻土层过滤,用15%的meoh的dcm溶液(200ml)洗涤。合并滤液和洗涤液并浓缩。将残留的固体真空干燥。得到呈白色固体的所需产物(2.86g,13.4mmol,89.5%)。iva-4的合成:在室温下,向肉豆蔻酸(3.86g,16.9mmol)的苯(40ml)和dmf(1滴)溶液中加入草酰氯(25.35mmol,1.5当量,3.22g)。因此,25.35mmol草酰氯相对于起始材料肉豆蔻酸为1.5倍摩尔当量(16.9mmol×1.5=25.35mmol)。将混合物在室温下搅拌1.5小时。在60℃下加热30分钟。将混合物浓缩。将残余物溶于甲苯并再次浓缩。将残余的油(浅黄色)溶于20ml苯中,并经由注射器在10℃下添加到20-3(2.86g,13.4mmol)和三乙胺(3.53ml,1.5当量)的苯(40ml)溶液中。因此,3.53ml三乙胺相对于13.4mmol20-3为1.5倍摩尔当量,即,与该步骤的起始材料相比,该试剂50%摩尔过量。添加后,将得到的混合物在室温下搅拌过夜。将反应混合物用水稀释,并用20%h2so4调至ph6-7。过滤混合物并用水洗涤。获得浅色固体。将粗产物从甲醇中重结晶。得到呈灰白色固体的所需产物(5.65g,13mmol,100%)。iva-5的合成:在室温下在30分钟的时间段内向20-4(5.65g,13mmol)的thf(60ml)悬浮液中分批加入氢化铝锂(0.99g,26mmol)。然后将混合物温和加热至回流过夜。将混合物冷却至0℃并添加硫酸钠9水合物。将混合物搅拌2小时,然后通过硅藻土垫和硅胶过滤,先用醚洗涤。滤液变浑浊并形成沉淀。过滤得到白色固体。将固体从meoh中重结晶,得到无色结晶固体(2.43g)。然后将硅藻土垫和硅胶用5%的meoh的dcm溶液(400ml)然后用10%的meoh的dcm溶液(含1%三乙胺,300ml)洗涤。合并含有所需产物的级分并浓缩。得到白色固体。将固体从meoh中重结晶,得到无色结晶固体(0.79g)。合并上述两种固体(2.43g和0.79g)并真空干燥(3.20g,60%)。1hnmr(cdcl3于7.27ppm处)δ:2.58(似三重峰,7.2,hz,4h),1.52-1.44(m,4h),1.33-1.24(m,44h),0.89(似三重峰,6.6hz,6h),2.1-1.3(非常宽,1h)。iva的合成:向20-5(7mmol,2.87g)和三乙胺(30mmol,4.18ml)的dcm(100ml)溶液中加入mpeg-nhs(来自nof,5.0mmol,9.97g,peg分子量约2,000,n=约45)的dcm(120ml)溶液。24小时后,将反应溶液用水(300ml)洗涤。将水相用dcm(100ml×2)萃取两次。合并dcm萃取物,用盐水(100ml)洗涤。将有机相经硫酸钠干燥,过滤,部分浓缩。将浓缩溶液(约300ml)冷却至约15℃。过滤得到白色固体(1.030g,未反应的起始胺)。向滤液中加入et3n(1.6mmol,0.222ml,4当量)和乙酸酐(1.6mmol,164mg)。将混合物在室温下搅拌3小时,然后浓缩成固体。通过硅胶柱色谱法(0-8%的甲醇的dcm溶液)纯化残余的固体。得到呈白色固体的所需产物(9.211g)。1hnmr(cdcl3于7.27ppm处)δ:4.19(s,2h),3.83-3.45(m,180200h),3.38(s,3h),3.28(似三重峰,7.6hz,2h,ch2n),3.18(似三重峰,7.8hz,2h,ch2n),1.89(s,6.6h,水),1.58-1.48(m,4h),1.36-1.21(m,48-50h),0.88(似三重峰,6.6hz,6h)。实例12:用lnp-iii-3配制的编码不同流感病毒的ha的mrna的组合进行的接种实验:用lnp-iii-3配制的mrna疫苗组合物肌内(i.m.)免疫雌性balb/c小鼠,剂量、施用途径和接种时间表如表a所示(根据实例1的mrna序列)。作为阴性对照,向一组小鼠注射缓冲液(乳酸林格氏液,rila)。作为阳性对照,将一组小鼠用经批准的流感疫苗(tetra2016/2017;甲型流感/加利福利亚州/07/2009,甲型流感/香港/4801/2014,乙型流感/布里斯班/60/2008,乙型流感/普吉岛/3073/2013)接种。在第0天和第21天向所有动物注射相应的组合物。在第21天、第35天和第49天采集血样用于测定结合抗体滴度(使用elisa)和阻断抗体滴度(使用hi测定)。使用在第49天分离的脾细胞通过细胞内细胞因子染色(ics)分析t细胞应答。下面提供了所进行的实验的详细描述。表a:免疫方案(实例12)12.1.elisa法测定抗ha蛋白特异性igg1和igg2a抗体:基本上如本领域公知的那样或如上所述进行elisa测定。对mrna疫苗组合物中包含的每种抗原进行elisa(如表a所示)。结果显示在图25(h1n1(甲型流感/加利福利亚州/7/2009))、图27(h3n2(甲型流感/香港/4801/2014))、图29(乙型流感(乙型流感/布里斯班/60/2008))和图30(乙型流感(乙型流感/普吉岛/3073/2013))中。12.2.血凝抑制测定(hi):在96孔板中,将获得的血清与hah1n1抗原(甲型流感/加利福利亚州/07/2009(h1n1);nibsc)或hah3n2抗原和红细胞(4%红细胞;lohmanntierzucht)混合。在ha中和抗体的存在下,可以观察到对红细胞血凝的抑制。导致可见血凝抑制的最低滴定血清水平是测定结果。结果显示在图26((h1n1(甲型流感/加利福利亚州/7/2009))和图28(h3n2(甲型流感/香港/4801/2014))中。12.3.检测t细胞应答:根据本领域已知的标准方案分离来自接种后小鼠的脾细胞。简而言之,将分离的脾脏通过细胞滤网研磨,并在pbs/1%fbs中洗涤,然后进行红细胞裂解。在用pbs/1%fbs进行充分洗涤步骤后,将脾细胞接种到96孔板中(每孔2×106个细胞)。将细胞用h1n1(甲型流感/加利福利亚州/07/2009)的重叠的15mer肽的库刺激以确定cd8+t细胞应答,或将它们用重组ha蛋白刺激以确定cd4+t细胞应答。刺激后,使用cytofix/cytoperm试剂(bd生物科学公司)根据制造商说明洗涤细胞并针对细胞内细胞因子染色。将以下抗体用于染色:cd3-fitc(1∶100)、cd8-pe-cy7(1∶200)、tnf-pe(1∶100)、ifnγ-apc(1∶100)(ebioscience)、cd4-bdhorizonv450(1∶200)(bd生物科学公司),并用1∶100稀释的fcγ阻断剂温育。将aqua染料用于区分活细胞/死细胞(英杰公司(invitrogen))。使用cantoii流式细胞仪(bd公司(becktondickinson))获取细胞。使用flowjo软件包(树星公司)分析流式细胞术数据。cd4+t细胞的结果如图31所示;cd8+t细胞的结果如图32所示。结果:数据表明,在用lnp配制的mrna组合疫苗接种后可以检测到igg1和igg2a抗体。值得注意的是,对于包含在相应组合中的所有编码抗原的mrna,均可以检测到特异性igg1和igg2a抗体,证明包含在相应组合物中的所有mrna都翻译成蛋白并在小鼠中引发体液免疫应答,如图25(h1n1(甲型流感/加利福利亚州/7/2009))、图27(h3n2(甲型流感/香港/4801/2014))、图29(乙型流感(乙型流感/布里斯班/60/2008))和图30(乙型流感(乙型流感/普吉岛/3073/2013))所示。与用经批准的疫苗接种的小鼠相比,对于所有测试的抗原而言,应答更强或至少同样强。针对h1n1(甲型流感/加利福利亚州/7/2009)和h3n2(甲型流感/香港/4801/2014)证实了功能性中和抗体(参见图26和图28)。与用经批准的疫苗接种的小鼠相比,功能性中和抗体的诱导对于mrna组合疫苗而言更明显且更耐久。值得注意的是,在一次免疫后,所测试的mrna组合疫苗通常已达到>40的hi滴度。图31显示,所测试的流感mrna组合在免疫小鼠的脾中刺激了针对所有抗原的稳健的cd4+ifnγ/tnf-αt细胞应答。图32显示,所测试的流感mrna组合在免疫小鼠的脾中刺激了稳健的cd8+ifn-γ/tnf-αt细胞应答,如针对h1n1(甲型流感/加利福利亚州/07/2009)所示,而值得注意的是,经批准的疫苗未诱导cd8+t细胞应答。总体而言,数据表明,针对衍生自不同流感病毒(甲型和乙型)的ha抗原的基于lnp配制的mrna的组合疫苗诱导了强烈且耐久的体液免疫应答和t细胞介导的细胞免疫应答。实例13:用lnp-iii-3配制的编码不同流感病毒的ha的mrna的组合进行的接种实验:用lnp-iii-3配制的mrna疫苗组合物肌内(i.m.)免疫雌性balb/c小鼠,剂量、施用途径和接种时间表如表b所示(根据实例1的mrna序列)。作为阴性对照,向一组小鼠注射缓冲液(乳酸林格氏液,rila)。作为阳性对照,将一组小鼠用经批准的流感疫苗(甲型流感/加利福利亚州/07/2009,甲型流感/瑞士/9715293/2013,乙型流感/布里斯班/60/2008,乙型流感/普吉岛/3073/2013)接种。所有动物在第0天和第21天接种。在第21天、第35天和第49天采集血样用于测定结合抗体滴度(使用elisa)、阻断抗体滴度(使用hi测定)以及测定病毒中和滴度(vnt)。使用在第49天分离的脾细胞通过细胞内细胞因子染色(ics)分析t细胞应答。下面提供了所进行的实验的详细描述。表b:免疫方案(实例13)13.1.elisa法测定抗ha蛋白特异性igg1和igg2a抗体:基本上如本领域公知的那样或如上所述进行elisa测定。对mrna疫苗组合物中包含的每种抗原进行elisa(如表b所示)。结果显示在图33(h1n1(甲型流感/加利福利亚州/7/2009))、图35(h3n2(甲型流感/香港/4801/2014))、图37(乙型流感(乙型流感/布里斯班/60/2008))和图38(h5n1(甲型流感/越南/1203/2004))中。13.2.血凝抑制测定(hi)和病毒中和测定:如上所述进行hi测定。结果显示在图34((h1n1(甲型流感/加利福利亚州/7/2009))和图36(h3n2(甲型流感/香港/4801/2014))中。13.3.检测t细胞应答:根据本领域已知的标准方案分离来自接种后小鼠的脾细胞。基本上如实例12中所述进行ics实验。cd4+t细胞的结果如图39所示;cd8+t细胞的结果如图40所示。结果:数据表明,在用lnp配制的mrna组合疫苗接种后可以检测到igg1和igg2a抗体。值得注意的是,对于包含在相应组合中的所有编码抗原的mrna,均可以检测到特异性igg1和igg2a抗体,证明包含在相应组合物中的所有mrna都翻译成蛋白并在小鼠中引发体液免疫应答,如图33(h1n1(甲型流感/加利福利亚州/7/2009))、图35(h3n2(甲型流感/香港/4801/2014))、图37(乙型流感(乙型流感/布里斯班/60/2008))和图38(h5n1(甲型流感/越南/1203/2004))所示。与用经批准的疫苗接种的小鼠相比,对于所有测试的抗原而言,甚至对于所测试的最低mrna疫苗剂量而言,应答通常更强或至少同样强。针对h1n1(甲型流感/加利福利亚州/7/2009)和h3n2(甲型流感/香港/4801/2014)证实了功能性中和抗体(参见图34和图36)。与用经批准的疫苗接种的小鼠相比,功能性中和抗体的诱导对于mrna组合疫苗而言更明显且更耐久。值得注意的是,对于最高测试剂量而言,在一次免疫后,所测试的mrna组合疫苗已达到>40的hi滴度。图39显示,所测试的流感mrna组合在免疫小鼠的脾中刺激了针对所有抗原的稳健的cd4+ifnγ/tnf-αt细胞应答,其中观察到更高的应答。图40显示,所测试的流感mrna组合在免疫小鼠的脾中刺激了稳健的cd8+ifn-γ/tnf-αt细胞应答,如针对h1n1(甲型流感/加利福利亚州/07/2009)和h5n1(甲型流感/越南/1203/2004)所示,而值得注意的是,经批准的疫苗未诱导cd8+t细胞应答。总体而言,数据表明,针对衍生自不同流感病毒(甲型和乙型)的ha抗原的基于lnp配制的mrna的组合疫苗诱导了强烈且耐久的体液免疫应答和t细胞介导的细胞免疫应答。实例14:用lnp-iii-3配制的编码流感病毒的神经氨酸酶na1的mrna的疫苗进行的接种实验:用lnp-iii-3配制的mrna疫苗组合物肌内(i.m.)免疫雌性balb/c小鼠,剂量、施用途径和接种时间表如表c所示(根据实例1的mrna序列)。作为阴性对照,向一组小鼠注射缓冲液(乳酸林格氏液,rila)。作为阳性对照,将一组小鼠用influsplit2016/2017(甲型流感/加利福利亚州/7/2009(h1n1)、甲型流感/香港/4801/2014(h3n2)、乙型流感/布里斯班/60/2008、乙型流感/普吉岛/3073/2013)进行i.m.注射。所有动物在第0天和第21天接种。在第21天、第35天和第49天采集血样用于测定免疫应答。使用在第49天分离的脾细胞通过细胞内细胞因子染色(ics)分析t细胞应答。表c:免疫方案(实例14)14.1.确定n1na(甲型流感/加利福利亚州/7/2009)的免疫应答:使用酶联凝集素测定法(ella)分析功能性na特异性抗体,该方法基本上如本领域先前所述的那样进行。ella在用大糖蛋白底物胎球蛋白包被的96孔板中进行。na从胎球蛋白切割末端唾液酸,暴露出倒数第二个糖,即半乳糖。花生凝集素(pna)是对半乳糖具有特异性的凝集素,因此可以使用pna-辣根过氧化物酶缀合物,然后添加生色过氧化物酶底物,来对去唾液酸化的程度进行定量。测得的光密度与na活性成比例。为了测量功能性na抑制(ni)抗体滴度,将血清的连续稀释液在具有甲型流感/加利福利亚州/7/2009(h1n1)病毒(用triton-x-100预处理)的胎球蛋白包被的板上温育。将导致≥50%na活性抑制的最高血清稀释度的倒数称为ni抗体滴度。结果显示在图41中。为了确定t细胞应答,基本上如上所述进行ics实验。用na特异性肽混合物刺激细胞,并测定cd8+t细胞应答和cd4+t细胞应答。结果显示在图42(cd4+)和图43(cd4+)中。结果:如图41所示,在用lnp配制的编码na1甲型流感/加利福利亚州/2009的mrna接种的小鼠中可检测到强的和特异性的功能性免疫应答,而对于注射疫苗的小鼠仅能测到弱应答。如图42和图43所示,所测试的na1mrna疫苗在免疫小鼠的脾中刺激了稳健的cd4+和cd8+t细胞应答,如图所示,而值得注意的是,经批准的疫苗未诱导cd8+t细胞应答。实例15:在小鼠中用lnp-iii-3配制的编码狂犬病毒抗原的mrna进行接种实验并评估促炎性环境以及在小鼠中注射lnp-iii-3配制的荧光标记的mrna(f*-mrna)并分析引流淋巴结(dln)中免疫细胞的组成和激活状态。f*-mrna对应于荧光标记的pplucmrna(60%-utp-40%-5-氨基烯丙基-utp),它由于标记而不能翻译成蛋白(seqidno:224286)。接种后需要激活先天免疫系统以产生有效的适应性免疫应答。因此,测试了根据本发明的本发明的lnp-iii-3配制的mrna在小鼠中i.m.施用lnp配制的rabv-gmrna后(瞬时)诱导促炎性细胞因子和趋化因子的效力。将balb/c小鼠(n=6只/组)i.m.接种10μg未配制的(mrna)或lnp配制的rabv-g-mrna(mrna/lnp),或接种缓冲液对照。在i.m.施用后4小时、14小时、24小时和96小时后分离肌肉组织、dln和血清样品,并通过流式微珠阵列(cytometricbeadarray,cba)测量蛋白裂解物和血清中的细胞因子或趋化因子含量。结果显示在图44-49中。为了阐明促炎性环境是否转化成免疫细胞的激活和组成变化,分析了dln中白细胞的数量和激活状态。为了确保任何观察到的作用不依赖于mrna编码的蛋白,使用了不能翻译的荧光标记的mrna(f*-mrna)。将balb/c小鼠(n=3只/组)在两条腿中i.m.注射10μg未配制的(f*mrna)或lnp配制的f*mrna(f*mrna/lnp),或注射缓冲液。在i.m.施用后4小时、24小时和48小时分离左右dln,并通过流式细胞术分别进行分析。dln中各细胞群的数量(50a)和激活的免疫细胞的频率(50b)的显示在图50a/b中。结果:如图44-46所示,lnp配制的rabv-gmrna诱导促炎性细胞因子tnf和il-6的显著但瞬时释放,在注射后14小时达到峰值浓度。重要的是,为了该方法的安全性,细胞因子释放是局部的,并且未观察到tnf的全身释放(在血清中)。与注射部位相比,在血清中检测到瞬时的、低10倍的il-6浓度,在注射后96小时恢复到基线(参见图46)。如图47-49所示,lnp配制的rabv-gmrna诱导促炎性趋化因子的显著但瞬时释放。强烈上调的趋化因子包括在巨噬细胞、单核细胞和nk细胞的趋化性中起关键作用的mip-1β,以及将t细胞、nk细胞和nkt细胞募集到炎症部位的cxcl-9。此外,mcp-1、mip-1α和cxcl1的浓度瞬时升高,它们吸引多种免疫细胞,如单核细胞、巨噬细胞、树突细胞和中性粒细胞。我们还观察到上述趋化因子血清浓度的瞬时升高,但与在注射部位或dln中检测到的相比,其程度要低得多。如图50a和图50b所示,肌内注射lnp配制的f*-mrna诱导了细胞性的强烈增加,而在注射未配制的f*-mrna后不存在这种现象。除了nk细胞随时间增加外,注射后24小时观察到了细胞数量的最强升高。主要由单核细胞和粒细胞组成的cd11b+gr1+细胞造成了白细胞的最大增加。dln中细胞性的增加伴随着适应性和先天性免疫细胞的强烈激活,在注射后24小时达到峰值,此时超过90%的t细胞和b细胞表达活化标记物cd69。总之,这些结果表明,i.m.注射lnp配制的mrna疫苗诱导了广泛但瞬时的局部免疫刺激环境,该环境与诱导强烈的适应性免疫应答相关。实例16:在非人灵长类动物中用lnp-iii-3配制的编码狂犬病毒抗原的mrna进行的接种实验:将如前述实例中制备的lnp-iii-3配制的rabv-gmrna疫苗用于接种。用食蟹猴(macacafascicularis)进行的研究在西班牙圣佩尔佩图阿-德莫古达(santaperpètuademogoda,spain)的envigocrs,s.a.u.公司开展。这些动物具有越南血统,圈养繁殖,未产未孕。处理开始时动物年龄为2.5岁至3.5岁,体重为2.2kg至3.3kg。在第0天和第28天用500μl的单剂量向nhp的股二头肌中i.m.接种。使用获得许可的人狂犬病疫苗(诺华公司(novartis))以完整人体剂量根据预暴露预防时间表在第0天、第7天和第28天或根据减量时间表在第0天和第28天进行nhp的i.m.接种。如上所述分析接种后的猴的vnt。如上所述分析t细胞应答(cd4+和cd8+)。结果显示在图51-55中。结果:图51显示用1μglnp配制的rabv-g-mrna单次i.m.免疫已在初免接种后第28天在所有动物中诱导了等于或高于0.5iu/ml的保护性滴度的vnt。观察到的免疫原性是剂量依赖性的,mrna剂量高10倍产生高10倍的vnt。图52显示在第28天用rabv-g-mrna进行第二次接种可以增强观察到的初级应答,导致vnt增加20倍。监测抗体滴度六个月表明,在初始下降后,对于10μg的mrna剂量,滴度稳定在约40iu/ml的保护性水平,对于1μg的mrna剂量,滴度稳定在约4iu/ml的保护性水平。图53显示存在b细胞记忆。为了证明在完成接种后五个月存在b细胞记忆,进行第三次接种(回忆接种)并在五天后测量vnt。在两个剂量组中,观察到vnt的非常快的10倍增加,表明mrna疫苗诱导了强烈的回忆应答。图54显示lnp配制的rabv-g-mrna疫苗在单次接种后诱导了高于0.5iu/ml的保护性中和抗体滴度,与完整人体剂量的许可狂犬病疫苗相比相当或更高。单次接种后四周,与接种的猴相比,mrna接种的猴所测得的vnt显著增加。在第28天进行的加强接种进一步增加了vnt水平,使得mrna接种的猴高达1000iu/ml,胜过诱导的vnt10倍。这些数据表明,用lnp配制的rabv-g-mrna疫苗进行两次注射来接种足以诱导针对狂犬病毒感染的保护。对于100μg剂量的lnp配制的rabv-g-mrna,即使单次施用也可足以诱导保护性和持续性的抗体滴度。与必须应用三次的现有技术的狂犬病疫苗相比,这是特别有利的。图55和图56显示本发明的lnp配制的rabv-gmrna疫苗在接种后诱导了特异性细胞应答,这些作用未在接种的动物中观察到。对于两种mrna疫苗剂量观察到rabv-g特异性ifn-γ+/il-2+cd4+t细胞(图55),而在接受100μg剂量的动物中检测到rabv-g特异性ifn-γ+/grzb+cd8+t(图56)细胞。值得注意的是,在接受的猴中仅观察到轻微的细胞应答。实例17:在非人灵长类动物中用lnp-iii-3配制的编码流感h1n1或流感h3n2ha抗原的mrna进行的接种实验:将如前述实例中所述的lnp-iii-3配制的ha-mrna甲型流感/加利福尼亚州/7/2009(h1n1)或ha-mrna甲型流感/香港/4801/2014(h3n2)疫苗用于接种。用食蟹猴(macacafascicularis)进行的研究在西班牙圣佩尔佩图阿-德莫古达(santaperpètuademogoda,spain)的envigocrs,s.a.u.公司开展。这些动物具有越南血统,圈养繁殖,未产未孕。处理开始时动物年龄为2.5岁至3.5岁,体重为2.2kg至3.3kg。用10μg的h1n1-ha或h3n2-ha疫苗接种nhp,并通过血凝抑制(hi)测定法测量针对相应病毒的功能性抗体。作为对照,用完整人体剂量的接种一组动物。在第0天和第28天用500μl的单剂量向初始nhp的股二头肌中i.m.接种10μgh1n1-ha或h3n2-ha疫苗。通过血凝抑制(hi)测定法测量针对相应病毒的功能性抗体。结果显示在图57-59中。如上所述分析t细胞应答。结果显示在图60a-b中。结果:图57显示用10μglnp配制的h1n1-hamrna或h3n2-hamrna单次i.m.免疫已在初免接种后第28天在所有动物中诱导了等于或高于被视为在人类中具有保护性的1∶40滴度的hi滴度。图58显示在第28天用相应的h1n1-hamrna第二次接种可以增强观察到的初级应答,导致测得的hi滴度强烈增加。监测抗体滴度超过12个月(544天)表明,在初始下降后,滴度稳定在约640的保护性h1n1hi滴度。重要的是,所有接种后的动物均保持hi滴度明显高于保护极限,直至初免接种后一年的观察期结束,证实了h1n1ha抗原特异性体液免疫应答的极长寿命。图59显示lnp配制的h3n2-hamrna疫苗在单次接种后诱导了保护性h3n2-hi滴度,其响应与强效流感疫苗(季节2016/17;含有流感病毒株h1n1、h3n2和乙型流感/布里斯班的表面抗原ha和神经氨酸酶,以及佐剂mf59c.1)相当。单剂量的lnp配制的mrna疫苗足以诱导保护性h3n2-hi滴度,与完整人体剂量的诱导的滴度相当。第二剂量进一步增加了hi滴度,其中lnp配制的h3n2-hamrna疫苗的作用要强得多。图60显示本发明的lnp配制的h3n2-hamrna疫苗在接种疫苗后诱导了特异性ifn-γ+/il-2+cd4+t细胞应答和tnfα+/il-2+cd4+t细胞应答,这些作用未在接种的动物中观察到。实例18:在非人灵长类动物中用编码不同流感抗原的mrna组合进行的接种实验用lnp-iii-3配制的mrna疫苗免疫非人灵长类动物(nhp)(每组6只动物),剂量、施用途径和接种时间表如表d所示(优选地根据实例1的mrna序列)。作为疫苗,使用包含四种ha抗原的mrna组合物(“四价ha”)或使用包含七种ha+na抗原的mrna组合物(四种ha,三种na;七价或“七价ha+na”)。所有动物在第0天和第28天接种。在第0天、第14天、第28天、第56天、第77天和第84天采集血样以测定抗体应答。使用分离的脾细胞通过细胞内细胞因子染色(ics)分析t细胞应答。基本上如上所述进行免疫应答分析(ella、hi测定、elisa、ics、vnt)。表d:免疫方案*每种mrna在组合物中的含量相同,即4×10μg、4×50μg、7×10μg或7×50μg实例19:lnp-iii-3配制的流感mrna疫苗的临床开发为了证明流感mrna疫苗组合物的安全性和有效性,开展了随机、双盲、安慰剂对照的临床试验(i期)。对于临床开发,使用已建立的gmp工艺生产gmp级rna,对dna水平和rna水平实施各种质量控制,如wo2016/180430a1中详细描述的那样。在临床试验中,将人类志愿者(成年受试者,18-45岁)用包含一种编码本文指定的一种流感抗原的mrna的mrna组合物(“单价”,h3n2甲型流感/香港/4801/2014)、或包含本文指定的四种ha流感抗原的mrna组合物(“四价ha”)、或包含本文指定的四种ha和三种na流感抗原的mrna组合物(“七价ha+na”)或包含本文指定的多种ha和多种na流感抗原的mrna组合物(“多价ha+na”)肌内(i.m.)注射至少两次。此外,一组老年志愿者也接受处理(>65岁的老年人)。研究设计如下表e-h所示。表e:四价ha流感研究的临床设计*每种mrna在组合物中的含量相同表f:单价流感研究的临床设计(h3n2)*每种mrna在组合物中的含量相同表g:七价/七价ha+na流感研究的临床设计*每种mrna在组合物中的含量相同表h:多价ha+na流感研究的临床设计*每种mrna在组合物中的含量相同为了评估根据本发明的流感疫苗组合物的安全特性,在施用后监测受试者(生命体征、接种部位耐受性评估、血液学分析)。通过hi滴度测定和ella测定来分析免疫功效。在第0天作为基线以及在完成接种后采集血样。分析血清的功能性抗体(hi测定、ella、vnt(favn试验))。此外,使用世界动物卫生组织(worldorganizationforanimalhealth)推荐的适应细胞培养的挑战病毒株cvs11,使用快速荧光灶抑制试验进行rffit测定以分析早期vnt的存在。简而言之,以连续两倍稀释度测试热灭活血清中和100个组织培养半数感染剂量(tissuecultureinfectiousdose50%)的cvs的潜力。将血清稀释液与病毒在37℃下温育约70分钟(在具有5%co2的水夹套培养箱中)。每孔加入30,000个bhk-21细胞。将感染的细胞培养物在37℃和5%co2下温育22小时。使用80%丙酮/20%pbs在-20℃下固定细胞10分钟,然后使用fitc缀合的抗狂犬病球蛋白染色。用pbs将板洗涤两次,除去过量的pbs。通过fitc阳性信号检测到的狂犬病毒的存在,将细胞培养物评为阳性或阴性。血清处理孔中的阴性评定细胞代表狂犬病毒的中和。每个rffit测试包括who或oie标准血清(阳性参考血清),该血清用作测定标准化的参考。测试血清的中和活性参照who提供的标准血清来计算,并以国际单位/ml(iu/ml)显示。此外,通过口服活流感病毒或安慰剂对健康受试者的亚组进行挑战。在挑战后跟踪受试者的流感相关疾病的症状、感染和免疫应答。实例20:在5℃下储存3个月的lnp(lnp-iii-3)的稳定性为了比较在5℃下储存3个月的lnp-iii-3配制的rabv-gmrna的免疫原性和反应原性,在加强接种两周后通过测定体液应答(包括功能性抗体)和细胞免疫应答来评估免疫原性(参见表j)。如上所述通过病毒中和测定法测定rabv-g特异性抗体滴度。表j:免疫方案(实例20的):如从图62a和62b中显而易见的是,令人惊讶地,在5℃下储存三个月后,lnp的稳定性没有受到负面影响,即,此类lnp仅在体内显示出微小的作用并且足以在初免后和加强接种后产生非常高的vnt。实例21:lnp(lnp-iii-3)的毒性分析该实例的目的是评估本发明的lnp(lnp-iii-3)的毒性。为此,在不同的动物模型(例如小鼠、大鼠或兔)中用不同的mrna剂量(例如1μg、10μg、40μg、100μg或200μg)进行了多项体内毒性研究。结果表明,本发明的lnp在体内未显示出明显的毒性,如通过分析局部反应、疼痛、食物消耗、体重、器官重量、临床化学(即,没有观察到与测试物质相关的不利变化)和血液学(即,没有观察到与测试物质相关的不利变化)所证明。只在用例如10μg和100μg接种的少量动物中发现轻微的局部反应如红斑和肿胀,即,通常在1-3天内发生的对疫苗的正常反应。实例22:在雪貂中用lnp-iii-3配制的编码不同流感病毒的ha的mrna的组合进行的接种实验:将雪貂(mustelaputoriusfuro;6-12个月大)用含有编码h1n1甲型流感/加利福利亚州/07/2009、h3n2甲型流感/香港/4801/2014、ha乙型流感/布里斯班/60/2008和ha乙型流感/普吉岛/3073/2013的mrna构建体的lnp-iii-3配制的mrna疫苗组合物肌内(im)免疫,该疫苗组合物在本文称为“四价mrna疫苗”(参见表k)。根据实例1的相应mrna序列。作为阳性对照,将一组雪貂用经批准的流感疫苗(tetra2016/2017)接种。在第0天和第21天向所有动物注射相应的组合物。在第0天、第21天、第35天和第49天采集血样用于测定每种编码抗原的阻断抗体滴度(使用如上所述的hi测定和mn测定)。结果显示在图63中。表k:免疫方案(实例22)结果:如图63所示,检测每种编码抗原的阻断抗体滴度。图63a和b显示对于h1n1和h3n2而言,可观察到明显的剂量响应,并且对于所有测试组而言,在第二次接种后诱导了保护性hi滴度(>40)。值得注意的是,对于160μg组和80μg组而言,在初免接种后已经获得了保护性hi滴度。图63c和d显示,对于160μg浓度而言,也可检测到对乙型流感/布里斯班的保护性hi滴度。观察到对乙型流感/普吉岛的mn滴度(图63d)。总之,结果表明,本文使用的四价mrna疫苗诱导所有四种抗原的功能性抗体应答。此外,抗体应答与批准的疫苗fluad所观察到的相当,表明本发明的lnp配制疫苗的巨大潜力。实例23:在雪貂中用lnp-iii-3配制的编码不同流感病毒的ha的mrna的组合进行的挑战性接种实验:将雪貂(mustelaputoriusfuro;6-12个月大)用实例22的lnp-iii-3配制的四价mrna疫苗肌内(i.m.)免疫。作为阳性对照,将多个组接种tetra2016/2017。作为阴性对照,将多个组注射安慰剂。对于每个组,处理6只动物(表l中的“免疫阶段”)。为了模拟过去季节的流感病毒感染,在接种实验之前,将一些组也用流感病毒感染。将第5-8组用h3n2甲型流感/福井/20/2004病毒感染,将第13-16组用乙型流感/马萨诸塞州/2/2012山形(yamagata)谱系感染(参见表l中的“初免阶段”)免疫后,用流感病毒对雪貂进行气管内挑战。将第5-8组用ha甲型流感/荷兰/602/2009病毒挑战,将第13-16组用乙型流感/布里斯班/60/2008维多利亚(victoria)谱系挑战(参见表l中的“挑战阶段”)。病毒挑战后1-3天,分析雪貂的病毒载量(鼻、喉、拭子)和健康参数(发烧、体重)。病毒挑战后4天,对动物实施安乐死并分析免疫应答(hi滴度、igg、mn等)。表l:实验程序(实例23)实例24:用lnp-iii-3配制的编码三种不同na抗原的mrna(三价namrna疫苗)进行的接种实验如实例14中示例性显示的那样,lnp-iii-3配制的编码神经氨酸酶的mrna诱导强烈且有效的免疫应答。在本实例中,接种包含编码甲型流感/加利福尼亚州/07/2009(h1n1)的na的mrna、编码甲型流感/香港/4801/2014(h3n2)的na的mrna和编码乙型流感/布里斯班/60/2008的na的mrna的三价mrna组合物(本文称为“三价namrna疫苗”)。根据实例1的相应mrna序列。根据下表m中提供的方案,在第0天和第21天用三价namrna疫苗、作为阳性对照的influsplittetra(2016/2017)或缓冲液对照(rila)注射雌性balb/c小鼠。获取血清样品用于测定特异性抗体滴度(ella测定,根据实例14进行)。ella测定的结果显示在图64中。表m:免疫方案(实例24):结果:如图64所示,在用lnp配制的编码三种不同na抗原的mrna(三价namrna疫苗)接种的小鼠中可以检测到强烈的和特异性的功能性免疫应答。与用完整人体剂量的influsplittetra接种后检测到的应答相比,用本发明的三价lnp-iii-3配制的namrna疫苗获得的应答更明显。结果表明,对于每种na抗原而言,在用lnp-iii-3配制的三价namrna疫苗接种后均诱导了强烈的功能性免疫应答。实例25:用lnp-iii-3配制的编码三种不同na抗原和四种不同ha抗原的mrna(四价mrna疫苗)进行的接种实验如上文实例中示例性显示的那样,lnp-iii-3配制的四价hamrna疫苗和三价namrna疫苗对每种编码抗原而言均诱导了强烈且有效的免疫应答。在本实例中,接种lnp-iii-3配制的编码三种不同na抗原(编码甲型流感/加利福尼亚州/07/2009(h1n1)的na的mrna、编码甲型流感/香港/4801/2014(h3n2)的na的mrna和编码乙型流感/布里斯班/60/2008的na的mrna)和四种不同ha抗原(编码甲型流感/加利福尼亚州/07/2009(h1n1)的ha的mrna、编码甲型流感/香港4801/2014(h3n2)的ha的mrna和编码乙型流感/布里斯班/60/2008的ha的mrna和编码乙型流感的ha的mrna)的mrna组合物(本文称为“七价ha/namrna疫苗”)。根据实例1的相应mrna序列。在第0天和第21天用lnp-iii-3配制的四价hamrna疫苗、lnp-iii-3配制的三价namrna疫苗、或lnp-iii-3配制的七价ha/namrna疫苗i.m.注射雌性balb/c小鼠。作为阳性对照,将一组小鼠注射influsplit2016/2017。作为阴性对照,将一组小鼠注射rila缓冲液。在第21天、第35天、第49天采集用于分析免疫应答(hi滴度、elisa)的血清样品(如上所述进行测定)。在第49天采集脾细胞(ics)。实验细节在表n中提供。elisa和hi滴度结果显示在图65-70中。表n:免疫方案(实例25)组小鼠数量处理组剂量处理18四价hamrna疫苗4μg(每种1μg)i.m.,1×25μl28三价namrna疫苗3μg(每种1μg)i.m.,1×25μl38七价ha/namrna疫苗7μg(每种1μg)i.m.,1×25μl48七价ha/namrna疫苗7μg(每种0.5μg)56influsplittetra1/10人体剂量i.m.,2×25μl66rila---i.m.,1×25μl结果:结果表明,lnp-iii-3配制的七价ha/namrna疫苗在接种小鼠中诱导了强烈且有效的免疫应答。图65-图68:显示存在针对四种ha抗原中的每一种的总igg1和igg2a抗体。值得注意的是:在用四价hamrna疫苗接种的小鼠中检测到的免疫应答之间未检测到差异,表明添加编码na抗原的进一步的mrna构建体不会降低七价mrna疫苗的有效性。图69:显示存在针对三种na抗原中的每一种的特异性抗体。值得注意的是:在用三价namrna疫苗接种的小鼠中检测到的免疫应答之间未检测到差异,表明添加编码na抗原的进一步的mrna构建体不会降低七价mrna疫苗的有效性。图70:显示用lnp配制的七价ha/namrna疫苗接种小鼠诱导了功能性抗体。实例26:用lnp-iii-3配制的编码埃博拉gp的mrna进行的接种实验在本实例中,使用编码埃博拉病毒的糖蛋白gp(zebovgp塞拉利昂2014)的mrna,将本发明的mrnalnp-iii-3制剂与已确立的mrna疫苗形式(鱼精蛋白制剂;参见实例6)进行比较。编码埃博拉病毒gp的mrna(seqidno:224362)的鱼精蛋白制剂如实例6中所述。编码埃博拉病毒gp的mrna(seqidno:224362)的lnp制剂如上所述。埃博拉gpmrna疫苗在小鼠体内的免疫原性:将雌性balb/c小鼠在第0天和第21天注射lnp-iii-3配制的编码埃博拉病毒gp的mrna(rnaid“r3875”;肌内(i.m.))或鱼精蛋白配制的编码埃博拉病毒gp的mrna(rnaid“r3875”;皮内(i.d.))。作为阴性对照,将一组小鼠注射rila缓冲液。在第35天采集用于分析igg终点滴度(elisa)的血清样品。使用重组zebovmayingagp蛋白(缺少跨膜结构域)包被以进行elisa。elisa结果显示在图71中。接种实验的概要在表o中提供。表o:免疫方案(实例26)结果:图71显示lnp-iii-3配制的编码埃博拉病毒gp的mrna在小鼠中诱导强烈的体液免疫应答(i.m.施用)。与已确立的鱼精蛋白mrna疫苗形式(i.d.施用)相比,可以显著降低类似免疫应答所需的mrna量。此外,lnp-iii-3配制的mrna疫苗可以经肌内施用,这是预防性疫苗的重要特征(在例如人类受试者中肌内施用疫苗更容易和安全)。实例27:通过皮下施用lnp-iii-3配制的编码h3n2的mrna进行的接种实验如先前实例中所述,当肌内或皮内施用时,lnp-iii-3配制的mrna疫苗诱导强烈且有效的免疫应答(例如参见实例4)。为了评估本发明的疫苗形式针对其他合适的施用途径的有效性,测试了皮下注射。向非人灵长类动物(食蟹猴)注射lnp-iii-3配制的编码甲型流感/香港/4801/2014h3n2的mrna(根据实例1的mrna序列)。将三个组用不同的疫苗剂量(10μg、50μg、100μg)皮下(sc)接种,将一个对照组肌内接种。如本文所述测定第0天、第28天、第49天和第70天的hi滴度。实验结果显示在图72中。接种实验的概要在表p中提供。表p:免疫方案(实例27)结果:如图72所示,本发明的lnp-iii-3配制的mrna疫苗形式在皮下施用时诱导了针对编码抗原的强保护性抗体滴度。值得注意的是,hi滴度与通过i.m.施用而实现的那些滴度相当。此外,一次施用后已经实现保护性滴度(第28天)。对于50μg和100μg而言,检测到s.c.接种动物的稳定保护性滴度。综上所述,结果表明本发明的lnp-iii-3配制的mrna疫苗形式适于皮内、肌内和皮下施用。实例28:用lnp-iii-3配制的ovamrna疫苗进行的接种实验对于接种,将每组9只小鼠(c57bl/6)在3周内用1μglnp配制的ovamrna(组分a)和32μg鱼精蛋白配制的ovamrna(组分b)皮内注射3次,作为阴性对照,注射rila(参见表q)。在第7天和第21天用ova特异性dextramer(结合cd8阳性细胞的抗原特异性t细胞受体)测量循环抗原特异性cd8阳性t细胞的水平。1μglnp配制的ovamrna(组分a)疫苗在皮内施用后诱导了高水平和可增强水平的循环抗原特异性cd8阳性t细胞(参见图73和图74)。表q:组分、处理和rna稀释(实例28)通过细胞内细胞因子染色(ics)测量多功能抗原特异性cd8阳性t细胞(ifnγ/tnfα)的水平。因此,在最后一次接种一周后从接种小鼠分离脾细胞,并用ova特异性肽(siinfekl和tewtssnvmeerkikv)刺激cd8阳性t细胞(参见图75)。图75显示,与鱼精蛋白配制的ovamrna(组分b)相比,1μglnp配制的ovamrna疫苗(组分a)在皮内施用后诱导了高水平的多功能cd8阳性t细胞。通过检测ova特异性igg2c滴度进行b细胞免疫应答的检测。因此,在最后一次接种一周后从接种小鼠获取血清样品并通过elisa分析。与鱼精蛋白配制的ovamrna相比,1μglnp配制的ova-mrna疫苗在皮内施用后导致ova特异性igg2c滴度增加(参见图76)。结果表明,本发明的lnp-iii-3配制的mrna疫苗形式适于在体内诱导抗肿瘤反应,并因此可用于针对肿瘤的接种。实例29:用lnp-iii-3配制的ovamrna疫苗进行的肿瘤挑战实验在实验的第0天,以每只小鼠3×105个e.g7-ova细胞(在100μl体积的pbs中)向c57bl/6小鼠在右侧腹部进行皮下(s.c.)注射。皮内(i.d.)治疗在第4天开始并且每周两次,持续三周。向小鼠注射1μgovamrna和在lnp中配制的不相关pplucmrna。为了控制注射过程引起的抗肿瘤作用,向小鼠注射缓冲液(rila)。实验结果显示在图77和图78中,其中图77显示本发明的组合物对肿瘤生长的影响,图78显示本发明的组合物对存活的影响。通过使用卡尺测量三个维度的肿瘤大小来监测肿瘤生长。根据下式计算肿瘤体积:图77中的结果表明,与用不相关mrna(组分b)的其他处理相比,本发明的组分a(lnp配制的ovamrna)大大降低了中位肿瘤体积。另外,图78中的结果表明,与其他处理(组分b和缓冲液)相比,本发明的组分a(lnp配制的ovamrna)大大增加了肿瘤挑战小鼠的存活率。表r:组分、处理和rna稀释(实例29)结果表明,本发明的lnp-iii-3配制的mrna疫苗形式适于肿瘤接种。实例30:用lnp-iii-3配制的内基因肿瘤相关抗原mrna疫苗与检查点抑制剂相结合进行的接种实验在实验的第0天,以每只小鼠1×105个b16.f10细胞(鼠黑色素瘤细胞系)向c57bl/6小鼠在右侧腹部进行皮下(s.c.)注射。在肿瘤挑战后第6天,用lnp配制的trp2mrna(组分a)和不相关lnp配制的pplucmrna(组分b)皮内接种小鼠。此外,经腹膜内(i.p.)施用免疫检查点抑制剂抗-pd1(克隆:rmp1-14)和抗-ctla4(克隆:9h10)(均为bioxcell公司),并分析中值肿瘤大小和存活率。为了排除由检查点抑制剂引起的抗肿瘤作用,向小鼠注射组分b和对照抗体(大鼠igg2a,bioxcell)。与使用不相关mrna(组分b)与检查点抑制剂抗-pd1和抗-ctla4或对照抗体的组合进行的其他处理相比,用针对mtrp2的疫苗和检查点抑制剂抗-pd1和抗-ctla4处理的荷瘤小鼠显示出肿瘤生长延迟和存活率增加(参见图79和图80)。表s:组分、处理和rna/抗体稀释结果表明,本发明的lnp-iii-3配制的mrna疫苗形式适合与检查点抑制剂组合用于抗肿瘤疗法。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1