一种还原响应型肿瘤靶向多肽药物偶联物及其制备方法和应用与流程
本发明涉及一种多肽药物偶联物及其制备方法和应用,尤其涉及一种可应用于肿瘤治疗的还原响应型肿瘤靶向多肽药物偶联物及其制备方法和应用。
背景技术:
恶性肿瘤是一种由多种诱因共同作用而引起的严重威胁人类健康的常见病和多发病,占所有疾病死亡率的第二位,严重危害着我国人民的健康,给患者家庭和国家医疗体系带来严重的经济负担,也对新型抗肿瘤药物的研发提出了严峻的挑战,但到目前为止抗肿瘤药物的研发取得的成效却不尽如人意,主要原因包括肿瘤易产生耐药性,化疗药物对肿瘤的靶向性差,毒副作用大等。
小分子靶向肽可以通过受体相互作用将药物选择性地靶向到肿瘤部位,使治疗药物在病灶区浓集,病灶区的药物浓度超出常规制剂的数倍乃至数百倍,提高了系统化疗的效率,大大地降低了药物的毒副作用,例如促性腺激素释放激素(gonadotropinreleasinghormone,gnrh)是由下丘脑弓状核分泌细胞分泌的一种十肽激素,研究显示gnrh受体在子宫、卵巢、输卵管、胎盘、乳腺、前列腺等的肿瘤细胞中都有表达,而正常组织则是低表达或不表达gnrh受体。但是传统的靶向肽只能携带药物到肿瘤细胞,由于靶向多肽本身的理化性质特点很难跨越细胞膜,导致药物不能进入细胞,研究显示c端拥有—r/kxxr/k(r:精氨酸;k:赖氨酸;x:任何氨基酸)序列的多肽拥有组织渗透的功能,即c端规则(cendr)。
近年来,纳米给药系统以其优良特性受到了广泛的关注,纳米给药系统具有以下特征:较大程度提高药物的水溶性、通过提高渗透性和保留效应(epr)来实现对肿瘤的被动靶向、延长体内循环时间、提高药物利用率以及降低毒副作用等。然而,普通的纳米制剂并不能识别肿瘤部位与正常部位,也不能区分细胞内及细胞外的环境。
二硫键在一定量的谷胱甘肽(gsh)或二硫苏糖醇(dtt)等还原剂存在下被还原生成巯基,而细胞内的谷胱甘肽浓度(0.5~10mm/l)是细胞外谷胱甘肽浓度(2~20μm/l)的200倍以上,但是二硫键在人体的正常体温、ph和氧化等环境下非常稳定,即细胞外的谷胱甘肽浓度不足以还原二硫键,而在细胞内谷胱甘肽的作用下可以被还原生成巯基。另外,肿瘤组织细胞比正常组织细胞缺氧,更具有还原性环境。因此,可以将亲水性的聚合物和疏水性的药物通过二硫键链接,并在溶剂中自组装成纳米胶束,通过细胞内吞作用进入靶细胞后被gsh还原,即二硫键断裂生成巯基,从而快速有效地释放药物,并扩散到细胞核等结构,从而杀死癌细胞。
但是目前最常用的二硫键连接臂主要为2,2′-二硫代二乙酸、3,3′-二硫代二丙酸等,例如以3,3′-二硫代二丙酸作为连接臂的药物前体,在gsh、dtt等还原条件下,二硫键迅速发生断裂,但是释放的药物通常会带着“尾巴”,而非原药分子形式。
技术实现要素:
本发明针对现有抗肿瘤药物选择性差、水溶性差、靶向多肽穿膜能力不足以及还原响应释放原药等方面存在的缺陷,提供一种还原响应型肿瘤靶向的多肽药物偶联物及其制备方法和应用。
本发明解决上述技术问题的技术方案如下:
一种还原响应型肿瘤靶向的多肽药物偶联物,具有如式ⅰ所示的分子结构式:
其中,aaa1为l或d型lys;aaa2为l或d型的lys或arg;x为l或d型的ac-cys;y为nh或o;roh为疏水性抗肿瘤药物;n为1或2,glp为焦谷氨酸。
进一步,所述aaa1为d型lys,aaa2为l型arg,x为d型的ac-cys,具有如式ⅱ所示的结构式:
进一步,所述抗肿瘤药物是指紫杉烷类、喜树碱类、长春碱类药物中的任意一种。
进一步,所述紫杉烷类药物是指紫杉醇、多烯紫杉醇、卡巴他赛、拉洛他赛中的一种,所述喜树碱类药物是指喜树碱、伊立替康、拓扑替康、10-羟基喜树碱、7-乙基-10-羟基喜树碱中的一种,所述长春碱类药物是指长春碱、长春新碱、长春瑞滨中的一种。
本发明提供的多肽药物偶联物释放原药分子的机理为:
本发明采用了肿瘤微环境靶向给药的思路,通过引入对还原环境敏感的自毁式二硫键连接臂,在肿瘤细胞内谷胱甘肽提供的还原条件下,多肽药物偶联物的二硫键发生断裂,二硫键断裂后与多肽连接的这一端生成一个自由的巯基,另一端由于受到结构稳定因素的影响,该巯基会亲核进攻邻近的酯键从而生成一个稳定的五元环或六元环结构,同时释放抗癌药物的原药分子,以卡巴他赛为例,其还原响应释放原药分子的机理如下图所示:
本发明提供的多肽药物偶联物的有益效果为:
1)本发明提供的多肽药物偶联物能够实现靶向给药,多肽可将抗肿瘤药物运送到特定的肿瘤细胞,而且多肽c端rxxr序列的存在增加了药物对肿瘤组织细胞膜的穿膜性,提高了药物的靶向性,增加了药物疗效,降低对正常细胞的毒副作用。
2)本发明得到的多肽药物偶联物,可以在溶剂中自发组装成纳米胶束,延长体内循环时间。
3)本发明提供的多肽药物偶联物在实现靶向给药的同时,又发挥了二硫键在肿瘤部位特异性降解的特点。与常规的2,2′-二硫代二乙酸、3,3′-二硫代二丙酸等连接臂相比,无需通过进一步水解就可以得到原药分子形式的抗癌药物。
本发明还要求保护由上述的多肽药物偶联物制备而成的多肽药物纳米胶束,所述多肽药物纳米胶束是通过将上述的多肽药物偶联物和脂肪酸甘油三酯置于水中溶解得二者的混合溶液,后将溶液超声,过滤膜,向其中加入甘露醇冻干,即得,所得胶束的粒径为10~400nm,载药量为10~40wt%。
本发明还要求保护前述的多肽药物偶联物以及由本发明的多肽药物偶联物制备而成的多肽药物纳米胶束在抗肿瘤药物领域的应用。
进一步,所述肿瘤指的是前列腺癌。
本发明还提供了上述多肽药物偶联物的制备方法,包括如下步骤:
1)将含有2-3个碳原子的巯基醇或巯基胺与2,2′-二硫二吡啶反应,制备吡啶基二硫基醇或吡啶基二硫基胺;
2)使用对硝基氯甲酸苯酯与步骤1)得到的吡啶基二硫基醇或吡啶基二硫基胺进行偶联反应制备碳酸酯或氨基碳酸酯;
3)将步骤2)所得碳酸酯或氨基碳酸酯与含羟基基团的疏水性抗肿瘤药物通过酯交换反应生成偶联物;
4)将步骤3)所得的偶联物与靶向多肽通过巯基-二硫键交换反应,制备含有二硫键的多肽药物偶联物;
反应路线如下:
进一步,上述制备方法中各个步骤的具体反应过程如下:
步骤1):将含有2-3个碳原子的巯基醇或巯基胺和2,2′-二硫二吡啶按照摩尔比1:(1~3)加入溶剂中,室温反应12~48小时,反应完毕浓缩、硅胶柱分离、浓缩、干燥得吡啶基二硫基醇或吡啶基二硫基胺;
步骤2):在碱性条件下,将步骤1)所得的吡啶基二硫基醇或吡啶基二硫基胺溶于溶剂中得溶液,室温搅拌下将对硝基氯甲酸苯酯滴加至溶液中,控制吡啶基二硫基醇或吡啶基二硫基胺与对硝基氯甲酸苯酯的摩尔比为1:(1~3),室温反应1~10小时,浓缩、硅胶柱分离、浓缩、干燥得碳酸酯或氨基碳酸酯;
步骤3):在碱性条件下,将步骤2)所得的碳酸酯或氨基碳酸酯和含有羟基基团的疏水性抗肿瘤药物按摩尔比1:(1~3)溶于溶剂中,回流反应1~10小时,降至室温,反应液经经酸洗、分液、干燥、浓缩、硅胶柱纯化、浓缩、真空干燥后得二者的偶联物;
步骤4):惰性氛围中,搅拌条件下将靶向多肽滴加到步骤3)所得偶联物的溶液中,靶向多肽和偶联物的摩尔比为1:(1~3),室温下反应12~48小时,沉淀,离心,干燥,得含有二硫键的多肽药物偶联物。
本发明提供的多肽药物偶联物的制备方法的有益效果是:原料易得、反应条件温和、产率和产物纯度高、提纯方法简单等优点,利于批量生产。
附图说明
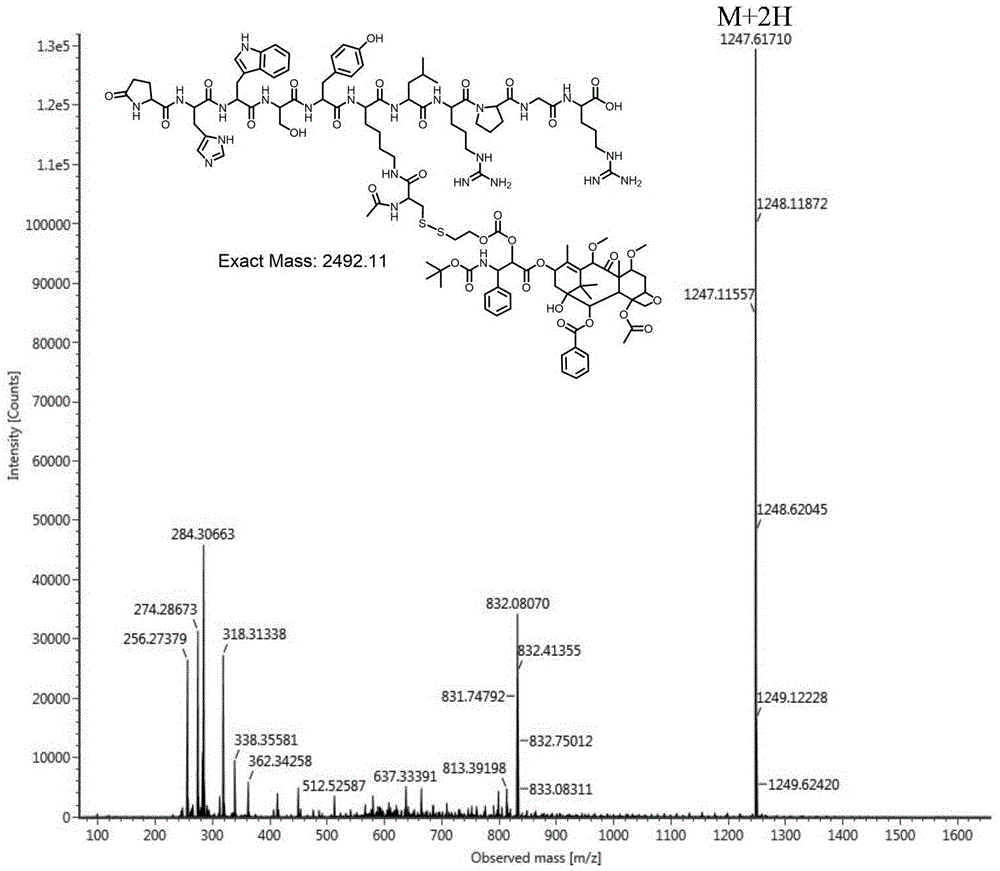
图1为实施例1所得的多肽偶联卡巴他赛的maldi-tof-ms图;
图2为实施例1所得多肽偶联卡巴他赛在dtt条件下还原响应释药结果图;
图3为实施例2所得胶束的粒径分布图;
图4为实施例2所得胶束与卡巴他赛对前列腺癌细胞du145的增殖抑制活性比较。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
实施例1:
一种还原响应型肿瘤靶向的多肽药物偶联物,具有如下结构式:
上述多肽药物偶联物的制备方法如下:
1)2-(2-吡啶基二硫基)乙醇的制备:
将2-巯基乙醇(2.0g,25.5mmol)和2,2′-二硫二吡啶(py-ss-py,8.4g,38.3mmol)加入100ml甲醇中,室温反应24小时。减压蒸去甲醇,过硅胶柱纯化,浓缩,真空干燥得3.27g淡黄色油状产物,收率68.4%。经检测产物的1hnmr,表明得到式a所示的2-(2-吡啶基二硫基)乙醇。
2)4-硝基苯基-2-(2-吡啶基二硫基)乙基碳酸酯的制备:
将2-(2-吡啶基二硫基)乙醇(3.27g,17.5mmol)和三乙胺(3.7g,36.6mmol)溶于100ml二氯甲烷中,0℃搅拌下将对硝基氯甲酸苯酯(4.23g,21.0mmol)缓慢滴加至溶液中,滴毕,室温反应6小时。浓缩,硅胶柱分离、浓缩、真空干燥得白色固体产物4.37g,收率71.1%。经检测产物的1hnmr,表明得到式b所示的4-硝基苯基-2-(2-吡啶基二硫基)乙基碳酸酯;3)2-(2-吡啶基二硫基)乙基碳酸酯与卡巴他赛偶联物的制备:
将4-硝基苯基-2-(2-吡啶基二硫基)乙基碳酸酯(1.5g,4.26mmol)和卡巴他赛(2.97g,3.55mmol)溶于200ml二氯甲烷中,加入2ml三乙胺,然后升温至回流反应5小时。反应完毕,降至室温,用稀盐酸水洗有机相、分液、干燥、浓缩、经硅胶柱纯化、浓缩,真空干燥得2.6g白色固体,收率为70.2%。经检测产物的1hnmr,表明得到式c所示结构的2-(2-吡啶基二硫基)乙基碳酸酯与卡巴他赛偶联物(py-ss(o)-caba)。
4)多肽-二硫键(o)-卡巴他赛的制备:
将多肽(0.3g,0.2mmol)溶于2mldmso中,氮气保护、搅拌下,滴加到py-ss(o)-caba(0.2g,0.2mmol)的dmso(2ml)溶液,室温下反应48小时。反应结束,将反应液滴加到250ml乙酸乙酯中,0℃条件下析出白色固体,离心得到0.4g白色粉末状固体,收率为83.3%。经检测产物的maldi-tof-ms,表明得到式d所示结构的多肽-二硫键(o)-卡巴他赛,如图1所示。
合成路线如下所示:
为了验证实施例1所得的多肽药物偶联物在还原条件下是否释放原药分子,我们对卡巴他赛、实施例1所得多肽药物偶联物以及实施例1所得多肽药物偶联物置于10mm的还原剂dtt溶液中后不同时间的产物均进行了hplc测试,结果如图2所示,由图1我们可以看出,实施例1所得多肽药物偶联物在dtt溶液中放置10min后,产物中已经出现了原药分子卡巴他赛,表明已经有一部分的多肽药物偶联物分解释放出了原药分子卡巴他赛,而随着放置时间的逐渐延长,原药分子卡巴他赛的量逐渐增加,因而,本申请提供的多肽药物偶联物在还原条件下可以迅速分解释放原药。
实施例2:
一种含有实施例1多肽药物偶联物的纳米胶束,采用如下方法制成:将20mg多肽药物偶联物和10μl中链脂肪酸甘油三酯置于水中,然后超声1min,过滤膜,向其中加入甘露醇冻干,即得还原响应型多肽药物纳米胶束冻干粉。利用动态光散射(dynamiclightscattering,dls)测定得到纳米胶束的粒径及分布(图3)。
实施例3:
一种还原响应型肿瘤靶向的多肽药物偶联物前体,具有如下结构式:
上述多肽药物偶联物前体的制备方法如下:
1)吡啶基二硫乙胺盐酸盐的制备:
将巯基丙胺盐酸盐(1.0g,8.8mmol)和2,2′-二硫二吡啶(py-ss-py,1.9g,8.8mmol)加入60ml甲醇中,室温反应48小时。减压浓缩反应液,乙醚沉降目标产物,抽滤,真空干燥得如式e所示的1.39g淡黄色油状液体产物,收率71.3%。
2)4-硝基苯基-(2-吡啶基二硫基)氨基碳酸酯的制备:
将吡啶基二硫乙胺盐酸盐(1.39g,6.3mmol)和三乙胺(0.72g,7.1mmol)溶于50ml二氯甲烷中,冰浴下将对硝基氯甲酸苯酯(1.76g,8.82mmol)缓慢滴加至溶液中,滴毕,室温反应10小时。浓缩,硅胶柱分离、浓缩、真空干燥得式f所示的淡黄色油状液体1.06g,收率79.8%。
3)4-硝基苯基-(2-吡啶基二硫基)氨基碳酸酯与sn-38偶联物的制备:
将4-硝基苯基-2-(2-吡啶基二硫基)氨基碳酸酯(1.70g,4.84mmol)和sn-38(2.85g,7.26mmol)溶于200ml二氯甲烷中,加入5ml三乙胺,室温反应12小时。反应完毕,用稀盐酸水溶液水洗有机相、分液、干燥、浓缩、经硅胶柱纯化、浓缩,真空干燥得2.05g淡黄色固体,收率为70.2%。得到式g所示结构的2-(2-吡啶基二硫基)氨基碳酸酯与sn-38偶联物(py-ss(n)-sn-38)。
4)多肽-二硫键(n)-sn38的制备:
将多肽(0.5g,0.3mmol)溶于2mldmso中,氮气保护、搅拌下,滴加到py-ss(n)-sn38(0.36g,0.6mmol)的dmso(2ml)溶液,室温下反应48小时。反应结束,将反应液滴加到250ml乙酸乙酯中,0℃条件下析出白色固体,离心得到0.48g白色固体,收率为78.2%。经检测产物的maldi-tof-ms,表明得到式h所示结构的多肽-二硫键(n)-sn38。
合成路线如下:
实施例4:
一种还原响应型肿瘤靶向的多肽药物偶联物前体,具有如下结构式:
上述多肽药物偶联物前体的制备方法如下:
1)3-(2-吡啶基二硫基)丙醇的制备:
将3-巯基丙醇(0.5g,5.43mmol)和2,2′-二硫二吡啶(py-ss-py,3.6g,16.34mmol)加入60ml甲醇中,室温反应12小时。减压蒸去甲醇,过硅胶柱纯化,浓缩,真空干燥得如式i所示的0.85g淡黄色油状液体,收率77.9%。
2)4-硝基苯基-3-(2-吡啶基二硫基)丙基碳酸酯的制备:
将3-(2-吡啶基二硫基)丙醇(0.85g,4.23mmol)和三乙胺(0.52g,5.15mmol)溶于50ml二氯甲烷中,室温搅拌下将对硝基氯甲酸苯酯(2.56g,12.7mmol)缓慢滴加至溶液中,滴毕,室温反应8小时。浓缩,硅胶柱分离、浓缩、真空干燥得式j所示的淡黄色油状液体1.22g,收率78.9%。
3)3-(2-吡啶基二硫基)丙基碳酸酯与长春瑞滨联物的制备:
将4-硝基苯基-3-(2-吡啶基二硫基)丙基碳酸酯(1.22g,3.33mmol)和长春瑞滨(7.77g,9.99mmol)溶于150ml二氯甲烷中,加入1ml三乙胺,然后升温至回流反应10小时。反应完毕,降至室温,用稀盐酸水洗有机相、分液、干燥、浓缩、经硅胶柱纯化、浓缩,真空干燥得如式k所示的2.20g淡黄色固体3-(2-吡啶基二硫基)丙基碳酸酯与卡巴他赛偶联物(py-ss(o)-长春瑞滨),收率为65.8%。
4)多肽-二硫键(o)-长春瑞滨的制备:
将多肽(0.5g,0.3mmol)溶于2mldmso中,氮气保护、搅拌下,滴加到py-ss(o)-长春瑞滨(0.9g,0.9mmol)的dmso(2ml)溶液,室温下反应24小时。反应结束,将反应液滴加到250ml乙酸乙酯中,0℃条件下析出白色固体,离心得到0.58g白色固体,收率为79%。经检测产物的maldi-tof-ms,表明得到式i所示结构的多肽-二硫键(o)-长春瑞滨。
合成路线如下所示:
为了验证本发明所得多肽药物偶联物对肿瘤细胞的增殖抑制效果,我们取实施例2所得的多肽药物胶束以及卡巴他赛进行了体外抗肿瘤细胞的效果对比实验,我们以前列腺癌细胞du145为例分别进行了实施例2所得的多肽药物胶束与卡巴他赛对肿瘤细胞的增殖抑制效果实验,具体操作过程如下:
取对数生长期的细胞,调整适当的细胞密度,接种于96孔板内,100μl/well,培养于37℃,5%co2的培养箱内。培养过夜后给药,分别加药作用48h。分设空白组、给药组,每组设4个复孔。体外抗前列腺癌效果如图4所示。从图4中可以看出,多肽-二硫键(o)-卡巴他赛与卡巴他赛具有近似的细胞毒性,多肽-二硫键(o)-卡巴他赛对结前列腺癌细胞du145的半数致死量ic50为0.012μm,有较强的抗肿瘤活性。
综上所述,本发明提供的多肽药物偶联物不仅水溶性好,并且能够在肿瘤细胞内的还原条件下1h内释放出原药,实现了靶向释放,且经过实验证明与原药具有基本相同的抗肿瘤活性,可以于48h内发挥出其对肿瘤细胞的抑制作用。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!