一种绿豆提取物的制备方法与流程
本发明涉及植物提取的制备方法,具体涉及一种绿豆提取物的制备方法。
背景技术:
绿豆(vignaradiatusl.)又名文豆、吉豆、青小豆,是豆科草本植物绿豆的成熟种子,作为豆类中主要的粮食作物在各地被广泛种植,绿豆是我国传统杂粮作物,产量和出口量均居世界首位,至今已有两千多年的栽培史,属高蛋白、低脂肪、中淀粉作物,营养丰富,经济利用价值高。同时,绿豆具有良好食用及药用价值,有“济世之食谷”之说。绿豆含有均衡的营养素,包括蛋白质和膳食纤维,以及含有大量的生物活性物质,如氨基酸、黄酮类、酚类、低聚糖等,是抗氧化、抗炎、抑菌和抗肿瘤的主要活性成分。绿豆药材是《中国药典》2015年版中收载的多个成方制剂,如护肝片、消络痛片、消络痛胶囊和清宁丸的重要组成药味。传统中医认为绿豆味性干寒,内服具有清热解毒、消炎、利水润肤等功效。现在医学则认为绿豆在抗炎、抑菌、降脂、抗肿瘤和解毒方面功效颇佳。
技术实现要素:
本发明的目的在于克服现有技术存在的不足之处而提供一种绿豆提取物的制备方法。
为实现上述目的,本发明采取的技术方案为:一种绿豆提取物的制备方法,所述方法包括以下步骤:
(1)绿豆与乙醇溶液混合进行提取,过滤得到乙醇粗提液;
(2)乙醇粗提液浓缩成浸膏,加水混悬得到次;
(3)依次用石油醚、二氯甲烷、乙酸乙酯、正丁醇对浓缩液进行萃取,得到石油醚萃取液、二氯甲烷萃取液、乙酸乙酯萃取液、正丁醇萃取液;
(4)石油醚萃取液、二氯甲烷萃取液、乙酸乙酯萃取液、正丁醇萃取液浓缩,洗涤、干燥,得到石油醚绿豆萃取物、二氯甲烷绿豆萃取物、乙酸乙酯绿豆萃取物和正丁醇绿豆萃取物。
优选地,步骤(1)中所述乙醇溶液中乙醇的体积分数为30~90%,提取的温度为25-80℃。
优选地,步骤(1)中提取的方法为:用乙醇溶液提取绿豆1-4次,每次提取的绿豆和乙醇溶液的料液比为1:5~1:30kg/l,每次提取的时间为60-180分钟。
优选地,步骤(1)中提取的方法为:用乙醇溶液提取绿豆2次,每次提取的绿豆与乙醇溶液的料液比为1:10kg/l,每次提取的时间为120分钟,提取的温度为80℃。
优选地,步骤(2)中将浓缩后的浸膏加与浸膏质量相等的水混悬得到浓缩液;步骤(3)中石油醚、二氯甲烷、乙酸乙酯、正丁醇的用量为步骤(2)浓缩液体积的1-3倍。
更有选地,步骤(3)中石油醚、二氯甲烷、乙酸乙酯、正丁醇任意一种溶剂分2-5次萃取。
优选地,步骤(4)中浓缩的方式为减压蒸发,温度为45~60℃。
优选地,步骤(4)中干燥的方式为真空冷冻干燥。
本发明还提供一种石油醚绿豆萃取物,所述萃取物由上述任意一种绿豆提取物的制备方法制备得到,所述萃取物具有抗炎效果。
一种二氯甲烷绿豆萃取物,所述萃取物由上述任意一种绿豆提取物的制备方法制备得到,所述萃取物具有抗炎效果。
一种乙酸乙酯绿豆萃取物,所述萃取物由上述任意一种绿豆提取物的制备方法制备得到,所述萃取物具有抗炎效果。
一种正丁醇绿豆萃取物,所述萃取物由上述任意一种绿豆提取物的制备方法制备得到,所述萃取物具有抗炎效果。
上述任意一种绿豆萃取物为在制备抗炎药品、抗炎保健品、抗炎化妆品中的用途,所述绿豆萃取物为石油醚绿豆萃取物、二氯甲烷绿豆萃取物、乙酸乙酯绿豆萃取物和正丁醇绿豆萃取物至少一种。
本发明制备的绿豆萃取物能够较好的减少炎症反应产生的no释放,具有良好好的抗炎作用,且对细胞没有毒性,可用于药品、保健品、化妆品等产品中。
本发明的有益效果在于:本发明提供了一种绿豆提取物及其制备方法,本方法所得的绿豆提取物能较好的抑制no的释放,具有良好的抗炎功效,且制备工艺简单,原料来源丰富,效率高,成本低,溶剂可回收利用,适合工业化大规模生产的需求。
附图说明
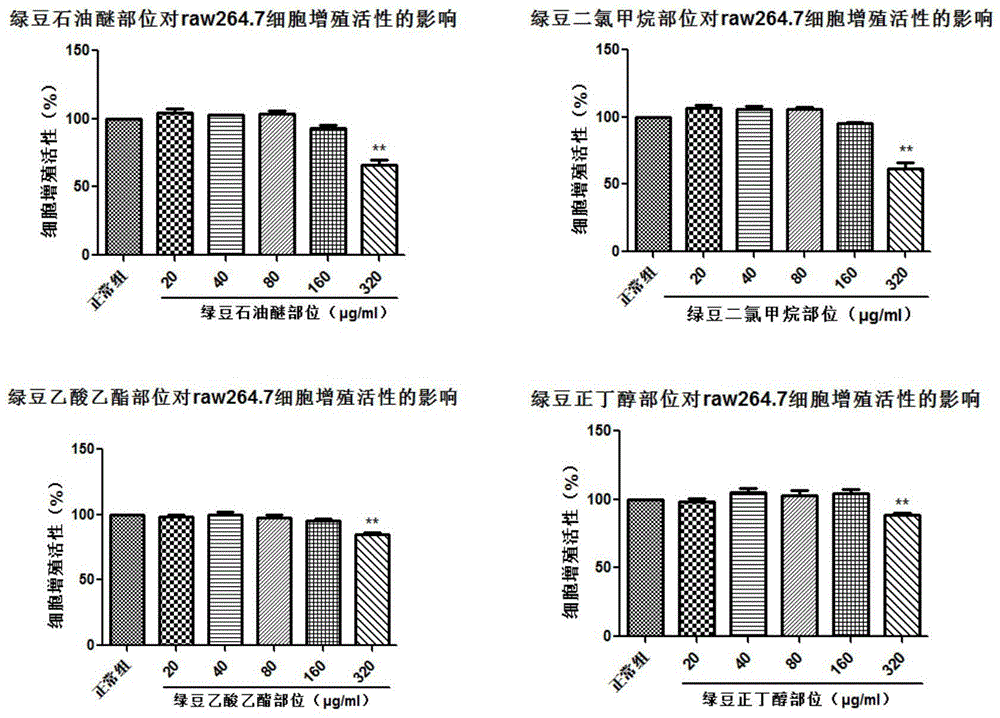
图1为本发明实施例的绿豆提取物对raw264.7细胞安全浓度的实验结果图。
图2为本发明实施例的绿豆有效部位对lps诱导raw264.7产生的no释放影响实验结构图。
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。
实施例1
作为本发明实施例的一种绿豆提取物的制备方法,所述方法包括以下步骤:
(1)将绿豆成熟种子(2kg)加入至提取罐,第一次加入20l的75%乙醇,80℃提取2.5h,过滤得到滤液1,将残渣再加入20l的75%乙醇,提取2.5h,过滤得到滤液2,合并两次滤液;
(2)减压回收乙醇,得到乙醇总浸膏,再将乙醇总浸膏在水中(1:1)分散,得到浓缩液;
(3)依次用1倍体积量的石油醚、二氯甲烷、乙酸乙酯、正丁醇分别分3次萃取,得到石油醚萃取液、二氯甲烷萃取液、乙酸乙酯萃取液、正丁醇萃取液;
(4)再减压浓缩去除溶剂,于45℃真空干燥箱中干燥,得到石油醚绿豆萃物(8.3%)、二氯甲烷绿豆萃取物(0.72%)、乙酸乙酯绿豆萃取物(0.38%)、正丁醇绿豆萃取物(1.8%)。
石油醚绿豆萃物的提取率=石油醚绿豆萃物(m)/绿豆(m)×%=8.3%;
二氯甲烷绿豆萃物的提取率=二氯甲烷绿豆萃物(m)/绿豆(m)×%=0.72%;
乙酸乙酯绿豆萃物的提取率=乙酸乙酯绿豆萃物(m)/绿豆(m)×%=0.38%;
正丁醇豆萃物的提取率=正丁醇绿豆萃物(m)/绿豆(m)×%=1.8%;
实施例2
作为本发明实施例的一种绿豆提取物的制备方法,所述方法包括以下步骤:
(1)将绿豆成熟种子(2kg)加入至提取罐,第一次加入20l的75%乙醇,80℃提取2.5h,过滤得到滤液1,将残渣再加入20l的75%乙醇,提取2.5h,过滤得到滤液2,合并两次滤液;
(2)减压回收乙醇,得到乙醇总浸膏,再将乙醇总浸膏在水中(1:1)分散,得到浓缩液;
(3)依次用2倍体积量的石油醚、二氯甲烷、乙酸乙酯、正丁醇分别分4次萃取,得到石油醚萃取液、二氯甲烷萃取液、乙酸乙酯萃取液、正丁醇萃取液;
(4)再减压浓缩去除溶剂,于45℃真空干燥箱中干燥,得到石油醚绿豆萃物(7.8%)、二氯甲烷绿豆萃取物(0.63%)、乙酸乙酯绿豆萃取物(0.31%)、正丁醇绿豆萃取物(1.4%)。
实施例3
作为本发明实施例的一种绿豆提取物的制备方法,所述方法包括以下步骤:
(1)将绿豆成熟种子(2kg)加入至提取罐,第一次加入20l的30%乙醇,75℃提取2.5h,过滤得到滤液1,将残渣再加入20l的30%乙醇,提取2.5h,过滤得到滤液2,合并两次滤液;
(2)减压回收乙醇,得到乙醇总浸膏,再将乙醇总浸膏在水中(1:1)分散,得到浓缩液;
(3)依次用3倍体积量的石油醚、二氯甲烷、乙酸乙酯、正丁醇分别分3次萃取,得到石油醚萃取液、二氯甲烷萃取液、乙酸乙酯萃取液、正丁醇萃取液;
(4)再减压浓缩去除溶剂,于45℃真空干燥箱中干燥,得到石油醚绿豆萃物(8.1%)、二氯甲烷绿豆萃取物(0.68%)、乙酸乙酯绿豆萃取物(0.35%)、正丁醇绿豆萃取物(1.7%)。
实施例4
作为本发明实施例的一种绿豆提取物的制备方法,所述方法包括以下步骤:
(1)将绿豆成熟种子(2kg)加入至提取罐,第一次加入20l的75%乙醇,40℃提取2.5h,过滤得到滤液1,将残渣再加入20l的75%乙醇,提取2.5h,过滤得到滤液2,合并两次滤液;
(2)减压回收乙醇,得到乙醇总浸膏,再将乙醇总浸膏在水中(1:1)分散,得到浓缩液;
(3)依次用3倍体积量的石油醚、二氯甲烷、乙酸乙酯、正丁醇分别分2次萃取,得到石油醚萃取液、二氯甲烷萃取液、乙酸乙酯萃取液、正丁醇萃取液;
(4)再减压浓缩去除溶剂,于45℃真空干燥箱中干燥,得到石油醚绿豆萃物(7.6%)、二氯甲烷绿豆萃取物(0.64%)、乙酸乙酯绿豆萃取物(0.39%)、正丁醇绿豆萃取物(2.1%)。
实施例5
绿豆萃取物抗炎实验。
在正常生理状态下,巨噬细胞分泌的no及其它炎性因子较少,no是一种气体信号分子,它可以通过细胞膜参与多种生物过程,如神经递质传递、免疫防御、细胞凋亡和运动的调节等,是主要的炎性介质。在诱发炎症反应的诸多因素中,内毒素是激发炎症反应的一类重要触发剂,它是一种革兰氏阴性菌,其化学本质为脂多糖(lps),它可以通过刺激细胞,激活细胞内炎症信号传导通路,从而介导炎性因子的合成和释放,所以当受到外界致炎因子刺激时,巨噬细胞中的no及其它炎性因子会失去平衡,分泌量显著增加,导致炎症的发生。当加入抗炎药物后,这些炎性因子受到抑制而减少,从而缓解炎症。因此,通过选取no作为抗炎活性研究指标,可判断药物抗炎作用效果,筛选抗炎活性成分。
实验试剂及仪器:
样品的配制:精密称取实施例1中得到的绿豆萃取物,用含10%胎牛血清的dmem培养基配成母液,经0.22μm滤器过滤,再用培养基稀释至实验所需浓度使用。
试剂的配制:
mtt(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)溶液的配制:精密称取mtt粉末,用pbs缓冲液溶解配制成浓度为5mg/ml的溶液,并用0.2μm的滤器除菌避光4℃保存,备用。
lps溶液的配制:精密称取lps固体,用pbs缓冲液配制成浓度为1mg/ml的溶液,并用0.2μm的滤器除菌避光4℃保存,备用。
细胞培养:无菌条件下,将raw264.7细胞接种于含10%胎牛血清的dmem培养基的培养瓶中,在37℃,5%co2饱和湿度环境下培养,待细胞生长至近融合状态,加入适量培养基,用一次性滴管吹打细胞,使细胞脱落,吹打均匀后将细胞传代至25cm2培养瓶中,每2d传代1次。
实验方法:
取对数生长期的上述细胞,加入适量培养基,用一次性滴管吹打细胞,使细胞脱落,吹打均匀后收集,取部分细胞加入台盼蓝,用细胞计数仪计数,调整细胞密度至4×104/ml,将细胞接种于96孔板中,每孔100μl,37℃,5%co2饱和湿度环境下孵育24h后;
加入培养基配制的样品(10、20、40、80、160μg/ml)100ml,作为实验组;
正常组不添加药物,空白组不接种细胞,用等量培养基替代;
每组设置3个复孔,于37℃,5%co2饱和湿度环境下孵育24h,后弃培养基,用pbs洗涤一遍,每孔加入100μldmem无血清培养基和20μl5mg/mlmtt溶液,在37℃,5%co2饱和湿度环境下培养4h后,舍弃上清液,每孔加入150μldmso溶液,震荡5-10min,使结晶充分溶解,立即置酶标仪下测a490,实验重复三次。
细胞活性=((样品处理组a490-空白组a490)/(正常组a490-空白组a490))×100%。
绿豆萃取物对raw264.7细胞的毒性作用见图1,由图可知,绿豆四种萃取物在浓度为20、40、80、160μg/ml时raw264.7细胞活性与正常组比较均没有显著性差异(p>0.05),在浓度为320μg/ml时,与正常组比较具有显著性差异(p<0.05),实验结果表明,四种萃取物在20-160μg/ml浓度下对正常细胞均没有毒性。
绿豆萃取物对lps刺激raw264.7细胞产生no的影响实验。
实验分为正常组(培养基)、模型组(1μg/mllps),实验组(绿豆提取物10、20、40μg/ml)。取对数生长期的细胞,加入适量培养基,用一次性滴管吹打细胞,使细胞脱落,吹打均匀后收集,取部分细胞加入台盼蓝,用细胞计数仪计数,调整细胞密度至1×105/ml,将细胞接种于96孔板中,每孔100μl,37℃,5%co2饱和湿度环境下孵育24h后,按分组添加培养基,每组设置3个复孔,于37℃,5%co2饱和湿度环境下孵育24h后,在96孔板中加入样品培养液上清50μl,再加入室温griessreagentⅰ,之后各孔中继续加入室温griessreagentⅱ,酶标仪530nm下测定吸光度。
ic50采用spss17.0软件计算。
绿豆种萃取物对lps刺激raw264.7细胞释放no的影响见图2,由图2可知,与正常组相比,模型组no水平显著升高(p<0.05);绿豆石油醚提取物、二氯甲烷提取物及正丁醇提取物高中低剂量均能显著抑制lps刺激raw264.7细胞释放的no(p<0.05),故表明绿豆石油醚提取物、二氯甲烷提取物及正丁醇提取物具有抗炎活性,可抑制炎症因子no的释放,ic50分别为97.10μg/ml、99.05μg/ml、244.92μg/ml,且石油醚提取物、二氯甲烷提取物抗炎活性最好。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!