一种制备柔性脂质体的方法与流程
本发明涉及生物医药领域,具体涉及一种柔性脂质体的方法。
背景技术:
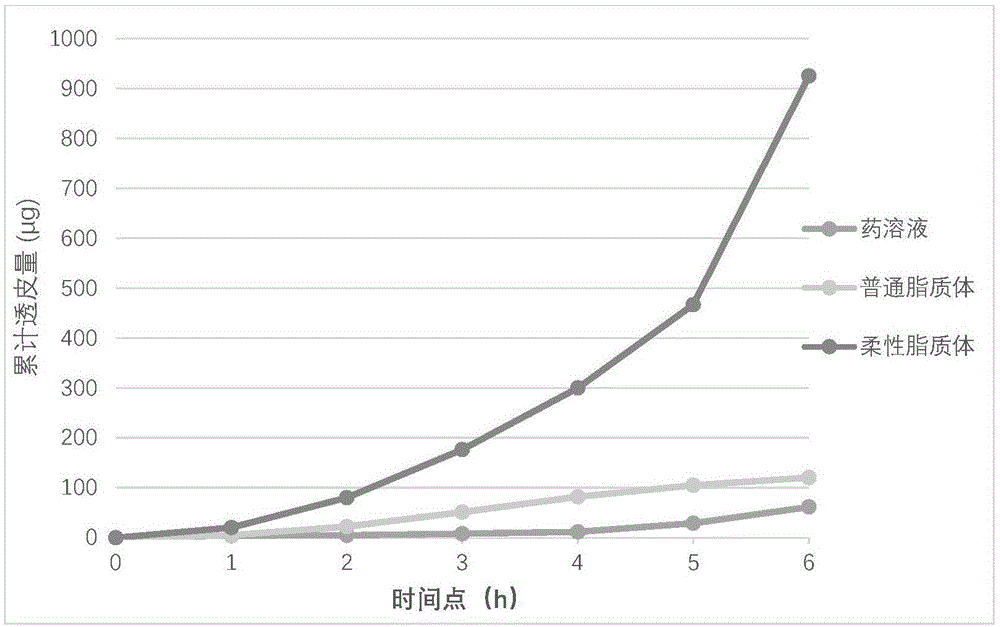
:近几十年来,各种活性药物成分(api),如热不稳定蛋白、酸不稳定药物、酶敏感、高亲脂、亲水性、光敏药物和高分子量分子,都被封装在囊泡内进行运载。然而,传统脂质体作为透皮运载工具基本没有作用,它们通常积累在角质层,很难渗透到更深层次的区域或系统性循环中。柔性脂质体(els)亦称为可变形脂质体、变形脂质体、弹性脂质体,是具有生物相容性的双层囊泡系统,可以为治疗、生物化学和美容等目的提供多种运送药物的手段。这种囊泡系统已经开发出了局部的、喷鼻、口服以及经皮输送系统。分子透皮转运可直接使药物到达至目标靶位,这种无痛给药方式可增加病人的顺应性,相比注射或口服产品,其具有无全身毒性、可降低血浆中药物波动、特定位点的药物局部输送、绕过肝代谢、无损伤式传递等特点。除此以外,能够成功运载药物的载体本身也是制剂学家们关注的重点,因为柔性脂质体载体具有自身明显的优势且易于停止治疗。目前脂质体的制备方法多为薄膜法、反相蒸发法、溶剂注入法和复乳法等,这些方法一般称为被动载药法,而ph梯度法,硫酸铵梯度法一般被称为主动载药法。这些方法多需要高能量输入,复杂的操作程序,易带来杂质,难于规范化扩大生产,稳定性也是难于解决的问题。本发明旨在获得操作更简便且囊泡稳定的制备方法。技术实现要素:本发明公开了一种制备柔性脂质体的方法,包括以下步骤:1)将磷脂和表面活性剂溶解于溶剂中,制备成磷脂溶液,所述磷脂和所述溶剂的质量体积比为1:(0.5-2)g/ml,优选为1:(1-1.5)g/ml;2)在缓冲液中加入甘油或丙二醇,制备成水相溶液,其中优选所述甘油或丙二醇在所述水相溶液中的浓度为3至30w/v%,更优选为10-15w/v%;3)将所述磷脂溶液注入所述水相溶液,经过混合后得到柔性脂质体;其中,所述磷脂在所述磷脂溶液和所述水相溶液体积之和的终浓度范围为2-60mg/ml。其中,所述柔性脂质体可在室温下制备而成,优选为在温度范围为19至26℃的任一温度下均可,例如温度19、20、21、22、23、24、25、26℃。其中,磷脂在磷脂溶液中的浓度为1-80w/v%。表面活性剂在磷脂溶液中的浓度为5-50w/v%,所述磷脂和所述溶剂的质量体积比为1:(0.5-2)g/ml。所述混合磷脂溶液和水相溶液的体积比率优选为1:3至1:7。在一个实施例中,脂溶性活性物质溶解于步骤1)中所述的溶剂中。在一个具体实施例中,步骤1)为:将磷脂、表面活性剂、脂溶性活性物质诸如多烯紫杉醇溶解于辛癸酸甘油三酯中,搅拌使上述物质溶解。在一个实施例中,水溶性活性物质溶解于步骤2)中所述的缓冲液中。所述磷脂溶液和所述水相溶液体积之和,所述磷脂与活性物质的质量比范围为100:0.001-100:90,例如所述磷脂与活性物质的质量比为100:0.004、100:80。在一个具体实实施例中,1)将磷脂和表面活性剂溶解于溶剂中,制备成磷脂溶液,所述溶剂在所述磷脂溶液中的浓度为5-60w/v%;2)在缓冲液中加入甘油或丙二醇,制备成水相溶液,其中所述甘油或丙二醇在所述水相溶液中的浓度为10-15w/v%;3)将所述磷脂溶液注入所述水相溶液,经混合后得到柔性脂质体;将脂溶性活性物质溶解于步骤1)中所述的溶剂中;或者,将水溶性活性物质溶解于步骤2)中所述的缓冲液中;其中,所述磷脂在所述磷脂溶液和所述水相溶液体积之和的终浓度为20-60mg/ml,所述磷脂与活性物质的质量比范围为100:0.004至100:80。在一个具体实施例中,缓冲液选自去离子水、生理盐水、醋酸钠缓冲液、枸橼酸钠缓冲液、乳酸缓冲液、磷酸盐缓冲液、酒石酸缓冲液。在一个具体实施例中,所述甘油或丙二醇在所述水相溶液中的浓度为3-30w/v%,优选为4-20w/v%,例如10-20w/v%、15-20w/v%。在一个实施例中,步骤1)中所述的磷脂溶液或者步骤2)中所述的缓冲液中,还可添加抗氧化剂和/或防腐剂。抗氧化剂选自维生素e、辅酶q10、硫辛酸、亚硫酸氢钠、亚硫酸钠、焦亚硫酸钠中的至少一种。防腐剂选自硫柳汞、苯甲醇、羟丙甲酯、羟丙丁酯、三氯叔丁醇中的至少一种。在一个具体实施例中,所述磷脂包括卵磷脂、脑磷脂、大豆磷脂、合成磷脂、二月桂酰磷脂酰胆碱、二油酰磷脂酰胆碱中的一种以上。各种磷脂中的磷脂酰胆碱含量不少于50%。在一个具体实施例中,所述溶剂包括乙醇、peg200至600中的任一种、peg-6辛/癸酸甘油酯、peg-7辛/癸酸甘油酯、peg-8辛/癸酸甘油酯还氧二元醇中的一种以上。在一个具体实施例中,所述表面活性剂选自离子型表面活性剂或非离子型表面活性剂,包括span、tween、油酸、胆酸钠或去氧胆酸钠的一种以上,优选span80。在一个具体实施例中,所述活性物质包括细胞生长因子、分泌蛋白或多肽、疫苗蛋白、激素、胰岛素、维生素、谷胱甘肽、硫辛酸、苯磷硫胺、水飞蓟素、dna载体。在一个具体实施例中,所述混合采用搅拌方式或者超声,搅拌条件优选为700-750rmp,绞拌速度可随容量增加,例如体积为100-200ml,搅拌速率可达5000-7000rmp,体积为500-1000ml,搅拌速率可用10000-13000rmp;搅拌时间2分钟以上,例如搅拌2至15分钟。另一方面,本发明提供了一种柔性脂质体,由上述任一项所述的方法制备而成。在一方面,本发明还公开了一种药物组合物,包含前述的柔性脂质体和药学上可接受的药用辅料,该药物组合物的剂型包括乳膏剂、凝胶剂。有益效果本发明公开的制备方法形成的单一分布的柔性脂质体直径为120-180nm,活性医药成分包裹率可达45-95%。该方法制作的脂质体在室温中可保持50天,4℃可维持10个月,具有较好的稳定性。附图说明图1示出普通脂质体和柔性脂质体在凝胶中紫杉醇累积透皮量比,数值表示为平均值±se,n=3。图2示出普通脂质体和柔性脂质体在凝胶中累积透皮量比较,数值表示为平均值±se,n=3。图3示出局部皮肤应用普通脂质体胰岛素和柔性脂质体胰岛素的降糖作用比较,正常对照组为正常大鼠的血糖水平,普通脂质体组为在糖尿病模型中使用普通脂质体胰岛素处理后的血糖水平,柔性脂质体组为在糖尿病模型中使用柔性脂质体胰岛素处理后的的血糖水平。图4示出水飞蓟溶液和水飞蓟脂质体经浆膜囊转运比较。图5磷脂浓度对包封率的影响。具体实施方式下面将通过具体描述,对本发明作进一步的说明。除非另有限定,本文中所使用的所有技术和科学术语具有与本发明所属
技术领域:
的普通技术人员通常理解相同的含义。本申请中,单数形式“一个”、“该”包括复数对象,除非上下文另外清楚规定。如本文所用的术语“磷脂”也称磷脂类、磷脂质,是指含有磷酸的脂类,属于复合脂。磷脂为两性分子,一端为亲水的含氮或磷的头,另一端为疏水(亲油)的长烃基链。磷脂可构成脂双分子层,即细胞膜的结构。例如磷脂包括卵磷脂、脑磷脂、大豆磷脂、合成磷脂、二月桂酰磷脂酰胆碱、二油酰磷脂酰胆碱。磷脂在磷脂溶液中的浓度为1-80w/v%。在一个具体实施例中,磷脂在磷脂溶液中的浓度为5、10、15、20、25、30、35、40、45、50、55、60、75、80w/v%。优选地,制备中称取的磷脂在磷脂溶液中的浓度为30-50w/v%,例如在柔性脂质体溶液终体积的浓度为5w/v%,即50mg/ml。溶剂包括乙醇、peg400、选自peg200至600中的任一种、选自peg-8辛/癸酸甘油酯中的任一种、peg-6至-8辛/癸酸甘油酯、还氧二元醇中的一种以上。溶剂在磷脂溶液中的浓度为5-60w/v%。例如溶剂在磷脂溶液中的浓度为5、10、15、20、25、30w/v%。溶剂诸如乙醇在磷脂溶液中的浓度为50-60w/v%,例如54%、55%。表面活性剂选自离子型表面活性剂或非离子型表面活性剂,包括span(斯潘)、tween、油酸、胆酸钠或去氧胆酸钠的一种以上,优选span80(斯潘80)。表面活性剂在磷脂溶液中的浓度为5-50w/v%,表面活性剂在磷脂溶液中的浓度为5、10、15、20、25、30、35、40、45、50w/v%。例如span80在磷脂溶液中的浓度为10%-30%,优选为15%。磷脂溶液和水相溶液混合的体积比率可以为1:3至1:7之间,例如1:3、1:4、1:5、1:6、1:7。磷脂溶液和水相溶液混合的体积比与制备中称取的磷脂在柔性脂质体溶液终体积的浓度有关,本领域技术人员可以根据实际需要进行调整磷脂溶液和水相溶液混合的体积比,以达到本发明中要求制备中称取的磷脂在柔性脂质体溶液终体积的浓度范围。脂溶性活性物质可溶解于磷脂溶液中,例如将磷脂、表面活性剂、脂溶性活性物质诸如多烯紫杉醇溶解于辛癸酸甘油三酯中,搅拌使上述物质溶解。例如制备水飞蓟素按配比将磷脂溶于有机溶剂中,使磷脂在柔性脂质体终体积中的浓度在2-60mg/ml之间,优选为40-50mg/ml。有机溶剂选自乙醇、丙二醇,或乳酸乙酯,还氧二元醇,有机溶剂在磷脂溶液中的浓度为45-55%,优选为48%-54%。加入5-30%脂类量的表面活性剂胆酸钠,优选为7%或8%,5-20%脂类量的水飞蓟素,优选10%。水溶性活性物质溶解于水相中的缓冲液中。缓冲液选自去离子水、生理盐水、醋酸钠缓冲液、枸橼酸钠缓冲液、乳酸缓冲液、磷酸盐缓冲液、酒石酸缓冲液。甘油或丙二醇在所述水相溶液中的浓度为3-30w/v%,优选为4-20w/v%,例如10-20w/v%、15-20w/v%,优选为10%、11%、12%、13%、14%、15%。如本文所用的术语“活性物质”是指能够包裹在脂质体中并具有生物学活性的物质,所述活性物质包括细胞生长因子、分泌蛋白或多肽、疫苗蛋白、激素、胰岛素、维生素、谷胱甘肽、硫辛酸、苯磷硫胺、水飞蓟素、dna载体中的至少一种,本领域技术人员可合理预期,使用本发明中制备脂质体的方法,可以包裹任何活性物质。如本文所用的术语“抗氧化剂”是防止脂质被氧化以保持脂质体的更长的保存时间的一类物质。例如抗氧化剂选自维生素e、辅酶q10、硫辛酸、亚硫酸氢钠、亚硫酸钠、焦亚硫酸钠。如本文所用的术语“防腐剂”是指能抑制微生物活动,防止药品腐败变质的一类添加剂。例如防腐剂选自硫柳汞、苯甲醇、羟丙甲酯、羟丙丁酯、三氯叔丁醇。如本文所用的术语“缓冲液”包括去离子水、生理盐水、醋酸钠缓冲液、枸橼酸钠缓冲液、乳酸缓冲液、磷酸盐缓冲液、酒石酸缓冲液。在一个具体实施例中,所述搅拌的条件优选为700-750rmp,绞拌速度可随容量增加,例如体积为100-200ml,搅拌速率可达5000-7000rmp,体积为500-1000ml,搅拌速率可用10000-13000rmp;搅拌时间2分钟以上,例如搅拌2-15分钟。在一个具体实施例中,制备柔性脂质体的方法和配方1.脂相制备:按比例将磷脂溶于溶剂中,磷脂在脂质体悬液中的终浓度可在在2-60mg/ml之间,例如按配比将磷脂溶于有机溶剂中,使脂类的浓度在10-50mg/ml之间;有机溶剂选自乙醇、peg400,labrasol(peg-8辛/癸酸甘油酯)。同时加入表面活性剂,表面活性剂的浓度为脂相总量的5-50w/v%;脂溶性的医药活性成份此时按比例加入,在室温中搅拌350-700rmp溶解。2.水相制备:按比例将水溶性医药活性成份溶于生理盐水或缓冲液中制成水相溶液,缓冲液可选自醋酸钠缓冲液、枸橼酸钠缓冲液、乳酸缓冲液、磷酸盐缓冲液、酒石酸缓冲液。然后加入最终容量的1-30%的促进囊泡形成的水相溶剂例如丙二醇或甘油。3.柔性脂质体制备:以700-10000rmp(按体积而定)搅拌混合脂相溶液2-15分钟,将脂相缓缓加入同样搅拌速度的水相,搅拌水合2-30分钟。这样形成的单一分布的柔性脂质体直径为90-180nm。活性医药成分包裹率可达45-95%。该方法制作的脂质体在室温中可保持50天,4℃可维持10个月。对于脂溶性的活性物质,可保存在前脂质体状态(即脂质溶液),在使用之前在于水介质部分混合,这样可以大大提升室温条件下的保存期,解决稳定性问题。本发明公开的一种药物组合物,包含前述的柔性脂质体和药学上可接受的药用成分,该药物组合物的剂型包括乳膏剂、凝胶剂、透皮制剂的制备由实施例中的脂质体可以制备成不同的剂型,例如溶液剂,膏剂或凝胶剂。1.溶液剂;将制成的脂质体直接加入生理盐水或缓冲液,其中的医药活性成分按各自的有效浓度而定。缓冲液选自枸橼酸钠缓冲液、乳酸缓液、磷酸盐缓冲液。2.乳膏剂:乳膏剂基质由油相、水相、乳化剂及促透剂组成,其中油相材料选自凡士林、石蜡或液状石蜡、羊毛脂、硅酮、蜂蜡、氢化植物油、硬脂酸甘油脂、高级脂肪醇等,占基质20w/v%~70w/v%;水相成分选自聚乙二醇、甘油、丙二醇,占基质20w/v%~70w/v%;乳化剂选自新生皂类、吐温类、司盘类、十二烷基硫酸钠,占基质0.1w/v%~5w/v%;促透剂选自薄荷脑、冰片、樟脑、水杨酸甲酯、氮酮、丙二醇、n-甲基吡咯烷酮,占基质0~9w/v%。脂质体乳膏剂由医药活性成分脂质体和基质组成,其中医药活性成分脂质体占2w/v%~30w/v%。基质可以是水包油型或油包水型。其制备方法是将油相、水相分别加热至70℃左右,再混合搅匀乳化,冷却后加入医药含活性成分脂质体,搅匀即可。3.制备医药活性成分脂质体凝胶剂脂质体凝胶剂由医药活性成分脂质体、高分子基质材料、防腐剂、保湿剂和溶剂组成,亦可含有中和剂和促透剂。高分子基质材料选自卡波普、羧甲基纤维素钠、羟丙甲纤维素、羟丙基纤维素、聚乙烯吡咯烷酮、透明质酸、胶原蛋白;温度敏感的高分子材料等。保湿剂为甘油;防腐剂为、羟苯乙酯或硫柳汞;溶剂为水;中和剂为氢氧化钠或三乙醇胺;促透剂选自薄荷脑、樟脑、氮酮、柠檬烯、丙二醇、n甲基吡咯烷酮。各组分的重量百分比为:医药活性成分脂质体2~30w/v%,高分子基质材料0.1~5w/v%,保湿剂4~15w/v%,防腐剂0.01~0.5w/v%,中和剂0~6w/v%,促透剂0~20w/v%,溶剂35~70w/v%。制备方法为:将高分子基质材料加水溶胀,按上述配比分别加入保湿剂、防腐剂、中和剂和促透剂,加水至规定量,调整ph值在5.5~7.2之间,加入医药活性成分脂质体,搅匀即可。实施例通过以下实施例进一步说明本发明。提供实施例仅用于说明目的,并且不应被解释为以任何方式限制本发明的范围或内容。实施例1:干细胞衍生因子柔性脂质体及应用剂型制备干细胞外泌体中含300多种生物因子,存在于培养液中,可以分离纯化或以条件培养基直接作为活性因子应用。它们具有美白、靓颜、刺激再生,创伤修复等作用。可运用于医药或化妆品等领域。干细胞衍生因子柔性脂质体及应用剂型制备的具体方法如下:1.磷脂溶液的制备将0.5g的90w/v%磷脂酰胆碱的大豆卵磷脂和0.09g斯潘80加入到0.7ml乙醇中,室温待其溶解后,加入0.1g维生素e,室温搅拌700rmp10分钟,混匀,以获得脂质溶液;2.干细胞衍生因子溶液的制备取脂肪细胞来源的干细胞条件培养液(无动物血清、无抗生素,蛋白浓度0.25μg/ml)7.5ml,向其中加入甘油1.2ml,混匀后作为水相溶液;3.干细胞衍生因子柔性脂质体的制备在室温700rmp搅拌状态下,将脂质溶液注入水相溶液中,总体积为10ml。室温搅拌10分钟,700rmp即得柔性脂质体。该柔性脂质体的直径为125nm±28nm。最终的柔性脂质体剂型中脂质浓度为5w/v%(50mg/ml),衍生因子终浓度为0.1875μg/ml。本发明的干细胞衍生因子柔性脂质体可以作为医药或化妆品配方的一部分,制备成任何适当形式的创伤修复及化妆品,例如,乳液、膏霜、油剂、水剂、凝胶及气雾剂等。实施例2:乙肝疫苗柔性脂质体乙肝疫苗(hepatitisbvaccin)是提纯的乙肝表面抗原,用于预防乙肝的特殊药物。疫苗接种后,可刺激免疫系统产生保护性抗体,这种抗体存在于人的体液中,乙肝病毒一旦出现,抗体会立即作用,将其清除,阻止感染,并且不会伤害到肝脏,从而使人体具有预防乙肝的免疫力,以达到预防乙肝感染的目的。普遍的接种方式是肌肉注射,多需三次注射后抗体的阳性率可达96%以上.而且抗体效果持续维持在较高水平。使用透皮技术可改善病人的顺应性,没有打针的痛苦,而脂质体可将药物包裹起来,增加稳定性,缓释性。提高疫苗的效应。乙肝疫苗柔性脂质体的制备方法如下:1.磷脂溶液的制备将0.5g90w/v%磷脂酰胆碱的大豆卵磷脂在室温下加入至0.7ml乙醇中,再加入0.1g的土温20,待大豆卵磷脂溶解后,以750rmp搅拌2分钟混匀。2.乙肝疫苗溶液的制备按配比将乙肝疫苗溶于缓冲液或生理盐水中制成乙肝疫苗溶液,缓冲液选自醋酸钠缓冲液、枸橼酸钠缓冲液、乳酸缓冲液、磷酸盐缓冲液、酒石酸缓冲液。再加入1.3ml的甘油,水相的终体积共8.7ml。3.乙肝疫苗柔性脂质体的制备将上述制得的磷脂溶液滴入乙肝疫苗溶液中,以750rmp搅拌15分钟水合,即得到乙肝疫苗柔性脂质体。最终的柔性脂质体剂型中脂质浓度为5w/v%(50mg/ml),乙肝疫苗的终浓度为0.1ng/ml-1g/ml。该乙肝疫苗柔性脂质体可加入乳膏剂、凝胶剂、喷雾剂应用。实施例3:多烯紫杉醇柔性脂质体及其局部使用紫杉醇是一种从自然资源获取的使用最广泛和有效的抗肿瘤药因子。它有广谱的抗肿瘤活性,特别是对卵巢癌、乳腺癌、非小细胞肺癌、头颈部肿瘤、卡波济氏肉瘤、泌尿道的恶性肿瘤。这是一个高度亲脂性的物质,logp值为3.96、水溶性小于0.01mg/ml。此外,该成分缺少可离子化的官能团,因此也不能用改变酸碱度来增加其溶解度的,紫杉醇的给药面临巨大的挑战。发明人经过实验证实多烯紫杉醇在辛癸酸甘油三酯中溶解度最高(表1),后续磷脂溶液制备中优选使用该溶剂。表1.多烯紫杉醇在不同油类的溶解度(n=3)多烯紫杉醇柔性脂质体制备方法如下:1.磷脂溶液的制备将按照表2配比称量90w/w%磷脂酰胆碱的大豆卵磷脂、表面活性剂斯潘80、多烯紫杉醇,溶于0.70ml的辛癸酸甘油三酯中(辛癸酸甘油三酯在脂相溶液的终浓度为55w/w%),磁力搅拌700rmp使其溶解。使用上述方法的制备的柔性脂质体结果为表2、3所述。另外,发明人进一步考察溶于0.065-0.70ml的辛癸酸甘油三酯中(辛癸酸甘油三酯在脂相溶液的终浓度为10-55w/w%)同样可获得相似的柔性脂质体。2.磷酸盐缓冲液的制备在ph7.4的磷酸盐缓冲液8.45ml中加入0.845ml甘油,磷酸盐缓冲液中甘油的终浓度为10w/v%。3.多烯紫杉醇柔性脂质体制备缓缓注入搅拌状态下的磷酸盐缓冲液(ph7.4,磷酸盐缓冲液中含10w/v%的甘油)。最终的柔性脂质体剂型中脂质浓度为5w/v%,多烯紫杉醇中浓度为0.6w/v%。同样的方法用于准备传统脂质体配方(磷脂酰胆碱:胆固醇=7:3,其他步骤相同)作为对照比较。最后的脂质体配方的脂质浓度也是5w/v%。表2.紫杉醇柔性脂质体的成分与特征el-sp2被选作最佳剂型来检测脂质体可承载的紫杉醇的最大剂量,配方用增加的紫杉醇剂量(1.0、2.0、4.0、6.0、8.0、10mg/ml)来制备。并进行了14天的观察药物晶体出现、浊度、包裹效率。表3.优选柔性脂质体承载紫杉醇量数值表示为:平均值±sd(n=3);na=未出现.柔性紫杉醇脂质体配方药物装载的数量结果(表3)显示:柔性脂质体配方最大药物加载量为6.0mg/ml,药物包封率为74.0±3.8,与商业化紫杉醇配方类似。相比之下传统脂质体的药物,最大装载量平均为2.0mg/ml,本发明制备的柔性脂质体的最大装载量显著提高。优化的紫杉醇弹性脂质体配方el-sp2特征:脂质含量为5w/v%;药物含量为0.6w/v%;包裹率为74.0±3.8%;颗粒大小为159±5.8nm;多分散性指数0.042pi;弹性为57.9±3.8;药物回收率为96.8±5.1%;球形囊的形状。局部给药是一种特殊剂型,它运送药物到生物系统中整个药理学效应所期待的特殊位点。局部的化学疗法已经被用来探索限制造成正常组织损伤无差别的毒性。局部的紫杉醇给药可使药物持续接触肿瘤细胞,增加药物渗透肿瘤细胞,减少肿瘤细胞的复制速度。在肿瘤发生点的局部化疗其局部高药物浓度能提高肿瘤的化疗反应,同时也降低相邻转移的系统性风险。体外皮肤渗透试验:1.皮肤制备:使用猪耳皮肤来自屠宰场宰杀1小时以内。用动物电推剪除去表面的毛发,收集全层皮肤,粘附于真皮层的脂肪用外科手术到去掉。用去离子水清洗并包装于铝箔中,保存于-20℃,一周内使用。2.体外皮肤渗透试验:用弗朗茨扩散池实施体外渗透试验,扩散池包括供体和受体两个室,由1.43cm2扩散区分开,供体室顶端开放,暴露于大气环境,离体的猪耳皮肤被安装于两室之间,角质层面向供体室夹紧到位,磁搅拌器加入受体室并用磷酸盐缓冲液ph7.4作为受体介质注满受体相,少量的叠氮化钠(0.0025w/v%)加入其中预防微生物生长。整个装置设立于电搅拌仪之上,温度控制在37℃±0.5℃。皮肤切片最初放于弗朗茨扩散池2h以促进皮肤水合。这一时期后,5ml的适当的配方应用到皮肤表面。用于体外皮肤渗透的研究。在受体舱按预先确定的时间间隔收集0.5ml的介质,2ml柔性脂质体、普通脂质体、药物溶液(均含有6mg/ml紫杉醇)用于体外皮肤渗透的研究。取而代之的是相同数量的新鲜的缓冲液。可见渗透药物的量用使用紫外分光光度计(thermospectronicuv-1,usa)来测量,吸光度在214nm。结果显示24小时柔性脂质体透皮紫杉醇药量为溶液的15倍,普通脂质体的7.7倍(表4)。表4.紫杉醇体外透皮量比较。实施例4:胰岛素脂质体透皮制剂及其制备方法糖尿病是慢性的代谢性疾病,以血糖浓度升高为特征(空腹血糖大于126mg/dl)。透皮给胰岛素较之皮下给药是更好的途径,除了安全之外,比皮下给药有几个优势:没有注射的局部疼痛,多次注射的不方便,以及偶尔发生的低血糖。透皮给药可以克服各种原因造成的病人不遵医嘱,改进服从率,得到更好的控糖效果。胰岛素柔性脂质体的制备方法如下:1.磷脂溶液的制备将0.5g90w/v%磷脂酰胆碱的大豆卵磷脂在室温下加入至0.7mlpeg400中,再加入胆酸钠0.1g,待大豆卵磷脂溶解后,以700rmp搅拌2分钟混匀。2.制备胰岛素溶液将胰岛素溶于磷酸缓冲液溶液,并加入1ml的甘油,含有甘油的胰岛素溶液体积为8.7ml。3.胰岛素柔性脂质体在750rmp搅拌下将上述制得的磷脂溶液注入胰岛素溶液中,15分钟水合,即得到胰岛素柔性脂质体。在胰岛素脂质体中,胰岛素的终浓度可以为1.5mg/ml。表5.该脂质体的基本性能以上的普通脂质体和柔性脂质体溶液加终浓度为2w/v%的二甲亚砜作为渗透促进剂。然后加入到5w/v%的甲基纤维素凝胶中,避光储存于阴凉处。体外皮肤渗透试验,实验步骤参照实施例3,结果显示柔性脂质体较普通脂质体和药溶液透皮效果明显增加(表6和图2)。表6.普通脂质体和柔性脂质体累计透皮量比较体内研究:进行体内研究以四氧嘧啶诱导的糖尿病白化大鼠(重240-362g)进行,大鼠禁食24h但饮水随意以适应环境。所有的实验在8点到12点之间进行以生理影响最小化。任何处理之前,使用切尾巴方法以及用血糖测量仪(accucheck)检测大鼠的血糖水平。以150毫克/公斤剂量的四氧嘧啶溶解在2毫摩尔柠檬酸缓冲(ph值3.0)中,并将其溶液腹腔内注射于大鼠。一周后,四氧嘧啶化的大鼠的空腹血糖达到300mg/dl或更高被认为是糖尿病,以用于后续研究。在这项研究中,所有的动物都保持正常的饮食条件。含有2.24mg胰岛素的柔性脂质体和普通脂质体甲基纤维素凝胶应用于剃毛的鼠背侧面,用胶带覆盖,24小时后,使用上述方法做血糖水平测量。实验结果,结果显示皮肤局部使用柔性脂质体胰岛素较普通脂质体胰岛素的降糖作用更强(表7)。表7.血糖水平比较实施例5:水飞蓟素柔性脂质体的口服制剂水飞蓟素,源自水飞蓟(silybummarianum)的黄酮木质素,具有多种的药理作用,包括保肝、抗氧化剂、抗炎、抗癌、保护心血管系统。尽管临床试验显示水飞蓟素在高剂量是安全的(>1500毫克/天)在人类中,过去的三十年里的药代动力学的研究其相关的吸收、分布、代谢、排泄显示水飞蓟素的吸收差、代谢迅速,口服生物利用度不好。有报道称在小鼠血清中水飞蓟素的生物利用度仅0.73%。在此,我们用脂质体载入水飞蓟素,以求改善其吸收率,提高生物利用度。制备方法如下:1.水飞蓟素脂质溶液的制备将水飞蓟素2g溶于6ml还氧二元醇,再加大豆或葵瓜子卵磷脂(pc>50%)20g,胆酸钠4g,再加丙二醇直至成为50ml亮黄色的透明溶液。2.水飞蓟素脂质体生成脂质溶液与加10w/v%的甘油的去离子水、或生理盐水、或缓中液(ph7.4)以人工震摇或750rmp磁力搅拌方式水合10分钟,磷脂可自发的形成囊泡,捕捉飞蓟素进入脂质体囊泡中。脂质溶液与水介质1:3混合可得含有10mg/ml的水飞蓟素的脂质体悬液。表8.水飞蓟素脂质体的基本性能:粒径(nm)zeta电位(mv)包封率(%)78.8±3.832.05±0.3243.03±3.20水飞蓟素柔性脂质体的肠道吸收比较:翻转鼠肠囊内药物转运模型是体外研究药物吸收的有效工具。1ml的水飞蓟素脂质溶液添加蒸馏水至20ml以形成水飞蓟素脂质体作为水飞蓟素脂质体组。水飞蓟素溶于等量的还氧二元醇和丙二醇,其与水飞蓟素脂质溶液等量,然后取1ml的溶液,添加蒸馏水至20ml,作为水飞蓟素的对照溶液。翻转肠囊运输实验一式三份在37℃水浴进行。实验当天,wistar鼠用戊巴比妥钠注射麻醉并安乐死,腹部中线切口,取出整个小肠的长度,然后截取由远端到幽门15厘米肠段。切下的肠段用冰生理盐水冲洗,除去肠内容物。该肠段用一根玻璃棒来翻转。结扎翻转肠的一端,充满浆膜液体,然后另一端也的结扎。翻转肠囊长度为10厘米。翻转肠放在25ml的水飞蓟素溶液或水飞蓟素脂质体中,这些液体用作粘膜液(囊外液),共六个囊为一组。整个实验过程扩散器是保存在一个恒温37℃的摇晃浴和充满氧气的条件下进行。在不同的时间点取出肠囊,取0.5ml的囊内液测定其水飞蓟素浓度。表9.水飞蓟素肉桂性脂质体的肠道吸收比较样本进行紫外分析,三个样本的均值是用于数据分析(表10)。吸收曲线下的面积auc通过梯形法计算。试验结果显示脂质体的水飞蓟素经肠道转运较对照有明显增加(p<0.01)。实施例6:磷脂浓度对包封率的影响使用实施例1中的制备方法制备干细胞生长因子柔性脂质体。以干细胞生长因子为例,考察磷脂浓度对包封率的影响(表11,图5)。结果表明,当磷脂浓度达到50mg/ml时,柔性脂质体的包封率达到了85%以上。表10.浆膜药浓度(n=3)表11.磷脂浓度对应的包封率通过引用并入本文引用的每个专利文献和科学文献的全部公开内容通过引用并入本文用于所有目的。等效以上为低能量,冷加工制备的柔性脂质体的部分实施例,实际应用不能一一列举,但凡应用我们的方法制作脂质体都应在该专利保护范围。本发明可以在不脱离其基本特征的情况下以其他具体形式实施。因此,前述实施例被认为是说明性的,而不是对本文所述的本发明的限制。本发明的范围由所附权利要求书而不是由前述说明书表示,并且意在将落入权利要求书的等同物的含义和范围内的所有改变包括在其中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1