一种具有声动力治疗效果的金属-卟啉纳米颗粒、制备方法及其应用与流程
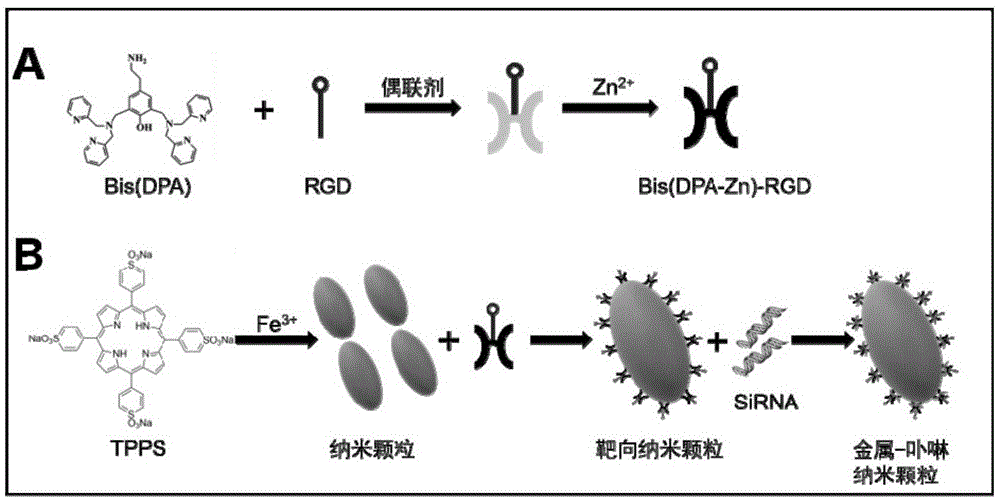
本发明涉及一种靶向多肽修饰的金属-卟啉纳米颗粒、制备方法,及其应用。
背景技术:
肝癌是临床最常见的肿瘤之一,位居恶性肿瘤发病率第六位,病死率第三位,每年有约50万的新增病例。目前针对肝癌的治疗方法主要有手术切除,射频消融,化疗,经肝动脉化疗栓塞(tace)等,但是均具有很大的局限性。手术切除和射频消融适应患者不足40%;化疗有严重的副作用以及耐药性,治疗效果差;tace有诸多禁忌症以及不良反应。光动力治疗(pdt)利用无毒的光与光敏剂产生活性氧(ros)杀伤肿瘤细胞,引起研究者的极大关注,其优点是可以有效的、选择性的破坏肿瘤组织而不损伤相邻的健康组织。与目前常用的治疗方法相比,虽然光动力治疗具有其独特的优点,但其临床应用依旧很少。这是因为目前光动力治疗技术存在很严重的限制,例如光的穿透深度浅、药物非特异性分布造成的皮肤光毒性等。声动力(sdt)治疗利用低频超声激活声敏剂,产生ros杀伤肿瘤细胞,较之pdt具有很好的穿透深度,可用于治疗深部肿瘤。但由于声敏剂靶向性差,肿瘤部位药物浓度低,以及细胞内抗氧化物质抵抗治疗效果,故治疗效果欠佳。
技术实现要素:
本发明的主要目的,在于提供一种卟啉类金属-有机纳米颗粒,可以特异性地富集在肿瘤区域,并且可以通过降低肿瘤细胞内抗氧化物质sod2的含量达到较好的声动力治疗效果。
本发明的技术方案如下:
一种具有声动力治疗效果的金属-卟啉纳米颗粒,利用卟啉的磺酸根与金属离子反应,形成纳米颗粒,然后在其表面修饰靶向多肽,最后再负载功能性sirna,形成具有肿瘤特异性靶向效果的多功能金属-卟啉纳米颗粒;其中,
所述的卟啉为磺酸根离子修饰的卟啉分子;
所述的金属离子包括铁离子(fe3+)、锰离子(mn2+)、钆离子(gd2+)、锌离子(zn2+)、铜离子(cu2+)中的至少一种;
所述的靶向多肽是crgdfc(cyclo(arg-gly-asp-d-phe-cys)),crgdyk(cyclo(arg-gly-asp-d-tyr-lys)),crgdyc(cyclo(arg-gly-asp-d-tyr-cys)),crgdfk(cyclo(arg-gly-asp-d-phe-lys)),中的至少一种;
所述的sirna是能够降低细胞内sod2表达的sirna。
作为优选,所述的卟啉类分子为meso-四(4-磺酸钠苯基)卟啉(tpps)。
本发明的另一目的,在于提供上述的一种具有声动力治疗效果的金属-卟啉纳米颗粒在肿瘤治疗制剂中的应用。
作为优选,所述的肿瘤治疗制剂为声动力和基因联合治疗癌症制剂。
本发明的再一目的,在于提供一种具有声动力治疗效果的金属-卟啉纳米颗粒的制备方法,包括如下步骤:
1)制备卟啉和金属离子组装的纳米结构;所述的卟啉为磺酸根离子修饰的卟啉分子;
所述的金属离子包括铁离子(fe3+)、锰离子(mn2+)、钆离子(gd2+)、锌离子(zn2+)、铜离子(cu2+)中的至少一种;
2)制备具有靶向性多肽偶联的zn(ii)-二甲基吡啶胺二聚体(bis(dpa-zn);所述的靶向性多肽是指crgdfc,crgdyk,crgdyc,crgdfk中的一种;
3)将2)中制备有机分子加入到a)中制备纳米结构中进行表面修饰。
作为优选,所述的具有声动力治疗效果的金属-卟啉纳米颗粒的制备方法,包括如下步骤:
a)将三氯化铁与卟啉溶解于去离子水中,100-2000rpm室温搅拌12-36h;
b)将以上溶液移入30kd超滤管,3000-5000rpm室温离心10-20min;
c)去上清液,取沉淀,用去1-5ml离子水吹打混匀,放入超滤管中离心,3000-5000rpm15-25min,此步骤重复1-4次;
d)将以上沉淀用1-5ml去离子水重悬,制成初步的纳米颗粒;
e)首先制备dpa的二聚体—bis(dpa);接着利用制备的bis(dpa)和rgd进行偶联;
第一,将2-4mgbis(dpa)和2-4mgsulfo-smcc加入到1-3mldmso中,震荡至均匀分散,并且反应2h-10h。
第二,1-2mgcrgdyk多肽分散到1-3mlpbs中,接着加入0.5-0.7mgtraut试剂;在3-5℃反应0.5-5h制备得到rgd-sh;
第三,bis(dpa)-smcc分散到dmso中,rgd-sh分散到pbs,按照摩尔比1-2:1-2在3-5℃反应12-36h,制备的bis(dpa)-rgd利用hplc进行纯化;
最后,制备混合溶液,其中含1-3mm分散在dmso中的bis(dpa)-rgd和3-5mmzn2+溶液,搅拌1-3h,制备成bis(dpa-zn)-rgd;
f)取0.5-2ml步骤d)制成的初步纳米颗粒,加入10-100ul的bis(dpa-zn)-rgd,室温搅拌(1000rpm)过夜,重复步骤(c),将沉淀用0.5-2ml去离子水重悬,制成靶向纳米颗粒;
g)将靶向纳米颗粒与sirna按照50-100ug:10pm的比例混合,静置30-60min,得到最终的卟啉-金属纳米颗粒。
优选地,上述方法中,步骤1)为:
a)将三氯化铁与卟啉溶解于去离子水中,室温搅拌(1000rpm)24h;
b)将以上溶液移入30kd超滤管,室温离心(4000rpm)15min;
c)取沉淀用去3ml离子水吹打混匀,放入超滤管中离心(4000rpm)15-25min,此步骤重复3次;
d)将以上沉淀用3ml去离子水重悬,制成纳米结构。
优选地,上述方法中,步骤2)为:首先制备dpa的二聚体—bis(dpa),接着利用制备的bis(dpa)和rgd进行偶联;
第一,将3.38mgbis(dpa)和2.18mgsulfo-smcc加入到2mldmso中,震荡至均匀分散,并且反应2h以上;
第二,1.73mgcrgdyk多肽分散到2mlpbs(ph7.4)中,接着加入0.6mgtraut试剂。在4℃反应2h制备得到rgd-sh;
第三,bis(dpa)-smcc分散到dmso中,rgd-sh分散到pbs(ph7.4)按照摩尔比1:1在4℃反应24h,制备的bis(dpa)-rgd利用hplc进行纯化;
最后,简单的混合2mlbis(dpa)-rgd溶液(2mm,分散在dmso中)和2mlzn2+溶液(4mm),搅拌2h,制备成bis(dpa-zn)-rgd。
取1ml初步制成的纳米颗粒,加入10-100ul的bis(dpa-zn)-rgd,室温搅拌(1000rpm)过夜,重复步骤(c),将沉淀用1ml去离子水重悬,制成靶向纳米颗粒。
本发明,纳米颗粒通过实体瘤的高通透性的滞留(epr)效应,对肿瘤具有良好的被动靶向效果,可以增加药物在肿瘤部位的蓄积,减少非特异性分布。除了被动靶向外,利用配体、受体可以实现纳米颗粒的主动靶向功能,进一步提高肿瘤特异性分布。其中,精氨酸-甘氨酸-天冬氨酸(rgd)可以与肿瘤新生血管高表达的αvβ3整合素特异性结合。而所有实体瘤细胞(乳腺癌、前列腺癌、肝癌等)成瘤过程必然伴随着肿瘤新血管生成整合素αvβ3作为肿瘤发生发展过程中的共有物质,具有一定的特异性。
细胞内抗氧化物质主要有超氧化物歧化酶(sod1,sod2)、谷胱甘肽(gsh)以及维生素e等,细胞可以通过抗氧化物质抵抗ros的杀伤效果,故可以通过减少细胞内抗氧化物质的含量增强ros的杀伤效果。铁、铜、锰等金属离子可以将谷胱甘肽氧化,降低细胞抗氧化能力。通过递送特定序列的sirna进入细胞,可以下调超氧化物歧化酶的含量,实现两种抗肿瘤治疗的协同疗效。
从上述技术方案可以看出,本公开提供的金属-卟啉纳米颗粒,具有以下有益效果:
通过化学方法将卟啉制作成纳米颗粒,并在表面修饰靶向多肽,可以提高药物在肿瘤处的靶向富集,增强其声动力效果。通过递送的sirna降低肿瘤细胞内抗氧化酶sod2的含量,可以进一步增强声动力对肿瘤的杀伤效果,从而实现对深部位肝癌的较彻底治疗。
附图说明
图1为根据本公开实施例制备的的制备流程图。
图2a为根据本公开实施例制备的纳米颗粒的tem图。
图2b为根据本公开实施例制备的纳米颗粒的粒度分析图。
图2c为根据本公开实施例制备的纳米颗粒与普通的卟啉的吸收曲线图。
图2d为根据本公开实施例制备的纳米颗粒与普通的卟啉的荧光光谱图。
图3a、3b为根据本公开实施例制备的纳米颗粒的声动力产ros性能图。
图3c为根据本公开实施例制备的纳米颗粒的凝胶电泳图。
图3d为根据本公开实施例制备的纳米颗粒合成过程表面电势变化图。
图4a为根据本公开实施例制备的纳米颗粒下调细胞内超氧化物歧化酶2的westernblot图。
图4b为根据本公开实施例制备的纳米颗粒下调超氧化物歧化酶2相对定量图。
具体实施方式
为了本公开的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本公开进一步详细说明。
本发明提供一种卟啉类金属-有机纳米颗粒的制备方法,包括如下步骤:
a)将三氯化铁与卟啉溶解于去离子水中,室温搅拌(1000rpm)24h;
b)将以上溶液移入30kd超滤管,室温离心(4000rpm)15min;
c)取沉淀用去3ml离子水吹打混匀,放入超滤管中离心(4000rpm)15-25min,此步骤重复3次;
d)将以上沉淀用3ml去离子水重悬,初步制成的纳米颗粒;
e)首先结合申请人之前的工作制备dpa的二聚体—bis(dpa)(g.liu,k.y.choi,a.bhirde,m.swierczewska,x.chen,angew.chem.int.ed.2012,51,445-449)。接着利用制备的二甲基吡啶胺二聚体(bis(dpa))和rgd进行偶联。第一,将3.38mgbis(dpa)和2.18mg4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc)加入到2ml二甲基亚砜(dmso)中,震荡至均匀分散,并且反应2h以上。第二,1.73mgcrgdyk多肽分散到2mlpbs(ph7.4)中,接着加入0.6mgtraut试剂。在4℃反应2h制备得到rgd-sh。第三,bis(dpa)-smcc分散到dmso中,rgd-sh分散到pbs(ph7.4)按照摩尔比1:1在4℃反应24h,制备的bis(dpa)-rgd利用hplc进行纯化。最后,简单的混合2mlbis(dpa)-rgd溶液(2mm,分散在dmso中)和zn2+溶液(4mm),搅拌2h,制备成bis(dpa-zn)-rgd。
f)取1ml初步制成的纳米颗粒,加入10-100ul的bis(dpa-zn)-rgd,室温搅拌(1000rpm)过夜,重复步骤(c),将沉淀用1ml去离子水重悬,制成靶向纳米颗粒。
g)将靶向纳米颗粒与sirna按照50-100ug:10pm的比例混合,静置30-60min,得到最终的卟啉-金属纳米颗粒。
本公开提供的金属-卟啉纳米颗粒,通过金属离子与卟啉(tpps)的结合,修饰靶向多肽,共递送sirna,制备成金属-卟啉纳米颗粒(nanotpps),其粒度约100nm,具有较好的肿瘤靶向性能及声动力产ros性能,同时联合基因治疗,具有很好的杀伤肿瘤细胞的效果。
图1为根据本公开实施例纳米颗粒的制备方法流程图,如图1所示,本公开卟啉-金属纳米颗粒的制备方法,包括:
步骤1:在卟啉与金属离子加入超纯水中,室温搅拌,超滤得纳米颗粒前体;
本实施例中的卟啉为meso-四(4-磺酸钠苯基)卟啉,其质量为1mg,超纯水的体积为
5ml;本实施例中的金属离子是指铁离子(fe3+),其质量为20mg,在其它实施例中,
对于其他的场景,也可以是其他的离子,如锰离子(mn2+)、钆离子(gd2+)锌离子(zn2+)、铜离子(cu2+)等;
本实施例中的搅拌速度为1000rpm,搅拌时间为12h;
本实施例中,超滤过程中使用的超滤管分子量为30kd,离心转速为4000rpm,离心时间为15min;
步骤2:取bis(dpa)和sulfo-smcc加入dmso中,震荡混匀,静置反应得到bis(dpa)-smcc。
本实施例中bis(dpa)的质量为3.38mg,sulfo-smcc的质量为2.18mg,dmso的体积为2ml,反应时间为2-4h。
步骤3:在crgdyk多肽的pbs溶液中加入traut试剂,反应得到rgd-sh。
本实施例中,crgdyk多肽的质量为1.73mg,pbs溶液的ph为7.4,体积为2ml;
本本实施例中,traut试剂的质量为0.6mg;
本实施例中的反应温度为4℃,反应时间为2h;
步骤4:将bis(dpa)-smcc的dmso溶液与rgd-sh的pbs溶液混合,反应纯化得到bis(dpa-zn)-rgd;
本实施例中,bis(dpa)-smcc和rgd-sh的摩尔比为1:1;
本实施例中的反应温度为4℃,反应时间为24h;
本实施例中利用hplc对其纯化;
步骤5:bis(dpa-zn)-rgd溶液中加入锌离子(zn2+),制备出bis(dpa-zn)-rgd。
本实施例中,bis(dpa-zn)-rgd溶解在dmso中,其浓度为2mm;
本实施例中,zn2+浓度为4mm,反应条件为搅拌(1000转/分钟),时间为2h;
步骤6:在纳米颗前体溶液中,加入bis(dpa-zn)-rgd,反应过夜,超滤纯化得到靶向纳米颗粒。
本实施例中,将1mg纳米颗粒前体加入5ml的超纯水中;
本实施例中,bis(dpa-zn)-rgd的浓度为1mm,体积为100ul,
本实施例中,反应条件为室温搅拌(1000rpm);
本实施例中,超滤管分子量为30kd,离心转速为4000rpm,离心时间为30min;
步骤7:在靶向纳米颗粒溶液中,加入sirna,反应得到最终的卟啉-金属纳米颗粒,将其避光4℃保存。
本实施例中,选用sirna的序列为5′-caacaggccuuauuccacu-3′。
本实施例中,靶向纳米颗粒与sirna的比例为50-100ug:10pm。
本实施例中,反应条件为4℃静置60min。
图2a为根据本实施例制备的纳米颗粒的tem图;图2b为根据本实施例制备的纳米颗粒的粒径分布图
结合图2a和图2b可知,该纳米颗粒呈梭形,粒径均一,结构稳定;该纳米颗粒在水中的平均直径为100nm,该粒径为其体内应用提供了保障。
基于以上实施例中制备的纳米颗粒,进行了基本的性能测试。
图2c和图2d为纳米颗粒与tpps的紫外吸收曲线图与荧光光谱图。根据图2c、2d可知,纳米化之后,药物吸收曲线红移,在红外光区有明显吸收并可以激发出红外区域的荧光,这对药物在体内的示踪,具有重要的意义。
图3a和图3b为根据本公开实施例制备的卟啉-金属纳米颗粒的声动力产ros性能检测图,利用ros检测试剂dma对其产ros性能进行检测,可以看出所制备的纳米颗粒具有较好的声动力产ros性能,且在一定范围内具有浓度依赖性。
图3c为根据本公开实施例制备的卟啉-金属纳米颗粒的sirna凝胶阻滞电泳检测图,结果显示,当纳米颗粒与sirna的比例为50μg:10pm和100μg:10pm时,纳米颗粒与sirna可以完全结合。
图3d为根据本公开实施例制备的卟啉-金属纳米颗粒合成过程中表面电势变化图,单纯的纳米颗粒表面电势为-65±4.08mv,纳米颗粒表面修饰靶向多肽后表面电势为-20±1.63mv,靶向纳米颗粒装载sirna后表面电势为-34±1.69mv。
图4a和图4b分别为根据本公开实施例制备的卟啉-金属纳米颗粒对细胞内sod2作用的westernblot结果图及其相对定量图,图中可以看出纳米颗粒装载具有下调sod2表达的sirna后,与细胞孵育24小时,可以明显下调细胞内抗氧化酶sod2的含量,并且相对于单纯的sirna,纳米化之后下调作用更明显,是由于靶向纳米颗粒可以递送更多的sirna进入细胞,产生作用。
- 还没有人留言评论。精彩留言会获得点赞!