一种天麻素或乙酰天麻素在改善tau蛋白的病理损伤中应用的制作方法
本发明属于改善蛋白的病理损伤技术领域,具体涉及一种改善tau蛋白的病理损伤的分子领域。
背景技术:
微管系统是细胞骨架成分,可参与多种细胞功能。微管由微管蛋白及微管相关蛋白组成,tau蛋白是含量最高的微管相关蛋白。正常tau蛋白的细胞功能是与微管蛋白结合促进其聚合形成微管;与形成的微管结合,维持微管稳定性,降低微管蛋白分子的解离,并诱导微管成束。tau蛋白基因位于17染色体长臂。正常人中由于tau蛋白mrna剪辑方式不同,可表达出6种同功异构体。tau蛋白为含磷酸基蛋白,正常tau蛋白分子含2~3个磷酸基。tau蛋白异常折叠和过度磷酸化,可以导致蛋白质丧失正常生物功能,从而导致与之相关的病理改变,甚至是疾病的发生。
天麻素英文为gastrodin,为一种植物提取物,具有多种药理作用,对血压、血小板聚集、自由基以及免疫功能等均有影响。乙酰天麻素英文为acetylgastrodin,简称ag,为天麻素一种重要衍生物。
技术实现要素:
本发明的目的在于提供一种改善tau蛋白的病理损伤的物质。
本发明的目的是这样实现的,包括天麻素或乙酰天麻素,用于改善tau蛋白的病理损伤,特别是改善人类tau蛋白的病理损伤,其通过抑制tau蛋白聚集特别是抑制humantau311蛋白聚集,以及抑制humantau441蛋白聚集的途径实现;或者通过抑制tau蛋白磷酸化的水平,抑制位点是tau蛋白396位点和tau蛋白231位点和tau蛋白199位点。
本发明(优点)天麻素是天麻中众多成分的一种,毒性低,可以长时间服用,天麻素易于大规模生产,其可以减轻tau蛋白的病理损伤,通过抑制tau蛋白聚集和磷酸化实现。
附图说明
图1为天麻素对humantauac-306vqivyk311的干扰实验,即天麻素对humantau311的干扰实验。
图2为天麻素对humantau441(abcam公司)的干扰实验。
图3天麻素减轻转基因小鼠大脑中的tau蛋白磷酸化水平。
图4wb实验证实,天麻素治疗后的转基因小鼠大脑中的tau磷酸化在病理位点396,231,199明显减轻。
图5为乙酰天麻素对humantauac-306vqivyk311的干扰实验,即乙酰天麻素对humantau311的干扰实验。
图6为乙酰天麻素对humantau441(abcam公司)的干扰实验。
图7为乙酰天麻素减轻转基因小鼠大脑中的tau蛋白磷酸化水平。
图8为wb实验证实,乙酰天麻素治疗后的转基因小鼠大脑中的tau磷酸化在病理位点396,231,199明显减轻。
具体实施方式
下面结合附图对本发明作进一步的说明,但不以任何方式对本发明加以限制,基于本发明教导所作的任何变换或替换,均属于本发明的保护范围。
实施例1
天麻素对tau蛋白聚集的抑制
本部分的方法和对结果的判断使用了文献1和2和3的方法。
在体外研究中,我们采用负染透射电镜实验观察天麻素,其中天麻素来源于昆明制药集团股份有限公司,天麻素对tau聚集后的螺旋丝状物的干扰。tau331蛋白来源于成都凯捷生物医药科技发展有限公司。
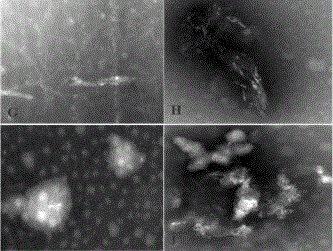
图1为天麻素对humantauac-306vqivyk311的干扰实验,即天麻素对humantau311的干扰实验,图片g-h说明:tau331(100μm)孵育4天后的电镜图片,tau为螺旋丝状;i-j:天麻素(20μm)与humantau331蛋白相互作用4天后的电镜图片,tau331蛋白的螺旋丝结构被破坏,比例尺为200纳米(scalebar=200nm)。
图2天麻素对humantau441的干扰实验材料,来源于abcam公司,图片说明k-l:humantau441(4μm)孵育4天后的电镜图片,tau为螺旋丝状;i-j:天麻素(2.5μm)与tau蛋白共同孵育4天后的电镜图片,比例尺为200纳米(scalebar=200nm),tau纤维化被天麻素干扰变形。
实施例1结论:天麻素与tau蛋白共同孵育后能够破坏tau蛋白的结构,对tau蛋白的聚集有抑制效果。
实施例2
天麻素减轻转基因小鼠大脑中的tau蛋白磷酸化水平。
我们将人类tau蛋白转基因进入到小鼠中,其实验方案我们按照文献[4]的方法进行。图3中a:control(tg)为转基因小鼠大脑的免疫组织化学的切片,图3中b:gastrodin(tg)为给予了天麻素的转基因小鼠大脑的免疫组织化学的切片,图3中c:wt为野生型小鼠大脑的免疫组织化学的切片,免疫组化试验结果表明:与未治疗组相比,天麻素明显减轻了转基因小鼠的tau磷酸化水平约56%(p<0.05),与wt正常组相比无显著性差异(p>0.05)。图4中a:control(tg)为转基因小鼠大脑的tau蛋白磷酸化,图4中b:gastrodin(tg)为给予了天麻素的转基因小鼠大脑tau蛋白磷酸化。wb实验进一步证实,天麻素治疗后的转基因小鼠大脑中的tau磷酸化在病理位点396,231,199明显减轻。
转基因小鼠为p301ltau小鼠,其构建和鉴定方法如下:
p301ltau转基因小鼠的构建方法为参考文献5和6中的方法,简要概述如下:以c57bl⁄6xdba2f1为背景,与c57bl⁄6背景的小鼠回交。在控制神经元特异性mthy1.2启动子的条件下,通过pcr介导的途径,人病理的p301l突变被插入到cdna编码最长的人脑tau亚型,小鼠可以表达最长的人tau亚型ftdp-17p301l突变,转基因tau的亚型包括外显子2和3以及4个微管结合重叠(htau402+3+4r).p301l转基因小鼠的鉴定:转基因小鼠的鉴定用寡核苷酸:tau-i(o-100,59-ggagttcgaagtgatggaag-39)tau-k(o-101,59-ggtttttgctggaatcctgg-39),经pcr扩增得到碱基对为500的扩增产物,通过smai证实p301l基因的存在,至少生成10个独立的转基因株系,通过免疫印迹分析七中4个有类似的表达水平。
通过实施例1和2说明天麻素可以减轻小鼠大脑中的tau蛋白磷酸化水平,改善tau蛋白病理。
实施例3
乙酰天麻素(ag)对tau蛋白聚集的抑制。
本部分的方法和对结果的判断使用了文献1和2和3的方法。
在体外研究中,我们采用负染透射电镜实验观察乙酰天麻素(昆明制药集团股份有限公司提供)对tau(成都凯捷生物医药科技发展有限公司提供)聚集后的螺旋丝状物的干扰。
图5为乙酰天麻素对humantauac-306vqivyk311的干扰实验,即乙酰天麻素对humantau311的干扰实验。a-b:humantau331(100μm)孵育4天后的电镜图片,tau为螺旋丝状;c-d:乙酰天麻素(20μm)与tau331蛋白相互作用4天后的电镜图片,tau331蛋白的螺旋丝结构被破坏变形,比例尺为200纳米(scalebar=200nm)。
图6乙酰天麻素对humantau441(abcam公司)的干扰实验。e-f:humantau441(4μm)孵育4天后的电镜图片,tau为螺旋丝状;g-h:乙酰天麻素(2μm)与tau蛋白共同孵育4天后的电镜图片,tau螺旋丝状结构被乙酰天麻素干扰变形,比例尺为200纳米(scalebar=200nm)。
实施例3结论:乙酰天麻素与tau蛋白共同孵育后能够破坏tau蛋白的结构,对tau蛋白的聚集有抑制效果。
实施例4
乙酰天麻素减轻转基因小鼠大脑中的tau蛋白磷酸化水平。
我们将人类tau蛋白转基因进入到小鼠中,其实验方案我们按照文献[4]的方法进行。图7中a:control(tg)为转基因小鼠大脑的免疫组织化学的切片,图7中b:ag(tg)为给予了乙酰天麻素的转基因小鼠大脑的免疫组织化学的切片,图7中c:wt为野生型小鼠大脑的免疫组织化学的切片,免疫组化试验结果表明:与未治疗组相比,乙酰天麻素明显减轻了转基因小鼠的tau磷酸化水平约54%(p<0.05),与wt正常组相比无显著性差异(p>0.05)图8中a:control(tg)为转基因小鼠大脑的tau蛋白磷酸化,图8中b:ag(tg)为给予了乙酰天麻素的转基因小鼠大脑tau蛋白磷酸化,wb实验进一步证实,乙酰天麻素治疗后的转基因小鼠大脑中的tau磷酸化在病理位点396,2631199明显减轻。
通过实施例3和4乙酰天麻素可以减轻小鼠大脑中的tau蛋白磷酸化水平,改善tau蛋白病理。
总结实施例1-4得到结论:天麻素及其衍生物乙酰天麻素可以通过与tau蛋白的相互作用,抑制tau蛋白聚集,降低tau蛋白磷酸化水平,改善tau蛋白病理损伤。
实验方法参考以下文献:
1.li,c.,gotz,j.,2017.tau-basedtherapiesinneurodegeneration:opportunitiesandchallenges.natrevdrugdiscov16,863-883.
2.santa-maria,i.,diaz-ruiz,c.,ksiezak-reding,h.,chen,a.,ho,l.,wang,j.,pasinetti,g.m.,2012.gspeinterfereswithtauaggregationinvivo:implicationfortreatingtauopathy.neurobiolaging33,2072-2081.
3.daccache,a.,lion,c.,sibille,n.,gerard,m.,slomianny,c.,lippens,g.,cotelle,p.,2011.oleuropeinandderivativesfromolivesastauaggregationinhibitors.neurochemint58,700-707.
4.jiao,s.s.,yao,x.q.,liu,y.h.,wang,q.h.,zeng,f.,lu,j.j.,liu,j.,zhu,c.,shen,l.l.,liu,c.h.,wang,y.r.,zeng,g.h.,parikh,a.,chen,j.,liang,c.r.,xiang,y.,bu,x.l.,deng,j.,li,j.,xu,j.,zeng,y.q.,xu,x.,xu,h.w.,zhong,j.h.,zhou,h.d.,zhou,x.f.,wang,y.j.,2015.edaravonealleviatesalzheimer'sdisease-typepathologiesandcognitivedeficits.procnatlacadsciusa112,5225-5230.
5.gotz,j.,chen,f.,barmettler,r.&nitsch,r.m.(2001a)taufilamentformationintransgenicmiceexpressingp301ltau.j.biol.chem.,276,529–534
6ittner,l.m.&gotz,j.(2007)pronuclearinjectionforthegenerationoftransgenicmice.nat.protoc.,2,1206–1215。
- 还没有人留言评论。精彩留言会获得点赞!