岩藻黄素在预防或治疗脓毒症以及制备脓毒症药物的应用的制作方法
本发明涉及岩藻黄素在预防或治疗脓毒症以及制备脓毒症药物的应用,药物化学的技术领域。
背景技术:
作为影响公众健康的重大问题,脓毒症(sepsis)的研究已成为现代急危重症医学十分活跃的前沿领域之一,全球每年约有1800万例脓毒症患者,死亡率在28-50%,而且患病率已由1.5%增加至6%,增加态势明显,其中有一半以上的患者入住重症监护室(icu),每3名院内死亡患者中,就有1名是脓毒症患者,治疗费用比icu其他患者费用的多5倍。2016年2月美国重症医学会(sccm)与欧洲重症医学会(esicm)联合发布最新脓毒症定义及诊断标准(脓毒症3.0版本),认为脓毒症是机体对感染的反应失调而导致危及生命的器官功能障碍。该定义更关注机体应对感染时所发生的复杂病理生理反应,强调“危及生命的器官功能障碍”。最新脓毒症定义及诊断标准的制定为更精准地诊断和治疗脓毒症奠定了基础,为今后流行病学研究和临床试验提供了更好的参考标准。脓毒症治疗药物研究的焦点和难点在于药物能否有效地提高患者存活率。脓毒症的发病机制极为复杂,至今还远远未能阐明,特别是随着重组人活化蛋白c(rhapc)的退市,目前尚无明确有效的药物应用于该疾病的临床治疗。
目前已建立的脓毒症动物模型主要有3类:毒血症模型、细菌感染模型和宿主屏障破坏模型。毒血症模型是脓毒症模型中最早也是最常用的动物模型,注射毒素如脂多糖(lipopolysaccharides,lps)构建炎症模型,诱发tnf-α、il-1β、il-6等炎症因子的产生,引发与人类相似的系统性炎症反应。
岩藻黄素(fucoxanthin,fx)又称为墨角黄素,是一类脂溶性橙色色素,是类胡萝卜中最丰富的化合物之一,在自然界中占类胡萝卜素总产量的10%以上,尤其是在海洋环境中广泛存在。当前国内市场上纯度为10%的工业岩藻黄素价格为每公斤3000元左右,岩藻黄素标准品市场价格为每克约为人民币15万元。岩藻黄素最早是从网地藻属、海带等海洋棕色海藻中分离出来。岩藻黄素除了存在于褐藻等大型海藻中,在微藻如硅藻、金藻和定鞭藻中也广泛存在,因藻中岩藻黄素含量较高,表现出特征性的棕黄色,岩藻黄素在光系统的捕光复合体中起着重要的作用。
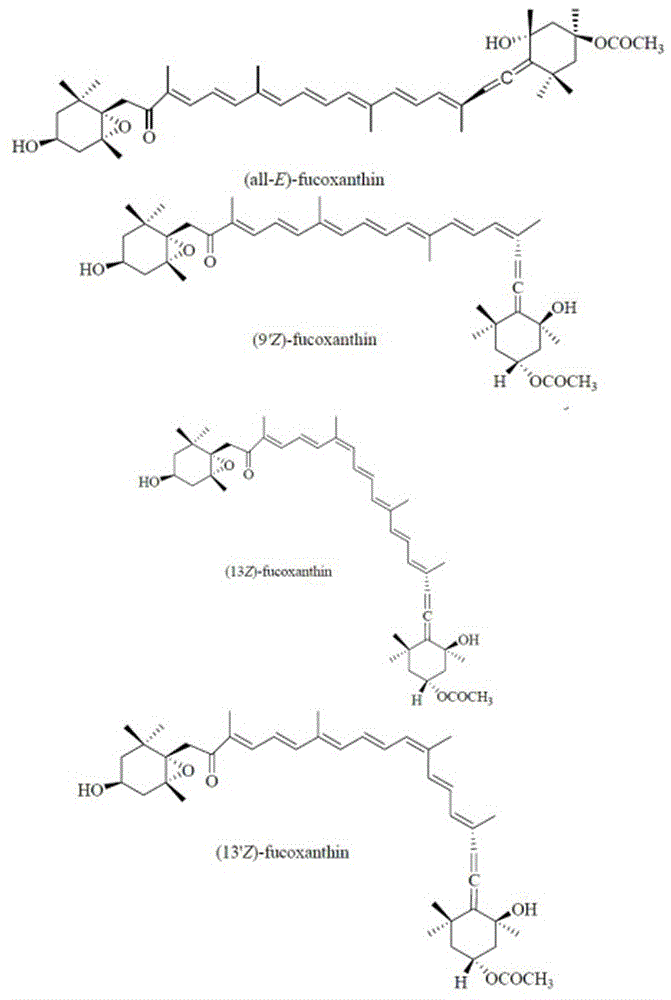
岩藻黄素有四种光学异构体,分子结构独特,如图1所示,含有1个多烯烃骨架,属于丙二烯型类胡萝卜素,含不寻常的丙二烯键和5,6-单环氧基,加上9-共轭双键,羰基和羟基等功能性基团。这些特点赋予了岩藻黄素独特的生理活性和不稳定性。岩藻黄素极不稳定,遇光、热、酸碱等易被氧化和异构化,从而发生降解。
岩藻黄素具有具有抗氧化、抗肿瘤、抗癌、抗血管生成、抗疟疾、抗痘、减肥和视力防护等多种生理功能,广泛应用到水产禽畜养殖、化妆品、健康食品和制药等行业。据报道,岩藻黄素在预防乳腺癌、前列腺癌、结肠癌、肺癌和皮肤癌等疾病有一定的作用。饮食中摄入的岩藻黄素大多数会转化成岩藻黄醇,后者可能对癌细胞的抑制效果比在体内的岩藻黄素更有效。研究发现:岩藻黄素和岩藻黄醇可以诱导不同种类的癌细胞,使它们的生长受到抑制,甚至凋亡,岩藻黄素和岩藻黄醇的抗癌作用是通过抑制细胞增殖、诱导细胞凋亡、细胞周期阻滞和抗血管生成的机制介导的,但对脓毒症小鼠的保护作用及机制研究尚未见报道。基于此,本发明人在紧密追踪脓毒症发生机制研究新进展的基础上,发明了岩藻黄素抑制脓毒症的发生发展,从而用于制备预防或治疗脓毒症的药物。
技术实现要素:
为了解决现有技术所存在的上述问题,本发明提供岩藻黄素在预防或治疗脓毒症以及制备脓毒症药物的应用,具体涉及岩藻黄素通过抑制由lps诱导的nf-κb信号通路的磷酸化水平,减少核转录因子nf-κb的核转位,抑制炎症因子表达,进而提高存活率,从而达到预防或治疗脓毒症。
本发明的技术方案如下:
岩藻黄素在预防或治疗脓毒症中的应用。
优选的,岩藻黄素通过减少核转录因子nf-κb的核转位,抑制炎症因子表达进而达到预防或治疗脓毒症。
本发明还包括一种岩藻黄素在制备预防或治疗脓毒症的药物中的应用,岩藻黄素根据剂量需要,加入药学上可接受的载体或辅料,以注射液、片剂、冻干粉针、胶囊剂、薄膜包衣片形式存在。所述辅料可为淀粉、预胶化淀粉、糊精、蔗糖、乳糖、甘露醇、微晶纤维素、预胶化淀粉、糊精、蔗糖、乳糖、甘露醇、微晶纤维素等。
优选的,所述岩藻黄素注射使用剂量范围是0.1mg/kg-10mg/kg。
所述岩藻黄素的结构式为:
与现有技术相比,本发明的有益效果如下:
1、本发明的岩藻黄素通过抑制由lps诱导的nf-κb信号通路的磷酸化水平,减少核转录因子nf-κb的核转位,抑制炎症因子表达,进而提高存活率,从而达到预防或治疗脓毒症。
2、本发明通过小鼠体内实验研究表明岩藻黄素使lps诱导的脓毒症小鼠的120h的存活率由零提高至40%(p<0.05),并不同程度地抑制血清中炎症因子的表达,体外细胞实验研究发现岩藻黄素显著抑制由lps诱导的nf-κb信号通路的磷酸化水平,减少核转录因子nf-κb的核转位,抑制炎症因子表达,从而达预防或治疗脓毒症的效果。
附图说明
图1是本发明岩藻黄素及其同分异构体的结构示意图;
图2是本发明不同剂量的岩藻黄素对lps诱导的脓毒症小鼠模型生存率的影响的示意图;
图3是本发明不同剂量的岩藻黄素对lps诱导的脓毒症小鼠模型血清中的il-1β含量变化的影响的示意图;
图4是本发明不同剂量的岩藻黄素对lps诱导的脓毒症小鼠模型血清中的il-6含量变化的影响的示意图;
图5是本发明不同剂量的岩藻黄素对lps诱导的脓毒症小鼠模型血清中的tnf-α含量变化的影响的示意图;
图6是本发明岩藻黄素对lps刺激后细胞炎症因子il-1β表达水平的影响的示意图;
图7是本发明岩藻黄素对lps刺激后细胞炎症因子il-6表达水平的影响的示意图;
图8是本发明岩藻黄素对lps刺激raw264.7细胞iκbα和nf-κb表达的影响示意图;
图9是本发明岩藻黄素对pnf-κb和nf-κb比值的影响示意图;
图10是本发明岩藻黄素对piκbα和iκbα比值的影响示意图;
图11是本发明岩藻黄素对lps刺激thp1-luciatmnf-κb细胞对nf-κb转录抑制的影响示意图。
具体实施方式
下面结合具体实施例来对本发明进行详细的说明。
实施例一
在lps诱导脓毒症小鼠模型中验证岩藻黄素对小鼠生存率影响
试验方法如下:
随机将90只c57bl/6小鼠随机分为9组,分别为空白对照组、lps模型组、岩藻黄素(0.1mg/kg)组、岩藻黄素(1.0mg/kg)组、岩藻黄素(10mg/kg)组、岩藻黄素(0.1mg/kg)+lps组、岩藻黄素(1.0mg/kg)+lps组、岩藻黄素(10.0mg/kg)+lps组和阳性对照组乌司他丁ulinastatin(104u/kg),每组10只;其中lps模型组腹腔注射lps(40.0mg/kg),岩藻黄素+lps组分为岩藻黄素(0.1mg/kg)+lps组、岩藻黄素(1.0mg/kg)+lps组和岩藻黄素(10.0mg/kg)+lps组,分别于注射lps前30min腹腔注射岩藻黄素0.1mg/kg、1.0mg/kg和10.0mg/kg,空白组腹腔注射等量的生理盐水。所有的小鼠均术前禁食12h,自由饮水。120h内每12h观察记录小鼠的生存情况,采用kaplan-meier生存分析法对各组小鼠的存活率进行统计学分析(log-rank检验)。
试验结果如下:
岩藻黄素对lps诱导的脓毒症小鼠模型生存率影响
如图2所示,与空白对照组相同,岩藻黄素药物单独注射的0.1mg/kg、1.0mg/kg和10.0mg/kg3个不同剂量组的小鼠生存率均为100%,说明岩藻黄素药物本身对小鼠生存率并没明显的毒性;与此同时,岩藻黄素药物组的小鼠生存率要高于lps模型组,其中以1mg/kg的剂量组最为显著(p<0.01),小鼠生存率由0%提高到了40%,而10mg/kg的剂量组生存率仅为20%,实验结果说明岩藻黄素可以显著提高lps诱导的炎症小鼠生存率,但岩藻黄素药物剂量与lps诱导的炎症小鼠生存率并不成正比,选择1.0mg/kg剂量的岩藻黄素用于后续的实验研究。
同时,在实验中的小鼠状态观察中发现,空白对照组中的小鼠状态良好,活泼好动,皮毛光泽细密,呼吸均匀,大便成形;lps模型组小鼠在腹腔注射lps半小时后,出现呼吸急促,蜷缩少动,毛发湿润,拒食,便稀,眼睛分泌物增多等现象,随着时间的推移,病情加重,12h后开始出现死亡;岩藻黄素治疗组小鼠的状态较lps模型组有明显好转。
实施例二
elisa法分析岩藻黄素对lps诱导的脓毒症小鼠模型血清中炎症因子释放的抑制作用
实验方法如下:
造模给药后12h眼眶采血,分离血清,依照elisa试剂盒说明书的操作步骤,检测外周血的血清中炎症因子il-1β、il-6、tnf-α的表达水平。具体操作如下所述:
1.实验前将所需要用的试剂盒室温放置半个小时以上使其平衡至室温;实验分为空白对照、阴性对照、阳性对照、实验组等共4组,每组实验重复三次,并做好详细记录。
2.从已平衡至室温的试剂盒中取出elisa板条,(不使用的应该立即放回至4℃冰箱),
3.将标准品按逐级稀释法进行稀释,稀释液采用试剂盒配有的标准稀释液,在每个板条中各加入50μl样本稀释液和50μl待检测样本,然后再加入50μl生物素抗体工作液(1:100稀释,稀释溶剂为样本稀释液,使用前30min内配制,仅限当日内使用),用密封条将板条密封,室温孵育2h,宜使用微量振荡器。
4.人工手动洗板5次(每一次洗板后应该将其反应孔中的洗涤液拍出),期间可进行酶结合物工作液的配制(1:100稀释,稀释溶剂为样本稀释液,使用前30min内配制,仅限当日内使用),室温放置,应注意避光保存;加入酶结合物工作液100μl/孔,用密封条将板条密封;室温孵育1h,宜使用微量振荡器。
5.人工手动第二次洗板5次(每一次洗板后应该将其反应孔中的洗涤液拍出);然后每孔加入100μl显色底物(包括空白孔),室温避光孵育15min。
6.每孔加入100μl终止液(包括空白孔),轻轻混均匀后在10min内立即测定其在450nm处od值,最后进行数据分析处理。
7.用graphpadprism5软件作图,采用mean(平均值)+s.e.m.(标准物)表示,由graphpadprism5软件分析数据之间差异显著性,采用的是单因素方差分析法。
试验结果如下:
elisa法检测岩藻黄素对lps诱导的脓毒症小鼠模型血清炎症因子表达的影响
分析图3可知(图中的“+”表示添加了该种物质,“-”表示未添加该种物质,下同),与空白对照组相比,lps模型组小鼠血清中的il-1β含量均明显升高(p<0.001),随着岩藻黄素注射浓度的增加,il-1β的含量不断减少,其中岩藻黄素(10.0mg/kg)治疗组小鼠血清中的il-1β含量却相较lps组明显减少(p<0.01)。
分析图4可知,与空白对照组相比,lps模型组小鼠血清中的il-6含量均明显升高(p<0.001),随着岩藻黄素注射浓度的增加,il-6的含量不断减少,其中岩藻黄素低中高剂量(0.1mg/kg,1.0mg/kg,10.0mg/kg)治疗组小鼠血清中的il-1β含量均相较lps组明显减少(p<0.001)。
分析图5可知,与空白对照组相比,lps模型组小鼠血清中的tnf-α含量均明显升高(p<0.001),其中岩藻黄素(1.0mg/kg)治疗组小鼠血清中的tnf-α含量相较lps组抑制效果最佳(p<0.01)。
实施例三
qpcr分析岩藻黄素对lps刺激后细胞炎症因子水平表达的影响
实验方法如下:
分别于6孔板中加入配制好的raw264.7细胞悬液,细胞浓度1×106/孔,每孔1ml,然后置于37℃,5%co2的培养箱培养24h;每孔加入不同的药物处理,实验分4组:空白对照组、lps组(1mg/l)、岩藻黄素组(10.0nmol/l)、lps+岩藻黄素组:先加入岩藻黄素(10.0nmol/l)培养6h后,再加入脂多糖(1.0mg/l)培养3小时后;分别收集各组细胞,于4℃、3000rpm离心10min,取细胞,培养基上清分装后置于-80℃待测。采用trizol一步法提取细胞总rna。mrna经逆转录反应生成cdna,并以此为模板进行实时荧光定量pcr;实时荧光定量pcr通过abisteponeplus型荧光定量pcr仪选用sybrgreen法采集待测基因及内对照gapdh扩增各循环荧光信号,经appliedbiosystemssds软件进行荧光采集和数据分析。用graphpadprism5软件作图,采用mean(平均值)+s.e.m.(标准物)表示,由graphpadprism5软件分析数据之间差异显著性,采用的是单因素方差分析法。
试验结果如下:
qpcr分析岩藻黄素对lps刺激后细胞炎症因子水平表达的影响
分析图6可知,与空白对照组相比,lps组raw264.7细胞中的炎症因子il-1β转录活性显著上调(p<0.01);岩藻黄素(10.0nmol/l)单独作用对raw264.7细胞炎症因子il-1β转录活性并无明显影响(p>0.05);与lps组相比较,岩藻黄素+lps组可显著抑制由lps诱导raw264.7细胞炎症因子il-1β转录活性的上调作用(p<0.05)。
分析图7可知,与空白对照组相比,lps组raw264.7细胞中的炎症因子il-6转录活性显著上调(p<0.01);岩藻黄素(10.0nmol/l)单独作用对raw264.7细胞炎症因子il-6转录活性并无明显影响(p>0.05);与lps组相比较,岩藻黄素+lps组可显著抑制由lps诱导raw264.7细胞炎症因子il-6转录活性的上调作用(p<0.05)。
实施例四
岩藻黄素对lps刺激raw264.7细胞iκbα和nf-κb表达的影响
实验方法如下:
分别于6孔板中加入配制好的raw264.7细胞悬液,细胞浓度1×106/孔,每孔1ml,然后置于37℃,5%co2的培养箱培养24h;每孔加入不同的药物处理,实验分4组:空白对照组、lps组(1mg/l)、岩藻黄素组(10.0nmol/l)、lps+岩藻黄素组:先分别加入岩藻黄素(10.0nmol/l)培养1h、3h和6h后,再用lps(1.0mg/l)刺激10min;分别收集各组细胞,于4℃、3000rpm离心10min,去除上清后抽提蛋白,蛋白分装后置于-80℃待测。通过westernblot法检测nf-κb信号通路中相关蛋白的变化。用graphpadprism5软件作图,采用mean(平均值)+s.e.m.(标准物)表示,由graphpadprism5软件分析数据之间差异显著性,采用的是单因素方差分析法。
试验结果如下:
岩藻黄素对lps刺激raw264.7细胞iκbα和nf-κb表达的影响
分析图8至图10可知,经lps刺激后,iκbα和nf-κb的磷酸化程度显著提高(p<0.001),这表明,lps可以促进炎症通路表达,与lps组相比,岩藻黄素(10.0nmol/l)孵育3h后,再经1.0mg/l的lps刺激10min,则可显著下调iκbα和nf-κb磷酸化水平,且与lps组和hupa组比较均有统计学意义(p<0.01)。
实施例五
岩藻黄素对lps刺激thp1-luciatmnf-κb细胞对nf-κb转录抑制的影响
实验方法如下:
分别于96孔板中加入配制好的thp1-luciatmnf-κb细胞悬液,细胞浓度1×105/孔,每孔0.2ml,然后置于37℃,5%co2的培养箱培养24h;每孔加入不同浓度的岩藻黄素与lps(1.0mg/ml)共培养16小时后收取上清。取10微升的培养基上清加入不透光板底的96孔板,再加入40微升的显色液后用酶标仪测荧光强度,荧光强度代表nf-κb蛋白的活性。
试验结果如下:
分析图11可知,低浓度(30-300nm)的岩藻黄素无法抑制由lps诱导的nf-κb蛋白的激活;高浓度的岩藻黄素(1-20μm)对于由lps诱导的nf-κb蛋白的激活呈现出一个剂量依赖的抑制效果,其中ec50(半最大效应浓度)为3.78μm。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!