一种小鼠椎间盘退变模型的造模设备的制作方法
本实用新型涉及椎间盘退变研究领域,具体而言,涉及一种小鼠椎间盘退变模型的造模设备。
背景技术:
椎间盘退变是导致腰痛的重要因素,动物模型是研究椎间盘退变的重要基础。一直以来,小鼠作为重要的实验动物被广泛用于椎间盘退变的相关研究中,其优势如下:一,价格低廉、操作简便;二,时间周期短,效益高;三,组织探针及标志物丰富;四,基因组易修饰,能够创建多种基因修饰小鼠进行相关研究
目前以小鼠为对象的椎间盘造模方法主要为以下几类:一,力学诱导模型,包括压力模型及失稳模型;二,损伤模型,即通过物理方法或化学注射损伤纤维环、软骨终板、韧带等结构;三:自然诱导,即通过老年小鼠自发椎间盘退变作为模型;四:自发模型,即利用基因修饰,改变相关蛋白表达水平进行造模。
上述动物模型对阐述椎间盘退变的病理生理及分子机制做出贡献,但均存在一些缺陷。如下:
一,力学诱导模型中,机械加压模型要求专业装置、易行性差,且受力位点为小鼠尾椎,模拟性存在不足,而失稳模型一方面诱发椎间盘退变时间较长,不易控制;另一方面还存在术后周围组织的纤维化可能会使失稳的脊柱重新稳定,存在不可靠因素,其可重复性也较差;二,结构损伤模型,虽快速有效,但模拟性差,创伤导致的瞬时结构改变占病理发展的比重过大;三:自然诱导,虽然模拟性好,但周期长,研究证明18月龄小鼠的椎间盘才出现明显的退变性改变,由此带来较高的成本;四:自发模型,快速且具有一定模拟性但技术水平要求高,实验过程复杂且干扰因素持续存在。
因此,构建一种理想的椎间盘退变动物模型对于科学客观地阐述人类椎间盘退变的分子机制意义重大。
鉴于此,特提出本实用新型。
技术实现要素:
本实用新型的目的在于提供一种小鼠脊柱退变模型的造模设备,该造模设备可以引导小鼠避水习性,使其长时间保持双足站立姿势,增加小鼠腰椎椎间盘所受轴向应力,加速腰椎椎间盘退变进程,形成椎间盘退变模型。
本实用新型是这样实现的:
本实用新型提供了一种小鼠椎间盘退变模型的造模设备,其包括:一个或多个造模筒和用于放置所述造模筒的水槽,所述造模筒的侧壁靠近底壁的位置或者是所述造模筒的底壁开设有多个透水孔,所述透水孔与所述造模筒内部的用于放置小鼠的造模腔相连通。
进一步地,在本实用新型的一些实施方案中,所述造模筒上设置有用于打开或关闭所述造模腔的筒盖,所述筒盖和/或造模筒侧壁上设置有多个透气孔,所述透气孔与所述造模腔相连通。
进一步地,在本实用新型的一些实施方案中,所述造模筒的内径为9-11cm,高度为12-14cm。
进一步地,在本实用新型的一些实施方案中,所述造模筒的材质为玻璃材质或塑料材质。
需要说明的是,造模筒的材质应当为透明材质,便于透光。
进一步地,在本实用新型的一些实施方案中,所述透气孔的数量为4个,4个透气孔沿圆周方向均匀分布在所述造模筒的侧壁上。
进一步地,在本实用新型的一些实施方案中,所述水槽的底壁上设置有多个用于固定所述造模筒的限位件,所述限位件包括两个左右对称的呈圆弧形的限位凸起,所述限位凸起位于所述水槽的底壁表面并往远离所述水槽的底壁方向凸出。
进一步地,在本实用新型的一些实施方案中,所述造模设备还包括基板,所述基板的表面设置有造模室和与所述造模室相邻的供小鼠自由活动的休息室,所述水槽安装在所述造模室中。
进一步地,在本实用新型的一些实施方案中,所述休息室的内壁上设置有水壶和食槽,所述休息室的底壁设置有垫料槽。
进一步地,在本实用新型的一些实施方案中,所述造模设备还包括第一盖板,所述第一盖板用于打开或关闭所述造模室的开口。
进一步地,在本实用新型的一些实施方案中,所述造模设备还包括第二盖板,所述第二盖板用于打开或关闭所述休息室的开口。
本实用新型的有益效果包括:
本实用新型提供的造模设备首次通过引导小鼠避水习性,使其长时间保持双足站立姿势,增加小鼠腰椎椎间盘所受轴向应力,加速腰椎椎间盘退变进程,结果显示,小鼠在10周时出现明显椎间盘退变征象,包括:椎间盘高度下降、组织学改变及退变标志蛋白的表达升高。该造模方式符合人椎间盘退变的病理发展特性,规避了外界创伤及炎症的干扰。
此外,本实用新型构建的小鼠椎间盘退变模型是一种新型、无创、有效的双足站立小鼠椎间盘退变模型,能够模拟过度应力导致脊柱退变的发病过程,为椎间盘退变的力学生物学信号转导机制等研究提供有效的力学动物模型。
附图说明
为了更清楚地说明本实用新型实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本实用新型的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
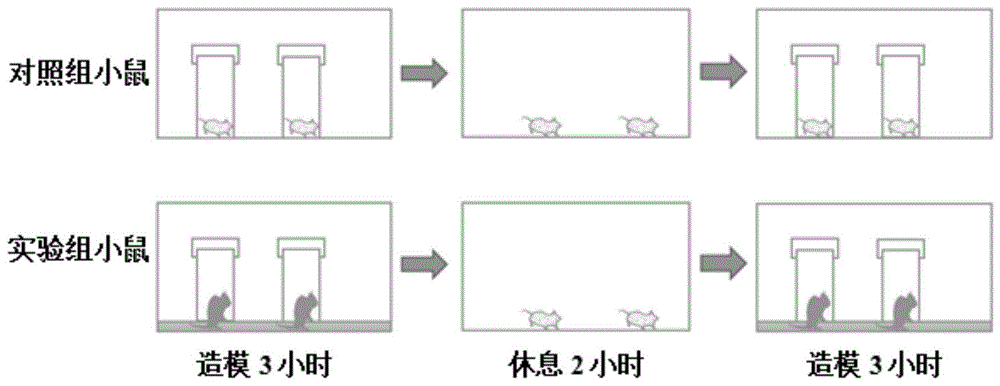
图1为本实用新型的造模设备进行造模的程序示意图。
图2为本实用新型实验例中的采用实施例造模设备引导小鼠维持长时间的站立姿势的拍照结果(大体观)和CT摄像图。
图3为本实用新型实验例中的造模后小鼠腰椎组织影像学分析结果;图中:(A)对椎间盘标本行Micro-CT检查,观察到实验组小鼠的椎间隙高度下降(箭头);(B)测量并计算椎间盘高度指数(DHI%)的示意图,公式为:DHI%=(A+B+C)/(D+E+F+G+H+I)*100%。(C)实验组与对照组小鼠椎间盘高度指数(DHI%)。图中CON:对照组,POST 6W:造模后6周组,POST 10W:造模后10周组。
图4为本实用新型实验例中的造模后小鼠腰椎组织HE染色结果;图中:(A)HE染色结果,相比对照组,实验组椎间隙高度依次降低(a~c);髓核组织细胞外基质减少,细胞体积减小(d~f);纤维环组织显著变薄,排列紊乱,裂隙增大增宽,细胞形态缩小,且细胞外空泡增多(g~i);软骨终板高度下降、细胞空泡增多(j~l);高倍镜下观察,实验组小鼠纤维环区域出现断裂(m,方框),且有骨赘生成(n,方框);(B)根据小鼠椎间盘退变改良评分表进行评分并行统计学分析结果;(C)计算并比较对照组与实验组小鼠的软骨终板高度。图中*:与对照组相比P<0.05,▲:与造模6周组相比P<0.05,CON:对照组,POST 6W:造模后6周组,POST 10W:造模后10周组,NP:髓核,AF:纤维环,CEP:软骨终板。比例尺=200μm(a~c),50μm(d~n)。
图5为本实用新型实验例中的造模后小鼠腰椎组织Masson染色结果;图中:相比对照组,实验组小鼠椎间盘纤维环及软骨终板中红染的纤维素增多(d~l),提示椎间盘退变加速。图中CON:对照组,POST 6W:造模后6周组,POST 10W:造模后10周组,AF:纤维环,CEP:软骨终板。比例尺=200μm(a~c,g~i),50μm(d~f,j~l)。
图6为本实用新型实验例中的造模后小鼠腰椎组织免疫组化结果;图中:(A)免疫组化的结果显示,相比于对照组,实验组小鼠椎间盘退变程度显著升高,具体表现为:II型胶原在髓核组织内表达显著增加(a~c),而在纤维环(d~f)及软骨终板(g~i)区域内表达逐渐降低;MMP13(j~l)和OCN(m~o)在纤维环中的阳性细胞率依次升高;(B)造模10周组小鼠纤维环内骨赘区域可见大量OCN表达(黑色方框);(C)MMP13阳性细胞率统计;(D)OCN阳性细胞率统计。图中:*:与对照组相比P<0.05,▲:与造模6周组相比P<0.05,CON:对照组,POST 6W:造模后6周组,POST 10W:造模后10周组,MMP13:基质金属蛋白酶13,OCN:骨钙素,Col2a1:II型胶原。比例尺=50μm(a~o and B)。
图7为本实用新型实验例中的造模后小鼠关节突关节组织染色结果;图中:HE染色结果显示(a~f),相比对照组,实验组小鼠关节突关节发生明显退变,表现为:i)关节面粗糙;ii)关节软骨细胞簇的形成,肥大软骨细胞增多;iii)关节间隙变窄。Masson染色结果与HE染色相符(g~l),相比对照组,实验组小鼠关节突关节的关节面纤维素增多。图中:CON:对照组,POST 6W:造模后6周组,POST 10W:造模后10周组。比例尺=200μm(a~c,g~i),50μm(d~f,j~l)。
图8为本实用新型实验例中的新型双足站立小鼠IDD模型的关节突关节免疫组化结果;图中:(A)结果显示,相比对照组,实验组小鼠关节突关节软骨中MMP13表达量显著增加(a~f),Collagen X的表达量显著增加(g~l)。图中:CON:对照组,POST 6W:造模后6周组,POST 10W:造模后10周组,MMP13:基质金属蛋白酶13,CollagenX:X型胶原。比例尺=200μm(a~c,g~i),50μm(d~f,j~l)。
图9为本实用新型实施例中的造模设备的第一视角下的结构示意图。
图10为本实用新型实施例中的造模设备的第二视角下的结构示意图。
图11为本实用新型实施例中的造模设备的第三视角下的结构示意图。
图12为本实用新型实施例中的造模设备的第四视角下的结构示意图。
图13为本实用新型实施例中的造模筒的内部结构示意图。
图14为本实用新型实施例中的造模筒的俯视图。
图15为本实用新型实施例中的水槽的结构示意图。
图16为本实用新型实施例中的造模筒固定在水槽的限位件上的结构示意图。
图标:造模设备100,基板101,水槽102,造模筒103,造模室104,休息室105,透水孔106,造模腔107,筒盖108,透气孔109,限位件110,限位凸起111,水壶112,食槽113,垫料槽114,第一盖板116,第二盖板117,第一透风口118,第二透风口119,挡板120,挡杆121。
具体实施方式
为使本实用新型实施例的目的、技术方案和优点更加清楚,下面将对本实用新型实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本实用新型的特征和性能作进一步的详细描述。
实施例
请参考图9-图12,本实施例提供的一种小鼠椎间盘退变模型的造模设备100,其包括:基板101、水槽102和多个造模筒103。基板101的上表面设置有造模室104和与造模室104相邻的供小鼠自由活动的休息室105(参考图9和图10)。
该造模设备100结合造模室104与休息室105,功能整合,方便操作。造模室104和休息室105的顶部具有开口,可供操作放置物品到其内部。
参考图13和图14,造模筒103呈筒状结构,其采用有机玻璃材质制成,具有透光作用。在造模时,为小鼠提供充足的光线。当然,在其他的实施例中,也可以采用塑料材质制成,确保具有透光作用即可。
造模筒103内部开设有造模腔107,用于放置小鼠。造模时,将小鼠放置与该造模腔107中。造模筒103的侧壁靠近底壁的位置开设有多个透水孔106。透水孔106与造模筒103内部的用于放置小鼠的造模腔107相连通。透水孔106用于将外部水导入到造模腔107内。将透水孔106设置于造模筒103的侧壁靠近底壁的位置,有利于水的导入和排出。
当然,透水孔106的数量可以根据实际情况设置。本实施例中,透水孔106的数量设置为4个,4个透水孔106沿圆周方向均匀分布在造模筒103的侧壁上。均匀分布的透水孔106可以更快速地将水导入至造模腔107或排出到造模腔107外。当然,在其他的实施例中,也可以直接在造模筒103的底壁开设透水孔106。
此外,造模筒103上设置有用于打开或关闭造模腔107的筒盖108,筒盖108上设置有多个透气孔109,透气孔109与造模腔107相连通。透气孔109的作用在于将外界空气导入到造模腔107内,在造模时,为小鼠提供充足的氧气。
本实施例中,造模筒103的内径为10cm,高度为12cm。空间过小不利于小鼠采取趴卧姿势,空间过大不利于小鼠采取双足站立姿势。合适的空间大小有利于小鼠采取双足站立姿势。
此外,本实施例中,水槽102安装在造模室104中,水槽102的底壁上设置有多个用于固定造模筒103的限位件110。限位件110包括两个左右对称的呈圆弧形的限位凸起111,限位凸起111位于水槽102的底壁表面并往远离水槽102的底壁方向凸出(参考图9,图10和图15)。
在造模时,将造模筒103放置在两个限位凸起111的中间(参考图9和图16),进行固定。通过限位件110的设置,可以使得在造模的过程中,避免造模筒103的移动,相互碰撞。在非造模状态时,造模筒103可以从造模室104中取出,单独存放。
每个限位件110中的两个限位凸起111的端部之间具有的间距可以为水的流动提供空间,使得当造模筒103放置在两个限位凸起111的中间时,水能够顺利进入到造模腔107内,不致于堵塞。此外,水槽102的内侧壁设置有刻度尺,便于操作者观察水量。
参考图9和图11,造模室104的侧壁上开设有第一透风口118,通过该第一透风口118可以在造模时让外界的空气进入到造模室104内部。
另外,休息室105的内壁上设置有水壶112和食槽113,休息室105的底壁设置有垫料槽114。在造模的过程中,需让小鼠自由活动一段时间。休息室105可以为小鼠提供活动空间。其内设置的水壶112可为小鼠提供水源,食槽113可放置食物,便于小鼠采食。此外,休息室105的底壁还设置有垫料槽114和开关锁。
参考图9和图1,2,休息室105的侧壁上设置有第二透风口119,通过该第二透风口119可以让外界的空气进入到休息室105内部,为小鼠在休息时提供氧气。为了防止在小鼠休息时从休息室105中跑出,在第二透风口119的位置还设置有挡板120,挡板120的上侧与休息室105的侧壁靠近第二透风口119的下沿铰接,在休息室105的底部侧壁上设置有挡杆121,挡杆121的一端与休息室105的底部侧壁转动连接,另一端可自由摆动。需要关闭挡板120时,将挡杆121的自由端转动至竖直的位置(此时可抵挡挡板120转动,起到关闭的效果),需要打开挡板120时,将挡杆121的自由端转动至水平位置,此时挡板120转动可向外侧翻转,小鼠可从第二透风口119取出。
参考图9和图10,此外,本实施例中,造模设备100还包括第一盖板116和第二盖板117,第一盖板116的一侧边与造模室104的一侧壁上沿位置铰接,用于打开或关闭造模室104上的开口。第二盖板117的一侧边与休息室105的一侧壁上沿位置铰接,用于打开或关闭休息室105的开口。
采用本实施例的造模设备100对小鼠进行造模的方法如下:
(1)将待造模的小鼠放入造模筒103的造模腔107中,盖上筒盖108;如果需要对多足小鼠造模,则取多个造模筒103。一个造模筒103放入一只小鼠。
(2)往水槽102中加入适量的水,该水量确保当造模筒103放入后,水进入到造模腔107内时,造模腔107的水深在5mm左右即可。
(3)将装有小鼠的造模筒103对应放置水槽102中的限位件110位置,进行造模。一个限位件110固定一个造模筒103。
(4)关闭第一盖板116和第二盖板117。
(5)造模时间为6-10周,每天造模2次,每次造模3小时(也就是控制小鼠在造模筒103的时间每次为3小时),每天的相邻两次造模间隔时间为2小时。间隔期间,将小鼠取出,放置于休息室105,让小鼠正常自由活动,使其自由采食和水分。休息结束后,将小鼠再次放回到造模筒103继续造模。每日6小时造模结束后,将小鼠置于休息室,自由活动、进食或饮水。
(6)定期更换食槽与水壶,定期更换水槽内清水与垫料槽内垫料,维持适宜的造模及休息环境。
本实施例的造模设备和相应的造模方法,通过将小鼠置于有限的涉水空间内(内径10厘米,高度12厘米),由于避水习性,小鼠将主动采取前肢抬起、双足站立、脊柱直立前倾的姿势(如图1所示),增加小鼠轴向应力,加速腰椎椎间盘退变进程,并且可长时间维持该姿势。一段时间后例如6-10周,即可使小鼠出现明显椎间盘退变征象,包括:椎间盘高度下降、组织学改变及退变标志蛋白的表达升高等。该小鼠即可作为椎间盘退变模型,用于椎间盘退变的分子机制研究等领域中。
该造模设备不对小鼠采用外界刺激,规避干扰因素,使得采用该造模设。
此外,该造模方法不仅能够模拟人椎间盘退变的病理特点,还能够加速关节突关节退变,实现脊柱运动单元的整体退变。
实验例
实验分组:
参考图1,从广东省医学实验动物中心购买雄性8周龄C57BL/6小鼠32只,平均体重23.78±1.37g。实验组:随机选取16只小鼠,采用上述实施例的造模设备和方法进行造模,作为实验组;对照组:另16只小鼠作为对照组,除水槽内不盛水外,其余处理同实验组。实验小鼠饲养于广东省骨科研究院,恒温/恒湿的标准清洁级动物房内。
于造模后6周(POST 6W)、10周(POST 10W)随机处死小鼠评估椎间盘及关节突关节退变程度,通过影像学检查、组织学染色、免疫组化技术,验证得到的双足站立小鼠椎间盘退变模型的脊柱运动单元退变加速。结果如下:
(1)如图2所示,相比对照组,实验组小鼠可保持长时间的双足站立姿势。
(2)造模后小鼠腰椎组织影像学分析
见图3,对椎间盘标本行Micro-CT检查,观察到实验组小鼠的椎间隙高度下降(箭头),通过测量并计算椎间盘高度指数(DHI%),显示,造模10周的小鼠DHI明显低于对照组。
(3)造模后小鼠腰椎组织HE染色
通过HE染色结果,如图4A所示,相比对照组,实验组椎间隙高度依次降低(a~c);髓核组织细胞外基质减少,细胞体积减小(d~f);纤维环组织显著变薄,排列紊乱,裂隙增大增宽,细胞形态缩小,且细胞外空泡增多(g~i);软骨终板高度下降、细胞空泡增多(j~l)。高倍镜下观察,实验组小鼠纤维环区域出现断裂(m,方框),且有骨赘生成(n,方框);
根据小鼠椎间盘退变改良评分表进行评分,结果显示造模6周和造模10周的小鼠明显高于对照组(图4B);
比较对照组与实验组小鼠的软骨终板高度,可以看出造模6周和造模10周的小鼠明显低于对照组(图4C)。
(4)造模后小鼠腰椎组织Masson染色
Masson染色结果显示,相比对照组,实验组小鼠椎间盘退变程度显著升高,具体表现为纤维环(d~i)及软骨终板(j~l)中红染的纤维素区域逐渐增多(图5)。
(5)造模后小鼠腰椎组织免疫组化结果
免疫组化的结果显示,相比于对照组,实验组小鼠椎间盘退变程度显著升高,具体表现为:II型胶原在髓核组织内表达显著增加(a~c),而在纤维环(d~f)及软骨终板(g~i)区域内表达逐渐降低;MMP13(j~l)和OCN(m~o)在纤维环中的阳性细胞率依次升高(图6A);
图6B的结果显示,造模10周组小鼠纤维环内骨赘区域可见大量OCN表达(黑色方框);
此外,MMP13阳性细胞率统计结果和OCN阳性细胞率统计结果显示造模6周和造模10周的小鼠明显高度对照组(图6C和图6D)。
(6)造模后小鼠关节突关节组织染色结果
造模后的关节突关节标本HE染色结果显示:与对照组相比,实验组小鼠的关节突关节发生明显的退变。具体表现为:1)关节面变粗糙;2)细胞簇的形成以及具有空泡的肥大软骨细胞增多;3)关节间隙的缩短甚至关节融合。Masson染色结果(图7,g-l)与HE染色相符,相比于对照组,实验组小鼠关节突关节的关节面红染区域逐渐增多。表明机械应力除了影响椎间盘,也能加速关节突关节退变。
此外,关节突关节中,MMP13阳性细胞率显著增加(a~f),关节面中X型胶原的含量也随着造模时长而显著增加(g~l),进一步提示过度应力造成了明显的关节突关节退变(图8)。
从上述结果可以看出,小鼠在造模10周时出现明显椎间盘退变征象,包括:椎间盘高度下降、组织学改变及退变标志蛋白的表达升高。该造模方式符合人椎间盘退变的病理发展特性,规避了外界创伤及炎症的干扰。
综上,本实用新型提供的造模设备通过引导小鼠避水习性,使其长时间保持双足站立姿势,增加小鼠轴向应力,加速腰椎椎间盘退变进程,进而可到得到一种新型、无创、有效的双足站立小鼠椎间盘退变模型,该小鼠椎间盘退变模型能够模拟过度应力导致脊柱退变的发病过程,为椎间盘退变的力学生物学信号转导机制研究提供有效的力学动物模型。
以上所述仅为本实用新型的优选实施例而已,并不用于限制本实用新型,对于本领域的技术人员来说,本实用新型可以有各种更改和变化。凡在本实用新型的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本实用新型的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!