鲁拉西酮固体分散体及其制备方法与流程
本申请请求2017年01月06日向中国国家知识产权局提交的、专利申请号为201710009826.8的专利申请的优先权和权益,并且通过参照将其全文并入此处。本发明涉及医药领域,具体地,本发明涉及鲁拉西酮固体分散体、制备鲁拉西酮固体分散体的方法、药物组合物、药物联合以及药物组合物在制备药物中的用途。
背景技术:
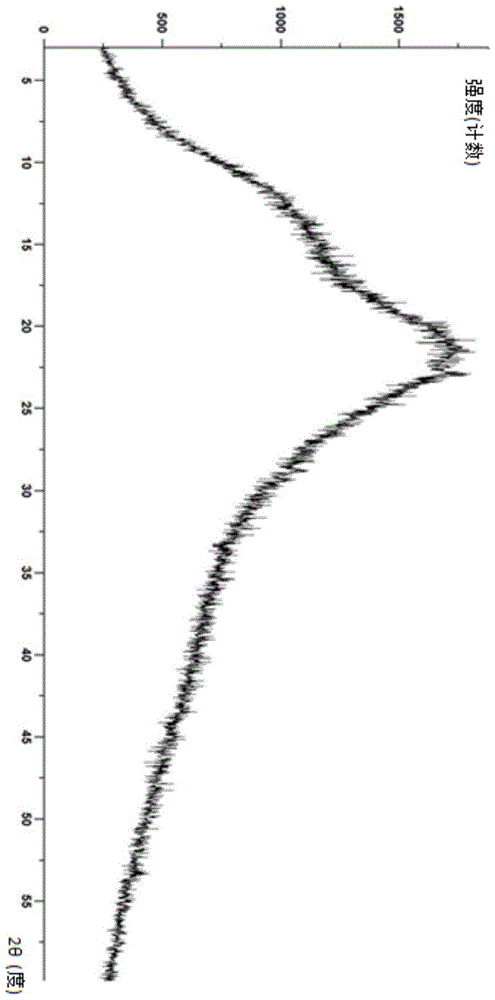
:盐酸鲁拉西酮是一种非典型抗精神病药物,2010年10月28日美国食品药品监督管理局(fda)批准日本住友制药公司的盐酸鲁拉西酮片剂上市,商品名为latuda,规格分别有20mg、40mg、60mg、80mg、120mg/片,用于治疗精神分裂症。2013年6月28日,fda批准了鲁拉西酮的两个新适应症,一是作为单药治疗,二是作为锂或丙戊酸钠的辅助药物治疗,用于成人患者中i型双相情感障碍相关的重性抑郁发作。鲁拉西酮的作用机制目前尚未明确。已有人提出,鲁拉西酮治疗精神分裂症,主要是通过作用于中枢2型多巴胺(d2)和2型5-羟色胺(5-ht2a)等受体,对精神病患者的阳性和阴性症状均具有显著疗效,另外鲁拉西酮还可以改善认知功能。且鲁拉西酮较少引起体重增加,不引起葡萄糖、脂质(类脂)、ecg和qt间期变化。然而,目前上市的鲁拉西酮片剂生物利用度较低,且规定必须与食物同时服用,食物的热量必须大于350卡路里,否则会使鲁拉西酮的血药峰浓度(cmax)和药-时曲线下面积(auc)分别下降3倍和2倍,就算如此生物利用度也仅有9%-19%。而该药的服药要求对于精神分裂症患者和抑郁患者来说是比较严苛的,平时正常进食一般不会严格计算热量,并且部分患者会有拒绝进食或食欲下降的症状,如果没有进食足够的食物服药,可能导致该药的生物利用度下降,影响疗效,耽误患者病情。故开发一种能够减弱或消除食物效应的剂型以提高患者的顺应性是药物研发者拭待解决的关键问题。发明概述本申请是基于发明人对以下问题和事实的发现而提出的:现有盐酸鲁拉西酮的溶解度具有较强的ph依赖性,在水中和偏酸性介质中溶解度较好,而在中性介质中溶解度迅速下降,溶解或部分溶解于胃中的盐酸鲁拉西酮在进入肠道的中性环境后大量析出,而仅有极少部分药物溶解吸收,导致生物利用度较低。同时,由于肠道中溶解和吸收的药物的量较少,进一步放大了食物引起的胃肠道表面活性剂增加从而增溶的效应,造成食物效应过大。因此,发明人认为,如果能对鲁拉西酮进行较大程度的增溶,就有可能降低其食物效应。基于此,本发明提出了一种制备鲁拉西酮固体分散体的方法,利用该方法制备的鲁拉西酮固体分散体,使得鲁拉西酮在肠道中溶出度大幅增加,食物效应大幅降低。在本发明的第一方面,本发明提出了一种鲁拉西酮固体分散体。根据本发明的实施例,所述鲁拉西酮固体分散体含有鲁拉西酮、药用热熔载体以及酸性调节剂,所述鲁拉西酮为游离碱形式。发明人惊喜地发现,鲁拉西酮突破性的以游离碱的形式提供,极大地降低了鲁拉西酮固体分散体的熔点,并且鲁拉西酮固体分散体中含有的酸性调节剂,提高了鲁拉西酮在偏中性介质中的溶出。根据本发明实施例的鲁拉西酮固体分散体,特别适于通过熔融处理获得。根据本发明的实施例,上述鲁拉西酮固体分散体还可以进一步具有如下附加技术特征至少之一:根据本发明的实施例,所述鲁拉西酮与所述药用热熔载体的重量比约为1:1~1:50。发明人发现,所述鲁拉西酮与所述药用热熔载体的质量比低于1:50,导致药用热熔载体比例过高,单位剂量制剂的重量或体积过大,无法满足正常服药要求,从而造成患者的服药顺从性变差;所述鲁拉西酮与所述药用热熔载体的质量比高于1:1,导致药用热熔载体比例过低,药物分散性可能较差,且影响形成的固体分散体的质量,降低增溶效果。根据本发明的实施例,所述鲁拉西酮与所述药用热熔载体的重量比约为1:1~1:30。发明人发现,所述鲁拉西酮与所述药用热熔载体的质量为1:1~1:30时,单位剂量制剂的重量适宜,药物分散性较优,增溶效果较优。根据本发明的实施例,所述鲁拉西酮与所述药用热熔载体的重量比约为1:3~1:30。发明人发现,所述鲁拉西酮与所述药用热熔载体的质量为1:3~1:30时,单位剂量制剂的重量适宜,药物分散性较优,增溶效果较优。所述药用热熔载体的类型不受特别限制,根据本发明的具体实施例,所述药用热熔载体包括选自聚维酮、共聚维酮、聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)、醋酸羟丙甲纤维素琥珀酸酯(hpmcas)、聚乙二醇、羟丙基甲基纤维素(hpmc)、羟丙基纤维素、乙基纤维素和丙烯酸树脂(例如eudragite,eudragitl)的中至少之一。上述药用热熔载体可以使药物高度分散,并有着较好的热稳定性和热塑性,有利于热熔挤出工艺的进行,还可以抑制药物晶核的形成和生长,增加鲁拉西酮的溶出。根据本发明的实施例,所述鲁拉西酮与所述酸性调节剂的重量比约为1:0.05~1:25。发明人发现,所述鲁拉西酮与所述酸性调节剂的重量比高于1:0.05,导致酸性调节剂比例过低,药物的溶出变差;所述鲁拉西酮与所述酸性调节剂的重量比低于1:25,导致酸性调节剂比例过高,进而导致单位剂量制剂的重量或体积过大,无法满足正常服药要求,患者的服药顺从性变差,同时可能影响热熔的工艺过程。根据本发明的实施例,所述鲁拉西酮与所述酸性调节剂的重量比为约1:1~1:20。发明人发现,单位剂量制剂的重量或体积适宜,药物溶出增加,热熔的工艺过程更顺利。根据本发明的实施例,所述酸性调节剂包括选自一水柠檬酸、无水柠檬酸、富马酸、苹果酸、琥珀酸、抗坏血酸、酒石酸、山梨酸和甘氨酸中的至少之一。上述酸性调节剂可有效提高鲁拉西酮在偏中性介质中的溶出,通过混合和热熔挤出时,鲁拉西酮与酸性调节剂可充分有效混合,在溶出过程中,二者一同溶出,酸性调节剂可以调整药物周围微环境的ph值,有利于鲁拉西酮的溶出。根据本发明的实施例,所述鲁拉西酮固体分散体进一步含有增塑剂。发明人发现,增塑剂可提高热熔工艺的可行性,降低热熔温度和热熔过程的扭矩。鲁拉西酮固体分散体的鲁拉西酮在偏中性介质中的溶出会进一步提高。根据本发明的实施例,所述鲁拉西酮与所述增塑剂的重量比约为1:0~1:10。发明人发现,当鲁拉西酮与增塑剂的重量比小于1:10时,影响挤出工艺过程及影响挤出物的造粒特性,使挤出物不易造粒。同时单位剂量制剂的重量或体积过大,无法满足正常服药要求,患者的服药顺从性变差。根据本发明的实施例,所述鲁拉西酮与所述增塑剂的重量比约为1:0.5~1:5。发明人发现,此情况下,单位制剂的重量或体积适宜,且热熔的工艺过程顺利。-根据本发明的实施例,所述增塑剂包括选自泊洛沙姆、聚乙二醇、柠檬酸三乙酯、邻苯二甲酸二乙酯和单硬脂酸甘油酯中的至少之一。发明人发现,上述增塑剂的加入可以降低聚合物挤出过程的加工温度,提高工艺可行性,降低热熔过程的扭矩,同时增塑剂还有一定的增溶作用。另一方面,本发明提供了一种制备鲁拉西酮固体分散体的方法。根据本发明的实例,本发明所述方法包括:熔融处理,即熔融并混合含有鲁拉西酮和药用热熔载体的混合物;冷却混合物得到鲁拉西酮固体分散,其中鲁拉西酮为游离碱形式。另一方面,本发明提出了一种制备鲁拉西酮固体分散体的方法。根据本发明的实施例,本发明所述方法包括:熔融处理,即熔融并混合含鲁拉西酮、药用热熔载体、酸性调节剂和任选的增塑剂的混合物;冷却混合物得到鲁拉西酮固体分散,其中,所述鲁拉西酮为游离碱形式。根据本发明实施例的鲁拉西酮固体分散体的方法制备工艺步骤少,无需溶剂,操作简单,适于连续化生产,收率高,容易实现产业化生产。更为重要的是,利用根据本发明实施例的制备方法所获得的鲁拉西酮固体分散体具有在偏中性介质(如ph6.0)中的高溶出率(溶出率可达30%~70%)的特点,生物利用度显著提高,并且本发明的实施例的鲁拉西酮固体分散体的食物效应显著下降,克服了现有技术中过多的服药限制,避免了患者因服药不当所导致的疗效降低甚至无效,保证了药效的正常发挥,从而增加了患者服药的灵活性和顺应性。根据本发明的实施例,上述鲁拉西酮固体分散体的方法还可以进一步包括如下附加技术特征至少之一:根据本发明的实例,熔融和混合步骤在热熔挤出机中进行。所述热熔挤出机适用于连续生产,产量高,易于工业化生产。根据本发明的实施例,所述鲁拉西酮与所述药用热熔载体的重量比约为1:1~1:50。发明人发现,所述鲁拉西酮与所述药用热熔载体的质量比低于1:50,导致药用热熔载体比例过高,单位剂量制剂的重量或体积过大,无法满足正常服药要求,患者的服药顺从性变差;所述鲁拉西酮与所述药用热熔载体的质量比高于1:1,导致药用热熔载体比例过低,药物分散性变差,且影响形成的固体分散体的质量,降低增溶效果。所述药用热熔载体的类型不受特别限制,根据本发明的具体实施例,所述药用热熔载体包括选自聚维酮、共聚维酮、聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)、醋酸羟丙甲纤维素琥珀酸酯(hpmcas)、聚乙二醇、羟丙基甲基纤维素、羟丙基纤维素、乙基纤维素和丙烯酸树脂中的至少之一。发明人发现,上述药用热熔载体可以使药物高度分散,并有着较好的热稳定性和热塑性,有利于热熔挤出工艺的进行,还可以抑制药物晶核的形成和生长,增加鲁拉西酮的溶出。根据本发明的实施例,所述鲁拉西酮与所述酸性调节剂的重量比约为1:0.05~1:25。发明人发现,所述鲁拉西酮与所述酸性调节剂的重量比高于1:0.05,导致酸性调节剂比例过低,药物的溶出较差;所述鲁拉西酮与所述酸性调节剂的重量比低于1:25,导致酸性调节剂比例过高,导致单位剂量制剂的重量或体积过大,无法满足正常服药要求,患者的服药顺从性变差,同时影响热熔的工艺过程。根据本发明的实施例,所述酸性调节剂包括选自一水柠檬酸、无水柠檬酸、富马酸、苹果酸、琥珀酸、抗坏血酸、酒石酸、山梨酸和甘氨酸中的至少之一。上述酸性调节剂可有效提高鲁拉西酮在偏中性介质中的溶出,发明人发现,通过混合和热熔挤出鲁拉西酮与酸性调节剂时,鲁拉西酮与酸性调节剂可充分有效混合,在溶出过程中,二者可一同溶出,酸性调节剂可以调整药物周围微环境的ph值,从而进一步提高鲁拉西酮的溶出。根据本发明的实施例,所述混合物进一步含有增塑剂。发明人发现,增塑剂可提高热熔工艺的可行性,降低热熔温度和热熔过程的扭矩。鲁拉西酮固体分散体的鲁拉西酮在偏中性介质中的溶出会进一步提高。根据本发明的实施例,所述鲁拉西酮与所述增塑剂的重量比约为1:0~1:10。发明人发现,当鲁拉西酮与增塑剂的重量比小于1:10时,影响挤出的工艺过程及影响挤出物的造粒特性,使挤出物不易造粒;同时也会造成单位剂量制剂的重量或体积过大,无法满足正常服药要求,患者的服药顺从性变差。根据本发明的实施例,所述增塑剂包括选自泊洛沙姆、聚乙二醇、柠檬酸三乙酯、邻苯二甲酸二乙酯和单硬脂酸甘油酯中的至少之一。发明人发现,上述增塑剂的加入可以降低聚合物挤出过程的加工温度,提高工艺可行性,降低热熔过程的扭矩,同时增塑剂还有一定的增溶作用。根据本发明的实施例,熔融处理中的熔融和混合步骤在约80℃至约200℃的温度,同时热熔挤出机螺杆转速在约30rpm至约1000rpm下进行。根据所采用的药用热熔载体的类型,选择热熔挤出机的温度和螺杆转速。熔融和混合在温度约为80℃至200℃、螺杆转速约为30至约1000rpm的条件下进行可较为顺利地将目标混合物挤出,挤出速度和产率可满足要求,且增溶效果较好。根据本发明的实施例,熔融处理中的熔融和混合步骤在约115℃至约175℃的温度,同时热熔挤出机螺杆转速在约30rpm至约300rpm下进行。根据所采用的药用热熔载体的类型,选择热熔挤出机的温度和螺杆转速。熔融和混合在温度为115℃至约175℃、螺杆转速为约30rpm至约300rpm的条件下进行可较为顺利地将目标混合物挤出,挤出速度和产率可满足要求,且增溶效果较好。根据本发明的实施例,一种采用上述方法制备得到的鲁拉西酮固体分散体。本发明人发现鲁拉西酮固体分散体显著提高了鲁拉西酮在偏中性介质中的溶出度,显著提高了生物利用度,显著降低了食物效应。在本发明的第三方面,本发明提出了一种药物组合物。根据本发明的实施例,所述药物组合物包括上述的鲁拉西酮固体分散体或由上述的方法制备的鲁拉西酮固体分散体。根据本发明实施例的药物组合物,有利于鲁拉西酮的吸收,可保证鲁拉西酮在小肠的溶出增加,而无需考虑食物对鲁拉西酮吸收的影响,降低了过多的服药限制,避免了因服药不当导致的疗效降低甚至无效,保证药效的正常发挥,从而增加患者服药的灵活性和顺应性。根据本发明的实施例,上述药物组合物还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述药物组合物进一步包括药学上可接受的辅料。所述药学上可接受的辅料可使药物组合物呈现一定的剂型,利于患者服用或者注射,提高药物的生物利用度和稳定性。根据本发明的实施例,所述药学上可接受的辅料包括选自填充剂、崩解剂、粘合剂、表面活性剂、矫味剂和润滑剂中的至少之一。其中,所述填充剂、崩解剂、粘合剂、表面活性剂、矫味剂和润滑剂的选择不受特别限制。根据本发明的具体实施例,所述填充剂包括选自乳糖、淀粉、微晶纤维素、甘露醇、糊精、预胶化淀粉、玉米淀粉、山梨醇、硫酸钙、磷酸氢钙和碳酸钙中的至少之一。根据本发明的具体实施例,所述崩解剂包括选自交联聚维酮、交联羧甲基纤维素钠、羧甲基淀粉钠、干淀粉、低取代羟丙基纤维中素的至少之一。根据本发明的具体实施例,所述粘合剂包括选自淀粉、预胶化淀粉、羧甲基纤维素钠、羟丙基纤维素、甲基纤维素、乙基纤维素、羟丙甲纤维素、蔗糖、明胶、聚乙烯吡咯烷酮、微晶纤维素和共聚维酮中的至少之一。根据本发明的具体实施例,所述表面活性剂包括选自十二烷基硫酸钠、季铵化物、卵磷脂、脂肪酸甘油酯、脂肪酸山梨坦和聚山梨酯中的至少之一。根据本发明的具体实施例,所述矫味剂包括选自蔗糖、三氯蔗糖、安赛蜜、阿斯巴甜、甜菊糖苷、糖精钠和甜蜜素中的至少之一。根据本发明的具体实施例,所述润滑剂包括选自硬脂酸镁、微粉硅胶、硬脂酸、滑石粉、山嵛酸甘油酯、氢化蓖麻油、硬脂酸富马酸钠中的至少之一。加入填充剂可以改善物料的性能,调节压缩率和流动性,提高产品性能,促进制剂成型,使制备过程更加顺利;加入崩解剂可使片剂在体内迅速崩解,使药物迅速溶解吸收;所述粘合剂具有一定的粘度,能使一些松散的粉末形成具有一定大小的颗粒,提高颗粒流动性,并能在一定程度上调节组合物的崩解和药物的释放;表面活性剂的加入有利于药物的分散,在一定程度上提高了药物的增溶性;在口崩解片或悬浮液等特定剂型中加入矫味剂,可以改善药物的口感,掩盖药物的不良气味,提高患者的依从性;加入润滑剂可以减少颗粒之间或片与模具之间的摩擦,使在压片过程中压力分布均匀,更容易压片。根据本发明的实施例,所述药物组合物呈颗粒、片剂、胶囊或肠溶制剂。如上所述,根据本发明实施例的药物组合物在小肠中的溶出显著增加。本发明实施例的药物组合物呈颗粒、片剂、胶囊或肠溶包衣制剂。适用于本发明实施例药物组合物的特点,有利于进一步提高药物组合物的生物利用度。在本发明的第四方面,本发明提出了一种药物联合,所述药物联合用于治疗或预防精神性疾病,例如,精神分裂症,i型双相情感障碍,自闭症,双相情感障碍和抑郁症。根据本发明的实施例,所述药物联合包括:鲁拉西酮作为第一活性成分,其中,鲁拉西酮是以上述的鲁拉西酮固体分散体形式存在或通过上述制备方法得到鲁拉西酮固体分散体的形式存在;不同于鲁拉西酮的药物作为第二活性成分,所述不同于鲁拉西酮的药物用于治疗或预防精神性疾病。利用根据本发明实施例的药物联合,对精神性疾病的治疗或预防效果显著,患者用药的灵活性和顺应性显著提高。本发明提供一种上述鲁拉西酮固体分散体或药物组合物在制备药物中的用途,其中所述药物用于治疗或预防精神疾病,例如精神分裂症,i型双相情感障碍,自闭症,双相情感障碍和抑郁症。如上所述,本申请提供的药物组合物具有在偏中性介质中具有高溶解速率和高生物利用度的特征。本申请提供的药物组合物可有效治疗或预防精神分裂症等精神疾病,食物效应低,避免了因服药不当导致的疗效降低甚至无效的副作用,保证了药效的正常发挥。在本发明的第五方面,本发明提出了一种治疗或预防精神性疾病患者方法,如精神分裂症,i型双相情感障碍,自闭症,双相情感障碍和抑郁症,通过向病人给予治疗有效量的上述鲁拉西酮固体分散体或组合物。如本文所用,本文公开的所有数字均为近似值,无论是否使用“大约”或“约”等字眼,这意味着存在在给定值或范围的5%内,特别是1%内的差异。或者,当由本领域普通技术人员考虑时,术语“约”意指在平均值的可接受的标准误差范围内。因此,每当公开一个具有n值的数字时,任何具有n+/-1%,n+/-2%,n+/-3%,n+/-4%或n+/-5%值的任何数字会被明确地公开,其中“+/-”表示加或减。除非本文另有说明或与上下文明显矛盾,否则本文所用的“一”,“一个”和“所述”旨在包括“至少一个”或“一个或多个”。因此,冠词是指一个或多个语法对象(即至少一个)。举例来说,“辅料”是指一种或多种辅料,因此,可能考虑多于一种辅料,且可以采用或用于所描述的实施方案中。附图说明图1是根据本发明实施例17的热熔粉末的xrd检测结果;图2是根据本发明实施例17的热熔粉末的xrd检测结果;以及图3是根据本发明实施例17的热熔粉末的xrd检测结果。具体实施方式下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。其中,实施例中所用的参比制剂为住友公司(sumitomo)生产的40mg盐酸鲁拉西酮片。实施例中使用的鲁拉西酮为游离碱形式,除非实施例另有说明或与上下文明显矛盾。发明人在前期研究发现,参比制剂(40mg盐酸鲁拉西酮片,住友(sumitomo))在0.1m盐酸和ph3.8介质可以100%溶出,但是原研片剂进食后的生物利用度仅为9%-19%,在动物中的生物利用度皆小于12%,由此可见这两种介质仅能代表空腹或部分人进食状态下的胃环境,而无法代表小肠部位的环境。而鲁拉西酮吸收的主要部位在小肠,且鲁拉西酮的溶解度具有较强的ph依赖性,在水中和偏酸性介质中溶解度较好,而在中性介质中溶解度迅速下降,因此采用这两种介质(0.1m盐酸和ph3.8介质)均无法代表药物在体内的状态。小肠上段的ph大约为6.0,因此研究时发明人首先选择6.0作为溶出介质的ph值,而空腹和进食状态下小肠会分泌不同浓度的胆酸盐,即存在一定量的表面活性剂,因此发明人考察了参比制剂在ph6.0介质加不同浓度表面活性剂(十二烷基硫酸钠)中的溶出,与参比制剂的生物利用度对比,发现参比制剂在ph6.0加0.01%sds(十二烷基硫酸钠)的溶出平台与空腹的生物利用度接近,因此发明人后续选择ph6.0加0.01%sds作为空腹时的溶出的筛选介质,而进食状态相比空腹表面活性剂的浓度会升高,因此发明人选择ph6.0加0.03%sds作为溶出介质判断制剂在进食状态下的溶出。发明人发现,专利申请wo2014076712a2公开了一种盐酸鲁拉西酮的固体分散体的制备方法,该方法需要使用大量有机溶剂,且按其处方工艺制备了固体分散体后发现其在ph6.0加0.01%sds的溶出平台仅为7%,相比参比制剂有所增加,但增溶效果远远不及本申请的处方;专利申请us20140343076a1公开了一种盐酸鲁拉西酮的组合物,将鲁拉西酮与至少一种酸和至少一种表面活性剂和其他辅料混合,按其处方工艺制备了制剂后发现其增溶效果也远远不及本申请的处方;专利申请cn105395493a公开了一种盐酸鲁拉西酮片,将枸橼酸钾和山梨醇加热熔融后,加入盐酸鲁拉西酮熔融挤出制粒,外加辅料压片,该专利方法需要两步熔融,且按其处方工艺制备后发现在ph6.0加0.01%sds的溶出介质中平台也很低。具体详见对比例1~3。对比例1专利申请us20140343076a1专利申请us20140343076a1中的具体处方如表1所示。表1称取总混粉末25%(w/w)的纯化水,并按处方比例称取hpmc和柠檬酸,溶解在纯化水中,作为制粒液备用。按表1处方称取添加物,混合10min,作为制粒底物。加制粒液,手工湿法制粒,过40目筛网筛分湿颗粒,在50℃的烘箱中干燥60min。干燥颗粒通过40目筛网进行筛分,然后加入硬脂酸镁,混合,所得混合物灌装胶囊。对比例2专利申请cn105395493a专利申请cn105395493a具体处方如表2所示。表2将枸橼酸钾和山梨醇加热熔融,再加入盐酸鲁拉西酮熔融,冷却后加入添加物混合研磨,过筛,然后灌胶囊。对比例3专利申请wo2014076712a2专利申请wo2014076712a2具体处方如表3所示。表3组分比例(%)盐酸鲁拉西酮25.00共聚维酮75.00甲醇100ml(后除去)二氯甲烷100ml(后除去)总计100.00按处方量称取盐酸鲁拉西酮和共聚维酮,溶解于甲醇和二氯甲烷体积比1:1的混合溶剂(共200ml)中,使药物和载体充分溶解,而后60-65℃下喷雾干燥,得到的喷干粉末直接灌装胶囊。另外,为了便于说明问题,发明人提供了以下对比例4~6,具体如下所述。对比例4不加酸性调节剂的热熔粉末具体处方如表4所示。表4按表4处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为30rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按表4处方加入添加物微晶纤维素,混合,并将所得混合物灌胶囊。对比例5具体处方如表5所示。表5组分比例(%)鲁拉西酮10.64soluplus53.21一水柠檬酸11.15微晶纤维素25.00总计100.00按表5所示处方。称取上述组分,直接充分混合后,无热熔处理,灌胶囊。对比例6具体处方如表6所示。表6组分比例(%)盐酸鲁拉西酮10.75soluplus53.77一水柠檬酸10.48微晶纤维素25.00总计100.00按表6所示处方称取上述组分,充分混合后,无热熔处理,灌胶囊。另外,为了进一步说明问题,发明人也尝试了其它对比例实验,具体为:依照表5或表6所示的处方,进行混合,经过湿法制粒后灌胶囊或将鲁拉西酮、载体与酸性调节剂溶解于甲醇中喷雾干燥处理后,灌胶囊。下面将详述本发明的制备实施例,本发明的药物组合物的制备工艺概括如下:1、将鲁拉西酮、药用热熔载体、酸性调节剂和,任选的,增塑剂,过筛,充分混合均匀,制得物理混合物;2、将上述物理混合物匀速加到热熔挤出机中,以合适的温度和螺杆转速挤出,物料经过剪切、挤压和混合后最终以条状或片状挤出,得到挤出物;3、挤出物经冷却后,粉碎,过筛,得到鲁拉西酮固体分散体颗粒或粉末;4、将鲁拉西酮固体分散体颗粒或粉末与药学上可接受的辅料混合均匀,制备成口服药物制剂,如颗粒、片剂、胶囊等。同时包括肠溶制剂,例如将片剂进行肠溶包片,或肠溶胶囊。具体的制备过程如实施例1~16所述。实施例1具体处方如表7所示。表7按表7所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为30rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物微晶纤维素,混合,所得混合物灌胶囊。实施例2按实施例1处方和制备工艺,最后将所得颗粒灌到肠溶胶囊壳中。实施例3具体处方如表8所示。表8按表8所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为160℃、165℃、170℃、170℃、170℃、170℃、170℃、165℃,螺杆转速设置为30rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物微晶纤维素,混合,灌胶囊。实施例4具体处方如表9所示。表9按表9所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为200rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,所得混合物灌胶囊。实施例5具体处方如表10所示。表10按表10所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、150℃、150℃、150℃、150℃、150℃、145℃,螺杆转速设置为30rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,所得混合物灌胶囊。实施例6具体处方如表11所示。表11按表11所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、150℃、150℃、150℃、150℃、150℃、145℃,螺杆转速设置为100rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,所得混合物灌胶囊。实施例7具体处方如表12所示。表12按表12所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为135℃、150℃、175℃、175℃、175℃、175℃、175℃、170℃,螺杆转速设置为100rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物微晶纤维素,混合,所得混合物灌胶囊。实施例8具体处方如表13所示。表13按表13所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为200rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物微晶纤维素,混合,所得混合物灌胶囊。实施例9具体处方如表14所示。表14按表14所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、150℃、150℃、150℃、150℃、150℃、145℃,螺杆转速设置为200rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,将所得混合物灌胶囊。实施例10具体处方如表15所示。表15按表15所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、150℃、150℃、150℃、150℃、150℃、145℃,螺杆转速设置为30rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,混合物灌胶囊。实施例11具体处方如表16所示。表16按表16所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为100rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,所得混合物灌胶囊。实施例12具体处方如表17所示。表17按表17所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为200rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,所得混合物灌胶囊。实施例13具体处方如表18所示。表18按表18所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为300rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,所得混合物灌胶囊。实施例14具体处方如表19所示。表19按表19所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为300rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,所得混合物灌胶囊。实施例15具体处方如表20所示。表20按表20所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为300rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物甘露醇,混合,所得混合物灌胶囊。实施例16具体处方如表21所示。表21按表21所示处方称取热熔过程中所含组分,充分混合后加入到热熔挤出机的饲粉器中,模机筒温度设定为115℃、135℃、165℃、165℃、165℃、165℃、165℃、160℃,螺杆转速设置为300rpm,热熔挤出,挤出物冷却后进行粉碎,粉碎后的物料过60目筛网,按处方加入添加物,混合,所得混合物灌胶囊。在以上对比例以及制备实施例的基础上,发明人对制备实施例所获得的热熔粉末进行了xrd检测(如实施例17所述),并对对比例、制备实施例所获得的制剂进行了体外溶出实验和药物动力学实验(如实施例18和19所述)。具体如下所述。实施例17在该实施例中,发明人以对实施例1、3和4所制备的热熔粉末为例,进行了xrd检测,所用仪器为x-ray粉末衍射仪,仪器生产厂家为:荷兰帕纳科,型号为锐影,仪器参数如表22所示。表22取供试品适量,将零背景样品架圆形框中,用载玻片轻压,得到一个平整的平面,并用零背景的样品架固定,即得。待仪器运行稳定后,按表22所示的检测条件扫描1次,记录图谱。具体检测结果如图1~3所示。从图1~3可看出,实施例1、3、4中所制备的热熔粉末为无定型形态。实施例18体外溶出测试在该实施例中,参比制剂(盐酸鲁拉西酮片,40mg,日本住友(sumitomo))、对比例1~6和实施例1~16所制备的胶囊在模拟小肠上段溶液(含0.01%sds的ph6.0缓冲液)介质,介质的体积900±9ml,介质的温度37.0±0.5℃,桨法,50rpm,加在线过滤器的条件下进行体外溶出试验。溶出试验取样时间点:5min、10min、15min、20min、30min、45min、60min、150rpm-15min。取样位置:在桨叶顶端至液面的中点,距溶出杯内壁10mm处。溶出介质(含0.01%sds的ph6.0缓冲液)配置:称取7.8g的二水合磷酸二氢钠,0.224g氢氧化钠,加水1000ml使溶解,混匀;用饱和氢氧化钠溶液或磷酸调节其ph值至6.00±0.05;称取0.1gsds,加入上述缓冲溶液中,微热溶解,搅拌均匀,即得。采用高效液相(hplc)法进行体外溶出含量测定,试验条件为:hplc仪器型号:agilent1260;色谱条件:色谱柱:kromasil100-5c184.6×50mm,5μm;柱温:30℃;检测波长:230nm;流速:1.0ml/min;进样体积:20μl;运行时间:4.5min(主峰rt≈2min);流动相:0.05mol/l磷酸盐缓冲液(ph3.0)-乙腈(6:4)(v:v,体积比)。具体地,0.05mol/l磷酸氢二钠溶液(ph3.0)配置方法为:称取磷酸氢二钠7.098g,加纯化水1000ml使溶解,用磷酸调节ph值至3.0±0.05,混匀,滤膜(聚醚砜,0.45μm,φ=50mm,津腾)抽滤即得。流动相:按0.05mol/l磷酸氢二钠溶液(ph3.0)-乙腈(6:4)(v/v)比例混匀,超声15min脱气即得。试验结果如表23所示。表23各对比例与实施例在含0.01%sds的ph6.0缓冲液中的溶出(n=3)从表23中的溶出结果可以看出,在含0.01%sds的ph6.0缓冲液中,参比制剂、对比例1、2、3、4溶出量极低,均低至7%;单纯物理混合的对比例5和对比例6溶出稍微有所提高,也分别仅为4%和8%。同时,发明人发现采用非热熔工艺的对比例的溶出也仅是稍微有所提高。因此发明人可以得出结论,对比例1~3的药物在小肠溶出量很低,影响药物在小肠的吸收;对比例4~6的药物在小肠溶出量稍微有所提高,但不显著。实施例1~16均比参比制剂和对比例体外溶出量显著提高,显著增加了药物的溶出度,大大降低已在胃中溶解的药物在小肠析出的风险。实施例1~16非常有利于药物在小肠中的吸收。实施例19药物动力学实验在本实施例中,发明人以实施例1和实施例2所获得的组合物为例,将参比制剂的片剂、实施例1和实施例2的胶囊进行比格犬的药动学实验,每组n=3,分别在空腹状态和进食状态下进行实验,考察食物对其药动的影响。采用lc-ms-ms检测比格犬血浆中鲁拉西酮的含量,并采用winnonlin6.3软件非房室模型法计算药动学参数。结果如表24所示:表24空腹状态和进食状态下犬的药物动力学参数从表24可知,参比制剂在比格犬的空腹条件下、进食条件下分别给药后,食物使得犬的鲁拉西酮的aucinf和cmax差异较大,犬进食时的aucinf为空腹时的2.45倍,犬进食时的cmax为空腹的2.18倍;食物效应较为显著。而实施例1犬进食时的auinfc为空腹时的1.3倍,犬进食时的cmax为空腹时的0.89倍;实施例2犬进食时的aucinf为空腹时的1.17倍,犬进食时的cmax为空腹时的0.76倍;实施例1、2与参比制剂相比,生物利用度也有所提高。两组实施例的食物效应都明显下降。综上,本发明提出的鲁拉西酮的热熔制剂有利于鲁拉西酮的吸收,可保证鲁拉西酮在小肠的溶出增加,无需考虑食物对鲁拉西酮吸收的影响,降低了过多的服药限制,也可避免因服药不当导致的疗效降低甚至无效,保证药效的正常发挥,从而增加患者服药的灵活性和顺应性。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“实施例”、“另一个示例”“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1