靶向NK细胞免疫检查点治疗感染性疾病的方法与流程
本公开涉及免疫治疗领域。具体而言,本公开涉及通过靶向nk细胞免疫检查点来预防或治疗感染性疾病的方法。本公开还涉及nk细胞免疫检查点分子拮抗剂或表达抑制剂和包含其的药物组合物在治疗感染性疾病中的用途。
技术背景
由包括人类免疫缺陷病毒(hiv)、乙型肝炎病毒(hbv)和丙型肝炎病毒(hcv)等在内的病毒感染引起的感染性疾病呈全球性流行。不同性别、年龄和种族的人群对于上述病毒均存在不同程度的易感性。例如,据世界卫生组织统计,全球约有1.85亿人(总人口的约3%)感染hcv(mohdhanafiah,k.,etal.,globalepidemiologyofhepatitiscvirusinfection:newestimatesofage-specificantibodytohcvseroprevalence.hepatology,2013.57(4):p.1333-1342)。据估算,我国目前有超过3000万hcv感染患者,并呈逐年上升趋势。
在病毒感染的急性期过程中,如果不能快速清除病毒,则往往进展为慢性感染阶段。在hcv感染中,高达80%的急性感染者不能清除病毒,进展为慢性感染。hcv慢性感染导致的进一步的主要症状包括肝硬化、门静脉高压及肝癌的发生。据who2015的数据显示,每年约有350,000例死亡与hcv直接相关,并且约27%的肝硬化及约25%的肝癌由hcv感染所致。此外,hcv感染还会导致病人生活质量显著下降。
hcv治疗的标准方案为长效干扰素注射和利巴韦林口服联合治疗。综合不同hcv亚型,约有50%的患者能够通过治疗达到持续病毒学应答(sustainedvirologicalresponse,svr)。近年来,直接靶向病毒的药物(direct-actingantiviraldrugs,daa)取得了长足进展,新的daa药物正逐步用于临床。但daa药物面临的局限性包括:(1)耐药性;(2)daa药物与传统的利巴韦林/长效干扰素联合治疗一样,无法对再次感染有效保护,并且已进入慢性感染中后期的患者治疗效果有限;(3)目前daa药物的种类较少且价格昂贵,显著增加患者的经济负担。
因此,本领域中对于包括hcv在内的病毒感染引起的感染性疾病,特别是慢性感染期的高效、经济的治疗方法仍然存在需要。
技术实现要素:
本发明人令人惊讶的发现,通过靶向nk细胞上表达的免疫检查点分子(例如使用相应拮抗剂或表达抑制剂),能够在患有由病毒感染引起的感染性疾病的受试者中阻断、抑制和/或逆转nk细胞耗竭。上述过程进一步促进病毒的快速清除,从而起到预防或治疗感染性疾病的作用。
相应的,在一个方面,本公开涉及一种用于在受试者中阻断、抑制和/或逆转nk细胞耗竭的方法,其中所述受试者患有或有风险患由病毒感染引起的感染性疾病,所述方法包括对所述受试者施用有效量的针对nk细胞免疫检查点分子的拮抗剂或表达抑制剂的步骤。
在另一个方面,本公开涉及一种预防或治疗受试者中由病毒感染引起的感染性疾病的方法,所述方法包括对所述受试者施用有效量的针对nk细胞免疫检查点分子的拮抗剂或表达抑制剂的步骤。
上述病毒的种类没有特别限制,并包括可以建立感染性疾病的任何种类的病毒。在一些实施方案中,所述病毒可以选自人类免疫缺陷病毒(hiv)、乙型肝炎病毒(hbv)和丙型肝炎病毒(hcv)。在一些实施方案中,所述病毒是hcv。
人类获得性免疫缺陷综合症(aids,艾滋病)是由人类免疫缺陷病毒(hiv)感染引起的一系列疾病。hiv包括hiv-1和hiv-2,其是一种逆转录病毒。hiv感染人体免疫系统中的重要细胞,如辅助性t细胞(特别是cd4+t细胞),巨噬细胞和树突状细胞。hiv感染通过多种机制导致低水平的cd4+t细胞,包括感染的t细胞的细胞焦亡,未感染的旁临细胞的凋亡,对感染的细胞的直接病毒杀伤,以及通过cd8+细胞毒性淋巴细胞来杀伤被感染的cd4+t细胞等。当cd4+t细胞数量下降到临界水平以下时,细胞介导的免疫力就会丧失,机体受到机会性感染的可能性增加,从而导致艾滋病的发展。
在大多数情况下,hiv是一种性传播感染,通过与血液、精液和阴道液体接触或转移发生。在这些体液中,hiv作为游离病毒颗粒和感染的免疫细胞中的病毒两者存在。此外,在感染的母亲与婴儿之间可能会发生垂直传播。
艾滋病毒感染后的最初阶段称为急性hiv或原发性hiv。许多人在感染后2-4周患上类似流感的疾病或类似单核细胞增多症的疾病,而其他人则没有明显的症状。最常见的症状包括发烧,淋巴结肿大,喉咙发炎,皮疹,头痛,疲倦和/或口腔和生殖器溃疡。部分患者在该阶段也会发生机会性感染。症状持续时间各不相同,但通常为一周或两周。由于其非特异性,这些症状通常不被认识到是hiv感染的迹象。
最初的症状之后的第二阶段称为临床潜伏期/慢性感染期,无症状hiv或慢性hiv的阶段。hiv感染的第二阶段可持续约3-20年(平均约8年)。虽然一开始通常很少或没有症状,但随着这个阶段的进展,许多人会出现发烧,体重减轻,胃肠道问题和肌肉疼痛,50%-70%的个体还患有持续性全身性淋巴结肿大。大多数感染hiv-1的个体具有可检测的病毒载量,并且在没有治疗的情况下最终会发展为艾滋病。由于免疫系统的进行性衰竭,艾滋病患者患各种病毒性感染和癌症的风险增加。在不进行治疗的情况下,患者的平均存活时间为9至11年。
乙型肝炎是一种由乙型肝炎病毒(hbv)的感染引起的影响肝脏的疾病。其能够导致急性和慢性感染。世界上大约三分之一的人口在其一生中的某个时间点受到hbv感染,其中约3.43亿人患有慢性感染。每年有超过750,000人死于乙型肝炎,其中约300,000人是由于肝癌。这种疾病也可以影响其他类人猿。hbv的传播是主要通过暴露于感染性血液或含有血液的体液,其比hiv的传染性高50到100倍。可能的传播形式包括性接触,输血和输入其他人体血液制品,再次使用受污染的针头和注射器,以及分娩时母婴垂直传播。病毒可在感染后30至60天内检测到,并可持续存在并发展成慢性乙型肝炎。
hbv的急性感染导致急性病毒性肝炎,这种疾病始于一般健康状况不佳,食欲不振,恶心,呕吐,全身酸痛,轻度发烧和尿液暗,然后发展为黄疸。疾病持续数周,然后在大多数受影响的人中逐渐改善。少数人可能患有更严重的肝脏疾病,即暴发性肝衰竭,并可能因此而死亡。急性感染可能完全无症状并无法被识别到。
hbv的慢性感染可能是无症状的,或者与肝脏的慢性炎症(慢性肝炎)有关,导致持续数年的肝硬化。这种类型的感染显著增加了肝细胞癌的发病率。在整个欧洲,乙型和丙型肝炎引起大约50%的肝细胞癌。包括肝硬化和肝癌在内的这些并发症导致15%至25%的慢性hbv感染患者死亡。
丙型肝炎是一种由丙型肝炎病毒(hcv)引起的感染性疾病,主要影响肝脏。据世界卫生组织统计,全球约有1.85亿人(占总人口的约3%)感染hcv。据估算,我国目前有超过3000万hcv感染患者,并呈逐年上升趋势。hcv主要通过血液传播,其传播途径还包括性传播、母婴传播等。一般认为hcv感染人类和黑猩猩。在hcv感染中,高达80%的急性hcv感染者不能清除病毒,继而进展为慢性感染。慢性感染导致的进一步的主要症状包括肝硬化、门静脉高压及肝癌的发生。据who2015年数据显示,每年约有350,000死亡与hcv直接相关。此外,hcv感染也会导致病人生活质量显著下降。
hcv感染在约15%的病例中引起急性症状。症状通常是轻微的,包括食欲减退,疲劳,恶心,肌肉或关节疼痛和体重减轻等,以及少见的急性肝功能衰竭。在仅15%-20%的hcv感染病例中发生病毒的自发清除。
约80%的暴露于hcv的个体转化为慢性感染,其定义为存在可检测的病毒复制至少六个月。大多数人在慢性感染的最初几年内经历极少或没有症状。然而,慢性感染数年后可能会导致肝硬化或肝癌。全球约27%的肝硬化及约25%的肝癌由hcv感染所致。大约10-30%的hcv感染者在30年内发展为肝硬化。发生肝硬化的人患肝细胞癌的风险较正常人高20倍。这种转化的发生率为每年1-3%。此外,肝硬化可能导致门静脉高压,腹水,容易瘀伤或出血,静脉曲张,黄疸和认知功能障碍综合征(肝性脑病)等症状。
在一些实施方案中,上述方法用于预防受试者中由病毒(例如hiv、hbv或hcv)感染引起的感染性疾病,所述受试者有患所述感染性疾病的风险。例如,所述受试者曾与病毒(例如hiv、hbv或hcv)感染者或携带者接触,例如通过相应病毒的传播途径接触,包括血液传播、性传播和母婴传播途径等。
在一些实施方案中,上述方法用于治疗受试者中由病毒(例如hiv、hbv或hcv)感染引起的感染性疾病。在一些实施方案中,所述感染性疾病处于急性感染期。在另一些实施方案中,所述感染性疾病处于慢性感染期。
例如,在一些实施方案中,所述感染性疾病是处于慢性感染期的hcv感染。
如上文针对各种感染性疾病所讨论的,病毒感染通常是一个病原与宿主免疫博弈的过程。感染通常可分为急性感染和慢性感染阶段。急性感染通常是短暂的,病原入侵导致免疫系统活化,机体通过天然免疫或适应性免疫响应快速清除病原,恢复稳态;慢性感染中,病原能够通过潜伏、逃逸宿主免疫等方式持续存在。慢性感染能够通过诱导细胞病变、引发持续炎症、建立免疫耐受等方式影响宿主,导致免疫力下降、器官病变和癌变,甚至死亡等严重后果。在此过程中,往往伴随着免疫效应细胞例如t细胞和nk细胞的耗竭。
在上述方法的任何实施方案中,所述nk细胞免疫检查点分子可以选自kir、nkg2a、tigit和klrg1。
kir(killer-cellimmunoglobulin-likereceptors,杀伤细胞免疫球蛋白样受体)是在nk细胞和少数t细胞上表达的i型跨膜糖蛋白家族。它们通过与在有核细胞类型上表达的主要组织相容性(mhc)i类分子(在人类中为hla-a)相互作用来调节这些细胞的杀伤功能。大多数kir是抑制性的,这意味着它们对mhc分子的识别抑制了表达其的nk细胞的细胞毒活性。kir在nk细胞上的初始表达是随机的,但是nk细胞在成熟过程中改变kir的表达以实现免疫防御和自身耐受之间的平衡。由于其抑制nk细胞活性的特性,kir广泛参与病毒感染,自身免疫性疾病和癌症形成过程。
nkg2a(cd94)是c型凝集素受体家族的成员,其是一种ii型跨膜蛋白。nkg2a主要在nk细胞表面和部分cd8+t细胞亚群中表达。nkg2a识别非经典mhc糖蛋白i类(人类中的hla-e和小鼠中的qa-1分子),并且在与其配体结合后抑制nk细胞的细胞毒活性。
tigit(tcellimmunoreceptorwithiganditimdomains,具有ig和itim结构域的t细胞免疫受体)是存在于一些nk细胞和t细胞上的抑制性免疫受体。tigit可以以高亲和力与树突状细胞(dc),巨噬细胞等细胞上的cd155(pvr)结合,也可以与亲和力较低的cd112(pvrl2)结合。tigit抑制淋巴细胞活性,而dnam-1受体是活化型的。tigit通过与dnam-1竞争结合cd155配体来抑制dnam-1介导的nk细胞活化。通过阻断tigit,能够恢复nk细胞的一些功能。
klrg1(killercelllectin-likereceptorsubfamilygmember1,杀伤细胞凝集素样受体亚家族g成员1)是淋巴细胞共抑制或免疫检查点受体,主要在晚期分化的效应和效应记忆cd8+t和nk细胞上表达。其配体是具有相似亲和力的e-钙粘蛋白和n-钙粘蛋白,分别为上皮细胞和间充质细胞的标记物。
对于“免疫检查点分子”,如本领域技术人员理解的,其通常以配体-受体对的形式存在和发挥功能。在本文中,免疫检查点蛋白受体及其配体统称为免疫检验点分子。例如,对于nk细胞免疫检查点分子,通常配体-受体对中的受体在nk细胞中表达,而相应配体在其他类型的细胞中表达。通过受体-配体之间的相互作用,抑制nk细胞的活化和免疫效应功能。因此,在提及“免疫检查点分子”时,涵盖配体和受体两者。例如,当提及nkg2a时,涵盖nkg2a及其配体hla-e(人类)和qa-1(小鼠)。
在一些实施方案中,所述拮抗剂是针对所述免疫检查点分子(包括受体及其对应配体)的抗体或抗原结合片段。
如本文所用,术语“抗体”指包含至少一个抗原识别位点并能特异性结合抗原的免疫球蛋白分子。本文提及的术语“抗体”以其最广泛的含义理解,并包含单克隆抗体、多克隆抗体、抗体片段、包含至少两个不同的抗原结合结构域的多特异性抗体(例如双特异性抗体)。抗体还包括鼠源抗体、嵌合抗体、人源化抗体、人抗体以及其它来源的抗体。本公开的抗体可以来源于任何动物,包括但不限于人、非人灵长类动物、小鼠或大鼠等的免疫球蛋白分子。抗体可以含有另外的改变,如非天然氨基酸,fc效应子功能突变和糖基化位点突变。抗体还包括翻译后修饰的抗体、包含抗体的抗原决定簇的融合蛋白,以及包含对抗原识别位点的任何其它修饰的免疫球蛋白分子,只要这些抗体展现出所期望的生物活性。
术语“抗原结合片段”包括但不限于:fab片段,其具有vl、cl、vh和ch1域;fab′片段,其是在ch1域的c端具有一个或多个半胱氨酸残基的fab片段;fd片段,其具有vh和ch1域;fd′片段,其具有vh和ch1域和在ch1域的c端的一个或多个半胱氨酸残基;fv片段,其具有抗体的单一臂的vl和vh域;dab片段,其由vh域或vl域组成;分离的cdr区;f(ab′)2片段,其是包含由铰链区处的二硫桥连接的两个fab′片段的二价片段;单链抗体分子(例如单链fv;scfv);具有两个抗原结合位点的"双抗体",其包含同一多肽链中与轻链可变域(vl)连接的重链可变域(vh);"线性抗体",其包含一对串联fd区段(vh-ch1-vh-ch1),该区段与互补的轻链多肽一起形成一对抗原结合区;和任何前述物质的修饰的形式,其保留了抗原结合活性。
在上述方法的一些实施方案中,所述nk细胞免疫检查点分子是nkg2a,并且所述拮抗剂是针对nkg2a或其配体hla-e的抗体或其抗原结合片段。在一些实施方案中,所述nk细胞免疫检查点分子是kir,并且所述拮抗剂是针对kir或其配体hla-a的抗体或其抗原结合片段。在一些实施方案中,所述nk细胞免疫检查点分子是tigit,并且所述拮抗剂是针对tigit或其配体cd155(pvr)/cd112(pvrl2)的抗体或其抗原结合片段。在一些实施方案中,所述nk细胞免疫检查点分子是klrg1,并且所述拮抗剂是针对klrg1或其配体e-钙粘蛋白/n-钙粘蛋白的抗体或其抗原结合片段。
在另一些实施方案中,所述拮抗剂是所述免疫检查点分子的相应配体/受体或其片段的可溶性形式。例如,在所述nk细胞免疫检查点分子是nkg2a的情况下,所述拮抗剂可以是nkg2a/hla-e或其片段的可溶性形式。在所述nk细胞免疫检查点分子是kir的情况下,所述拮抗剂可以是kir/hla-a或其片段的可溶性形式。在所述nk细胞免疫检查点分子是tigit的情况下,所述拮抗剂可以是针对tigit/cd155(pvr)/cd112(pvrl2)或其片段的可溶性形式。在一些实施方案中,所述nk细胞免疫检查点分子是klrg1,并且所述拮抗剂是/klrg1/e-钙粘蛋白/n-钙粘蛋白的可溶性形式。所述拮抗剂还可以是包含所述受体/配体或其片段的可溶性形式的融合蛋白。
在上述方法的一些实施方案中,所述表达抑制剂是抑制相应免疫检查点分子(包括受体及其对应配体)的表达的microrna或sirna,包括各种修饰形式的microrna或sirna。
在一些实施方案中,本公开的nk细胞免疫检查点分子拮抗剂或表达抑制剂能够促进所述病毒的清除。
在本公开的方法的任何实施方案中,所述受试者包括但不限于非人灵长类动物和人。在一些实施方案中,所述受试者是人。
在一些实施方案中,所述方法还包括对所述受试者施用一种或多种另外的治疗剂的步骤。
例如,在一些实施方案中,所述另外的治疗剂选自nk细胞活化剂,例如nk细胞活化受体激动剂、nk细胞抑制受体拮抗剂或活化nk细胞的细胞因子或趋化因子。在一些实施方案中,所述另外的治疗剂选自t细胞(例如cd8+t细胞)活化剂,例如t细胞活化受体激动剂、t细胞抑制受体拮抗剂或活化t细胞的细胞因子或趋化因子。在另一些实施方案中,所述治疗剂选自直接靶向病毒(daa)药物。
本领域中已经研发了一些daa药物。例如,对于hbv感染,目前常用的daa药物包括干扰素、核苷类似物例如拉米夫定,阿德福韦酯,替比夫定,恩替卡韦,替诺福韦酯,克拉夫定等。对于hcv感染,已有的daa药物包括ns3/4a丝氨酸蛋白酶抑制剂,例如特拉匹韦(telaprevir)、波普瑞韦(boceprevir)、西咪匹韦(simeprevir)和阿那匹韦(asunaprevir);ns5b聚合酶抑制剂,例如索非布韦(sofosbuvir)、mericitabine(rg-7128)、ach-3422和mk-3682等;以及ns5a复制复合物蛋白抑制剂包括达卡他韦(daclatasvir)等。
对于hiv感染,目前常用的疗法是使用daa药物的高效联合抗反转录病毒治疗,也称为鸡尾酒疗法。例如,使用2种核苷类反转录酶抑制剂(nrtis)和1种非核苷类反转录酶抑制剂(nnrtis)的组合,或2种nrtis和1种增强型pis(含利托那韦)的组合。
相应的,在一些实施方案中,所述病毒是hbv,并且所述方法包括对所述受试者施用nk细胞免疫检查点拮抗剂或表达抑制剂和daa药物的组合的步骤,所述daa药物选自干扰素和核苷类似物例如拉米夫定,阿德福韦酯,替比夫定,恩替卡韦,替诺福韦酯,克拉夫定等。
在一些实施方案中,所述病毒是hcv,并且所述方法包括对所述受试者施用nk细胞免疫检查点拮抗剂或表达抑制剂和daa药物的组合的步骤,所述daa药物选自特拉匹韦、波普瑞韦、西咪匹韦、阿那匹韦、索非布韦、mericitabine(rg-7128)、ach-3422、mk-3682和达卡他韦。
在一些实施方案中,本公开的拮抗剂或表达抑制剂用于在对daa药物治疗不响应或耐受的受试者中阻断、抑制和/或逆转nk细胞耗竭,或者预防或治疗由病毒感染引起的感染性疾病,所述daa药物例如如上文所讨论的。
在一个方面,本公开涉及针对nk细胞免疫检查点分子的拮抗剂或表达抑制剂用于在受试者中阻断、抑制和/或逆转nk细胞耗竭中的用途,其中所述受试者患有或有风险患由病毒感染引起的感染性疾病。
在另一个方面,本公开涉及针对nk细胞免疫检查点分子的拮抗剂或表达抑制剂在制备用于在受试者中阻断、抑制和/或逆转nk细胞耗竭中的药物组合物中的用途,其中所述受试者患有或有风险患由病毒感染引起的感染性疾病。
在一个方面,本公开涉及针对nk细胞免疫检查点分子的拮抗剂或表达抑制剂用于预防或治疗受试者中由病毒感染引起的感染性疾病中的用途。
在另一个方面,本公开涉及针对nk细胞免疫检查点分子的拮抗剂或表达抑制剂在制备用于预防或治疗受试者中由病毒感染引起的感染性疾病的药物组合物中的用途。
在一个方面,本公开涉及一种药物组合物,其包含针对nk细胞免疫检查点分子的拮抗剂或表达抑制剂,以及任选的一种或多种药学上可接受的载体、赋形剂和/或稀释剂,所述药物组合物用于在受试者中阻断、抑制和/或逆转nk细胞耗竭中的用途,其中所述受试者患有或有风险患由病毒感染引起的感染性疾病。
在另一个方面,本公开涉及一种药物组合物,其包含针对nk细胞免疫检查点分子的拮抗剂,以及任选的一种或多种药学上可接受的载体、赋形剂和/或稀释剂,所述药物组合物用于预防或治疗受试者中由病毒感染引起的感染性疾病。
短语“药学上可接受的”是指在合理的医学判断的范围内适合用于与人和动物的组织接触而没有过度毒性、刺激性、变应性应答或其它问题或并发症,与合理的益处/风险比相称的那些化合物、材料、组合物和/或剂型。如本文中所用,短语“药学上可接受的载体、赋形剂和/或稀释剂”是指药学上可接受的材料、组合物或媒介物,如液体或固体填充剂、稀释剂、赋形剂、溶剂、介质、包封材料、制造助剂或溶剂包封材料,其维持本公开的拮抗剂的稳定性、溶解度或活性。
本公开的药物组合物可以通过各种途径施用,并根据不同的施用途径配制剂型。优选的,该药物组合物通过肠胃外途径施用,包括但不限于皮下注射、静脉内注射(包括推注)、肌肉内注射和动脉内注射。由于肠胃外剂型的施用通常绕过患者对污染物的天然防御,胃肠外剂型优选是无菌的或能够在对患者施用前灭菌。肠胃外剂型的实例包括但不限于准备注射的溶液、准备要溶解或悬浮在药学上可接受的注射用媒介物中的干产品、准备注射的悬浮液、受控释放肠胃外剂型、和乳剂。
在上述用途和药物组合物的一些实施方案中,所述病毒可以选自hiv、hbv和hcv。例如,在一些实施方案中,所述病毒是hcv。
在一些实施方案中,所述拮抗剂或表达抑制剂,或所述药物组合物用于预防受试者中由病毒(例如hiv、hbv或hcv)感染引起的感染性疾病,所述受试者有患所述感染性疾病的风险,例如曾与病毒(例如hiv、hbv或hcv)感染者或携带者接触。
在一些实施方案中,所述拮抗剂或表达抑制剂,或所述药物组合物用于治疗受试者中由病毒(例如hiv、hbv或hcv)感染引起的感染性疾病。在一些实施方案中,所述感染性疾病处于急性感染期。在另一些实施方案中,所述感染性疾病处于慢性感染期。例如,在一些实施方案中,所述感染性疾病是处于慢性感染期的hcv感染。
在上述用途的一些实施方案中,所述nk细胞免疫检查点分子可以选自kir、nkg2a、tigit和klrg1。
在一些实施方案中,所述拮抗剂是针对所述免疫检查点分子(包括其对应配体)的抗体或抗原结合片段。在一些实施方案中,所述nk细胞免疫检查点分子是nkg2a,并且所述拮抗剂是针对nkg2a或其配体hla-e的抗体或其抗原结合片段。在一些实施方案中,所述nk细胞免疫检查点分子是kir,并且所述拮抗剂是针对kir或其配体hla-a的抗体或其抗原结合片段。在一些实施方案中,所述nk细胞免疫检查点分子是tigit,并且所述拮抗剂是针对tigit或其配体cd155(pvr)/cd112(pvrl2)的抗体或其抗原结合片段。在一些实施方案中,所述nk细胞免疫检查点分子是klrg1,并且所述拮抗剂是针对klrg1或其配体e-钙粘蛋白/n-钙粘蛋白的抗体或其抗原结合片段。
在另一些实施方案中,所述拮抗剂是所述免疫检查点分子的相应配体/受体或其片段的可溶性形式。例如,在所述nk细胞免疫检查点分子是nkg2a的情况下,所述拮抗剂可以是nkg2a/hla-e或其片段的可溶性形式。在所述nk细胞免疫检查点分子是kir的情况下,所述拮抗剂可以是kir/hla-a或其片段的可溶性形式。在所述nk细胞免疫检查点分子是tigit的情况下,所述拮抗剂可以是针对tigit/cd155(pvr)/cd112(pvrl2)或其片段的可溶性形式。在一些实施方案中,所述nk细胞免疫检查点分子是klrg1,并且所述拮抗剂是/klrg1/e-钙粘蛋白/n-钙粘蛋白的可溶性形式。所述拮抗剂还可以是包含所述受体/配体或其片段的可溶性形式的融合蛋白。
在上述用途的一些实施方案中,所述表达抑制剂是抑制相应免疫检查点分子(包括受体及其对应配体)的表达的microrna或sirna,包括各种修饰形式的microrna或sirna。
在一些实施方案中,所述nk细胞免疫检查点分子拮抗剂或表达抑制剂,或所述药物组合物用于促进所述病毒的清除。
在上述用途的任何实施方案中,所述受试者包括但不限于非人灵长类动物和人。在一些实施方案中,所述受试者是人。
在一些实施方案中,所述拮抗剂或表达抑制剂用于与一种或多种另外的治疗剂组合使用,或者所述药物组合物还包含一种或多种另外的治疗剂。
在一些实施方案中,所述另外的治疗剂选自nk细胞活化剂,例如nk细胞活化受体激动剂、nk细胞抑制受体拮抗剂或活化nk细胞的细胞因子或趋化因子。在一些实施方案中,所述另外的治疗剂选自t细胞(例如cd8+t细胞)活化剂,例如t细胞活化受体激动剂、t细胞抑制受体拮抗剂或活化t细胞的细胞因子或趋化因子。在另一些实施方案中,所述治疗剂选自daa药物。所述daa药物可以选自例如上文中关于本公开的方法所描述的那些。
在一些实施方案中,本公开的拮抗剂或表达抑制剂,或所述药物组合物用于在对daa药物治疗不响应或耐受的受试者中阻断、抑制和/或逆转nk细胞耗竭或者预防或治疗由病毒感染引起的感染性疾病。所述daa药物如上文所述。
附图说明
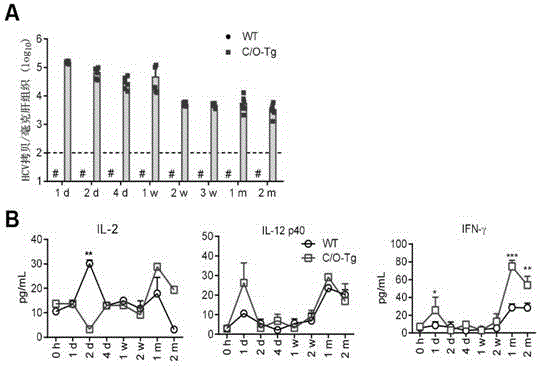
图1显示了hcv感染模型的建立和确认。图1a显示了c/o-tg小鼠及野生型同窝对照小鼠在尾静脉输注hcv后(每个时间点n≥6),在不同时间点通过qpcr检测肝组织中hcv基因组拷贝数的结果,检测下限为100拷贝/mg;图1b显示了感染后不同时间点使用luminex检测小鼠血清中il-2、il12p40和ifn-γ水平的结果。
图2显示了hcv感染过程中t细胞免疫检查点分子的表达情况和靶向上述分子的结果。图2a和图2b分别显示了感染后不同时间点肝脏和外周血中cd8+t细胞表面pd-1和tim-3的表达水平的结果;图2c显示了使用pd-1抗体或对照抗体处理小鼠后,通过qpcr检测外周血和肝组织中hcv拷贝数的结果;图2d显示了用pd-1抗体联合tim-3抗体或对照抗体处理小鼠后,通过qpcr检测外周血和肝组织中hcv拷贝数的结果。
图3显示了hcv感染过程中nk细胞免疫耐受和耗竭的结果。图3a显示了在感染后的不同时间点,将肝脏nk细胞与靶细胞yac-1共培养后通过流式细胞术检测nk细胞的ifn-γ和cd107a表达情况的结果;图3b显示了nk细胞活化受体ly49d、ly49h和nkg2d的表达结果;图3c显示了nk细胞免疫检查点分子nkg2a、klrg1和tigit的表达情况的结果。
图4显示了具有不同感染结果的小鼠中nkg2a的表达水平的结果。图4a显示了c/o-tg小鼠在hcv感染后1个月,根据血清病毒拷贝数的变化情况可分为自限性感染和慢性感染;图4b显示了感染后1个月小鼠血清病毒拷贝数与nk细胞上nkg2a表达情况的关系。
图5显示了nkg2a抗体抑制hcv建立慢性感染的结果。图5a显示了使用抗体处理小鼠的流程示意图,其中在hcv输注前1天开始施用抗体;图5b显示了nkg2a抗体或对照抗体处理1周和2周后血清和肝组织中的病毒拷贝数的结果;图5c显示了nkg2a抗体或对照抗体处理1周和2周后,将肝脏nk细胞与靶细胞yac-1共培养后通过流式细胞术检测nk细胞cd107a、颗粒酶b和ifn-γ的表达情况的结果。
图6显示了nkg2a抗体促进已建立的慢性感染中hcv清除的结果。图6a显示了使用抗体处理小鼠的流程示意图,其中在hcv输注后2周开始施用抗体;图6b显示了nkg2a抗体或对照抗体处理4周后血清和肝组织中的病毒贝数的结果;图6c显示了nkg2a抗体或对照抗体处理4周后,将肝脏nk细胞与靶细胞yac-1共培养后通过流式细胞术检测nk细胞cd107a和颗粒酶b的表达情况的结果;图6d显示了nkg2a抗体或对照抗体处理4周后,通过elispot检测hcv特异性cd8+t细胞功能的结果。
图7显示了qa-1抗体抑制hcv建立慢性感染的结果。图7a显示了在hcv感染的不同时间点,通过qpcr检测肝组织中qa-1mrna水平的结果;图7b显示了qa-1抗体或对照抗体处理2周后血清和肝组织中的病毒拷贝数的结果;图7c显示了qa-1抗体或对照抗体处理2周后,将肝脏nk细胞与靶细胞yac-1共培养后通过流式细胞术检测nk细胞cd107a和ifn-γ的表达情况的结果;图7d显示了qa-1或对照抗体处理2周后,通过elispot检测hcv特异性cd8+t细胞功能的结果。
图8显示了sirna干预qa-1表达抑制hcv建立慢性感染的结果。图8a显示了使用qa-1sirna或对照sirna处理小鼠的流程示意图,其中在hcv输注前1天开始施用sirna;图8b显示了qa-1sirna或对照sirna处理2周后,肝组织中不同细胞组分的qa-1mrna的表达水平的结果;图8c显示了qa-1sirna或对照sirna处理2周后血清和肝组织中的病毒拷贝数的结果;图8d显示了qa-1sirna或对照sirna处理2周后,将肝脏nk细胞与靶细胞yac-1共培养后通过流式细胞术检测nk细胞cd107a和ifn-γ的表达情况的结果。
图9显示了nkg2a抗体通过nk细胞发挥作用的结果。图9a显示了对nk细胞删除的检测;图9b显示了在nk细胞存在或删除的情况下,使用nkg2a抗体处理小鼠2周后通过elispot检测hcv特异性cd8+t细胞功能的结果;图9c显示了在nk细胞删除或cd8+t细胞删除的情况下,用nkg2a抗体处理小鼠2周后血清和肝组织中的病毒拷贝数的结果。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1.hcv小鼠模型的建立与确认
在hcv的感染过程中,急性hcv感染的特征在于t细胞应答的显著延迟。在先前的研究中,已经在icr小鼠背景上构建了人cd81和ocln肝脏特异双转基因小鼠(c/o-tg小鼠),该小鼠能够支持hcv慢性感染并模拟慢性丙型肝炎中免疫耐受、脂肪变性、肝纤维化、肝硬化等疾病进程(chenj,zhaoy,zhangc,chenh,fengj,etal.2014.persistenthepatitiscvirusinfectionsandhepatopathologicalmanifestationsinimmune-competenthumanizedmice.cellresearch24:1050)。
首先重复并验证了该hcv感染小鼠模型。使用hcv(j399em,1ml,tcid50=2x107)对c/o-tg小鼠及野生型同窝对照小鼠进行尾静脉输注。在hcv输注后不同时间点对小鼠肝脏中hcv基因组拷贝数的检测表明了c/o-tg小鼠中的hcv感染,以及从急性感染期转化为慢性感染期的过程,而野生型对照小鼠中检测不到hcv基因组(图1a)。对血清细胞因子的luminex测量显示了随着感染过程的进行典型的th1应答(ifn-γ,il-2和il-12p40)延迟(图1b)以及th2应答的缺失。上述结果与hcv感染患者中观察到的结果一致(faheys,dempseye,longa.theroleofchemokinesinacuteandchronichepatitiscinfection.cellularandmolecularimmunology11,25(2014))。
实施例2.t细胞免疫检查点阻断对hcv慢性感染没有影响
由于通常认为cd8+t细胞在病毒感染和清除过程中发挥重要功能,首先检测了hcv感染过程中,cd8+t的免疫检查点分子的表达情况。结果发现,在使用hcv感染小鼠后,t细胞免疫检查点分子pd-1(图2a)和tim-3(图2b)随着慢性感染的建立的上调。基于此,检测了靶向t细胞免疫检查点分子是否能够抑制该慢性感染过程。然而,如图2c和图2d的结果所示,无论单独使用pd-1阻断抗体(克隆号g4,杂交瘤自产)或联合使用pd-1和tim-3阻断抗体(克隆号be0115,购于bioxcell公司),均无法有效促进病毒清除。上述结果表明,靶向t细胞免疫检查点分子的不能有效抑制hcv慢性感染过程,或促进hcv的清除。
实施例3.nk细胞的耗竭导致hcv的持续感染
随后检测了hcv感染对nk细胞功能的影响。通过体外nk功能测定检测了hcv感染过程中的肝脏nk细胞的耗竭。结果显示,hcv感染的c/o-tg小鼠的肝脏nk细胞在受到靶细胞yac-1刺激后,ifn-γ分泌能力和cd107a脱粒水平在hcv输注后4天内升高,其随后快速下降到与未感染的肝脏nk细胞相似的基线水平(图3a)。进一步的研究表明,在hcv输注后4天内nk活化性受体ly49d,ly49h和nkg2d的上调(图3b)。这些结果显示了nk细胞响应hcv感染的瞬时肝脏浸润和活化。然而,在hcv输注后4天,肝脏nk细胞中这些活化受体下降,而免疫检查点分子klrg1,nkg2a和tigit的表达增加,并一直持续到hcv输注后2个月(图3c)。
此外,观察到在小部分hcv感染的c/o-tg小鼠中能够对hcv进行自发清除形成自限感染(图4a)。因此,进一步研究了具有不同hcv感染结果(即自限感染或慢性感染)的c/o-tg小鼠群体中nk细胞的耗竭以及免疫检查点分子的表达情况。结果发现,能够对hcv自发清除的小鼠的nk细胞显示非常低的nkg2a表达,而发展为hcv持续性感染的小鼠显示较高的nkg2a水平(图4b)。上述结果提示,在hcv感染从急性感染期向慢性感染期转化的过程中,包括nkg2a在内的免疫检查点分子的上调影响nk细胞的功能并导致其耗竭,促进hcv感染从急性感染期向慢性感染期的发展,并形成持续性感染。
实施例4.nkg2a的阻断或抑制促进hcv的清除
由于在发展为hcv持续性感染的小鼠中nkg2a表达上调,本公开进一步检测了使用拮抗剂阻断nkg2a对于hcv感染的预防和治疗效果。首先,在对c/o-tg小鼠(n=9每组)输注hcv(j399em,1ml,tcid50=2x107)的同时用nkg2a阻断抗体(克隆号20d5,购于thermo公司)或对照抗体处理(50μg/次,腹腔注射),所述抗体每3天施用一次并持续到hcv输注后1周或2周(图5a)。结果表明,相对于同型对照抗体处理组,nkg2a阻断抗体处理组小鼠的血清和肝脏中的病毒载量在1周和2周时有显著下降(图5b)。抗nkg2a处理后hcv拷贝数的下降与nk细胞杀伤活性上升和nk细胞ifn-γ分泌能力增强相关(图5c)。
为了进一步研究nkg2a阻断对慢性hcv感染的治疗效果,在hcv感染后2周对小鼠施用nkg2a阻断抗体,在此阶段已经观察到nkg2a的表达上调(图3c),并持续施用2周(图6a)。结果表明,对nkg2a的阻断降低了肝脏和血清中的病毒水平(图6b),并且其与升高的肝脏nk细胞活性(图6c)和hcv特异性t细胞应答相关(图6d),其通过使用hcv肽ns3、ns4b、ns5b、core和e2刺激t细胞后,其ifn-γ分泌水平体现。上述结果表明,靶向nkg2a能够打破nk细胞和hcv特异性t细胞应答耐受,起到清除病毒的效果。
由于人hla-e或小鼠qa-1作为配体与nkg2a相互作用以限制nk功能,进一步检测了hcv感染过程中nkg2a的配体的表达情况。通过检测hcv感染小鼠后不同时间点肝组织中qa-1的转录水平发现,qa-1又主要表达于肝实质细胞而非免疫细胞,并且qa-1的表达水平在hcv感染后发生显著上调(图7a)。因此,进一步检测了使用qa-1的抗体进行拮抗是否能够抑制或逆转nk细胞的耗竭。结果表明,相较于对照组,施用qa-1的阻断抗体(克隆号6a8.6f10.1a6,购于bdpharmigen公司)抑制hcv感染的c/o-tg小鼠中的hcv复制(图7b),并伴随着nk细胞功能的恢复(图7c)和cd8+t细胞功能的恢复(图7d)。
另一方面,研究了对免疫检查点分子的表达进行抑制是否能促进hcv的清除。对此,在hcv感染的c/o-tg小鼠中,通过尾静脉注射(图8a)递送针对qa-1的胆固醇缀合的sirna(序列:gaagaggaggagacacaua,由genepharma公司合成),其选择性地下调肝细胞中的qa-1(图8b)。结果表明,对肝细胞上qa-1表达下调抑制了hcv的复制(图8c),并逆转了nk细胞的耗竭过程(图8d)。总之,这些结果表明免疫检查点分子qa-1/nkg2a的相互作用损害nk细胞功能并导致其耗竭,其促进了hcv持续性感染的建立,而靶向上述免疫检查点分子能够逆转该过程,促进病毒的清除。
实施例5.靶向nk细胞而非t细胞上的nkg2a促进hcv的清除
由于nkg2a也在部分t细胞中表达,进一步研究了nk细胞还是t细胞上的nkg2a表达对于形成持续性hcv感染是重要的。为了验证nk细胞在该过程中的作用,在hcv感染的c/o-tg小鼠中在使用抗nkg2a处理之前对nk细胞进行了删除(图9a)。结果显示,在没有nk细胞的情况下,使用抗体对nkg2a进行阻断不能恢复hcv特异性t细胞活性(图9b),并且小鼠中hcv病毒的水平显着升高(图9c)。而在存在nk细胞的情况下,nkg2a抗体能够恢复hcv特异性t细胞活性并促进hcv的清除。因此,通过抗nkg2a恢复hcv特异性t细胞的细胞毒性将取决于nk细胞。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于lmp-1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于bcg1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于pap抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hm1.24抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hcv1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于afp抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hpve6抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hbv2抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hbv1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于ck19抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图