一种靶向肿瘤相关成纤维细胞的携载阿霉素的脂质纳米级超声造影剂及其制备方法与流程
本发明涉及一种纳米级超声造影剂,具体涉及一种靶向肿瘤相关成纤维细胞并且携载阿霉素的脂质纳米级超声造影剂及其制备方法与应用,属于超声分子影像学技术领域。
背景技术:
药物递送系统(drugdeliverysystem,dds)使药物选择性聚集于肿瘤组织,避免了传统药物治疗的全身系统毒性及生物利用率低等不足,虽然众多dds在体外实验中可以显著抑制肿瘤细胞,但是在体内实验或临床前期实验中疗效并不明显。研究表明,肿瘤微环境的存在是阻碍这些dds发挥疗效的重要原因。
肿瘤微环境包括细胞外基质、成纤维细胞及免疫细胞等,其中,肿瘤相关成纤维细胞(cancer-associatedfibroblasts,caf)是肿瘤微环境的主要细胞成份,其比例可达50%~70%。caf是由正常成纤维细胞受到肿瘤细胞所分泌的转化生长因子β1(transforminggrowthfactor,tgf-β1)等激活分化而成,其鉴别主要依靠形态学结合表面标志物,比如α-平滑肌肌动蛋白(α-smoothmuscleactin,α-sma)、腱生蛋白(tenascinc,tnc)等。caf不仅阻碍化疗药物或dds进入肿瘤内部,而且通过分泌多种细胞因子参与肿瘤组织的生长、侵袭及免疫抑制。因此,caf正成为抗肿瘤治疗的新靶点。
选择合适的靶向受体是抗caf治疗的前提,caf细胞表达并分泌的tnc蛋白在多数肿瘤组织中高表达(比如前列腺癌、乳腺癌、肝癌等),而在正常组织不表达。因此,tnc是抗caf治疗的合适靶向受体,目前为止有数篇研究以tnc为靶点进行了相关dds研究,并验证了各种配体的靶向性,包括短肽、tnc抗体、dna适体等。其中,短肽fh具有分子量小、靶向性高等优势,成为抗caf治疗的潜在配体。
靶向干预caf对于肿瘤治疗意义重大,目前也有众多靶向caf的dds被研制和应用,但是在靶向超声造影剂领域尚未见到有相关研究。实际上,靶向超声造影剂有其独特的优势,其不仅作为一种dds靶向定位输送药物,而且在超声(ultrasound,us)辐照下实现可视化治疗及增强治疗。显而易见,靶向caf的超声造影剂将为肿瘤治疗提供一种新策略。
技术实现要素:
针对目前尚无靶向caf超声造影剂相关研究的问题,本发明提供了一种靶向肿瘤相关成纤维细胞(caf)并且携载阿霉素的脂质纳米级超声造影剂及其制备方法。以脂质为壳膜材料、全氟丙烷为内核气体制备纳米级超声造影剂,该造影剂显像能力优良,生物安全性高,具有较强的caf靶向结合能力。
本发明还验证了上述靶向肿瘤相关成纤维细胞(caf)并且携载阿霉素的脂质纳米级超声造影剂在靶向杀伤caf细胞方面的效果。
术语解释:
肿瘤相关成纤维细胞:(cancer-associatedfibroblasts,caf),是肿瘤微环境的最主要基质细胞成份,其比例可达50%-70%,是由正常成纤维细胞受到肿瘤细胞所分泌的转化生长因子β1(tgf-β1)等激活分化而成,通过分泌多种细胞因子参与肿瘤组织的生长、侵袭及免疫抑制。
阿霉素:doxorubicin(dox),是一种抗肿瘤抗生素,可抑制rna和dna的合成,对rna的抑制作用最强,抗瘤谱较广,对多种肿瘤均有作用,属周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用。
dspe-peg-fh:二硬脂酰基磷脂酰乙醇胺-聚乙二醇-fh短肽。
dspe-peg-nhs:nhs活泼酯化的二硬脂酰基磷脂酰乙醇胺-聚乙二醇。
fh短肽(fh-pro):能够与肿瘤相关成纤维细胞特异性表达的腱生蛋白(tnc)高亲和力结合的多肽配体,氨基酸序列为fhkhkspalspvggg。
dmf:二甲基甲酰胺(n,n-dimethylformamide)。
tea:三乙基胺(triethylamine)。
tfa:三氟乙酸(trifluoroaceticacid)。
fh-nb:fh短肽修饰的靶向纳米微泡造影剂。
nb:无靶向修饰的纳米微泡造影剂。
dppc:二棕榈酰磷脂酰胆碱。
dspe-peg-fitc:二硬脂酰基磷脂酰乙醇胺-聚乙二醇-异硫氰酸荧光素。
dspe-peg-nh2:二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨。
室温:25±2℃。
本发明的技术方案如下:
一种靶向肿瘤相关成纤维细胞的携载阿霉素的脂质纳米级超声造影剂的靶向材料二硬脂酰基磷脂酰乙醇胺-聚乙二醇-fh短肽(dspe-peg-fh),具有如下所示的结构:
所述靶向材料dspe-peg-fh通过氨基与羧基缩合反应制备,包括如下步骤:
将摩尔比3:1:3的dspe-peg-nhs、fh-pro、hbtu混合于无水dmf中,加入三乙胺调节ph至8~9;室温搅拌反应2h;将体积比1:2:2:95的水、1,2-乙二硫醇、三异丙基硅烷、三氟乙酸混合后,按照1:5体积比加入上述反应液中用于去除短肽的保护基团;用乙醚分离dspe-peg-fh,分离产物进行透析48h,分子量截留值=3500da;最后,终产物dspe-peg-fh冻干后保存于-20℃。
反应路线:
一种靶向肿瘤相关成纤维细胞的携载阿霉素的脂质纳米级超声造影剂,以fh短肽为靶向配体,以脂质为壳膜材料,壳膜内部包裹有阿霉素和气态氟碳;其中,脂质和阿霉素的质量比为8:0.5~2;所述纳米级超声造影剂的粒径为150~270nm。
所述的脂质包含二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨(dspe-peg-nh2)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-异硫氰酸荧光素(dspe-peg-fitc)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-短肽(dspe-peg-fh),质量比例为1~10:1:~5:0.1~1:0.1~1。
根据本发明优选的,脂质和阿霉素的质量比为8:1.5。
根据本发明优选的,所述的脂质中dppc、dspe-peg-nh2、dspe-peg-fitc、dspe-peg-fh,质量比例为5:2:0.5:0.5。
根据本发明优选的,所述纳米级超声造影剂的平均粒径为218nm。
一种靶向肿瘤相关成纤维细胞的携载阿霉素的脂质纳米级超声造影剂的制备方法,包括步骤如下:
(1)称取0.1ml丙二醇、0.1ml甘油置于1.5mlep管中,加入脂质:5mgdppc、2mgdspe-peg-nh2、0.5mgdspe-peg-fitc,0.5mgdspe-peg-fh,pbs定容至1ml;
(2)向步骤(1)混合液中通入气态氟碳置换出空气,将离心管放置于恒温水浴锅中加热至脂质完全溶解;
(3)向步骤(2)混合液中加入阿霉素0.5-2.0mg/ml,机械振荡90s后取出,300rpm离心5min,取下层液体即为所制备的靶向肿瘤相关成纤维细胞的携载阿霉素的脂质纳米级超声造影剂。
根据本发明优选的,步骤(1)中所述的pbs为磷酸盐缓冲液,组分为:na2hpo48mm,kh2po42mm,ph7.2。
根据本发明优选的,步骤(2)中所述气态氟碳为全氟丙烷气体。
根据本发明优选的,步骤(2)中水浴温度为50℃-70℃,优选为60℃;水浴时间30min-60min,优选50min。
根据本发明优选的,步骤(3)中脂质和阿霉素的质量比为8:1.5。
以上本发明制备方法中未特别说明的均按照现有技术。
本发明的有益效果如下:
(1)本发明制备的靶向肿瘤相关成纤维细胞(caf)并且携载阿霉素的脂质纳米级超声造影剂,是以脂质材料为壳膜,阿霉素(dox)和全氟丙烷气体包裹在壳膜内部,粒径为150~270nm,平均粒径为218nm,在纳米级范围,能穿过肿瘤组织血管壁间隙,对于肿瘤的治疗具有靶向性和高效性。
(2)本发明制备的靶向肿瘤相关成纤维细胞(caf)并且携载阿霉素的脂质纳米级超声造影剂具有优良的增强显像能力,生物安全性高,能够有效靶向结合caf细胞。
(3)本发明利用超声辐照的方式,一方面可以实现靶向纳米级超声造影剂显影,另一方面可以借助超声辐照产生的声孔效应促进阿霉素更多的进入细胞内,实现诊疗一体化。
(4)本发明制备的靶向肿瘤相关成纤维细胞(caf)并且携载阿霉素的脂质纳米级超声造影剂联合超声靶向破坏微泡(utmd)能特异性杀伤caf细胞,有利于肿瘤疾病的治疗。
附图说明
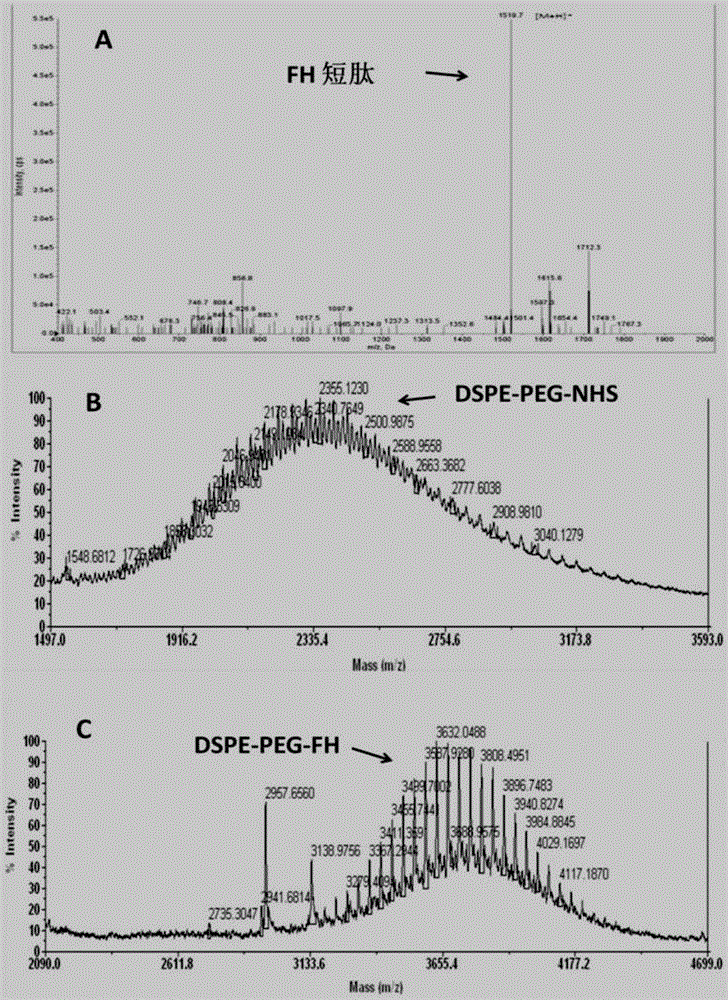
图1是靶向材料dspe-peg-fh合成的质谱鉴定,a图为fh短肽质谱结果,b图为原材料dspe-peg-nhs质谱结果,c图为dspe-peg-fh质谱结果;
图2是纳米级超声造影剂的表征检测,a为模式图,b为光镜图,c为荧光显微镜图,d为纳米粒径分布图,e为dox包封率,f为dox携载率;
图3是纳米级超声造影剂生物安全性检测;
图4是纳米级超声造影剂体外显影图;
图5是caf细胞模型建立,a为不同剂量tgf-β1、不同时间点免疫印迹结果,b~d为a图对应的柱状分析;
图6是纳米级超声造影剂靶向能力分析,a~d分别表示靶向纳泡(fh-nb)、无靶向纳泡(nb)靶向结合caf细胞、wpmy-1细胞荧光结果,e~h为对应的各组流式细胞检测;
图7是纳米级超声造影剂联合utmd实现特异性杀伤caf细胞,a为dox半数致死剂量(ic50),b为caf条件培养基对pc-3细胞的增殖影响,c图为条件培养基刺激模式图,d图为处理后caf细胞存活率,e图为对应的条件培养基对pc-3细胞活性影响。
具体实施方式
下面结合实施例对本发明做进一步说明,但不限于此。
二棕榈酰磷脂酰胆碱购自sigma-aldrich,产品编号p0763;二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨基购自西安瑞禧,产品编号r0042;二硬脂酰基磷脂酰乙醇胺-聚乙二醇-异硫氰酸荧光素购自西安瑞禧,产品编号r0055;阿霉素购自索莱宝,产品编号d8740。
实施例1:靶向材料dspe-peg-fh的合成及鉴定
靶向材料dspe-peg-fh的合成:
通过氨基与羧基缩合反应制备靶向材料dspe-peg-fh。将dspe-peg-nhs、fh短肽、hbtu按照一定比例(摩尔比3:1:3)混合与无水dmf中,加入三乙胺调节ph至8~9。室温温和搅拌反应2h。将水、1,2-乙二硫醇、三异丙基硅烷、三氟乙酸(1:2:2:95,v/v/v/v)混合后,按照1:5体积比加入上述反应液中,用于去除短肽的保护基团,用乙醚分离dspe-peg-fh,分离产物进行透析48h,分子量截留值=3500da。最后,终产物dspe-peg-fh冻干后保存于-20℃。
靶向材料dspe-peg-fh的鉴定:
采用基质辅助激光解吸电离飞行时间质谱(maldi-tofms)鉴定终产物。图1a显示fh短肽分子量为1500,图1b显示dspe-peg-nhs分子量为2300,图1c显示靶向材料dspe-peg-fh分子量为3800(等于fh短肽、dspe-peg-nhs分子量之和),表明材料合成正确。
实施例2:靶向caf并且携载dox的脂质纳米级超声造影剂的制备
(1)称取0.1ml丙二醇、0.1ml甘油置于1.5mlep管中,加入5mgdppc、2mgdspe-peg-nh2,0.5mgdspe-peg-fitc、0.5mg实施例1制备的dspe-peg-fh,pbs定容至1ml;所述的pbs为磷酸盐缓冲液,组分为:na2hpo48mm,kh2po42mm,ph7.2;
(2)向步骤(1)混合液中通入全氟丙烷置换出空气,将离心管放置于60℃恒温水浴锅中加热至脂质完全溶解;
(3)向步骤(2)混合液中加入dox(0.5、1.0、1.5、2.0mg/ml),机械振荡90s后取出,300rpm离心5min,取下层液体即为所制备的纳米级超声造影剂。
图2a所示为靶向caf并且携载dox纳米级超声造影剂模式图及所用材料。
取上述制备的纳米级超声造影剂,稀释后滴加到载玻片上,通过光学显微镜及荧光显微镜观察造影剂的表观形貌,结果如图2b所示,1000×光学显微镜下可见造影剂均呈球形,粒径均一,分散均匀无聚集;图2c所示,fitc图为绿色,dox图为红色,fitc/dox图为黄色表示fitc与dox叠加,说明造影剂成功携载dox。
取上述制备的纳米级超声造影剂,稀释后使用纳米激光粒度仪检测超声造影剂的粒径,结果如图2d所示,造影剂的粒径为150~270nm,造影剂的平均粒径为218nm。
为了优化dox的包封率及携载率,dox选择了4个初始浓度,即0.5,1.0,1.5,2.0mg/ml,通过分析,dox浓度为2mg/ml时,携载率上升趋势减缓,而包封率下降趋势增快,因此选择1.5mg/ml为后续实验浓度。
实施例3:纳米级超声造影剂体外显影能力测定实验
将实施例2制备的纳米级超声造影剂置于琼脂凝胶制成的圆孔中,采用gelogiqe9超声诊断仪的造影模式,频率9.0mhz,机械指数(mi)0.12,二维与超声造影模式同步观察,调节参数设置,用超声仪内部工作站存储图像资料,以pbs为对照组。图3结果显示纳米级超声造影剂组出现增强显像,而对照pbs组未出现增强显像。
实施例4:纳米级超声造影剂生物安全性评价
以1×104个/孔将caf细胞接种于96孔板中,加入培养基,37℃、5%co2孵育培养24h,分别加入脂质浓度为0、25、50、100、200、400ug/ml的新鲜培养基,孵育24h后,将培养基换成含有10ulcck-8的新鲜培养基,继续孵育1~4h,用酶标仪在450nm波长处检测其光吸收值。图4结果显示当脂质浓度为400ug/ml时,细胞活性受到明显抑制,而在常用脂质浓度<50ug/ml时均未出现明显的细胞毒性(细胞存活率>98%),提示脂质材料纳米微泡的生物安全性高。
实施例5:建立caf细胞模型
肌成纤维细胞wpmy-1来源于人正常前列腺周围组织基质细胞,在tgf-β1等生长因子刺激下高表达caf细胞相关表型,因此可作为caf细胞模型。首先,分别给予wpmy-1细胞不同剂量tgf-β1(0,0.1,0.5,2.5,5,10ng/ml),及不同时间点(0,2,4,12,24,48h),24h后提取细胞总蛋白检测tnc表达水平,确定最佳刺激浓度及最佳时间点;然后,获取wpmy-1刺激后条件培养基,加入前列腺肿瘤细胞pc-3中,通过检测pc-3细胞增殖率间接证实caf细胞模型是否成功。
如图5所示,通过免疫印迹实验发现,tgf-β1浓度为5ng/ml,时间点为12h时,tnc表达水平均处于最高水平,为接下来实验确定最佳剂量及时间点;图7b所示,与正常条件培养基(normalmedium)、wpmy-1条件培养基(wpmy-1cm)相比,caf条件培养基(cafcm)显著增加pc-3细胞增殖率(143.1%vs.100%;143.1%vs.103.1%),间接表明wpmy-1细胞成功激活为caf细胞。
实施例6:caf靶向并且携载dox纳米级超声造影剂靶向能力分析
caf细胞以1×106个/孔接种于6孔板,待细胞生长至50%~70%密度时,加入fitc标记的caf靶向纳米级超声造影剂(fh-nb),共孵育培养30min后,用pbs洗去未结合的造影剂。分别用荧光显微镜及流式细胞仪分析造影剂靶向能力。同时,以未激活wpmy-1细胞(低表达tnc)、无靶向纳纳米级造影剂(nb)作为对照。
荧光显微镜及流式细胞仪结果显示:与nb相比,fh-nb与caf靶向结合更强(图6c,6d,6g,6h,93.8%vs.3.55%);fh-nb与caf的靶向结合明显高于wpmy-1细胞(图6c,6a,6g,6e,93.8%vs.15.0%)。提示该靶向纳米级超声造影剂能靶向结合caf细胞,靶向结合能力与细胞tnc表达水平正相关。
实施例7:caf靶向并且携载dox纳米超声造影剂联合超声辐照特异性杀伤caf细胞
首先通过剂量-细胞活性曲线确立dox的半数致死剂量(ic50),然后再进行细胞杀伤检测,caf细胞以1×106个/孔接种于6孔板,待细胞生长至50%~70%密度时,分别给予不同处理(pbs,dox,dox+us,nb-dox,nb-dox+us,fh-nb-dox,fh-nb-dox+us),超声辐照参数为:声强1.0w/cm2,时间60sec。cck-8检测各处理组细胞活性。并获取各组条件培养基,加入pc-3细胞并分析生存率(图7c)。
结果显示:doxic50为5.8ng/ml(图7a),各组caf细胞杀伤结果如下fh-nb-dox+us>nb-dox+us>freedox+us>freedox>fh-nb-dox>nb-dox>pbs(图7d)。在超声辐照各组细胞存活率,fh-nb-dox+us(12.1%)明显低于nb-dox+us(30.7%)、dox+us(51.6%),表明fh-nb-dox能靶向结合并促进dox杀伤caf细胞。另外,超声辐照各组细胞杀伤效果均显著高于无超声辐照组(fh-nb-dox+us,12.1%vs.fh-nb-dox,72.8%;nb-dox+us,30.7%vs.nb-dox,75.2%),表明超声辐照在超声纳米泡靶向治疗中的重要性。其次,与dox组相比,fh-nb-dox、nb-dox组细胞存活率明显增高(55.1%vs.72.8%,75.2%),表明作为药物递送系统,超声纳米泡能避免dox的系统毒性。pc-3细胞生存率分析间接验证了上述实验结果(图7e)。
- 还没有人留言评论。精彩留言会获得点赞!