植入式微型生物传感器的制作方法
[0001]
本发明是有关于一种生物传感器,特别是指一种植入式微型生物传感器。
背景技术:
[0002]
糖尿病病患人口呈快速增长,随之益发强调需监控体内葡萄糖(glucose)的变化,所以许多研究开始朝向研发可植入体内进行连续式葡萄糖监控(continuous glucose monitoring,cgm)的系统,以解决一天需反复多次的采血与检测为患者生活上所带来的不便。连续式葡萄糖监控系统的基本架构包含生物传感器(biosensor)与发射器(transmitter),其中生物传感器用以量测体内对应于葡萄糖浓度的生理讯号,且大多运用电化学方式,也就是以葡萄糖氧化酵素(glucose oxidase,gox)催化葡萄糖反应生成葡萄糖酸内酯(gluconolactone)与还原态酵素,后续还原态酵素将与体内生物流体中的氧气进行电子转移进而生成副产物过氧化氢(h2o2),最后借由催化副产物h2o2的氧化反应来量化葡萄糖浓度,其反应式如下。
[0003]
glucose+gox(fad)
→
gox(fadh2)+gluconolactone gox(fadh2)+o2→
gox(fad)+h2o2[0004]
在上述反应中,fad(黄素腺嘌呤二核苷酸,flavin adenine dinucleotide)为gox的活性中心。
[0005]
然而,血液或组织液中若存在如维他命c的主要成分-抗坏血酸(ascorbic acid,aa)、常见止痛药成分-乙酰氨酚(acetaminophen,am)、尿酸(uric acid,ua)、蛋白质或葡萄糖类似物等干扰物且其氧化电位接近h2o2的氧化电位时便会影响葡萄糖量测的讯号,使得连续式葡萄糖监控系统在实际操作上难以确保测定数值能真实反应受测者的状态以及维持讯号的长期稳定度。目前相应的解决方法可借由设置高分子膜进行筛除,或以多工作电极搭配酵素覆盖的有无或覆盖有不同酵素的方式,进而施加电压而由各工作电极读取多个讯号。最后,针对前述多个讯号进行处理,便可获得较为准确的待测分析物的生理参数,但前者往往无法完全筛除干扰物,而后者增加制程的复杂度。
[0006]
除了须避免干扰物影响外,生物传感器一般选用银/氯化银作为参考电极或兼具参考电极功能的对电极的材料,但氯化银在参考电极或对电极上不可被消耗殆尽且需具备一安全库存量,使得生物传感器维持于一稳定的检测环境中进行生理讯号的量测,并使生理讯号与待测分析物生理参数间达到一稳定的比例关系。
[0007]
然而,氯化银不只会因解离(dissolution)而导致氯离子流失,进而造成参考电位飘移,更会因银/氯化银作为对电极材料而参与氧化还原反应,使氯化银还原为银而被消耗。由此可知,生物传感器的使用寿命往往受限于参考电极或对电极上的氯化银含量,目前也有许多针对此问题所提出的发明。以两电极系统为例,在平均感测电流20纳安培(na)下对电极容量(capacity)的消耗约为每日1.73毫库伦(mc),也就是说,若欲将生物传感器埋置于皮表下进行连续16天的葡萄糖监控,至少需具备27.68mc的容量,所以现有技术尝试拉长对电极的长度至大于10mm。但为了避免植入深达皮下组织,此等生物传感器需以斜角方
式植入,进而造成植入伤口较大、较高感染风险等问题,且植入时的痛感也较显著。
[0008]
据此,在配合微型化连续式葡萄糖监控系统发展的前提下,如何研发出能同时提升量测精准度、延长使用寿命,并兼顾制程简化、降低成本等等需求的生物传感器,为业界亟欲达成的目标。
技术实现要素:
[0009]
本发明的目的在于提供一种具备量测精准度、可延长使用寿命且可连续监控的植入式微型生物传感器。
[0010]
本发明植入式微型生物传感器的第一态样,用于量测生物体内的一种分析物的一个生理参数,且包含:
[0011]
至少一个对电极,包含银/卤化银;
[0012]
一个第一工作电极,包括一个第一感测段;
[0013]
一个化学试剂层,至少包覆该第一感测段的一部分,以与该生物体内的分析物反应产生一个生成物,该第一感测段于该期间内的至少一个t1时段受一个第一电压差驱动而执行一个量测动作,以量测对应该分析物生理参数的一个生理讯号;以及
[0014]
至少一个第二工作电极,包括一个邻设于该第一感测段的第二感测段;
[0015]
该第二工作电极的该第二感测段于该期间内的至少一个t2时段受一个第二电压差驱动而执行一个去干扰动作以消耗该生物体内的干扰物;
[0016]
该第二工作电极于该期间内的至少一个t3时段配合该对电极并使该对电极被驱动而执行一个再生动作以再生该卤化银。
[0017]
在本发明植入式微型生物传感器的第一态样中,该第一电压差使该第一工作电极的电位高于该对电极的电位。
[0018]
在本发明植入式微型生物传感器的第一态样中,该第二电压差使该第二工作电极的电位高于该对电极的电位。
[0019]
在本发明植入式微型生物传感器的第一态样中,该对电极受一个第三电压差驱动而使该对电极的电位高于该第二工作电极的电位。
[0020]
在本发明植入式微型生物传感器的第一态样中,该t1时段与该t3时段为不重叠。
[0021]
在本发明植入式微型生物传感器的第一态样中,该t1时段与该t2时段至少部分重叠。
[0022]
在本发明植入式微型生物传感器的第一态样中,该第一感测段表面包含第一导电材料,该第二感测段包含不同于该第一导电材料的第二导电材料,且当该第一工作电极受该第一电压差驱动而使该第一导电材料对该生成物具有第一灵敏度时,该第二工作电极受该第二电压差驱动而使该第二导电材料对该生成物具有小于该第一灵敏度的第二灵敏度。
[0023]
在本发明植入式微型生物传感器的第一态样中,该第一导电材料为贵金属、贵金属的衍生物或前述的组合,该贵金属是选自于金、铂、钯、铱或前述的组合,且该第一电压差为0.2v至0.8v。
[0024]
在本发明植入式微型生物传感器的第一态样中,该第二导电材料为碳,且该第二电压差为0.2v至0.8v。
[0025]
在本发明植入式微型生物传感器的第一态样中,该第一工作电极的第一感测段受
该第一电压差驱动而形成一个量测范围,而该第二工作电极的第二感测段受该第二电压差驱动而形成一个去干扰范围,且该去干扰范围接触该第一感测段周遭并可至少部分重叠于该量测范围。
[0026]
在本发明植入式微型生物传感器的第一态样中,该第二感测段以一个间隙邻设于该第一感测段的至少一个侧边,且该间隙不大于0.2mm。
[0027]
在本发明植入式微型生物传感器的第一态样中,该第二感测段以其一个侧边沿着该第一感测段的周缘延伸而设置,且该第一感测段的周缘中邻设有该第二感测段的部分占该第一感测段的总周长的30%~100%。
[0028]
在本发明植入式微型生物传感器的第一态样中,该至少一个第二工作电极的数目为两个,且所述第二工作电极的所述第二感测段分别邻设于该第一工作电极的该第一感测段的相对两侧边。
[0029]
在本发明植入式微型生物传感器的第一态样中,该植入式微型生物传感器还包含一个基板,其中该基板包含一个第一表面与一个相反于该第一表面的第二表面,且该第一感测段与该第二感测段均设置于该第一表面,而该对电极设置于该第二表面。
[0030]
在本发明植入式微型生物传感器的第一态样中,该植入式微型生物传感器是以垂直于该生物体皮表的方式被部分植入于该生物体皮表下并具有长度不大于6mm的一个植入端。
[0031]
本发明植入式微型生物传感器的第二态样,用以于一个期间内量测生物体内的一种分析物的一个生理参数且包含:
[0032]
至少一个对电极,包含银/卤化银;
[0033]
一个第一工作电极,包括一个第一感测段;
[0034]
一个化学试剂层,至少包覆该第一感测段的一部分,以与该生物体内的分析物反应产生一个生成物;
[0035]
该第一感测段于该期间内的至少一个t1时段受一个第一电压差驱动而执行一个量测动作,以量测对应该分析物生理参数的一个生理讯号;
[0036]
该第一工作电极于该期间内的至少一个t3时段配合该对电极并使该对电极被驱动而执行一个再生动作以再生该卤化银;以及至少一个第二工作电极,包括一个邻设于该第一感测段的第二感测段,该第二工作电极的该第二感测段于该期间内的至少一个t2时段受一个第二电压差驱动而执行一个去干扰动作以消耗该生物体内的干扰物。
[0037]
在本发明植入式微型生物传感器的第二态样中,该t1时段与该t3时段为不重叠。
[0038]
在本发明植入式微型生物传感器的第二态样中,该t1时段与该t2时段至少部分重叠。
[0039]
在本发明植入式微型生物传感器的第二态样中,该第一感测段表面包含第一导电材料,该第二感测段包含不同于该第一导电材料的第二导电材料,且当该第一工作电极受该第一电压差驱动而使该第一导电材料对该生成物具有第一灵敏度时,该第二工作电极受该第二电压差驱动而使该第二导电材料对该生成物具有小于该第一灵敏度的第二灵敏度。
[0040]
在本发明植入式微型生物传感器的第二态样中,该第二感测段以一个间隙邻设于该第一感测段的该至少一个侧边,且该间隙不大于0.2mm。
[0041]
本发明的有益效果在于:本发明植入式微型生物传感器因包含该第一工作电极、
该至少一个第二工作电极及该至少一个对电极,并透过该第一感测段与该第二感测段的位置设计与特定时序操作,使得该植入式微型生物传感器可以执行量测并降低干扰物影响,更可藉由对该对电极施加电压差的方式进行卤化银的再生作业,且上述三种作业还可以依据实际需求进行调整变化,也让该植入式微型生物传感器具备量测精准度、可延长使用寿命并可连续且稳定地监控分析物的生理参数。
附图说明
[0042]
图1是一个结构示意图,说明本发明实施例1的植入式微型生物传感器;
[0043]
图2是一个局部剖面示意图,说明沿图1的线ii-ii进行剖面的结构;
[0044]
图3是一个局部剖面示意图,说明沿图1的线iii-iii进行剖面的结构;
[0045]
图4是一个局部剖面示意图,说明沿图1的线iv-iv进行剖面的结构;
[0046]
图5是一个局部剖面示意图,说明实施例1的第一感测段与该第二感测段之间的作用;
[0047]
图6是一个结构示意图,说明实施例1的变化结构;
[0048]
图7是一个局部剖面示意图,说明沿图6的线vii-vii进行剖面的结构;
[0049]
图8是一个俯视示意图,说明实施例1的第二表面的结构变化;
[0050]
图9是一个局部剖面示意图,说明沿图8的线ix-ix进行剖面的结构;
[0051]
图10是一个局部俯视示意图,说明实施例1的第一表面的结构变化;
[0052]
图11是一个局部剖面示意图,说明沿图10的线xi-xi进行剖面的结构;
[0053]
图12是一个局部剖面示意图,说明沿图10的线xii-xii进行剖面的结构;
[0054]
图13是一个局部俯视示意图,说明实施例1的第一表面的结构变化;
[0055]
图14是一个局部剖面示意图,说明沿图13的线xiv-xiv进行剖面的结构;
[0056]
图15是一个局部剖面示意图,说明沿图13的线xv-xv进行剖面的结构;
[0057]
图16是一个俯视示意图,说明本发明实施例2的植入式微型生物传感器;
[0058]
图17是一个局部剖面示意图,说明沿图16的线xvii-xvii进行剖面的结构;
[0059]
图18是一个局部剖面示意图,说明沿图16的线xviii-xviii进行剖面的结构;
[0060]
图19是一个局部剖面示意图,说明沿图16的线xix-xix进行剖面的结构;
[0061]
图20是一个局部剖面示意图,说明实施例2的第一感测段与该两个第二感测段之间的作用;
[0062]
图21是一个俯视示意图,说明实施例2的第一工作电极的第一感测段与第二工作电极的第二感测段之间的结构变化;
[0063]
图22是一个俯视示意图,说明实施例2的第一工作电极的第一感测段与第二工作电极的第二感测段之间的结构变化;
[0064]
图23是一个局部剖面示意图,说明沿图22的线xxiii-xxiii进行剖面的结构;
[0065]
图24是一个局部结构示意图,说明本发明实施例3的植入式微型生物传感器;
[0066]
图25是一个局部剖面示意图,说明沿图24的线xxv-xxv进行剖面的结构;
[0067]
图26是一个局部剖面示意图,说明沿图24的线xxvi-xxvi进行剖面的结构;
[0068]
图27是一个结构示意图,说明实施例3的结构变化;
[0069]
图28是一个局部剖面示意图,说明沿该图27的线xxviii-xxviii进行剖面的结构;
[0070]
图29是一个示意图,说明实施例3制造流程中的步骤(a1)、(a2)及(a3);
[0071]
图30是一个局部剖面示意图,说明沿图29的(a3)的线xxx-xxx进行剖面的第二表面结构;
[0072]
图31是一个局部剖面示意图,说明沿图29的(a3)的线xxxi-xxxi进行剖面的第二表面结构;
[0073]
图32是一个结构示意图,说明本发明实施例4的植入式微型生物传感器;
[0074]
图33是一个局部剖面示意图,说明沿图32的线xxxiii-xxxiii进行剖面的结构;
[0075]
图34是一个局部剖面示意图,说明沿图32的线xxxiv-xxxiv进行剖面的结构;
[0076]
图35是一个俯视示意图,说明本发明实施例5的植入式微型生物传感器;
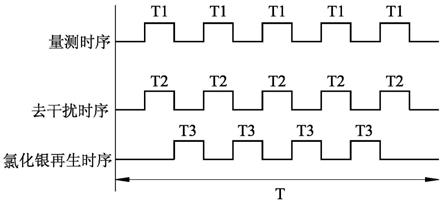
[0077]
图36是一个电路图,说明应用例1的电路设计;
[0078]
图37是一个时序示意图,说明应用例1的操作时序;
[0079]
图38是一个时序示意图,说明应用例2的操作时序;
[0080]
图39是一个时序示意图,说明应用例3的操作时序;
[0081]
图40是一个电路图,说明应用例4的电路设计;
[0082]
图41是一个电路图,说明应用例4的另一电路设计;
[0083]
图42是一个时序示意图,说明应用例4的操作时序;
[0084]
图43是一个量测曲线图,说明应用例1于体外去干扰实验的结果,当该第二工作电极的去干扰功能被开启时,曲线c1为第一感测段所测得的电流讯号,曲线c2为第二感测段所测得的电流讯号;曲线c3为该第二工作电极的去干扰功能未被开启时于第一感测段所测得的电流讯号;
[0085]
图44是一个量测曲线图,说明应用例1在不执行去干扰动作的状况下体内葡萄糖浓度随时间变化的量测结果,其中虚线框部分为药物干扰期间,曲线a代表第一工作电极量测结果,而数个数值点c代表通过现有检测试片搭配分析仪而获得的葡萄糖浓度值;
[0086]
图45是一个柱状图,说明图44中于药物干扰与无药物干扰下进行量测的误差结果;
[0087]
图46是一个量测曲线图,说明在执行去干扰动作的状况下体内葡萄糖浓度随时间变化的量测结果,其中虚线框部分为药物干扰期间,曲线a代表第一工作电极量测结果,曲线b代表第二工作电极量测结果,而数个数值点c代表通过现有检测试片搭配分析仪而获得的葡萄糖浓度值;及
[0088]
图47是一个柱状图,说明图46中于药物干扰与无药物干扰下进行量测的误差结果。
具体实施方式
[0089]
本文中所提到的「分析物」泛指任何存在于生物体内的待测物质,例如但不限于葡萄糖、乳糖(lactose)、尿酸等,于本发明的具体例中,该分析物是以葡萄糖为主;而较佳地,该植入式微型生物传感器为植入式葡萄糖传感器,且更佳地应用于量测人体组织间液(interstitial fluid,isf)中的葡萄糖浓度,也就是本文中所提到的「生物流体」可为但不限于组织间液,而「生理参数」可为但不限于浓度。
[0090]
本文中的「至少一个」表示一个或多个的数量。
[0091]
本发明将就以下实施例作进一步说明,但应了解的是,该实施例只为例示说明的用途,而不应被解释为本发明实施的限制。
[0092]
在本发明被详细描述前,应当注意在以下的说明内容中,类似的组件是以相同的编号来表示。
[0093]
[植入式微型生物传感器的电极结构及其制程]
[0094]
<实施例1>
[0095]
图1为本发明实施例1的植入式微型生物传感器的结构示意图。在实施例1中,该植入式微型生物传感器的第一表面分为一个用于与发射器(图未示)连接的第一讯号输出区a、一个用于量测该生物体内的分析物生理参数(如浓度,在实施例1中就是葡萄糖浓度)的第一感测区c及一个连接该第一讯号输出区a与该第一感测区c的第一讯号连接区b。该植入式微型生物传感器是以垂直于该生物体皮表的方式被部分植入于该生物体的皮表下并具有一个植入端,且该植入端至少包含该第一感测区c。具体地,该植入端的长度至少需满足到真皮层并可量测到组织液中葡萄糖的深度,其长度可不大于6mm,较佳为不大于5mm,更佳为不大于4.5mm,或又更佳为不大于3.5mm,以避免让生物体产生异物感,更具备形成伤口较小、可降低痛感等优点。更具体地,该第一感测区c的长度可介于2mm至6mm之间,较佳地介于2mm至5mm之间,更佳地介于2mm至4.5mm之间,或又更佳地介于2mm至3.5mm之间,而该第一感测区c的宽度例如但不限于0.01mm至0.5mm,较佳为小于0.3mm。
[0096]
请同步参考图2至图4,图2至图4分别显示实施例1的植入式微型发射器于第一感测区c、第一讯号输出区a及第一讯号连接区b的结构。实施例1的植入式微型生物传感器包含:一个基板1、一个第一工作电极2、一个第二工作电极3、一个对电极4、一个用以与该生物体内葡萄糖反应进而产生过氧化氢的化学试剂层6、及一个绝缘层单元7[含有一个第一绝缘层71及一个第二绝缘层72,请参图4]。
[0097]
该基板1包括一个第一表面11(也就是前述植入式微型生物传感器的第一表面),及相反于该第一表面11的第二表面12。该基板1的材质可选用任何已知适合使用于电极基板的材质且较佳具备可挠性及绝缘性质,例如但不限于:聚酯(polyester)、聚酰亚胺(polyimide)等高分子材质,前述高分子材质可以单独使用一种或者混合多种使用。
[0098]
参阅图1至图4,该第一工作电极2设置于第一表面11上,且包括一个位在该第一感测区c并为该化学试剂层6所覆盖的第一感测段20、位在该第一讯号连接区b的第一连接段21及位在该第一讯号输出区a的第一输出段22。在图1中,该第一工作电极2的第一感测段20表面(也就是实际参与反应的表面)至少含有一第一导电材料1c,该第一感测段20受第一电压差驱动而由该第一导电材料1c与过氧化氢(为该化学试剂层6与葡萄糖反应所生成者)反应产生一个电流讯号,且当该电流讯号的数值与过氧化氢浓度具有比例关系时获得对应该葡萄糖浓度的一个生理讯号。该第一导电材料1c包含但不限于:碳、铂、铝、镓、金、铟、铱、铁、铅、镁、镍、钼、锇、钯、铑、银、锡、钛、锌、硅、锆、前述元素的混合物、或前述元素的衍生物(如合金、氧化物或金属化合物等)。较佳地,该第一导电材料1c为贵金属、贵金属的衍生物或前述的组合。
[0099]
该第二工作电极3设置于该第一表面11并包括一个邻设于该第一感测段20且位在该第一感测区c的第二感测段30、位在该第一讯号连接区b的第二连接段31及位在该第一讯号输出区a的第二输出段32。于图1中,该第二工作电极3的第二感测段30表面至少含有第二
导电材料2c,该第二感测段30受一个第二电压差驱动而由该第二导电材料2c消耗掉生物体内的至少部分干扰物。该第二导电材料2c同样可使用如上述第一导电材料1c所例举的元素或其衍生物。
[0100]
请参考图5,当该第一工作电极2经该第一电压差驱动时,该第一感测段20不只会在其表面产生一量测范围1s并会与该范围内的过氧化氢反应产生电流讯号,该第一导电材料1c同时也会与体内生物流体中干扰物反应而产生一个干扰电流讯号,且该干扰电流讯号将与该电流讯号混合输出而对该生理讯号造成干扰。而该第二工作电极3经该第二电压差驱动时,其第二感测段30表面会因电化学反应的发生而开始产生浓度梯度变化,进而形成至少一个去干扰范围2s并如前文所述消耗掉生物体内的干扰物,尤其是趋近该第二感测段30表面的干扰物。于此同时,因该第二感测段30邻近于该第一感测段20,使得该去干扰范围2s会接触该第一感测段20周遭并可至少部分重叠于该量测范围1s,以同步消耗该第一感测段20的该量测范围1s内的干扰物。较佳地,为使该去干扰范围2s能够充分地消耗该量测范围1s内的干扰物,在该第一感测区c中,该第二工作电极3的第二感测段30是以一个间隙邻设于该第一工作电极2的该第一感测段20的至少一个侧边,且该间隙不大于0.2mm,以有效降低该干扰物对该葡萄糖浓度量测的干扰;更佳地,该间隙范围为0.01mm至0.2mm;又更佳地,该间隙范围为0.01mm至0.1mm;再更佳地,该间隙范围为0.02mm至0.05mm。
[0101]
再者,当该第二工作电极3经第二电压差驱动时,该第二导电材料2c也有机会与过氧化氢反应而产生另一电流讯号,但却消耗掉原应由该第一工作电极2进行感测并借以推知分析物浓度的过氧化氢,进而影响实际被测得的分析物浓度。因此,该第一导电材料1c更佳地需选用经第一电压差驱动后对于过氧化氢具有第一灵敏度的电极材料,且又更佳地,前述可作为该第一导电材料1c的该贵金属是选自于金、铂、钯、铱或前述的组合。而该第二导电材料2c需不同于该第一导电材料1c,且具体来说,需选用经第二电压差驱动后对于过氧化氢具有小于第一灵敏度的第二灵敏度的电极材料,更具体地需选用经第二电压差驱动后对于过氧化氢几乎不具灵敏度的电极材料,例如但不限于碳、镍、铜等。于实施例1中,该第一导电材料1c为铂,而第一电压差范围建议为0.2伏特(v)至0.8伏特(v),且较佳为0.4v至0.7v。于实施例1中,该第二导电材料2c为碳,而第二电压差范围建议为0.2v至0.8v,且较佳为0.4v至0.7v。此外,该第一电压差可与该第二电压差相同,但本发明并不以此为限。
[0102]
再者,请参考图6说明,尽管图1所绘示的实施例1中第一工作电极2位于该第一感测区c内的部分均包含有第一导电材料1c,但是只有该第一感测区c内的部分该第一工作电极2包含第一导电材料1c同样可行。
[0103]
回到图1,该植入式微型生物传感器的第二表面分为一个第二讯号输出区d、一个第二讯号连接区e及一个第二感测区f。该对电极4设置于该基板1的第二表面12(也就是前述该植入式微型生物传感器的第二表面)上,且包含包括一个位在该第二感测区f的第三感测段40、位在该第二讯号连接区e的第三连接段41及位在该第二讯号输出区d的第三输出段42,以配合该第一工作电极2进行该生理讯号的量测,以及配合该第二工作电极3进行该干扰物的消耗。基于满足上述两个配合作业下,该对电极4并不限定设置于该第二表面12上,也可选择地设置于该第一表面11上,但当将该对电极4设置于第二表面12时具有缩减植入式微型生物传感器的宽度的效果。此外,该对电极4可选择地配合该第一工作电极2或该第二工作电极3而被驱动,以再生该卤化银。
[0104]
在实施例1中,形成该对电极4表面的材料包含银/卤化银r,使该对电极4兼具参考电极的功能,也就是本发明的对电极4可以在与第一工作电极2形成电子回路,使第一工作电极2上电流畅通,以确保电化学反应在工作电极2上发生之余,还能提供稳定的相对电位作为参考电位。较佳地,实施例1中该卤化银为氯化银,但在其他实施例中也可以为碘化银。为了进一步降低成本以及提高本发明的生物传感器的生物兼容性,可以只有该第三感测段40表面包含该银/卤化银r。或者,如图6,可仅第二感测区f内的部分第三感测段40表面包含该银/卤化银r。此外,该第三感测段40表面也可为该银/卤化银与碳(例如碳胶)的混合物,至于银/卤化银与碳之间的比例以让对电极4能稳定执行设定的量测动作为主要条件。
[0105]
不过,在该对电极4的第三感测段40中卤化银的含量比例仍须在一个安全区间内,以让该卤化银不会被全部消耗,才能让该生物传感器维持在稳定的检测环境中进行生理讯号的量测。因此,请参考图7,为了避免卤化银在生物体内环境剥离,更可于该第三感测段40表面所露出的该银/卤化银r上至少一部分覆盖以第三导电材料3c,并借由该第三感测段40的侧边或表面未被覆盖的该银/卤化银进行感测。前述的「至少一部分覆盖」是指部分覆盖或全部覆盖。较佳地,该第三导电材料3c为例如但不限于碳,也可为银,或其他不影响该对电极4的感测表现的导电材料。除此之外,如欲满足微型化的设计,同时让卤化银含量维持在安全区间内,本发明也可通过施加一个第三电压差于该对电极4与该第一工作电极2或该第二工作电极3之间,使该对电极4的电位高于该第一工作电极2或该第二工作电极3的电位,进而再生该卤化银并维持该卤化银于该对电极4的第三感测段40中的含量于一个安全区间内。具体地,以对电极4上银与卤化银的总重为100wt%,银与卤化银分别占其总重的比例可例如但不限于95wt%:5wt%、70wt%:30wt%、60wt%:40wt%、50wt%:50wt%、40wt%:60wt%、30wt%:70wt%或5wt%:95wt%等。也就是说,该卤化银的含量与该银/卤化银总重间具有一个比值,且该比值大于0且小于1,较佳为介于0.01-0.99之间,更佳为介于0.1-0.9之间,又更佳为介于0.2-0.8之间,再更佳为介于0.3-0.7之间或介于0.4-0.6之间。详细的操作方法及其再生原理将于后文一并说明,在此暂不赘述。
[0106]
回到图2,该化学试剂层6是至少包覆该第一感测段20的一部分的该第一导电材料1c。于实施例1中,该化学试剂层6不只覆盖该第一感测段20,同时也覆盖该第二感测段30及间隙的一部分或全部及该基板1的该第二表面12上的对电极4的第三感测段40,也就是说该化学试剂层6全面包覆该植入式微型生物传感器的至少部分该第一感测区c及第二感测区f[如图1所示]。该化学试剂层6包含至少一种与该分析物产生反应或促使该分析物反应的酵素,该酵素例如但不限于:葡萄糖氧化酵素、葡萄糖脱氢酶(glucose dehydrogenase)等。
[0107]
同样地,如图1与图4所示,在需露出以分别进行讯号感测以及讯号输出的感测区(包含第一感测区c及第二感测区f)与讯号输出区(包含第一讯号输出a及第二讯号输出区d)以外,必须对该植入式微型生物传感器的讯号连接区(包含第一讯号连接区b及第二讯号连接区e)内的第一连接段21、第二连接段31及第三连接段41进行绝缘,所以该第一绝缘层71是位于第一讯号连接区b,并覆盖该第一工作电极2的第一连接段21及第二工作电极3的第二连接段31;而该第二绝缘层72位于第二讯号连接区e,但用以覆盖该基板1的该第二表面12上的该对电极4的第三连接段41,且该第二绝缘层72的长度并不需等同于该第一绝缘层71的长度。形成该绝缘层单元7的材料可为任何绝缘材料,例如但不限于聚对二甲苯(parylene)、聚酰亚胺(polyimide)、聚二甲基硅氧烷(pdms)、液晶高分子材料(lcp)或是
microchem的su-8光阻等。等。该绝缘层单元7的第一绝缘层71与第二绝缘层72的层结构可为一层或多层。此外,该化学试剂层6除了包覆该第一感测段20、该第二感测段30与该第三感测段40外,甚至可包覆部分该第一绝缘层71与该第二绝缘层72。
[0108]
虽然图未显示,但在前述化学试剂层6、第一绝缘层71与第二绝缘层72外还可包覆有一高分子限制层,以限制多余物质进入植入式微型生物传感器而影响葡萄糖浓度的量测。
[0109]
此外,再次检视图1,植入式微型生物传感器的该基板1的该第一表面11的第一讯号输出区a与该第二表面12的第二讯号输出区d内还可包含数个电性接触部8,且具体地,所述电性接触部8的其中两个可作为一组开关,用以在一个发射器耦接至该微型生物传感器时启动该发射器的电源,又或者所述电性接触部8可作为数据传输的媒介,但本发明中该电性接触部8的数量及其功能不受限于前述说明。
[0110]
参阅图8及图9,实施例1所揭示的植入式微型生物传感器也可包含一个设置在该基板1的该第二表面12上的参考电极9,且该参考电极9同样包括一个位在该第二感测区f的第四感测段90、一个位在该第二讯号连接区e的第四连接段91及一个位在该第二讯号输出区d的第四输出段92,而该银/卤化银r则可至少设置于该第四感测段90的表面。
[0111]
实施例1中植入式微型生物传感器的电极结构已大致说明如上,其中该第一工作电极2与该第二工作电极3的细部叠层结构及其可能的变化例将搭配制造方法进一步说明如后。
[0112]
较佳地,参阅图1至图4,该植入式微型生物传感器的制造方法包括以下步骤:
[0113]
(a)提供一基板1,其含有第一表面11;
[0114]
(b)形成一第一工作电极2于该基板1的第一表面11上,使该第一工作电极2至少包含一第一感测段20,且该第一感测段20包含一第一导电材料1c;
[0115]
(c)形成至少一第二工作电极3于该基板1的第一表面11上,使该第二工作电极3至少包含一第二感测段30,其中该第二感测段30邻设于该第一感测段20的至少一侧边并包含与该第一导电材料1c不同的一第二导电材料2c;
[0116]
(d)形成一对电极4于该基板1,以配合该第一工作电极2测定该目标分析物的生理参数;以及
[0117]
(f)形成一化学试剂层6,使该化学试剂层6至少盖覆于该第一感测段20的该第一导电材料1c上,以与该目标分析物反应以产生一生成物。
[0118]
具体地,该基板1的该第一表面11可划分为该第一讯号输出区a、该第一讯号连接区b与该第一感测区c,而该步骤(b)及(c)进一步包括以下步骤:首先,在该基板1的第一表面11上铺设该第二导电材料2c[步骤(a)]。接着,基于预设的该第一工作电极2与该第二工作电极3的形状、位置、长度、面积等设计图案化该第二导电材料2c[步骤(b)],定义出相互分离的一第一区块与至少一第二区块。最后,形成该第一导电材料1c于该第一感测区c内并覆盖至少部分的该第一区块的该第二导电材料2c以完成该第一工作电极2的该第一感测段20[步骤(d)]的制备。此时,该第二区块的该第二导电材料2c定义为该第二工作电极3,并可区分为位于该第一讯号输出区a的第二输出段32、位于该第一讯号连接区b的第二连接段31以及位于该第一感测区c的第二感测段30。也就是说,经由实施例1的制造方法所制成的植入式微型生物传感器的该第一感测段20与该第二感测段30均位于该第一感测区c内。
[0119]
更具体地,参阅图10、图11及图12,其分别绘示依据前述制造方法所制备而得的植入式微型生物传感器结构的俯视图、其沿图10的线xi-xi进行剖面的结构及其沿图10的线xii-xii进行剖面的结构。在实施例1中,借由步骤(b)使第二导电材料2c划分为左右相间隔且呈长条形的第一区块与第二区块,且第二导电材料2c于第一区块内是由该第一感测区c经由该第一讯号连接区b延伸至该第一讯号输出区a(请参考图1),但借由步骤(d)可使该第一导电材料1c只覆盖在该第一感测区c内的该第二导电材料2c上,此时如图11所示,该第一工作电极2的该第一感测段20实质上包含设置在该基板1的该第一表面11上的一层第二导电材料2c及覆盖于该第二导电材料2c上的第一导电材料1c,而该第一工作电极2的该第一连接段21可只由一层第二导电材料2c所构成,如图12所示。该第二工作电极3则如前段所述只由一层第二导电材料2c所构成。在其他变化例中,也可借由调整步骤(d)使第一导电材料1c只覆盖在该第一感测区c内的部分该第二导电材料2c上,如图6所示。在其他变化例中,也可借由调整步骤(b)与步骤(d)使第一导电材料1c不只覆盖在整个第一感测区c内的第二导电材料2c上,甚至延伸至部分第一讯号连接区b的第二导电材料2c上。在其他变化例中,更可借由调整步骤(b),使第二导电材料2c虽同样划分为左右相间隔且呈长条状的第一区块与第二区块,但第一区块的第二导电材料2c的长度短于第二区块的第二导电材料2c的长度,且更具体地,第一区块的第二导电材料2c只位于该第一讯号输出区a与该第一讯号连接区b内。接着,借由步骤(d)使第一导电材料1c形成于该第一感测区c并以其一部分覆盖在该第一讯号连接区b内的第二导电材料2c上以使该第一感测段20耦接至该第一输出段22。
[0120]
如图13至图15所示,在其他变化例中,该第一导电材料1c也可覆盖在所有的该第二导电材料2c上,此时该第一感测段20以及该第一连接段21,甚至于该第一输出段22的层结构均至少包含一层第二导电材料2c与一层完全覆盖该第二导电材料2c的第一导电材料1c。同样地,该第二工作电极3则如前段所述只由一层第二导电材料2c所构成。此外,本发明的植入式微型生物传感器中该第一工作电极2与该第二工作电极3的细部结构可不以前述制程所能获得者为限,该第一工作电极2也可只由第一导电材料1c所构成,而不包含第二导电材料2c。
[0121]
该基板1的该第一表面11上的该第一讯号输出区a、该第一讯号连接区b以及该第一感测区c的位置及其涵盖范围可借由设置绝缘层的方式来定义。在实施例1中,该步骤(b)还包含一于该步骤(b)之后的步骤(c),该步骤(c)是形成一第一绝缘层71于该基板1的第一表面11上,以定义该第一讯号连接区b(第一绝缘层71所在区域)、该第一感测区c(未被该第一绝缘层71覆盖并用以被植入于该生物体皮表下,及该第一讯号输出区a(未被该第一绝缘层71覆盖并用以耦接至该发射器的区域)。在第一讯号连接区b中,该第一工作电极2的第一连接段21及该第二工作电极3的第二连接段31的层结构至少包含一层第二导电材料2c。
[0122]
较佳地,该步骤(b)是使该第二感测段30以不大于0.2mm的间隙邻设于该第一感测段20的至少一侧边。
[0123]
较佳地,上述步骤(a)是利用一网版印刷制程来完成,而上述步骤(b)是利用一蚀刻制程来完成,且更佳地步骤(b)为利用一激光雕刻制程来完成。上述步骤(d)为用以形成一导电材料层的步骤,其可利用一溅镀制程,但较佳是经由一电镀制程来完成。
[0124]
上述步骤(f)是将形成该第一工作电极2与该第二工作电极3的该基板1插入含有该化学试剂的溶液中,使得所形成的该化学试剂层6同时盖覆于该第一感测段20的该第一
导电材料1c、该第二感测段30的该第二导电材料2c与该对电极4的该第三感测段40上。
[0125]
另可选择地,该植入式微型生物传感器的制造方法还包括一于该步骤(f)之前的步骤(e):形成一第三电极(图未示)于该基板上且与该对电极4及该第一工作电极2分开设置。该第三电极可为参考电极或第三工作电极。该步骤(d)及(e)的细部步骤及层结构态样请见下述实施例3及4。
[0126]
又另可选择地,该植入式微型生物传感器的制造方法还包括一于该步骤(f)之前的步骤(g),该步骤(g)是形成一第二绝缘层72于该基板1的第二表面12,以定义一位于该第二表面12的第二感测区f。
[0127]
该制造方法不限于前述所提到的顺序与步骤,前述步骤可以依据实际需要进行顺序调整。实施例1的制造方法具有以下优点:(1)在同一感测区内制作出表面材质不同的两个感测段,后续利用同一化学试剂层为一次性包覆就可以,相较于先前技术中利用不同酵素或酵素的有无来去除干扰物而言具有制程简化的效果;(2)该第一工作电极2、该第二工作电极3各别的形状与尺寸,乃至于该第一工作电极2与该第二工作电极3之间的配合及其间隙等均可利用图案化程序精准控制;(3)该基板1的第二表面12的制程可以依据后续需求进行变化。
[0128]
<实施例2>
[0129]
请参考图16至图19,实施例2的植入式微型生物传感器的结构与实施例1结构大致相同,不同处在于:为有效降低该干扰物对该生理讯号的量测干扰至一误差范围内,实施例2的第二感测段30是以一间隙邻设于该第一感测段20的至少三个侧边,也就是该第二感测段30是以该间隙环绕该第一感测段20的至少三个侧边。较佳地,该间隙不大于0.2mm,但该间隙范围更佳为0.02mm至0.05mm。更具体地,该第二感测段30是以其一侧边沿着该第一感测段20的周缘延伸并弯折而呈u型环绕该第一感测段20的至少三侧边。此时,如图20所示,该第二感测段30至少分别在该第一感测段20的相对两个侧边形成两个去干扰范围2s,且所述去干扰范围2s分别都接触于该第一感测段20的周遭并重叠于该量测范围1s,进而消耗掉趋近于该第一感测段20的该量测范围1s内的干扰物。较佳地,该误差范围为20%以下,又更佳为10%以下。
[0130]
实施例2的微型生物传感器的制造方法大致与实施例1相同,不同处在于:该步骤(b)中图案化第二导电材料2c是使该第二区块的第二导电材料2c从该第一讯号输出区a往该第一感测区c延伸并于该第一感测区c内弯折而呈u型并将该第一区块的第二导电材料2c围绕于其u型结构的开口之间。因此,在此步骤(b)中第二工作电极3的第二感测段30的构形及其环绕第一感测段20的程度可通过图案化第二导电材料2c时定义完成。在其他变化例中,该第一感测段20与第二感测段30的位置关系也可以如图21的(a)及(b)所示,也就是当该第二感测段30以其一侧边沿着该第一感测段20的周缘延伸而设置时,该第一感测段20的周缘中邻设有该第二感测段30的部分占该第一感测段20的总周长的30%~100%而使该第二感测段30呈i型(如实施例1所示)、l型或前述的u型。
[0131]
又或者,在其他变化例中,该第二感测段30可环绕该第一感测段20的四个侧边[如图22所示]。详细来说,该第一连接段21及该第一输出段22是设置于该第二表面12上,以及该第一感测段20的一部分设置于该第一表面11上,另一部分是自该基板1的第一表面11穿过该第二表面12并沿着该第二表面12延伸而朝向该第一连接段21的方向设置[如图23所
示]。
[0132]
<实施例3>
[0133]
如图24至图26所示,实施例3的植入式微型生物传感器的结构与实施例2结构大致相同,不同处在于:实施例3的植入式微型生物传感器还包含一与该对电极4彼此间隔地设置于第二表面12上的参考电极9,且该参考电极9表面至少包含银/卤化银r。为了提供足够的容量并调整该银/卤化银的用量,该对电极4的面积大于该参考电极9的面积。
[0134]
进一步详细说明,如图24所示,该对电极4具体地是设置于该基板1的该第二表面12上且于植入式微型生物传感器的该植入端的该第二感测区f内设计有一沿着植入方向(也就是前文所述的垂直于该生物体皮表并朝向该生物体皮表移动的方向)延伸设置的前端部40a及一远离该植入方向(接近该第二讯号连接区e)的后端部40b。在实施例3中,该对电极4的第三感测段40由该前端部40a与该后端部40b所组成。该参考电极9是与该对电极4间隔设置且包括一同样位于该植入端的该第二感测区f的第四感测段90,其中,该第四感测段90的面积小于该第三感测段40的面积。具体地,该对电极4的该前端部40a与该后端部40b为分别邻设于该参考电极9的该第四感测段90相邻的两侧边而使该对电极4实质上呈l型,而该参考电极9的该第四感测段90位于该l型结构的凹口处。更具体地,该第四感测段90的宽度与该对电极4的后端部40b的宽度的总和小于该对电极4的该前端部40a的宽度。此外,第一绝缘层71与第二绝缘层72的长度可为相同,此时如图26所示,该化学试剂层6可一致性地包覆在第一感测段20、第二感测段30、第三感测段40与第四感测段90上。
[0135]
在一变化态样中,如图27及图28所示,第一绝缘层71与第二绝缘层72的长度不同,进而造成该第一感测区c的长度较该第二感测区f的长度短,所以,将该基板1插入含有该化学试剂的溶液时,可使得化学试剂层6只覆盖于该第一感测段20、第二感测段30及该第三感测段40的前端部40a,而该参考电极9的第四感测段90表面可不被该化学试剂层6覆盖。
[0136]
在另一变化态样中,如同前文所述,该参考电极9的第四感测段90表面的该银/卤化银可至少部分被第三导电材料3c覆盖,以减少卤化银露出的面积并进而降低其因解离而流失的机率;此时,该参考电极9改由其露出的侧边或未被该第三导电材料3c所覆盖的表面配合该第一工作电极2、该对电极4进行感测。较佳地,该第三导电材料3c为碳。
[0137]
在实施例3中,该微型生物传感器的制造方法与该实施例2类似,不同处在于:该步骤(d)是形成一对电极4于该第二表面12上,并使该对电极4包括一位于该第二感测区f的第三感测段40,该第三感测段40含有该前端部40a及该后端部40b;以及该步骤(e)是形成一参考电极9于第二表面12上,并使该参考电极9与该对电极4间隔设置且包括一位于该第二感测区f的第四感测段90。该对电极4与该参考电极9的结构配置已如前文所述便不再赘述。
[0138]
在此必须先说明的是,在准备将植入式微型生物传感器运送出工厂出售之前,实施例1或实施例2中的对电极4或本实施例中的参考电极9上可以没有卤化银(即卤化银的初始量为0),而是仅先铺上银。在微型生物传感器植入生物体体内后,利用后续的氯化银再生步骤将涂布在对电极4或参考电极9上的银氧化为银离子后,银离子便会结合体内的氯离子而形成氯化银于对电极4或参考电极9上,当对电极4或参考电极9上的银/氯化银达到一定比例后便可稳定参与量测的动作。因此,参考图29,在达成前述结构的其中一种制法中,该步骤(d)及(e)包括以下步骤:(a1)形成一衬底材料层l于该基板1的第二表面12上;(a2)铺设一参考电极材料(也就是前文所述的银/卤化银r)或其前驱物p(也就是银)于部分该衬底
材料层l上;(a3)于该第二表面12上针对该衬底材料层l及该参考电极材料或其前驱物p进行图案化制程,以定义出相互分离且不电连接的一第三区块与一第四区块,其中该第三区块是作为该对电极4。具体地,借由该步骤(a2)可轻易地控制对电极4与参考电极9的反应面积或其彼此之间配合的构形,以及电极表面上银/卤化银所在的位置、所占面积的大小,进而可简单地完成对电极4与参考电极9的制程并控制银/卤化银用量。具体地,在该步骤(a3)之后,该第三区块中该衬底材料层l具有不同的宽度,以该植入方向来看,朝向该植入方向延伸设置且具有较大宽度者为该对电极4的该前端部40a,而远离该植入方向且具有较小宽度者为该对电极4的该后端部40b。此外,该参考电极材料或该前驱物p的一部分或全部是位于该第四区块。此时,若该步骤(a2)中铺设的是该参考电极材料,则所铺设处就是该参考电极9的该第四感测段90,但若该步骤(a2)中铺设的是该参考电极材料的前驱物,则需再进行步骤(a4)使位于该第四区块的前驱物转变为该参考电极材料,以作为该参考电极9的该第四感测段90,且此时该基板1的该第二表面12沿着图29的线xxx-xxx进行剖面的剖面示意图则如图30所示,其中该对电极4的该后端部40b为一包含一层衬底材料层l及其上覆盖的一层前驱物p的叠层结构,而该参考电极9的该第四感测段90则为一包含一层衬底材料层l及其上覆盖的一层银/卤化银r的叠层结构。至于该对电极4的该前端部40a的结构则可如图31所示,其为该基板1的该第二表面12沿着图29的线xxxi-xxxi进行剖面的剖面示意图,只由一层衬底材料层l所构成。
[0139]
在实施例3中,在该步骤(a3)之后,该参考电极材料或该前驱物p的一部分是位于该第四区块,该前驱物p的另一部分是位于该第三区块,而后续的该步骤(a4)只将该第四区块内的该前驱物p转为该参考电极材料,但残留于该第三区块内的该前驱物p不影响该对电极4后续量测的表现。但在一变化态样中,该步骤(a3)之后的该前驱物p可全部是位于该第四区块。
[0140]
虽图未示,前述结构也可通过另一种制法来完成,该步骤(d)及(e)包括以下步骤:(b1)形成一衬底材料层l于该基板1的第二表面12上;(b2)于该第二表面12上针对该衬底材料层l进行图案化制程,以定义出相互分离且不电连接的一第三区块与一第四区块,其中,该第三区块是作为该对电极4;及(b3)形成一参考电极材料或一参考电极材料的前驱物p于至少部分的该第四区块上,以使该第四区块作为参考电极9。此时,若该步骤(b3)中铺设的是该参考电极材料,则所铺设处为该参考电极9的该第四感测段90,但若该步骤(b3)中铺设的是该参考电极材料的前驱物p,则需另外进行步骤(b4),也就是使位于该第四区块的前驱物p转变为该参考电极材料,以作为该参考电极9的该第四感测段90。
[0141]
较佳地,该衬底材料层l可包含银、碳、银/卤化银、前述的混合物、或前述的叠层结构。具体地,该衬底材料层l可只为一层碳,所以该对电极4的该第三感测段40可只包含碳。更具体地,该衬底材料层l的该碳层与该基板1的该第二表面12之间具有一银层,使得该衬底材料层l实质上为一叠层结构。
[0142]
<实施例4>
[0143]
如图32所示,实施例4的植入式微型生物传感器的结构与实施例3结构大致相同,不同处在于:实施例4的植入式微型生物传感器中该对电极4兼具参考电极的功能,而该参考电极9替换为一第三工作电极5。该第三工作电极5的材料及层结构可参照该第一工作电极2或该第二工作电极3,且于实施例4中,该第三工作电极5的层结构与实施例1的该第一工
作电极2相同,也就是由碳作为底层并于碳的表面上形成铂。除了实施例4的结构设计外,该第三工作电极5也可选择地设置于第一表面11上,也就是该第三工作电极5与该对电极4可选择地在同一表面或不同表面上。此外,第三工作电极5的配置不单单可按实施例3的构形,即便是按图8的构形也为可行。
[0144]
详细来说,参阅图33及图34,在实施例4中,该微型生物传感器的制造方法与该实施例3类似,不同处在于:该步骤(e)是形成一第三工作电极5于第二表面12上,并使该第三工作电极5与该对电极4间隔设置且包括一位于该第二感测区f的第四感测段50,其中,该第四感测段50的一侧边是与该对电极4的后端部40b平行间隔设置,而该第四感测段50中相邻于该侧边的另一侧边是与该对电极4的前端部40a平行间隔设置。也就是说,该对电极4的该前端部40a与该后端部40b分别邻设于该第四感测段50的相邻两侧边,而使得该对电极4实质上呈l型结构。
[0145]
较佳地,该步骤(d)包括以下步骤:(c1)形成一衬底材料层于该基板1的第二表面12上;(c2)于该第二表面12上定义出相互分离的一第三区块与一第四区块,其中,该第三区块是作为该对电极4。具体地,该第三区块的该衬底材料层l具有不同的宽度,以该植入方向来看,朝向该植入方向延伸设置且具有较大宽度者为该对电极4的该前端部40a,而远离该植入方向且具有较小宽度者为该对电极4的该后端部40b;(c3)形成一参考电极材料或一参考电极材料的前驱物p于第三区块的部分该衬底材料层l上,且具体地是设置在该对电极4的该前端部40a上;(c4)若步骤(c3)中铺设的是该参考电极材料的前驱物p,则使该前驱物p转变为一参考电极材料,以使该对电极4的该前端部40a作为该对电极4的该第三感测段40并兼具有参考电极的功能。
[0146]
较佳地,该步骤(c1)的衬底材料层包含银、碳、银/卤化银、前述的混合物、或前述的叠层结构,而该步骤(c3)中该参考电极材料的前驱物p为银。
[0147]
综合以上制程来看,该对电极4的层结构可选择地为一层、两层或三层。当该对电极4为两层结构时,如前文所述的结构态样例如:该对电极4含有一层设置于该基板1上的导电材料层(例如但不限于碳),以及覆盖于该导电材料层上的银/卤化银层,在制程与后续的应用中,该导电材料的设置可避免将银转变成卤化银时因过度卤化而绝缘的问题。
[0148]
前述导电材料层为碳时,更可于该导电材料与该基板1的该第二表面12之间设置另一导电材料层(例如但不限于银),以降低当碳直接设置在该基板1的该第二表面12上可能造成该植入式微型生物传感器的该讯号输出区d的阻抗过高的问题。此时,该对电极4为一个三层结构。
[0149]
又或可选择地,该对电极4可只为单一层结构,也就是该步骤(c1)的衬底材料层l可选自于银/卤化银、银/卤化银与导电材料的混合物、或银与导电材料的混合物,且该导电材料较佳地为碳。此时步骤(d)中则可省略步骤(c3),最后形成只有一层由银/卤化银或银/卤化银与碳的混合物所组成的对电极4。其中,该银/卤化银与碳的用量比例只要让对电极4能稳定执行设定的操作步骤就可以。必须说明的是,将银/卤化银或银混入碳胶中来形成该衬底材料层l,可同时改善卤化制程中的绝缘问题、叠层时的附着度问题,以及高阻抗问题等。
[0150]
同样地,在实施例4中,该第一工作电极2用以进行该生理讯号的量测,该第二工作电极3用以降低体内干扰物对于该量测的干扰。然而,该卤化银再生的操作可改由该第三工
作电极5配合该对电极4来进行,也就是该第三电压差为施加于该对电极4与该第三工作电极5之间,使该对电极4的电位高于该第三工作电极5的电位,进而驱动该对电极4进行氧化反应而再生该卤化银。借此,有助于前述量测、去干扰与卤化银再生等三种操作间的效率,而其详细的操作方法将于后续实施例中说明,在此不再赘述。
[0151]
<实施例5>
[0152]
如图35所示,实施例5的植入式微型生物传感器的结构与实施例1结构大致相同,不同处在于:实施例5的植入式微型生物传感器包含两个第二工作电极3、3’(也就是该至少一第二工作电极的数量为两个)。该第二工作电极3’同样具有第二感测段30’、第二连接段31’及第二输出段32’。该两个第二工作电极3、3’的第二感测段30、30’的长度与面积可为相同或不同,且各自可以不同的间隙邻设于该第一感测段20。
[0153]
实施例5的微型生物传感器的制造方法大致与实施例1相同,不同处在于:该步骤(b)是形成两该第二区块而定义该两个第二工作电极3、3’,且该两个第二工作电极3、3’的该两个第二感测段30、30’分别邻设于该第一感测段20的相对两侧边。
[0154]
[植入式微型生物传感器的操作方法]
[0155]
<应用例1>
[0156]
以图32的实施例4为例,该植入式微型生物传感器包含基板1、第一工作电极2(其第一感测段20由一碳层与覆盖该碳层的铂所组成)、第二工作电极3(其第二感测段30呈u型环绕该第一感测段20并由一碳层所组成)、对电极4(其第三感测段40由一碳层及覆盖该碳层的银/氯化银层所组成)、第三工作电极5(其第四感测段50的结构与第一工作电极2相同)及覆盖于该第一感测段20、该第二感测段30、该第三感测段40与第四感测段50的化学试剂层6。该植入式微型生物传感器的操作方式是用以于一期间t内量测该分析物浓度,且该期间包含至少一t1时段、至少一t2时段与至少一t3时段,搭配图36进一步说明该操作方法如下:
[0157]
于t1时段进行量测步骤:使该开关s1为闭路(close)状态并施加第一电压差(例如但不限于0.5v)于该第一工作电极2与对电极4之间,使该第一工作电极2的电位v1高于该对电极4的电位v4,而由第一工作电极2进行如先前文所述的氧化反应,并与该化学试剂层6、该分析物(此应用例中为葡萄糖)进行电化学反应而获得该生理讯号i1。同时,该对电极4则进行还原反应,使该氯化银还原为银,其反应式如后:2agcl+2e
—
→
2ag+2cl
-
。此外,用以执行量测步骤的t1区段的时间可为固定值,且可为2.5秒、5秒、15秒、30秒、1分钟、2.5分钟、5分钟、10分钟或30分钟,较佳为30秒。
[0158]
于t2时段进行去干扰步骤:使该开关s2为闭路并施加第二电压差(例如但不限于0.5v)于第二工作电极3与该对电极4之间,使该第二工作电极3的电位v2高于该对电极4的电位v4,以驱动该第二工作电极3的表面进行反应,进而消耗掉该干扰物。
[0159]
于t3时段进行氯化银的再生步骤:使该开关s3为闭路并施加第三电压差于该对电极4与该第三工作电极5之间,使该对电极4的电位v4高于该第三工作电极5的电位v3,以驱动该对电极4进行氧化反应,将周遭的银氧化为银离子后与生物流体中固有的氯离子结合而再生氯化银。必须说明的是,当其他实施例中的卤化银为碘化银时,人体通过掺碘的食盐也可以取得碘离子,借此同样能通过前述再生机制来进行,以延长本发明植入式微型生物传感器的使用寿命。
[0160]
实质上借由该第一工作电极2的电位v1、该第二工作电极3的电位v2、该第三工作电极5的电位v3与该对电极4的电位v4间的数值安排,第一电压差、第二电压差、第三电压差之间的数值安排,以及该开关s1、该开关s2、该开关s3各别开路(open)或闭路的切换让该量测步骤、去干扰步骤及再生步骤可以同时进行,但该量测步骤、去干扰步骤及再生步骤也可部分同时进行或分开进行,也就是上述的t1时段、t2时段及t3时段可以完全重叠、部分重叠、或完全不重叠。此外,t1时段、t2时段及t3时段分别可为一固定时间值或一变动时间值。
[0161]
具体地,应用例1中量测、去干扰与氯化银再生的操作时序如图37所示,其中横轴为时间,纵轴为电流,其中量测时序的线条表示第一电压差的施加和移除,去干扰时序的线条表示第二电压差的施加和移除,而氯化银再生时序的线条表示第三电压差的施加和移除。详细来说,在应用例1的该期间t中包含5个t1时段、1个t2时段及4个t3时段,应用例1中所采用的操作方法为在该期间t内让开关s2(请参考图36)全程为闭路状态并使该第二工作电极3的电位v2高于该对电极4的电位v4而由该第二工作电极3进行去干扰动作。同时,在该期间t内该开关s1为循环且交替地切换于开路与闭路状态之间,使该第一工作电极2间歇地配合该对电极4进行量测动作。此外,该些t1时段中任两者之间除可借由电路断开操作之外,也可以该第一电压差为0的方式来间隔。
[0162]
再者,在本次量测动作与下次量测动作之间(也就是每两个t1时段之间)均由该对电极4配合该第三工作电极5执行氯化银的再生动作,也就是说每个t1时段与每个t3时段不重叠。
[0163]
<应用例2>
[0164]
应用例2中同样采用如图32的实施例4的植入式微型生物传感器,惟应用例2中量测、去干扰与氯化银再生的操作时序如图38所示,该量测期间t包含5个t1时段、6个t2时段及2个t3时段,其中,每个t1时段与每个t2时段不重叠,也就是当该第一工作电极2于该t1时段进行量测动作时,该第二工作电极3可借由电路断开操作或接地的方式来处理。此外,量测步骤、去干扰步骤和再生步骤不必然需要以交替循环的方式进行,也可于数次量测步骤或去干扰步骤后再进行一次再生步骤。举例而言,应用例2中该两个t3时段与该些t2时段中的两个t2时段重叠,也就是说量测两次与去干扰三次后才进行一次再生步骤。再者,第一次去干扰动作可优先于第一次量测动作进行,以有效地避免体内该干扰物对于该量测的干扰。
[0165]
<应用例3>
[0166]
应用例3中同样采用如图32的实施例4的植入式微型生物传感器,惟应用例3中量测、去干扰与氯化银再生的操作时序如图39所示,该量测期间t包含5个t1时段、6个t2时段及5个t3时段,其中,每个t1时段与每个t2时段均有部分重叠,每个t2时段与每个t3时段也均有部分重叠,但每个t1时段与每个t3时段不重叠。同样地,第一次去干扰动作可优先于第一次量测动作进行,以有效地避免体内该干扰物对于该量测的干扰,而氯化银的再生动作可于每一次量测间隔中执行,以维持该氯化银于该对电极4的该第三感测段40上的含量于安全区间内。
[0167]
<应用例4>
[0168]
与应用例1至应用例3不同的是,应用例4采用如图20的实施例2的植入式微型生物传感器。具体地,该植入式微型生物传感器包含基板1、第一工作电极2(其第一感测段20由
一碳层与覆盖该碳层的铂所组成)、第二工作电极3(其第二感测段30呈u型环绕该第一感测段20并由一碳层所组成)、对电极4(其第三感测段40由一碳层及覆盖该碳层的银/氯化银层所组成)及覆盖于该第一感测段20、该第二感测段30以及该第三感测段40的化学试剂层6。
[0169]
请参考图40,该去干扰动作为施加第二电压差于该第二工作电极3与该对电极4之间,使该第二工作电极3的电位v2高于该对电极4的电位v4,而该第二工作电极3进行氧化反应消耗该干扰物。但对于没有第三工作电极5的应用例4来说,该氯化银的再生步骤为施加该第三电压差于该对电极4与该第二工作电极3之间,并使该对电极4的电位v4高于该第二工作电极3的电位v2,也就是由该对电极4反过来扮演工作电极的角色进行氧化反应,进而达成氯化银的再生。又或者,该开关s2可选择地连接至一较高电位(也就是高于该对电极4的电位v4)以进行该去干扰动作,或一较低电位(也就是低于该对电极4的电位v4)以进行该氯化银的再生动作。又或者,如图41所示,该具有较低电位v2的第二工作电极3甚至可以进一步耦接至一控制单元u,借由该控制单元u调整每一次氯化银再生动作所能再生的量。举例来说,该对电极4中氯化银具有对应于该生理讯号的一消耗量,当该第三电压差为一固定值时,可根据该卤化银的消耗量而动态调整该氯化银的再生步骤中该第三电压差的施加时间。相反地,当该氯化银的再生步骤中该第三电压差的施加时间为一固定值时,则可根据该卤化银的消耗量而动态调整该第三电压差。
[0170]
应用例4中量测、去干扰与氯化银再生的操作时序进一步搭配图42如后。其中该期间t包含5个t1时段、5个t2时段及4个t3时段,其中,在该量测期间内该第一工作电极2为间歇进行量测动作,且在该第一工作电极2进行量测动作的同时,该第二工作电极3同步进行去干扰动作(也就是每个t1时段与每个t2时段完全重叠),以降低该干扰物对于该量测的干扰。接着,当该第一工作电极2与该第二工作电极3停止该量测动作与该去干扰动作时,由该第二工作电极3与该对电极4配合进行该氯化银的再生动作(也就是每个t3时段均与每个t1时段、每个t2时段不重叠)。也就是说,应用例4的该第二工作电极3为一两用电极,其可于t2时段配合该对电极4进行去干扰动作,也可于t3时段配合该对电极4进行该再生动作。
[0171]
<应用例5>
[0172]
应用例5同样采用如图20的实施例2的植入式微型生物传感器。与应用例4不同的是,应用例5的氯化银再生步骤为施加该第三电压差于该对电极4与该第一工作电极2之间,并使该对电极4的电位v4高于该第一工作电极2的电位v1。也就是说,应用例5的该第一工作电极2为一两用电极,其可于t2时段配合该对电极4进行去干扰动作,也可于t3时段配合该对电极4进行该再生动作。
[0173]
尽管本发明的植入式微型生物传感器的操作方法揭示如上,但仍可包含例如应用例1的变化态样:在该期间t内让开关s1(请参考图36)全程为闭路状态而使该第一工作电极2配合该对电极4全程进行该量测动作,而该开关s2可为全程闭路状态(也就是全程均开启去干扰的功能)或为循环且交替地切换于开路与闭路状态之间,使该第二工作电极3间歇地配合该对电极4进行去干扰动作。又或可包含以下态样:该t1时段与t2时段不重叠、该t2时段与该t3时段至少部分重叠的态样,本发明不以此为限。
[0174]
<去干扰试验-体外(in vitro)>
[0175]
接着,利用实施例4的植入式微型生物传感器搭配应用例1的操作方法进行体外的去干扰试验,且干扰物为乙酰氨酚(am)。具体的试验步骤为:将微型生物传感器于不同时间
区间(p1至p9)依序浸入分别含有磷酸盐缓冲生理盐水(pbs)溶液、40mg/dl葡萄糖溶液、100mg/dl葡萄糖溶液、300mg/dl葡萄糖溶液、500mg/dl葡萄糖溶液、100mg/dl葡萄糖溶液、掺入2.5mg/dl乙酰氨酚的100mg/dl葡萄糖溶液、100mg/dl葡萄糖溶液及掺入5mg/dl乙酰氨酚的100mg/dl葡萄糖溶液,实验结果如图43所示,其中当该第二工作电极3的去干扰功能未被开启时,于第一感测段20所测得的电流讯号为曲线c3,而当该第二工作电极3的去干扰功能开启时,曲线c1为第一感测段20所测得的电流讯号,曲线c2为第二感测段30所测得的电流讯号。
[0176]
从图43的曲线c3可以看出,第一感测段在pbs溶液中未有电流讯号,当葡萄糖溶液的浓度越高,电流讯号与葡萄糖浓度呈一比例关系而随之升高。然而,相较于微型生物传感器于时间区段p3的电流讯号,当将微型生物传感器于时间区段p7浸入含有2.5mg/dl乙酰氨酚的100mg/dl葡萄糖溶液时,其电流讯号显然受到乙酰氨酚的干扰而飘高。当将微型生物传感器于时间区段p9浸入含有5mg/dl乙酰氨酚的100mg/dl葡萄糖溶液时,其电流讯号受到乙酰氨酚的干扰更为明显。
[0177]
相反地,从图43的曲线c1与曲线c2可以看出,当将微型生物传感器于时间区段p7浸入含有2.5mg/dl乙酰氨酚的100mg/dl葡萄糖溶液时,其电流讯号与时间区段p3的电流表现一致,也就是说当该第二工作电极的去干扰功能被开启时该第一感测段的电流表现便不会受到乙酰氨酚的干扰,即使提高乙酰氨酚的浓度也是如此。从另一方面来看,该第二工作电极的第二感测段用以使乙酰氨酚氧化而消耗,所以其在pbs溶液、及葡萄糖溶液皆没有电流讯号,而当有乙酰氨酚时便会产生电流讯号。由此可知,当第一感测段的量测范围中有乙酰氨酚,第二感测段会消除乙酰氨酚,使第一感测段的量测不会受乙酰氨酚的干扰。借此,本发明的微型生物传感器可以量测出更准确的生理参数。
[0178]
[去干扰试验
–
体内(in vivo)]
[0179]
接着,利用实施例4的植入式微型生物传感器搭配应用例1的操作方法进行体内的去干扰试验。虽未图示,在本试验中植入式微型生物传感器可配合一底座与一发射器而构成一连续性葡萄糖监控系统,其中该微型生物传感器可借由该底座固定至该生物体皮表上并部分植入该生物体皮表下,进行对应该葡萄糖浓度的该生理讯号的量测。接着,将该发射器结合至该底座并耦接该微型生物传感器,以接收并处理该微型生物传感器所测得的该生理讯号。另外,本试验为由受测者服用2颗各500毫克(mg)的普拿疼来进行,而药物干扰期间为服用药物后的4至6个小时。
[0180]
图44为一量测曲线图,说明在不执行去干扰动作的状况下体内葡萄糖浓度随时间变化的量测结果,其中虚线框部分为药物干扰期间,曲线a代表第一工作电极量测结果,而数个数值点c代表通过现有检测试片搭配分析仪而获得的葡萄糖浓度值;图45是一柱状图,说明图44中于药物干扰与无药物干扰下进行量测的误差结果;图46为一量测曲线图,说明在执行去干扰动作的状况下体内葡萄糖浓度随时间变化的量测结果,其中虚线框部分为药物干扰期间,曲线a代表第一工作电极量测结果,曲线b代表第二工作电极量测结果,而数个数值点c代表通过现有检测试片搭配分析仪而获得的葡萄糖浓度值;图47是一柱状图,说明图46中于药物干扰与无药物干扰下进行量测的误差结果。由图44及图45结果可知,未开启去干扰功能的微型生物传感器在药物干扰期间所测得的数值显然高于现有检测试片所测得的数值,且其于无药物干扰期间的平均误差值为-0.2mg/dl,但于药物干扰期间的平均误
差值为12.6mg/dl,总误差值为6.7mg/dl,而于药物干扰期间的平均绝对相对偏差值(mean absolute relative difference,mard)为10.6。
[0181]
由图46及图47结果可知,开启去干扰功能的植入式微型生物传感器在药物干扰期间的表现基本上与现有检测试片所测得的数值一致,且其于无药物干扰期间的平均误差值为0.1mg/dl,于药物干扰期间的平均误差值为-2.1mg/dl,总误差值为-1.1mg/dl,而于药物干扰期间的mard为4.6。
[0182]
借此,本试验证实了去干扰步骤确实可以大幅降低误差,并助于提升量测精准度。
[0183]
综上所述,本发明植入式微型生物传感器因包含该第一工作电极、该至少一个第二工作电极及该至少一个对电极,并通过该第一感测段与该第二感测段的位置设计,使得该植入式微型生物传感器可以执行量测并降低干扰物影响,更可借由对该对电极施加电压差的方式进行卤化银的再生作业,且上述三种作业还可以依据实际需求进行调整变化,也让该植入式微型生物传感器具备量测精准度、可延长使用寿命并可连续且稳定地监控分析物的生理参数,确实能达成本发明的目的。
[0184]
只是以上所述者,为本发明的实施例而已,当不能以此限定本发明实施的范围,只要是依本发明权利要求书及专利说明书内容所作的简单的等效变化与修饰,皆仍属本发明专利涵盖的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1