用于产生金属硼氢化物和分子氢的方法与流程
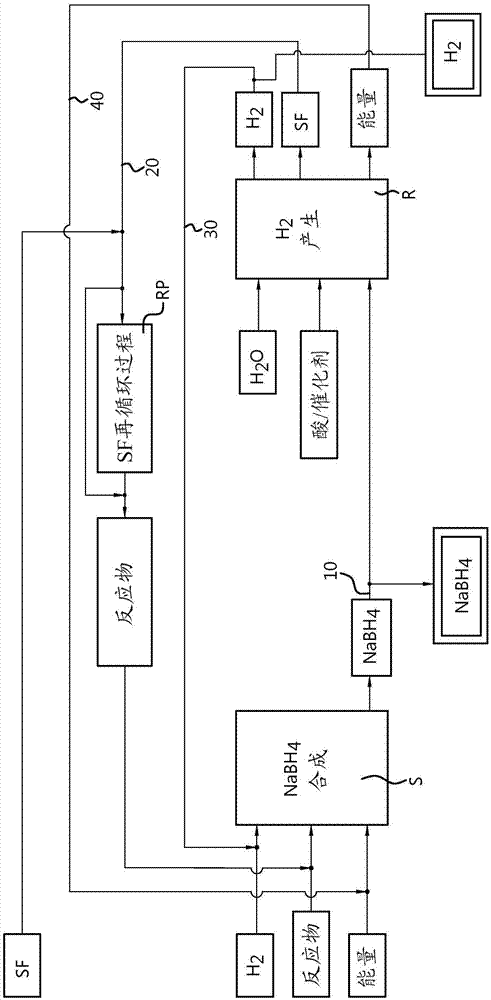
本发明涉及用于产生金属硼氢化物和H2中的至少一种的方法。本发明还涉及用于实施该方法的设备。发明背景在H2(被称为氢,氢原子将被称为原子氢)的生产、储存和运输中涉及的相当高的成本阻碍其快速且广泛的推广。仅在对于所产生的能量的每一单位而言氢价格已经普遍降低至电力、汽油、柴油、天然气等的现行价格水平(例如,每兆焦耳的成本(€/MJ))的情况下,预期发生氢的突破性进展。目前,已知三种产生氢(氢气)的生产方法:-作为另一化学过程的副产物,对此,释放氢所需要的能量是次要的;-蒸气重整技术,对此,产生氢所需要的能量为约140MJ/kgH2(141.1kJ/摩尔);以及-电解技术,对此,产生氢所需要的能量为约204.5MJ/kgH2(206.1kJ/摩尔)。当考虑氢产生的环境CO2足迹时,则仅通过使用经由诸如风、水、地热源和太阳的源产生的电力可以获得零CO2足迹。可以将核动力用作替代选择,其中鉴于安全性、储存和环境考虑,强烈优选使用钍作为燃料。在蒸气重整技术中使用生物质被认为是CO2中性的。以气体形式使用氢。其转化为热量通过使用催化剂的燃烧来完成,并且其转化为电能通常通过采用燃料室。可以观察到以下缺点:氢的低比重意味着每千克氢气燃料需要许多空间,这使得通过陆路或水路的运输成本高。将氢用于能量产生的核心问题是在目前的生产方法下其能量损失;以及当冷却或压缩氢时,在氢储存中损失能量。已经尝试通过使氢液化来解决长距离的运输问题。在实际应用中,此类技术以成本和所涉及的复杂性形式示出许多缺点。其需要许多能量来保持氢足够冷以使其保持处于液态。通常在氢储存于杜瓦瓶(Dewar)中约14天后开始蒸发,而在一般隔离的容器中将立即开始蒸发。蒸发的氢可以用作燃料以例如驱动用于运输的船舶或卡车。根据经验,在实际应用中,一方面已经将压缩氢的压力从300bar升高至700bar以具有足够的运输范围,其涉及在运输期间对于氢的储存损失约6%的氢。氢也可以储存在金属硼氢化物中,随后其可以从金属硼氢化物中释放以获得H2。产生氢的反应具有金属硼氢化物(例如,NaBH4)作为起点。已经发现了NaBH4的若干产生途径。例如,来自丹麦奥胡斯大学的BoRichter和TorbenRenéJensen已经在WO2013/182208中公开了一种方法,其中将钠转化为氢化钠,然后将所述氢化钠球磨并且使用稀释剂在低的压力和温度下与BH3偶联以获得NaBH4。进一步已知在Schlesinger型方法中合成NaBH4。美国能源部(USDoE)的研究显示,不需要遵循Schlesinger方法中的完整路径,但是可以遵循较短的路径以合成NaBH4。YingWu在2015年已经公开了电解类型的方法(https://www.hydrogen.energy.gov/pdfs/review05/st12_wu.pdf:ProcessfortheRegenerationofSodiumBoratetoSodiumBorohydrideforUseasaHydrogenStorageSource),由于不用NaCl而是用NaOH开始,其被证实是更加成本有效的。用NaOH开始由于使用全世界过剩的NaOH而也可以证实是有利的。该方法已经由YingWu在2006年于美国能源部(USDoE)的出版物中描述(https://www.hydrogen.energy.gov/pdfs/progress06/iv_b_1_wu.pdf:IV.B.1ProcessforGenerationofSodiumBoratetoSodiumBorohydrideforUseasaHydrogenStorageSource;YingWu;2006),尤其是关于该出版物的图3。在金属硼氢化物与水的反应中,许多反应产物成形为废燃料混合物。这些反应产物中的一些可以再次循环。然而,用于产生金属硼氢化物的已知方法及其作为燃料的用途在所需的能量以及废燃料的反应产物方面依然非常不足。发明概述本发明的目的是提供用于产生金属硼氢化物和H2的有利方法。本发明的另一目的或可选目的是提供用于产生金属硼氢化物和H2的方法,其提供可以容易地在所述方法内再循环的反应产物。本发明的又一目的或可选目的是提供用于产生金属硼氢化物和H2的方法,其提供最少的废产物。本发明的又一目的或可选目的是以所需的有利的量的能量来储存和产生H2。本发明的又一目的或可选目的是提供在最小的能量损失和浪费的情况下的能量储存和产生的方法。本发明的又一目的或可选目的是提供在低风险水平下储存、运输和分配能量的方法。本发明的又一目的或可选目的是提供储存、运输、分配和产生能量的方法,其可以容易地缩放(scaled)至期望的水平。通过用于产生金属硼氢化物和H2中的至少一种的方法来实现以上目的中的至少一个,所述方法包括以下步骤:A.通过以下中的至少一项在合成过程(S、S1、S2、S3)中产生金属硼氢化物,其中H2是反应物:A1.提供金属氢氧化物、B2O3和H2,以使得合成过程根据整个反应式进行并且产生金属硼氢化物,任选地产生金属硼氢化物和O24Me(OH)n+2nB2O3+6nH2→4Me(BH4)n+5nO2;以及A2.提供金属硼氧化物和H2,以使得合成过程根据整个反应式进行并且产生金属硼氢化物,尤其产生金属硼氢化物和O2Me(BO2)n+2nH2→Me(BH4)n+nO2,其中Me是金属并且n是金属离子的价态;B.在化学反应过程(R、R1、R2)中产生H2,其中在步骤A中产生的金属硼氢化物和/或金属硼氧化物与H2O是反应物,对于分别在步骤B和步骤A中作为反应物和反应产物的相同量的金属硼氢化物和金属硼氧化物,在步骤B中产生的H2的量大于在步骤A1和/或A2中作为反应物所需的H2的量;以及C.将步骤C中产生的H2提供至步骤A,以及重复步骤A、步骤B和步骤C,其中分别取出步骤A和步骤B中产生的金属硼氢化物和/或金属硼氧化物以及H2中的至少一种的一部分,同时分别留下一定量的金属硼氢化物和H2以允许重复步骤A、步骤B和步骤C。所述方法的反应机制为产生金属硼氢化物和/或H2提供非常能量有效的步骤。所述方法可以容易地从低的能量需求至非常高的能量需求进行缩放。步骤A和步骤B可以在分开的壳体中或在单个壳体内完成,并且可以在连续的“一锅”法中完成。在实施方案中,步骤A需要热量形式的能量,热量形式的能量产生于步骤B中,并且步骤B中产生的热量至少部分地被提供至步骤A。在实施方案中,选择步骤A和步骤B的过程,以使步骤B的反应产物是步骤A的反应物。在实施方案中,根据化学反应步骤的整个化学反应式中的至少一个,选择步骤A和步骤B的过程,以使步骤B的反应产物是步骤A的反应物:B1.4Me(BH4)n+10nH2O→4Me(OH)n+2nB2O3+16nH2;以及B2.Me(BH4)n+2nH2O→Me(BO2)n+4nH2。在实施方案中,选择金属硼氢化物与H2O的比率以获得以下中的至少一种-增加H2的产生速率,以及-产生为以下中的至少一种的反应产物--步骤A的反应物,以及--再循环过程的反应物,所述再循环过程产生为步骤A的反应物的反应产物。在实施方案中,金属硼氢化物中的硼氢(BH4)根与H2O的摩尔量的比率为至少BH4:H2O=2:5。在实施方案中,将催化剂和酸中的至少一种添加至步骤B中以促进化学反应过程中的至少一个化学反应,从而获得以下中的至少一项-增加H2的产生速率,以及-产生为以下中的至少一种的反应产物--步骤A的反应物,以及--再循环过程的反应物,所述再循环过程产生为步骤A的反应物的反应产物。在实施方案中,将金属氢氧化物添加至步骤B中以获得以下中的至少一种-降低H2的产生速率,以及-产生为以下中的至少一种的反应产物--步骤A的反应物,以及--再循环过程的反应物,所述再循环过程产生为步骤A的反应物的反应产物。在实施方案中,在第一设备机构中实施步骤A,在第二设备机构中实施步骤B,将一定量的金属硼氢化物从第一设备机构提供至第二设备机构,并且将一定量的H2从第二设备机构提供至第一设备机构,以用于在第一设备机构和第二设备机构中循环实施步骤A和步骤B。在实施方案中,H2O提供为超纯水(UPW)。在实施方案中,UPW满足以下中的至少一种:具有低于1μS/cm、尤其低于0.5μS/cm、尤其低于0.1μS/cm、尤其低于0.06μS/cm的电导率,以及具有电子和半导体级水ASTM类型E-1分类或更好的分类。在另一方面,本发明提供用于产生能量的方法,所述方法包括步骤-采用根据前述权利要求中任一项所述的方法产生H2;以及-提供来自前述步骤的H2以及O2以使得化学反应进行并且产生能量,所述化学反应任选地根据反应式进行H2+O2→2H2O。在又一方面,本发明提供用于产生金属硼氢化物的方法,其中所述方法包括以下步骤中的至少一个-提供金属氢氧化物、B2O3和H2,以使合成过程进行并且产生金属硼氢化物,任选地产生金属硼氢化物和O2,其中所述合成过程根据反应式进行4Me(OH)n+2nB2O3+6nH2→4Me(BH4)n+5nO2;以及-提供金属硼氧化物和H2,以使得合成过程根据整个反应式进行并且产生金属硼氢化物,尤其产生金属硼氢化物和O2Me(BO2)n+2nH2→Me(BH4)n+nO2,其中Me是金属并且n是金属离子的价态。在实施方案中,金属(Me)是锂(Li)、钠(Na)和钾(K)中的至少一种。在又一方面,本发明提供用于实施以上方法中任一项的设备。附图简述本发明的其他特征和优点将通过非限制性和非排他性实施方案由对本发明的描述而变得显而易见。这些实施方案不解释为限制保护范围。本领域技术人员将认识到,可以构思和减少本发明的其他替代和等同实施方案以在不背离本发明范围的情况下进行实践。将参考附图描述本发明的实施方案,在所述附图中,相似或相同的参考标记表示相似、相同或相应的部件,并且其中图1示出本发明的实施方案的示意图;图2A示出本发明实施方案中涉及的反应式之间的关系的图示;图2B示出本发明另一实施方案中涉及的反应式之间的关系的图示;图2C示出示意性燃料合成过程;图2D示出示意性能量产生过程;图3示出用于合成本发明实施方案中的金属硼氢化物的合成步骤的能量水平;图4示出采用YingWu提出的合成过程的本发明实施方案的示意图;图5示出采用Richter和Jensen提出的合成过程的本发明实施方案的示意图;图6示出本发明的另一实施方案的示意图;图7示出本发明的另一实施方案的示意图;图8示意性地描述所实施的实验的反应装备;图9、图10和图11示出所实施的实验的反应装备的照片;图12、图13和图14示出对所实施的三个实验监测的温度和压力的图;图15示出实验中获得的固体残余物;图16示出对实验中产生的气体进行气相色谱(GC)测量的GC图;以及图17示出对图15中示出的残余物进行X-射线衍射(XRD)测量的XRD图。具体实施方式图1示出本发明的方法的实施方案的示意图。所示实施方案中的金属硼氢化物(NaBH4)由H2和合成过程S中的一些其他反应物产生。合成过程需要能量的输入。根据合成过程中所涉及的实际部分过程,例如,可能需要压力和/或热量形式的能量来升高反应物的温度,或者可以将能量输入电解过程中。其他类型的过程还可以涉及其他类型的能量。随后金属硼氢化物被提供(如箭头10所示)至金属硼氢化物化学反应过程R,其进一步涉及H2O作为反应物。金属硼氢化物与H2O发生化学反应并且分解成包含H2的反应产物。金属硼氢化物与H2O的反应过程R中产生的H2的量大于合成过程S中为了合成与反应过程R中为了产生H2而分解的金属硼氢化物量相同的量的金属硼氢化物所用的H2的量。金属硼氢化物和H2O可以被视为用于产生H2的燃料,并且除了所产生的H2以外的反应产物可以被称为废燃料SF。将过程R中产生的H2提供为进入过程S的反应物(如箭头30所示)以再次产生金属硼氢化物,所述金属硼氢化物在过程R等中再次用于产生H2。除了过程R中产生的H2以外,也可以将废燃料SF中的反应产物提供返回至合成过程S,如箭头20所示。来自金属硼氢化物和H2O的反应过程R的废燃料SF中的反应产物可能必须首先在单独的再循环过程RP中再循环,或者可以直接用于合成过程S,也如图1所示。此外,反应过程R通常以产生的热量的形式产生能量。也可以将来自反应过程R的能量提供返回至合成过程S,如箭头40所示。可以从所述过程中取出金属硼氢化物和/或H2以在别处使用。然而,应保留一些金属硼氢化物和H2,以使得产生过程继续。可以将酸和/或催化剂提供进入反应过程R以用于H2产生,以及促进化学反应过程中的至少一个化学反应。可以选择酸和/或催化剂以获得H2的产生速率的增加,和/或产生为步骤A的反应物和/或再循环过程的反应物的反应产物,所述再循环过程产生为步骤A的反应物的反应产物。此外,还可以将金属氢氧化物添加至反应过程R以用于降低H2的产生速率,和/或产生为步骤A的反应物的反应产物,和/或再循环过程的反应物的反应产物,所述再循环过程产生为步骤A的反应物的反应产物。可以选择的另一参数为金属硼氢化物与H2O的比率。可以选择所述比率以获得H2的产生速率的增加,和/或产生为步骤A的反应物和/或再循环过程的反应物的反应产物,所述再循环过程产生为步骤A的反应物的反应产物。在实施方案中,金属硼氢化物(Me(BH4)n)中的硼氢(BH4)根与H2O的摩尔量的比率为至少BH4:H2O=2:5。因此各种参数可用于调整金属硼氢化物与H2O的反应过程中的化学反应机制,以降低H2的产生速率,以及选择有利的反应产物。在2016年3月7日提交并且援引2015年11月6日提交的Dutch专利申请NL2015742的优先权的两个Dutch专利申请中更详细地公开了此类过程,所述申请的内容通过引用并入本文。供应H2O的水的品质对于产生H2非常重要,如已在WO2010/087698A2中所示,其通过引用并入本文。所述国际公布通常公开了H2的产生方法,其中将金属硼氢化物溶于电导率为<0.5μS/cm的水中。具有如此低电导率的水的品质被鉴定为ASTM类型E-1级水(电子和半导体级水),其在本描述中被称为超纯水(UPW)。本描述中的UPW是指满足以上品质等级的水和/或电导率为<1μS/cm、尤其为<0.5μS/cm、更尤其为<0.1μS/cm和更尤其为<0.06μS/cm的水。电导率为<0,06μS/cm的水也被规定在25℃具有18.2MΩ或更大的电阻率。此外,硼氢化物燃料的此类溶液和此类使用通常在氮环境中以避免与环境空气中的CO2和H2O的任何反应。金属硼氢化物与具有如以上所述的低电导值的水形式提供的H2O非常有效地反应。也可以将金属氢氧化物(例如MeOH)溶于混合物中,以提供稳定的燃料混合物。优选地,将金属氢氧化物首先溶于UPW,此后,溶解金属硼氢化物以获得可以提供至反应过程R的燃料混合物。援引NL2015739的优先权并且较早提及的两个Dutch专利申请公开了金属硼氢化物、金属氢氧化物和超纯水的燃料混合物,以及用于由此类燃料混合物产生H2的方法。那些申请的说明书、权利要求和附图通过引用并入本公开内容。为了加速产生H2的反应,可以将混合物的pH值通过添加酸而降低至约pH=7的值。例如,HCl用作酸是有利的,尽管也可以使用其他类型的酸,例如柠檬酸。这尤其有利于燃料混合物的移动应用。在固定应用中,可以采用具有较高pH值的燃料混合物。可以另外使用催化剂或可选地使用酸用于加速金属硼氢化物与H2O的反应。将来自燃料混合物的反应的H2随后用于能量产生。可以在废燃料混合物SF中收集其他反应产物。各种再循环过程是已知的并且已经针对NaOH和废燃料中的任何反应产物进行了使用和测试,可以从中选择适当的再循环过程。金属硼氢化物已经显示与H2O反应以形成H2,对此,化学计量比产生以下基本化学反应式:该基本反应式仅表示金属硼氢化物与H2O的反应的一个途径。可以根据各种反应式由各种化学反应途径产生许多反应产物,所述反应式可以在各种环境下在使用者位置发生。在大量UPW(ASTM类型E-1)下,由在H2产生后的燃料混合物产生的废燃料中的反应产物示于下表中。*亚利桑那州立大学的X-射线衍射数据表明,NAB(OH)4是水解反应的副产物(DonGervasio,MichaelXu和EvanThomas;亚利桑那州立大学;Tempe,AZ;2005年7月26日)。**ProgressinthecatalystsforH2generationfromNaBH4fuel;V.I.Simagina(4-3-36)(需要的氢)本描述主要涉及硼氢化钠(NaBH4)作为金属硼氢化物。金属硼氢化物的其他实例为硼氢化锂(LiBH4)和硼氢化钾(KBH4)。然而,根据本发明的方法适用于任何金属硼氢化物,其可以被称为Me(BH4)n,其中Me是具有化合价值n并且因此具有与其连接的数目n个硼氢根BH4的金属。金属包括通常被称为金属的任何材料,包括碱金属、过渡金属和复合金属。各种化学反应机制可以适用于合成过程S和反应过程R。实例提供在图2A中。图2A还示出通过H2O的水解的用于产生H2的化学反应式,以及用于产生能量的H2和O2的反应的化学反应式。左手边的反应机制需要能量的输入,而右手边的反应机制产生能量。所述反应机制一起提供循环全过程,其中单个反应机制的所有反应产物可以在单个反应机制中再次用作反应物,如图2A所示。单个反应式中所用的(摩尔)量彼此相匹配:6H2O→6H2+3O2(s2,图2A)4NaOH+2B2O3+6H2→4NaBH4+5O2(s1,图2A)4NaBH4+10H2O→4NaOH+2B2O3+16H2(r1,图2A)16H2+8O2→16H2O(r2,图2A)或者,其中单个反应式中所用的(摩尔)量彼此不匹配的反应式可以分别写作:2H2O→2H2+O22NaOH+B2O3+3H2→2NaBH4+2.5O22NaBH4+5H2O→2NaOH+B2O3+8H22H2+O2→2H2O另一组可能的反应机制示于图2B中,其中单个反应式中所用的(摩尔)量也是彼此匹配:2H2O→2H2+O2(s2,图2B)NBO2+2H2→NaBH4+O2(s1,图2B)NaBH4+2H2O→NaBO2+4H2(r1,图2B)4H2+2O2→4H2O(r2,图2B)在与以上相同的方式中,这些反应式可以重新写为彼此不匹配的单个反应式。以上反应式是非常有利的反应式并且是平衡的,因此是极佳的反应式。反应式s2和r2是已知的。通过WebOC.org网址(http://nl.webqc.org/balance.php)的化学计量公式的平衡计算工具确认反应式s1和r1。反应式中的吉布斯(Gibbs)能的基本值和材料的摩尔质量示于下表中。*https://en.wikipedia.org/wiki/List_of_standard_Gibbs_free_energies_of_formation**HandbookofChemistryandPhysics,第76版***www.citrination.com首先,讨论关于图2的反应式。下表显示出根据反应式的吉布斯能/摩尔以及吉布斯能的变化(Δ)/以摩尔计的分子数,因此,例如,在式s2中,6摩尔H2O、6摩尔H2和3摩尔O2。反应式s2是由水产生氢的已知的基本反应过程。化学反应消耗能量以用于分解H2O分子,同时在形成H2和O2时不释放(吉布斯)能,如下表所示。反应式s1示出由根据反应机制s2或反应机制r1产生的H2以及由NaOH和B2O3产生NaBH4的反应。NaOH是广泛可用的。作为最终结果,根据式s1的化学反应消耗如下表示出的能量。根据反应式的两个过程s2和s1都消耗能量。例如,这些过程可以在无碳(零碳足迹)产生的能量(如风能、水能、太阳能和核能)是可用的位置实施。反应机制s2不需要实施,或者仅在开始阶段实施以提供H2。在稍后阶段,H2来自反应机制r1。反应式r1显示,将产生的NaBH4用于在与H2O(优选地供应为超纯水(UPW))的化学反应中产生H2以及产生能量,其示于下表中。由箭头10表示通常为金属硼氢化物的NaBH4从NaBH4合成侧转移至H2产生侧。来自反应式r1的反应产物为NaOH、B2O3和H2。可以收集NaOH和B2O3并且返回废燃料SF中以再次用于反应机制s1,以便重新产生NaBH4,如箭头20所示。式r1的过程中产生的H2至少部分地返回式s1的过程,如箭头30所示。过程r1中释放的能量也可以再用于反应过程s1,以使需要从外部源供应的能量的量在理想状况下降低至3,411.2–1,040.2=2,371.0kJ。反应过程s1需要从外部源输入能量。根据反应式r2的能量产生的过程产生可以作为清洁反应产物排放的H2O。式r2的过程产生大量的能量,如下表所示。图2的过程循环与以上相应的表的组合表明,能量(优选以零碳足迹(无碳)方式产生的能量)可以用于在合成机制s1中产生金属硼氢化物(例如,NaBH4),所述金属硼氢化物随后在反应过程r1中用于产生H2,H2可以转移回至金属硼氢化物合成过程s1中。反应机制s1和r1分别对应于图1的合成过程S和反应过程R。下表示出了图2A的反应式s2、s1、r1和r2中涉及的原子对于在诸如用于产生蒸气的燃烧室或燃烧炉的能量产生反应器中根据反应式r2产生的每摩尔H2的摩尔平衡和能量平衡。表中的能量和分子平衡表明,根据反应s1的NaBH4产生过程需要H2以及对于在能量产生反应r2中产生的每摩尔H2需要213.19kJ能量。NaBH4合成反应s1(S)需要2摩尔NaOH、1摩尔B2O3和3摩尔H2以产生2摩尔NaBH4。反应式r1(R)的过程由2摩尔NaBH4和5摩尔H2O产生8摩尔H2。反应机制s1(S)和r1(R)一起表明,金属硼氢化物合成反应s1中使用的3摩尔H2与金属硼氢化物分解和H2产生反应r1中产生的8摩尔H2的3:8或1:2.67的氢倍增效率。最佳的反应过程是其中在反应过程r1中对于2摩尔NaBH4使用至少5摩尔H2O的反应过程。优选地,使用较大量的水以保持反应产物为液态。给出以下两个实例,其中使用具有氢含量等于1kgH2的量的NaBH4。在第一实例中,使用具有33.33%wtNaBH4、5%wtNaOH和剩余部分的超纯水(UPW)的燃料混合物(硼氢化物燃料):●9.38kgNaBH4,其为248.05摩尔;●1.41kgNaOH,其为35.19摩尔;以及●17.36kgUPW,其为936.69摩尔。这给出了28.15kg的总质量,并且1kg的H2为所述量的3.6%wt。2:1的H2O:NaBH4的比率(其为基本方程Rb所需要的比率)将需要8.937kg的UPW,因此混合物中17.36kg的UPW是足够的。5:2的H2O:NaBH4的比率(其为反应式3所需要的比率)将需要量为11.172kg的UPW,因此混合物中17.36kg的UPW也是足够的。在第二实例中,使用具有66.66%wtNaBH4、5%wtNaOH和剩余部分的UPW的燃料混合物(硼氢化物燃料):●9.38kgNaBH4,其为248.05摩尔;●0.70kgNaOH,其为17.60摩尔;以及●3.98kgUPW,其为221.35摩尔。这给出了14.06kg的总质量,并且1kg的H2为所述量的7.1%wt。2:1的H2O:NaBH4的比率(其为基本方程Rb所需要的比率)将需要8.937kg的UPW,因此混合物中3.98kg的UPW是不足的。5:2的H2O:NaBH4的比率(其为反应式r1所需要的比率)将需要量为11.172kg的UPW,因此混合物中3.98kg的UPW也是不足的。基本反应式Rb和反应式r1分别需要额外的4.96kg和7.19kg的UPW,其可以从根据反应式r2的燃料室中产生的水中获得,如图2右手边的箭头50所示。图2B示出方框s1和r1的其他反应途径,同时已经调整方框s2和R2的反应机制中的摩尔量以匹配图2B中所有方框的摩尔量。示出吉布斯能和所涉及的分子数的相应的表示于以下。与图2A的反应机制S2和r2相比,图2B的反应机制s2和r2甚至是更有利的,因为每摩尔NaBH4需要显著更少的能量。使B2O3作为反应残余物对于4摩尔NaBH4需要3,411.2kJ。这产生22.56MJ/kgNaBH4,其可以表示为211.5MJ/kgH2。使用NaBO2作为反应残余物需要782,6kJ/摩尔NaBH4。这产生20.70MJ/kgNaBH4,其可以表示为194.1MJ/kgH2。对于转化成NaBO2的每摩尔NaBH4,释放308.4kJ的能量,以及4摩尔H2。因此,除了NaBH4中的一千克H2以及76.5MJ的热量以外,还释放了另一千克的H2。图2C示出对于燃料合成过程FS1、FS2的一般概述。反应机制方框FS1包括图2A或图2B的反应机制方框s1和r1。废燃料SF可以在过程FS2中再循环或额外地提供。也可以将清洁的反应物提供进入所述过程。可以将合成过程中产生的部分H2用于保持合成过程持续进行。或者,可以从外部提供H2。合成过程FS1、FS2产生金属硼氢化物燃料,其在本实例中为NaBH4。金属硼氢化物燃料可以用于能量产生过程EP1、EP2,如图2D所示。反应机制方框EP1包括图2A或图2B的反应机制方框r1和r2。产生的部分或全部的水可以再循环进入能量产生。金属硼氢化物燃料可以通常提供为溶于超纯水的金属硼氢化物以及用于稳定燃料混合物的金属氢氧化物,因为金属硼氢化物倾向于与超纯水快速反应。呈现与图3相关的两个其他实例。图3示出基于电解的用于NaBH4的两个合成途径所涉及的能量水平。该图表明,与采取NaCl作为起始材料相比,采取NaOH作为起始材料需要显著更少的能量。所需的能量分别为500kJ和3,200kJ。由Brown和Schlesinger在US2,534,533中已经描述了首先采取NaH作为起点的过程。随后,YingWu在本发明背景部分提及的公开中已经提出在电解过程中由NaOH替代通常使用的NaCl。图4在图的左手边示出了根据YingWu用于合成NaBH4的方案在采用NaOH电解的过程中所涉及的反应步骤的示意性概括,并且在图的右手边示出了NaBH4和H2O的反应过程R。结合的合成过程S和反应过程R的另一实例示于图5中,其示出已经由Richter和Jensen提出并且公开在WO2013/182208A1中的过程。所述过程基于通过球磨使金属活化并且随后产生活化金属的氢化物,其在低压下溶于溶剂。Minkina已经在EP1787952中公开了另一实例。以上已经描述了可以在本发明的过程循环中采用多个化学过程,如图1所示。对于由合成过程S所产生的并进入反应过程R的相同量的金属硼氢化物,与输入金属硼氢化物合成过程S所需的量相比,反应过程R产生较大量的H2。因此产生的金属硼氢化物和H2的量将适时地增加。因此,所述方法是用于产生金属硼氢化物和/或H2的方法。可以从所述过程中取出金属硼氢化物和H2以在别处使用。并非从所述过程中取出所有金属硼氢化物或H2,否则所述过程将结束。因此监控或以其他方式保证在过程中维持最小量的金属硼氢化物和H2。这可以以各种方式来实现,例如,通过软件控制,通过将储备料保持在隔开的储存容器中以用于运行所述过程以及用于从所述过程取出。在后一实例中,将用于保持过程运行的储存容器保持填充至期望的水平。本发明的实施方案示于图6,其中从产生循环中取出金属硼氢化物。方框R-S表示金属硼氢化物分解以及H2产生R和金属硼氢化物合成S的连续过程,正如图1至图5所讨论的。将所产生的金属硼氢化物提供进入容器或罐T1。将金属硼氢化物从所述罐T1取出以用于下一循环的反应和合成过程R-S。罐T1具有预定的容量,所述容量根据需要来考虑以保持产生循环R-S运行。超过罐T1容量的任何过量的金属硼氢化物溢出进入罐T2。从所述罐T2取出从产生循环中取出的金属硼氢化物。已显示,NaBH4从罐T2取出并且提供至金属硼氢化物分解和H2产生过程(反应器)R以及使用者的燃料室FC。将由燃料室FC产生的H2O提供返回至使用者的反应器R,并且将来自使用者的反应器R的反应产物提供返回至金属硼氢化物产生循环R-S。图7示出本发明的另一实施方案。该图示出了两个产生过程循环R1-S1和R2-S2。将NaBH4与H2O在混合器M中混合并且提供至反应过程R1和R2。仅示出一个混合器M,但是各产生过程循环也可以装备有其自身的混合器。此外,可以将酸和NaOH提供至混合物中以用于控制反应过程。在援引NL2015742的优先权和先前提及的Dutch专利申请中公开了通过添加酸和/或金属氢氧化物来控制反应过程,所述申请的内容通过引用并入本文。将废燃料SF中的反应产物和所产生的部分H2连同反应过程R1、R2中产生的热量提供至合成过程S1、S2。根据需要,废燃料SF可以必须首选进行再循环。将R2-S2产生循环中产生的部分H2提供至燃料室FC以产生电能。燃料室可以产生约83MJ/kgH2能量。也可以将H2用于已经转变为使用H2作为燃料的燃煤电厂,在此情况下,产生的能量的量为约85MJ/kgH2。与转变的燃煤电厂相比,操作成本对于燃料室倾向于较高。将在R1-S2产生循环中产生的部分H2提供至合成过程R3,以产生NaBH4用于在别处使用。将产生的NaBH4储存在罐T中。金属硼氢化物可以首先溶于水(优选为超纯水(UPW)),其用金属氢氧化物进行缓冲以获得稳定的燃料混合物,如援引NL2015742的优先权和先前提及的Dutch专利申请中已经公开,所述申请的内容通过引用并入本文。若需要再循环,来自用于分解NaBH4和在别处产生H2的一个或多个反应过程的废燃料SF可以返回至合成过程S3或另一合成过程。实验基于用于产生H2的燃料混合物的制备和H2从燃料混合物的产生来讨论以下实验和实验结果。提供所用材料、反应装备、实验及其结果的细节。材料所有化学品购自Sigma-Aldrich,除了超纯水(UPW)以外,超纯水(UPW)从PureWaterGroup获得。将以下化学品用于制备燃料和活化剂溶液。通过将30.837克UPW置于烧杯中并且添加2.505克NaOH以及搅拌所得的混合物直至所有NaOH微球完全溶解来制备碱性溶液。通过将盐酸浓缩物与相同量的超纯水混合来制备活化性剂溶液。将75.637克盐酸浓缩物在烧杯中称重。将75.633克UPW在另一(不同的)烧杯中称重,并且将盐酸添加至UPW。两个烧杯用该溶液冲刷,以确保均匀的溶液。通过使3.331克碱性溶液与1.666克硼氢化钠混合来制备5克燃料(也被称为燃料混合物或燃料溶液)。将混合物搅拌直至溶液中无剩余的固体。混合物的短暂加热(在加热板上几秒)有助于溶解固体。燃料溶液的pH值测定为pH=13.5。以下给出在实验中产生H2的燃料的最终组成。化合物量(克)%wtNaBH41.66633.34NaOH0.2505.00UPW3.08161.66总计:4.997100.00反应装备反应装备示于图8至图11中。反应器装备包括不锈钢反应容器1(具有182.4±1.5ml的体积)和特氟龙嵌件2。特氟龙嵌件2为实际的反应混合物容器并且在每一反应中用新的特氟龙嵌件替代。在反应容器的顶部上提供压力传感器3,分别用于气相和液相的温度传感器4、5(热电偶),隔板6和阀7。传感器3、4和5与数据获取计算机连接。以下给出所用的压力传感器和温度传感器的规格。将传感器进行校准并且下表给出校准日志。阀7与四联连接器8连接。两个50ml的气相色谱(GC)小瓶9、10各自经由小瓶与连接器之间的各自的阀与四联连接器8连接。此外,另一阀11与四联连接器8连接,用于使气体能够添加至反应容器1并且能够从反应容器1排出。在开始实验之前,管和GC小瓶处于真空下。一旦将其中具有燃料的嵌件置于反应容器1中,用大气压力的氮气(纯度级N50,AirLiquide)填充管和反应容器。通过交替地添加氮气(5bar)和施加真空连续三次来去除空气,然后用氮气(5bar)加压并且最终打开气体排泄阀直至容器内部的压力等于环境压力。通过反应装备含有燃料和填充有氮气,所述装备已经准备好通过注射器12注射活化剂穿过隔板6进入反应容器1内部的嵌件2。实验的实施按照荷兰研究所TNO的方案15EM/0678在2015年10月29日进行三次H2产生实验。将燃料插入嵌件2中,并且如先前所述,用氮气填充反应器1。为了添加活化剂溶液,实施以下步骤。首先,用一次性不锈钢针(具有0.9mm的内径)配备清洁的一次性注射器12(具有2ml的体积)。注射器用活化剂溶液冲刷,注射器或针中未留有空气。测定经冲刷的注射器的质量。用注射器对天平进行去皮称重,并且用所需量的活化剂(也被称为活化剂溶液或活化剂混合物)填充注射器。测定注射器加活化剂的质量。其次,通过将其注射经过隔板6使注射器缓慢排空(20-40秒的过程)进入特氟龙嵌件2,未让任何气体进入注射器或针。当完成活化剂的添加时,取出注射器并且称重。通过注射器和活化剂的结合质量减去空注射器的重量来测定所添加的活化剂的精确量。以下给出实验中所添加的燃料和活化剂的精确量。实验参考燃料[克]活化剂[克]YPEvG1190.20080.3352YPEvG1200.19930.3331YPEvG1210.20010.3554在小瓶中的压力被认为稳定之后约30分钟(通常在完成活化剂的添加之后约15分钟),用来自反应容器的气体混合物填充GC小瓶。由于数据收集软件的故障,较早终止实验YPEvG119。从添加活化剂的时刻开始,总的数据记录时间为1,610秒(26.7分钟)。实验显示反应容器中的稳定压力,因此实验被认为是成功的。通过打开将小瓶连接至四联连接器和反应容器的阀来填充GC小瓶。由于在小瓶中维持真空,当它们各自的阀都打开时,它们被气相快速填充。使填充的小瓶平衡5分钟,然后关闭它们各自的阀,并且将小瓶送至通过气相色谱(GC)进行分析。在填充GC小瓶后,释放反应容器中的任何过量的压力并且打开容器。取出特氟龙嵌件。将留在嵌件2中的固体在真空烘箱中于30℃干燥。压力和温度曲线图12至图14分别给出实验YPEvG119、YPEvG120和YPEvG121的压力和温度曲线。当添加活化剂溶液时开始反应,其在图12至图14中由S连同在开始进行测量后以秒计的时间表示。然后液体的温度(T液体)快速增加,峰在75℃至77℃。同时地,气体压力显示快速增加,表明产生气体。以下给出所得的稳定压力和相应的温度以及开始压力和温度。实验参考P开始[bara]T开始1[℃]P结束[bara]T结束[℃]YPEvG1191.0325.31.9224.8YPEvG1201.0326.21.9625.0YPEvG1211.0425.81.9725.11T开始由于用氮气预先冲刷并且施加真空而是较高的。由于通过与反应器容器壁的相互作用而快速冷却,因此气体温度的增加(T气体)明显更低。气相色谱(GC)结果图16中给出实验YPEvG-121的气相色谱(GC)分析曲线作为实例。在荷兰研究所TNO的报告15EM/0712中报道了所述分析。下表示出分析图16的曲线的结果。下表给出来自气相色谱测量的氢(H2)和氮(N2)的浓度。实验参考H2气体[%vol]N2气体[%vol]其他[%vol]YPEvG11945.353.21.5YPEvG12045.252.91.9YPEvG12145552817因为在各个测试前用氮气冲刷装备,因此分析中的其他气体主要由容器内的反应造成。如从上表可见,GC测量几乎仅检测到氢气和氮气。还检测到了少量的水和氧。氧和可能较少程度的水在结合燃料和活化剂溶液之前就已经存在,因此也包括在起始压力中。X-射线衍射(XRD)结果来自反应的残余物在干燥之前为灰色固体。在真空中干燥后,获得白色固体。从实验YPEvG119获得的固体示于图15。使用X-射线衍射(XRD)分析来自实验YPEvG119的这种白色残余物。通过XRD定性评估实验的固体残余物。XRD限于鉴定结晶化合物。对于大量的无定形化合物,没有尖的衍射图样。图17中给出测量的XRD衍射图样。发现三个库的图样与测量的图样重叠良好。下表给出对应于所鉴定的这些库的图样的结晶固体。图样参考化学式物质名称1PDF00-007-0277Na2B4O7·5H2O八面硼砂,syn2PDF00-005-0628NaCl石盐,syn3PDF01-075-2259Na2ClB(OH)4氯硼钠石,syn上表第一列中的整数用于鉴定图17中相对应的图样的峰。因此,用‘2’鉴定的峰与对应于NaCl的图样PDF00-005-0628相对应。在荷兰研究所TNO的报告15EM/0712中还报道了XRD分析的分析报告。讨论GC结果表明,产生的气体在所有实验中几乎完全是氢气。因此,压力增加可以用于确定产生的氢气的绝对值(应用理想气体定律,由于低压力,其是可适用的)。计算氢气的摩尔量以及氮气的起始摩尔量。将两者转化成其各自的体积百分数并且与GC结果进行比较。下表给出氢和氮的这些计算的摩尔量和体积百分数。计算的体积百分数结果与GC实验测量的体积百分数相符。对氢的GC结果显示较低浓度的氢气。因此,由压力值计算的氢的量应被视为最大值。在下表中,计算的氢的量与氢的理论最大量相比较,所述氢可以根据反应式、使用燃料中采用的NaBH4的质量由硼氢化钠产生(比率被指定为收率):NaBH4+2H2O→NaBO2+4H2这是硼氢化钠的分解反应的理想反应式。实际的反应可以不同(也由XRD结果表明)。然而,为了与理论最大值相关的比较,这是适当的反应方程式。下表也给出了产生的氢气的质量与所应用的燃料和活化剂溶液的总质量的比率(指定为效率):获得的收率接近于100%的理论最大值。实验YPEvG119具有比其他两个实验低的收率。未能发现直接原因,但是可能泄露了一些H2。不大可能的是,其与较短的测量时间有关,因为压力在相当长的时间内已经是恒定的(并且反应完成),正如也在图12中可见。结论实验的目的是验证当与活化剂溶液接触时燃料混合物H2Fuel是否产生氢气。GC分析表明,主要产生氢气。检测到氮气和氢气,具有少量的氧和水。压力增加可以有助于H2产生,并且用于量化产生的H2的量。所得结果应被视为最大值。燃料在与活化剂溶液的反应中产生氢气,并且平均为理论最大值的96%mol,由于所使用的NaBH4的规格,实践中的最大值为98%mol,并且与结合的燃料和活化剂溶液的总质量有关的效率为2.5%wt。在这种情况下,提供过量的酸和水,以便在注射后最短的合理时间段内获得最大的氢转化率。XRD分析表明,在反应后,没有残留硼氢化钠或其他结晶硼氢化物。检测到的矿物质主要是食盐和硼酸钠。这表明反应达到完成。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1