具有适中离子释放速率的碱金属离子源和形成方法与流程
相关申请
本申请要求2013年5月6日提交美国临时申请No.61/819,699的权益。上述申请的全部教导通过引用并入本文。
背景技术:
对碱金属、例如但不限于钾的其它来源有日益增长的需要。氯化钾(传统的钾施肥剂)在远离南半球的为数有限的地理位置中生产,其中运输成本明显促进了市场价格,使得钾肥的本地制造日益有吸引力。随着人类人口增长,农业也必须随之增长和发展,特别是在南半球的可利用地区。例如,这些地区的现代农业发展需要在土壤上生长农作物,而所述土壤经常完全耗尽了主要营养物、结构元素例如植物可利用形式的硅(单硅酸)或钙、和结构发展矿物质例如粘土矿物(层状硅酸盐)。换句话说,这些土壤由于缺乏适当的结构和必要元素资源,不是农作物生长最适宜的。从土壤施肥的观点来看,传统的施肥剂,例如硝酸钾和氯化钾,由于它们的过度浸出、缺乏相应离子的保持力、和不能向土壤提供适当的结构,因而不是最佳的。以这些高可溶性盐的形式被引入土壤的钾和其他营养元素因此被浪费,对环境具有潜在的负面影响,例如氯化物污染。因此,需要新的钾源和更好的营养素输送手段,以允许在南半球的可利用地区中的高农业生产率和扩张。理想的是,这些来源可同时提供必要元素,例如钙和植物可利用的硅,以及促进形成结构矿物质。
造岩矿物,例如钾长石(KAlSi3O8),基于它们比较高的K2O含量(在纯KAlSi3O8中K2O大于15wt%),因此可以被认为是地球上丰富的传统来源替代品。近几十年来,已经进行了致力于从造岩矿物提取钾离子(K+)的许多研究工作。这样的提议当中包括完全分解带钾硅酸盐和铝硅酸盐的方法,旨在以高可溶性盐(例如但不限于KCl)的形式提取K+。这些提取法通常基于从原料分解之后获得的水溶液中沉淀可溶于水的钾盐。所述分解方法又通常使用比较高的温度(>1000℃)、或/和侵蚀性酸-碱处理,不可避免地产生大量液体和/或固体废物,需要复杂而昂贵的分离技术。(“Processing for decomposing potassium feldspar by adopting low-temperature semidry method for comprehensive utilization,”CN 103172074 A;Hao Zhang等(2012)。The Extraction of Potassium from Feldspar by Molten Salt Leaching Method with Composite Additives,Advanced Materials Research,524-527,1136;和Pedro Lucas Gervasio Ladiera Potash产品和方法专利申请WO 2013061092 A1。它们全部的教导以其整体通过引用并入本文。)
还已经进行了尝试利用未改变的石粉(碎石)作为肥料中钾的替代来源和植物可利用的硅源。(Anne Kjersti Bakken,Harvard Gautneb,Kristen Myhr(1997)Plant available potassium in rocks and mine tailings with biotite,nepheline and K-feldspar as K-bearing mineralsActa Agriculturae Scandinavica,Section B–Soil&Plant Science.Vol.47;和Y.Tokunaga,Potassium silicate(1991)A slow-release potassium fertilizerFertilizer Research.30,55-59。它们全部的教导以其整体通过引用并入本文。)然而,那些碎石的天然化学风化是极度缓慢的过程,并且来自碎原生矿物的益处例如营养物释放和层状硅酸盐形成只能在远远超过现代农业的农作物生长和收获的时间量程——数年、可能数十年的时间量程上才能显现。
因此,存在生产以适中速率释放营养素的钾离子源的需要,所述速率低于传统盐的无限溶解速率,但快于天然存在的矿物质通常展现的速率。理想地,这种源从地球丰富的带K硅酸盐岩石生产,可提供结构组分(例如以单硅酸形式的硅和/或钙),并且可促进形成粘土矿物(层状硅酸盐)。同样,还存在生产这样的材料源以最小化上述问题的方法的需要。
技术实现要素:
本发明总的涉及形成碱金属离子源的方法和通过所述方法形成的碱金属离子源。
在一种实施方式中,本发明形成碱金属离子源的方法包括合并第一组分与第二组分以形成固体混合物,所述第一组分包括颗粒状带碱金属离子的架状硅酸盐,第二组分包括碱土金属和碱金属中至少一种的氧化物和氢氧化物的至少一种。所述第一组分的硅与所述第二组分的所述碱土金属和碱金属中至少一种的摩尔比为约1.0:0.1至约1.0:0.3。所述混合物任选联合湿研磨或联合干研磨,或分开研磨并在研磨之后掺合。在所述固体混合物湿联合研磨的情况下,存在的液体总量为液体与固体的重量比是约0.05:1至约5:1。所述混合物然后暴露于升高的温度和压力一段时间,该时间足以形成包括所述第一组分的硅和碱金属的凝胶,从而形成碱金属源。所述碱金属离子源的雪硅钙石相与未反应的带碱金属离子的架状硅酸盐相的重量比可为约1:1至约0:1。所述碱金属离子源的K(Na)-A-S-H凝胶的重量百分比可为约10%至约100%。所述碱金属离子源的比表面积可为约8m2/g至50m2/g。
在本发明方法的另一种实施方式中,碱金属离子源是如下形成的:降低所述颗粒状带碱金属离子的架状硅酸盐的尺寸,直到至少约50重量%的所述颗粒具有等于或小于5μm的直径,其利用激光衍射粒度分析仪以液体模式(例如,在水介质中)通过激光衍射测量。
在一种实施方式中,本发明的碱金属离子源由颗粒状带碱金属离子的架状硅酸盐通过本发明的方法形成,从而形成碱金属源,其含有不少于10重量%的所述带碱金属离子的硅酸盐凝胶,具有约8m2/g至约50m2/g的比表面积(BET),并在暴露于对于钾和二氧化硅不饱和的水溶液在24小时内释放不少于1g钾/1千克碱金属离子源和不少于1wt%的硅酸。
在一种实施方式中,本发明的碱金属离子源由颗粒状带碱金属离子的架状硅酸盐通过本发明的方法形成,从而形成碱金属源,其具有在约3m2/g至约10m2/g的Brunauer-Emmett-Teller(BET)比表面积。
本发明具有许多优点。例如,从带有钾的岩石形成碱金属离子源的本发明方法不需要强酸或过量的液体并且可在相对适中的温度(≤350℃)下进行。本发明的方法还通过定制所形成的凝胶相对于所述颗粒状带碱金属离子的架状硅酸盐中带有碱金属离子的其他组分的量,不需要复杂的中间步骤就能够控制所述碱金属从最终产物的释放速率。此外,从所述产物释放钾还伴随着向土壤引入构成所述凝胶的实体(硅酸和氢氧化铝)和所述实体以对土壤有益处的二次相的形式发生沉淀(主要是层状硅酸盐)。以如上所述的方式,这在单一材料中提供了几种关键的元素和土壤的必要结构组分。此外,本发明的方法避免了形成固体和液体废物,所述废物原本将需要在使用所述产物、例如其中所述产物用作肥料之前进行分离、再循环和储存。
本发明的材料的组成和结构允许通过所述必要元素的可控释放来调节土壤组成。例如,在高度酸性土壤(pH<5)的情况下,可通过从所述产物释放的钙离子来安全地提高pH。此外,雪硅钙石相的存在防止了钙离子的完全释放,从而可防止土壤pH上升到超过7。硅酸盐凝胶以硅酸的单体和低重量低聚物的形式提供了植物可利用的硅,它是许多植物的结构和防御元素,还参与层状硅酸盐相原位沉淀。适中的钾释放速率防止钾随着灌溉立即流失掉。原始相,当包含在所述产物中时,允许定植在植物根部并长期缓慢释放所有它的实体。
本发明还涉及以下项目。
1.形成具有适中的离子释放速率的碱金属离子源的方法,所述方法包括以下步骤:
a)合并第一组分与第二组分以形成固体混合物,所述第一组分为颗粒状带碱金属离子的架状硅酸盐,所述第二组分包括碱土金属和碱金属中至少一种的氧化物和氢氧化物中的至少一种,其中所述固体混合物中所述硅与所述第二组分的所述碱土金属和碱金属中至少一种的摩尔比为约1.0:0.1至约1.0:0.3;和
b)所述固体混合物暴露于水热处理以形成凝胶,所述凝胶包含所述第一组分的硅和碱金属,从而形成碱金属离子源。
2.项目1的方法,其中所述第一组分的碱金属包括锂、钠和钾的至少一种。
3.项目2的方法,其中所述第一组分的碱金属包括钾。
4.项目3的方法,其中所述颗粒状带碱金属离子的架状硅酸盐是铝硅酸盐。
5.项目4的方法,其中所述带碱金属离子的架状铝硅酸盐包括选自钾长石(KAlSi3O8)、白榴石(KAlSi2O6)、原钾霞石(KAlSiO4)和霞石(Na3KAl4Si4O16)的至少一种。
6.项目4的方法,其中所述第一组分包括至少约5重量%的K2O当量。
7.项目1的方法,其中所述第二组分包括碱金属。
8.项目7的方法,其中所述第二组分的碱金属包括锂(Li)、钠(Na)和钾(K)的至少一种。
9.项目1的方法,其中所述第二组分包括碱土金属。
10.项目9的方法,其中所述第二组分的碱土金属包括铍(Be)、镁(Mg)、钙(Ca)和锶(Sr)的至少一种。
11.项目10的方法,其中所述第二组分的碱土金属包括钙(Ca)。
12.项目11的方法,其中所述第二组分的钙是氢氧化钙(Ca(OH)2)的形式。
13.项目12的方法,其中所述氢氧化钙的量在合并的固体混合物中以约5重量%至约30重量%存在。
14.项目1的方法,其还包括在水热处理之前所述混合物与液态水合并以形成液固混合物的步骤。
15.项目14的方法,其中所述液固混合物中的液体存在量为液固重量比约0.05:1至约5:1。
16.项目15的方法,其还包括研磨所述固体混合物从而降低所述第一组分的平均粒度直到具有5μm或更小直径的所述颗粒的体积百分比为至少约30%的步骤。
17.项目16的方法,其还包括研磨所述固体混合物从而降低所述第一组分的平均粒度直到具有5μm或更小直径的所述颗粒的体积百分比为至少约50%的步骤。
18.项目16的方法,其中所述液态水在所述研磨步骤之前添加。
19.项目16的方法,其中所述液态水在所述研磨步骤之后添加。
20.项目16的方法,其中所述水热处理包括将所述液固混合物暴露于约100℃至约350℃的温度下一段时间,该时间足以形成不少于10重量%的量的包含所述第一组分的二氧化硅和碱金属的凝胶。
21.项目20的方法,其中所述第一组分的碱金属是钾。
22.项目16的方法,其中所述水热处理包括在所述混合物暴露于约100℃至约350℃的温度从而形成所述硅酸盐凝胶的所述时间段的至少一部分期间,将所述固体混合物暴露于约100psig至约500psig的压力。
23.项目22的方法,其还包括通过将所述颗粒尺寸降至等于或小于约5mm的粒度来形成所述第一组分的步骤。
24.项目23的方法,其还包括将所述碱金属离子源与土壤合并的步骤。
25.项目1的方法,其中所述固体混合物暴露于升高的温度和压力下,直到所述第一组分的基本上所有的碱土金属作为所述凝胶的组分存在。
26.项目1的方法,其中所述碱金属离子源的雪硅钙石相与未反应的带碱金属离子的架状硅酸盐相的重量比为约1:1至约0:1。
27.项目1的方法,其中所述碱金属离子源的K(Na)-A-S-H凝胶的重量百分比为约10%至约100%。
28.项目1的方法,其中所述碱金属离子源的比表面积为约8m2/g至50m2/g。
29.形成具有适中的离子释放速率的碱金属离子源的方法,所述方法包括以下步骤:降低颗粒状带碱性金属离子的架状硅酸盐的尺寸,直到至少约50重量%的所述颗粒具有等于或小于5μm的直径,其通过基于激光的粒度分布分析进行测量。
30.项目29的方法,其中所述第一组分的碱金属包括锂、钠和钾的至少一种。
31.项目30的方法,其中所述带碱金属离子的架状硅酸盐的碱金属包括钾。
32.项目31的方法,其中所述颗粒状带碱金属离子的架状硅酸盐的硅酸盐是铝硅酸盐。
33.项目32的方法,其中所述颗粒状带碱金属的架状硅酸盐包括选自钾长石(KAlSi3O8)、白榴石(KAlSi2O6)、原钾霞石(KAlSiO4)和霞石(Na3KAl4Si4O16)的至少一种。
34.项目33的方法,其中所述颗粒状带碱金属的架状硅酸盐包括至少约5重量%的K2O当量。
35.项目34的方法,其中所述颗粒状带碱金属离子的架状硅酸盐包括正长岩和花岗岩的至少一种。
36.具有适中的离子释放速率的碱金属离子源,其通过包括以下步骤的方法形成:
a)合并第一组分与第二组分以形成固体混合物,所述第一组分为颗粒状带碱金属离子的架状硅酸盐,所述第二组分包括碱土金属和碱金属中至少一种的氧化物和氢氧化物中的至少一种,其中所述硅与所述第二组分的所述碱土金属和碱金属中至少一种的摩尔比为约1.0:0.1至约1.0:0.3;和
b)将所述固体混合物暴露于水热处理以形成包含所述第一组分的二氧化硅和碱金属的凝胶,从而形成所述碱金属离子源,其包含不少于10重量%的量的所述带碱金属离子的硅酸盐凝胶,其中所述碱金属离子源具有约8m2/g至约50m2/g的比表面积(BET),其中所述碱金属离子源在暴露于对于钾和二氧化硅不饱和的水溶液24小时后释放不少于1g钾/1千克碱金属离子源和不少于1wt%的硅酸。
37.项目36的碱金属离子源,其还包括在水热处理之前,将所述混合物与液态水合并以形成液固混合物的步骤。
38.项目37的碱金属离子源,其中所述液固混合物中的液体的量为所述混合物中液固重量比为约0.05:1至约5:1。
39.项目38的碱金属离子源,其还包括研磨所述固体混合物的步骤。
40.项目39的碱金属离子源,其中所述液态水在所述研磨步骤之前添加到所述固体混合物。
41.项目40的碱金属离子源,其中所述液态水在所述研磨步骤之后添加到所述固体混合物。
42.项目36的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐的碱金属包括锂、钠和钾中的至少一种。
43.项目42的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐的碱金属包括钾。
44.项目43的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐是铝硅酸盐。
45.项目44的碱金属离子源,其中所述颗粒状带碱金属的架状硅酸盐包括选自钾长石(KAlSi3O8)、白榴石(KAlSi2O6)、原钾霞石(KAlSiO4)和霞石(Na3KAl4Si4O16)的至少一种。
46.项目45的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐包括至少约5重量%的K2O当量。
47.项目45的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐包括正长岩、霞石正长岩和花岗岩的至少一种。
48.项目36的碱金属离子源,其中所述碱金属离子源的雪硅钙石相与微斜长石加上正长石相之和的重量比为约01:1至约0:1。
49.项目36的碱金属离子源,其中所述碱金属离子源的K(Na)-A-S-H凝胶的重量百分比为约10%至约100%。
50.项目36的碱金属离子源,其中所述碱金属离子源的比表面积为约8m2/g至50m2/g。
51.具有适中的碱金属离子释放速率的碱金属离子源,其通过包括以下步骤的方法形成:降低颗粒状带碱金属离子的架状硅酸盐的尺寸,直到至少约50重量%的所述颗粒具有等于或小于5μm的直径,其通过基于激光的粒度分布分析来测量,从而形成Brunauer-Emmett-Teller(BET)比表面积为约3m2/g至约10m2/g的碱金属离子源。
52.项目51的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐的所述碱金属包括锂、钠和钾的至少一种。
53.项目52的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐的所述碱金属包括钾。
54.项目53的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐是铝硅酸盐。
55.项目54的碱金属离子源,其中所述颗粒状带碱金属的架状硅酸盐包括选自钾长石(KAlSi3O8)、白榴石(KAlSi2O6)、原钾霞石(KAlSiO4)和霞石(Na3KAl4Si4O16)的至少一种。
56.项目55的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐包括至少约5重量%的K2O当量。
57.项目51的碱金属离子源,其中所述颗粒状带碱金属离子的架状硅酸盐包括正长岩、霞石正长岩和花岗岩的至少一种。
附图说明
图1是生产本发明产物的实施方式的本发明方法的某些实施方式的步骤的顺序示意图。
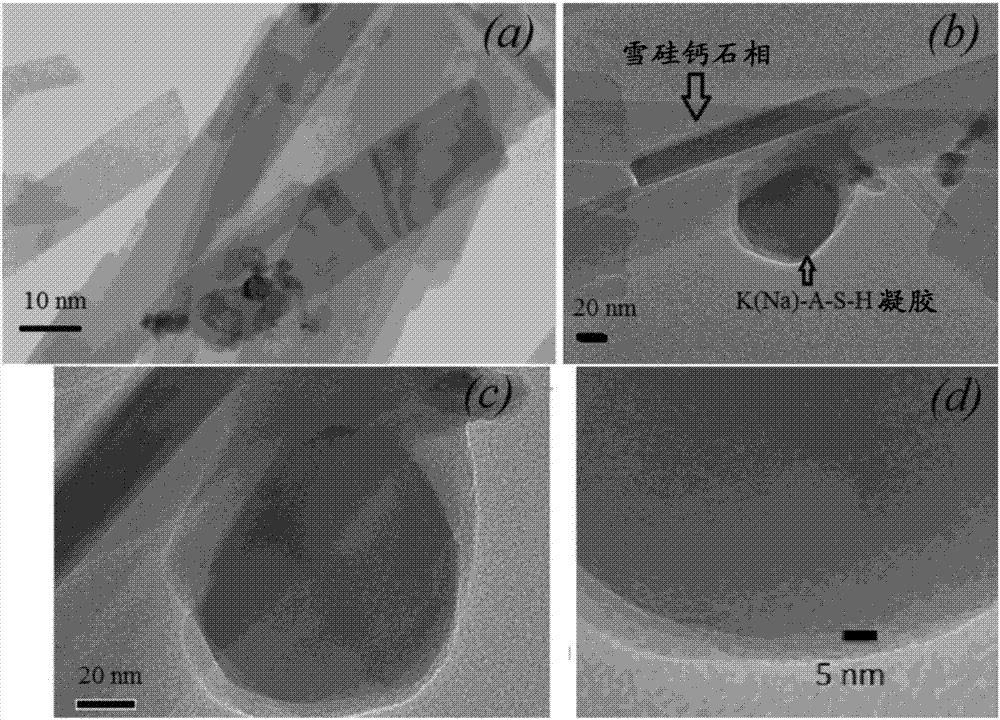
图2A至2D是透射电子显微(TEM)图像,显示了在称作材料#1的一种本发明产物实施方式中,与雪硅钙石相一起共同形成和稳定化的无定形组分(凝胶)。
图3A至3D是本发明实施方式的一种实施方式的二次电子像。
图4A是本发明的一种实施方式的背散射电子图像;图4B是本发明一种实施方式的能量色散X-射线光谱组成图谱,显示了钾(浅灰色)沿着所述主体材料的分布。
图5A-5B是如下所述的本发明实施方式的钾(K)的累计释放速率的动力学表现,以及还如下所述与对照样品的该速率的比较。
图6A和6B表现了如下所述的本发明实施方式的钾的即时释放速率,以及还如下所述与对照样品的该速率的比较。
具体实施方式
前述事项从下面本发明的示例性实施方式的更具体描述中将是显而易见的,在所述附图中示出时,其中同样的参考字符在不同的图中始终是指相同的部分。所述图不一定是按比例的,而是重点放在说明本发明的实施方式上。
本发明总的涉及形成碱金属离子源的方法和通过本发明的方法形成的金属离子源。本发明的碱金属离子源具有许多用途,例如在所述碱金属是钾的情况下,是农作物生长的肥料。图1是表现本发明方法的某些实施方式的示意图10。本发明方法的三种可能的实施方式的步骤在图1中对“过程1”表示为“1”,对“过程1I”为“1I”,对“过程2”为“2”。图1中显示的第一组分12是颗粒状带碱金属离子的架状硅酸盐。应理解在短语“颗粒状带碱金属离子的架状硅酸盐”中的“硅酸盐”包括铝硅酸盐。
在图1表示的本发明方法的一种实施方式中,第一组分12由含所述碱金属的合适的矿石形成,所述矿石通过本领域技术人员已知的合适方法例如压碎来降低尺寸。例如,合适的矿石粒度可降低到通过例如筛分分析测量为平均粒度等于或小于约5mm。(精和粗集料筛分分析的ASTM C136-06标准试验方法,其教导通过引用以其整体并入本文中)。本发明方法中用于产生所述碱金属离子源的合适的碱金属的例子包括,例如,锂(Li)、钠(Na)和钾(K)的至少一种。合适的锂源的例子包括透锂长石(LiAlSi4O10)。合适的钠源的例子包括钠长石(NaAlSi3O8)和霞石(Na3KAl4Si4O16)。合适的钾源的例子包括钾长石(KAlSi3O8)、白榴石(KAlSi2O6)、原钾霞石(KAlSiO4)和霞石(Na3KAl4Si4O16)。合适的所述钾源的例子包括矿石,例如正长岩、霞石正长岩和花岗岩。
在特别优选的实施方式中,所述碱金属是钾,优选的带碱金属离子的架状硅酸盐是钾长石(KAlSi3O8),其中所述合适的矿石含有至少约5重量%的氧化钾(K2O)当量。
在一种实施方式中,所述第二组分包括碱金属和碱土金属的至少一种。优选地,所述第二组分14的碱土金属包括铍(Be)、镁(Mg)、钙(Ca)和锶(Sr)的至少一种。优选地,所述第二组分的碱土金属包括钙。最优选地,所述第二组分的碱土金属当所述碱土金属为氧化钙(CaO)或氢氧化钙(Ca(OH)2)的形式时与所述第一组分组合。
在另一种实施方式中,所述第二组分包含碱金属。优选地,所述第二组分的碱金属包括锂(Li)、钠(Na)和钾(K)的至少一种。
在一种实施方式中,所述第一组分12的硅与所述第二组分14的所述碱土金属和碱金属中至少一种的摩尔比为约1.0:0.1至约1.0:0.3。在优选实施方式中,第二组分14包含氧化钙或氢氧化钙形式的钙作为第二组分14的碱土金属元素。基于存在于第一组分12和第二组分14的固体混合物中的氧化钙量,氧化钙的浓度优选为合并的第一和第二组分的约5重量%至约30重量%。
在过程1中,第一组分12与第二组分14和液态水20合并以形成液体和固体的混合物。在一种实施方式中,存在的液态水的量是在所述液体和固体混合物中的液固重量比为约0.05:1至约5:1,优选约2:1至约3:1之间。
在优选实施方式中,所述合并的液体和固体混合物被湿联合研磨20,从而降低所述颗粒状带碱金属离子的架状硅酸盐的平均粒度,直到直径为5μm或更小的所述颗粒状带碱金属离子的架状硅酸盐的颗粒的重量百分比为至少约50%。所述液体和固体混合物的研磨是优选的、但是任选的。或者,所述固体和液体混合物可如下所述水热处理,其中首先进行湿联合研磨步骤。
所述液体和固体混合物通过暴露于升高的温度和压力而水热处理22,从而形成带碱金属离子的硅酸盐凝胶,“材料#1”24的关键组分。所述凝胶包含所述第一组分的碱金属,从而形成碱金属离子源。在优选实施方式中,所述液体和固体混合物暴露于约100℃至约350℃的温度和约100PSIG(磅力/平方英寸表压)至约500PSIG的压力二者下,从而形成带碱金属离子的硅酸盐凝胶。在具体的实施方式中,所述液体和固体混合物暴露于升高的温度和压力下,直到所述第一组分的基本上全部的碱金属作为硅酸盐凝胶的组分存在。
在同样在图1中表现的过程1I中,第一组分12与第二组分14合并,形成固体混合物并任选干研磨16。在过程1I中,第二组分14包含碱金属和碱土金属中至少一种的氧化物和氢氧化物的至少一种。任选地,第二组分14的碱金属可与第一组分12的碱金属相同。
过程1I的固体混合物然后如过程1进行水热处理,但是根据需要补给水,从而得到与过程1相同的液固重量比。如同过程1,水热处理导致形成带碱金属离子的硅酸盐凝胶,材料#1的关键组分。
在一种实施方式中,通过本发明的过程1或过程1I的方法形成的材料#1与土壤组合,形成混合物。优选地,硅酸盐凝胶与土壤的重量比为约0.0001:1至约0.01:1。
在另一种实施方式中,图1表现为“过程2”的本发明方法包括通过干研磨降低颗粒状带碱金属离子的架状硅酸盐的尺寸,直到至少约50重量%的所述颗粒具有等于或小于约5μm的直径,其利用激光衍射粒度分析仪以液体模式(水)通过激光衍射测量,而形成碱金属离子源,从而形成“材料#2”30。降低颗粒状带碱金属离子的架状硅酸盐的尺寸的合适方法的例子包括球磨和微粉化。用于所述方法的这种实施方式中的颗粒状带碱金属离子的架状硅酸盐的合适的源的例子如上所述。在优选实施方式中,所述颗粒状带碱金属离子的架状硅酸盐是矿石,例如正长岩,包括例如霞石正长岩,和花岗岩,并且降低所述正长岩尺寸的优选方法包括湿式球磨。
在一种实施方式中,本发明是通过本发明的方法从颗粒状带碱金属离子的架状硅酸盐形成的碱金属离子源。从中获得本发明的具有适中离子释放速率的碱金属离子源的合适的颗粒状带碱金属离子的架状硅酸盐的例子如上面所列。在一种实施方式中,所述碱金属离子源源自于钾长石并且Brunauer-Emmett-Teller(BET)比表面积为约8m2/g至约50m2/g,和微孔比表面积(宽度4至的孔、腔和缺陷的表面积)为约1m2/g至约10m2/g。
提供以下例子作为本发明的实施方式并且绝不是限制性的。
示例:
带有钾的造岩矿物的机械-水热改变
以下本发明的两种产物实施方式(材料#1和材料#2)与工业球磨矿物质粉末的非限制性实施例在表I和II中提供。根据本发明,表I报告了初始矿物(正长岩矿石)的化学(氧化物)和矿物质(相)组成的混合物、以及最终形成的产物的组成的例子。表II报告了由表I描述的混合物形成的本发明产物的一些物理性质。
实施例
10g粗略磨碎的原材料(碎正长岩矿石,尺寸<5mm的不规则粗晶粒)并且组成在表I中列出,与干燥的粉末状Ca(OH)2(Sigma-Aldrich,等级:≥96.0%≤3.0%碳酸钙)在添加水之前混合5-10分钟。根据表I列出的比例向所述混合物添加蒸馏水。所述悬液放入McCrone Microscope&Accessories(Westmount,Ill)的McCrone微粉化磨机的腔中,并研磨30分钟(研磨元件(玛瑙球)和样品之间的重量比是大约4)。研磨之后,所述悬液转移到可从Parr Instrument Co.(Moline,Ill)商购的批式压力容器并在约200℃的温度和约225PSIG的压力下不加搅拌保持约24小时。反应之后,所生成的含残余液体的固相在约110℃下干燥过夜。所述材料的最终组成在表I中作为实施例1、2和3列出。表I的实施例4、5和6仅通过干研磨获得。研磨在McCrone微粉化磨机中进行;研磨元件和矿物质样品之间的重量比为约67。这种研磨对相组成不具有显著的影响,但是提供的有益效果有利于增加钾释放速率,包括增加超细颗粒的可用表面积、体积和引入晶格扰乱。实施例7(实验中的对照样品)仅通过工业球磨从与实施例1、2和3相同的正长岩矿石制备。实施例8(实验中的对照样品)仅通过工业球磨从与实施例4、5和6相同的正长岩矿石制备。研磨参数在表I中列出,获得的材料的性质在表II中列出。以下分析技术用来表征关键的材料性质和性能:
每个合成样品根据Brunauer-Emmett-Teller测定比表面积(SSA-BET)。所述分析利用氮气作为吸附气体,用表面积和孔隙率分析仪进行。在本研究中,以Micrometric ASAP 2020表面积和孔隙率分析仪在77K下收集氮气吸附等温线,所述分析仪可得自Micrometrics Co.,Norcross,GA。样品在110℃下在低真空脱气~24小时。借助Brunauer-Emmett-Teller(BET)模型的SSA计算被应用于所述等温线的吸收分支。为了估算微孔面积(宽度为4-的孔面积和表面粗糙度),应用T-Plot模型。
利用激光衍射粒度分析仪LS 13 320(Beckman Coulter,Inc.)以液体模式(在水介质中)通过激光衍射法进行粉末样品的粒度分布(PSD)分析。在所述悬液初步超声处理旨在避免因团聚引起的随机误差之后,获得衍射图案。
通过粉末X-射线衍射得到相组成:样品在浸出试验之前和之后的粉末X-射线衍射图案利用可得自PANalytical,Co.的PANalytical X’Pert Pro衍射仪获得。使用推荐用于慢扫描复杂而结晶差的样品的扫描速率150秒/阶和入射/衍射光束光学器件。材料#1中结晶部分的相组成和非晶部分(K(Na)-A-S-H凝胶)的量通过利用可得自PANalytical,Co.的High-Score plus软件,进行XRD图谱的定量线形分析来测定。
所述材料的显微结构通过扫描电子显微术(SEM)和透射电子显微术(TEM)研究。扫描电子显微术(SEM)研究利用可得自JEOL USA,Inc.的JEOL 6610LV显微镜以低真空(30Pa)和高真空(<10-3Pa)两种模式进行。在高真空模式中,利用15-20kV加速电压、40-50点尺寸和1015mm工作距离来成像二次电子像(SE),以研究晶粒的微观结构和以微米/亚微米尺度观察表面粗糙度、拓扑结构、内含物和孔隙率。天然缺陷和污染(commination)引起的“人造”缺陷在这种模式中最好辨别。反散射电子成像(BSE)用于观察基于原子序数的各种相,以将晶粒尺寸、形状和它们的矿物学相关联(如果可能)。能量散射X-射线分析(EDX)用于组成映射。
营养元素释放(材料性能)如下研究。表II的“短期K释放累积值”对应于材料#1、材料#2和两种对照的3个批次——实施例7和8以pH=5的新鲜溶液在24小时内进行的从中释放的钾(K)的克数(g)总和(固液重量比=1:10,流入液的pH=5,t=22℃)。表II的“中期K释放累积值”对应于在10天内进行的10批(每批用保持相同的固液比的新鲜流入液替代旧的流入液)中释放的钾的克数总和(固液重量比=1:10,流入液的pH=5,t=22℃)。利用美国Agilent Technologies,Inc.提供的感应耦合等离子体质谱仪测量流出液中的元素浓度。通过用于测量K释放速率的相同方法来分析元素例如钙Ca和Si的释放。
表I
表II
*X-射线衍射分析揭示,材料#1的所有实施例,在分批浸出试验之前和之后都显示存在雪硅钙石-即通式为Ca5Si6O16(OH)2·nH2O*的结晶化合物,其中n~4。
**两个相代表最初包含在正长岩矿石中的K-长石。微斜长石和正长石二者的通式为KAlSi3O8。
***按照IUPAC,“凝胶”定义为它的全部体积被流体膨胀的非流体胶态网络或聚合物网络。铝硅酸盐凝胶含有[SiO4]4-和[AlO4]5-簇的无机胶态或聚合物网络。碱金属的电荷平衡离子沿着无规骨架分布。
除了X-射线衍射数据之外,通过透射电子显微术证实了由于水热处理在材料#1中形成的无定形K(Na)-A-S-H凝胶,所述图像在图2中显示。扫描电子显微术揭示了材料#1在亚微米-/微米尺度的显微结构(实施例1,在图3a-3d中描绘)。通过高分辨率的二次电子像说明了在材料#1中无定形凝胶与雪硅钙石的小晶体和残余的结晶K长石一起共存(图2a-2d)。材料#1(实施例1)的组成EDX映射显示了在主体材料中钾的分布(K用浅灰色显示)(图4)。
如上所述的材料#1和材料#2的累计钾释放以直方图和图5a-5b说明。钾的即时释放动力学在图6中绘制。
在pH≤5以及环境温度和压力下,材料#1和材料#2二者都通过两种主要的化学机制释放K+和其他离子:离子交换到材料-流体界面上和水解Al-O-Si和Si-O-Si键。如图5和6中可看到的,最初的溶解相对于K+流入液是高度不饱和的,导致材料#1和材料#2二者在24小时内迅速和明显的释放。随后的释放受水解速率限制,明显比最初的离子交换更慢。
可利用的比表面积(SSA-BET)、无定形部分的浓度(该参数只与材料#1有关并且表示为K(Na)-A-S-H凝胶的wt%,参见表II)和亚纳米尺度的缺陷的表面浓度(该参数与材料#1和材料#2二者相关并且通过微孔T-Plot面积估算,参见表II)有助于K释放的动力学控制。对于材料#1,如图5a可看出,所述SSA、无定形部分(凝胶)的浓度、和微孔面积(T-plot面积)越高,K+的释放速率也越高。例如:实施例1的材料#1的特征在于凝胶含量、SSA-BET和T-Plot面积最高;因此,它表现出是最高的(相对于对照样品7增加24-倍)。实施例2在如上所述的材料性质和K释放两个方面处于中间(相对于对照样品7增加13-倍)。实施例3的材料#1也遵循这种趋势并且具有最低(5-倍)的增加。雪硅钙石/(微斜长石+正长石)之间的重量比又对可迅速利用的Ca量有贡献:这个比率越高,Ca由于它在雪硅钙石结晶结构内的固定而利用度越低。
对于材料#2,微米尺寸颗粒的所述SSA-BET、微孔面积和体积浓度有助于离子释放动力学。其他参数相同,实施例4、5和6的材料相对于对照样品8分别显示出K释放的2-倍、3-倍和4-倍增加。比较材料#1和材料#2的K释放性能,可合理地得出结论,一般而言,仅有机械处理的效果明显低于机械-化学处理。
本文中引用的所有专利、公布的申请和参考文献的教导通过引用以其整体并入。
虽然本发明已经参考其示例性实施方式具体显示和描述,但本领域技术人员应理解,可以在其中做出形式和细节上的各种改变而不背离所附权利要求包括的本发明范围。
- 还没有人留言评论。精彩留言会获得点赞!