通过重组酵母生产3-羟基丙酸的制作方法
本申请要求于2012年11月30日提交的美国临时申请序列号61/731,722的优先权,将其内容通过引用完全结合在此。
对序列表的引用
本申请包括一个计算机可读形式的序列表,将其通过引用结合在此。
背景
涉及到石油的未来供应的忧虑已经推进了在其他原料的可再生能源和可再生资源的领域中的研究。生物燃料(如乙醇和生物塑料(例如,聚乳酸))是可以使用微生物直接从农业来源制造的产品的实例。然后可以使用非酶促化学转化得到另外的希望的产品,例如将乙醇脱水为乙烯。
3-羟基丙酸(3-HP)是一种由美国能源部鉴定为可以通过发酵制造的排名前12的高潜力结构单元化学品之一的三碳羧酸。作为乳酸(2-羟基丙酸)的异构体的3-HP的替代名称包括乙烯乳酸和3-羟基丙酸化物。3-HP是一种有吸引力的可再生平台化学品,来自葡萄糖的理论产量为100%,具有允许它参与不同种化学反应的多种官能团,以及低的毒性。可以将3-HP用作底物来形成若干日用化学品,例如1,3-丙二醇、丙二酸、丙烯酰胺、以及丙烯酸。丙烯酸是一种用来生产丙烯酸酯和超强吸收能力聚合物的大量化学品(>70亿磅/年),并且目前来源于丙烯的催化氧化。3-HP的发酵性生产将为作为这些商业上有意义的化学品的原料的石油化学产品提供可持续的替代物,从而减少能量消耗、US对外国石油的依赖以及温室气体的产生。
可以使用细菌将糖发酵为有机酸。然而,对于大规模有机酸生产而言,细菌显示出某些缺陷。随着产生有机酸,发酵培养基变得越来越酸性。较低的pH条件实际是优选的,因为所得产物部分地或完全地处于酸形式。然而,大部分产生有机酸的细菌在强酸环境中表现不佳,并且因此当培养基变得更具酸性时,它们死亡或开始产生地如此慢,以至于变得经济上不可行。为了防止这一情况,缓冲培养基以维持较高的pH成为必要。然而,这使得回收有机酸产物更加困难且昂贵。
近年来,围绕使用酵母将糖发酵为有机酸的兴趣已经越来越多。酵母在多种工业发酵中被用作生物催化剂,并且显示出优于细菌的若干优势。虽然许多细菌不能合成它们生长和有效代谢糖所需的某些氨基酸或蛋白质,但是大部分酵母物种可以从无机氮化合物合成它们必需的氨基酸或蛋白质。酵母还不易受噬菌体感染的影响,噬菌体感染可以导致细菌的生产力丧失或其中的整个发酵运行亏损。
尽管酵母是有机酸生产的有吸引力的候选物,但是它们显示出若干困难。首先,酵母中的途径工程典型地难于细菌。酵母中的酶被分隔在细胞质、线粒体或过氧化物酶体中,而细菌中的酶被合并在细胞质中。这意味着可能需要除去靶向信号,以保证生物合成途径的酶共存于单个细胞内的同一区室中。可能还需要控制途径中间体在这些区室之间的运送,以使至希望的产物的碳流最大化。其次,并不是所有酵母物种都满足大规模经济发酵所必需的标准。事实上,仅有一小部分的酵母具有足够高的体积和特定糖利用率与在较低pH条件下有力生长的能力的组合。美国能源部估计,大约2.5g/L/小时的生产率对于若干有机酸(包括3-HP)的经济发酵而言是必需的(http://www1.eere.energy.gov/biomass/pdfs/35523.pdf)。
尽管许多酵母物种天然地将己糖发酵为乙醇,但是即使有也极少数天然地产生显著产量的有机酸。这已导致努力在遗传上修饰各种酵母物种,以产生有机酸。先前已经通过破坏内源性丙酮酸脱羧酶(PDC)基因并插入乳酸脱氢酶(LDH)基因以消除乙醇产生而研发了产生乳酸的遗传修饰的酵母菌株(参见例如,WO 99/14335、WO 00/71738、WO 02/42471、WO 03/049525、WO 03/102152以及WO 03/102201)。这一改变将糖代谢从产生乙醇转移至产生乳酸。酵母的发酵产物和途径不同于细菌的发酵产物和途径,并且因此需要不同的工程方法使产量最大化。可能需要消除或减少以便增强有机酸产物产量或纯度的其他天然产品是甘油、乙酸盐(酯)和二醇。遗传改变的酵母菌株中的甘油的减少描述于例如WO 07/106524中。
不同于乳酸,3-HP不是在自然界中已知的任何途径的主要终产物,仅仅在一些细菌和真菌中发现了痕量。因此,需要更大量的遗传工程产生生产3-HP的酵母。先前将酿酒酵母菌株工程化为通过乳酸中间体产生非常低水平的3-HP(参见WO 02/042418)。然而,野生型酿酒酵母的耐受水平使得它不足以成为3-HP生产的最优宿主。对3-HP高度耐受的酵母细胞描述于US 2012/0135481中。然而,在本领域中仍需要进一步以一种更成本有效的方式改进工业规模的3-HP生产。
概述
在此描述了具有主动3-HP途径的重组酵母细胞,其中该途径包括非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)活性。在一些方面中,这些重组酵母细胞包括一种异源多核苷酸,该异源多核苷酸编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)。
在一个方面中,是一种重组酵母细胞,该重组酵母细胞包括(1)一种主动3-HP途径,该主动3-HP途径通过β-丙氨酸中间体进行,以及(2)一种异源多核苷酸,该异源多核苷酸编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN),其中该细胞能够产生3-HP。在一些实施例中,该细胞包括一种异源多核苷酸,该异源多核苷酸编码天冬氨酸1-脱羧酶(ADC)。在一些实施例中,该GAPN与SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的氨基酸序列具有至少50%序列一致性。
在另一个方面中,是一种重组酵母细胞,该重组酵母细胞包括(1)一种主动3-HP途径,以及(2)一种异源多核苷酸,该异源多核苷酸编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN),其中该GAPN:(a)与SEQ ID NO:192的氨基酸序列具有至少50%序列一致性;或(b)与SEQ ID NO:194的氨基酸序列具有至少80%序列一致性;并且其中该细胞能够产生3-HP。
在一些方面中,当在相同条件下培养时,与不具有编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)的该异源多核苷酸的细胞相比,这些重组酵母细胞产生更大量的3-HP。
在一些方面中,这些重组酵母细胞包括一种或多种(例如,两种、若干种)选自以下各项的异源多核苷酸:编码PPC的异源多核苷酸、编码PYC的异源多核苷酸、编码AAT的异源多核苷酸、编码ADC的异源多核苷酸、编码BAAT或gabT的异源多核苷酸以及编码3-HPDH的异源多核苷酸。
在一些实施例中,这些重组酵母细胞包括对编码PDC、ADH、GAL6、CYB2A、CYB2B、GPD、GPP、ALD或PCK的一种或多种内源基因的破坏。在一些实施例中,这些重组酵母细胞包括对编码PDC的内源基因和编码GPD的内源基因中的一个或两个的破坏。
在一些实施例中,该酵母细胞是伊萨酵母属、假丝酵母属、克鲁维酵母属、毕赤酵母属、裂殖酵母属、有孢圆酵母属、接合酵母属或酵母属酵母细胞。在一些实施例中,该酵母细胞是东方伊萨酵母CNB1酵母细胞。在一些实施例中,该重组酵母细胞是一种3-HP耐受酵母细胞。在一些实施例中,该细胞不能发酵戊糖。
还描述了生产3-HP以及相关化合物的方法。在一个方面中,是一种生产3-HP的方法,该方法包括:(a)在适合生产3-HP的条件下,在培养基中培养在此描述的重组酵母细胞;并且(b)回收3-HP。在另一个方面中,是一种生产丙烯酸或其盐的方法,该方法包括:(a)在适合生产3-HP的条件下,在培养基中培养在此描述的重组酵母细胞;(b)回收3-HP;(c)在适合生产丙烯酸或其盐的条件下,将3-HP脱水;并且(d)回收丙烯酸或其盐。
附图简要说明
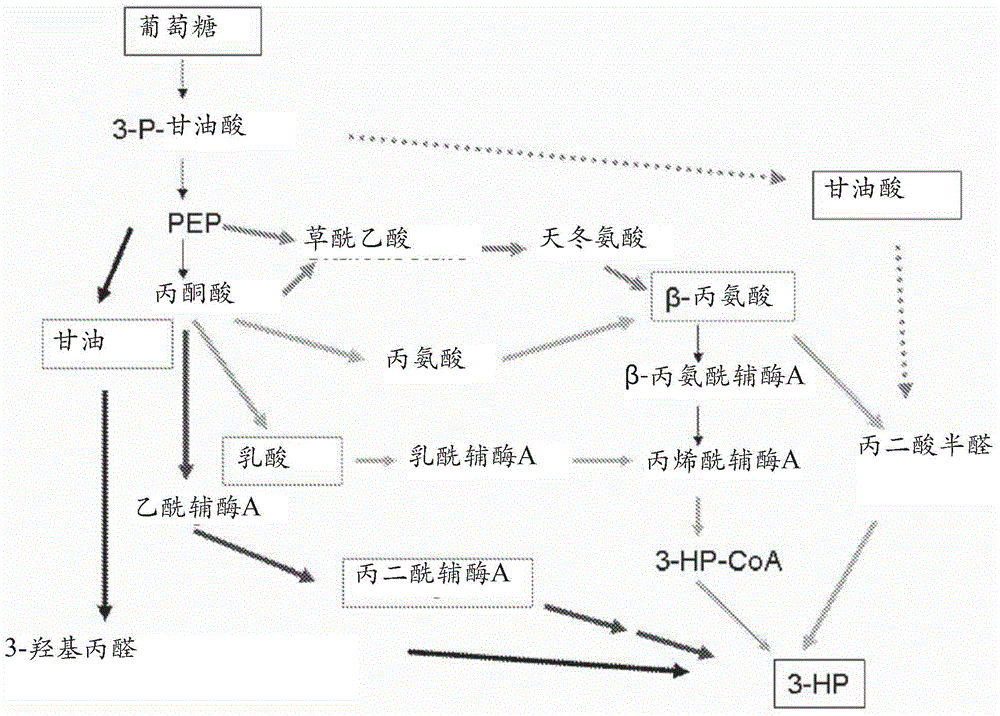
图1示出了从葡萄糖的选择性3-HP途径的概述。
图2示出了用于产生3-磷酸甘油酸的途径的概述。
图3示出了pMBin222的质粒图。
图4示出了pMcTs102的质粒图。
图5示出了pMcTs125的质粒图。
图6示出了pMcTs65的质粒图。
图7示出了pCKle73的质粒图。
图8示出了pSTK8的质粒图。
图9示出了pMcTs128的质粒图。
图10示出了pMBin227的质粒图。
图11示出了pMlBa157的质粒图。
图12示出了pMlBa158的质粒图。
图13示出了pMlBa162的质粒图。
图14示出了pMeJi322的质粒图。
图15示出了pMeJi323-3的质粒图。
图16示出了pMlBa163的质粒图。
图17示出了3-HP/DCW的发酵曲线图。
图18示出了消耗葡萄糖/DCW的发酵曲线图。
图19示出了pMBin240的质粒图。
图20示出了pMBin241的质粒图。
图21示出了来自在此描述的若干菌株的GAPN活性曲线图。
定义
3-HP:术语“3-HP”包括“3-羟基丙酸”的盐和酸形式。
主动3-HP途径:如在此使用,具有“主动3-HP途径”的宿主细胞以一种量产生催化代谢途径的每个反应所必需的活性酶,该量足以从可发酵糖产生3-HP,并且因此当在至少一种可发酵糖的存在下在发酵条件下培养时,该宿主细胞能够以可测量的产量产生3-HP。具有主动3-HP途径的宿主细胞包括一个或多个3-HP途径基因。如在此使用,“3-HP途径基因”是指一种编码在主动3-HP途径中涉及的酶的基因。
催化主动3-HP途径中的每个反应所必需的活性酶可以来自内源基因表达的活性、异源基因表达的活性、或来自内源基因和异源基因表达的活性的组合,如在此更加详细地描述。
非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN):在此将术语“非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶”、“NADP依赖性甘油醛-3-磷酸脱氢酶”或“GAPN”定义为催化甘油醛-3-磷酸和NADP+至3-磷酸甘油酸和NADPH的化学反应的酶(例如,EC 1.2.1.9)。可以如在本领域所描述,例如如在塔莫伊(Tamoi)等人,1996,生物化学杂志(Biochem.J.)316,685-690中所描述;或如在于此的实例中所描述,从无细胞提取物中确定GAPN活性。例如,可以通过在一种反应混合物中监测在NADPH氧化后340nm处的吸光度变化而用分光光度计测量GAPN活性,该反应混合物包含100mM Tris/HCl缓冲液(pH 8.0)、10mM MgCl2、10mM GSH、5mM ATP、0.2mM NADPH、2个单位的3-磷酸甘油酸磷酸激酶、2mM 3-磷酸甘油酸以及该酶。
破坏:术语“破坏”意指参照基因的编码区和/或控制序列被部分或完全修饰(例如通过缺失、插入和/或取代一个或多个核苷酸),从而使得编码的多肽的表达不存在(失活)或降低,和/或编码的多肽的酶活性不存在或降低。可以使用本领域已知的技术测量破坏效果,如使用来自在此参照的无细胞提取物测量值检测酶活性的不存在或降低;或通过对应的mRNA的不存在或降低(例如,至少25%降低、至少50%降低、至少60%降低、至少70%降低、至少80%降低或至少90%降低);具有酶活性的对应多肽的量的不存在或降低(例如,至少25%降低、至少50%降低、至少60%降低、至少70%降低、至少80%降低或至少90%降低);或具有酶活性的对应多肽的比活性的不存在或降低(例如,至少25%降低、至少50%降低、至少60%降低、至少70%降低、至少80%降低或至少90%降低)。可以通过本领域已知的方法破坏感兴趣的具体基因,例如通过直接同源重组(参见酵母遗传学方法(Methods in Yeast Genetics)(1997版),亚当斯(Adams),戈特斯科林(Gottschling),凯泽(Kaiser)及施特姆斯(Stems),冷泉港出版社(Cold Spring Harbor Press)(1998))。
编码序列:术语“编码序列”或“编码区”意指指定一个多肽的氨基酸序列的多核苷酸序列。编码序列的边界一般由开放阅读框架决定,该开放阅读框架通常以ATG起始密码子或替代性起始密码子(例如GTG和TTG)开始,并且以终止密码子(例如TAA、TAG、和TGA)结束。编码序列可以是基因组DNA、cDNA、合成的多核苷酸、和/或重组多核苷酸的一个序列。
序列一致性:两个氨基酸序列之间或者两个核苷酸序列之间的关联度通过参数“序列一致性”来描述。
出于在此所述的目的,使用尼德尔曼-翁施(Needleman-Wunsch)算法(尼德尔曼和翁施,分子生物学杂志(J.Mol.Biol.)1970,48,443-453)来确定两个氨基酸序列之间的序列一致性程度,该算法是如在EMBOSS包(EMBOSS:欧洲分子生物学开放软件套件(The European Molecular Biology Open Software Suite),赖斯(Rice)等人,遗传学趋势(Trends Genet.)2000,16,276-277)(优选3.0.0版或更新版本)的尼德尔(Needle)程序中所实施的。所使用的这些任选参数是空位开放罚分10、空位延伸罚分0.5,及EBLOSUM62(BLOSUM62的EMBOSS版本)取代矩阵。尼德尔标注的“最长的一致性”的输出(使用-非简化选项获得)被用作百分比一致性,并且如下计算:
(一致的残基X 100)/(参照序列的长度-比对中的空位总数)
出于在此所述的目的,使用尼德曼-翁施算法(尼德曼(Needleman)和翁施(Wunsch),1970,见上文)来确定两个脱氧核糖核苷酸序列之间的序列一致性程度,该算法是如在EMBOSS软件包(EMBOSS:欧洲分子生物学开放软件套件,赖斯(Rice)等人,2000,见上文)(优选3.0.0版或更新版本)的尼德尔程序中所实施的。所使用的这些任选参数是空位开放罚分10、空位延伸罚分0.5,及EDNAFULL(NCBI NUC4.4的EMBOSS版本)取代矩阵。尼德尔标注的“最长的一致性”的输出(使用-非简化选项获得)被用作百分比一致性,并且如下计算:
(一致的脱氧核糖核苷酸X 100)/(参照序列的长度-比对中的空位总数)
异源多核苷酸:在此将术语“异源多核苷酸”定义为以下多核苷酸:对该宿主细胞而言不是天然的多核苷酸;已经对编码区做出结构修饰的天然多核苷酸;由于通过重组DNA技术(例如,一种不同的(外源的)启动子)对DNA的操作而定量改变其表达的天然多核苷酸;或具有该多核苷酸的一个或多个额外的拷贝以定量改变表达的宿主细胞中的天然多核苷酸。“异源基因”是包括异源多核苷酸的基因。
内源基因:术语“内源基因”意指对参照宿主细胞而言天然的基因。“内源基因表达”意指内源基因的表达。
核酸构建体:术语“核酸构建体”意指一种包括一个或多个(例如,两个、若干个)控制序列的多核苷酸。多核苷酸可以是单链的或双链的,并且可以分离自天然存在的基因、可以被修饰来以另外的不会在自然界中存在的方式包含核酸的区段,或可以是合成的。
控制序列:术语“控制序列”意指多肽表达所必需的核酸序列。控制序列对于编码多肽的多核苷酸可以是天然的或外源的,并且彼此可以是天然的或外源的。此类控制序列包括但不限于,前导子序列、多聚腺苷酸化序列、前肽序列、启动子序列、信号肽序列及转录终止子序列。出于引入有利于将这些控制序列与编码一种多肽的多核苷酸的编码区连接的特异性限制酶切位点的目的,这些控制序列可以提供有多个接头。
可操作地连接:术语“可操作地连接”意指如下的构造,其中,控制序列相对于多核苷酸的编码序列安置在适当位置处,从而使得该控制序列指导该编码序列的表达。
表达:术语“表达”包括生产多肽涉及的任何步骤,包括但不局限于:转录、转录后修饰、翻译、翻译后修饰、和分泌。可以对表达进行测量—例如,来检测增加的表达—通过本领域已知的技术,例如测量mRNA和/或翻译的多肽的水平。
表达载体:术语“表达载体”意指一种线性或环形的DNA分子,该分子包括编码一种多肽的多核苷酸并且被可操作地连接至控制序列,其中这些控制序列提供编码该多肽的多核苷酸的表达。最低限度上,该表达载体包括启动子序列,以及转录和翻译终止信号序列。
宿主细胞:术语“宿主细胞”意指对用核酸构建体或表达载体进行的转化、转染、转导等是易感的任何细胞类型。术语“宿主细胞”涵盖由于复制期间发生的突变而与亲本细胞不同的亲本细胞的任何后代。在此将术语“重组酵母细胞”定义为包括一种或多种(例如,两种、若干种)异源多核苷酸的非天然存在的酵母宿主细胞。
等位基因变体:术语“等位基因变体”意指占据同一染色体基因座的基因的两种或更多种可替代形式中的任一种。等位基因变异由突变天然产生,并且可以导致群体内的多态性。基因突变可以是沉默的(在所编码的多肽中没有改变)或可编码具有改变的氨基酸序列的多肽。多肽的等位基因变体是由基因的等位基因变体编码的多肽。
体积生产力:术语“体积生产力”是指每单位时间使用的每体积系统(例如,培养基和其中的内容物的总体积)产生的参照产物的量(例如,产生的3-HP的量)。
可发酵的培养基:术语“可发酵的培养基”或“发酵培养基”是指包括一种或多种(例如,两种、若干种)糖的培养基,例如葡萄糖、果糖、蔗糖、纤维二糖、木糖、木酮糖、阿拉伯糖、甘露糖、半乳糖和/或可溶性低聚糖,其中该培养基能够部分地被宿主细胞转化(发酵)为希望的产物,例如3-HP。在一些情况下,这种发酵培养基来源于天然来源,例如甘蔗、淀粉、或纤维素;并且可以来自这种来源的酶水解(糖化作用)的预处理。
高严谨度条件:术语“高严谨度条件”意指对于长度为至少100个核苷酸的探针而言,遵循标准DNA印迹程序,在42℃下在5X SSPE、0.3%SDS、200微克/ml剪切并变性的鲑鱼精子DNA和50%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用0.2X SSC、0.2%SDS,在65℃下洗涤三次,每次15分钟。
低严谨度条件:术语“低严谨度条件”意指对于长度为至少100个核苷酸的探针而言,遵循标准DNA印迹程序,在42℃下在5X SSPE、0.3%SDS、200微克/ml剪切并变性的鲑鱼精子DNA和25%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用0.2X SSC、0.2%SDS,在50℃下洗涤三次,每次15分钟。
中严谨度条件:术语“中严谨度条件”意指对于长度为至少100个核苷酸的探针而言,遵循标准DNA印迹程序,在42℃下在5X SSPE、0.3%SDS、200微克/ml剪切并变性的鲑鱼精子DNA和35%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用0.2X SSC、0.2%SDS,在55℃下洗涤三次,每次15分钟。
中-高严谨度条件:术语“中-高严谨度条件”意指对于长度为至少100个核苷酸的探针而言,遵循标准DNA印迹程序,在42℃下在5X SSPE、0.3%SDS、200微克/ml剪切并变性的鲑鱼精子DNA和35%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用0.2X SSC、0.2%SDS,在60℃下洗涤三次,每次15分钟。
非常高严谨度条件:术语“非常高严谨度条件”是指对于长度为至少100个核苷酸的探针而言,遵循标准DNA印迹程序,在42℃下在5X SSPE、0.3%SDS、200微克/ml剪切并变性的鲑鱼精子DNA和50%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用0.2X SSC、0.2%SDS,在70℃下洗涤三次,每次15分钟。
非常低严谨度条件:术语“非常低严谨度条件”是指对于长度为至少100个核苷酸的探针而言,遵循标准DNA印迹程序,在42℃下在5X SSPE、0.3%SDS、200微克/ml剪切并变性的鲑鱼精子DNA和25%甲酰胺中预杂交和杂交12至24小时。载体材料最终使用0.2X SSC、0.2%SDS,在45℃下洗涤三次,每次15分钟。
缩写:3-HPA,3-羟基丙醛;3-HPDH,3-羟基丙酸脱氢酶;AAM,丙氨酸2,3氨基变位酶;AAT,天冬氨酸转氨酶;ACC,乙酰辅酶A羧化酶;ADC,天冬氨酸1-脱羧酶;AKG,α-酮戊二酸;ALD,醛脱氢酶;BAAT,β-丙氨酸转氨酶;BCKA,支链α-酮酸脱羧酶;bp,碱基对;CYB2,L-(+)-乳酸-细胞色素c氧化还原酶;CYC,异-2-细胞色素c;EMS,乙烷甲基磺化酶(sulfonase);ENO,烯醇酶;gabT,4-氨基丁酸转氨酶;GAPDH,甘油醛-3-磷酸脱氢酶;GPD,甘油3-磷酸脱氢酶;GPP,甘油3-磷酸磷酸酶;HIBADH,3-羟基异丁酸脱氢酶;IPDA,吲哚丙酮酸脱羧酶;KGD,α-酮戊二酸脱羧酶;LDH,乳酸脱氢酶;MAE,苹果酸酶;OAA,草酰乙酸;PCK,磷酸烯醇式丙酮酸羧激酶;PDC,丙酮酸脱羧酶;PDH,丙酮酸脱氢酶;PEP,磷酸烯醇式丙酮酸;PGK,磷酸甘油酸激酶;PPC,磷酸烯醇式丙酮酸羧化酶;PYC,丙酮酸羧化酶;RKI,核糖5-磷酸-酮醇异构酶;TAL,转醛醇酶;TEF1,翻译延长因子-1;TEF2,翻译延长因子-2;TKL,转酮醇酶;XDH,木糖醇脱氢酶;XR,木糖还原酶;YP,酵母提取物/蛋白胨。
在此提及“约”一个数值或参数包括指向那个数值或参数本身的方面。例如,提及“约X”的描述包括方面“X”。当与测量值组合使用时,“约”包括涵盖至少与测量该具体数值的方法相关的不确定性的范围,并且可以包括在给定的数值附近正或负两个标准差的范围。
如在此和所附权利要求书中所使用,单数形式“一种/个”、“或”以及“该”包括复数指示物,除非上下文以另外的方式清楚表明。应该理解的是在此描述的这些方面包括“由……方面组成”和/或“基本由……方面组成”。
除非由上下文以另外的方式定义或清楚表明,在此使用的所有技术术语和科学术语具有如本领域的普通技术人员所通常理解的相同的含义。
详细说明
在此尤其描述了具有主动3-HP途径的重组酵母细胞,这些重组酵母细胞进一步包括一种异源多核苷酸,该异源多核苷酸编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)。申请人已经出人意料地发现,与不具有编码GAPN的异源多核苷酸的细胞相比,GAPN的表达与经由-丙氨酸的主动3-HP途径一起增强代谢性3-HP的产生。已知在细胞外运送3-HP盐是消耗ATP的(范马里斯(van Maris)等人代谢工程(Metabolic Engineering)2004,6,245-255)。因此,在表达GAPN的细胞中增加的细胞外3-HP是出乎意料的,因为当在丙酮酸的途中产生3-磷酸甘油酸时,GAPN绕过ATP的产生(参见图2)。
申请人的发现,即表达GAPN以增加3-HP产生,对于酵母细胞而言可以是特别适用的,相信这些酵母细胞缺乏GAPN活性。另外,由于GAPN产生NADPH而非NADH(参见图2),因此表达GAPN对于在以下细胞中产生3-HP而言也可以是适用的,这些细胞是可以从增加的NADPH受益的细胞(例如,过表达利用NADPH的酶(如EC 1.1.1.298类别的3-HPDH)的细胞)或可以从减少的NADH受益的细胞(例如,具有对内源GPD或PDC基因的破坏,从而积累NADH的细胞)。
在一个方面中,该重组酵母细胞包括一种编码GAPN的异源多核苷酸并且当在相同条件下培养时,与不具有该异源多核苷酸的酵母细胞相比,产生(或能够产生)更大量的3-HP。在一些方面中,该酵母细胞缺乏内源GAPN基因。在一些实施例中,当在相同条件下培养时,与不具有编码GAPN的异源多核苷酸的细胞相比,该酵母细胞产生(或能够产生)多至少10%(例如,多至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少75%、至少100%或至少200%)的3-HP。
非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)
该非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)可以是适于宿主细胞及其在此描述的使用方法的任何GAPN,如天然存在的GAPN(例如,内源GAPN或来自另一物种的天然GAPN)或保留GAPN活性的其变体。在一个方面中,GAPN存在于宿主细胞的胞液中。
在一些方面中,当在相同条件下培养时,与不具有编码GAPN的异源多核苷酸的宿主细胞相比,包括编码GAPN的异源多核苷酸的重组酵母细胞具有增加水平的GAPN活性。在一些方面中,当在相同条件下培养时,与不具有编码GAPN的异源多核苷酸的宿主细胞相比,这些酵母细胞具有增加至少5%,例如至少10%、至少15%、至少20%、至少25%、至少50%、至少100%、至少150%、至少200%、至少300%或至少500%的GAPN活性水平。
可以与在此描述的宿主细胞和使用方法一起使用的示例性GAPN包括但不限于表1中示出的那些GAPN。
表1.
编码适合的GAPN的另外的多核苷酸可以获得自任何适合属的微生物,包括在UniProtKB数据库(www.uniprot.org)内可容易获得的那些。在一个方面中,该GAPN是革兰氏阳性细菌GAPN或获得自在此描述的微生物中的任何微生物的GAPN,例如光合作用的真核生物(包括植物和绿藻)或古生菌。
例如,该GAPN可获得自以下物种中的任一种:芹菜、拟南芥、花生、意大利海芋(Arum italicum)、蜡状芽孢杆菌、地衣芽孢杆菌、苏云金芽孢杆菌、甜菜、莱茵衣藻、丙酮丁醇梭菌、丙酮丁醇梭菌、艰难梭菌、巴氏梭菌、产气荚膜梭菌、生孢梭菌、小白屈菜(Ficaria verna)、巴西橡胶树、德氏乳杆菌、炽热甲烷嗜热菌(Methanothermus fervidus)、豌豆、蓖麻、菠菜、无乳链球菌、马肠链球菌、变形链球菌、化脓链球菌、硫磺矿硫化叶菌、硫磺矿硫化叶菌、硫磺矿硫化叶菌、硫磺矿硫化叶菌、细长聚球藻(Synechococcus elongatus)PCC 7942、黄槿(Talipariti tiliaceum)、附着热变形菌(Thermoproteus tenax)、小麦或玉蜀黍。
该GAPN可以是革兰氏阳性细菌GAPN,例如芽孢杆菌属、链球菌属、链霉菌属、葡萄球菌属、肠球菌属、乳杆菌属、乳球菌属、梭菌属、土芽孢杆菌属或海洋芽孢杆菌属GAPN。在一个方面中,该GAPN是嗜碱芽孢杆菌、解淀粉芽孢杆菌、短芽孢杆菌、环状芽孢杆菌、克劳氏芽孢杆菌、凝结芽孢杆菌、坚强芽孢杆菌、灿烂芽孢杆菌、迟缓芽孢杆菌、地衣芽孢杆菌、巨大芽孢杆菌、短小芽孢杆菌、嗜热脂肪芽孢杆菌、枯草芽孢杆菌、或苏云金芽孢杆菌GAPN。在另一个方面中,该GAPN是似马链球菌、化脓链球菌、乳房链球菌或马链球菌兽疫亚种GAPN。在另一个方面中,该GAPN是不产色链霉菌、阿维链霉菌、天蓝色链霉菌、灰色链霉菌或变铅青链霉菌GAPN。
在一个方面中,该GAPN是链球菌属GAPN,例如SEQ ID NO:154的变形链球菌GAPN或SEQ ID NO:158的马肠链球菌GAPN。在一个方面中,该GAPN是梭菌属GAPN,例如SEQ ID NO:190的丙酮丁醇梭菌GAPN。在一个方面中,该GAPN是玉蜀黍属GAPN,例如SEQ ID NO:159或192的玉蜀黍GAPN。在一个方面中,该GAPN是乳杆菌属GAPN,例如SEQ ID NO:194的德氏乳杆菌GAPN。
应当理解的是,对于前述物种,包括完全和不完全状态,及其他分类学等同物,例如无性型,无论已知的它们知道的物种名称是什么。本领域的普通技术人员将容易地识别适当等效物的身份。
这些物种的菌株可以容易地在许多培养物保藏中心为公众所获得,如美国典型培养物保藏中心(ATCC)、德国微生物菌种保藏中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH,DSM)、荷兰菌种保藏中心(Centraalbureau Voor Schimmelcultures,CBS)、以及美国农业研究菌种保藏中心北方地区研究中心(NRRL)。
可以使用GAPN编码序列或其子序列;连同对应的氨基酸序列或其片段来设计核酸探针以根据本领域熟知的方法来鉴定并克隆来自不同属或种的菌株的GAPN。具体地说,这类探针可以用于按照标准DNA印迹程序与感兴趣的属或种的基因组或cDNA杂交,以便鉴定并分离其中的相应基因。这样的探针可以大大短于整个序列,例如至少14个核苷酸、至少25个核苷酸、至少35个核苷酸、至少70个核苷酸长度。该探针可以更长,例如至少100个核苷酸、至少200个核苷酸、至少300个核苷酸、至少400个核苷酸、至少500个核苷酸长度。可以使用甚至更长的探针,例如至少600个核苷酸、至少700个核苷酸、至少800个核苷酸、或至少900个核苷酸长度。DNA和RNA探针两者都可使用。典型地将探针进行标记,用于检测相应的基因(例如,用32P、3H、35S、生物素或抗生物素蛋白)。
可以针对与以上描述的探针杂交并且编码具有GAPN活性的多肽的DNA,对从这类其他菌株制备的基因组DNA或cDNA库进行筛选。来自这类其他菌株的基因组DNA或其他DNA可以通过琼脂糖或聚丙烯酰胺凝胶电泳,或其他分离技术来分离。来自文库的DNA或分离的DNA可转移到并固定在硝酸纤维素或其他适合的载体材料上。为了鉴定与GAPN编码序列或其子序列同源的克隆或DNA,在DNA印迹法中可以使用载体材料。
出于上述探针的目的,杂交是指,在非常低至非常高严谨度条件下,多核苷酸杂交至标记的核酸探针或其全长互补链或前述各项的子序列。在这些条件下,核酸探针杂交的分子可以使用例如X射线胶片而进行检测。对于长度为至少100个核苷酸的长探针而言,非常低至非常高严谨度条件和洗涤条件是如上文所述定义的。对于长度为约15个核苷酸至约70个核苷酸的短探针而言,严谨度条件和洗涤条件是如上文所述定义的。
也可以使用以上提到的探针从其他来源,包括从自然界(例如,土壤、堆肥、水、青贮等)分离的微生物或直接从天然材料(例如,土壤、堆肥、水、青贮等)获得的DNA样品鉴定并获得GAPN。用于从自然生活环境中直接分离微生物和DNA的技术是本领域熟知的。随后可以通过类似地筛选另一种微生物的基因组或cDNA文库或混合DNA样品衍生编码GAPN的多核苷酸。一旦已经用如在此描述的适合的探针检测到编码GAPN的一种多核苷酸,则可以通过利用本领域的普通技术人员已知的技术来分离或克隆该序列(参见例如,J.萨姆布鲁克(Sambrook),E.F.弗里奇(Fritsch)和T.马尼亚蒂斯(Maniatis),1989,分子克隆实验手册(Molecular Cloning,A Laboratory Manual),第2版,冷泉港(Cold Spring Harbor),纽约)。
用来分离或克隆编码GAPN的多核苷酸的技术包括从基因组DNA分离、从cDNA制备或其组合。可以例如通过使用熟知的聚合酶链反应(PCR)或表达文库的抗体筛选来检测具有共有结构特征的克隆DNA片段,实现从此类基因组DNA克隆多核苷酸。参见例如,英尼斯(Innis)等人,1990,PCR:方法和应用指南(PCR:A Guide to Methods and Application),学术出版社(Academic Press),纽约。还可以使用其他核酸扩增程序,诸如连接酶链式反应(LCR)、连接激活转录(LAT)、和基于核苷酸序列的扩增(NASBA)。
在一个方面中,该GAPN与在此描述的任何GAPN(例如,SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的任何GAPN)具有至少50%,例如至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列一致性。在一个方面中,该GAPN序列与在此描述的任何GAPN(例如,SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的任何GAPN)相差不多于十个氨基酸,例如相差不多于五个氨基酸、相差不多于四个氨基酸、相差不多于三个氨基酸、相差不多于二个氨基酸或相差一个氨基酸。在一个方面中,该GAPN包括在此描述的任何GAPN(例如,SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的任何GAPN)的氨基酸序列、等位基因变体或具有GAPN活性的其片段或者由其组成。在一个方面中,该GAPN具有一个或多个(例如,两个、若干个)氨基酸的氨基酸取代、缺失和/或插入。在一些方面中,氨基酸取代、缺失和/或插入的总数不多于10,例如不多于9、8、7、6、5、4、3、2或1。
氨基酸变化通常是一种次要性质的变化,即并不显著影响蛋白质的折叠和/或活性的保守氨基酸取代或插入;典型地具有一种到约30个氨基酸的小缺失;氨基-末端或羧基-末端小延伸,如一种氨基-末端蛋氨酸残基;具有多达约20-25个残基的一种小连接肽;或通过改变净电荷促进纯化或另一种功能的一种小延伸,如一种聚组氨酸段(poly-histidine tract)、一种抗原表位或一种结合域。
保守取代的实例是在下组的范围内:碱性氨基酸(精氨酸、赖氨酸及组氨酸)、酸性氨基酸(谷氨酸和天冬氨酸)、极性氨基酸(谷氨酰胺和天冬酰胺)、疏水性氨基酸(亮氨酸、异亮氨酸及缬氨酸)、芳香族氨基酸(苯丙氨酸、色氨酸及酪氨酸)及小氨基酸(甘氨酸、丙氨酸、丝氨酸、苏氨酸及甲硫氨酸)。一般不会改变比活性的氨基酸取代是本领域已知的并且例如由H.诺伊拉特(Neurath)和R.L.希尔(Hill),1979,在蛋白质(The Proteins),学术出版社(Academic Press),纽约中描述。最常发生的交换是Ala/Ser、Val/Ile、Asp/Glu、Thr/Ser、Ala/Gly、Ala/Thr、Ser/Asn、Ala/Val、Ser/Gly、Tyr/Phe、Ala/Pro、Lys/Arg、Asp/Asn、Leu/Ile、Leu/Val、Ala/Glu、和Asp/Gly。
可替代地,氨基酸改变具有这样一种性质:改变多肽的物理化学特性。例如,氨基酸改变可以改善GAPN的热稳定性、改变底物特异性、改变最适pH等。
可以根据本领域已知的程序来鉴定必需氨基酸,例如定点诱变或丙氨酸扫描诱变(坎宁安(Cunningham)和威尔斯(Wells),1989,科学(Science)244:1081-1085)。在后一项技术中,在该分子中的每个残基处引入单个丙氨酸突变,并且对所得突变体分子的GAPN活性进行测试以鉴定对于该分子的活性至关重要的氨基酸残基。还参见,希尔顿(Hilton)等人,1996,生物化学杂志(J.Biol.Chem.)271:4699-4708。也可结合假定接触位点氨基酸的突变,如通过以下技术例如核磁共振、结晶学、电子衍射、或光亲和标记进行确定,对结构进行物理学分析,从而确定GAPN的活性位点或其他生物学相互作用。参见例如德福斯(de Vos)等人,1992,科学255:306-312;史密斯(Smith)等人,1992,分子生物学杂志224:899-904;沃勒达尔(Wlodaver)等人,1992,欧洲生物化学学会联盟通讯(FEBS Lett.)309:59-64。还可以从与参照GAPN相关的其他GAPN的一致性分析推断必需氨基酸的一致性。
使用已知的诱变、重组和/或改组方法、随后进行一个相关的筛选程序可以做出单一或多种氨基酸取代、缺失和/或插入并对其进行测试,这些相关的筛选程序例如由Reidhaar-Olson(瑞德哈尔-奥尔森)和Sauer(萨奥尔),1988,科学241:53-57;Bowie(鲍依)和萨奥尔,1989,Proc.Natl.Acad.Sci.USA(美国国家科学院院刊)86:2152-2156;WO 95/17413;或者WO 95/22625所描述的那些。可以使用的其他方法包括:易错PCR、噬菌体展示(例如,洛曼(Lowman)等人,1991,生物化学(Biochemistry)30:10832-10837;美国专利号5,223,409;WO 92/06204)以及区域定向诱变(德比希尔(Derbyshire)等人,1986,基因(Gene)46:145;内尔(Ner)等人,1988,DNA 7:127)。
可以结合诱变/改组方法与高通量自动化筛选方法来检测由宿主细胞表达的克隆的、诱变的多肽的活性(内斯(Ness)等人,1999,自然生物技术(Nature Biotechnology)17:893-896)。编码活性GAPNs的诱变的DNA分子可以回收自宿主细胞,并且使用本领域的标准方法对其进行迅速测序。这些方法允许迅速确定多肽中单个氨基酸残基的重要性。
在一些方面中,在相同条件下,该GAPN具有在此描述的任何GAPN(例如,SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的任何GAPN)的至少20%,例如至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%的GAPN活性。
在一个方面中,GAPN编码序列在至少低严谨度条件,例如中严谨度条件、中-高严谨度条件、高严谨度条件或非常高严谨度条件下与来自在此描述的任何GAPN(例如,SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的任何GAPN)的编码序列的全长互补链杂交(参见例如,J.萨姆布鲁克(Sambrook),E.F.弗里奇(Fritsch)和T.马尼亚蒂斯(Maniatus),1989,见上文)。在一个方面中,GAPN编码序列与来自在此描述的任何GAPN(例如,SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的任何GAPN)的编码序列具有至少65%,例如至少70%、至少75%、至少80%、至少85%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列一致性。
在一个方面中,编码GAPN的异源多核苷酸包括在此描述的任何GAPN(例如,SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的任何GAPN)的编码序列。在一个方面中,编码GAPN的异源多核苷酸包括来自在此描述的任何GAPN的编码序列的子序列,其中该子序列编码具有GAPN活性的多肽。在一个方面中,该编码子序列中的核苷酸残基的数目是参照编码序列的数目的至少75%,例如至少80%、85%、90%或95%。
在此描述的任何相关方面的参照编码序列可以是天然编码序列(例如,由熟练的技术人员使用可获得的序列数据库容易确定的序列)或简并序列,例如针对具体宿主细胞设计的密码子优化的编码序列。例如,SEQ ID NO:154的变形链球菌GAPN的编码序列可以是天然的变形链球菌GAPN编码序列或密码子优化版本,例如示于SEQ ID NO:154中的编码序列。
该GAPN可以是一种融合多肽或可切割的融合多肽,其中另一个多肽融合在该亲本的N-末端或C-末端处。通过将编码另一种多肽的多核苷酸与编码GAPN的多核苷酸融合而产生融合多肽。用于产生融合多肽的技术在本领域是已知的,并包括连接编码多肽的编码序列,这样使得它们在框内并且使得融合多肽的表达处于相同的一个或多个启动子和终止子的控制下。融合蛋白还可以使用内含肽技术构建,其中融合在翻译后产生(库珀(Cooper)等人,1993,欧洲分子生物学学会杂志(EMBO J.)12:2575-2583;道森(Dawson)等人,1994,科学(Science)266:776-779)。
主动3-HP途径
任何适合的3-HP途径都可以与具有异源GAPN的重组酵母细胞一起使用,以产生3-HP。3-HP途径、3-HP途径基因以及用于发酵3-HP的对应的工程转化体在本领域是已知的(例如,美国公开号2012/0135481;美国专利号6,852,517;美国专利号7,309,597;美国公开号2001/0021978;美国公开号2008/0199926;WO 02/42418;以及WO 10/031083;将其内容以其全文结合在此)。若干已知的3-HP途径的综述示于图1中。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过PEP或丙酮酸、OAA、天冬氨酸、β-丙氨酸以及丙二酸半醛中间体而进行(参见例如,美国公开号2010/0021978,图1)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括丙酮酸羧化酶(PYC)、PEP羧化酶(PPC)、天冬氨酸转氨酶(AAT)、天冬氨酸1-脱羧酶(ADC)、β-丙氨酸转氨酶(BAAT)、氨基丁酸转氨酶(gabT)、3-HP脱氢酶(3-HPDH)、3-羟基异丁酸脱氢酶(HIBADH)以及4-羟基丁酸脱氢酶基因中的一种或多种。这些3-HP途径基因还可以包括PEP羧激酶(PCK)基因,该基因已被修饰为产生以下多肽,该多肽优选地催化PEP转化为OAA(天然的PCK基因通常产生以下多肽,该多肽优选地催化OAA至PEP的逆反应)。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过PEP或丙酮酸、OAA和苹果酸中间体而进行(参见例如,美国公开号2010/0021978,图4)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括PPC、PYC、苹果酸脱氢酶以及苹果酸脱羧酶基因中的一种或多种。这些3-HP途径基因还可以包括一种PCK基因,该基因已被修饰为产生以下多肽,该多肽优选地催化PEP转化为OAA。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过PEP或丙酮酸、OAA和丙二酸半醛中间体而进行(参见例如,美国公开号2010/0021978,图1)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括PPC、PYC、2-酮酸脱羧酶、α-酮戊二酸(AKG)脱羧酶(KGD)、支链α-酮酸脱羧酶(BCKA)、吲哚丙酮酸脱羧酶(IPDA)、3-HPDH、HIBADH以及4-羟基丁酸脱氢酶基因中的一种或多种。这些3-HP途径基因还可以包括一种PCK基因,该基因已被修饰为产生以下多肽,该多肽优选地催化PEP转化为OAA。另外,这些3-HP途径基因包括一种PDC基因和/或苯甲酰甲酸脱羧酶基因,该基因已被修饰为编码以下多肽,该多肽能够催化OAA转化为丙二酸半醛。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过PEP或丙酮酸、OAA、丙二酰辅酶A以及丙二酸半醛中间体而进行,其中该丙二酸半醛中间体是任选的(参见例如,美国公开号2010/0021978,图2)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括PPC、PYC、OAA甲酸裂解酶、丙二酰辅酶A还原酶、辅酶A酰化丙二酸半醛脱氢酶、3-HPDH、HIBADH以及4-羟基丁酸脱氢酶基因中的一种或多种。这些3-HP途径基因还可以包括一种PCK基因,该基因已被修饰为产生以下多肽,该多肽优选地催化PEP转化为OAA。另外,这些3-HP途径基因可以包括一种OAA脱氢酶基因,该基因是通过将2-酮酸脱氢酶基因修饰以产生一种多肽而得到,该多肽催化OAA转化为丙二酰辅酶A。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过丙酮酸、乙酰辅酶A、丙二酰辅酶A以及丙二酸半醛中间体而进行,其中该丙二酸半醛中间体是任选的(参见例如,WO 02/042418,图44)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括丙酮酸脱氢酶(PDH)、乙酰辅酶A羧化酶(ACC)、丙二酰辅酶A还原酶、辅酶A酰化丙二酸半醛脱氢酶、3-HPDH、HIBADH以及4-羟基丁酸脱氢酶基因中的一种或多种。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过丙酮酸、丙氨酸、β-丙氨酸、β-丙氨酰辅酶A、丙烯酰辅酶A、3-HP辅酶A以及丙二酸半醛中间体而进行,其中β-丙氨酰辅酶A、丙烯酰辅酶A、3-HP辅酶A以及丙二酸半醛中间体是任选的(可以经由丙二酸半醛中间体或经由β-丙氨酰辅酶A、丙烯酰辅酶A和3-HP辅酶A中间体将β-丙氨酸转化为3-HP)(参见例如,美国专利7,309,597,图1)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括丙氨酸脱氢酶、丙酮酸/丙氨酸转氨酶、丙氨酸2,3氨基变位酶、辅酶A转移酶、辅酶A合成酶、β-丙氨酰辅酶A解氨酶、3-HP辅酶A脱水酶、3-HP辅酶A水解酶、3-羟基异丁酰辅酶A水解酶、BAAT、3-HPDH、HIBADH以及4-羟基丁酸脱氢酶基因中的一种或多种。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过丙酮酸、乳酸、乳酰辅酶A、丙烯酰辅酶A以及3-HP辅酶A中间体而进行(参见例如,WO 2010/042418,图1)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括LDH、辅酶A转移酶、辅酶A合成酶、乳酰辅酶A脱水酶、3-HP辅酶A脱水酶、3-HP辅酶A水解酶以及3-羟基异丁酰辅酶A水解酶基因中的一种或多种。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过甘油和3-HPA中间体而进行(参见例如,美国专利6,852,517)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括甘油脱水酶和醛脱氢酶基因中的一种或多种。
在某些实施例中,在此提供的酵母细胞具有以下主动3-HP途径,该主动3-HP途径通过PEP或丙酮酸、OAA、天冬氨酸、β-丙氨酸、β-丙氨酰辅酶A、丙烯酰辅酶A、3-HP辅酶A以及丙氨酸中间体而进行,其中OAA、天冬氨酸和丙氨酸中间体是任选的(可以经由OAA和天冬氨酸或经由丙氨酸将PEP或丙酮酸转化为β-丙氨酸)(参见WO 02/042418,图54;美国专利7,309,597,图1)。在这些实施例中,这些酵母细胞包括一套3-HP途径基因,这些基因包括PPC、PYC、AAT、ADC、辅酶A转移酶、辅酶合成酶、β-丙氨酰辅酶A解氨酶、3-HP-辅酶A脱水酶、3-HP-辅酶A水解酶、3-羟基异丁酰辅酶A水解酶、丙氨酸脱氢酶、丙酮酸/丙氨酸转氨酶以及AAM基因中的一种或多种。这些3-HP途径基因还可以包括一种PCK基因,该基因已被修饰为产生以下多肽,该多肽优选地催化PEP转化为OAA。
在某些实施例中,在此提供的酵母细胞表达一种或多种编码选自下组的酶的3-HP途径基因,该组由以下各项组成:ACC(催化乙酰辅酶A转化为丙二酰辅酶A),丙氨酸2,3氨基变位酶(AAM,催化丙氨酸转化为β-丙氨酸),丙氨酸脱氢酶(催化丙酮酸转化为丙氨酸),醛脱氢酶(催化3-HPA转化为3-HP),KGD(催化OAA转化为丙二酸半醛),AAT(催化OAA转化为天冬氨酸),ADC(催化天冬氨酸转化为β-丙氨酸),BCKA(催化OAA转化为丙二酸半醛),BAAT(催化β-丙氨酸转化为丙二酸半醛),4-氨基丁酸转氨酶(gabT,催化β-丙氨酸转化为丙二酸半醛),β-丙氨酰辅酶A解氨酶(催化β-丙氨酰辅酶A转化为丙烯酰辅酶A),辅酶A酰化丙二酸半醛脱氢酶(催化丙二酰辅酶A转化为丙二酸半醛),辅酶A合成酶(催化β-丙氨酸转化为β-丙氨酰辅酶A或将乳酸转化为乳酰辅酶A),辅酶A转移酶(催化β-丙氨酸转化为β-丙氨酰辅酶A和/或将乳酸转化为乳酰辅酶A),甘油脱水酶(催化甘油转化为3-HPA),IPDA(催化OAA转化为丙二酸半醛),LDH(催化丙酮酸转化为乳酸),乳酰辅酶A脱水酶(催化乳酰辅酶A转化为丙烯酰辅酶A),苹果酸脱羧酶(催化苹果酸转化为3-HP),苹果酸脱氢酶(催化OAA转化为苹果酸),丙二酰辅酶A还原酶(催化丙二酰辅酶A转化为丙二酸半醛或3-HP),OAA甲酸裂解酶(亦称丙酮酸-甲酸裂解酶和酮酸甲酸裂解酶,催化OAA转化为丙二酰辅酶A),OAA脱氢酶(催化OAA转化为丙二酰辅酶A);PPC(催化PEP转化为OAA),丙酮酸/丙氨酸转氨酶(催化丙酮酸转化为丙氨酸),PYC(催化丙酮酸转化为OAA),PDH(催化丙酮酸转化为乙酰辅酶A),2-酮酸脱羧酶(催化OAA转化为丙二酸半醛),3-HP辅酶A脱水酶(亦称丙烯酰辅酶A水合酶,催化丙烯酰辅酶A转化为3-HP辅酶A),3-HPDH(催化丙二酸半醛转化为3-HP),3-HP辅酶A水解酶(催化3-HP辅酶A转化为3-HP),HIBADH(催化丙二酸半醛转化为3-HP),3-羟基异丁酰辅酶A水解酶(催化3-HP辅酶A转化为3-HP)以及4-羟基丁酸脱氢酶(催化丙二酸半醛转化为3-HP)。对于这些酶活性中的每种酶活性而言,感兴趣的反应(括号中)可以是内源或异源活性的结果。
可以使用任何适合的3-HP途径基因(内源的或异源的)并以足以产生在所选的主动3-HP途径中涉及的酶的量表达。伴随现在多于550个物种可获得的全基因组序列(其中多于一半的这些序列可在公共数据库(例如NCBI)中获得)(包括395个微生物基因组以及多种酵母、真菌、植物和哺乳动物基因组),对于所选的宿主而言,编码在此教导的所选3-HP途径的酶活性的基因的鉴定在本领域是常规且熟知的。例如,可以在与所选宿主相关或远缘的宿主中鉴定取代已知基因的适合的同源物、直向同源物、旁系同源物以及非直向同源物基因以及生物体之间的遗传改变的交换。
对于没有已知基因组序列的酵母而言,可以典型地使用本领域已知的技术获得感兴趣的基因的序列(作为过表达候选物或作为插入位点)。可以利用常规实验设计测试各种基因的表达和各种酶的活性,包括在3-HP途径中起作用的基因和酶。可以进行实验,其中单独地在酵母中和在酶区块(直至并优选包括所有途径酶,针对改善3-HP生产的需要(或希望)而建立)中表达每种酶。一种说明性实验设计测试了每种单独的酶以及每个独特的酶对的表达,并且可以进一步测试所有需要的酶或每个独特的酶组合的表达。如应该领会的,可以采取多种方法。
可以通过引入编码一种或多种参与3-HP途径的酶的异源多核苷酸而产生本发明的重组宿主细胞,如下所述。如本领域的普通技术人员应该领会的,在一些情况下(例如,取决于宿主的选择),鉴于宿主细胞可以具有来自一个或多个途径基因的内源酶活性,示于3-HP途径中的每个基因的异源表达可能并不为3-HP生产所需要。例如,如果选择的宿主缺乏3-HP途径的一种或多种酶,则将一种或多种缺陷酶的异源多核苷酸引入该宿主中,用于进行随后的表达。可替代地,如果选择的宿主展现出一些途径基因的内源表达,但是缺乏其他基因的内源表达,则需要缺乏的一种或多种酶的编码多核苷酸,以实现生物合成3-HP。因此,可以通过引入异源多核苷酸而产生重组宿主细胞,以获得希望的生物合成途径的酶活性,或可以通过引入一种或多种希望的异源多核苷酸而获得希望的生物合成途径,这些希望的异源多核苷酸与一种或多种内源酶一起产生希望的产物,例如3-HP。
取决于所选重组宿主生物的3-HP途径成分,本发明的宿主细胞将包括至少一种编码GAPN的异源多核苷酸、至少一种编码3-HP途径基因的酶的异源多核苷酸以及直到包括3-HP途径的所有编码异源多核苷酸。例如,可以通过异源表达对应的多核苷酸而在缺乏3-HP途径酶的宿主中建立3-HP生物合成。在缺乏3-HP途径的所有酶的宿主中,可以包括异源表达该途径中的所有酶,尽管应该理解的是即使该宿主包括至少一种途径酶,仍可以表达途径的所有酶。
如在此使用,“丙酮酸羧化酶基因”或“PYC基因”是指编码具有丙酮酸羧化酶活性的多肽的任何基因,意味着能够催化丙酮酸、CO2和ATP转化为OAA、ADP和磷酸。在某些实施例中,PYC基因可以来自酵母来源。例如,该PYC基因可以来自东方伊萨酵母PYC基因,该基因编码阐述于SEQ ID NO:2中的氨基酸序列。在其他实施例中,该基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:2的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自东方伊萨酵母的PYC基因可以包括阐述于SEQ ID NO:1中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:1中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,该PYC基因可以来自细菌来源。例如,该PYC基因可以来自仅使用PYC而不使用PPC(参见下文)用于进行回补的几种细菌物种之一(例如球形红假单胞菌)或来自具有PYC和PPC两者的细菌物种(例如依特利红假单胞菌(R.etli))。由球形红假单胞菌和依特利红假单胞菌的PYC基因编码的氨基酸序列分别阐述于SEQ ID NO:3和4中。PYC基因可以来自编码SEQ ID NO:3或4的氨基酸序列的基因或来自编码以下氨基酸序列的基因,该氨基酸序列与SEQ ID NO:3或4的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。可替代地,该PYC基因可以来自编码不依赖乙酰辅酶A进行活化的酶的PYC基因,例如编码阐述于SEQ ID NO:5(羧基转移酶亚单位)或SEQ ID NO:6(生物素羧化酶亚单位)中的氨基酸序列的荧光假单胞菌PYC基因、编码阐述于SEQ ID NO:7中的氨基酸序列的谷氨酸棒状杆菌PYC基因或编码以下氨基酸序列的基因,该氨基酸序列与SEQ ID NO:5、6或7的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。PYC基因还可以来自编码不被天冬氨酸抑制的酶的PYC基因,例如编码阐述于SEQ ID NO:8中的氨基酸序列的苜蓿根瘤菌PYC基因(萨奥尔(Sauer)FEMS微生物学评论(FEMS Microbiol Rev)29:765(2005)),或来自编码以下氨基酸序列的基因,该氨基酸序列与SEQ ID NO:8的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
如在此使用,“PEP羧化酶基因”或“PPC基因”是指编码具有PEP羧化酶活性的多肽的任何基因,意味着能够催化PEP和CO2转化为OAA和磷酸。在某些实施例中,PPC基因可以来自细菌PPC基因。例如,该PPC基因可以来自编码阐述于SEQ ID NO:10中的氨基酸序列或以下氨基酸序列的大肠杆菌PPC基因,该氨基酸序列与SEQ ID NO:10的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自大肠杆菌的PPC基因可以包括阐述于SEQ ID NO:9中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:9中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,PPC基因可以来自“A”型PPC,发现于许多古细菌和数目有限的细菌中,不被乙酰辅酶A激活且较不受天冬氨酸的抑制。例如,PPC基因可以来自编码阐述于SEQ ID NO:11中的氨基酸序列的嗜热自养甲烷杆菌PPC A基因、编码阐述于SEQ ID NO:12中的氨基酸序列的产气荚膜梭菌PPC A基因或编码以下氨基酸序列的基因,该氨基酸序列与SEQ ID NO:11或12的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在这些实施例的某些实施例中,该基因可以已经经历对天然基因的一个或多个突变,以便产生具有改进的特征的酶。例如,该基因可以被突变为编码以下PPC多肽,该多肽与天然多肽相比对天冬氨酸反馈具有增加的耐受性。在其他实施例中,该PPC基因可以来自植物来源。
如在此使用,“天冬氨酸转氨酶基因”或“AAT基因”是指编码具有天冬氨酸转氨酶活性的多肽的任何基因,意味着能够催化OAA2转化为天冬氨酸。具有天冬氨酸转氨酶活性的酶被分类为EC 2.6.1.1。在某些实施例中,AAT基因可以来自酵母来源,例如东方伊萨酵母或酿酒酵母。例如,该AAT基因可以来自编码阐述于SEQ ID NO:14中的氨基酸序列的东方伊萨酵母AAT基因或编码阐述于SEQ ID NO:15中的氨基酸序列的酿酒酵母AAT2基因。在其他实施例中,该基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:14或15的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自东方伊萨酵母的AAT基因可以包括阐述于SEQ ID NO:13中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:13中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,该AAT基因可以来自细菌来源。例如,该AAT基因可以来自大肠杆菌aspC基因,该基因编码包括阐述于SEQ ID NO:16中的氨基酸序列的多肽。在其他实施例中,该基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:16的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
如在此使用,“天冬氨酸脱羧酶基因”或“ADC基因”是指编码具有天冬氨酸脱羧酶活性的多肽的任何基因,意味着能够催化天冬氨酸转化为β-丙氨酸。具有天冬氨酸脱羧酶活性的酶被分类为EC 4.1.1.11。在某些实施例中,ADC基因可以来自细菌来源。因为活性天冬氨酸脱羧酶需要无活性酶原的蛋白酶解加工,所以在这些实施例中,应该选择酵母宿主细胞,以支持由细菌ADC基因编码的活性酶的形成。
在一些实施例中,该ADC基因可以来自阿维链霉菌panD基因,该基因编码阐述于SEQ ID NO:17中的氨基酸序列。在一些实施例中,该ADC基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:17的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自阿维链霉菌的ADC基因可以包括阐述于SEQ ID NO:130、145、146或147的任一项中的核苷酸序列;或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:130、145、146或147的任一项中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
在其他实施例中,该ADC基因可以来自丙酮丁醇梭菌panD基因,该基因编码阐述于SEQ ID NO:18中的氨基酸序列。在一些实施例中,该ADC基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:18的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自丙酮丁醇梭菌的ADC基因可以包括阐述于SEQ ID NO:131中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:131中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
在其他实施例中,该ADC基因可以来自幽门螺杆菌ADC基因,该基因编码阐述于SEQ ID NO:133中的氨基酸序列。在一些实施例中,该ADC基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:133的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自幽门螺杆菌的ADC基因可以包括阐述于SEQ ID NO:133中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:133中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
在其他实施例中,该ADC基因可以来自芽孢杆菌属TS25ADC基因,该基因编码阐述于SEQ ID NO:135中的氨基酸序列。在一些实施例中,该ADC基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:135的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自芽孢杆菌属TS25的ADC基因可以包括阐述于SEQ ID NO:134中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:134中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
在其他实施例中,该ADC基因可以来自谷氨酸棒状杆菌ADC基因,该基因编码阐述于SEQ ID NO:137中的氨基酸序列。在一些实施例中,该ADC基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:137的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自谷氨酸棒状杆菌的ADC基因可以包括阐述于SEQ ID NO:136中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:136中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
在其他实施例中,该ADC基因可以来自地衣芽孢杆菌ADC基因,该基因编码阐述于SEQ ID NO:139中的氨基酸序列。在一些实施例中,该ADC基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:139的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自地衣芽孢杆菌的ADC基因可以包括阐述于SEQ ID NOs:138、148、149、150或151的任一项中的核苷酸序列;或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NOs:138、148、149、150或151的任一项中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
如在此使用,“β-丙氨酸转氨酶基因”或“BAAT基因”是指编码具有β-丙氨酸转氨酶活性的多肽的任何基因,意味着能够催化β-丙氨酸转化为丙二酸半醛。具有β-丙氨酸转氨酶活性的酶被分类为EC 2.6.1.19。在某些实施例中,BAAT基因可以来自酵母来源。例如,BAAT基因可以来自pyd4基因的东方伊萨酵母同系物,其编码阐述于SEQ ID NO:20中的氨基酸序列。在一些实施例中,该BAAT基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:20的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自东方伊萨酵母的BAAT基因可以包括阐述于SEQ ID NO:19中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:19中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,该BAAT基因可以来自克鲁维毕赤酵母pyd4基因,该基因编码阐述于SEQ ID NO:21中的氨基酸序列。在一些实施例中,该BAAT基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:21的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自克鲁维毕赤酵母的BAAT基因可以包括阐述于SEQ ID NO:142中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:142中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,该BAAT基因可以来自细菌来源。例如,BAAT基因可以来自阿维链霉菌BAAT基因,该基因编码阐述于SEQ ID NO:22中的氨基酸序列。在一些实施例中,该BAAT基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:22的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自阿维链霉菌的BAAT基因可以包括阐述于SEQ ID NO:140中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:140中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
BAAT基因还可以是“4-氨基丁酸转氨酶”或“gabT基因”,意指它对4-氨基丁酸以及β-丙氨酸具有天然活性。可替代地,可以通过随机或定向工程化来自细菌或酵母来源的天然gabT基因而得到BAAT基因,以编码具有BAAT活性的多肽。例如,BAAT基因可以来自阿维链霉菌gabT,该gabT编码阐述于SEQ ID NO:23中的氨基酸序列。在一些实施例中,来自阿维链霉菌的BAAT基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:23的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,BAAT基因可以来自酿酒酵母gabT基因UGA1,该基因编码阐述于SEQ ID NO:24中的氨基酸序列。在一些实施例中,来自酿酒酵母的BAAT基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:24的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自酿酒酵母的BAAT基因可以包括阐述于SEQ ID NO:141中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:141中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
如在此使用,“3-HP脱氢酶基因”或“3-HPDH基因”是指编码具有3-HP脱氢酶活性的多肽的任何基因,意味着能够催化丙二酸半醛转化为3-HP。具有3-HP脱氢酶活性的酶类被分类为EC 1.1.1.59(如果它们利用NAD(H)辅因子),和EC 1.1.1.298(如果它们利用NADP(H)辅因子)。被分类为EC 1.1.1.298的酶类可替代地被称为丙二酸半醛还原酶。
在某些实施例中,3-HPDH基因可以来自酵母来源。例如,3-HPDH基因可以来自YMR226C基因的东方伊萨酵母同系物,其编码阐述于SEQ ID NO:26中的氨基酸序列。在一些实施例中,该3-HPDH基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:26的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自东方伊萨酵母的3-HPDH基因可以包括阐述于SEQ ID NO:25中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:25中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,3-HPDH基因可以来自酿酒酵母YMR226C基因,该YMR226C基因编码阐述于SEQ ID NO:129中的氨基酸序列。在一些实施例中,该3-HPDH基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:129的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自酿酒酵母的3-HPDH基因可以包括阐述于SEQ ID NO:144中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:144中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
在其他实施例中,该3-HPDH基因可以来自细菌来源。例如,3-HPDH基因可以来自大肠杆菌ydfG基因,该基因编码SEQ ID NO:27中的氨基酸序列。在一些实施例中,该基因可以编码以下氨基酸序列,该氨基酸序列与SEQ ID NO:27的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自大肠杆菌的3-HPDH基因可以包括阐述于SEQ ID NO:143中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:143中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,3-HPDH基因可以来自勤奋金属球菌(M.sedula)丙二酸半醛还原酶基因,该基因编码阐述于SEQ ID NO:29中的氨基酸序列。在一些实施例中,该3-HPDH基因可以编码以下氨基酸序列,该氨基酸序列与阐述于SEQ ID NO:29中的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在某些实施例中,来自勤奋金属球菌的3-HPDH基因可以包括阐述于SEQ ID NO:152中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:152中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
如在此使用,“3-羟基异丁酸脱氢酶基因”或“HIBADH基因”是指编码具有3-羟基异丁酸脱氢酶活性的多肽的任何基因,意味着能够催化3-羟基异丁酸转化为甲基丙二酸半醛。具有3-羟基异丁酸脱氢酶活性的酶被分类为EC 1.1.1.31。一些3-羟基异丁酸脱氢酶还具有3-HPDH活性。在某些实施例中,HIBADH基因可以来自细菌来源。例如,HIBADH基因可以来自编码阐述于SEQ ID NO:28中的氨基酸序列的粪产碱菌(A.faecalis)M3A基因、分别编码阐述于SEQ ID NO:30或SEQ ID NO:31中的氨基酸序列的恶臭假单胞菌KT2440或E23440mmsB基因或编码阐述于SEQ ID NO:32中的氨基酸序列的铜绿假单胞菌PAO1mmsB基因。在一些实施例中,HIBADH基因可以编码以下氨基酸序列,该氨基酸序列与阐述于SEQ ID NO:28、30、31或32中的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
如在此使用,“4-羟基丁酸脱氢酶基因”是指编码具有4-羟基丁酸脱氢酶活性的多肽的任何基因,意味着能够催化4-羟基丁酸转化为丁二酸半醛。具有4-羟基丁酸脱氢酶活性的酶被分类为EC 1.1.1.61。一些4-羟基丁酸脱氢酶还具有3-HPDH活性。在某些实施例中,4-羟基丁酸脱氢酶基因可以来自细菌来源。例如,4-羟基丁酸脱氢酶基因可以来自编码阐述于SEQ ID NO:33中的氨基酸序列的真氧产碱杆菌(R.eutropha)H164hbd基因或编码阐述于SEQ ID NO:34中的氨基酸序列的克氏梭菌(C.kluyveri)DSM 555hbd基因。在其他实施例中,该基因可以编码以下氨基酸序列,该氨基酸序列与阐述于SEQ ID NO:33或34中的氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。
如在此使用,“PEP羧激酶基因”或“PCK基因”是指编码具有PEP羧激酶活性的多肽的任何基因,意味着能够催化PEP、CO2和ADP或GDP转化为OAA和ATP或GTP,或反之亦然。具有PEP羧激酶活性的酶被分类为EC 4.1.1.32(利用GTP/GDP)和EC 4.1.1.49(利用ATP/ADP)。在某些实施例中,PCK基因可以来自酵母来源。在其他实施例中,PCK基因可以来自细菌来源,并且在这些实例的某些实施例中,该基因可以来自以下细菌,在该细菌体内PCK反应有利于OAA的产生而非其中脱羧作用是优势的更常见形式的反应。例如,PCK基因可以来自编码阐述于SEQ ID NO:35中的氨基酸序列的产琥拍酸曼氏杆菌(M.succiniciproducens)PCK基因、编码阐述于SEQ ID NO:36中的氨基酸序列的产琥珀酸厌氧螺菌(A.succiniciproducens)PCK基因、编码阐述于SEQ ID NO:37中的氨基酸序列的产琥珀酸放线杆菌(A.succinogenes)PCK基因或编码阐述于SEQ ID NO:38中的氨基酸序列的真氧产碱杆菌PCK基因。在其他实施例中,PCK基因已经经历对它来自其中的天然基因的一个或多个突变,这样使得所得基因编码以下多肽,该多肽优选地催化PEP转化为OAA。例如,PCK基因可以来自编码阐述于SEQ ID NO:39中的氨基酸序列的大肠杆菌K12菌株PCK基因,其中该基因已被突变为优选地催化PEP转化为OAA。在其他实施例中,通过PEP羧基转磷酸酶催化PEP至OAA的转化,例如发现于丙酸细菌(例如,谢氏丙酸杆菌(P.shermanii)、伍氏醋酸杆菌(A.woodii))中的,这些丙酸细菌使用无机磷酸和二磷酸而非ATP/ADP或GTP/GDP。
如在此使用,“苹果酸脱氢酶基因”是指编码具有苹果酸脱氢酶活性的多肽的任何基因,意味着能够催化OAA转化为苹果酸。在某些实施例中,苹果酸脱氢酶基因可以来自细菌或酵母来源。
如在此使用,“苹果酸脱羧酶基因”是指编码具有苹果酸脱羧酶活性的多肽的任何基因,意味着能够催化苹果酸转化为3-HP。已知苹果酸脱羧酶活性不天然地发生。因此,可以通过将一个或多个突变掺入天然来源基因中而得到苹果酸脱羧酶基因,该天然来源基因编码具有乙酰乳酸脱羧酶活性的多肽。具有乙酰乳酸脱羧酶活性的多肽催化2-羟基-2-甲基-3-氧代丁酸转化为2-乙偶姻,并被分类为EC 4.1.1.5。在某些实施例中,苹果酸脱羧酶基因可以来自细菌来源。例如,苹果酸脱羧酶基因可以来自编码阐述于SEQ ID NO:40中的氨基酸序列的乳酸乳球菌aldB基因、编码阐述于SEQ ID NO:41中的氨基酸序列的嗜热链球菌aldB基因、编码阐述于SEQ ID NO:42中的氨基酸序列的短芽孢杆菌aldB基因或编码阐述于SEQ ID NO:43中的氨基酸序列的产气肠杆菌budA基因。
如在此使用,“α-酮戊二酸(AKG)脱羧酶基因”或“KGD基因”是指编码具有α-酮戊二酸脱羧酶活性的多肽的任何基因,意味着能够催化α-酮戊二酸(2-氧化戊二酸)转化为丁二酸半醛。具有AKG脱羧酶活性的酶被分类为EC 4.1.1.71。可以使用KGD基因得到以下基因,该基因编码能够催化OAA转化为丙二酸半醛的多肽。这一活性可以发现于天然KGD基因中,或可以通过将一个或多个突变掺入天然KGD基因中而得到该活性。在某些实施例中,KGD基因可以来自细菌来源。例如,KGD基因可以来自编码阐述于SEQ ID NO:44中的氨基酸序列的结核分枝杆菌KGD基因、编码阐述于SEQ ID NO:45中的氨基酸序列的慢生性大豆根瘤菌KGD基因或编码阐述于SEQ ID NO:46中的氨基酸序列的洛蒂分枝杆菌(M.loti)(又称洛蒂根瘤菌(Rhizobium loti))KGD基因。
如在此使用,“支链α-酮酸脱羧酶基因”或“BCKA基因”是指编码具有支链α-酮酸脱羧酶活性的多肽的任何基因,该活性可用于使一系列长度为三至六个碳的α-酮酸脱羧。具有BCKA活性的酶被分类为EC 4.1.1.72。可以使用BCKA基因得到以下基因,该基因编码能够催化OAA转化为丙二酸半醛的多肽。这一活性可以发现于天然BCKA基因中,或可以通过将一个或多个突变掺入天然BCKA基因中而得到该活性。在某些实施例中,BCKA基因可以来自细菌来源。例如,BCKA基因可以来自乳酸乳球菌kdcA基因,该kdcA基因编码阐述于SEQ ID NO:47中的氨基酸序列。
如在此使用,“吲哚丙酮酸脱羧酶基因”或“IPDA基因”是指编码具有吲哚丙酮酸脱羧酶活性的多肽的任何基因,意味着能够催化吲哚丙酮酸转化为吲哚乙醛。具有IPDA活性的酶被分类为EC 4.1.1.74。可以使用IPDA基因得到以下基因,该基因编码能够催化OAA转化为丙二酸半醛的多肽。这一活性可以发现于天然IPDA基因中,或可以通过将一个或多个突变掺入天然IPDA基因中而得到该活性。在某些实施例中,吲哚丙酮酸脱羧酶基因可以来自酵母、细菌或植物来源。
如在此使用,“丙酮酸脱羧酶基因”或“PDC基因”是指编码具有丙酮酸脱羧酶活性的多肽的任何基因,意味着能够催化丙酮酸转化为乙醛。具有PDC活性的酶被分类为EC 4.1.1.1。在优选实施例中,被掺入如在此提供的修饰的酵母细胞中的PDC基因已经经历对它来自其中的天然基因的一个或多个突变,这样使得所得基因编码能够催化OAA转化为丙二酸半醛的多肽。在某些实施例中,PDC基因可以来自酵母来源。例如,PDC基因可以来自编码阐述于SEQ ID NO:49中的氨基酸序列的东方伊萨酵母PDC基因、编码阐述于SEQ ID NO:50中的氨基酸序列的酿酒酵母PDC1基因或编码阐述于SEQ ID NO:51中的氨基酸序列的乳酸克鲁维酵母PDC。在某些实施例中,来自东方伊萨酵母PDC基因的PDC基因可以包括阐述于SEQ ID NO:48中的核苷酸序列或以下核苷酸序列,该核苷酸序列与阐述于SEQ ID NO:48中的核苷酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%序列一致性。在其他实施例中,PDC基因可以来自细菌来源。例如,PDC基因可以来自编码阐述于SEQ ID NO:52中的氨基酸序列的运动发酵单胞菌PDC基因或编码阐述于SEQ ID NO:53中的氨基酸序列的巴氏醋酸杆菌PDC基因。
如在此使用,“苯甲酰甲酸脱羧酶”基因是指编码具有苯甲酰甲酸脱羧酶活性的多肽的任何基因,意味着能够催化苯甲酰甲酸转化为苯甲醛。具有苯甲酰甲酸脱羧酶活性的酶被分类为EC 4.1.1.7。在优选实施例中,被掺入如在此提供的修饰的酵母细胞中的苯甲酰甲酸脱羧酶基因已经经历对它来自其中的天然基因的一个或多个突变,这样使得所得基因编码能够催化OAA转化为丙二酸半醛的多肽。在某些实施例中,苯甲酰甲酸脱羧酶基因可以来自细菌来源。例如,苯甲酰甲酸脱羧酶基因可以来自编码阐述于SEQ ID NO:54中的氨基酸序列的恶臭假单胞菌mdlC基因、编码阐述于SEQ ID NO:55中的氨基酸序列的铜绿假单胞菌mdlC基因、编码阐述于SEQ ID NO:56中的氨基酸序列的施氏假单胞菌dpgB基因或编码阐述于SEQ ID NO:57中的氨基酸序列的荧光假单胞菌ilvB-1基因。
如在此使用,“OAA甲酸裂解酶基因”是指编码具有OAA甲酸裂解酶活性的多肽的任何基因,意味着能够催化酰化物酮酸转化为其对应的辅酶A衍生物。由OAA甲酸裂解酶基因编码的多肽对丙酮酸或对另一种酮酸可以具有活性。在某些实施例中,OAA甲酸裂解酶基因编码一种将OAA转化为丙二酰辅酶A的多肽。
如在此使用,“丙二酰辅酶A还原酶基因”是指编码具有丙二酰辅酶A还原酶活性的多肽的任何基因,意味着能够催化丙二酰辅酶A转化为丙二酸半醛(亦称辅酶A酰化丙二酸半醛脱氢酶活性)。在某些实施例中,丙二酰辅酶A还原酶基因可以来自双功能丙二酰辅酶A还原酶基因,该双功能丙二酰辅酶A还原酶基因还具有催化丙二酸半醛转化为3-HP的能力。在这些实施例的某些实施例中,丙二酰辅酶A还原酶基因可以来自细菌来源。例如,丙二酰辅酶A还原酶基因可以来自编码阐述于SEQ ID NO:58中的氨基酸序列的橙色绿屈挠菌(C.aurantiacus)丙二酰辅酶A还原酶基因、编码阐述于SEQ ID NO:59中的氨基酸序列的卡氏玫瑰弯菌(R.castenholzii)丙二酰辅酶A还原酶基因或编码阐述于SEQ ID NO:60中的氨基酸序列的赤杆菌属NAP1丙二酰辅酶A还原酶基因。在其他实施例中,丙二酰辅酶A还原酶基因可以来自以下丙二酰辅酶A还原酶基因,该基因编码仅催化丙二酰辅酶A转化为丙二酸半醛的多肽。例如,丙二酰辅酶A还原酶基因可以来自编码阐述于SEQ ID NO:61中的氨基酸序列的勤奋金属球菌Msed_0709基因或编码阐述于SEQ ID NO:62中的氨基酸序列的嗜热古菌(S.tokodaii)丙二酰辅酶A还原酶。
如在此使用,“丙酮酸脱氢酶基因”或“PDH基因”是指编码具有丙酮酸脱氢酶活性的多肽的任何基因,意味着能够催化丙酮酸转化为乙酰辅酶A。在某些实施例中,PDH基因可以来自酵母来源。例如,PDH基因可以来自酿酒酵母LAT1、PDA1、PDB1或LPD基因,这些基因分别编码阐述于SEQ ID NO:63-66中的氨基酸序列。在其他实施例中,PDH基因可以来自细菌来源。例如,PDH基因可以来自大肠杆菌菌株K12亚株MG1655aceE、aceF或lpd基因,这些基因分别编码阐述于SEQ ID NO:67-69中的氨基酸序列,或枯草芽孢杆菌pdhA、pdhB、pdhC或pdhD基因,这些基因分别编码阐述于SEQ ID NO:70-73中的氨基酸序列。
如在此使用,“乙酰辅酶A羧化酶基因”或“ACC基因”是指编码具有乙酰辅酶A羧化酶活性的多肽的任何基因,意味着能够催化乙酰辅酶A转化为丙二酰辅酶A。具有乙酰辅酶A羧化酶活性的酶被分类为EC 6.4.1.2。在某些实施例中,乙酰辅酶A羧化酶基因可以来自酵母来源。例如,乙酰辅酶A羧化酶基因可以来自酿酒酵母ACC1基因,该基因编码阐述于SEQ ID NO:74中的氨基酸序列。在其他实施例中,乙酰辅酶A羧化酶基因可以来自细菌来源。例如,乙酰辅酶A羧化酶基因可以来自分别编码阐述于SEQ ID NO:75-78中的氨基酸序列的大肠杆菌accA、accB、accC或accD基因或分别编码阐述于SEQ ID NO:79-82中的氨基酸序列的橙色绿屈挠菌accA、accB、accC或accD基因。
如在此使用“丙氨酸脱氢酶基因”是指编码具有丙氨酸脱氢酶基因活性的多肽的任何基因,意味着能够催化丙酮酸NAD依赖性还原氨化为丙氨酸。具有丙氨酸脱氢酶活性的酶被分类为EC 1.4.1.1。在某些实施例中,丙氨酸脱氢酶基因可以来自细菌来源。例如,丙氨酸脱氢酶基因可以来自枯草芽孢杆菌丙氨酸脱氢酶基因,该枯草芽孢杆菌丙氨酸脱氢酶基因编码阐述于SEQ ID NO:83中的氨基酸序列。
如在此使用,“丙酮酸/丙氨酸转氨酶基因”是指编码具有丙酮酸/丙氨酸转氨酶活性的多肽的任何基因,意味着能够催化丙酮酸和L-谷氨酸转化为丙氨酸和2-氧化戊二酸。在某些实施例中,丙酮酸/丙氨酸转氨酶基因来自酵母来源。例如,丙酮酸/丙氨酸转氨酶基因可以来自编码阐述于SEQ ID NO:84中的氨基酸序列的粟酒裂殖酵母丙酮酸/丙氨酸转氨酶基因或编码阐述于SEQ ID NO:85中的氨基酸序列的酿酒酵母ALT2基因。
如在此使用,“丙氨酸2,3氨基变位酶基因”或“AAM基因”是指编码具有丙氨酸2,3氨基变位酶活性的多肽的任何基因,意味着能够催化丙氨酸转化为β-丙氨酸。已知丙氨酸2,3氨基变位酶活性不天然地发生。因此,可通过将一个或多个突变掺入天然来源基因中而得到丙氨酸2,3氨基变位酶基因,该天然来源基因编码具有类似活性(例如赖氨酸2,3氨基变位酶活性)的多肽(参见例如,美国专利7,309,597)。在某些实施例中,该天然来源基因可以是编码阐述于SEQ ID NO:86中的氨基酸序列的枯草芽孢杆菌赖氨酸2,3氨基变位酶基因、编码阐述于SEQ ID NO:87中的氨基酸序列的牙龈卟啉单胞菌赖氨酸2,3氨基变位酶基因或编码阐述于SEQ ID NO:88中的氨基酸序列的核梭杆菌(F.nucleatum)(ATCC-10953)赖氨酸2,3氨基变位酶基因。
如在此使用,“辅酶A转移酶基因”是指编码具有辅酶A转移酶活性的多肽的任何基因,在一个实例中,该活性包括催化β-丙氨酸转化为β-丙氨酰辅酶A和/或催化乳酸转化为乳酰辅酶A的能力。在某些实施例中,辅酶A转移酶基因可以来自酵母来源。在其他实施例中,辅酶A转移酶基因可以来自细菌来源。例如,辅酶A转移酶基因可以来自埃氏巨球形菌辅酶A转移酶基因,该埃氏巨球形菌辅酶A转移酶基因编码阐述于SEQ ID NO:89中的氨基酸序列。
如在此使用,“辅酶A合成酶基因”是指编码具有辅酶A合成酶活性的多肽的任何基因。在一个实例中,这一活性包括催化β-丙氨酸转化为β-丙氨酰辅酶A的能力。在另一个实例中,这一活性包括催化乳酸转化为乳酰辅酶A的能力。在某些实施例中,辅酶A合成酶基因可以来自酵母来源。例如,辅酶A合成酶基因可以来自酿酒酵母辅酶A合成酶基因。在其他实施例中,辅酶A合成酶基因可以来自细菌来源。例如,辅酶A合成酶基因可以来自大肠杆菌辅酶A合成酶、球形红假单胞菌或肠道沙门菌辅酶A合成酶基因。
如在此使用,“β-丙氨酰辅酶A解氨酶基因”是指编码具有β-丙氨酰辅酶A解氨酶活性的多肽的任何基因,意味着能够催化β-丙氨酰辅酶A转化为丙烯酰辅酶A。在某些实施例中,β-丙氨酰辅酶A解氨酶基因可以来自细菌来源,例如丙酸杆菌(C.propionicum)β-丙氨酰辅酶A解氨酶基因,该基因编码阐述于SEQ ID NO:90中的氨基酸序列。
如在此使用,“3-HP辅酶A脱水酶基因”或“丙烯酰辅酶A水合酶基因”是指编码具有3-HP辅酶A脱水酶基因活性的多肽的任何基因,意味着能够催化丙烯酰辅酶A转化为3-HP辅酶A。具有3-HP辅酶A脱水酶活性的酶被分类为EC 4.2.1.116。在某些实施例中,3-HP辅酶A脱水酶基因可以来自酵母或真菌来源,例如大豆疫霉菌(P.sojae)3-HP辅酶A脱水酶基因,该基因编码阐述于SEQ ID NO:91中的氨基酸序列。在其他实施例中,3-HP辅酶A脱水酶基因可以来自细菌来源。例如,3-HP辅酶A脱水酶基因可以来自编码阐述于SEQ ID NO:92中的氨基酸序列的橙色绿屈挠菌3-HP辅酶A脱水酶基因、编码阐述于SEQ ID NO:93中的氨基酸序列的深红红螺菌(R.rubrum)3-HP辅酶A脱水酶基因或编码阐述于SEQ ID NO:94中的氨基酸序列的有蒴红螺菌(R.capsulates)3-HP辅酶A脱水酶基因。在仍其他实施例中,3-HP辅酶A脱水酶基因可以来自哺乳动物来源。例如,3-HP辅酶A脱水酶基因可以来自智人-HP辅酶A脱水酶基因,该智人-HP辅酶A脱水酶基因编码阐述于SEQ ID NO:95中的氨基酸序列。
如在此使用,“3-HP辅酶A水解酶基因”是指编码具有3-HP辅酶A水解酶活性的多肽的任何基因,意味着能够催化3-HP辅酶A转化为3-HP。在某些实施例中,3-HP辅酶A水解酶基因可以来自酵母或真菌来源。在其他实施例中,3-HP辅酶A水解酶基因可以来自细菌来源。
如在此使用,“3-羟基异丁酰辅酶A水解酶基因”是指编码具有3-羟基异丁酰辅酶A水解酶活性的多肽的任何基因,在一个实例中,该活性包括催化3-HP辅酶A转化为3-HP的能力。在某些实施例中,3-羟基异丁酰辅酶A水解酶基因可以来自细菌来源,例如编码阐述于SEQ ID NO:96中的氨基酸序列的荧光假单胞菌3-羟基异丁酰辅酶A水解酶基因或编码阐述于SEQ ID NO:97中的氨基酸序列的蜡状芽孢杆菌3-羟基异丁酰辅酶A水解酶基因。在其他实施例中,3-羟基异丁酰辅酶A水解酶基因可以来自哺乳动物来源,例如智人3-羟基异丁酰辅酶A水解酶基因,该基因编码阐述于SEQ ID NO:98中的氨基酸序列。
如在此使用,“乳酸脱氢酶基因”或“LDH基因”是指编码具有乳酸脱氢酶活性的多肽的任何基因,意味着能够催化丙酮酸转化为乳酸。在某些实施例中,LDH基因可以来自真菌、细菌或哺乳动物来源。
如在此使用,“乳酰辅酶A脱水酶基因”是指编码具有乳酰辅酶A脱水酶活性的多肽的任何基因,意味着能够催化乳酰辅酶A转化为丙烯酰辅酶A。在某些实施例中,乳酰辅酶A脱水酶基因可以来自细菌来源。例如乳酰辅酶A脱水酶基因可以来自埃氏巨球形菌乳酰辅酶A脱水酶E1、EIIa或EIIb亚单位基因,这些基因编码阐述于SEQ ID NO:99-101中的氨基酸序列。
如在此使用,“醛脱氢酶基因”是指编码具有醛脱氢酶活性的多肽的任何基因,在一个实例中,该活性包括催化3-HPA转化为3-HP的能力(反之亦然)。在某些实施例中,醛脱氢酶基因可以来自酵母来源,例如编码阐述于SEQ ID NO:102中的氨基酸序列的酿酒酵母醛脱氢酶基因或编码阐述于SEQ ID NO:122、124或126中的氨基酸序列的东方伊萨酵母醛脱氢酶基因。在其他实施例中,醛脱氢酶基因可以来自细菌来源,例如编码阐述于SEQ ID NO:103中的氨基酸序列的大肠杆菌aldH基因或编码阐述于SEQ ID NO:104中的氨基酸序列的肺炎克雷伯菌醛脱氢酶基因。
如在此使用,“甘油脱水酶基因”是指编码具有甘油脱水酶活性的多肽的任何基因,意味着能够催化甘油转化为3-HPA。在某些实施例中,甘油脱水酶基因可以来自细菌来源,例如肺炎克雷伯菌或弗氏柠檬酸杆菌甘油脱水酶基因。
可以使用本领域已知的方法或如在此描述检测所选主动3-HP途径的酶及其活性。这些检测方法可包括使用特异抗体、形成酶产物、或酶底物的消失。参见,例如萨拉布鲁克(Sambrook)等人,Molecular Cloning:A Laboratory Manual(分子克隆实验指南),第三版,Cold Spring Harbor Laboratory(冷泉港实验室),纽约(2001);Ausubel(奥苏贝尔)等人,Current Protocols in Molecular Biology(《当前分子生物学》),John Wiley and Sons(约翰威利父子公司),巴尔的摩,马里兰州(1999);以及Hanai(哈奈)等人,Appl.Environ.Microbiol.(《应用及环境微生物学》)73:7814-7818(2007))。
宿主、表达载体与核酸构建体
该重组酵母细胞可以是具有主动3-HP途径的任何酵母细胞。本领域的普通技术人员应该理解,遗传改变(包括在此示例的代谢修饰)可以参考适合的宿主生物(例如东方伊萨酵母)及其相应的代谢反应或用于希望的遗传材料(例如希望的代谢途径的基因)的适合的来源生物加以描述。然而,考虑到多种多样的生物的全基因组测序以及基因组学领域中的较高水平的技能,本领域的普通技术人员可以将在此提供的教导和指导应用于其他酵母生物中。例如,可以通过掺入相同的或来自不同于参考物种的物种的类似编码核酸而容易地将在此示例的东方伊萨酵母代谢改变应用于其他物种中。
如在此使用的“酵母”包括产子嚢酵母(内孢霉目)、产担子酵母和属于半知菌类(芽孢纲)的酵母。由于酵母的分类在将来可能改变,出于在此描述的目的,酵母应如在酵母生物学与活性(Biology and Activities of Yeast)(斯金纳(Skinner),F.A.,帕斯莫尔(Passmore),S.M.和达文波特(Davenport),R.R.编著,应用细菌学研讨会系列第9期(Soc.App.Bacteriol.Symposium Series No.9),1980)中所述进行定义。
该酵母宿主细胞可以是假丝酵母属、汉逊酵母属、克鲁维酵母属、毕赤酵母属、酵母属、裂殖酵母属、耶氏酵母属或伊萨酵母属细胞,例如萨纳瑞西斯假丝酵母(Candida sonorensis)、甲醇山梨糖假丝酵母(Candida methanosorbosa)、嗜酒假丝酵母(Candida ethanolica)、乳酸克鲁维酵母、马克斯克鲁维酵母、发酵毕赤酵母、Pichia galeiformis、膜醭毕赤酵母(Pichia membranifaciens)、沙漠毕赤酵母(Pichia deserticola)、卡氏酵母、酿酒酵母、糖化酵母、布拉迪酵母(Saccharomyces bulderi)、道格拉斯酵母(Saccharomyces douglasii)、克鲁维酵母、诺地酵母、卵形酵母、解脂耶氏酵母或东方伊萨酵母细胞。
该酵母宿主细胞可以来自一个细胞或被工程化,这样使得该细胞已经被遗传修饰为产生较高的乳酸滴度,对酸性pH展现出增加的耐受性,对乙醇或丙醇展现出增加的耐受性和/或展示出发酵戊糖的增加的能力(然而,在一些实施例中,该酵母细胞不能发酵戊糖)。示例性遗传修饰的酵母细胞描述于WO 00/71738、WO 03/049525、WO 03/102201、WO 03/102152、WO 02/42471、WO 2007/032792、WO 2007/106524、WO 2007/117282中,将其内容相对于所述细胞通过引用结合在此。将描述于前述申请中的任何酵母细胞的修饰与如在此描述的主动3-HP途径一起考虑。
该酵母宿主细胞可以是克勒勃屈利(crabtree)阳性表型或克勒勃屈利阴性表型。克勒勃屈利阴性生物由被诱导为增加的发酵性状态的能力表征。天然存在的生物和重组生物两者都可以被表征为克勒勃屈利阴性的。将克勒勃屈利效应定义为当在高浓度的葡萄糖(例如>5mM葡萄糖)的存在下在需氧条件下培养微生物时,该微生物中的耗氧抑制。不论氧利用率如何,克勒勃屈利阳性生物在葡萄糖的存在下继续发酵(而非呼吸),而克勒勃屈利阴性生物未展示出葡萄糖介导的耗氧抑制。这一特征对于有机产品合成而言是有用的,因为它允许细胞在较高的底物浓度下生长,但保留氧化磷酸化的有益的高能作用。在一个方面中,该酵母具有克勒勃屈利阴性表型。
在某些实施例中,在此提供的酵母细胞是3-HP耐受的酵母细胞,如描述于US 2012/0135481中。如在此使用,“3-HP耐受的酵母细胞”是指在包含75g/L或更多3-HP的培养基中,在小于4.0的pH下,展现出至少2.5g/L/hr的平均糖分解速度的酵母细胞。这样的速度和条件代表用于生产3-HP的经济过程。在这些实施例的某些实施例中,这些酵母细胞能以其天然形式展现出3-HP耐受性。在其他实施例中,在引入与主动3-HP途径相关的遗传修饰前、中或后,这些细胞可以已经经历突变和/或选择(例如,恒化器选择或重复的系列传代培养),这样使得这些突变的和/或选择的细胞具有比同一物种的野生型细胞对3-HP的更高程度的耐受性。例如,在一些实施例中,在用一个或多个异源3-HP途径基因遗传修饰之前,这些细胞已经在3-HP或乳酸的存在下经历了突变和/或选择。在某些实施例中,可以在以其天然形式展示出3-HP抗性的细胞上进行突变和/或选择。可以在不同水平的3-HP的存在下,针对糖消耗以及其他特征对经历突变和/或选择的细胞进行测试,以便确定它们作为用于生产3-HP的工业化宿主的可能性。除了3-HP耐受性以外,在此提供的酵母细胞可以经历用于抵抗一种或多种另外的有机酸(例如,乳酸)或抵抗其他发酵产物、副产物或培养基组分的突变和/或选择。
可以使用本领域熟知的方法完成选择,例如对3-HP或对其他化合物的耐受性的选择。例如,如在上文提及的,选择可以是恒化器选择。恒化器选择使用以下恒化器,该恒化器允许连续培养微生物(例如,酵母),其中可以独立控制比生长速率和细胞数目。连续培养实质上是一种定容的流动系统,向其中连续添加培养基并且从其中可以发生任何溢流的连续去除。一旦这样的一个系统处于平衡状态,则细胞数目和营养素状态保持不变,并且该系统处于稳态。恒化器允许通过一种限制性营养素(例如碳源或氮源)的稀释率和浓度的改变来控制培养物的群体密度和比生长速率两者。通过改变培养物生长时的条件(例如,在其他之中,减少接种物菌株的生长必需的次级碳源的浓度),将在该群体中选择能够在改变的条件下长得更快的微生物并且这些微生物将比在新的条件下作用得不同样好的微生物长得快。典型地,这样的选择需要在恒化培养物的生长过程中至少一种培养物组分的递增或递减。恒化器的操作以及它们在微生物的定向进化中的用途在本领域是熟知的(参见,例如Novick Proc Natl Acad Sci USA(《美国科学院院报》)36:708-719(1950),Harder(哈德)J Appl Bacteriol(《应用细菌学杂志》)43:1-24(1977))。其他选择方法包括但不限于在选择条件下进行重复的系列传代培养,如描述于例如美国专利号7,629,162中。可以使用此类方法代替使用以上描述的葡萄糖受限的恒化器方法或除其之外,可以使用此类方法。
在3-HP培养基中展现出生长和葡萄糖消耗的最佳组合的酵母菌株(如描述于例如US 2012/0135481中)对于与3-HP途径相关的各种遗传修饰而言是优选的宿主细胞。具有相对较高水平的3-HP耐受性的潜力(如通过在75g/L 3-HP或更高的3-HP的存在下,在低于4的pH下的生长所指示的)的酵母属包括例如假丝酵母属、克鲁维酵母属、伊萨酵母属、酵母属、毕赤酵母属、裂殖酵母属、有孢圆酵母属以及接合酵母属。展现出3-HP耐受性的物种包括东方伊萨酵母(亦称克柔假丝酵母(C.krusei))、郎比可假丝酵母(C.lambica)(亦称发酵毕赤酵母)和布拉迪酵母(S.bulderi)(亦称Kazachstania bulderi)。东方伊萨酵母和郎比可假丝酵母来自东方伊萨酵母/发酵毕赤酵母进化枝,而布拉迪酵母来自酵母属进化枝。展现出3-HP耐受性的具体菌株包括东方伊萨酵母菌株24210、PTA-6658、60585和CD1822,布拉迪酵母菌株MYA-402和MYA-40以及郎比可假丝酵母菌株ATCC 38617。
可以按类似方式测试其他野生型酵母或真菌并且鉴定在较高水平的3-HP的存在下具有可接受水平的生长和葡萄糖利用率的酵母或真菌,如在此描述。例如,格罗斯(Gross)和罗宾斯(Robbins)(水生生物学(Hydrobiologia)433(103):91-109)已经编辑了在较低的pH(<4)环境中鉴定的81种真菌物种的一个列表,该列表可以作为潜在生产宿主与测试相关。
在某些实施例中,通过将一个或多个遗传修饰掺入克勒勃屈利阴性宿主酵母细胞中产生在此提供的修饰的酵母细胞。在这些实施例的某些实施例中,该宿主酵母细胞属于伊萨酵母属、假丝酵母属或酵母属,并且在这些实施例的某些实施例中,该宿主细胞属于东方伊萨酵母/发酵毕赤酵母或酵母属进化枝。在这些实施例的某些实施例中,该宿主细胞是东方伊萨酵母或郎比可假丝酵母或布拉迪酵母。
东方伊萨酵母/发酵毕赤酵母进化枝是最末端进化枝,该进化枝至少包含物种东方伊萨酵母、P.galeiformis、毕赤酵母属YB-4149(NRRL指定)、嗜酒假丝酵母、沙漠毕赤酵母、膜醭毕赤酵母以及发酵毕赤酵母。使用如库兹曼(Kurtzman)和罗伯尼特(Robnett)描述于“从核大亚基(26S)核糖体DNA部分序列的分析中鉴定子囊菌纲酵母及其系统发育(Identification and Phylogeny of Ascomycetous Yeasts from Analysis of Nuclear Large Subunit(26S)Ribosomal DNA Partial Sequences)”,安东尼·范·列文虎克(Antonie van Leeuwenhoek)73:331-371,1998中的方法,通过分析酵母物种的26S核糖体DNA的可变D1/D2结构域鉴定东方伊萨酵母/发酵毕赤酵母进化枝的成员(尤其参见第349页)。从数以百计的子囊菌中分析26S核糖体DNA的可变D1/D2结构域揭示,东方伊萨酵母/发酵毕赤酵母进化枝包含非常密切相关的物种。与位于该进化枝外的酵母物种相比,东方伊萨酵母/发酵毕赤酵母进化枝的成员与该进化枝的其他物种在26S核糖体DNA的可变D1/D2结构域中展现出较大的相似性。因此,可以使用库兹曼(Kurtzman)和罗伯尼特(Robnett)的方法,通过比较其对应的核糖体DNA的D1/D2结构域并且与该进化枝的其他物种和该进化枝外的密切相关物种的D1/D2结构域相比较而鉴定东方伊萨酵母/发酵毕赤酵母进化枝的其他成员。
在某些实施例中,在此提供的重组酵母细胞属于伊萨酵母属,并且在这些实施例的某些实施例中,这些酵母细胞是东方伊萨酵母。当第一次被表征时,物种东方伊萨酵母被指定的名称是库德里阿兹威毕赤酵母(Pichia kudriavzevii)。东方伊萨酵母的无性型(无性形式)被称为克柔假丝酵母。已经在别处列举了物种东方伊萨酵母的多种另外的异名(库兹曼(Kurtzman)和费尔(Fell),酵母分类研究(The Yeasts,a Taxonomic Study),第35节,库德里亚夫采夫伊萨酵母(Issatchenkia Kudryavtsev),第222-223页(1998))。
在某些实施例中,这些酵母细胞是东方伊萨酵母CNB1酵母细胞。东方伊萨酵母CNB1酵母细胞描述于WO 2012/074818(将其内容通过引用结合在此)中并且包括在此描述的东方伊萨酵母CNB1酵母细胞以及来自在此描述的东方伊萨酵母CNB1酵母细胞的任何酵母细胞。
3-HP生产的理想酵母细胞能够在较低的pH水平下生长。在较低的pH下进行发酵的能力降低了下游的回收成本,从而使得生产更经济。因此,在某些实施例中,该酵母宿主细胞能够在较低的pH水平下(例如,在低于7、6、5、4或3的pH水平下)生长。
除3-HP耐受性和/或较低pH生长能力之外,适合的宿主细胞可以具有一种或多种有利的特征。例如,可以基于糖分解速度、比生长速率、耐热性、对生物质水解产物抑制剂的耐受性、整体流程稳健性等对展现出3-HP耐受性的潜在的宿主细胞进行进一步选择。可以在进行与3-HP途径相关的任何遗传修饰之前评估这些标准,或可以在已经发现一种或多种此类修饰之后对其进行评估。
因为大部分酵母天然地产生乙醇,所以在从丙酮酸(PDC)生产乙醇中,消除或严重减少催化第一步的酶对于替代产物的足够产量而言是有利的。在克勒勃屈利阳性酵母(例如酵母属)中,破坏的PDC基因导致宿主需要用于二碳化合物(例如乙醇或乙酸)的营养缺陷型,并且在包含葡萄糖的培养基中导致缺乏生长。可以使用对乙酸依赖和葡萄糖耐受的渐进选择而获得能够克服这些局限的突变体(参见例如,范马里斯(van Maris)应用与环境微生物学(Appl Environ Microbiol)Appl Environ Microbiol 70:159(2004))。因此,在某些实施例中,优选的酵母宿主细胞是克勒勃屈利阴性酵母细胞,其中PDC被破坏的菌株能够在葡萄糖上生长并保留C2原养型。下文示出了对基因破坏的更加详细的讨论。
在一些方面中,该酵母细胞包括在此描述的主动3-HP途径的一种或多种(例如,两种、若干种)异源多核苷酸(例如,一种编码PPC的异源多核苷酸;一种编码PYC的异源多核苷酸;一种编码AAT的异源多核苷酸;一种编码ADC的异源多核苷酸;一种编码BAAT或gabT的异源多核苷酸;和/或一种编码3-HPDH的异源多核苷酸),其中当在相同条件下培养时,与没有主动3-HP途径的这一种或多种异源多核苷酸的宿主细胞相比,该酵母细胞分泌(和/或能够分泌)增加水平的3-HP。在一些方面中,当在相同条件下培养时,与没有主动3-HP途径的这一种或多种异源多核苷酸的宿主细胞相比,该酵母细胞分泌和/或能够分泌增加至少5%,例如至少10%、至少15%、至少20%、至少25%、至少50%、至少100%、至少150%、至少200%、至少300%或至少500%的水平的3-HP。适合的培养条件的实例在下面进行了描述并且基于在此的教导,对本领域的普通技术人员而言将是容易地显而易见的。
在这些方面的任何方面中,该重组酵母细胞产生(和/或能够产生)产量为理论产量的至少10%,例如至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的3-HP。
在这些方面的任何方面中,该重组酵母细胞具有大于约0.1g/L/小时的3-HP体积生产力,例如大于约0.2g/L/小时、0.5g/L/小时、0.6g/L/小时、0.7g/L/小时、0.8g/L/小时、0.9g/L/小时、1.0g/L/小时、1.1g/L/小时、1.2g/L/小时、1.3g/L/小时、1.5g/L/小时、1.75g/L/小时、2.0g/L/小时、2.25g/L/小时、2.5g/L/小时或3.0g/L/小时;或约0.1g/L/小时与约2.0g/L/小时之间,例如约0.3g/L/小时与约1.7g/L/小时之间、约0.5g/L/小时与约1.5g/L/小时之间、约0.7g/L/小时与约1.3g/L/小时之间、约0.8g/L/小时与约1.2g/L/小时之间或约0.9g/L/小时与约1.1g/L/小时之间。
可以使用本领域熟知的方法,在适合产生主动3-HP途径的一种或多种多肽的营养培养基中培养这些重组酵母细胞。例如,可以通过摇瓶培养,以及在合适的培养基中和在允许表达和/或分离所希望的多肽的条件下,在实验室或工业发酵罐中小规模或大规模发酵(包括连续发酵,分批发酵,补料分批发酵,或固态发酵)来培养该细胞。如在此所述,该培养是使用本领域中已知的程序,在一种适合营养培养基中发生,该培养基包括碳源和氮源及无机盐。合适的培养基从商业供应商处可获得或者可根据公开的组成(例如,在美国典型培养物保藏中心目录中)来制备,或可以从可商购的成分制备。
在此描述的重组酵母细胞还可以经受适应进化,以进一步增加3-HP生物合成,包括在接近理论最大生长的条件下。
在此描述的重组酵母细胞可以进一步包含脂肪酶或酯酶活性,例如归因于表达一种编码脂肪酶或酯酶(EC 3.1.1.-)的异源多核苷酸。可以使用此类细胞生产3-HP的酯,例如3-羟基丙酸甲酯、3-羟基丙酸乙酯、3-羟基丙酸丙酯、3-羟基丙酸丁酯或2-乙基己基3-羟基丙酸酯。这些细胞可以进一步包含酯酶活性,例如归因于表达一种编码酯酶的异源多核苷酸。可以使用此类细胞生产聚合的3-HP。这些细胞可以进一步包含醇脱氢酶(EC 1.1.1.1)活性、醛脱氢酶(EC 1.2.1.-)活性或两者,例如归因于表达一种编码醇脱氢酶、醛脱氢酶或两者的异源多核苷酸。可以使用此类细胞生产1,3-丙二醇。
在此描述的重组酵母细胞可以利用以下表达载体,这些表达载体包括一个或多个(例如,两个、若干个)异源3-HP途径基因的编码序列(例如,在此描述的PPC、PYC、AAT、ADC、BAAT、gabT和/或3-HPDH的编码序列),这些编码序列被连接至一个或多个控制序列,这一个或多个控制序列指导在与这一个或多个控制序列相容的条件下在适合的酵母细胞中的表达。可以在任何于此描述的酵母细胞和方法中使用此类表达载体。在此描述的多核苷酸可以按多种方式操纵,以提供希望的多肽的表达。取决于表达载体,在其插入载体以前操纵多核苷酸可以是希望的或必需的。用于利用重组DNA方法修饰多核苷酸的技术是本领域熟知的。
可以将一个构建体或载体(或多个构建体或载体)引入酵母细胞中,这样使得该构建体或载体被维持作为染色体整合体或作为自主复制的染色体外载体,如早前所述;该构建体或载体(或这些构建体或载体)包括一个或多个(例如,两个、若干个)异源3-HP途径基因。
各种核苷酸和控制序列可以连接在一起以产生重组表达载体,该重组表达载体可以包括一个或多个(例如,两个、若干个)合宜的限制性位点以允许在此类位点插入或取代该多核苷酸。可替代地,可以通过将这种或这些多核苷酸或者包括该序列的核酸构建体插入用于表达的适当载体中而表达这种或这些多核苷酸。在产生该表达载体时,该编码序列是位于该载体中,这样使得该编码序列与该供表达的适当控制序列可操作地连接。
重组表达载体可以是能够方便地进行重组DNA程序并能使多核苷酸表达的任何载体(例如,质粒或病毒)。载体的选择将典型地取决于该载体与有待引入该载体的宿主细胞的相容性。该载体可以是一种线性的或闭合的环状质粒。
在一个方面中,每种异源多核苷酸都被包含在独立的载体上。在一个方面中,这些异源多核苷酸中的至少两种被包含在单一的载体上。在一个方面中,这些异源多核苷酸中的至少三种被包含在单一的载体上。在一个方面中,这些异源多核苷酸中的至少四种被包含在单一的载体上。在一个方面中,所有这些异源多核苷酸都被包含在单一的载体上。编码蛋白复合体的异聚亚基的多核苷酸可以被包含在单一载体的单一异源多核苷酸中或可替代地,被包含在分开的载体的分开的异源多核苷酸中。
载体可以是自主复制型载体,即作为染色体外实体而存在、其复制独立于染色体复制的载体,例如,质粒、染色体外元件、微型染色体或人工染色体。该载体可以包含用于确保自我复制的任何装置。可替代地,该载体可以是这样一种载体,当它被引入该宿主细胞中时,被整合到基因组中并且与其中已整合了它的一个或多个染色体一起复制。此外,可以使用单一载体或质粒或两个或更多个载体或质粒(这些载体或质粒共同包含有待引入到酵母细胞的基因组中的总DNA)或转座子。
该表达载体可以包含任何适合的启动子序列,该启动子序列可被酵母细胞识别,以表达GAPN基因或在此描述的任何3-HP途径基因。启动子序列包括介导多肽表达的转录控制序列。该启动子可以是在选择的酵母细胞中显示出转录活性的任何多核苷酸,包括突变型、截短型及杂合型启动子,并且可以是由编码与该细胞同源或异源的细胞外或细胞内多肽的基因获得。
在此描述的每种异源多核苷酸都可以被可操作地连接至对于该多核苷酸而言外源的启动子上。例如,在一个方面中,编码GAPN的异源多核苷酸被可操作地连接至对于该多核苷酸而言外源的启动子上。在另一个方面中,编码在此描述的3-HP途径的多肽(例如,PPC、PYC、AAT、ADC、BAAT、gabT或3-HPDH)的异源多核苷酸被可操作地连接至对于该多核苷酸而言外源的启动子上。这些启动子可以与所选的天然启动子相同或与其具有较高水平的序列一致性(例如,至少约80%、至少约85%、至少约90%、至少约95%或至少约99%)。
用于指导核酸构建体在酵母细胞中的转录的适合的启动子的实例包括但不限于获得自以下各项的基因的启动子:酿酒酵母烯醇酶(ENO-1),酿酒酵母半乳糖激酶(GAL1),酿酒酵母醇脱氢酶/甘油醛-3磷酸脱氢酶(ADH1,ADH2/GAP),酿酒酵母丙糖磷酸异构酶(TPI),酿酒酵母金属硫蛋白(CUP1),酿酒酵母3-磷酸甘油酸激酶(PGK),PDC1,木糖还原酶(XR),木糖醇脱氢酶(XDH),L-(+)-乳酸-细胞色素c氧化还原酶(CYB2),翻译延长因子-1(TEF1),翻译延长因子-2(TEF2),甘油醛-3-磷酸脱氢酶(GAPDH)以及乳清酸核苷5'-磷酸脱羧酶(URA3)基因。Romanos(罗马诺斯)等人,1992,Yeast(《酵母杂志》)8:423-488描述了酵母宿主细胞的其他有用的启动子。
控制序列也可以是被宿主细胞识别以终止转录的合适转录终止子序列。该终止子序列被可操作地连接至编码该多肽的多核苷酸的3’末端。可以使用在所选的酵母细胞中具有功能的任何终止子。该终止子可以与所选的天然终止子相同或与其具有较高水平的序列一致性(例如,至少约80%、至少约85%、至少约90%、至少约95%或至少约99%)。在某些实施例中,3-HP途径基因被连接至一种终止子,该终止子包括对于该宿主细胞而言天然的天然GAL10基因的功能部分或与天然GAL10终止子具有至少80%、至少85%、至少90%或至少95%序列一致性的序列。
酵母宿主细胞的适合的终止子获得自以下各项的基因:酿酒酵母烯醇酶,酿酒酵母细胞色素C(CYC1),酿酒酵母甘油醛-3磷酸脱氢酶(gpd),PDC1,XR,XDH,转醛醇酶(TAL),转酮醇酶(TKL),核糖5-磷酸酮醇异构酶(RKI),CYB2以及半乳糖家族的基因(尤其是GAL10终止子)。上文的罗马诺斯等人,1992描述了酵母宿主细胞其他有用的终止子。
控制序列也可以是适合的前导子序列,其中转录时,所述前导子序列是对由宿主细胞翻译重要的mRNA的非翻译区。该前导子序列可操作地连接至编码该多肽的多核苷酸的5’末端。可以使用在选择的酵母细胞中具有功能的任何前导子序列。
酵母宿主细胞的适合的前导子获得自以下各项的基因:酿酒酵母烯醇酶(ENO-1)、酿酒酵母3磷酸甘油酸激酶、酿酒酵母α-因子和酿酒酵母醇脱氢酶/甘油醛-3磷酸脱氢酶(ADH2/GAP)。
控制序列还可以是一种聚腺苷酸化序列,可操作地连接至该多核苷酸的3’末端并且当转录时由宿主细胞识别为将聚腺苷酸残基添加至所转录的mRNA的信号的序列。可以使用在选择的宿主细胞中具有功能的任何聚腺苷酸化序列。有用于酵母细胞的聚腺苷酸化序列在郭(Guo)和谢尔曼(Sherman),1995,分子细胞生物学(Mol.Cellular Biol.)15:5983-5990中描述。
也可能令人希望的是添加调节序列,该调节序列允许相对于宿主细胞的生长而调节多肽的表达。调节系统的实例是引起将响应于化学或物理刺激(包含调节性化合物的存在)而开启或关闭的基因表达的那些系统。在原核系统中的调节系统包括lac、tac、以及trp操纵基因系统。在酵母中,可以使用ADH2系统或GAL1系统。调节序列的其他实例是允许基因扩增的那些。在真核系统中,这些调节序列包括在甲氨蝶呤存在下被扩增的二氢叶酸还原酶基因以及用重金属扩增的金属硫蛋白基因。在这些情况下,编码该多肽的多核苷酸将与调节序列可操作地连接。
这些载体可以包含一个或多个(例如,两个、若干个)允许方便地选择转化细胞、转染细胞、转导细胞等细胞的选择性标记。选择性标记是一种基因,该基因的产物提供了杀生物剂抗性或病毒抗性、重金属抗性、营养缺陷型的原养型、等。酵母宿主细胞的适合的标记包括ADE2、HIS3、LEU2、LYS2、MET3、TRP1以及URA3。
这些载体可以包含一个或多个(例如,两个、若干个)允许将该载体整合进宿主细胞的基因组中或在该细胞中独立于基因组而自主复制的元件。
用于整合到宿主细胞基因组中,该载体可以依赖于编码多肽的多核苷酸的序列或该载体中通过同源或非同源重组而整合到该基因组中的任何其他元件。可替代地,该载体可以包含用于指导通过同源重组而整合到宿主细胞基因组中的一个或多个染色体中的一个或多个精确位置处的另外的多核苷酸。为了增加在精确位置处整合的可能性,这些整合的元件应包含足够数量的核酸,例如100至10,000个碱基对、400至10,000个碱基对、以及800至10,000个碱基对,这些碱基对与对应的靶序列具有高度的序列一致性以提高同源重组的可能性。这些整合元件可以是与宿主细胞的基因组内的靶序列同源的任何序列。此外,这些整合元件可以是非编码多核苷酸或编码多核苷酸。另一方面,该载体可以通过非同源重组整合到宿主细胞的基因组中。
对于自主复制,载体可以进一步包含使该载体能够在所讨论的酵母细胞中自主复制的复制起点。复制起点可以是在细胞中起作用的介导自主复制的任何质粒复制子。术语“复制起点”或“质粒复制子”意指使质粒或载体能够在体内复制的多核苷酸。用于在酵母宿主细胞中使用的复制起点的实例是2微米复制起点ARS1、ARS4、ARS1与CEN3的组合、以及ARS4与CEN6的组合。
可以将在此描述的多核苷酸的多于一个的拷贝插入到宿主细胞中以增加多肽的产生。通过将序列的至少一个另外的拷贝整合到酵母细胞基因组中或者通过包含一个与该多核苷酸一起的可扩增的选择性标记基因可以获得多核苷酸的增加的拷贝数目,其中通过在适当的选择性试剂的存在下培养细胞可以选择包含选择性标记基因的经扩增的拷贝的细胞、以及由此该多核苷酸的另外的拷贝。
用于连接以上所描述的元件以构建在此描述的重组表达载体的程序是本领域的普通技术人员熟知的(参见例如,萨姆布鲁克(Sambrook)等人,1989,见上文)。
本领域已知的用于制备包括一个或多个3-HP途径基因的酵母细胞的另外的程序和技术描述于例如US 2012/0135481中,将其内容通过引用结合在此。
基因破坏
该重组酵母细胞还可以包括一个或多个(例如,两个、若干个)基因破坏,以例如将糖代谢从不希望的产物转移至3-HP。在一些方面中,当在相同条件下培养时,与没有这一个或多个破坏的细胞相比,这些重组宿主细胞产生更大量的3-HP。在一些方面中,使这些被破坏的内源基因中的一个或多个失活。
在某些实施例中,在此提供的重组酵母细胞包括编码在乙醇生产中涉及的酶的一个或多个内源基因的破坏,包括例如丙酮酸脱羧酶(PDC,将丙酮酸转化为乙醛)和/或醇脱氢酶(ADH,将乙醛转化为乙醇)基因。这些修饰降低了酵母细胞生产乙醇的能力,从而使3-HP生产最大化。然而,在某些实施例中,在此提供的重组酵母细胞可以被工程化为同时生产3-HP和乙醇。在那些实施例中,优选地不破坏编码在乙醇发酵中涉及的酶的内源基因,并且在某些实施例中,这些酵母细胞可以包括一个或多个增加乙醇产生的异源基因。
在一些实施例中,这些重组酵母细胞可以包括对一个编码PDC的内源基因的破坏,该PDC与SEQ ID NO:186具有至少75%,例如至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%序列一致性。在一些实施例中,该内源基因编码具有以下氨基酸序列的PDC,该氨基酸序列包括SEQ ID NO:186或由其组成。在一些实施例中,编码PDC的内源基因的编码序列与SEQ ID NO:185具有至少75%,例如至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%序列一致性。在一些实施例中,编码PDC的内源基因的编码序列包括SEQ ID NO:185或由其组成。在一些实施例中,使编码PDC的内源基因失活。
在某些实施例中,在此提供的重组酵母细胞包括一个或多个内源基因的破坏,这一个或多个内源基因编码在生产替代发酵产物(例如甘油)或其他副产物(例如乙酸或二醇)中涉及的酶。例如,在此提供的细胞可以包括以下各项的基因中的一种或多种的破坏:甘油3-磷酸脱氢酶(GPD,催化二羟丙酮磷酸反应为甘油3-磷酸),甘油3-磷酸酶(GPP,催化甘油-3磷酸转化为甘油),甘油激酶(催化甘油3-磷酸转化为甘油),二羟丙酮激酶(催化二羟丙酮磷酸转化为二羟丙酮),甘油脱氢酶(催化二羟丙酮转化为甘油),醛脱氢酶(ALD,例如,将乙醛转化为乙酸或将3-HP转化为3-HPA)或丁二醇脱氢酶(催化丁二醇转化为乙偶姻,反之亦然)。
在一些实施例中,这些重组酵母细胞可以包括对一个编码GPD的内源基因的破坏,该GPD与SEQ ID NO:188具有至少75%,例如至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%序列一致性。在一些实施例中,该内源基因编码具有以下氨基酸序列的GPD,该氨基酸序列包括SEQ ID NO:188或由其组成。在一些实施例中,编码GPD的内源基因的编码序列与SEQ ID NO:187具有至少75%,例如至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%序列一致性。在一些实施例中,编码GPD的内源基因的编码序列包括SEQ ID NO:187或由其组成。在一些实施例中,使编码GPD的内源基因失活。
在某些实施例中,在此提供的重组酵母细胞包括一个或多个内源基因的破坏,这一个或多个内源基因编码催化3-HP途径中的逆反应的酶,包括例如PEP羧激酶(PCK)、具有OAA脱羧酶活性的酶或CYB2A或CYB2B(催化乳酸转化为丙酮酸)。PCK催化PEP转化为OAA,反之亦然,但是对OAA至PEP的反应展现出偏好。为了减少OAA至PEP的转化,可以破坏天然PCK基因的一个或多个拷贝。在某些实施例中,其中的一个或多个天然PCK基因已经被破坏的酵母细胞可以表达一个或多个异源PCK基因,这一个或多个异源PCK基因已被突变为编码以下多肽,该多肽有利于将PEP转化为OAA。OAA脱羧酶催化OAA转化为丙酮酸。已经鉴定了具有OAA脱羧酶活性的酶,例如由大肠杆菌中的eda基因编码的酶以及酵母和真菌中的苹果酸酶(MAE)。为了减少OAA脱羧酶活性,可以破坏编码具有OAA脱羧酶活性的酶的天然基因的一个或多个拷贝。在某些实施例中,其中的一个或多个天然OAA脱羧基因已经被破坏的酵母细胞可以表达一个或多个异源OAA脱羧基因,这一个或多个异源OAA脱羧基因已被突变为编码以下多肽,该多肽催化丙酮酸转化为OAA。
在某些实施例中,在此提供的重组酵母细胞包括一个或多个内源基因的破坏,这一个或多个内源基因编码在与3-HP途径产物或中间体进行的不希望的反应中涉及的酶。此类基因的实例包括编码将3-HP转化为3-HP的醛的酶的那些基因,已知这些醛对某些细胞而言是有毒的。
在某些实施例中,在此提供的重组酵母细胞包括一个或多个内源基因的破坏,这一个或多个内源基因编码对3-HP途径具有中性作用的酶,包括例如GAL6(将半乳糖转化为葡萄糖的GAL系统的负调节物)。中性基因的破坏允许在不影响天然途径的情况下插入一个或多个异源基因。
还可以使用建模设计基因破坏,这些基因破坏另外地优化途径的利用(参见例如,美国专利公开US 2002/0012939、US 2003/0224363、US 2004/0029149、US 2004/0072723、US 2003/0059792、US 2002/0168654和US 2004/0009466以及美国专利号7,127,379)。建模分析允许可靠地预测将代谢移向更有效地生产3-HP对细胞生长的影响。用于鉴定并设计有利于生物合成希望的产物的代谢改变的一种示例性计算方法是OptKnock计算框架(OptKnock computational framework),伯加德(Burgard)等人,生物技术与生物工程(Biotechnol.Bioeng.)84:647-657(2003)。
可以使用本领域熟知的方法(包括在此描述的那些方法)构建包括基因破坏的重组酵母细胞。可以破坏该基因的一部分,例如编码区或为编码区的表达所需的控制序列。该基因的这样的一个控制序列可以是启动子序列或其功能部分,即足以影响该基因的表达的部分。例如,可以将启动子序列失活从而无表达或可以将天然启动子替换为较弱的启动子以减少编码序列的表达。可修饰的其他控制序列包括但不限于前导子、前肽序列、信号序列、转录终止子以及转录激活因子。
可以通过基因缺失技术来构建包括基因破坏的重组酵母细胞,以消除或减少该基因的表达。基因缺失技术使得可以部分或完全除去该基因,从而消除其表达。在此类方法中,使用已经构建为邻接地包含侧翼于该基因的5'和3'区的质粒,通过同源重组完成该基因的缺失。
还可以通过引入、取代和/或除去该基因中的或为其转录或翻译所需的其控制序列中的一个或多个(若干个)核苷酸来构建包括基因破坏的重组酵母细胞。例如,可以插入或除去核苷酸,用于引入终止密码子、除去起始密码子或移码开放阅读框。可以根据本领域已知的方法,通过定点诱变或PCR产生的诱变完成这样一种修饰。参见例如,波特斯坦(Botstein)和绍特勒(Shortle),科学(Science)1985,229,4719;洛(Lo)等人,美国国家科学院院刊(Proc.Natl.Acad.Sci.U.S.A.)1985,81,2285;樋口(Higuchi)等人,核酸研究(Nucleic Acids Res)1988,16,7351;岛田(Shimada),分子生物学方法(Meth.Mol.Biol.)1996,57,157;霍(Ho)等人,基因(Gene)1989,77,61;霍尔顿(Horton)等人,基因1989,77,61;以及萨卡尔(Sarkar)和松梅尔(Sommer),生物技术(BioTechniques)1990,8,404。
还可以通过将破坏性核酸构建体插入该基因中而构建包括基因破坏的重组酵母细胞,该破坏性核酸构建体包括与该基因同源的核酸片段,该片段将产生具有同源性的区域的重复并且在重复的区域之间掺入构建体DNA。这样的一种基因破坏可以消除基因表达,如果插入的构建体将该基因的启动子与编码区分离或打断编码序列,这样使得产生无功能性基因产物。破坏构建体可以简单地是伴有与该基因同源的5’和3’区的选择性标记基因。该选择性标记使得可以鉴定包含破坏的基因的转化株。
还可以通过基因转化过程构建包括基因破坏的重组酵母细胞(参见例如,伊格莱西亚斯(Iglesias)和特劳特勒(Trautner),分子普通遗传学(Molecular General Genetics)1983,189,73-76)。例如,在基因转化方法中,将对应于该基因的核苷酸序列体外诱变,以产生缺陷核苷酸序列,然后将其转化进重组体菌株中以产生缺陷基因。通过同源重组,该缺陷核苷酸序列替换该内源基因。该缺陷核苷酸序列还包括一种用于选择包含缺陷基因的转化株的标记可以是令人希望的。
可以使用本领域熟知的方法(包括但不限于化学诱变),通过随机或特异诱变进一步构建包括基因破坏的重组酵母细胞(参见例如,霍普伍德(Hopwood),微生物学方法中的突变体分离(The Isolation of Mutants in Methods in Microbiology(J.R.诺里斯(Norris)和D.W.里本(Ribbons),编辑))第363-433页,学术出版社(Academic Press),纽约,1970)。可以通过使亲本菌株经受诱变并筛选其中该基因的表达已经被减少或失活的突变体菌株来修饰该基因。诱变可以是特异的或随机的,例如通过使用适合的物理或化学诱变剂、使用适合的寡核苷酸或使DNA序列经受PCR产生的诱变来进行。此外,诱变可以通过使用这些诱变方法的任何组合来进行。
适用于本发明目的的物理或化学诱变剂的实例包括紫外线(UV)照射,羟胺,N-甲基-N’-硝基-N-亚硝基胍(MNNG),N-甲基-N’-亚硝基胍(NTG),邻甲基羟胺,亚硝酸,乙基甲磺酸(EMS),亚硫酸氢钠,甲酸和核苷酸类似物。当使用此类试剂时,诱变典型地是在适合条件下在所选的诱变剂的存在下通过孵育有待诱变的亲本菌株并选择展现出该基因的减少表达或无表达的突变体来进行的。
可以使用来自其他微生物来源的与在此描述的基因同源或互补的核苷酸序列来破坏所选的重组体菌株中的对应基因。
在一个方面中,重组酵母细胞中的基因修饰未用选择性标记加以标记。可以通过将突变体在反向选择培养基中进行培养来除去选择性标记基因。在该选择性标记基因包含侧翼于其5'和3'端的重复序列的情况下,当该突变体菌株经受反向选择时,这些重复序列将有助于该选择性标记基因通过同源重组而环出。还可以通过向该突变体菌株中引入一个核酸片段,该核酸片段包括缺陷基因的5'和3'区但是缺乏该选择性标记基因,随后在反向选择培养基上进行选择,通过同源重组来除去该选择性标记基因。通过同源重组,包含该选择性标记基因的缺陷基因被缺乏该选择性标记基因的核酸片段替换。还可以使用本领域已知的其他方法。
生产3-HP以及相关化合物的方法
可以使用在此描述的重组酵母细胞生产3-HP。在一个方面中,是一种生产3-HP的方法,该方法包括:(a)在适合生产3-HP的条件下,在培养基中培养在此描述的重组酵母细胞中的任一重组酵母细胞(例如,包括主动3-HP途径和编码GAPN的异源多核苷酸的重组宿主细胞);并且(b)回收3-HP。
可以使用本领域熟知的方法,在适合生产3-HP的营养培养基中培养包括主动3-HP途径的重组酵母细胞。例如,可以通过在适合的发酵培养基中和在允许产生3-HP的条件下,进行摇瓶培养,以及在实验室或工业发酵罐中进行小规模或大规模发酵(包括连续、分批、分批补料或固态发酵)来培养这些细胞。
这些重组酵母细胞可以在一种可发酵的培养基中产生3-HP,该可发酵培养基包括一种或多种(例如,两种、若干种)糖,这些糖是例如葡萄糖、果糖、蔗糖、纤维二糖、木糖、木酮糖、阿拉伯糖、甘露糖、半乳糖和/或可溶的低聚糖。碳源可以是十二碳糖(例如蔗糖)、己糖(例如葡萄糖或果糖)、多糖或葡萄糖的其他聚合物、葡萄糖寡聚物(例如麦芽糖、麦芽三糖和异麦芽三糖)、潘糖以及果糖寡聚物。如果该细胞被修饰为赋予发酵戊糖的能力,则该发酵培养基可以包括戊糖,例如木糖、木聚糖或木糖的其它寡聚物和/或阿拉伯糖。此类戊糖可以适合地是包含半纤维素的生物质的水解产物。在一些实施例中,该细胞不能发酵戊糖和/或该可发酵的培养基包括低于1%的戊糖。在一些情况下,该可发酵的培养基来自天然来源,例如甘蔗、淀粉、或纤维素;并且可以是通过酶水解(糖化作用)对这种来源进行预处理的结果。在一些方面中,该可发酵的培养基包括甘蔗汁。合适的培养基从商业供应商处可获得或者可根据公开的组成(例如,在美国典型培养物保藏中心目录中)来制备,或可以从可商购的成分制备。
除了来自一种或多种(例如,两种、若干种)糖的适当的碳源之外,该可发酵的培养基可以包含本领域的普通技术人员已知的其他营养素或刺激物,例如大量营养素(如,氮源)以及微量营养素(如,维生素、矿物盐、以及金属辅因子)。在一些方面中,碳源优先地可以补充有至少一种碳源,例如酵母提取物、N2、蛋白胨(例如,BactoTM蛋白胨)、或大豆蛋白胨(例如,BactoTM大豆蛋白胨)。维生素的非限制性实例包括多种维生素、生物素、泛酸盐、烟酸、内消旋肌醇、硫胺素、吡哆醇、对氨基苯甲酸、叶酸、核黄素、以及维生素A、维生素B、维生素C、维生素D和维生素E。矿物盐和金属辅因子的实例包括但不限于Na、P、K、Mg、S、Ca、Fe、Zn、Mn、Co以及Cu。
在一些实施例中,可以在化学成分确定的培养基中培养本发明的重组酵母细胞。在一个实例中,该培养基包含大约5g/L硫酸铵,大约3g/L磷酸二氢钾,大约0.5g/L硫酸镁、痕量元素和维生素以及大约150g/L葡萄糖。在培养过程中可以允许pH自由变化,或必要的话,可以缓冲,以防止pH跌至预定的水平之下或升至预定的水平之上。在某些实施例中,用足够的酵母细胞接种该发酵培养基,这些酵母细胞是产生约1.0的OD600的评估对象。除非另外明确指明,如在此使用,OD600是指使用型号DU600分光光度计(贝克曼库尔特公司(Beckman Coulter))在600nm的波长下以1cm路长测量的光密度。
用于生产3-HP的方法的具体条件可以由本领域的普通技术人员根据在此的教导确定。在这些方法的一些方面中,将这些酵母细胞培养约12小时至约216小时,例如约24小时至约144小时、或约36小时至约96小时。温度典型地在约26℃至约60℃之间,例如约34℃至约50℃。
视情况而定,可以在厌氧、基本上厌氧(微好氧)、或好氧条件下进行培养。简言之,厌氧的是指一种缺少氧气的环境,基本上厌氧的(微好氧的)是指一种其中氧气的浓度比空气低的环境,并且好氧是指一种其中氧气浓度大致等于或大于空气的氧气浓度的环境。基本上缺氧条件包括例如使得在培养基中的溶氧浓度保持在小于10%的饱和度的培养、分批发酵或连续发酵。基本上缺氧条件还包括使细胞在维持有小于1%氧气的气氛的密封室内的液体培养基中或固体琼脂上生长或静止。例如可以通过向培养物鼓吹N2/CO2混合物或其他一种或多种适合的非氧气体来维持氧气的百分比。在一些实施例中,在缺氧条件或基本上缺氧条件下进行培养。
在一个实例中,在生产期过程中,发酵培养基中的细胞浓度典型地在约0.1至20,优选从0.1至5,甚至更优选从1至3g干细胞/升发酵培养基的范围内。希望的话,摄氧率(OUR)可以贯穿整个发酵变化作为过程控制(参见例如,WO 03/102200)。在一些实施例中,在微好氧条件下培养在此提供的重组酵母细胞,这些微好氧条件由从2至45mmol/L/hr,例如2至25、2至20、2至15、2至10、10至45、15至40、20至35或25至35mmol/L/hr的摄氧率表征。在某些实施例中,当在由从2至25mmol/L/hr的摄氧率表征的微好氧条件下培养时,在此提供的重组酵母细胞表现尤其好。可以在生产期过程中缓冲培养基,这样使得将pH维持在约3.0至约7.0或从约4.0至约6.0的范围内。适合的缓冲剂是当酸形成时中和它的碱性材料,并且包括例如氢氧化钙、碳酸钙、氢氧化钠、氢氧化钾、碳酸钾、碳酸钠、碳酸铵、氨、氢氧化铵等。通常,那些在常规的发酵过程中使用的缓冲剂在此也是适合的。
在利用缓冲发酵的那些实施例中,当酸性发酵产物形成时,可以将它们中和成对应的盐。在这些实施例中,回收酸包括再生游离酸。这可以通过以下方式完成:移除细胞并用强酸(例如硫酸)酸化发酵液。这导致形成盐副产物。例如,在将钙盐用作中和剂并且将硫酸用作酸化剂的情况下,将石膏产生为盐副产物。将这一副产物与发酵液分离,并且使用例如液液提取、蒸馏、吸收以及其他技术回收酸(参见例如,T.B.维克罗伊(Vickroy),综合生物技术(Comprehensive Biotechnology)的第3卷,第38章(编辑M.武-杨(Moo-Young)),帕加马(Pergamon),牛津,1985;R.达塔(Datta)等人,FEMS微生物学评论(FEMS Microbiol Rev),1995,16:221-231;美国专利号4,275,234、4,771,001、5,132,456、5,420,304、5,510,526、5,641,406和5,831,122以及WO 93/00440)。
在其他实施例中,在培养过程中,可以允许发酵培养基的pH从处于或高于3-HP的pKa的起始pH(典型地是4.5或更高)降至处于或低于酸发酵产物的pKa,例如低于4.5或4.0,如在约1.5至约4.5的范围内、在从约2.0至约4.0的范围内或在从约2.0至约3.5的范围内。
在仍其他实施例中,可以通过在发酵过程之前或开始时,将发酵液的pH调节为处于或低于产物酸的pKa而进行发酵,以产生该产物酸。之后,贯穿整个培养,可以将pH维持为处于或低于该产物酸的pKa。在某些实施例中,可以将pH维持为低于4.5或4.0,例如在约1.5至约4.5的范围内、在约2.0至约4.0的范围内或在约2.0至约3.5的范围内。
在此描述的这些方法可以利用任何适合的发酵操作模式。例如,分批模式发酵可以与一个封闭系统一起使用,其中培养基和重组酵母(在发酵的开始设置的)除了试剂(某些例如用于pH控制、泡沫控制,或过程支持所需的其他试剂)之外,没有另外的投入。在此描述的过程还可以在补料分批模式或连续模式中利用,如上所提及。
可以在若干生物反应器构型中实践在此描述的这些方法,例如搅拌槽、鼓泡塔、气升式反应器以及本领域的普通技术人员已知的其他反应器。视情况而定,能以游离细胞培养或固定化细胞培养的方式执行这些方法。可以使用任何用于支持固定化细胞培养的材料,例如藻酸盐、纤维床、或菱形材料,例如温石棉、蒙脱石KSF和蒙脱石K-10。
在这些方法的一个方面中,生产的3-HP的滴度大于约5g/L,例如大于约10g/L、25g/L、50g/L、75g/L、100g/L、125g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、210g/L、225g/L、250g/L、275g/L、300g/L、325g/L、350g/L、400g/L或500g/L;或在约10g/L与约500g/L之间,例如约50g/L与约350g/L之间、约100g/L与约300g/L之间、约150g/L与约250g/L之间、约175g/L与约225g/L之间或约190g/L与约210g/L之间。在一个实施例中,以大于约0.01克/克碳水化合物的滴度生产3-HP,例如大于约0.02、0.05、0.75、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、或1.0克/克碳水化合物。
在这些方法的一个方面中,当在相同条件下培养时,与培养不具有编码GAPN的异源多核苷酸的重组酵母细胞相比,生产的3-HP的量多至少5%,例如至少10%、至少15%、至少20%、至少25%、至少30%、至少50%或至少100%。
在于此提供的这些方法的某些实施例中,这些重组酵母细胞产生相对较低水平的乙醇。在某些实施例中,可以按10%或更少的产量,优选按2%或更少的产量生产乙醇。在这些实施例的某些实施例中,产生的乙醇检测不出。然而,在其他实施例中,可以同时生产3-HP和乙醇。在这些实施例中,可以按大于10%、大于25%或大于50%的产量生产乙醇。
可以使用本领域已知的任何程序从发酵培养基中任选地回收3-HP,这些程序包括但不限于色谱法(例如,尺寸排阻色谱法、吸附色谱法、离子交换色谱法)、电泳程序、溶解度差异、渗透、蒸馏、提取(例如,液液提取)、渗透蒸发、萃取过滤、膜过滤、膜分离、反或超滤。在一个方面中,从其他发酵材料中分离3-HP并通过蒸馏的常规方法加以纯化。因此,在一个方面中,该方法进一步包括通过蒸馏纯化回收的3-HP。
还可以通过上述程序(例如,色谱法、电泳程序、溶解度差异、蒸馏或提取)将杂质(污染物)化学转化为更易于从3-HP中除去的产物和/或通过将杂质直接化学转化为3-HP而纯化重组3-HP。例如,在一个方面中,该方法进一步包括通过使用本领域已知的化学技术将β-丙氨酸污染物转化为3-HP而纯化回收的3-HP。
在这些方法的一些方面中,在可任选地纯化之前和/或之后的重组3-HP制剂是基本上纯的。关于生产3-HP的方法,“基本上纯的”意指回收的制剂包含不多于15%的杂质,其中杂质意指除3-HP以外的化合物。在一种变体中,提供了一种基本上纯的制剂,其中该制剂包含至多25%杂质、或至多20%杂质、或至多10%杂质、或至多5%杂质、或至多3%杂质、或至多1%杂质、或至多0.5%杂质。
应该理解的是,可以将通过β-丙氨酸中间体进行的3-HP途径应用于生产β-丙氨酸(例如,如果破坏将β-丙氨酸转化为丙二酸半醛的下游基因;参见图1)。在这种情况下,该重组酵母细胞将产生β-丙氨酸而非3-HP或产生β-丙氨酸和3-HP的混合物。应该进一步理解的是,希望的话,可以通过本领域已知的方法将在此描述的重组酵母细胞表达的β-丙氨酸用化学方法转化为3-HP,如上文所提及。
可以用化学方法将使用在此披露的方法生产的3-HP转化为其他有机化合物。例如,可以将3-HP氢化以形成1,3丙二醇(一种有价值的聚酯单体)。也可以使用在体外或在体内具有氧化还原酶活性的多肽从3-HP生产丙二醇。可以使用任何方法氢化有机酸(例如3-HP),例如用于氢化丁二酸和/或乳酸的那些方法。例如,可以使用金属催化剂氢化3-HP。
可以将通过任何在此描述的方法生产的3-HP转化为丙烯酸。可以使用本领域已知的技术通过将3-HP化学脱水而产生丙烯酸,例如在催化剂(例如,固体氧化物脱水催化剂,如二氧化钛或氧化铝)的存在下加热。
在一个方面中,是一种生产丙烯酸或其盐的方法,该方法包括:(a)在适合生产3-HP的条件下,在培养基中培养在此描述的重组酵母细胞(例如,包括主动3-HP途径和编码GAPN的异源多核苷酸的重组宿主细胞);(b)回收3-HP;(c)在适合生产丙烯酸或其盐的条件下,将3-HP脱水;并且(d)回收丙烯酸或其盐。
可以使用本领域已知的方法进行适合的测定,这些测定用于测试在此描述的生产方法和酵母细胞的3-HP和丙烯酸的产生。例如,可以通过多种方法(例如HPLC(高效液相色谱)、GC-MS(气相色谱-质谱法)和LC-MS(液相色谱-质谱法))或使用本领域熟知的常规程序的其他适合的分析方法对终产物3-HP和中间体(例如,β-丙氨酸)以及其他有机化合物进行分析。还可以用培养上清液测试发酵液中的3-HP的释放。可以使用例如针对葡萄糖和醇类的折光率检测器、以及针对有机酸的UV检测器通过HPLC(Lin(林)等人,Biotechnol.Bioeng.(《生物技术与生物工程》)90:775-779(2005))、或使用本领域熟知的其他适合的测定和检测方法量化在发酵培养基中的副产物和残余的糖(例如,葡萄糖)。
通过说明提供了以下实例,并且并不旨在使限制本发明。
实例
用作缓沖液和底物的化学品至少是试剂等级的商品。
培养基和溶液
TE由10mM Tris碱和1mM EDTA(pH8.0)构成。
2X YT+amp平板是由16g/L胰蛋白胨、10g/L酵母提取物、5g/LNaCl、100mg/L氨比西林、以及15g/L细菌培养用琼脂构成。
ura选择性平板是由具有硫酸铵的6.7g酵母氮碱(nitrogen base)、5g酪蛋白氨基酸、100mL 0.5M琥珀酸(pH 5)、20g诺布尔琼脂(Noble agar)、以及855mL去离子水构成。在高压灭菌之后,添加40mL无菌50%葡萄糖以及2mL 10mg/mL氯霉素,并且倒平板。
ura选择性培养基是由具有硫酸铵的6.7g酵母氮碱、5g酪蛋白氨基酸、100mL 0.5M琥珀酸(pH 5)、以及855mL去离子水构成。在高压灭菌之后,添加40mL无菌50%葡萄糖以及2mL 10mg/mL氯霉素。
YP+10%葡萄糖培养基是由500mL YP肉汤和100mL无菌50%葡萄糖构成。
YP肉汤是由10g/L酵母提取物、20g/L蛋白胨构成。
YPD平板是由10g酵母萃取物、20g蛋白胨、20g细菌培养用琼脂、以及加至960mL的去离子水构成。在高压灭菌之后,添加40mL无菌50%葡萄糖,并且倒平板。
TAE是由4.84g/L Tris碱、1.14mL/L冰乙酸、以及2mL/L的0.5M EDTA(pH 8.0)构成。
TBE是由10.8g/L Tris碱、5.5g/L硼酸、以及4mL/L的0.5M EDTA(pH 8.0)构成。
LiOAc/TE溶液是由8份无菌水、1份1M LiOAc、以及1份10X TE构成。
10X TE(200mL)是由2.42g Tris碱、4mL 0.5M EDTA(pH 8.0)构成。使用5M HCl将pH调节至7.5,并且将溶液通过高压灭菌器进行灭菌。
PEG/LiOAc/TE溶液是由8份50%PEG3350、1份1M LiOAc、以及1份10X TE构成。
50%PEG3350是通过将100g PEG3350添加至150mL水中并且进行加热和搅拌直至溶解来制备的。然后将体积用水加至200mL,并且通过高压灭菌器进行灭菌。
ScD FOA平板是由275mL 2X-ScD 2X FOA液体培养基和275mL 2X-ScD 2X FOA平板培养基构成,熔融并且冷却至65℃。
2X-ScD 2X FOA液体培养基是由6.66g不含有氨基酸的酵母氮碱、1.54g ura-DO补充物(Clontech,山景城(Mountain View),加利福尼亚州(CA),美国)、20g右旋糖、50mg尿嘧啶、2mg尿苷、以及2g 5-FOA(5-氟乳清酸,一水合物;多伦多研究化学(Toronto Research Chemicals),北约克(North York),安大略省(ON),加拿大)以及加至1L的水构成。将所得溶液进行过滤以灭菌。
2X-ScD 2X FOA平板培养基是由11g细菌培养用琼脂和275mL水构成。将所得溶液进行高压蒸汽处理以灭菌。
DM2培养基是由硫酸铵(5.0g/L)、七水硫酸镁(0.5g/L)、磷酸二氢钾(3.0g/L)、痕量元素溶液(1mL/L)以及维生素溶液(1mL/L)构成。在溶解所有培养基组分后,使用适当的碱(例如KOH)将培养基的pH调节至希望的初始pH。
痕量元素溶液是由EDTA(15.0g/L)、七水硫酸锌(4.5g/L)、脱水二氯化锰(1.0g/L)、六水氯化钴(II)(0.3g/L)、五水硫酸铜(II)(0.3g/L)、脱水钼二钠(0.4g/L)、脱水氯化钙(4.5g/L)、七水硫酸铁(3g/L)、硼酸(1.0g/L)、以及碘化钾(0.1g/L)构成。
维生素溶液是由生物素(D-;0.05g/L)、泛酸钙(D+;1g/L)、烟酸(5g/L)、肌醇(25g/L)、盐酸吡哆醇(1g/L)、对氨基苯甲酸(0.2g/L)、以及盐酸硫胺素(1g/L)构成。
DM1X-α-gal平板是由DM1盐、20g/L葡萄糖、痕量元素溶液、维生素溶液、2mL/L X-α-gal(16mg/mL)、以及20g/L琼脂构成。
DM1盐溶液是由2.28g/L尿素、3g/L磷酸二氢钾、以及0.5g/L七水硫酸镁构成。
伯得富磷酸缓冲液(Butterfields Phosphate Buffer)是由1.25mL/L储备溶液(26.22g/L磷酸二氢钾以及7.78g/L碳酸钠)以及5mL/L氯化镁溶液(81.1g/L MgCl2-6H2O)构成。将所得溶液进行高压蒸汽处理以灭菌,并且将pH调节至7.2。
CNB1摇瓶培养基是由尿素(2.3g/L)、七水硫酸镁(0.5g/L)、磷酸二氢钾(3.0g/L)、痕量元素溶液(1mL/L)以及维生素溶液(1mL/L)、葡萄糖(120.0g/L)、2-(N-吗啉基)乙磺酸(MES)(97.6g/L)构成。在溶解所有培养基组分后,使用适当的碱(例如KOH)将培养基的pH调节至初始pH 5.8。
表2:引物序列
实例1:用于将DNA转化进酵母基因组中的程序
基于以下具体程序,进行以下实例中描述的将DNA转化进酵母宿主基因组中以产生重组酵母菌株。
将3mL的YP+10%葡萄糖培养基添加至14mL法尔肯管(Falcon tube)中,并且使用无菌环将希望的菌株接种进该培养基中。使培养物在250rpm摇动下在37℃生长过夜(约16小时)。将0.5mL过夜培养物添加至125mL带挡板的包含25mL液体YP+10%葡萄糖培养基的摇瓶中。使摇瓶培养物在250rpm摇动下在37℃生长。以大约以小时计的间隔抽取培养物的小等分部分,并且测量OD600。使培养物生长直到OD600为0.6-1.0。
将细胞通过在室温在2279x g离心来进行收获,将沉淀物重悬浮在25mL无菌水中,然后在室温在2279x g进行离心。将沉淀物重悬浮在1mL无菌水中,并且将重悬浮的细胞转移至1.5mL试管,并且然后在16,100x g进行沉淀。将细胞重悬浮在1mL LiOAc/TE溶液中,并且然后在16,100x g进行沉淀。然后将细胞沉淀物重悬浮在250μLLiOAc/TE溶液中。
将以下组分添加至1.5mL试管中:100μL以上细胞,10μL新鲜煮沸的然后冰冻的鲑鱼精DNA(安捷伦科技,圣克拉拉(Santa Clara),加利福尼亚州,美国),以及10μL所希望的、线性化的转化DNA。还制备了用水代替DNA的对照反应。向各转化反应中依次添加600μL的PEG/LiOAc/TE溶液、40μL DMSO,并且将反应倒置数次以混合。将转化反应孵育于42℃水浴中持续15分钟,并且将细胞在5,400x g沉淀1min。将细胞重悬浮在水中,分为两部分,并且将转化反应物的各一半铺于ura选择性培养基平板上。将平板放置在37℃下。在生长2天后菌落是可见的。
实例2:包含主动3-HP途径的酵母菌株的构建。
该实例描述了具有主动3-HP途径的酵母菌株的构建,其中这些菌株表达:四个拷贝的在adh1202基因座对地衣芽孢杆菌ADC(SEQ ID NO:139)进行编码的多核苷酸,一个拷贝的在pdc基因座对东方伊萨酵母PYC(SEQ ID NO:2)进行编码的多核苷酸,三个拷贝的对地衣芽孢杆菌ADC(SEQ ID NO:139)进行编码的多核苷酸(同时上调在pyc基因座对东方伊萨酵母PYC(SEQ ID NO:2)进行编码的内源性多核苷酸),四个拷贝的在adh9091基因座对地衣芽孢杆菌ADC(SEQ ID NO:139)进行编码的多核苷酸,以及内源性甘油3-磷酸脱氢酶GPD基因的破坏。
将东方伊萨酵母CNB1酵母菌株McTs253(US 2012/0135481)的ura-衍生物如前所述地进行分离(US 2012/0135481),所述东方伊萨酵母CNB1酵母菌株McTs253从在adh1202基因座处的四个多核苷酸序列表达天冬氨酸-α-脱羧酶(ADC)以及在pdc基因座处的丙酮酸羧化酶(PYC)。将McTs253的一些FOA抗性菌落针对在ura选择性平板上的缺乏生长并且通过针对所希望的环出事件(loop-out event)的PCR进行筛选。使用引物0614233和0611554,如所希望的,通过凝胶电泳表现的4.6kbp条带指示仅ura3scar位点(在亲本菌株中的两个URA3启动子之间同源重组之后留下的单一URA3启动子)的存在,同时大约5.9kbp的条带指示完整URA3启动子-URA3ORF-URA3终止子-URA3启动子盒的存在,表明希望的重组事件没有发生。使用Phire Plant Direct PCR试剂盒(Finnzymes)进行的PCR反应是根据厂商说明书进行的。来自亲本菌株McTs253的、具有希望的环出事件的一个FOA抗性菌落被指定为McTs258。
将菌株McTs258(见上文)用PvuI/SacII-消化的pMlBa157(图11)、以及HpaI/SacII-消化的pMlBa158(图12)进行转化,以将三个拷贝的对地衣芽孢杆菌ADC进行编码的多核苷酸整合在pyc基因座,并且将天然PYC启动子用PDC启动子替代(对于类似的实验程序参见US 2012/0135481)。使用Phire Plant Direct PCR试剂盒(Finnzymes)通过PCR使用引物0614308和0615118(被设计为通过凝胶电泳产生大约4.4kbp条带)以及0611247和0614235(被设计为通过凝胶电泳产生大约4.7kbp条带)对正确的基因座靶向与转化进行验证。将给出针对盒在pyc基因座处合适的整合的预期条带的菌株指定为MlBa400。
将MlBa400的ura-衍生物(见上文)如US 2012/0135481中描述的进行分离。将MlBa400的一些FOA抗性菌落通过PCR采用引物0612362和0611717针对希望的环出事件进行筛选。如所希望的,通过凝胶电泳表现的0.70kbp条带指示仅ura3scar位点(在亲本菌株中的两个URA3启动子之间同源重组之后留下的单一URA3启动子)的存在,同时大约2.1kbp的条带指示完整URA3启动子-URA3ORF-URA3终止子-URA3启动子盒的存在,表明希望的重组事件没有发生。来自亲本菌株MlBa400的、具有希望的环出事件的一个FOA抗性菌落被指定为MlBa404。
为了构建对应的纯合菌株,将MlBa404(见上文)用PvuI/SacII-消化的pMlBa157(见上文)和HpaI/SacII-消化的pMlBa162(图13)进行转化,并且使用Phire Plant Direct PCR试剂盒(Finnzymes)通过PCR将正确的基因座靶向与转化进行验证。为了确认野生型pyc基因座两者的丢失,引物0614309和0611622被设计为使得完整pyc基因座可以通过凝胶电泳产生大约0.45kbp的条带,同时表达盒的插入会产生6.4kbp产物。对于不再具有野生型基因座的那些菌株,使用引物组0614234和0612362以确认第一整合的存在,并且使用引物组0614234和0612366以确认第二整合的存在。对于针对三个拷贝的对地衣芽孢杆菌ADC(其中在pyc基因座处PDC启动子替代I东方伊萨酵母PYC启动子)进行编码的核苷酸纯合的菌株,这些引物组被设计为分别产生1.98和1.88kbp的产物。将给出如通过针对纯合子进行的凝胶电泳确定的预期条带的一个菌株指定为MlBa408。
将MlBa408的ura-衍生物(见上文)如US 2012/0135481中描述的进行分离。将MlBa408的一些FOA抗性菌落通过PCR采用引物0612366和0611717针对希望的环出事件进行筛选。如所希望的,通过凝胶电泳表现的0.60kbp条带指示仅ura3scar位点(在亲本菌株中的两个URA3启动子之间同源重组之后留下的单一URA3启动子)的存在,同时大约2.0kbp的条带指示完整URA3启动子-URA3 ORF-URA3终止子-URA3启动子盒的存在,表明希望的重组事件没有发生。来自亲本菌株MlBa408的、具有希望的环出事件的一个FOA抗性菌落被指定为MlBa413。
将菌株MlBa413(见上文)用HpaI/SacII-消化的pMeJi322(图14)、以及EcoRI/SacII-消化的pMeJi323-3(图15)进行转化,以将四个拷贝的对地衣芽孢杆菌ADC进行编码的多核苷酸整合在adh9091基因座(对于类似的实验程序参见US 2012/0135481)。使用Phire Plant Direct PCR试剂盒(Finnzymes)通过PCR使用引物0615118和0614627(被设计为通过凝胶电泳产生大约4.2kbp条带)以及0611247和0614626(被设计为通过凝胶电泳产生大约4.6kbp条带)对正确的基因座靶向与转化进行验证。给出了预期条带的一种菌株被指定为MlBa418。
将MlBa418的ura-衍生物(见上文)如US 2012/0135481中描述的进行制备。将MlBa418的一些FOA抗性菌落通过PCR采用引物0612366和0614627针对希望的环出事件进行筛选。如所希望的,通过凝胶电泳呈现4.4kbp条带指示仅ura3scar位点(在亲本菌株中的两个URA3启动子之间同源重组之后留下的单一URA3启动子)的存在,同时大约5.8kbp的条带指示完整URA3启动子-URA3ORF-URA3终止子-URA3启动子盒的存在,表明希望的重组事件没有发生。来自亲本菌株MlBa418的、具有希望的环出事件的一个FOA抗性菌落被指定为MlBa422。
为了构建对应的纯合菌株,将MlBa422(见上文)用HpaI/SacII-消化的pMeJi322(图14)和EcoRI/SacII-消化的pMlBa163(图16)进行转化,并且使用Phire Plant Direct PCR试剂盒(Finnzymes)通过PCR将正确的基因座靶向与转化进行验证。为了确认野生型adh9091基因座两者的丢失,引物0615158和0614626被设计为使得完整adh9091基因座可以通过凝胶电泳产生大约1.3kbp的条带,但表达盒的插入不产生扩增片段。对于不再具有野生型基因座的那些菌株,使用引物组0611718和0614626以确认第一整合的存在,并且使用引物组0612366和0614626以确认第二整合的存在。针对对于四个拷贝的在adh9091基因座处编码地衣芽孢杆菌ADC的核苷酸纯合的菌株,各引物组被设计为产生大约1.2kbp产物。给出针对纯合子的预期条带的一种菌株被指定为MlBa425。
将菌株MlBa425(见上文)的ura-衍生物如前所述地进行分离。将MlBa425的一些FOA抗性菌落针对在ura-选择性平板上缺乏生长、通过针对adh9091处第一和第二整合盒的存在的PCR进行筛选。使用引物组0611718和0614626以确认第一整合的存在,并且使用引物组0612366和0614626以确认第二整合的存在。针对对于四个拷贝的在adh9091基因座处编码地衣芽孢杆菌ADC的核苷酸纯合的ura-菌株,各引物组被设计为产生大约1.2kbp产物。给出针对纯合子的预期条带的一种菌株被指定为MlBa429。
将菌株MlBa429(见上文)用ApaI/SphI/SacI-消化的pHJJ56(US 2012/0135481)进行转化以破坏GPD基因。在GPD基因被破坏时,使用Phire Plant Direct PCR试剂盒(Finnzymes)通过PCR使用引物0614891和0612908(被设计为通过凝胶电泳产生大约1.9kbp条带)以及引物0612909和0614892(被设计为通过凝胶电泳产生大约2.0kbp条带)对正确的基因座靶向与转化进行验证。给出了预期条带的一种菌株被指定为McTs403。
将McTs403的ura-衍生物(见上文)如US 2012/0135481中描述的进行分离。将McTs403的一些FOA抗性菌落通过PCR采用引物0614891和0611718针对希望的环出事件进行筛选。如所希望的,通过凝胶电泳呈现1.4kbp条带指示仅ura3scar位点(在亲本菌株中的两个URA3启动子之间同源重组之后留下的单一URA3启动子)的存在,同时大约2.9kbp的条带指示完整URA3启动子-URA3ORF-URA3终止子-URA3启动子盒的存在,表明希望的重组事件没有发生。来自亲本菌株MlBa418的、具有希望的环出事件的一个FOA抗性菌落被指定为MeJi457。
为了构建对应的纯合菌株,将MMeJi257(见上文)用消化的pHJJ57(US 2012/0135481)进行转化,并且使用Phire Plant Direct PCR试剂盒(Finnzymes)通过PCR将正确的基因座靶向与转化进行验证。使用引物组0614891和0611718(被设计为通过凝胶电泳产生大约1.4kbp条带)确认在第一基因座处GPD缺失盒的存在,并且使用引物组0612908和0614892(被设计为通过凝胶电泳产生大约2kbp条带)来确认在在第二基因座处GPD缺失盒的存在。给出了预期条带的一种菌株被指定为MeJi461。
将MeJi461的ura-衍生物(见上文)如US 2012/0135481中描述的进行分离。将MeJi461的一些FOA抗性菌落通过PCR采用引物0611718和0614892针对希望的环出事件进行筛选。如所希望的,通过凝胶电泳呈现1.6kbp条带指示仅ura3 scar位点(在亲本菌株中的两个URA3启动子之间同源重组之后留下的单一URA3启动子)的存在,同时大约2.9kbp的条带指示完整URA3启动子-URA3 ORF-URA3终止子-URA3启动子盒的存在,表明希望的重组事件没有发生。来自亲本菌株MeJi461的、具有希望的环出事件的一个FOA抗性菌落被指定为MeJi465。
实例3:用于在酵母scw11基因座处表达异源非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)的插入载体的构建。
pMBin227(变形链球菌GAPN)
将质粒pMBin227设计为允许在东方伊萨酵母scw11基因座处整合受PDC启动子和终止子控制的变形链球菌GAPN编码序列,其中使用URA3作为选择性标记,并且如以下所述的进行构建。
来自变形链球菌的GAPN编码序列(SEQ ID NO:153,编码SEQ ID NO:154的GAPN)的密码子优化的版本是由GenScript(皮斯卡塔韦,新泽西州)合成,并且获得于载体pUC57中,该载体中具有添加的TAAA Kozak序列并且侧翼为5’XbaI和3’PacI位点。通过用XbaI和PacI消化将变形链球菌GAPN编码序列从pUC57质粒移除,并且在TAE缓冲液中的1.0%琼脂糖凝胶上进行分离,将大约1.4kbp片段(包含变形链球菌GAPN编码序列)从凝胶切除,并且使用凝胶提取试剂盒(凯杰(Qiagen))根据厂商说明书进行纯化。
将质粒pMBin204(US 2012/0135481)用XbaI和PacI进行消化,并且然后通过在TAE缓冲液中的琼脂糖凝胶电泳进行纯化。将大约8.4kbp的条带从凝胶切除,并且使用凝胶提取试剂盒(凯杰)根据厂商说明书进行纯化。使用T4连接酶(新英格兰生物实验室(New England Biolabs))将包含变形链球菌GAPN编码序列(见上文)的1.4kbp XbaI/PacI片段连接进8.4kbp pMBin204(见上文)线性化载体中,总反应体积为10μL,由1μL的8.4kbp载体、4μL的1.4kbp插入物、具有10mM ATP的1μL 10X连接缓冲液(新英格兰生物实验室)、3μlgdH2O和1μL T4连接酶(新英格兰生物实验室)组成。将反应22℃孵育18小时,并且根据厂商说明书将反应的4μL等分部分转化进One Shot TOP10细胞(英杰公司)中。在回收期之后,将来自转化反应的两个100μL等分部分铺在每ml补充有100μg氨比西林的150mm 2X YT平板上。将该板在37℃下孵育过夜。从选择板中选择推定的重组克隆并且使用9600(凯杰)从每种中制备DNA质粒。通过限制性酶切来分析克隆,并且将具有正确限制性酶切模式的质粒指定为pMBin222(图3)。质粒pMBin222包含受PDC启动子和终止子控制的变形链球菌GAPN编码序列,具有URA3选择性标记,该选择性标记侧翼为adh9091基因座的同源区。
将质粒pMcTs128产生为在scw11基因座处整合了受PDC启动子和终止子控制的恶臭假单胞菌mmsB编码序列,其中使用URA3作为选择性标记。将对于恶臭假单胞菌mmsB 3-HPDH的编码序列(编码SEQ ID NO:31的3-HPDH)针对东方伊萨酵母进行密码子优化,侧翼为5’XbaI位点和3’PacI限制性位点,并且由GeneArt(生命技术公司(Life Technologies Corporation),卡尔斯巴德(Carlsbad),加利福尼亚州)提供于质粒中,然后将该质粒用XbaI和PacI消化,并且将所得的898bp片段克隆进也用如上所述的XbaI和PacI进行消化的pMBin204的8.4kbp片段中(US 2012/0135481)。通过限制酶切消化和测序筛选若干重组克隆。将具有正确序列的一个克隆指定为pMcTs102(图4)。
将质粒pMcTs102(见上文)用NotI进行消化,并且将包含PDC启动子、mmsB 3-HPDH编码序列、PDC终止子以及URA3选择性标记的3.6kbp片段连接进pMcTs65(图6;还参见US 2012/0135481)的NotI位置中以产生pMcTs125(图5)。将质粒pMcTs125用NotI进行消化,并且将包含PDC启动子、mmsB、PDC终止子以及URA3选择性标记的3.6kbp片段连接进pACN62(US 2012/0135481)的NotI位点中以产生pCKle73(图7)。
质粒pSTK8(图8)包含允许基因在scw11基因座处整合的同源序列。将质粒pSTK8用NotI进行消化,以去除存在于scw11同源序列内部的URA3选择性标记以及PDC终止子。将质粒pCKle73(见上文)用NotI进行消化,并且将包含PDC启动子、mmsB、PDC终止子以及URA3选择性标记的3.6kbp片段连接进pSTK8(见上文)的NotI位点中以产生pMcTs128(图9)。
将质粒pMcTs128(见上文)用XbaI和PacI进行消化以去除mmsB基因,并且通过在TAE缓冲液中的1%琼脂糖凝胶电泳对该质粒进行分离。使用凝胶提取试剂盒(凯杰)根据厂商说明书将大约8kbp线性化片段从琼脂糖提取。
通过用XbaI和PacI降解将变形链球菌GAPN基因从pMBin222质粒移除,并且在TAE缓冲液中的1.0%琼脂糖凝胶上进行分离,将大约1.4kbp片段(包含变形链球菌GAPN基因)从凝胶切除,并且使用凝胶提取试剂盒(凯杰(Qiagen))根据厂商说明书进行纯化。使用T4连接酶(新英格兰生物实验室(New England Biolabs))将包含变形链球菌GAPN基因的1.4kbp XbaI/PacI消化的片段连接进8kbp pMcTs128(见上文)线性化载体的XbaI和PacI位点中,总反应体积为10μL,由2μL的8kbp载体、6μL的1.4kbp插入物、具有10mM ATP的1μL 10X连接缓冲液(新英格兰生物实验室)、以及1μl的T4连接酶(新英格兰生物实验室)组成。将反应16℃孵育18小时,并且根据厂商说明书将反应的4μL等分部分转化进One Shot TOP10细胞(英杰公司)中。将反应22℃孵育18小时,并且根据厂商说明书将反应的4μL等分部分转化进One Shot TOP10细胞(英杰公司)中。在回收期之后,将来自转化反应的两个100μL等分部分铺在每ml补充有50μg卡那霉素的150mm 2X YT平板上。将该板在37℃下孵育过夜。从选择板中选择推定的重组克隆并且使用9600(凯杰)从每种中制备DNA质粒。通过限制性酶切来分析克隆,并且将具有正确限制性酶切模式的质粒指定为pMBin227(图10)。
质粒pMBin227包含受PDC启动子和终止子控制的变形链球菌GAPN编码序列SEQ ID NO:153(编码SEQ ID NO:154的GAPN),具有URA3选择性标记,该选择性标记侧翼为scw11基因座的同源区。
pMBin240(德氏乳酸杆菌GAPN)&pMBin241(玉蜀黍GAPN)
将质粒pMBin240和pMBin241设计为允许在东方伊萨酵母scw11基因座处整合受PDC启动子和终止子控制的来自德氏乳酸杆菌或玉蜀黍的GAPN基因,其中使用URA3作为选择性标记,并且如以下所述的进行构建。
来自德氏乳酸杆菌(SEQ ID NO:193,编码SEQ ID NO:194的GAPN)和玉蜀黍(SEQ ID NO:191,编码SEQ ID NO:192的GAPN)的GAPN编码序列的密码子优化版本是由GeneArt(生命技术公司)合成。各自获得于载体pMK-RQ中,具有添加的TAAA kozak序列,并且侧翼为5’XbaI和3’PacI位点。通过用XbaI和PacI消化将德氏乳酸杆菌和玉蜀黍GAPN编码序列从pMK-RQ质粒移除,并且在TAE缓冲液中的1.0%琼脂糖凝胶上进行分离,将大约1.5kbp片段(包含德氏乳酸杆菌和玉蜀黍GAPN编码序列)从凝胶切除,并且使用凝胶提取试剂盒(凯杰(Qiagen))根据厂商说明书进行纯化。
将质粒pMBin227(见上文)用XbaI和PacI进行消化,并且然后通过在TAE缓冲液中的琼脂糖凝胶电泳进行纯化。将大约8.0kbp的条带从凝胶切除,并且使用凝胶提取试剂盒(凯杰)根据厂商说明书进行纯化。使用T4连接酶(新英格兰生物实验室(New England Biolabs))将包含德氏乳酸杆菌或玉蜀黍GAPN编码序列(见上文)的1.5kbp XbaI/PacI片段连接进8.0kbp pMBin227(见上文)线性化载体中,总反应体积为10μL,由1μL的8.0kbp载体、4μL的1.5kbp插入物、具有10mM ATP的1μL 10X连接缓冲液(新英格兰生物实验室)、3μl gdH2O和1μL T4连接酶(新英格兰生物实验室)组成。将反应22℃孵育18小时,并且根据厂商说明书将反应的4μL等分部分转化进One Shot TOP10细胞(英杰公司)中。在回收期之后,将来自转化反应的两个100μL等分部分铺在每ml补充有100μg氨比西林的150mm 2X YT平板上。将该板在37℃下孵育过夜。从选择板中选择推定的重组克隆并且使用9600(凯杰)从每种中制备DNA质粒。通过限制性酶切来分析克隆,并且将具有正确限制性酶切模式的质粒指定为pMBin240(图19)和pMBin241(图20)。
质粒pMBin240包含受PDC启动子和终止子控制的德氏乳酸杆菌GAPN编码序列SEQ ID NO:193(编码SEQ ID NO:194的GAPN),具有URA3选择性标记,该选择性标记侧翼为scw11基因座的同源区。质粒pMBin241包含受PDC启动子和终止子控制的玉蜀黍GAPN编码序列SEQ ID NO:191(编码SEQ ID NO:192的GAPN),具有URA3选择性标记,该选择性标记侧翼为scw11基因座的同源区。
实例4:包含主动3-HP途径并且在酵母scw11基因座处表达异源非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)的酵母菌株的构建
MBin558/559/560(变形链球菌GAPN)
将来自实例3的大约18μg的pMBin227用ApaI和SacI进行消化,并且然后使用TAE缓冲液在1%琼脂糖凝胶上进行分离。将大约5.6kbp的条带从凝胶切除,并且使用凝胶提取试剂盒(凯杰)根据厂商说明书进行纯化。如上所述,将大约900ng的pMBin227片段转化进东方伊萨酵母菌株MeJi465(见上文)中。将转化体铺板在ura选择性培养基上,并且在37℃进行孵育,重划线于ura选择性培养基上,并且在37℃孵育过夜。通过PCR针对在scw11处的整合对URA3+转化体进行检查。
使用Phire Plant Direct PCR试剂盒(Finnzymes)根据厂商说明书进行PCR。引物0611717和0615910被设计为通过凝胶电泳产生大约1.4kbp条带,而引物0612908和0615911被设计为产生大约1.9kbp的条带。将给出针对表达盒的合适的整合的预期条带的三种菌株指定为MBin558、MBin559和MBin560。这些菌株对于变形链球菌GAPN编码序列SEQ ID NO:153(编码SEQ ID NO:154的GAPN)来说在scw11基因座处是杂合的,其中所述编码序列的表达是由来自东方伊萨酵母的PDC启动子和终止子驱动的。
MBin596/597(德氏乳酸杆菌GAPN)&MBin598/599(玉蜀黍GAPN)
将来自实例3的各自大约10μg的pMBin240或pMBin241用ApaI和SacI进行消化,并且使用TAE缓冲液在1%琼脂糖凝胶上进行分离。将希望的大约5.7kbp的片段从凝胶切除,并且使用凝胶提取试剂盒(凯杰)根据厂商说明书进行纯化。将大约900ng的pMBin240或pMBin241片段(经ApaI和SacI消化)转化进如上所述的东方伊萨酵母CNB1MeJi465(见上文)中。将转化体铺板在ura选择性培养基上,并且在37℃孵育2天,重划线于ura选择性培养基上,并且在37℃孵育过夜。通过PCR针对在scw11处的整合对URA3+转化体进行检查。
使用Plant Direct PCR试剂盒(Finnzymes)根据厂商说明书进行PCR。引物0611717和0615910被设计为通过凝胶电泳产生大约1.4kbp条带,而引物0612908和0615911被设计为产生大约1.9kbp的条带。将给出针对德氏乳酸杆菌表达盒的合适的整合的预期条带的两种菌株指定为MBin596和MBin597。将给出针对玉蜀黍表达盒的合适的整合的预期条带的两种菌株指定为MBin598和MBin599。这些菌株对于德氏乳酸杆菌或玉蜀黍GAPN基因来说在scw11基因座处是杂合的,其中所述基因的表达是由来自东方伊萨酵母的PDC启动子和终止子驱动的。
实例5:表达NADP-依赖性甘油醛-3-磷酸脱氢酶(GAPN)基因的重组酵母菌株的酶活性
通过离心将重组酵母菌株MBin558(实例4)和MeJi461(实例2)各自进行收集,将上清液弃去,并且将细胞沉淀物储存在-20℃。在不同时间点16、30、和40小时对发酵罐进行取样,以针对酶活性进行测定。为了制备粗的无细胞的提取物(CFE),将细胞沉淀进行解冻并采用含1%蛋白酶抑制剂混合物(04693159001,罗氏化学)的1X PBS重悬浮至相当于OD600为25。将每一细胞悬浮液转移至具有2.4g的裂解基质(Lysing Matrix)Y(0.5mm氧化钇-稳定的锆球,MP生物医学(MP Biomedicals))的2.0mL微量离心管,并且在disruptor(MP生物医学)上在6.5/50秒的设定下进行3轮细胞裂解。在每轮之间将样品试管在冰上冷却3分钟。在裂解后,将样品在微量离心机中以最大速度在4℃离心10分钟。将上清液转移至新管中,并且保持在冰上或储存于-20℃以备将来使用。使用BCA蛋白测定试剂盒(二喹啉甲酸测定,皮尔斯生物技术(Pierce Biotechnology))并且以牛血清白蛋白作为标准品,根据厂商提供的说明书来确定裂解物中的总蛋白浓度。
如下来确定在此指示的细胞的CFE中NADP+依赖性甘油醛-3-磷酸脱氢酶(GAPN)活性:储存反应混合溶液被制备为当与CFE在测定反应混合物中组合时,提供以下:100mM Tris(pH 8.0);1.5mM NADP+;以及8mM甘油醛-3-磷酸。将190μL的该混合物添加至96-孔微量滴定板的孔中,并且添加10μL的适当稀释的CFE以开始反应。使用SpectraMax 340PC酶标仪在340nm对NADP+的还原进行监测。
在下表3中示出在不同时间点从酵母菌株MBin558和MeJi461 CFE测量的GAPN活性。菌株MBin558(包含主动3-HP途径和编码GAPN的异源多核苷酸)显示比对应菌株MeJi461(包含相同的主动3-HP途径,不含编码GAPN的异源多核苷酸)显著更多的GAPN活性。
表3.
来自采用酵母菌株MeJi461、MBin558、MBin597和MBin599进行的实验的另外的GAPN活性结果示出在图21中。表达变形链球菌GAPN(MBin558)、德氏乳酸杆菌GAPN(MBin597)或玉蜀黍GAPN(MBin599)的酵母菌株各个都示出比缺乏编码GAPN的异源多核苷酸的对应菌株(MeJi461)显著更多的GAPN活性。
实例6:表达NADP+依赖性甘油醛-3-磷酸脱氢酶(GAPN)基因的重组酵母菌株的3-HP产生
将重组酵母菌株MeJi461(实例2)和重组酵母菌株MBin558、MBin559、和MBin560(实例4)使用种子繁殖阶段进行培养,随后在3L生物反应器(欧谱(Applikon),福斯特市(Foster City),加利福尼亚州,美国)中进行单一阶段发酵。
对于种子阶段制备,将25mL的1X DM2培养基(用KOH调节至希望的pH)添加至125mL带挡板的烧瓶中,随后使用无菌环用感兴趣菌株进行接种。使培养物在250rpm摇动下在希望的温度下生长过夜持续大约16小时。然后将培养物的小等分部分以大约小时计的间隔进行抽取,以测量OD600直至达到OD600为4-6。
使用试纸(拜耳,埃尔克哈特,印第安纳州,美国)对存在的残留葡萄糖进行测量。然后将12mL的培养物添加至4mL的无菌冷却的75%甘油中,充分混合,并且孵育在冰上持续十分钟。然后将培养物和甘油混合物再混合,并且将1.0mL各自等分到10个1.8mL冷冻管(赛默飞世尔科技(Thermo Scientific),罗契斯特市(Rochester),纽约州,美国)中,并且储存于-80℃。
使用25mL的种子摇瓶培养物来接种包含1.5L DM2培养基的3L生物反应器。在生物反应器中的发酵是在大约30℃-40℃的温度下进行,其中pH被控制在大约2.0-7.0的范围内,并且在导致摄氧率(OUR)范围为2-45mmol/L/hr的搅拌和通气条件下。在此处呈现的实例中,在生物反应器中用于培养的温度、pH和OUR分别是30℃、4.0和10-25。
对于3-HP和β-丙氨酸的分析,将培养样品移除并且通过0.45μm96-孔滤板进行过滤,并且进一步于0.2%NH4OH中稀释10X。在水中的进一步稀释取决于样品中的分析物浓度。进一步的10X稀释是在样品缓冲液中进行,该样品缓冲液具有20%MeOH、1mM NH4Ac、0.1%NH4OH和15mg/L的13C均一标记的3-HP(作为针对3-HP的内标),或20%MeOH、1%甲酸以及3mg/L的13C均一标记的β-丙氨酸(作为针对β-丙氨酸的内标)。总稀释倍数是大约100至1000倍,这取决于β-丙氨酸或3-HP的浓度。
将2μL样品注射入由MassHunter程序控制的安捷伦1200HPLC(安捷伦)中,该HPLC采用安捷伦6410三重四极杆MS/MS检测器(Triple Quad MS/MS detector),使用表4中列出的仪器设置和柱子。使用定量离子片段峰面积与其稳定的同位素对应物(来自内标)的比率来定量,以消除离子抑制效应和仪器漂移。日测定与日测定之间的标准差是低于5%。
表4.
依据可商购试剂盒的方案:“液体葡萄糖氧化酶试剂盒”(“Liquid Glucose Oxidase Reagent Set”)(Pointe Scientific公司),来测量消耗的葡萄糖。
针对菌株MeJi461、MBin558、MBin559、和MBin560在不同时间点的所得发酵示出于图17(3-HP/DCW)和图18(消耗葡萄糖/DCW)中。表5和6中分别示出在41小时和46小时处3-HP发酵和葡萄糖消耗的具体结果。与对应菌株MeJi461(包含相同的主动3-HP途径,不含编码GAPN的异源多核苷酸)相比,菌株MBin558、MBin559、和MBin560(包含主动3-HP途径和编码GAPN的异源多核苷酸)在3-HP产生和葡萄糖消耗方面均显示出显著的改进。
表5.
表6.
下表7中示出了对于重组酵母菌株MeJi461、MBin558、MBin559、MBin560、MBin596、MBin597、MBin598、和MBin599在46小时后根据如上所述进行的发酵实验的另外对比。
表7.
与对应菌株MeJi461(包含相同的主动3-HP途径,不含编码GAPN的异源多核苷酸)相比,包含主动3-HP途径并且表达变异链球菌GAPN(MBin558/559/560)、德氏乳酸杆菌GAPN(MBin596/597)或玉蜀黍GAPN(MBin598/599)的酵母菌株在3-HP产生和葡萄糖消耗方面各自均示出显著的改进。
虽然出于清楚理解的目的,已经通过说明以及实例的方式相当详细描述了上文,本领域的普通技术人员将清楚的是,可以实施任何等效方面或修饰。因此,该说明和实例不应当解释为限制本发明的范围。
在一些方面中,本发明可以由以下已编号的段落描述:
[1]一种重组酵母细胞,该重组酵母细胞包括一种主动3-HP途径,其中该细胞包括一种异源多核苷酸,该异源多核苷酸编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN);并且其中该细胞能够产生3-HP。
[2]如段落[1]所述的重组酵母细胞,其中编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)的该异源多核苷酸包括一种对GAPN编码序列而言异源的启动子。
[3]如段落[1]或[2]所述的重组酵母细胞,其中当在相同条件下培养时,与不具有编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)的该异源多核苷酸的细胞相比,该细胞产生更大量的3-HP。
[4]如段落[3]所述的重组酵母细胞,其中当在相同条件下培养时,与不具有编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)的该异源多核苷酸的细胞相比,该重组酵母细胞能够产生多至少10%(例如,多至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少75%、至少100%或至少200%)的3-HP。
[5]如段落[1]-[4]中任一项所述的重组酵母细胞,其中该非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)与SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194的氨基酸序列具有至少50%,例如至少55%、60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%序列一致性。
[6]如段落[1]-[4]中任一项所述的重组酵母细胞,其中该非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:154、155、156、157、158、159、160、161、162、189、190、192或194或者由其组成。
[7]如段落[1]-[6]中任一项所述的重组酵母细胞,其中该细胞包括一种或多种选自以下各项的异源多核苷酸:
一种编码PPC的异源多核苷酸;
一种编码PYC的异源多核苷酸;
一种编码AAT的异源多核苷酸;
一种编码ADC的异源多核苷酸;
一种编码BAAT或gabT的异源多核苷酸;以及
一种编码3-HPDH的异源多核苷酸;
[8]如段落[7]所述的重组酵母细胞,其中该细胞包括一种编码PYC的异源多核苷酸。
[9]如段落[7]所述的重组酵母细胞,其中该PYC与SEQ ID NO:2、3、4、5、6、7或8的氨基酸序列具有至少60%,例如至少65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%序列一致性。
[10]如段落[7]所述的重组酵母细胞,其中该PYC具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:2、3、4、5、6、7或8或者由其组成。
[11]如段落[7]-[10]中任一项所述的重组酵母细胞,其中该细胞包括一种编码AAT的异源多核苷酸。
[12]如段落[11]所述的重组酵母细胞,其中该AAT与SEQ ID NO:14、15或16的氨基酸序列具有至少60%,例如至少65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%序列一致性。
[13]如段落[11]所述的重组酵母细胞,其中该AAT具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:14、15或16或由者其组成。
[14]如段落[7]-[13]中任一项所述的重组酵母细胞,其中该细胞包括一种编码ADC的异源多核苷酸。
[15]如段落[14]所述的重组酵母细胞,其中该ADC与SEQ ID NO:17、18、133、135、137或139的氨基酸序列具有至少60%,例如至少65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%序列一致性。
[16]如段落[14]所述的重组酵母细胞,其中该ADC具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:17、18、133、135、137或139或者由其组成。
[17]如段落[7]-[16]中任一项所述的重组酵母细胞,其中该细胞包括一种编码BAAT或gabT的异源多核苷酸。
[18]如段落[17]所述的重组酵母细胞,其中该BAAT或gabT与SEQ ID NO:20、21、22、23或24的氨基酸序列具有至少60%,例如至少65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%序列一致性。
[19]如段落[17]所述的重组酵母细胞,其中该BAAT或gabT具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:20、21、22、23或24或者由其组成。
[20]如段落[17]-[19]中任一项所述的重组酵母细胞,其中所述BAAT或gabT是一种还作为gabT的BAAT。
[21]如段落[7]-[20]中任一项所述的重组酵母细胞,其中该细胞包括一种编码3-HPDH(例如,利用NADPH的3-HPDH)的异源多核苷酸。
[22]如段落[21]所述的重组酵母细胞,其中该3-HPDH与SEQ ID NO:26、27、28、29、30、31、32、33、34或129的氨基酸序列具有至少60%,例如至少65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%序列一致性。
[23]如段落[21]所述的重组酵母细胞,其中该3-HPDH具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:26、27、28、29、30、31、32、33、34或129或由者其组成。
[24]如段落[21]-[23]中任一项所述的重组酵母细胞,其中该3-HPDH还是一种HIBADH。
[25]如段落[21]-[23]中任一项所述的重组酵母细胞,其中该3-HPDH还是一种4-羟基丁酸脱氢酶。
[26]如段落[7]-[25]中任一项所述的重组酵母细胞,其中该细胞包括一种编码PPC的异源多核苷酸。
[27]如段落[26]所述的重组酵母细胞,其中该PPC与SEQ ID NO:10、11或12的氨基酸序列具有至少60%,例如至少65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%序列一致性。
[28]如段落[26]所述的重组酵母细胞,其中该PPC具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:10、11或12或者由其组成。
[29]如段落[1]-[28]中任一项所述的重组酵母细胞,其中所述酵母细胞是克勒勃屈利阴性的。
[30]如权利要求[1]-[29]中任一项所述的重组酵母细胞,其中该酵母细胞属于选自以下各项的属:伊萨酵母属、假丝酵母属、克鲁维酵母属、毕赤酵母属、裂殖酵母属、有孢圆酵母属、接合酵母属以及酵母属。
[31]如段落[30]所述的重组酵母细胞,其中该酵母细胞属于选自以下各项的进化枝:东方伊萨酵母/发酵毕赤酵母进化枝和酵母属进化枝。
[32]如段落[30]所述的重组酵母细胞,其中该酵母细胞选自东方伊萨酵母、郎比可假丝酵母和布拉迪酵母。
[33]如段落[32]所述的重组酵母细胞,其中该酵母细胞是东方伊萨酵母细胞。
[34]如段落[33]所述的重组酵母细胞,其中该酵母细胞是东方伊萨酵母CNB1酵母细胞。
[35]如段落[1]-[34]中任一项所述的重组酵母细胞,其中该酵母细胞不能发酵戊糖。
[36]如段落[1]-[35]中任一项所述的重组酵母细胞,其中所述细胞进一步包括对一个或多个内源基因的破坏,这一个或多个内源基因编码PDC、ADH、GAL6、CYB2A、CYB2B、GPD、GPP、ALD或PCK。
[37]如段落[36]所述的重组酵母细胞,其中所述细胞进一步包括对一个编码PDC的内源基因的破坏。
[38]如段落[37]所述的重组酵母细胞,其中该细胞包括对一个编码PDC的内源基因的破坏,该PDC与SEQ ID NO:186具有至少75%,例如至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%序列一致性。
[39]如段落[37]所述的重组酵母细胞,其中该细胞包括对一个编码PDC的内源基因的破坏,该PDC具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:186或由其组成。
[40]如段落[36]-[39]中任一项所述的重组酵母细胞,其中编码PDC的该基因的编码序列与SEQ ID NO:185具有至少75%,例如至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%序列一致性。
[41]如段落[36]-[39]中任一项所述的重组酵母细胞,其中编码PDC的该内源基因的编码序列包括SEQ ID NO:185或由其组成。
[42]如段落[37]-[41]中任一项所述的重组酵母细胞,其中对编码PDC的该内源基因的破坏发生在编码PDC的该基因的编码序列中。
[43]如段落[37]-[41]中任一项所述的重组酵母细胞,其中对编码PDC的该内源基因的破坏发生在编码PDC的该基因的启动子序列中。
[44]如段落[37]-[43]中任一项所述的重组酵母细胞,其中当在相同条件下培养时,与没有该破坏的细胞相比,该细胞产生少至少25%(例如,少至少50%、少至少60%、少至少70%、少至少80%或少至少90%)的PDC。
[45]如段落[37]-[44]中任一项所述的重组酵母细胞,其中将编码PDC的该内源基因失活。
[46]如段落[37]-[45]中任一项所述的重组酵母细胞,其中当在相同条件下培养时,与没有对编码PDC的该内源基因破坏的细胞相比,该细胞产生减少量的乙醇(例如,少至少25%、少至少50%、少至少60%、少至少70%、少至少80%或少至少90%)。
[47]如段落[37]-[46]中任一项所述的重组酵母细胞,其中当在相同条件下培养时,与没有对编码PDC的该内源基因破坏的细胞相比,该细胞产生更大量的3-HP。
[48]如段落[37]-[47]中任一项所述的重组酵母细胞,其中当在相同条件下培养时,与没有对编码PDC的该内源基因破坏的细胞相比,该重组酵母细胞能够产生多至少10%(例如,多至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少75%、至少100%或至少200%)的3-HP。
[49]如段落[37]-[48]中任一项所述的重组酵母细胞,其中所述细胞进一步包括对一个编码GPD的内源基因的破坏。
[50]如段落[49]所述的重组酵母细胞,其中该细胞包括对一个编码GPD的内源基因的破坏,该GPD与SEQ ID NO:188具有至少75%,例如至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%序列一致性。
[51]如段落[49]所述的重组酵母细胞,其中该细胞包括对一个编码GPD的内源基因的破坏,该GPD具有一种氨基酸序列,该氨基酸序列包括SEQ ID NO:188或由其组成。
[52]如段落[49]-[51]中任一项所述的重组酵母细胞,其中编码GPD的该基因的编码序列与SEQ ID NO:187具有至少75%,例如至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%序列一致性。
[53]如段落[49]-[51]中任一项所述的重组酵母细胞,其中编码GPD的该内源基因的编码序列包括SEQ ID NO:187或由其组成。
[54]如段落[49]-[53]中任一项所述的重组酵母细胞,其中对编码GPD的该内源基因的破坏发生在编码GPD的该基因的编码序列中。
[55]如段落[49]-[53]中任一项所述的重组酵母细胞,其中对编码GPD的该内源基因的破坏发生在编码GPD的该基因的启动子序列中。
[56]如段落[49]-[55]中任一项所述的重组酵母细胞,其中当在相同条件下培养时,与没有该破坏的细胞相比,该细胞产生少至少25%(例如,少至少50%、少至少60%、少至少70%、少至少80%或少至少90%)的GPD。
[57]如段落[49]-[56]中任一项所述的重组酵母细胞,其中将编码GPD的该内源基因失活。
[58]如段落[49]-[57]中任一项所述的重组酵母细胞,其中当在相同条件下培养时,与没有对编码GPD的该内源基因破坏的细胞相比,该细胞产生减少量的甘油(例如,少至少25%、少至少50%、少至少60%、少至少70%、少至少80%或少至少90%)。
[59]如段落[49]-[58]中任一项所述的重组酵母细胞,其中当在相同条件下培养时,与没有对编码PDC的该内源基因的破坏的细胞相比,该细胞产生更大量的3-HP。
[60]如段落[49]-[59]所述的重组酵母细胞,其中当在相同条件下培养时,与没有对编码PDC的该内源基因破坏的细胞相比,该重组酵母细胞能够产生多至少10%(例如,多至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少75%、至少100%或至少200%)的3-HP。
[61]如段落[1]-[60]中任一项所述的重组酵母细胞,其中该细胞能够在包含75g/L或更多3-HP的培养基中在低于4的pH下生长。
[62]如段落[1]-[61]中任一项所述的重组酵母细胞,其中该细胞是一种3-HP耐受的酵母细胞。
[63]如段落[1]-[62]中任一项所述的重组酵母细胞,其中该细胞已经经历突变和/或选择,这样使得与同一物种的野生型细胞相比,该突变的和/或选择的细胞对3-HP具有更高程度的耐受性。
[64]如段落[63]所述的重组酵母细胞,其中在用编码非磷酸化NADP依赖性甘油醛-3-磷酸脱氢酶(GAPN)的该异源多核苷酸进行遗传修饰之前,该细胞已经经历突变和/或选择。
[65]如段落[63]或[64]所述的重组酵母细胞,其中该细胞已经在乳酸或3-HP的存在下经历选择。
[66]如段落[65]所述的重组酵母细胞,其中该选择是恒化器选择。
[67]一种组合物,包括如段落[1]-[66]中任一项所述的重组宿主细胞。
[68]如段落[67]所述的组合物,其中该组合物包括一种可发酵的培养基。
[69]如段落[68]所述的组合物,其中该可发酵的培养基包括蔗糖、葡萄糖和/或果糖。
[70]如段落[67]-[69]中任一项所述的组合物,其中该可发酵的培养基包括少于1%的戊糖。
[71]如段落[67]-[70]中任一项所述的组合物,进一步包括3-HP。
[72]如段落[71]所述的组合物,其中该3-HP的滴度大于约1g/L,例如大于约2g/L、5g/L、10g/L、15g/L、20g/L、25g/L、30g/L、35g/L、40g/L、45g/L、50g/L、55g/L、60g/L、65g/L、70g/L、75g/L、80g/L、85g/L、90g/L、95g/L、100g/L、125g/L、150g/L、200g/L或250g/L。
[73]如段落[68]-[72]中任一项所述的组合物,其中该培养基的pH低于5,例如在约1.5至约4.5、约2.0至约4.0或约2.0至约3.5的范围内。
[74]一种生产3-HP的方法,包括:
(a)在适合生产3-HP的条件下,在可发酵的培养基中培养如段落[1]-[66]中任一项所述的重组酵母细胞;并且
(b)回收该3-HP。
[75]如段落[74]所述的方法,其中该可发酵的培养基包括蔗糖、葡萄糖和/或果糖。
[76]如段落[74]或[75]所述的方法,其中该可发酵的培养基包括少于1%的戊糖。
[77]如段落[74]-[76]中任一项所述的方法,其中产生的3-HP的滴度大于约1g/L,例如大于约2g/L、5g/L、10g/L、15g/L、20g/L、25g/L、30g/L、35g/L、40g/L、45g/L、50g/L、55g/L、60g/L、65g/L、70g/L、75g/L、80g/L、85g/L、90g/L、95g/L、100g/L、125g/L、150g/L、200g/L或250g/L。
[78]如段落[74]-[77]中任一项所述的方法,其中所得3-HP是基本上纯的。
[79]如段落[77]-[78]中任一项所述的方法,其中该可发酵的培养基的pH低于5,例如在约1.5至约4.5、约2.0至约4.0或约2.0至约3.5的范围内。
[80]一种生产丙烯酸或其盐的方法,包括:
(a)在适合生产3-HP的条件下,在可发酵的培养基中培养如段落[1]-[66]中任一项所述的重组酵母细胞;
(b)回收该3-HP;
(c)在适合生产丙烯酸或其盐的条件下,将该3-HP脱水;并且
(d)回收该丙烯酸或其盐。
[81]如段落[74]-[80]中任一项所述的方法,其中该重组酵母细胞是一种东方伊萨酵母CNB1酵母细胞,该东方伊萨酵母CNB1酵母细胞被培养在包括少于1%戊糖的可发酵的培养基中。
- 还没有人留言评论。精彩留言会获得点赞!