抗H7CR抗体的制作方法
本申请是一个PCT申请,其要求2012年12月21日提交的美国临时专利申请号 61/745,296、2012年12月21日提交的美国临时专利申请号61/745,312、2013年5月 24日提交的美国临时专利申请号61/827,269、以及2013年5月24日提交的美国临时 专利申请号61/827,279的权益和优先权,在允许的情况下,将所有这些文件通过引用 以其全文结合。
关于联邦资助的研究或开发的声明:
部分地,本发明是在美国政府支持下在美国国立卫生研究院(NIH)的授予号 R01 CA097085-10和ROl A172592以及美国国家癌症研究所(NCI)的授予号U19 CA113341下进行的。美国政府在本发明中可以具有某些权力。
序列表的引用
本申请包括一个或多个序列表(依照37 C.F.R.1.821等等),其是以纸版和计算 机可读介质两者披露的,并且将其纸版和计算机可读披露通过引用以其整体结合在 此。
技术领域
本发明涉及能够免疫特异性地结合到B7-H7反受体即H7CR的抗体及其抗原结合 片段、以及其他分子,以及它们在治疗和诊断癌症和其他疾病中的用途。
背景技术:
人及其他哺乳动物的免疫系统负责针对感染以及疾病提供保护。此类保护是通过 体液免疫应答以及细胞介导的免疫应答两者提供的。该体液应答导致能够识别并中和 外来靶标(抗原)的抗体以及其他生物分子的产生。相比之下,该细胞介导的免疫应 答涉及通过T细胞来活化巨噬细胞、自然杀伤细胞(NK)、以及抗原特异性的细胞 毒性T-淋巴细胞,并且涉及响应于对一种抗原的识别而释放不同细胞因子(董 (Dong),C.等人(2003)“新颖的共刺激分子的免疫调节(Immune Regulation by Novel Costimulatory Molecules)”,免疫学研究(Immunolog.Res.)28(1):39- 48)。
T细胞最佳地介导针对一种抗原的免疫应答的能力需要两种不同的信号传导交互 (维列塔(Viglietta),V.等人(2007)“调节共刺激(Modulating Co- Stimulation)”,神经治疗学(Neurotherapeutics)4:666-675;科曼(Korman),A.J. 等人(2007)“癌症免疫治疗中的检查点阻滞(Checkpoint Blockade in Cancer Immunotherapy)”,免疫学进展(Adv.Immunol.)90:297-339)。第一,已展示在抗 原呈递细胞(APC)的表面上的抗原必须被呈递到一种抗原特异性的原初CD4+T细 胞。这种呈递通过T细胞受体(TCR)递送一个信号,该信号指导T细胞起始一个免 疫应答,该免疫应答对所呈递的抗原将是特异性的。第二,通过APC与不同的T细 胞表面分子之间的相互作用介导的一系列共刺激性以及抑制性信号首先触发T细胞的 活化以及增殖并且最终触发它们的抑制。因此,该第一信号对该免疫应答赋予特异 性;而该第二信号用以确定该应答的性质、量级以及持续时间。
免疫系统受共刺激性以及共抑制性配体和受体的紧密控制。这些分子针对T细胞 活化提供第二信号,并且提供正信号和负信号的平衡网络以使得针对感染的免疫应答 最大化同时限制对自身的免疫性(王(Wang),L.等人(3月7日,2011)“VISTA, 一种新颖的负向调节T细胞应答的小鼠Ig超家族配体(VISTA,A Novel Mouse Ig Superfamily Ligand That Negatively Regulates T Cell Responses)”,实验医学杂志(J. Exp.Med.)10.1084/jem.20100619:1-16;勒佩尼斯(Lepenies),B.等人(2008)“在 寄生虫感染过程中的负向共刺激分子的作用(The Role Of Negative Costimulators During Parasitic Infections)”,内分泌、代谢&免疫紊乱-药物靶标(Endocrine, Metabolic&Immune Disorders-Drug Targets)8:279-288)。特别重要的是该抗原递 呈细胞的B7.1(CD80)和B7.2(CD86)配体与CD4+T-淋巴细胞的CD28以及 CLTA-4受体之间的结合(夏普(Sharpe),A.H.等人(2002)“B7-CD28超家族 (The B7-CD28 Superfamily)”,自然综述免疫学(Nature Rev.Immunol.)2:116- 126;董(Dong),C.等人(2003)“新颖的共刺激分子的免疫调节(Immune Regulation by Novel Costimulatory Molecules)”,免疫学研究(Immunolog.Res.)28 (1):39-48;林德利(Lindley),P.S.等人(2009)“抑制CD28介导的共刺激的临 床应用(The Clinical Utility Of Inhibiting CD28-Mediated Costimulation)”,免疫学综述 (Immunol.Rev.)229:307-321)。B7.1或B7.2与CD28的结合刺激T细胞活化; B7.1或B7.2与CTLA4的结合抑制这种活化(董(Dong),C.等人(2003)“新颖的 共刺激分子的免疫调节(Immune Regulation by Novel Costimulatory Molecules)”,免 疫学研究(Immunolog.Res.)28(1):39-48;林德利(Lindley),P.S.等人 (2009)“抑制CD28介导的共刺激的临床应用(The Clinical Utility Of Inhibiting CD28-Mediated Costimulation)”,免疫学综述(Immunol.Rev.)229:307-321;格林 沃尔德(Greenwald),R.J.等人(2005)“B7家族再论(The B7 Family Revisited)”, 免疫学年报综述(Ann.Rev.Immunol.)23:515-548)。CD28组成性地表达于T细胞 的表面上(格罗斯(Gross),J.,等人(1992)“在小鼠中的共刺激分子受体CD28的 鉴定与分布(Identification And Distribution Of The Costimulatory Receptor CD28 In The Mouse)”,免疫学杂志(J.Immunol.)149:380–388),而在T-细胞活化之后 CTLA4表达被快速上调(林斯利(Linsley),P.等人(1996)“CTLA4细胞内运输和 对TCR接合位点的焦点定位(Intracellular Trafficking Of CTLA4 And Focal Localization Towards Sites Of TCR Engagement)”,免疫(Immunity)4:535–543)。由于CTLA4 是更高亲和力受体(夏普(Sharpe),A.H.等人(2002)“B7-CD28超家族(The B7- CD28 Superfamily)”,自然综述免疫学(Nature Rev.Immunol.)2:116-126),结合 首先启动T细胞增殖(通过CD28)并且然后抑制它(通过CTLA4的初期表达),从 而当不再需要增殖时削弱影响。
对CD28受体的配体的进一步研究已导致了对一组相关的B7分子(“B7超家 族”)的鉴定和表征(科伊尔(Coyle),A.J.等人(2001)“扩大的B7超家族:调节 T细胞功能的共刺激信号的复杂性日益增加(The Expanding B7 Superfamily: Increasing Complexity In Costimulatory Signals Regulating T Cell Function)”,自然免疫 学(Nature Immunol.)2(3):203-209;(夏普(Sharpe),A.H.等人(2002)“B7- CD28超家族(The B7-CD28 Superfamily)”,自然综述免疫学(Nature Rev. Immunol.)2:116-126;格林沃尔德(Greenwald),R.J.等人(2005)“B7家族再论 (The B7 Family Revisited)”,免疫学年报综述(Ann.Rev.Immunol.)23:515-548; 柯林斯(Collins),M.等人(2005)“免疫调控配体的B7家族(The B7 Family Of Immune-Regulatory Ligands)”,基因组生物学(Genome Biol.)6:223.1-223.7;洛克 (Loke),P.等人(2004)“免疫调节的新兴机制:扩大的B7家族与调控T细胞 (Emerging Mechanisms Of Immune Regulation:The Extended B7 Family And Regulatory T Cells)”关节炎研究与治疗(Arthritis Res.Ther.)6:208-214;科曼 (Korman),A.J.等人(2007)“癌症免疫治疗中的检查点阻滞(Checkpoint Blockade in Cancer Immunotherapy)”,免疫学进展(Adv.Immunol.)90:297-339;弗莱斯 (Flies),D.B.等人(2007)“新B7:在肿瘤免疫中发挥着关键作用(The New B7s: Playing a Pivotal Role in Tumor Immunity)”,免疫疗法杂志(J.Immunother.)30 (3):251-260;阿加瓦尔(Agarwal),A.等人(2008)“在移植与耐受中的正向共 刺激分子的作用(The Role Of Positive Costimulatory Molecules In Transplantation And Tolerance)”,器官移植的当前观点(Curr.Opin.Organ Transplant.)13:366-372;兰 肖考(Lenschow),D.J.等人(1996)“T细胞共刺激的CD28/B7系统(CD28/B7 System of T Cell Costimulation)”,免疫学年报综述(Ann.Rev.Immunol.)14:233- 258;王(Wang),S.等人(2004)“B7-CD28家族在T淋巴细胞应答的正向和负向调 节中的共-信号传导分子(Co-Signaling Molecules Of The B7-CD28 Family In Positive And Negative Regulation Of T Lymphocyte Responses)”,微生物与感染(Microbes Infect.)6:759-766)。当前存在八种已知的该家族成员:B7.1(CD80)、B7.2 (CD86)、可诱导的共刺激分子配体(ICOS-L)、程序性死亡-1配体(PD-L1;B7- H1)、程序性死亡-2配体(PD-L2;B7-DC)、B7-H3、B7-H4(也称为B7x以及 B7S1;西卡(Sica),G.L.等人(2003)“B7-H4,B7家族的一种分子,负向调节T 细胞免疫(B7-H4,A Molecule Of The B7 Family,Negatively Regulates T Cell Immunity)”,免疫(Immunity)18:849-861;臧(Zang),X.等人(2003)B7x: 一个广泛表达的抑制T细胞的活化的B7家族成员(B7x:A Widely Expressed B7 Family Member That Inhibits T Cell Activation)”,美国国家科学院院刊(Proc.Natl. Acad.Sci.(USA))100:10388-10392;普拉萨德(Prasad),D.V.等人(2003) B7S1,一种新颖的负向调节T细胞活化的B7家族成员(B7S1,A Novel B7 Family Member That Negatively Regulates T Cell Activation)”,免疫(Immunity)18:863- 873),B7-H6(柯林斯(Collins),M.等人(2005)“免疫调控配体的B7家族(The B7 Family Of Immune-Regulatory Ligands)”,基因组生物学(Genome Biol.)6: 223.1-223.7)以及B7-H7(弗莱吉尼克(Flajnik),M.F.等人(2012)“B7家族的演 化:B7H6以及Nkp30的共同演化,一种新的B7家族成员即B7H7的鉴定,以及B7 与MHC的历史关系的鉴定(Evolution Of The B7 Family:Co-Evolution Of B7H6 And Nkp30,Identification Of A New B7 Family Member,B7H7,And Of B7’s Historical Relationship With The MHC)”,免疫遗传学(Immunogenetics)64:571–590)。B7 基因家族在适应性免疫系统的调节中是至关重要的。大部分B7家族成员包含免疫球 蛋白超家族(IgSF)的可变(V)类型域以及恒定(C)类型域两者。
B7配体在许多不同的细胞类型(包括抗原递呈细胞(APC))的细胞表面上表 达,并且它们与T细胞上的受体分子的相互作用提供活化和/或抑制性信号,这些活 化和/或抑制性信号调节T细胞活化以及耐受性(柯林斯(Collins),M.等人 (2005)“免疫调控配体的B7家族(The B7 Family Of Immune-Regulatory Ligands)”,基因组生物学(Genome Biol.)6:223.1-223.7)。一些抑制性B7配体也 在肿瘤细胞上表达,导致免疫应答的抑制(凯依尔(Keir),M.E.等人(2008)“PD-1 及其配体的耐受性以及免疫性(PD-1 And Its Ligands In Tolerance And Immunity)”, 免疫学年报综述(Annu.Rev.Immunol.)26:677-704;邹(Zou),W.等人(2008) “在肿瘤微环境中的抑制性B7家族分子(Inhibitory B7-Family Molecules In The Tumour Microenvironment)”,自然综述免疫学(Nat.Rev.Immunol.)8:467-477)。因此, 刺激或衰减B7配体及其受体的相互作用保持了针对自身免疫病以及癌的治疗潜力 (WO 2011/020024;弗莱吉尼克(Flajnik),M.F.等人(2012)“B7家族的演化: B7H6以及Nkp30的共同演化,一种新的B7家族成员即B7H7的鉴定,以及B7与 MHC的历史关系的鉴定(Evolution Of The B7 Family:Co-Evolution Of B7H6 And Nkp30,Identification Of A New B7 Family Member,B7H7,And Of B7’s Historical Relationship With The MHC)”,免疫遗传学(Immunogenetics)64:571–590)。
尽管在炎症和癌的治疗上有所有的在先进展,对能够针对此类病况提供增强的免 疫治疗的组合物仍存在需要。
本发明一个目的是提供能够针对治疗癌、感染性疾病、炎症和其他疾病以及病况 提供增强的免疫治疗的组合物。
技术实现要素:
提供了能够免疫特异性地结合到B7-H7反受体即H7CR的抗体及其抗原结合片段 以及其他分子。该B7-H7反受体还称为B7-H7CR以及CD28H(玉(Yhu)等人,自 然通讯(Nature Communications),4:1-12(2013))。还提供了在治疗和诊断癌 症、感染性疾病、炎症和其他疾病以及病况中使用它们的方法。该H7CR结合分子可 以是单克隆抗体、人抗体、嵌合抗体或人源化抗体。
一个实施例提供了H7CR结合分子,其中该抗原结合片段包括六个CDR,其中这 些CDR包括抗H7CR抗体1.3、4.5以及7.8的CDR中的至少一个CDR,或它们的一 个共有CDR,其中剩下的所有CDR选自:
(A)抗H7CR抗体1.3的三个轻链以及三个重链CDR;
(B)抗H7CR抗体4.5的三个轻链以及三个重链CDR;或
(C)抗H7CR抗体7.8的三个轻链以及三个重链CDR。
另一个实施例提供了H7CR结合分子,其中这六个CDR是:
(A)抗H7CR抗体1.3的三个轻链以及三个重链CDR;
(B)抗H7CR抗体4.5的三个轻链以及三个重链CDR;或
(C)抗H7CR抗体7.8的三个轻链以及三个重链CDR。
再另一个实施例提供了H7CR结合分子,这些H7CR结合分子具有抗人H7CR抗 体1.3或4.5的一种人源化变体的一个抗原结合片段,其中该分子免疫特异性地结合 到人H7CR,并且其中该抗原结合片段包括:
(A)(1)抗人H7CR抗体1.3的一种人源化变体的一个轻链可变区,其中所述 轻链可变区具有SEQ ID NO:17-22中任一个的氨基酸序列;以及
(2)抗人H7CR抗体1.3的一种人源化变体的一个重链可变区,其中所述 重链可变区具有SEQ ID NO:23-28中任一个的氨基酸序列;
或
(B)(1)抗人H7CR抗体4.5的一种人源化变体的一个轻链可变区,其中所述 轻链可变区具有SEQ ID NO:33-38中任一个的氨基酸序列;以及
(2)抗人H7CR抗体4.5的一种人源化变体的一个重链可变区,其中所述 重链可变区具有SEQ ID NO:39-44中任一个的氨基酸序列。
一个优选实施例涉及如下实施例,其中所述H7CR结合分子免疫特异性地结合到 H7CR,该H7CR:
(A)排列于一个活细胞的表面;或
(B)以内源浓度表达。
在一个实施例中,该活细胞是T细胞、NK细胞、或浆细胞样树突细胞。
在再另一个实施例中,该分子基本上不能够阻滞H7CR与B7-H7的相互作用。
在另一个实施例中,该分子能够结合H7CR并且激动H7CR活性。
这些抗体中任一个可以是双特异性的、三特异性的或多特异性的抗体。该分子可 以是可检测地标记的,或包括一种轭合的毒素、药物、受体、酶、受体配体、或其组 合。
另一个实施例提供了一种药物组合物,该药物组合物包含治疗有效量的以上提及 的分子中的任一种,以及一种生理学上可接受的载体或赋形剂。
所披露的组合物可以用于通过以下方式治疗受试者中的疾病(该受试者展现该疾 病的一个症状):将治疗有效量的以上提及的药物组合物中的任一种给予受试者以激 活B7-H7通路并且刺激免疫应答。待治疗的特异性适应症包括但不限于癌症、感染性 疾病、慢性病毒性疾病、炎症性病况、或自身免疫病。
还提供了一种用于治疗疾病的方法,其中该药物组合物激动H7CR功能。
预防地治疗一种疾病的方法包括在受试者展现该疾病的一个症状之前向其给予预 防有效量的以上提及的药物组合物中的任一种。
用于在受试者中诊断一种疾病(尤其是癌症或影响T细胞数目以及健康的一种疾 病)的方法包括针对结合到以上提及的H7CR结合分子中的任一个的能力来测定该受 试者的细胞,其中该方法提供了用于诊断该受试者中的免疫应答或该疾病的存在的细 胞学测定。
附图说明
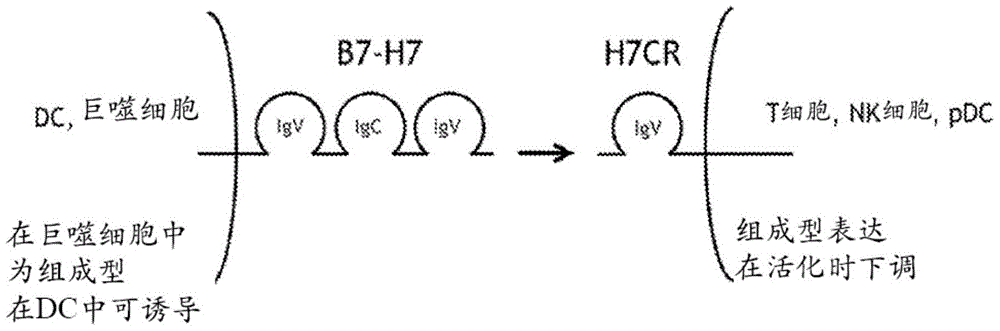
图1是单独的细胞上H7CR和B7-H7的结构、表达模式以及它们之间的相互作用 的图表。
图2是中位荧光强度对log[Ab](nM)的线形图,显示抗H7CR抗体1.3(Kd= 5.9nM)以及4.5(Kd=3.5nM)各自与H7CR CHO转染子的结合亲和力。
图3A以及3B是中位荧光强度对log[Ab](nM)的线形图,显示H7CR mAb结 合至来自PBMC的人原初(CD45RA+)CD4以及CD8T细胞的曲线(图3B)。
图4(A)-4(C)是流式细胞术数据的直方图,显示抗体1.3、4.5以及7.8结合 到表达于CHO转染子的表面上的人H7CR的能力。该数据表示为细胞计数对Comp PE-A的log荧光。每个图中的左峰表示同种型对照抗体;右峰代表H7CR抗体。
图5A-5D是流式细胞术数据的直方图,显示B7-H7Ig融合蛋白结合到H7CR CHO转染子。该数据表示为细胞计数对Comp APC-A的log荧光。发现用H7CR转染 子预孵育抗体1.3(图5B)、4.5(图5C)以及7.8(图5D)各自基本上不能够阻滞 H7CR与B7-H7的相互作用。
图6是显示抗人H7CR抗体(H7CR 4.5)结合到如内源地表达于人扁桃体组织的 表面上的H7CR的能力的显微照片。
图7(图A-C)是流式细胞术数据的散点图,显示H7CR表达与T和NK细胞中 的原初T细胞表型关联。图A显示来自四个供体的散点图,显示在CD3+T细胞上的 H7CR的表达(相对于它们的CD45RO的表达)。这些散点图是抗H7-CR抗体的荧光 对来自抗CD45RO的荧光。图B是显示T细胞和NK细胞基于CD3和CD16标记物的 表达的门控的散点图。该散点图是抗CD3抗体的荧光对来自抗CD16抗体的荧光。图 C显示来自四个供体的散点图,显示在CD16+NK细胞上的H7CR的表达(相对于它 们的CD45RO的表达)。这些散点图是抗H7-CR的荧光对来自抗CD45RO的荧光。
图8A-8H是四个健康PMBC供体(供体1,图8A以及8B;供体2,图8C以及 8D;供体3(图8E以及图8F)以及供体4(图8G以及图8H))的H7CR和B7-H7 的表达谱的流式细胞术散点图。图8A、8C、8E、以及8G是使用抗体1.3的log荧光 对使用抗CD3抗体的log荧光的散点图。图8B、8D、8F、以及8H是使用抗B7H7抗 体2D3对使用抗CD14抗体的log荧光的散点图。所有供体显示H7CR在CD3T细胞 上表达而在PBMC中B7-H7最低表达。
图9A-9H是显示四个健康PMBC供体(供体1,图9A以及9B;供体2,图9C 以及9D;供体3,图9E以及9F;以及供体4,图9G以及9H)的H7CR和B7-H7 的表达谱的流式细胞术散点图。图9A、9C、9E、以及9G是使用抗体1.3对使用抗 CD3抗体的荧光的散点图。图9B、9D、9F、以及9H是使用抗B7H7抗体2D3对使 用抗CD14抗体的荧光的散点图。供体2、3、4显示H7CR在CD3T细胞上表达而在 PBMC中B7-H7最低表达。供体1显示B7-H7在CD14+单核细胞上的高表达水平以 及在CD3T细胞上的低H7CR表达水平。
图10A-10D是显示由人单核细胞(10A、10F、10K、10P、10U、以及10Z)、 CD8+CD3+淋巴细胞(10B、10G、10L、10Q、10V、10AA)、CD8–CD3+淋巴细胞 (10C、10H、10M、10R、10W、以及10AB)、CD16+NK细胞(10D、10I、10N、 10S、10X、以及10AC)、以及CD3–CD8–细胞(10E、10J、10O、10T、10Y、以及 10AD)表达的H7CR和B7-H7的流式细胞术直方图。抗体18C3(10A-10E)以及 2D3(10F-10J)是抗B7-H7单克隆抗体。图10K-10O使用抗PD-1抗体。图10P-T使 用抗体1.3。图10U-Y使用抗体4.5。图10Z-AD使用抗体7.8。
图11A-11D是显示由食蟹猴单核细胞(11A、11F、11K、11P、11U、以及 11Z)、CD8+CD3+淋巴细胞(11B、11G、11L、11Q、11V、11AA)、CD8–CD3+ 淋巴细胞(11C、11H、11M、11R、11W、以及11AB)、CD16+NK细胞(11D、 11I、11N、11S、11X、以及11AC)以及CD3–CD8–细胞(11E、11J、11O、11T、 11Y、以及11AD)表达的H7CR和B7-H7的流式细胞术直方图。抗体18C3(图10A- 10E)以及2D3(图10F-10J)是抗B7-H7单克隆抗体。图10K-10O使用抗PD-1抗 体。图10P-T使用抗体1.3。图10U-Y使用抗体4.5。图10Z-AD使用抗体7.8。
图12A-12K是成熟单核细胞衍生的树突细胞表达B7-H7以及其他活化标记物的 体外分析的流式细胞术直方图。图12A是使用抗HLA-ABC抗体时计数对log Comp- FITC-A的直方图。图12B是使用抗B7-H1抗体时计数对log Comp-PE-A的直方图。 图12C是使用抗HLA-DR抗体时计数对log Comp-PerCP-Cy5-5-A的直方图。图12D 是使用抗CD40抗体时计数对log Comp-PE-Cy7-A的直方图。图12E是使用抗CD86 抗体时计数对log Comp-APC-A的直方图。图12F是使用抗CD83抗体时计数对log Comp-太平洋蓝(PacificBlue)-A的直方图。图12G是使用抗CD80抗体时计数对log Comp-FITC-A的直方图。图12H是使用抗B7-DC抗体时计数对log Comp-PE-A的直 方图。图12I是使用抗CD54抗体时计数对log Comp-太平洋蓝-A的直方图。图12J是 使用抗B7-H7抗体时计数对log Comp-PerCP-Cy5-5A的直方图。图12K是使用抗 CCR7抗体时计数对log Comp-APC-A的直方图。灰色实线代表同种型对照。短划线 代表不成熟的树突细胞。点线代表用TNFα以及PGE2处理一天的细胞。黑色实线代 表用1ng/ml TNFa以及1μg/ml PGE2处理两天的细胞。
图13是针对Ctl Ig(■)、H7CR1.3(●)、H7CR4.5(▲)、H7CR7.8(◆)以及 仅T细胞(—),分裂的细胞(CFSE低)的百分数对天数的线形图,并且显示抗 H7CR抗体促进模式抗原即破伤风类毒素特异性的T细胞应答。
图14A-14L条形图,显示了由经受破伤风类毒素蛋白刺激以及H7CR抗体或对照 抗体处理的细胞表达的细胞因子的性质和水平。图14A是用CtlIg、H7CR1.3, H7CR4.5、H7CR7.8或仅T细胞处理的IFN-γ(pg/nl)细胞的条形图。图14B是用 CtlIg、H7CR1.3,H7CR4.5、H7CR7.8或仅T细胞处理的IL-5(pg/nl)细胞的条形 图。图14D是用CtlIg、H7CR1.3,H7CR4.5、H7CR7.8或仅T细胞处理的IL-13 (pg/nl)细胞的条形图。图14E是用CtlIg、H7CR1.3,H7CR4.5、H7CR7.8或仅T细 胞处理的GM-CSF(pg/nl)细胞的条形图。图14F是用CtlIg、H7CR1.3,H7CR4.5、 H7CR7.8或仅T细胞处理的IL-10(pg/nl)细胞的条形图。图14G是用CtlIg、 H7CR1.3,H7CR4.5、H7CR7.8或仅T细胞处理的IL-6(pg/nl)细胞的条形图。图14H 是用CtlIg、H7CR1.3,H7CR4.5、H7CR7.8或仅T细胞处理的IL-12p70(pg/nl)细胞 的条形图。图14I是用CtlIg、H7CR1.3,H7CR4.5、H7CR7.8或仅T细胞处理的MCP- 1(pg/nl)细胞的条形图。图14J是用CtlIg、H7CR1.3,H7CR4.5、H7CR7.8或仅T细 胞处理的IL-17(pg/nl)细胞的条形图。图14AK是用CtlIg、H7CR1.3,H7CR4.5、 H7CR7.8或仅T细胞处理的MIP-1β(pg/nl)细胞的条形图。图14L是用CtlIg、 H7CR1.3,H7CR4.5、H7CR7.8或仅T细胞处理的IL-8(pg/nl)细胞的条形图。
图15A以及15B是流式细胞术散点图,显示了在抗原特异性的T细胞中用抗 H7CR抗体的处理增强了增殖以及细胞内IFNγ表达。图15A是使用CtlIg时log Comp-PerCP-Cy5-5-A::IFNg对Comp-FITC::CFSE的散点图。图15B是log Comp- PerCP-Cy5-5-A::IFNg对Comp-FIT::CFSE的散点图。
图16A-16B是显示了抗H7CR抗体对人T细胞应答的影响的条形图。图16A是 分裂的CD4+T细胞(%)的条形图,显示了在不存在CTLA4-Ig的情况下,抗CD28H 抗体(实心框)介导强烈增强的T细胞增殖。图16B显示抗CD28H抗体(实心框) 介导细胞因子表达的增加。图16B包括图A,它是来自用对照(空心框)或抗CD28H (实心框)处理的T细胞的pg/ml的IFN-γ的条形图。图B是pg/ml的以下细胞因子 (实心框)的条形图,从左向右:IL-5、IL-10、TNF-α、IL-17。对照(空心框)。
图17A-17B显示抗体1.3的轻链(图17A)和重链(图17B)的可变域的珍珠串 型(Collier Perles)2D表示。这些链的三个CDR环显示于这些图表的顶部。斜纹圆 是对于此mAb的缺失残基。方格的氨基酸是在那个位置为保守氨基酸。
图18A-18B显示抗体4.5的轻链(图18A)和重链(图18B)的可变域的珍珠串 型2D表示。这些链的三个CDR环显示于这些图表的顶部。斜纹圆是对于此mAb的 缺失残基。方格的氨基酸是在那个位置为保守氨基酸。
图19A-D是细胞数目对CFSE的流式细胞术直方图,显示在体内抗体1.3扩张了 人CD4+以及CD8+细胞。图19A以及19C是对照,显示细胞数目对一种对照抗体的 log荧光。图19B显示使用抗H7CR抗体1.3时CD4+细胞数目对log荧光。图19D显 示使用抗H7CR抗体1.3时CD8+细胞数目对log荧光。仓鼠IgG同种型对照(生物传 奇公司(Biolegend))被用作对照抗体。
图20A-H是流式细胞术散点图,显示注射了抗体1.3的NGS小鼠中CD40L、 IFNγ以及CD107a的细胞表达的增加。图20A显示未处理的CD4+细胞的log抗 CD40L抗体荧光对log抗CD3抗体荧光。图20B显示用抗H7CR抗体1.3处理的 CD4+细胞的抗CD40L抗体荧光的log荧光对log抗CD3抗体荧光。图20C显示在未 处理的CD4+细胞中抗IFNγ抗体的log荧光对抗CD3抗体的log荧光。图20D显示在 用抗H7CR抗体处理的CD4+细胞中IFNγ抗体的log荧光对H的log荧光。图20E显 示未处理的CD8+细胞的log抗CD107a抗体荧光对log抗CD3抗体荧光。图20F显示 用抗H7CR抗体1.3处理的CD8+细胞的抗CD107a抗体荧光的log荧光对log抗CD3 抗体荧光。图20G显示在未处理的CD8+细胞中抗IFNγ抗体的log荧光对抗CD3抗 体的log荧光。图20H显示在用抗H7CR抗体处理的CD8+细胞中IFNγ抗体的log荧 光对H的log荧光。
图21A是用(从左向右)嵌合的鼠抗H7CR抗体(1.3)、阴性对照(Ctl Ig)、 OKT3、OKT3+CD28、固定的嵌合鼠抗H7CR抗体(1.3)、固定的阴性对照、以及 固定的OKT3进行了刺激的静止的(resting)人PMBC中的IFN-γ(pg/mL)的点图。
图21B是用(从左向右)嵌合的鼠抗H7CR抗体(1.3)、阴性对照(Ctl Ig)、 OKT3、OKT3+CD28、固定的嵌合鼠抗H7CR抗体(1.3)、固定的阴性对照(Ctl- Ig)、以及固定的OKT3以10μg/ml浓度过夜刺激的活化的PMBC中的IFN-γ的点 图。
图22是针对通过1ng/ml TNFα以及1μg/ml PGE2成熟两天的单核细胞衍生的树 突细胞而言CFSE稀释的T细胞的百分数的条形图。在有100ng/ml破伤风类毒素的 情况下,将这些树突细胞用CFSE-标记的自体T细胞孵育两周。将细胞用(从左向 右)10μg/ml可溶的对照IgG4、嵌合的鼠抗H7CR抗体(1.3)、以及变体V1-V14 (参见表10)处理。
图23提供具有指明的重链以及轻链的三十六个人源化H7CR4.5的一系列的流式 细胞术散点图。将三十六个变体用H7CR-GFP融合蛋白转染的CHO细胞孵育并且用 抗人Ig第二抗体染色。X轴显示H7CR-GFP表达,并且Y轴显示结合到这些转染子 的变体。
具体实施方式
提供了能够免疫特异性地结合到B7-H7反受体即H7CR(也称为B7-H7CR以及 CD28H)的抗体、抗体的人源化变体及它们的抗原结合片段、以及其他分子,以及它们在治疗以及诊断癌症和其他疾病中的用途。
B7-H7表达于抗原递呈细胞上;它组成性地表达于巨噬细胞上并且在树突细胞上 是可诱导的。B7-H7与一个反受体(H7CR)相互作用以刺激该免疫系统以及免疫应 答(图1)。H7CR特别地表达于原初T细胞、NK细胞、以及浆细胞样树突细胞(尤 其是在脾脏、淋巴结和胸腺中)上,并且它的表达在成熟或活化的细胞上被下调。 H7CR的这种下调损伤活化的/记忆T细胞在体内的存活,并且在正常个体中导致返回 到免疫系统静止(immune system quiescence)。因此,B7-H7与H7CR之间的相互作 用对于天然T细胞引发以及活化的/记忆T细胞在体内的存活是重要的。然而,也看 到H7CR在慢性地抗原暴露的/耗尽的T细胞中被下调。能够结合到H7CR的分子, 诸如B7-H7 Ig以及抗H7CR抗体,能够充当T细胞增殖以及细胞因子产生的激动剂。 此类分子在治疗癌、感染性疾病以及由不足的T细胞应答表征的疾病中具有效用。相 反地,能够阻滞B7-H7与H7CR之间的相互作用的分子,诸如抗B7-H7抗体以及 H7CR Ig,充当T细胞增殖以及细胞因子产生的拮抗剂。此类分子在治疗炎症并且特 别是自身免疫病中具有效用。
A. B7-H7
通过爪蟾属(Xenopus)数据库的搜索,发现B7-H7是与爪蟾属B7-H4展现显著 同源性的一个基因。该B7-H4蛋白具有282个氨基酸残基,其已被归类为具有一个氨 基末端细胞外域,一个大的疏水跨膜域以及一个非常短的胞内域(仅由2个氨基酸残 基组成)。像其他B7家族成员一样,B7-H4在其细胞外域中具有一对Ig样区域。该 B7-H4蛋白具有一种类型I跨膜蛋白的整个结构。
发现该B7-H7氨基酸序列类似于之前发现的人基因,即HHLA2(人内源性逆转 录病毒-H长末端重复-相关蛋白2(HHLA2);马杰(Mager),D.L.等人(1999) “内源性逆转录病毒为两种新的人基因(HHLA2以及HHLA3)提供初级多腺苷酸化 信号(Endogenous Retroviruses Provide The Primary Polyadenylation Signal For Two New Human Genes(HHLA2 And HHLA3)”,基因组学(Genomics)59:255-263),其没 有已知功能(弗莱吉尼克(Flajnik),M.F.等人(2012)“B7家族的演化:B7H6以及 Nkp30的共同演化,一种新的B7家族成员即B7H7的鉴定,以及B7与MHC的历史 关系的鉴定(Evolution Of The B7 Family:Co-Evolution Of B7H6 And Nkp30, Identification Of A New B7 Family Member,B7H7,And Of B7’s Historical Relationship With The MHC)”,免疫遗传学(Immunogenetics)64:571–590)。
已发现人B7-H7序列在鸡、负鼠、有蹄哺乳动物(例如,马、猪)、鲑鱼、以及 鲨鱼中具有同系物。然而,迄今仅在啮齿动物(小鼠以及大鼠)中鉴定了拟基因。此 类基因的氨基酸序列在所有物种中揭示了一个类似的域结构,具有针对Ig超家族域的 典型残基的保守性。
人B7-H7多肽在长度上是414个氨基酸并且已被报导包含以下:一个信号序列、 一个细胞外域、3个免疫球蛋白样(Ig样)域、一个跨膜域、以及一个胞质域。具体 而言,该人B7-H7多肽已被报导包含一个Ig样V-类型1域,一个Ig样C-1类型域, 以及一个Ig样V-类型2域。存在B7-H7的多个天然存在的变体(例如,登录号 Q9UM44-1(智人),NP_009003(GI:5901964,智人),以及AAD48396(GI: 15726285,智人);见WO 2011/020024)。
术语“天然-B7-H7”是指任何天然存在的B7-H7氨基酸序列,包括不成熟的或前体 以及成熟形式。B7-H7的成熟形式包括已经过翻译后修饰的B7-H7蛋白,例如一个信 号或前导子氨基酸序列已被裂解的B7-H7多肽。一个代表性的人B7-H7的氨基酸序 列,登录号Q9UM44-1,是(SEQ ID NO:1):
基于计算机分析该人B7-H7被报导包含以下预测的域:在SEQ ID NO:1的氨基 酸残基1至22处的一个信号序列、在SEQ ID NO:1的氨基酸残基61至131处的一 个Ig样V-类型1域、在SEQ ID NO:1的氨基酸残基138至222处的一个Ig样C-1 类型域、在SEQ ID NO:1的氨基酸残基235至328处的一个Ig样V-类型2域、以及 在SEQ ID NO:1的氨基酸残基345至365处的一个跨膜域。针对人B7-H7多肽预测 的二聚体界面是SEQ ID NO:1的氨基酸残基141-144、156、158、160、162、193- 196、198、200、201、224、以及225。针对人B7-H7多肽预测的N联糖基化位点是在 SEQ ID NO:1的氨基酸残基90、103、以及318处。人B7-H7多肽的天然变体包括 BOT,N344K,以及S346R(UniProt Q9UM44)(参见,WO 2011/020024,将该参考 文献针对它对人B7-H7的结构以及序列的传授通过引用以其全文结合在此)。
编码人B7-H7(SEQ ID NO:1)的DNA序列是(SEQ ID NO:2):
相比于被广泛表达的人B7-H4,发现人B7-H7展现更受限的表达(例如,表达于 肠、肾、肺、上皮细胞和淋巴细胞中)。人HHLA2发现于靠近B7.1以及B7.2的染 色体3q13.33上。B7-H7组成性地表达于巨噬细胞上并且在树突细胞(DC)上是可诱 导的。
B. H7CR
如此处使用的,术语“天然H7CR”是指B7-H7的任何天然存在的反受体。H7CR 也称为B7-H7CR以及CD28H。H7CR是由T细胞、NK细胞、以及浆细胞样树突细胞 表达。人H7CR多肽另外在文献/数据库中被称为包含2(TMIGD2)的跨膜以及免疫 球蛋白域(拉希米(Rahimi),N.等人(电子出版2012年3月14日)“鉴定IGPR-1 作为一种新颖的参与血管生成的粘附分子(Identification Of IGPR-1 As A Novel Adhesion Molecule Involved In Angiogenesis)”,分子生物细胞(Molec.Biol.Cell.)23 (9):1646-1656)但B7-H7CR的功能之前未阐明。针对此类天然H7CR分子的氨 基酸序列的登录号的非限制性实例包括:Q96BF3-1(智人),Q96BF3-2(智人), NP_653216.1(GI:21389429;智人)以及NP_653216.2(GI:281306838;智人)。 一个天然H7CR分子的代表性氨基酸序列(Q96BF3-2)如下提供为SEQ ID NO:3:
编码人H7CR(SEQ ID NO:3)的DNA序列是(SEQ ID NO:4):
C.定义
如此处使用的,如果这种结合展现一种抗体结合至其同源抗原的特异性以及亲和 力的话,则称一个分子能够“免疫特异性地结合”一个第二分子。如果这种结合涉及免 疫球蛋白分子的抗原识别位点的话,则称抗体能够“免疫特异性地结合”至抗原(并且 特别是抗原H7CR)的一个靶区域或构造(“表位”)。免疫特异性地结合到一种具体 的抗原的一种抗体可以按更低的亲和力结合到其他抗原,前提是如果该其他抗原具有 由如通过例如免疫测定、测定、或本领域中已知的其他测定确定的抗原识 别位点所识别的一些序列或构造相似性的话,但不会结合至完全不相关的抗原。然 而,优选地,抗体(及其抗原结合片段)将不与其他抗原发生交叉反应。抗体也可以 按非免疫特异性的方式结合到其他分子,诸如结合到Fc受体(FcR),凭借该分子的 不涉及该抗原识别位点的其他区域/域中的结合域,诸如Fc区。
如在结合或展现的效果的背景下使用的术语“基本上”旨在表示所观察到的效果是 生理学或治疗相关的。因此,例如,如果阻滞的程度是生理学或治疗相关的话(例如 如果这种程度大于完全阻滞的60%,大于完全阻滞的70%,大于完全阻滞的75%,大 于完全阻滞的80%,大于完全阻滞的85%,大于完全阻滞的90%,大于完全阻滞的 95%,或大于完全阻滞的97%),一个分子能够基本上阻滞H7CR的活性。类似地, 如果此类免疫特异性以及表征是大于60%相同的,大于70%相同的,大于75%相同 的,大于80%相同的,大于85%相同的,大于90%相同的,大于95%相同的,或大于 97%相同的,则称一个分子与另一个分子具有基本上相同的免疫特异性和/或表征)。
如此处使用的,术语“受试者”旨在表示一种哺乳动物,诸如非灵长类(例如,母 牛、猪、马、猫、狗、大鼠等)以及灵长类(例如,猴以及人),最优选是人。术语 “患者”旨在表示接受用于诊断、治疗或预防目的的一种披露组合物的受试者。
如此处使用的,术语“抗体”旨在表示具有一个“可变区”抗原识别位点的一个免疫 球蛋白分子。术语“可变区”旨在将该免疫球蛋白的这种域与抗体广泛共享的域(例如 一个抗体Fc域)区分。该可变区包括一个“高变区”,其残基对抗原结合负责。该高 变区包括来自“互补决定区”或“CDR”的氨基酸残基(即,典型地大约在轻链可变域中 的残基24-34(L1)、50-56(L2)以及89-97(L3)以及大约在重链可变域中的残基 27-35(H1)、50-65(H2)以及95-102(H3)处;卡巴特(Kabat)等人,具有免疫 学意义的蛋白质序列(Sequences of Proteins of Immunological Interest),第5版,公 共卫生服务(Public Health Service),美国国家卫生研究院(National Institutes of Health),贝塞斯达(Bethesda),MD.(1991))和/或来自“高变环”的那些残基 (即,在轻链可变域中的残基26-32(L1)、50-52(L2)以及91-96(L3)以及在重 链可变域中的26-32(H1)、53-55(H2)以及96-101(H3);乔西亚(Chothia)以 及莱斯克(Lesk),1987,分子生物学杂志(J.Mol.Biol.)196:901-917)。“框架 区”或“FR”残基是除了如在此定义的高变区残基以外的那些可变域残基。术语抗体包 括单克隆抗体、多特异性抗体、人抗体、人源化抗体、合成抗体、嵌合抗体、骆驼化 抗体(参见例如,幕德曼斯(Muyldermans)等人,2001,生物化学科学趋势(Trends Biochem.Sci.)26:230;纳托尔(Nuttall)等人,2000,当前药剂生物技术(Cur. Pharm.Biotech.)1:253;莱兴曼(Reichmann)以及梅尔德曼斯(Muyldermans), 1999,免疫法杂志(J.Immunol.Meth.)231:25;国际公开号W0 94/04678和W0 94/25591;美国专利号6,005,079),单链Fvs(scFv)(参见,例如,参见普拉克图 恩(Pluckthun)于单克隆抗体的药理学(The Pharmacology of Monoclonal Antibodies),第113卷,罗森堡(Rosenburg)和摩尔(Moore)编辑,施普林格出版 社,纽约,第269-315页(1994)),单链抗体、二硫化物连接的Fvs(sdFv)、胞 内抗体、以及抗独特型(抗Id)抗体(包括,例如,此处披露的抗体的抗Id以及抗 抗Id抗体)。具体而言,此类抗体包括任何类型(例如,IgG、IgE、IgM、IgD、IgA 以及IgY)、类别(例如,IgG1、IgG2、IgG3、IgG4、IgA1以及IgA2)或子类的免疫 球蛋白分子。
如此处使用的,术语一种抗体的“抗原结合片段”是指一种抗体的包含以下项的一 个或多个部分:该抗体的互补决定区(“CDR”)以及任选地包括该抗体的“可变区”抗 原识别位点、并且展现免疫特异性地结合抗原的能力的框架残基。此类片段包括 Fab'、F(ab')2、Fv、单链(ScFv),及其突变体、天然存在的变体,以及包括该抗体 的“可变区”抗原识别位点以及一种异源蛋白(例如,毒素、针对不同抗原的抗原识别 位点、酶、受体或受体配体等)的融合蛋白。如此处使用的,术语“片段”是指一种肽 或多肽,该肽或多肽包括至少5个连续的氨基酸残基、至少10个连续的氨基酸残 基、至少15个连续的氨基酸残基、至少20个连续的氨基酸残基、至少25个连续的 氨基酸残基、至少40个连续的氨基酸残基、至少50个连续的氨基酸残基、至少60 个连续的氨基残基、至少70个连续的氨基酸残基、至少80个连续的氨基酸残基、至 少90个连续的氨基酸残基、至少100个连续的氨基酸残基、至少125个连续的氨基 酸残基、至少150个连续的氨基酸残基、至少175个连续的氨基酸残基、至少200个 连续的氨基酸残基、或至少250个连续的氨基酸残基的氨基酸序列。
人嵌合或人源化抗体对于在人体内使用是特别优选的,然而,可有利地采用鼠抗 体或其他物种的抗体用于许多用途(例如,体外或原位检测测定,急性体内使用 等)。完全人抗体对于人受试者的治疗性治疗是特别令人希望的。
人类抗体可以通过在本领域中已知的多种方法来制造,包括使用衍生自人类免疫 球蛋白序列的抗体文库的上述的噬菌体展示方法(参见美国专利号4,444,887以及 4,716,111;以及国际公开号WO 98/46645、WO 98/50433、WO 98/24893、WO 98/16654、WO 96/34096、WO 96/33735、以及WO 91/10741)。人抗体可以使用转基 因小鼠来产生,这些转基因小鼠不能表达功能内源性免疫球蛋白,但是可以表达人免 疫球蛋白基因。例如,可以随机地或通过同源重组将人重链和轻链免疫球蛋白基因复 合物引入到小鼠胚胎干细胞之中。可替代地,除了人重链和轻链基因之外,还可以将 人可变区、恒定区和多样区(diversity region)引入到小鼠胚胎干细胞之中。可以单独 使小鼠重链和轻链免疫球蛋白基因无-功能,或在引入人免疫球蛋白基因座的同时通过 同源重组来使这些免疫球蛋白基因无功能。具体地说,JH区的纯合缺失防止内源性抗 体产生。修饰的胚胎干细胞扩增并且微注射到胚囊中以便产生嵌合小鼠。然后使嵌合 小鼠繁殖以便产生表达人抗体的纯合子代。使用常规方法以一个选择的抗原(例如, 一种多肽的全部或一部分)来对转基因小鼠免疫。针对抗原的单克隆抗体可以使用常 规的杂交瘤技术从免疫的转基因小鼠获得(参见,例如美国专利号5,916,771)。转基 因小鼠所具有的人免疫球蛋白转基因在B细胞分化过程中重排,并且随后进行类别转 换和体细胞突变。因此,使用这种技术,可能产生治疗有用的IgG、IgA、IgM以及 IgE抗体。对于产生人抗体的这种技术的概要,参见朗伯格(Lonberg)以及胡萨尔 (Huszar)(1995,国际免疫学综述(Int.Rev.Immunol.)13:65-93,将其通过引用 以其全文结合在此)。对于产生人抗体和人单克隆抗体的这种技术以及产生此类抗体 的方案的详细讨论,参见,例如国际公开号WO 98/24893、WO 96/34096、以及WO 96/33735;以及美国专利号5,413,923、5,625,126、5,633,425、5,569,825、5,661,016、 5,545,806、5,814,318、以及5,939,598,将其通过引用以其全文结合在此。此外,公司 诸如安根尼克斯(Abgenix)公司(弗里蒙特,CA)以及梅达瑞克斯(Medarex) (普林斯顿,NJ)能够参与使用类似于上述的技术针对一个选择的抗原提供人抗体。
“嵌合抗体”是其中抗体的不同部分衍生自不同的免疫球蛋白分子的分子,如具有 衍生自一种非人抗体的可变区和人类免疫球蛋白恒定区的抗体。产生嵌合抗体的方法 在本领域中是已知的。参见例如,莫里森(Morrison),1985,科学(Science)229: 1202;维(Oi)等人,1986,生物技术(BioTechniques)4:214;吉利斯(Gillies) 等人,1989,免疫方法杂志(J.Immunol.Methods)125:191-202;以及美国专利号 6,311,415、5,807,715、4,816,567、以及4,816,397。包含来自一个非人物种的一个或多 个CDR以及来自一个人免疫球蛋白分子的框架区的嵌合抗体可以使用多个本领域已 知的技术产生,这些技术包括例如CDR-接枝(EC 239,400;国际公开号WO 91/09967;以及美国专利号5,225,539、5,530,101、以及5,585,089)、饰面或表面重修 (EP 592,106;EP 519,596;帕德兰(Padlan),1991,分子免疫学(Molecular Immunology)28(4/5):489-498;斯图德尼卡(Studnicka)等人,1994,蛋白质工 程(Protein Engineering)7:805;和罗吉斯卡(Roguska)等人(1994)美国国家科 学院院刊(Proc.Natl.Acad Sci.USA)91:969),以及链改组(美国专利号 5,565,332)。
“人源化抗体”是本领域中已知的(参见,例如,欧洲专利号EP 239,400、EP 592,106、以及EP 519,596;国际公开号WO 91/09967和WO 93/17105;美国专利号 5,225,539、5,530,101、5,565,332、5,585,089、5,766,886、以及6,407,213;以及帕德兰 (Padlan),1991,分子免疫学(Molecular Immunology)28(4/5):489-498;斯图 德尼卡(Studnicka)等人,1994,蛋白质工程(Protein Engineering)7(6):805- 814;罗吉斯卡(Roguska)等人,1994,PNAS 91:969-973;坦(Tan)等人, 2002,免疫学杂志(J.Immunol.)169:1119-1125;卡尔达斯(Caldas)等人,2000, 蛋白质工程(Protein Eng.)13:353-360;摩瑞亚(Morea)等人,2000,方法 (Methods)20:267-79;巴卡(Baca)等人,1997,生物化学杂志(J.Biol.Chem.) 272:10678-10684;罗吉斯卡(Roguska)等人,1996,蛋白质工程(Protein Eng.) 9:895-904;科托(Couto)等人,1995,癌症研究(Cancer Res.)55(23补充): 5973s-5977s;科托(Couto)等人,1995,癌症研究(Cancer Res.)55:1717-22;桑 德胡(Sandhu),1994,基因(Gene)150:409-10;佩德森(Pedersen)等人, 1994,分子生物学杂志(J.Mol.Biol.)235:959-973;琼斯(Jones)等人,(1986) 自然(Nature)321:522-525;莱兴曼(Reichmann)等人,(1988)自然(Nature) 332:323-329;以及普雷斯塔(Presta),1992,当前结构生物学观点(Curr.Op. Struct.Biol.)2:593-596)。如此处使用的,术语“人源化抗体”是指包括一个人框架 区以及来自一种非人(通常是小鼠或大鼠)免疫球蛋白的一个或多个CDR的免疫球 蛋白。提供CDR的非人免疫球蛋白称作“供体”并且提供框架的人免疫球蛋白称作“受 体”。恒定区不需要存在,但如果它们存在,它们必须与人免疫球蛋白恒定区基本上 相同,即至少约85%-90%、优选地约95%或更多是相同的。因此,除了可能地CDR 外,人源化免疫球蛋白的所有部分基本上与天然人免疫球蛋白序列的相应部分相同。 一种人源化抗体是包含人源化轻链以及人源化重链免疫球蛋白的一种抗体。例如,一 种人源化抗体将不包含一种典型的嵌合抗体,因为,例如一种嵌合抗体的整个可变区 是非人的。通过“人源化(humanization)”的过程一个供体抗体被“人源化”,因为预期 所得到的人源化抗体结合到与提供该CDR的供体抗体针对的相同的抗原上。对于大 部分,人源化抗体是人免疫球蛋白(受体抗体),其中该受体的高变区残基被来自具 有希望的特异性、亲和力、以及能力的一个非人物种(供体抗体)诸如小鼠、大鼠、 兔或非人类灵长动物的高变区残基替代。在一些情况下,人类免疫球蛋白的框架区 (FR)残基被相应的非人类残基替换。此外,人源化抗体可以包括受体抗体或供体抗 体中不存在的残基。作出这些修饰以进一步改进抗体性能。通常,该人源化抗体将包 括基本上至少一个、并且典型地两个可变域的全部,其中这些高变区的全部或基本上 全部对应于非人类免疫球蛋白的那些,并且FR的全部或基本上全部是人类免疫球蛋 白序列的那些。该人源化抗体任选地也将包括一个免疫球蛋白恒定区(Fc)的至少一 部分,典型地是免疫特异性地结合到一个FcγRIIB多肽的人免疫球蛋白的那部分,其 已通过引入氨基酸残基取代、缺失或添加(即,突变)改变。
抗人H7CR抗体的人嵌合或人源化衍生物对于在人体内使用是特别优选的,然 而,可有利地采用鼠抗体或其他物种的抗体用于许多用途(例如,体外或原位检测测 定,急性体内使用等)。此类人或人源化抗体包括在一个或多个非人CDR上的氨基 酸残基取代、缺失或添加。当与一种非衍生物人源化抗体比较时,该人源化抗体衍生 物可具有基本上相同的结合、更强的结合或更弱的结合。在特定实施例中,该CDR 的一、二、三、四、或五个氨基酸残基已被取代、缺失或添加(即,突变)。完全人 抗体对于人受试者的治疗性治疗是特别令人希望的。
此类人抗体可以通过在本领域中已知的多种方法来制造,包括使用衍生自人免疫 球蛋白序列的抗体文库的噬菌体展示方法(参见美国专利号4,444,887以及 4,716,111;以及国际公开号WO 98/46645、WO 98/50433、WO 98/24893、WO 98/16654、WO 96/34096、WO 96/33735、以及WO 91/10741)。此类人抗体可以使用 转基因小鼠来产生,这些转基因小鼠不能表达功能性内源性免疫球蛋白,但是可以表 达人免疫球蛋白基因。例如,可以随机地或通过同源重组将人重链和轻链免疫球蛋白 基因复合物引入到小鼠胚胎干细胞之中。可替代地,除了人重链和轻链基因之外,还 可以将人可变区、恒定区和多样区(diversity region)引入到小鼠胚胎干细胞之中。可 以单独使小鼠重链和轻链免疫球蛋白基因无-功能,或在引入人免疫球蛋白基因座的同 时通过同源重组来使这些免疫球蛋白基因无功能。具体地说,JH区的纯合缺失防止内 源性抗体产生。修饰的胚胎干细胞扩增并且微注射到胚囊中以便产生嵌合小鼠。然后 使嵌合小鼠繁殖以便产生表达人抗体的纯合子代。使用常规方法以一个选择的抗原 (例如,一种多肽的全部或一部分)来对转基因小鼠免疫。针对抗原的单克隆抗体可 以使用常规的杂交瘤技术从免疫的转基因小鼠获得(参见,例如美国专利号 5,916,771)。转基因小鼠所具有的人免疫球蛋白转基因在B细胞分化过程中重排,并 且随后进行类别转换和体细胞突变。因此,使用这种技术,可能产生治疗有用的 IgG、IgA、IgM以及IgE抗体。对于产生人抗体的这种技术的概要,参见朗伯格 (Lonberg)以及胡萨尔(Huszar)(1995,国际免疫学综述(Int.Rev.Immunol.) 13:65-93,将其通过引用以其全文结合在此)。对于产生人抗体和人单克隆抗体的这 种技术以及产生此类抗体的方案的详细讨论,参见,例如国际公开号WO 98/24893、 WO 96/34096、以及WO 96/33735;以及美国专利号5,413,923、5,625,126、 5,633,425、5,569,825、5,661,016、5,545,806、5,814,318、以及5,939,598,将其通过引 用以其全文结合在此。此外,公司诸如安根尼克斯(Abgenix)公司(弗里蒙特, CA)以及梅达瑞克斯(Medarex)(普林斯顿,NJ)能够参与使用类似于上述的技术 针对一个选择的抗原提供人抗体。
在所披露的方法中使用的抗体可以是单特异性的。还感兴趣的是双特异性的抗 体、三特异性的抗体或具有更大的多特异性的抗体,这些抗体展现对除H7CR外的不 同靶标(诸如免疫系统的其他分子)的特异性。例如,此类抗体可结合到H7CR和如 下的一种抗原两者上,该抗原对将该抗体靶标至一个具体的细胞类型或组织是重要的 (例如,靶标至与正治疗的一种肿瘤的癌抗原关联的一种抗原)。在另一个实施例 中,此类多特异性的抗体结合到B7-H7和H7CR两者,并且因此起作用以促进具有此 类分子的细胞的关联,以便由此激动T细胞应答。此类分子在治疗癌症和感染性疾病 上具有特别的效用。在另一个实施例中,为了增强免疫调节影响,此类多特异性的抗 体结合到以下分子(受体或配体),这些分子涉及供选择的或补充的免疫调节通路, 诸如CTLA4、TIM3、TIM4、OX40、CD40、GITR、4-1-BB、B7-H4、LIGHT或 LAG3。此外,该多特异性的抗体可结合到效应分子,诸如细胞因子(例如,IL-7、 IL-15、IL-12、IL-4TGF-β、IL-10、IL-17、IFNg、Flt3、BLys)以及趋化因子(例 如,CCL21),其对于调节急性以及慢性免疫应答两者可能是特别相关的。
编码优选的人受体框架序列的DNA序列包括但不限于来自人种系VH区段VH1- 18和JH6以及人种系VL区段VK-A26和JK4的FR区段。在一个特定实施例中,使 用常规重组DNA技术将这些CDR中的一个或多个插入框架区内。构架区可以是天然 存在的或是共有的构架区,并且优选地是人构架区(针对人框架区列表,参见,例 如,乔西亚(Chothia)等人,1998,“在免疫球蛋白可变域序列中的结构因素 (Structural Determinants In The Sequences Of Immunoglobulin Variable Domain),”分 子生物学杂志(J.Mol.Biol.)278:457-479)。
所披露的人源化或嵌合抗体可包含基本上至少一个、并且典型地为2个可变域的 全部,其中全部或基本上全部这些CDR区对应一种非-人免疫球蛋白(即,供体抗 体)的那些,并且全部或基本上全部这些框架区是一种人免疫球蛋白共有序列的那 些。优选地,该抗体还包括一种免疫球蛋白恒定区(Fc)的至少一部分,典型地为一 种人免疫球蛋白的那种。可相对于所提出的该抗体的功能(具体而言可能需要的效应 子功能)来选择抗体的恒定域。在一些实施例中,抗体的恒定域是(或包括)人 IgA、IgD、IgE、IgG或IgM域。在一个特定实施例中,当该人源化抗体旨在治疗用 途,并且需要抗体效应子功能(如抗体依赖性细胞介导的细胞毒性(ADCC)以及补 体依赖性细胞毒性(CDC)活性)时,使用尤其是IgG1以及IgG3同种型的人IgG恒 定域。在可替代的实施例中,当该抗体旨在治疗目的,并且不需要抗体效应子功能 时,使用IgG2以及IgG4同种型。该抗体的Fc恒定域可包括改变抗体效应子功能的 一个或多个氨基酸修饰,诸如披露于美国专利申请公开号2005/0037000以及 2005/0064514中的那些。
在一些实施例中,该抗体包含轻链以及至少重链的可变域两者。在其他实施例 中,该抗体可进一步包括重链的CH1、铰链、CH2、CH3、和CH4区中的一个或多 个。该抗体可以选自任何类别的免疫球蛋白(包括IgM、IgG、IgD、IgA和IgE)以 及任何同种型(包括IgG1、IgG2、IgG3和IgG4)。在一些实施例中,恒定域是一个补 体固定恒定域,其中希望该抗体展现出细胞毒性活性,并且类别典型地是IgG1。在其 他实施例中,在这种细胞毒性活性不是令人希望的情况下,恒定域可以属于IgG2类 别。该抗体可以包括来自多于一个的类别或同种型的序列,并且选择具体的恒定域来 优化所希望的效应子功能是在本领域普通技术范围内的。
在一个特定方面,本披露提供了一种Fc变体,其中该Fc区在选自下组的一个或 多个位置包括至少一个修饰(例如,氨基酸取代、氨基酸插入、氨基酸缺失),该组 由以下各项组成:通过EU索引以数字编号的228,234,235以及331,如在卡巴特 (Kabat)等人(1991,NIH出版91-3242,国家技术信息服务(National Technical Information Service),斯普林菲尔德(Springfield),弗吉尼亚州(Va.)中所述)。在 一个方面,该修饰是选自下组的至少一个取代,该组由以下各项组成:228P、234F、 235E、235F、235Y、以及331S,如通过如在卡巴特中列出的EU索引编号的。
在另一个特定方面,本披露提供了一种Fc变体,其中该Fc区是一个IgG4 Fc 区,并且在选自下组的一个或多个位置包括至少一个修饰,该组由以下各项组成: 228以及235,如通过如在卡巴特中列出的EU索引编号的。在再另一个特定方面,该 Fc区是一个IgG4 Fc区,并且这些非天然存在的氨基酸选自下组,该组由以下各项组 成:228P、235E以及235Y,如通过如在卡巴特中列出的EU索引编号的。
在另一个特定方面,本披露提供了一种Fc变体,其中该Fc区在选自下组的一个 或多个位置包括至少一个非天然存在的氨基酸,该组由以下各项组成:239、330以及 332,如通过如在卡巴特中列出的EU索引编号的。在一个方面,该修饰是选自下组的 至少一个取代,该组由以下各项组成:239D、330L、330Y、以及332E,如通过如在 卡巴特中列出的EU索引编号的。参见美国专利号7,317,091,通过引用以其全文结合 在此。
在一个特定方面,本披露提供了一种Fc变体1,其中该Fc区在选自下组的一个 或多个位置包括至少一个非天然存在的氨基酸,该组由以下各项组成:252、254以及 256,如通过如在卡巴特中列出的EU索引编号的。在一个方面,该修饰是选自下组的 至少一个取代,该组由以下各项组成:252Y、254T以及256E,如通过如在卡巴特中 列出的EU索引编号的。参见美国专利号7,083,784,通过引用以其全文结合在此。
在某些方面,本披露提供了一种Fc变体,其中该Fc区在位置428包括一个非天 然存在的氨基酸,如通过如在卡巴特中列出的EU索引编号的。在一个方面,在位置 428的修饰是选自下组,该组由以下各项组成:428T、428L、428F、以及428S,如通 过如在卡巴特中列出的EU索引编号的。参见美国专利号7,670,600,通过引用以其全 文结合在此。在另一个方面,一种Fc变体可进一步在位置434包括一个非天然存在 的氨基酸,如通过如在卡巴特中列出的EU索引编号的。在一个方面,在位置434的 修饰是选自下组,该组由以下各项组成:434A、434S、以及434F,如通过如在卡巴 特中列出的EU索引编号的。在其他方面,本披露提供了一种Fc变体,其中该Fc区 在位置428以及434包括一个非天然存在的氨基酸,如通过如在卡巴特中列出的EU 索引编号的。在一个特定方面,该Fc区包括428L、434S。参见美国专利号 8,088,376。
一个人源化抗体的框架区和CDR区不需要精确地与亲本序列对应,例如,供体 CDR或共有构架可以通过至少一个残基的取代、插入或缺失来进行诱变,以使得在那 个位点处的CDR或构架残基不与共有抗体或供体抗体相对应。然而,这类突变优选 地不是大规模的。通常,至少75%的人源化抗体残基会与亲本框架区(FR)和CDR 序列的那些相对应,更经常90%,并且最优选大于95%。人源化抗体可以使用多种本 领域中已知的技术产生,这些技术包括但不限于CDR-接枝(欧洲专利号EP 239,400;国际公开号WO 91/09967;以及美国专利号5,225,539、5,530,101、以及 5,585,089)、饰面或表面重修(欧洲专利号EP 592,106以及EP 519,596;帕德兰 (Padlan),1991,分子免疫学(Molecular Immunology)28(4/5):489-498;斯图 德尼卡(Studnicka)等人,1994,蛋白质工程(Protein Engineering)7(6):805- 814;和罗吉斯卡(Roguska)等人,1994,美国国家科学院院刊(Proc.Natl.Acad. Sci.)91:969-973),链改组(美国专利号5,565,332),以及披露于以下中的技术, 例如,美国专利号6,407,213、5,766,886、5,585,089,国际公开号WO 9317105,坦 (Tan)等人,2002,免疫学杂志(J.Immunol.)169:1119-25,卡尔达斯(Caldas) 等人,2000,蛋白质工程(Protein Eng.)13:353-60,摩瑞亚(Morea)等人, 2000,方法(Methods)20:267-79,巴卡(Baca)等人,1997,生物化学杂志(J. Biol.Chem.)272:10678-84,罗吉斯卡(Roguska)等人,1996,蛋白质工程 (Protein Eng.)9:895-904,科托(Couto)等人,1995,癌症研究(Cancer Res.)55 (23补充):5973s-5977s,科托(Couto)等人,1995,癌症研究(Cancer Res.) 55:1717-22,桑德胡(Sandhu),1994,基因(Gene)150:409-10,佩德森 (Pedersen)等人,1994,分子生物学杂志(J.Mol.Biol.)235:959-73,琼斯 (Jones)等人,(1986)自然(Nature)321:522-525,莱兴曼(Riechmann)等人, 1988,自然(Nature)332:323,以及普雷斯塔(Presta),1992,当前结构生物学观 点(Curr.Op.Struct.Biol.)2:593-596。这些框架区中的框架残基将经常用来自CDR 供体抗体的对应残基来取代以便改变、优选地改进抗原结合。这些框架取代是通过本 领域中熟知的方法来鉴别,例如通过模拟CDR与框架残基的相互作用以便鉴别对于 抗原结合重要的框架残基、和用于鉴别具体位置的不寻常框架残基的序列比较。(参 见,例如,奎因(Queen)等人,美国专利号5,585,089;美国公开号2004/0049014和 2003/0229208;美国专利号6,350,861;6,180,370;5,693,762;5,693,761;5,585,089; 和5,530,101和莱兴曼(Riechmann)等人,1988,自然(Nature)332:323)。
该抗体可通过本领域中已知的对于产生多肽有用的任何方法产生,这些方法是例 如体外合成、重组DNA生产等。优选地,该人源化抗体是通过重组DNA技术产生 的。该抗体可使用重组免疫球蛋白表达技术产生。免疫球蛋白分子重组产物(包括人 源化抗体)描述于美国专利号4,816,397(博斯(Boss)等人)、美国专利号 6,331,415以及4,816,567(两者都是卡比利(Cabilly)等人)、英国专利GB 2,188,638 (温特(Winter)等人)以及英国专利GB 2,209,757。免疫球蛋白重组表达技术(包 括人源化免疫球蛋白)也可见于戈德尔(Goeddel)等人,酶学基因表达技术方法 (Gene Expression Technology Methods in Enzymology)第185卷学术出版社 (Academic Press)(1991),以及博勒巴克(Borreback),抗体工程(Antibody Engineering),W.H.弗里曼(Freeman)(1992)。涉及重组抗体的生产、设计以及 表达的另外信息可以发现于梅福思(Mayforth),设计抗体(Designing Antibodies),学术出版社(Academic Press),圣地亚哥(1993)。
用于生产该重组嵌合抗体的示例性工艺可包括以下:a)通过常规分子生物学方 法,构建编码并表达抗体重链的一种表达载体,其中鼠抗人H7CR单克隆抗体的CDR 以及可变区融合到源自于一种人免疫球蛋白的一个Fc区,从而产生用于表达嵌合抗 体重链的载体;b)通过常规分子生物学方法,构建编码并表达鼠抗人H7CR单克隆 抗体的抗体轻链的一个表达载体,从而产生用于表达嵌合抗体轻链的载体;c)通过 常规分子生物学方法将这些表达载体转移到宿主细胞,以产生用于表达嵌合抗体的经 转染的宿主细胞;并且d)通过常规细胞培养技术培养该转染细胞,以产生嵌合抗 体。
用于产生重组人源化抗体的示例性工艺可包括以下:a)通过常规分子生物学方 法,构建编码并表达抗人H7CR重链的一种表达载体,其中需要来保持供体抗体结合 特异性的CDR以及最小部分的可变区框架源自于一种非人免疫球蛋白,诸如鼠抗人 H7CR单克隆抗体,并且抗体的剩余部分源自于一种人免疫球蛋白,从而产生用于表 达一种人源化抗体重链的一个载体;b)通过常规分子生物学方法,构建编码并表达 抗体轻链的一种表达载体,其中需要来保持供体抗体结合特异性的CDR以及最小部 分的可变区框架源自于一种非人免疫球蛋白,诸如鼠抗人H7CR单克隆抗体,并且抗 体的剩余部分源自于一种人免疫球蛋白,从而产生用于表达人源化抗体轻链的一个载 体;c)通过常规分子生物学方法将这些表达载体转移到宿主细胞,以产生用于表达 人源化抗体的经转染的宿主细胞;并且d)通过常规细胞培养技术培养该转染细胞, 以产生人源化抗体。
相对于任一个示例性方法,可将宿主细胞用此类表达载体共转染,这些表达载体 可包含不同的选择性标记,但除重链以及轻链编码序列外,优选地是相同的。此程序 提供了重链和轻链多肽的等同表达。可替代地,可以使用编码重链和轻链多肽两者的 单个载体。重链和轻链的编码序列可以包括cDNA或基因组DNA或两者。用于表达 该重组抗体的宿主细胞可以是细菌细胞,诸如大肠杆菌,或更优选地是真核细胞(例 如,中国仓鼠卵巢(CHO)细胞或HEK-293细胞)。对表达载体的选择依赖于对宿 主细胞的选择,并且可如此选择以在所选择的宿主细胞中具有希望的表达以及调控特 性。可使用的其他细胞系包括但不限于,CHO-K1、NSO、以及PER.C6(库赛尔,莱 顿,荷兰)。
可使用本领域普通技术人员所熟知的技术将所披露的抗体中的任一个产生抗独特 型抗体(参见,例如,格林斯潘(Greenspan),N.S.等人(1989)“独特型:结构以 及免疫原性(Idiotypes:Structure And Immunogenicity)”,FASEB杂志(FASEB J.) 7:437-444;以及尼西诺夫(Nisinoff),A.(1991)“独特型:概念和应用 (Idiotypes:Concepts And Applications)”,免疫学杂志(J.Immunol.)147(8): 2429-2438)。
如果希望的话,所披露的抗体的结合特性可通过对展现此类希望的特性的变体进 行筛选而进一步改进。例如,此类抗体可以使用本领域中已知的各种噬菌体展示方法 来产生。在噬菌体展示方法中,将功能抗体域展示在噬菌体颗粒表面上,这些颗粒携 带对其进行编码的多核苷酸序列。在一个具体实施例中,这种噬菌体可以用于展示从 全范围或组合抗体文库(例如,人或鼠类)表达的抗原结合域,例如Fab和Fv或二 硫键稳定的Fv。表达结合所感兴趣的抗原的抗原结合域的噬菌体可以用抗原来选择或 鉴别,例如,使用标记的抗原或结合或捕获于固体表面或珠粒上的抗原。在这些方法 中使用的噬菌体典型地是丝状噬菌体,包括fd以及M13。这些抗原结合域被表达为 一种重组地与噬菌体基因III或基因VIII蛋白融合的蛋白。可被用于制造免疫球蛋白 或其片段的噬菌体展示方法的实例包括披露于以下的那些,布林克曼(Brinkman), U.等人(1995)“二硫化物稳定的Fv片段的噬菌体展示(Phage Display Of Disulfide- Stabilized Fv Fragments),”免疫学方法杂志(J.Immunol.Methods),182:41-50, 1995;艾姆斯(Ames),R.S.等人(1995)“从组合噬菌体展示库分离的鼠类Fab向 全长免疫球蛋白的转换(Conversion Of Murine Fabs Isolated From A Combinatorial Phage Display Library To Full Length Immunoglobulins),”免疫学方法杂志(J. Immunol.Methods),184:177-186;凯特尔伯勒(Kettleborough),C.A.等人 (1994)“使用噬菌体-抗体库从免疫的小鼠分离肿瘤特异性细胞单链Fv以及从这些抗 体片段重建全部抗体(Isolation Of Tumor Cell-Specific Single-Chain Fv From Immunized Mice Using Phage-Antibody Libraries And The Re-Construction Of Whole Antibodies From These Antibody Fragments),”欧洲免疫学杂志(Eur.J.Immunol.),24:952-958, 1994;佩尔斯克(Persic),L.等人(1997)“在从噬菌体展示库选择后用于抗体或其 片段的真核表达的整合载体系统(An Integrated Vector System For The Eukaryotic Expression Of Antibodies Or Their Fragments After Selection From Phage Display Libraries)”,基因(Gene),187:9-18;伯顿(Burton),D.R.等人(1994)“来自 组合文库的人抗体(Human Antibodies From Combinatorial Libraries)”,免疫学进展 (Adv.Immunol.)57:191-280;PCT公开WO 92/001047;WO 90/02809;WO 91/10737;WO 92/01047;WO 92/18619;WO 93/11236;WO 95/15982;WO 95/20401;以及美国专利号5,698,426;5,223,409;5,403,484;5,580,717;5,427,908; 5,750,753;5,821,047;5,571,698;5,427,908;5,516,637;5,780,225;5,658,727; 5,733,743和5,969,108。
如上文参考文献中所述,在噬菌体选择之后,来自噬菌体的抗体编码区可以被分 离并且用于产生包括人源化抗体的全抗体或任何其他所希望的片段,并且表达在任何 所希望的宿主之中,包括哺乳动物细胞、昆虫细胞、植物细胞、酵母、以及细菌,例 如如下文详细描述的。例如,重组地产生Fab、Fab’以及F(ab’)2片段的技术还可以使 用本领域中已知的方法来加以采用。(诸如在以下中披露的那些,PCT公开WO 92/22324;马利纳克斯(Mullinax),R.L.等人.(1992)“一种异源二聚体Fab抗体蛋 白在一个克隆步骤中的表达(Expression Of A Heterodimeric Fab Antibody Protein In One Cloning Step)”,生物技术(BioTechniques),12(6):864-869;以及沙怀 (Sawai)等人(1995)“使用聚合酶链式反应以及cDNA表达载体直接生产源自于精 子固定抗体的Fab片段(Direct Production Of The Fab Fragment Derived From The Sperm Immobilizing Antibody Using Polymerase Chain Reaction And cDNA Expression Vectors)”,美国生殖免疫学杂志(Am.J.Reprod.Immunol.)34:26-34;以及贝特尔 (Better),M.等人(1988)“活性嵌合抗体片段的大肠杆菌分泌(Escherichia coli Secretion Of An Active Chimeric Antibody Fragment)”,科学(Science)240:1041- 1043)。可以用于产生单链Fv以及抗体的技术的实例包括描述于以下中的那些,美 国专利号4,946,778以及5,258,498;休斯顿(Huston),J.S.等人(1991)“单链Fv类 似物以及融合蛋白的蛋白质工程(Protein Engineering Of Single-Chain Fv Analogs And Fusion Proteins)”,酶学方法(Methods in Enzymology)203:46-88;舒(Shu),L. 等人,“从骨髓瘤细胞分泌单基因编码的免疫球蛋白(Secretion Of A Single-Gene- Encoded Immunoglobulin From Myeloma Cells)”,美国国家科学院院刊(Proc.Natl. Acad.Sci.(USA))90:7995-7999;以及斯凯拉(Skerra),A.等人(1988)“大肠杆 菌中的功能性免疫球蛋白Fv片段的装配(Assembly Of A Functional Immunoglobulin Fv Fragment In Escherichia coli)”,科学(Science)240:1038-1040。
噬菌体展示技术可以用于增加所披露的抗体对H7CR的亲和力。此技术在获得可 被用于这些组合方法的高亲和力抗体中是有用的。被称为亲和力成熟的技术采用诱变 或者CDR步移和重选择,使用此类受体或配体(或它们的细胞外域)或其抗原片段 来鉴别当与初始抗体或亲本抗体比较时以更高亲和力结合到该抗原的抗体(参见,例 如,格拉泽(Glaser),S.M.等人(1992)“在丝状噬菌体载体系统中通过基于密码子 的诱变进行的抗体工程”,免疫学杂志(J.Immunol.)149:3903-3913)。诱变整个密 码子而不是单个核芋酸产生了氨基酸突变的半随机谱。可构建由一组变体克隆所组成 的库,每一克隆都在单个CDR中相差单个氨基酸改变,并且这些克隆包含代表了每 个CDR残基的每个可能氨基酸取代的变体。可通过使固定化突变体与标记的抗原相 接触来筛选对抗原的结合亲和力增加的突变体。可使用本领域已知的任何筛选方法来 鉴定对抗原的亲和力增加的突变抗体(例如ELISA)(参见,例如,吴(Wu),H. 等人(1998)“Vitaxin,一种Alphavβ3特异性人源化Mab的逐步体外亲和力成熟 (Stepwise In Vitro Affinity Maturation Of Vitaxin,An Alphav Beta3-Specific Humanized Mab)”,美国国家科学院院刊(Proc.Natl.Acad.Sci.(USA))95(11):6037-6042; 耶尔顿(Yelton),D.E.等人(1995)“通过基于密码子的诱变进行的BR96抗癌抗体 的亲和力成熟(Affinity Maturation Of The BR96 Anti-Carcinoma Antibody By Codon- Based Mutagenesis)”,免疫学杂志(J.Immunol.)155:1994-2004)。可能可使用使 轻链随机化的CDR步移(参见,希尔(Schier)等人(1996)“通过在抗体结合部位 的中心的互补决定区的分子演化分离皮摩尔亲和力抗C-Erbb-2单链Fv(Isolation Of Picomolar Affinity Anti-C-Erbb-2 Single-Chain Fv By Molecular Evolution Of The Complementarity Determining Regions In The Center Of The Antibody Binding Site)”,分 子生物学(J.Mol.Biol.)263:551-567)。
随机诱变也可用于鉴定改进的CDR。噬菌体展示技术可替代地被用于增加(或降 低)CDR亲和力。被称为亲和力成熟的这种技术采用诱变或者“CDR步移”和重选 择,使用靶标抗原或其抗原片段来鉴别具有如下CDR的抗体,这些CDR当与初始抗 体或亲本抗体比较时以更高(或更低)亲和力结合到该抗原(参见,例如,格拉泽 (Glaser),S.M.等人(1992)“在丝状噬菌体载体系统中通过基于密码子的诱变进行 的抗体工程”,免疫学杂志(J.Immunol.)149:3903-3913)。诱变整个密码子而不是 单个核芋酸产生了氨基酸突变的半随机谱。可构建由一组变体克隆所组成的库,每一 克隆都在单个CDR中相差单个氨基酸改变,并且这些克隆包含代表了每个CDR残基 的每个可能氨基酸取代的变体。可通过使固定化突变体与标记的抗原相接触来筛选对 抗原的结合亲和力增加(或减少)的突变体。可使用本领域已知的任何筛选方法来鉴 定对抗原的亲和力增加(或减少)的突变抗体(例如ELISA)(参见,吴(Wu),H. 等人(1998)“Vitaxin,一种Alphavβ3特异性人源化Mab的逐步体外亲和力成熟 (Stepwise In Vitro Affinity Maturation Of Vitaxin,An Alphav Beta3-Specific Humanized Mab)”,美国国家科学院院刊(Proc.Natl.Acad.Sci.(USA))95(11):6037-6042; 耶尔顿(Yelton),D.E.等人(1995)“通过基于密码子的诱变进行的BR96抗癌抗体 的亲和力成熟(Affinity Maturation Of The BR96 Anti-Carcinoma Antibody By Codon- Based Mutagenesis)”,免疫学杂志(J.Immunol.)155:1994-2004)。可能可使用使 轻链随机化的CDR步移(参见,希尔(Schier)等人(1996)“通过在抗体结合部位 的中心的互补决定区的分子演化分离皮摩尔亲和力抗C-Erbb-2单链Fv(Isolation Of Picomolar Affinity Anti-C-Erbb-2 Single-Chain Fv By Molecular Evolution Of The Complementarity Determining Regions In The Center Of The Antibody Binding Site)”,分 子生物学(J.Mol.Biol.)263:551-567)。
用于完成此类亲和力成熟的方法描述于以下中,例如:克劳斯(Krause),J.C. 等人(2011)“使抗体结合部位构造变形的插入突变增强人抗体的功能(An Insertion Mutation That Distorts Antibody Binding Site Architecture Enhances Function Of A Human Antibody)”,MBio.2(1)pii:e00345-10.doi:10.1128/mBio.00345-10;库安 (Kuan),C.T.等人(2010)“靶标于恶性胶质瘤以及黑色素瘤的亲和力成熟的抗糖 蛋白NMB重组免疫毒素(Affinity-Matured Anti-Glycoprotein NMB Recombinant Immunotoxins Targeting Malignant Gliomas And Melanomas)”,国际癌症杂志(Int.J. Cancer)10.1002/ijc.25645;海克尔(Hackel),B.J.等人(2010)“稳定性以及CDR 组成偏移富集粘合剂功能性景观(Stability And CDR Composition Biases Enrich Binder Functionality Landscapes)”,分子生物学(J.Mol.Biol.)401(1):84-96;蒙哥马利 (Montgomery),D.L.等人(2009)“针对HIV-1 gp41的人类单克隆抗体的亲和力成 熟以及表征(Affinity Maturation And Characterization Of A Human Monoclonal Antibody Against HIV-1 gp41)”,MAbs 1(5):462-474;古斯特齐纳(Gustchina),E.等人 (2009)“通过源自于合成的原初人抗体文库的单克隆Fab的CDR-H2环的定向多样 化以及针对Gp41的内部三聚物的卷曲螺旋进行的亲和力成熟产生一组具有改进的 HIV-1中和效价以及幅度的Fab(Affinity Maturation By Targeted Diversification Of The CDR-H2 Loop Of A Monoclonal Fab Derived From A SyntheticHuman Antibody Library And Directed Against The Internal Trimeric Coiled-Coil Of Gp41 Yields A Set Of Fabs With Improved HIV-1 Neutralization Potency And Breadth)”,病毒学(Virology) 393(1):112-119;鳍片lay,W.J.等人(2009)“用于抗RAGE治疗的人源化大鼠抗 体的亲和力成熟:综合诱变揭示在互补决定区内部和外部两者的高水平的突变可塑性 (Affinity Maturation Of A Humanized Rat Antibody For Anti-RAGE Therapy: Comprehensive Mutagenesis Reveals A High Level Of Mutational Plasticity Both Inside And Outside The Complementarity-Determining Regions)”,分子生物学(J.Mol.Biol.)388 (3):541-558;波斯特朗(Bostrom),J.等人(2009)“改进抗体结合亲和力以及 特异性用于治疗性开发(Improving Antibody Binding Affinity And Specificity For Therapeutic Development)”,分子生物学方法525:353-376;史泰德(Steidl),S.等 人(2008)“通过定向CDR多样化进行人GM-CSF抗体的体外亲和力成熟”,分子免 疫学46(1):135-144;以及巴尔代雷斯(Barderas),R.等人(2008)“通过计算机 建模辅助的抗体亲和力成熟”,美国国家科学院院刊(Proc.Natl.Acad.Sci.(USA)) 105(26):9029-9034。
还提供了上述的抗体及其抗原结合片段中任一个的“衍生物”的产生以及使用。
术语“衍生物”是指免疫特异性地结合到一种抗原的一种抗体或其抗原结合片段, 但其相对于“亲本”(或野生型)分子包括一、二、三、四、五个或更多个氨基酸取 代、添加、缺失或修饰。此类氨基酸取代或添加可引入天然存在(即,DNA-编码 的)或非天然存在的氨基酸残基。术语“衍生物”包含例如,抗体1.3、4.5或7.8中任 一个的嵌合或人源化变体,连同具有改变的CH1、铰链、CH2、CH3或CH4区域的 变体,以形成例如具有展现增强或受损的效应子或结合特性的变体Fc区的抗体等。 术语“衍生物”另外包含非氨基酸修饰,例如氨基酸可通过已知的保护/阻滞基团、蛋白 质水解裂解而被糖基化(例如,具有改变的甘露糖、2-N-乙酰葡糖胺、半乳糖、果 糖、葡萄糖、唾液酸、5-N-乙酰神经氨酸、5-二醇神经氨酸等内容物)、乙酰化、聚 乙二醇化、磷酸化、酰胺化、衍生化,连接至细胞配体或其他蛋白等。在一些实施 例,该改变的碳水化合物修饰调节以下中一个或多个:溶解抗体,利于抗体的亚细胞 转运和分泌,促进抗体装配,构象完整性,以及抗体介导的效应子功能。在一个特定 实施例中,相对于缺少该碳水化合物修饰的抗体,该改变的碳水化合物修饰增强了抗 体介导的效应子功能。导致改变的抗体介导的效应子功能的碳水化合物修饰在本领域 中是众所周知的(例如,参见希尔兹(Shields),R.L.等人(2002)“人IgG N联寡糖 上岩藻糖的缺少改进了与人FcγRIII的结合以及抗体依赖性细胞毒性(Lack Of Fucose On Human IgG N-Linked Oligosaccharide Improves Binding To Human FcγRIII And Antibody-Dependent Cellular Toxicity.)”,生物化学杂志(J.Biol.Chem.)277(30): 26733-26740;戴维斯(Davies)J.等人(2001)“GnTIII在重组抗CD20CHO生产细 胞系中的表达:具有改变的糖型的抗体的表达通过对FCγRIII的更高亲和力导致 ADCC的增加(Expression Of GnTIII In A Recombinant Anti-CD20 CHO Production Cell Line:Expression Of Antibodies With Altered Glycoforms Leads To An Increase In ADCC Through Higher Affinity For FCγRIII)”,生物技术&生物工程74(4):288-294)。 改变碳水化合物含量的方法对于本领域的普通技术人员来说是已知的,参见,例如, 华力克(Wallick),S.C.等人(1988)“针对α(1----6)右旋糖酐的单克隆抗体的VH 残基的糖基化增加其对抗原的亲和力(Glycosylation Of A VH Residue Of A Monoclonal Antibody Against Alpha(1----6)Dextran Increases Its Affinity For Antigen)”,实验医学 杂志(J.Exp.Med.)168(3):1099-1109;涛(Tao),M.H.等人(1989)“对未糖 基化的嵌合的小鼠-人IgG的研究(Studies Of Aglycosylated Chimeric Mouse-Human IgG),碳水化合物在人IgG恒定区介导的结构以及效应子功能中的作用(Role Of Carbohydrate In The Structure And Effector Functions Mediated By The Human IgG Constant Region)”,免疫学杂志(J.Immunol.)143(8):2595-2601;劳特利奇 (Routledge),E.G.等人(1995)“无糖基化对人源化治疗性CD3单克隆抗体的免疫 原性的影响(The Effect Of Aglycosylation On The Immunogenicity Of A Humanized Therapeutic CD3 Monoclonal Antibody)”,移植60(8):847-53;艾略特 (Elliott),S.等人(2003)“通过糖工程学增强治疗性蛋白体内活性”,自然生物技术 (Nature Biotechnol.)21:414-21;希尔兹(Shields),R.L.等人(2002)“人IgG N 联寡糖上岩藻糖的缺少改进了与人FcγRIII的结合以及抗体依赖性细胞毒性(Lack Of Fucose On Human IgG N-Linked Oligosaccharide Improves Binding To Human FcγRIII And Antibody-Dependent Cellular Toxicity.)”,生物化学杂志(J.Biol.Chem.)277(30): 26733-26740)。
在一些实施例中,一种人源化抗体是一种衍生物。这种人源化抗体在一个或多个 非人CDR上包括氨基酸残基取代、缺失或添加。当与一种非衍生物人源化抗体比较 时,该人源化抗体衍生物可具有基本上相同的结合、更好的结合、或更差的结合。在 特定实施例中,该CDR的一、二、三、四、或五个氨基酸残基已被取代、缺失或添 加(即,突变)。
一种衍生物抗体或抗体片段可使用本领域的普通技术人员已知的技术通过化学修 饰进行修饰,这些技术包括但不限于,特异性的化学裂解、乙酰化、配制、衣霉素的 代谢合成等。在一个实施例中,一种抗体衍生物将与亲本抗体具有类似或相同的功 能。在另一个实施例中,一种抗体衍生物将展现相对于亲本抗体改变的活性。例如, 相比于亲本抗体,一种衍生物抗体(或其片段)可更紧密地结合到其表位或对蛋白水 解更加耐受。
在衍生化的抗体中的取代、添加或缺失可在该抗体的Fc区并且可由此起作用以 修饰该抗体至一个或多个FcγR的结合亲和力。用于修饰抗体(具有修饰的至一个或 多个FcγR的结合)的方法在本领域中是已知的,参见例如PCT公开号WO 04/029207、WO 04/029092、WO 04/028564、WO 99/58572、WO 99/51642、WO 98/23289、WO 89/07142、WO 88/07089、以及美国专利号5,843,597以及5,642,821。 一些实施例包含如下抗体,这些抗体的Fc区缺失(例如,一个Fab或F(ab)2等)或 被修饰,使得该分子展现减弱的或无Fc受体(FcR)结合活性,或展现增强的抗体依 赖性细胞介导的细胞毒性(ADCC)或补体依赖性细胞毒性(CDC)活性。一些实施 例包含如下抗体,这些抗体具有改变的对激活FcγR,例如FcγRIIIA的亲和力。优选 地,此类修饰也具有改变的Fc介导的效应子功能。影响Fc介导的效应子功能的修饰 在本领域中是众所周知的(参见美国专利号6,194,551,以及WO 00/42072)。在一个 具体实施例中,对Fc区的修饰得到如下的一种抗体,该抗体具有改变的抗体介导的 效应子功能、改变的与其他Fc受体(例如,Fc激活受体)的结合、改变的抗体依赖 性细胞介导的细胞毒性(ADCC)活性、改变的C1q结合活性、改变的补体依赖性细 胞毒性活性(CDC)、吞噬细胞活性、或其任何组合。
衍生化抗体可用于改变哺乳动物(优选地人)中的亲本抗体的半衰期(例如,血 清半衰期)。优选地,此类改变会使得半衰期超过15天,优选超过20天、超过25 天、超过30天、超过35天、超过40天、超过45天、超过2个月、超过3个月、超 过4个月或超过5个月。在哺乳动物(优选地人)中的人源化抗体或其片段的增加的 半衰期导致在该哺乳动物中所述抗体或抗体片段的更高血清滴度,并且因此减少给予 所述抗体或抗体片段的频度和/或减少待给予的所述抗体或抗体片段的浓度。具有增加 的体内半衰期的抗体或其片段可以通过本领域的普通技术人员已知的技术产生。例 如,具有增加的体内半衰期的抗体或其片段可以通过修饰(例如,取代、缺失或添 加)多个鉴别为涉及到Fc域与FcRn受体之间的相互作用中的氨基酸残基来产生。该 人源化抗体可被工程化以增加生物半衰期(参见,例如美国专利号6,277,375)。例 如,人源化抗体可在Fc-铰链域中被工程化以具有增加的体内或血清半衰期。
具有增加的体内半衰期的抗体或其片段可以通过将多聚体分子诸如高分子量聚乙 二醇(PEG)附接至所述抗体或抗体片段来产生。PEG可以在存在或不存在多官能连 接子的情况下,通过PEG与所述抗体或抗体片段的N末端或C末端的位点特异性轭 合或经由赖氨酸残基上存在的ε-氨基基团附接到所述抗体或抗体片段。可以使用使生 物活性的损失最少的线性或分支聚合物衍生化。可通过SDS-PAGE和质谱密切监测轭 合的程度,来确保PEG分子与抗体的正确轭合。未反应的PEG可以通过例如尺寸排 阻法或离子交换色谱法从抗体-PEG轭合物分离。
该抗体也可通过戴维斯(Davis)等人(参见美国专利号4,179,337)所述的方法 以及偶联剂修饰,以提供可以注射到哺乳动物循环系统中而基本上无免疫原性应答的 组合物。
可以修饰这些人源化抗体的框架残基。框架区中的构架残基可以用来自CDR供 体抗体的相应残基取代,以改变,优选改进抗原结合。这些构架取代是通过本领域众 所周知的方法鉴定的,例如通过对CDR和构架残基的相互作用建模以鉴定对抗原结 合重要的构架残基,并且通过序列比较以鉴定在特定位置上的不寻常构架残基。(参 见,例如美国专利号5,585,089;和莱兴曼(Riechmann),L.等人(1988)“再成形人 抗体用于治疗(Reshaping Human Antibodies For Therapy)”,自然332:323-327)。
也提供了重组地融合或化学轭合(包括两者共价以及非共价轭合)到一个异源分 子(即不相关的分子)的抗人H7CR抗体(并且更优选地,人源化抗体)以及其抗原 结合片段。该融合未必需要直接进行,而是可以通过接头序列发生。
在一个实施例中,此类异源分子是具有至少10、至少20、至少30、至少40、至 少50、至少60、至少70、至少80、至少90或至少100个氨基酸的多肽。此类异源 分子可以可替代地是酶、激素、细胞表面受体、药物部分,诸如:毒素(例如相思豆 毒素、蓖麻毒素A、假单胞菌外毒素(即,PE-40)、白喉毒素、蓖麻毒素、白树毒 素、或美洲商陆抗病毒蛋白),蛋白质(例如肿瘤坏死因子、干扰素(例如,α-干扰 素、β-干扰素)、神经生长因子、血小板衍生的生长因子、组织纤溶酶原激活剂、或 凋亡剂(例如,肿瘤坏死因子-α、肿瘤坏死因子-β)),生物反应调节剂(诸如,例 如淋巴因子(例如,白细胞介素-1(“IL-1”)、白细胞介素-2(“IL-2”)、白细胞介素- 6(“IL-6”))、粒细胞巨噬细胞集落刺激因子(“GM-CSF”)、粒细胞集落刺激因子 (“G-CSF”)、或巨噬细胞菌落刺激因子(“M-CSF”))、或生长因子(例如,生长 激素(“GH”))),细胞毒素(例如,细胞抑制剂或杀细胞剂,诸如紫杉醇、细胞 松弛素B、短杆菌肽D、溴化乙锭、吐根碱、丝裂霉素、依托泊苷、替尼泊苷 (tenoposide)、长春新碱、长春碱、秋水仙碱、阿霉素、柔红霉素、二羟基炭疽菌素 二酮、米托蒽醌、光辉霉素、放线菌素D、1-去氢睾酮、糖皮质激素、普鲁卡因、丁 卡因、利多卡因、普萘洛尔、和嘌呤霉素及其类似物或同源物),抗代谢物(例如, 甲氨蝶呤、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷、5-氟尿嘧啶达卡巴嗪(5-fluorouracil decarbazine)),烷基化剂(例如,氮芥(mechlorethamine)、苯丁酸氮芥(thioepa chlorambucil)、美法仑、(卡莫司汀;BSNU)和洛莫司汀(CCNU)、环磷 酰胺、白消安、二溴甘露醇、链脲霉素、丝裂霉素C和顺二氯二氨钼(II)(DDP) 顺钼),蒽环类抗生素(例如柔红霉素(以前的道诺霉素)和多柔比星),抗生素 (例如,更生霉素(dactinomycin)(以前的放线菌素(actinomycin))、博来霉 素、光辉霉素和安曲霉素(AMC)),或抗有丝分裂剂(例如长春新碱和长春碱)。
用于使这种治疗部分轭合至抗体的技术是熟知的;参见例如,阿尔农(Arnon) 等人,“癌症治疗中用于药物的免疫靶向的单克隆抗体(Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy)”,单克隆抗体和癌症治疗(Monoclonal Antibodies And Cancer Therapy),莱斯菲尔德(Reisfeld)等人(编辑),1985,第 243-56页,艾伦R.利斯有限公司(Alan R.Liss,Inc.);赫尔斯特伦(Hellstrom)等 人,“用于药物递送的抗体(Antibodies For Drug Delivery)”,控制药物递送 (Controlled Drug Delivery)(第2版),罗宾逊(Robinson)等人(编辑),1987, 第623-53页,马塞尔德克有限公司(Marcel Dekker,Inc.);索普(Thorpe),“癌症 治疗中细胞毒性剂的抗体载体:评论(Antibody Carriers Of Cytotoxic Agents In Cancer Therapy:A Review)”,单克隆抗体'84:生物和临床应用(Monoclonal Antibodies '84:Biological And Clinical Applications),平凯拉(Pinchera)等人(编辑),1985, 第475-506页;“癌症治疗中放射性标记抗体的治疗用途的分析、结果、以及未来前景 (Analysis,Results,And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy)”,用于癌症检测和治疗的单克隆抗体(Monoclonal Antibodies For Cancer Detection And Therapy),鲍德温(Baldwin)等人(编辑), 1985,第303-16页,学术出版社(Academic Press);以及索普等人(1982)“抗体-毒 素轭合物的制备和细胞毒性特性(The Preparation And Cytotoxic Properties Of Antibody- Toxin Conjugates)”,免疫学评论(Immunol.Rev.)62:119-158。
在一个实施例中,该抗体或融合分子包括一个Fc部分。此类分子的Fc部分可按 照同种型或子类而不同,可以是嵌合体或杂合体,和/或可经过修饰以便例如改进效应 子功能、控制半衰期、组织可接近性、增进生物物理特性例如稳定性,并且改进产生 效率(并且成本更小)。在构建所披露的融合蛋白中有用的许多修饰以及制备它们的 方法在本领域是已知的,参见例如穆勒(Mueller),J.P.等人(1997)“具有嵌合的 IgG2/G4恒定区的人源化猪VCAM特异性单克隆抗体阻滞人白细胞结合到猪内皮细胞 (Humanized Porcine VCAM-Specific Monoclonal Antibodies With Chimeric IgG2/G4 Constant Regions Block Human Leukocyte Binding To Porcine Endothelial Cells)”,分子 免疫学(Mol.Immun.)34(6):441-452,斯旺(Swann),P.G.(2008)“对于开发 治疗性单克隆抗体的考虑(Considerations For The Development Of Therapeutic Monoclonal Antibodies)”,当前免疫学观点(Cur.Opin.Immun.)20:493-499 (2008),以及帕斯塔(Presta),L.G.(2008)“治疗性抗体的分子工程以及设计 (Molecular Engineering And Design Of Therapeutic Antibodies)”,当前免疫学观点 (Cur.Opin.Immun.)20:460-470。在一些实施例中,该Fc区为天然IgG1、IgG2或 IgG4 Fc区。在一些实施例中,该Fc区是杂合体,例如由IgG2/IgG4 Fc恒定区组成的 嵌合体。该Fc区的修饰包括但不局限于:IgG4被修饰以阻止与Fcγ受体和补体的结 合,IgG1被修饰以改进与一种或多种Fcγ受体的结合,IgG1被修饰以最小化效应因 子功能(氨基酸变化),IgG1具有改变的/不具有聚糖(典型地通过改变表达宿 主),以及IgGl具有与FcRn的改变的pH-依赖性结合,以及IgG4在绞链区的氨基酸 残基#228处的丝氨酸改变为脯氨酸(S228P)以增强稳定性。该Fc区可以包括整个铰 链区,或不足整个铰链区。
对于与个体的Fcγ受体的等位基因变体(这些变体对于人IgG1的Fc域具有不同 的内在亲和力)表达相关的非霍奇金氏淋巴瘤或瓦尔登斯特伦氏巨球蛋白血症,在用 利妥昔单抗(一种针对CD20的嵌合小鼠/人IgG1单克隆抗体)治疗的患者中的治疗 成果。具体而言,具有低亲和力激活型Fc受体CD16A(FcγRIIIA)的高亲和力等位 基因的患者显示更高的反应率,并且在非霍奇金氏淋巴瘤的情况下显示改进的无进展 生存期。在另一个实施例中,Fc域可以包含一个或多个氨基酸插入、缺失或取代,这 些插入、缺失或取代减少与低亲和力抑制性Fc受体CD32B(FcγRIIB)的结合,并且 保持野生型水平的与低亲和力激活型Fc受体CD16A(FcγRIIIA)的结合或增强与之 的结合。
另一个实施例包括IgG2-4杂合体和IgG4突变体,它们具有降低的与FcR的结 合,这增加了它们的半衰期。代表性IgG2-4杂合体和IgG4突变体描述于安盖尔 (Angal),S.等人(1993)“单个氨基酸取代消除了嵌合的小鼠/人(Igg4)抗体的异 质性(A Single Amino Acid Substitution Abolishes The Heterogeneity Of Chimeric Mouse/Human(Igg4)Antibody)”,分子免疫学(Molec.Immunol.)30(1):105- 108;穆勒(Mueller),J.P.等人(1997)“具有嵌合的Igg2/G4恒定区的人源化猪 VCAM特异性单克隆抗体阻滞人白细胞结合到猪内皮细胞(Humanized Porcine VCAM-Specific Monoclonal Antibodies With Chimeric IgG2/G4 Constant Regions Block Human Leukocyte Binding To Porcine Endothelial Cells)”,分子免疫学(Mol. Immun.)34(6):441-452;以及美国专利号6,982,323。在一些实施例中,该IgG1 和/或IgG2域是缺失的,例如,安盖尔,s.等人描述了丝氨酸241替换为脯氨酸的 IgG1和IgG2。
在一个优选实施例中,Fc域含有氨基酸插入、缺失或取代,这些插入、缺失或取 代增强与CD16A的结合。在人IgG1的Fc域内增加与CD16A的结合并且减少与 CD32B的结合的大量取代在本领域是已知的并且描述于斯塔文哈根 (Stavenhagen),J.B.等人(2007)“治疗性抗体的Fc优化通过低亲和力激活型Fcγ 受体增强其体外杀死肿瘤细胞并且控制肿瘤体内扩展的能力”,癌症研究(Cancer Res.)57(18):8882-8890。具有降低的与CD32B的结合和/或增加的与CD16A的 结合的人类IgG1 Fc域的示例性变体包含F243L、R929P、Y300L、V305I或P296L取 代。这些氨基酸取代可按任何组合存在于人IgG1 Fc域中。在一个实施例中,该人 IgG1 Fc域变体含有F243L、R929P以及Y300L取代。在另一个实施例中,该人IgG1 Fc域变体含有F243L、R929P、Y300L、V305I以及P296L取代。在另一个实施例 中,该人IgG1 Fc域变体含有N297Q取代,因为这个突变消除FcR结合。
所述的分子中的任一个可以融合到标记序列(如一种肽)以促进纯化。在优选的 实施例中,标记氨基酸序列是一种六-组氨酸肽,即血球凝集素“HA”标签,其对应于 源自于流感血球凝集素蛋白的表位(威尔逊(Wilson),I.A.等人(1984)“抗原决定 簇在蛋白中的结构(The Structure Of An Antigenic Determinant In A Protein)”,细胞, 37:767-778)并且“flag”标签(克纳皮克(Knappik),A.等人(1994)“基于FLAG 肽的改进的亲和力标签用于重组抗体片段的检测以及纯化(An Improved Affinity Tag Based On The FLAG Peptide For The Detection And Purification Of Recombinant Antibody Fragments)”,生物技术17(4):754-761)。
这些抗体或其抗原结合片段可以轭合至一种诊断或治疗剂或任何其他希望血清半 衰期增加的分子。这些抗体可诊断地使用(体内、原位或体外)以例如作为一个临床 测试程序的部分监测一种疾病、失调或感染的发展或进展,例如以确定给定治疗方案 的效力。通过使抗体偶联到可检测物质上可以促进检测。可检测物质的实例包括各种 酶、辅基、荧光物质、发光物质、生物发光物质、放射性材料、正电子发射金属以及 非放射性顺磁金属离子。该可检测物质可被直接偶联或轭合至该抗体,或使用本领域 中已知的技术间接通过一个中间体(诸如,例如本领域中已知的一个接头)进行。参 见例如美国专利号4,741,900关于可以轭合至抗体用作诊断剂的金属离子。可通过将 抗体与可检测物质偶联完成这种诊断和检测,所述可检测物质包括但不限于各种酶, 酶包括但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、或乙酰胆碱酯酶;辅 基复合体,诸如但不限于抗生蛋白链菌素/生物素以及抗生物素蛋白/生物素;荧光材 料,诸如但不限于伞形酮、荧光素、异硫氰酸荧光素、若丹明、二氯三唤胺荧光素、 丹磺酰氯或藻红蛋白;发光材料,诸如但不限于发光胺;生物发光材料,诸如但不限 于荧光素酶、荧光素、以及水母发光蛋白;放射性材料,诸如但不限于铋(213Bi), 碳(14C),铬(51Cr),钴(57Co),氟(18F),钆(153Gd,159Gd),镓(68Ga, 67Ga),锗(68Ge),钬(166Ho),铟(115In,113In,112In,111In),碘(131I,125I, 123I,121I),镧(140La),镏(177Lu),锰(54Mn),钼(99Mo),钯(103Pd),磷 (32P),镨(142Pr),钷(149Pm),铼(186Re,188Re),铑(105Rh),钌 (97Ru),钐(153Sm),钪(47Sc),硒(75Se),锶(85Sr),硫(35S),锝 (99Tc),铊(201Ti),锡(113Sn,117Sn),氚(3H),氙(133Xe),镱(169Yb, 175Yb),钇(90Y),锌(65Zn);使用不同正电子发射断层扫描以及非放射性顺磁 金属离子的正电子发射金属。
这些分子可以是轭合至一种第二抗体以形成一种抗体杂轭合物,如通过西格尔 (Segal)在美国专利号4,676,980中所述的。此类杂轭合物抗体可另外结合到半抗原 (例如荧光素等),或结合到细胞标记物(例如4-1-BB、B7-H4、B7-H7、CD4、 CD8、CD14、CD25、CD27、CD40、CD68、CD163、CTLA4、GITR、LAG-3、 OX40、TIM3、TIM4、TLR2、LIGHT等)或结合到细胞因子(例如IL-7、IL-15、IL- 12、IL-4TGF-β、IL-10、IL-17、IFNg、Flt3、BLys)或趋化因子(例如CCL21)等。
这些分子可被附接至固相支撑体,其对于靶标抗原或能够结合到靶标抗原的其他 分子的免疫测定或纯化是特别有用的,该靶标抗原已通过结合到一种抗体或抗原结合 片段而固定到支撑体上。此类固相支持体包括但不限于,玻璃、纤维素、聚丙烯酰 胺、尼龙、聚苯乙烯、聚氯乙烯或聚丙烯。
也提供了编码任何此类抗体、融合蛋白或片段的核酸分子(DNA或RNA),连 同能够在一个细胞系中传递或复制此类核酸分子并且表达此类抗体、融合蛋白或片段 的载体分子(例如质粒)。这些核酸可以是单链的、双链的,可包含单链以及双链部 分两者。
D.优选的调节剂组合物
如此处使用的术语“调节”涉及改变效果或结果的能力。具体而言,一种抗人 H7CR抗体的一种人源化变体或其免疫特异性地结合人H7CR的抗原结合片段中的任 一个或物理特异性地结合H7CR的分子,能够调节H7CR及其同源配体之间的结合和/ 或调节作为H7CR–同源配体结合的结果发生的信号转导。
该抗体可以是一种激动H7CR的激动剂抗体。激动抗体可结合H7CR并且通过 H7CR刺激信号转导。
在一个实施例中,这些抗体或其免疫特异性地结合到H7CR的片段或融合分子基 本上在体外或在受体受试者或患者中并不能够阻滞H7CR与B7-H7的相互作用。如此 处使用的,“基本上不能够阻滞H7CR与B7-H7相互作用”的一个分子表示这种分子 的存在将H7CR-B7-H7相互作用衰减了少于50%,更优选地少于40%,仍更优选地少 于30%,仍更优选地少于20%,仍更优选地少于10%,仍更优选地少于5%,仍更优 选地少于1%,并且最优选地完全不能衰减这种相互作用,如通过此处披露的测定中 任一项测量的。此类抗体、片段以及融合分子作为治疗剂或在针对H7CR(或B7- H7)表达的诊断、细胞学和组织学测定上具有特别的效用。此外,具有增加的结合 B7-H7或其他细胞配体或受体的能力的多特异性抗H7CR抗体、抗H7CR抗原结合片 段及其各自的融合产物在利于将表达此类配体或受体的细胞共定位至表达H7CR的细 胞中具有特别的效用。
在一个第二实施例中,这些抗体、或其片段、或融合分子免疫特异性地结合到 H7CR并且能够在体外或在受体受试者或患者中基本上阻滞H7CR与B7-H7的相互作 用。如此处使用的,“能够基本上阻滞H7CR与B7-H7相互作用”的一个分子表示提 供此类分子将H7CR-B7-H7相互作用衰减了超过50%,更优选地超过60%,超过 70%,超过80%,超过90%,超过95%,超过99%或最优选地完全衰减此类相互作 用,如通过此处披露的测定中任一项测量的。此类抗体、片段以及融合分子在衰减 B7-H7-H7CR相互作用的生物效应上具有特别的效用。
一个优选实施例提供了人源化抗体以及片段或人抗体以及片段。
最优选地,当以内源浓度表达并且排列于受试者的细胞的表面时,此类分子将具 有足够的亲和力以及亲合力以能够结合到H7CR。术语“内源浓度”是指如下的水平, 在此水平一个分子在正常的、癌症或病原体感染的细胞中是天然表达的(即,在不存 在表达载体或重组启动子的情况下)。
(1)优选的啮齿动物抗人H7CR抗体及其CDR
此类分子可以通过以下方式产生:针对产生对人H7CR是免疫特异性的抗体的那 些来筛选杂交瘤系,并且然后任选地在此细胞系中针对展现调节活性(例如,中和活 性、激动活性,改变的信号转导活性等)的那些进行筛选。在一个实施例中,这些抗 体是仓鼠抗人H7CR克隆:1.3、4.5以及7.8。这些抗体能够结合到人H7CR并且基本 上不能够阻滞H7CR与B7-H7相互作用。对由这些抗人H7CR克隆表达的抗体进行测 序以揭示其可变域。这些可变域的CDR序列以加粗和加下划线示出:
抗人H7CR克隆1.3
轻链可变区:
重链可变区:
抗人H7CR克隆4.5
轻链可变区:
重链可变区:
抗人H7CR克隆7.8
轻链可变区:
重链可变区:
(2)这些抗人H7CR抗体的共有CDR
对所鉴定的抗体的CDR进行分析,以鉴定共有CDR序列以及可能的会提供类似 结合属性的变体CDR序列。使用Blosum62.iij分析根据表1计算此类变体CDR。表1 示出了该Blosum62.iij取代得分。得分越高取代越保守,并且因此更加可能地,该取 代将不会影响功能。
披露了具有1、2、3、4、5或6个变体CDR的抗体和抗原结合片段。鉴定相当 多的不同的CDR允许识别如下CDR残基,这些CDR残基很可能需要处于特别鉴定 的CDR的任何变体中。此类残基以粗体显示在表2和表3中。对于那些被发现在比 较的CDR中变化的残基,表1的取代得分提供了用于确定被允许的取代的身份的方 法。例如,如果一个具体的CDR的一个具体的残基被发现变化为R或S,那么由于 R和S具有-1的取代得分,R或S的具有-1或更大的取代得分的任何取代很可能作为 观察变体(R或S)(或比R或S更多可能性)以建立具有与该具体的CDR的结合属 性充分地类似的结合属性的变体CDR,以允许该变体CDR的替代使用,以形成一种 功能性抗H7CR抗体或抗原结合片段。对于每个位置,具有更高取代得分的残基的选 择的优选性超过了具有更低取代得分的残基的选择。
表2示出了对这些抗H7CR抗体的轻链CDR的分析,并且提供了所观察的以及 优选的变体轻链(“LC”)抗H7CR CDR的共有序列。
表3示出了对这些抗H7CR抗体的重链CDR的分析,并且提供了所观察的以及 优选的变体抗H7CR重链(“HC”)CDR的共有序列。
因此,除具有抗H7CR抗体1.3、4.5以及7.8的CDR的抗体及其抗原结合片段 外,也提供了具有如下CDR的抗体及其抗原结合片段,这些CDR具有上述的轻链和/ 或重链共有序列。
这些抗体或其片段包括展现与H7CR免疫特异性结合的且与由以上克隆中任一个 产生的仓鼠单克隆抗体的可变重链和/或轻链的氨基酸序列至少45%、至少50%、至 少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少 90%、至少95%、或至少99%一致的可变重链和/或可变轻链的氨基酸序列。此外,这 些抗体或其片段可包括展现与H7CR免疫特异性结合的且与以上列出的克隆的CDR 的氨基酸序列至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、 至少75%、至少80%、至少85%、至少90%、至少95%、或至少99%一致的CDR。 两种氨基酸序列的百分比同一性的确定可以由BLAST蛋白比较来确定。
在一个特定实施例中,一种抗体或其一个抗原结合片段包含上述优选抗体中的 一、二、三、四、五、或更优选地所有6个CDR并且将展现结合至人H7CR的能力。
(3)优选的人源化抗人H7CR抗体及其CDR
制备了抗人H7CR抗体1.3和4.5的多个优选轻链以及重链人源化衍生物。
(a)抗人H7CR抗体1.3的人源化变体
抗人H7CR抗体1.3的优选的人源化变体的轻链可变区的氨基酸序列(源自于 IGKV4-1*01受体框架)如下示出(CDR被加下划线示出):
1.VL1A IGKV4-1*01(人源化1):
2.VL1B IGKV4-1*01(人源化2):
3.VL1C IGKV4-1*01(人源化3):
抗人H7CR抗体1.3的优选的人源化变体的轻链可变区的氨基酸序列(源自于 IGKV2D-28*01受体框架)如下示出(CDR被加下划线示出):
1.VL2A IGKV2D-28*01(人源化1):
2.VL2B IGKV2D-28*01(人源化2):
3.VL2C IGKV2D-28*01(人源化3):
抗人H7CR抗体1.3的优选的人源化变体的重链可变区的氨基酸序列(源自于 IGHV4-31*02受体框架)如下示出(CDR被加下划线示出):
1.VH1A IGHV4-31*02(人源化1):
2.VH1B IGHV4-31*02(人源化2):
3.VH1C IGHV4-31*02(人源化3):
抗人H7CR抗体1.3的优选的人源化变体的重链可变区的氨基酸序列(源自于 AAY33199.1受体框架)如下示出(CDR被加下划线示出):
1.VH2A AAY33199.1(人源化1):
2.VH2B AAY33199.1(人源化2):
3.VH2C AAY33199.1(人源化3):
这些抗体及其抗原结合片段可包括抗人H7CR抗体1.3的上述人源化变体的36 个组合中的任一个。确切地,此类抗体包括示于表4中的组合:
(b)抗人H7CR抗体4.5的人源化变体
抗人H7CR抗体4.5的优选的人源化变体的轻链可变区的氨基酸序列(源自于 IGKV4-1*01受体框架)如下示出(CDR被加下划线示出):
1.VL1A IGKV4-1*01(人源化1):
2.VL1B IGKV4-1*01(人源化2):
3.VL1C IGKV4-1*01(人源化3):
抗人H7CR抗体4.5的优选的人源化变体的轻链可变区的氨基酸序列(源自于 IGKV2D-40*01受体框架)如下示出(CDR被加下划线示出):
1.VL2A IGKV2D-40*01(人源化1):
2.VL2B IGKV2D-40*01(人源化2):
3.VL2C IGKV2D-40*01(人源化3):
抗人H7CR抗体1.3的优选的人源化变体的重链可变区的氨基酸序列(源自于 IGHV4-31*02受体框架)如下示出(CDR被加下划线示出):
1.VH1A IGHV4-31*02(人源化1):
2.VH1B IGHV4-31*02(人源化2):
3.VH1C IGHV4-31*02(人源化3):
抗人H7CR抗体1.3的优选的人源化变体的重链可变区的氨基酸序列(源自于 IGHV2-5*01受体框架)如下示出(CDR被加下划线示出):
1.VH2A IGHV2-5*01(人源化1):
2.VH2B IGHV2-5*01(人源化2):
3.VH2C IGHV2-5*01(人源化3):
这些抗体及其抗原结合片段可包括抗人H7CR抗体4.5的上述人源化变体的36个 组合中的任一个。确切地,此类抗体包括示于表5中的组合:
所披露的抗体或其片段包括展现与人H7CR免疫特异性结合的且与由以上克隆中 任一个产生的小鼠单克隆抗体的可变重链和/或轻链的氨基酸序列至少45%、至少 50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少 85%、至少90%、至少95%、或至少99%一致的可变重链和/或可变轻链的氨基酸序 列。其他抗体或其片段包括展现与H7CR免疫特异性结合的且与以上列出的克隆的 CDR的氨基酸序列至少45%、至少50%、至少55%、至少60%、至少65%、至少 70%、至少75%、至少80%、至少85%、至少90%、至少95%、或至少99%一致的 CDR。两种氨基酸序列的百分比同一性的确定可以由BLAST蛋白比较来确定。
在一个优选实施例中,该抗体是包括一、二或三个轻链CDR以及一、二或三个 重链CDR(最优选地三个轻链CDR以及三个重链CDR)的一个人源化免疫球蛋白分 子(例如抗体、双抗体、融合蛋白等),其中这些轻链CDR包括:
(1)抗人H7CR抗体1.3的一种人源化变体的轻链CDR1;
(2)抗人H7CR抗体4.5的一种人源化变体的轻链CDR2;
(3)抗人H7CR抗体7.8的一种人源化变体的轻链CDR3;
(4)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的轻链CDR1以及轻链 CDR2;
(5)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的轻链CDR1以及轻链 CDR3;
(6)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的轻链CDR2以及轻链 CDR3;
或
(7)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的轻链CDR1、轻链 CDR2以及轻链CDR3。
在一个可替代的优选实施例中,该人源化免疫球蛋白分子包括一、二或三个轻链 CDR以及一、二或三个重链CDR(最优选地三个轻链CDR以及三个重链CDR), 其中这些重链CDR包括:
(1)抗人H7CR抗体1.3的一种人源化变体的重链CDR1;
(2)抗人H7CR抗体4.5的一种人源化变体的重链CDR2;
(3)抗人H7CR抗体7.8的一种人源化变体的重链CDR3;
(4)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的重链CDR1以及重链 CDR2;
(5)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的重链CDR1以及重链 CDR3;
(6)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的重链CDR2以及重链 CDR3;
或
(7)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的重链CDR1、重链 CDR2以及重链CDR3。
在一个特别优选的实施例中,该抗体是包括一、二或三个轻链CDR以及一、二 或三个重链CDR(最优选地三个轻链CDR以及三个重链CDR)的一个人源化免疫球 蛋白分子,其中这些轻链CDR包括:
(1)抗人H7CR抗体1.3的一种人源化变体的轻链CDR1;
(2)抗人H7CR抗体4.5的一种人源化变体的轻链CDR2;
(3)抗人H7CR抗体7.8的一种人源化变体的轻链CDR3;
(4)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的轻链CDR1以及轻链 CDR2;
(5)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的轻链CDR1以及轻链 CDR3;
(6)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的轻链CDR2以及轻链 CDR3;
或
(7)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的轻链CDR1、轻链 CDR2以及轻链CDR3,
并且其中这些重链CDR包括:
(1)抗人H7CR抗体1.3的一种人源化变体的重链CDR1;
(2)抗人H7CR抗体4.5的一种人源化变体的重链CDR2;
(3)抗人H7CR抗体7.8的一种人源化变体的重链CDR3;
(4)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的重链CDR1以及重链 CDR2;
(5)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的重链CDR1以及重链 CDR3;
(6)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的重链CDR2以及重链 CDR3;
或
(7)抗人H7CR抗体1.3、4.5或7.8的一种人源化变体的重链CDR1、重链 CDR2以及重链CDR3。
最优选地,此类CDR分别属于抗人H7CR抗体1.3、4.5或7.8的相同的人源化变 体。
在一个特定实施例中,一种抗体或一个抗原结合片段将包括抗人H7CR抗体 1.3、4.5或7.8的人源化变体的一、二、三、四、五、或更优选地所有6个CDR,并 且将展现与亲本抗体相同的结合至人H7CR的能力。
E.优选的组合物的治疗以及预防用途
如此处使用的,术语“治疗(treat、treating、treatment)”以及“治疗用途”是指 消除、减少或改善将从增加或降低的免疫应答受益的一种疾病或失调的一个或多个症 状。如此处使用的,“治疗有效量”是指一种治疗剂足够介导一个改变的免疫应答并且 更优选临床上相关的改变的免疫应答、足够介导一种疾病或病况的症状的减少或改善 的量。如果一个效果的量级足以影响接受者受试者的健康或预后的话,则该效果是临 床上相关的。治疗有效量可以是指治疗剂足以减少或最小化疾病进展,例如延迟或最 小化癌的传播的量。治疗有效量还可以是指在疾病的治疗或管理中提供治疗益处的治 疗剂的量。进一步地,针对治疗剂的治疗有效量意指治疗剂单独或与其他疗法组合在 疾病的治疗或管理中提供治疗益处的量,该治疗益处是例如,足以增强一种治疗性抗 体的治疗效力,足以治疗或管理一种疾病。
如此处使用的,术语“预防剂”是指可在检测到一种失调或疾病的任何症状之前在 预防这种失调或疾病中使用的一种药剂。“预防有效”量是足够介导这种保护的预防剂 的量。预防有效量还可以是指在疾病的预防中提供预防益处的预防剂的量。进一步 地,针对预防剂的预防有效量意指预防剂单独或与其他药剂组合在疾病的预防中提供 预防益处的量。
此处提供的给药剂量和频率被术语治疗有效以及预防有效所包含。剂量以及频率 进一步将典型地根据对于每一位患者而言特定的因素而变化,取决于所给予的特定的 治疗性或预防性药剂,癌症的严重性和类型,给药途径,连同该患者的年龄、体重、 反应、以及既往病史。适宜的方案可以由本领域的普通技术人员通过考虑到此类因素 并且通过遵循例如文献中所报道的以及在医师手册(Physician's Desk Reference)(第 56版,2002)中所推荐的剂量进行选择。
1.免疫系统的上调剂的使用
一个实施例涉及H7CR-结合分子,诸如抗H7CR抗体(以及结合到H7CR的此类 抗体的片段)或B7-H7 Ig,其通过结合到H7CR而激动(即,增强)T细胞增殖和/或 细胞因子产生。向一个受试者给予此类分子上调该受试者的免疫系统。因为H7CR表 达与原初T细胞表型关联,给予此类分子将有效于增加T细胞引发和活化并且因此有 益于与疫苗组合。此外,激动的抗H7CR(和B7-H7 Ig)将非常有益于与靶标于免疫 检查点的分子组合,并抑制正常而言会降低免疫应答的受体:抗PD-1,抗B7-H1,抗 CTLA4等。将此类抗体依序给予可能更好,即,首先给予抗H7CR以增强T细胞引 发,随后给予例如抗PD-1,以防止T细胞耗尽。也设想了靶标于H7CR的双特异性 分子以及免疫检查点阻滞。
免疫系统的上调在治疗癌症以及慢性感染(例如,HIV感染、AIDS等)中是特 别希望的,并且因此所披露的分子在治疗此类失调上具有效用。巨噬细胞已显示显著 有助于HIV感染的初始步骤(卡特(Carter),C.A.等人(2008)“巨噬细胞的HIV-1 感染的细胞生物学(Cell Biology Of HIV-1 Infection Of Macrophages)”,微生物学年报 综述(Ann.Rev.Microbiol.)62:425-443;努尔萨迪吉(Noursadeghi),M.等人 (2006)“单核巨噬细胞细胞的HIV-1感染:AIDS中细菌性先天免疫缺陷的情况 (HIV-1 Infection Of Mononuclear Phagocytic Cells:The Case For Bacterial Innate Immune Deficiency In AIDS)”,柳叶刀传染病(Lancet Infect.Dis.)6:794-804)。因 此,结合B7-H7的抗体(特别地如果轭合至一种毒素的话)在预防或治疗HIV感染 中具有效用。
如此处使用的,术语“癌症”是指起因于细胞的非正常不受控制的生长的一种赘生 物或肿瘤。如此处使用的,癌症明确地包括白血病以及淋巴瘤。该术语是指涉及如下 细胞的一种疾病,所述细胞具有转移至末端位点的潜力,并且展现与非癌细胞不同的 表型性状,例如,在一种三维基质诸如软琼脂中形成集落或在一种三维基底膜或细胞 外基质制品中形成管状网络或网状矩阵。非癌细胞不在软琼脂中形成集落和在一种三 维基底膜或细胞外基质制品中形成不同的球体样结构。
可以治疗或预防的癌症和相关失调包括但不限于以下:白血病,包括但不限于急 性白血病,急性淋巴细胞性白血病、急性髓细胞性白血病(诸如成髓细胞性、早幼粒 细胞性、髓单核细胞性、单核细胞性、红白血病(erythroleukemia leukemias)以及骨 髓增生异常综合症),慢性白血病,诸如但不限于慢性髓细胞性(粒细胞性)白血 病、慢性淋巴细胞性白血病、毛细胞白血病;真性红细胞增多症;淋巴瘤,诸如但不 限于霍奇金氏病、非霍奇金氏病;多发性骨髓瘤,诸如但不限于焖燃型多发性骨髓 瘤、非分泌性骨髓瘤、骨硬化性骨髓瘤、浆细胞白血病、孤立性浆细胞瘤以及髓外型 浆细胞瘤;瓦尔登斯特伦氏巨球蛋白血症;意义未明的单克隆丙种球蛋白病;良性单 克隆丙种球蛋白病;重链病;骨和结缔组织肉瘤,诸如但不限于骨肉瘤、骨原性肉 瘤、软骨肉瘤、尤因氏肉瘤、恶性巨细胞瘤、骨纤维肉瘤、脊索瘤、骨膜肉瘤、软组 织肉瘤、血管肉瘤(血管内皮瘤)、纤维肉瘤、卡波西氏肉瘤、平滑肌肉瘤、脂肪肉 瘤、淋巴管肉瘤、神经鞘瘤、横纹肌肉瘤、滑膜肉瘤;脑肿瘤,包括但不限于胶质 瘤、星形细胞瘤、脑干神经胶质瘤、室管膜瘤、少突神经胶质瘤、非神经胶质瘤、听 神经瘤、颅咽管瘤、髓母细胞瘤、脑膜瘤、松果体细胞瘤、松果体母细胞瘤、原发性 脑淋巴瘤;乳房癌,包括但不限于腺癌、小叶(小细胞)癌、导管内癌、髓样乳腺 癌、粘液乳腺癌、管状乳腺癌、乳头状乳腺癌、佩吉特氏病、以及炎性乳腺癌;肾上 腺癌,包括但不限于嗜铬细胞瘤和肾上腺皮质癌;甲状腺癌,诸如但不限于乳头状或 滤泡状甲状腺癌、髓样甲状腺癌和未分化甲状腺癌;胰腺癌,包括但不限于胰岛瘤、 胃泌素瘤、胰高血糖素、舒血管肠肽瘤、生长抑素分泌肿瘤和类癌或胰岛细胞瘤;垂 体癌,包括但不限于库欣氏症、催乳素分泌肿瘤、肢端肥大症、和糖尿病尿崩症;眼 癌,包括但不限于眼黑色素瘤,如虹膜黑色素瘤、脉络膜黑色素瘤、和睫状体黑色素 瘤、以及视网膜母细胞瘤;阴道癌,包括但不限于鳞状细胞癌、腺癌、以及黑色素 瘤;外阴癌,包括但不限于鳞状细胞癌、黑色素瘤、腺癌、基细胞癌、肉瘤、以及佩 吉特病;宫颈癌,包括但不限于鳞状细胞癌、以及腺癌;子宫癌,包括但不限于子宫 内膜癌和子宫肉瘤;卵巢癌,包括但不限于卵巢上皮癌、交界瘤、生殖细胞瘤、以及 间质肿瘤;食道癌,诸如但不限于鳞癌、腺癌、腺样囊性癌、粘液表皮样癌、腺鳞 癌、肉瘤、黑色素瘤、浆细胞瘤、疣状癌、以及燕麦细胞(小细胞)癌;胃癌,诸如 但不限于腺癌、蕈伞型(息肉)、溃疡型、浅表扩散型、弥散扩散型、恶性淋巴瘤、 脂肉瘤、纤雏肉瘤以及癌肉瘤;结肠癌;直肠癌;肝癌,诸如但不限于肝细胞癌以及 肝母细胞瘤;胆囊癌,包括但不限于腺癌;胆管癌,包括但不限于乳头状、结节性以 及弥漫性;肺癌,包括但不限于非小细胞肺癌、鳞状细胞癌(上皮癌)、腺癌、大细 胞癌以及小细胞肺癌;睾丸癌,包括但不限于胚组织瘤、精原细胞瘤、退化发育、经 典(典型)、精母细胞瘤、非精原细胞瘤、胚胎癌、畸胎瘤癌、绒毛膜癌(卵黄囊肿 瘤);前列腺癌,包括但不限于腺癌,平滑肌肉瘤以及横纹肌肉瘤;阴茎癌(penal cancer);口癌,包括但不限于鳞状细胞癌;基底癌症;唾液腺癌症,包括但不限于 腺癌,粘液表皮样癌、以及腺样囊性癌;咽癌,包括但不限于鳞状细胞癌以及疣型; 皮肤癌,包括但不限于基底细胞癌、鳞状细胞癌以及黑色素瘤、浅表性扩散性黑色素 瘤、结节性黑色素瘤、小痣恶性黑色素瘤、肢端雀斑样黑色素瘤;肾癌,包括但不限 于肾细胞癌、腺癌、肾上腺样瘤、纤维肉瘤、移行细胞癌(肾盂和/或输尿管);韦尔 姆斯氏肿瘤;膀胱癌,包括但不限于移行细胞癌、鳞状细胞癌、腺癌、癌肉瘤。此 外,癌症包括粘液肉瘤、骨肉瘤、内皮肉瘤、淋巴管内皮肉瘤、间皮瘤、滑膜瘤、成 血管细胞瘤、上皮癌、囊腺癌、支气管癌、汗腺癌、皮脂腺癌、乳头状癌以及乳头状 腺癌(为了综述此类失调,参见菲什曼(Fishman)等人,1985,医药(Medicine), 第2版,J.B.利平科特公司(Lippincott Co.),费城(Philadelphia)以及墨菲 (Murphy)等人,1997,明智的决策:癌症诊断、治疗和恢复全书(Informed Decisions:The Complete Book of Cancer Diagnosis,Treatment,and Recovery),海盗 企鹅(Viking Penguin),美国企鹅图书公司,美利坚合众国)。
因此,所披露的方法以及组合物在治疗、抑制或预防多种癌或包括(但不限于) 以下的其他异常增生性疾病中也是有用的:癌,包括膀胱、乳房、结肠、肾、肝、 肺、卵巢、胰、胃、宫颈、甲状腺、以及皮肤的癌,包括鳞状细胞癌;淋巴系统的造 血肿瘤、包括白血病、急性淋巴细胞性白血病、急性成淋巴细胞白血病、B细胞淋巴 瘤、T细胞淋巴瘤、伯基特(Berketts)淋巴瘤、骨髓系统的造血细胞肿瘤,包括急性 以及慢性髓细胞白血病以及前髓细胞白血病;间质来源的肿瘤,包括纤维肉瘤以及横 纹肌肉瘤;其他肿瘤,包括黑色素瘤、精原细胞瘤、畸胎癌(tetratocarcinoma)、成 神经细胞瘤以及神经胶质瘤;中央以及外周神经系统肿瘤,包括星形胶质细胞瘤、成 神经细胞瘤、神经胶质瘤、以及神经鞘瘤;间质来源的肿瘤,包括纤维肉瘤 (fibrosafcoma)、横纹肌肉瘤(rhabdomyoscarama)、以及骨肉瘤;以及其他的肿 瘤,包括黑色素瘤、着色性干皮病(xenoderma pegmentosum)、角化棘皮瘤 (keratoactanthoma)、精原细胞瘤、甲状腺滤泡性癌症以及畸胎癌 (teratocarcinoma)。还考虑的是,由细胞凋亡失常引起的癌症也将通过所披露的方 法和组合物来治疗。此类癌症可以包括但不限于滤泡性淋巴瘤,伴有p53突变的癌, 乳腺、前列腺和卵巢的激素依赖性肿瘤以及癌前病变如家族性腺瘤样息肉病和脊髓发 育不良综合征。在特定实施例中,通过所披露的方法和组合物在卵巢、膀胱、乳腺、 结肠、肺、皮肤、胰腺、或子宫中治疗或预防恶性肿瘤或异常增殖性变化(如化生和 发育异常)或过度增殖性失调。在其他特定实施例中,通过所披露的方法和组合物治 疗或预防肉瘤、黑色素瘤、或白血病。
虽然通过不同机制,癌细胞在其发育过程中均获得一组特征性的功能能力。此类 能力包括逃避凋亡、生长信号上的自给自足、对抗生长信号不敏感、组织浸润/转移、 无限的发展潜力(explicative potential)、以及持续的血管生成。术语“癌细胞”意在包 含变恶性癌前细胞和恶性癌细胞两者。在一些实施例中,癌症是指良性瘤,其保持在 局部。在其他实施例中,癌症是指恶性肿瘤,其已经侵入和破坏邻近的身体结构并扩 散到远处部位。在又其他实施例中,该癌症与一种特异性癌抗原(例如,pan-癌抗原 (KS 1/4)、卵巢癌抗原(CA125)、前列腺特异性抗原(PSA)、癌胚抗原 (CEA)、CD19、CD20、HER2/neu等)关联。
类似于如上讨论的其在肿瘤上的应用,所披露的抗体和抗原结合片段可单独使 用,或作为一种佐剂与疫苗或抗微生物剂组合,以刺激针对如下的免疫应答:毒素或 自身抗原或病原体(例如,病毒,诸如HIV、HTLV、肝炎病毒、流行性感冒病毒、 呼吸道合胞病毒、牛痘病毒、狂犬病毒;细菌,诸如分枝杆菌、葡萄球菌、链球菌、 肺炎球菌、脑膜炎球菌、淋球菌(Conococci)、克雷白氏菌属、变形菌、沙雷氏菌 属、假单胞菌属、军团杆菌属、棒状菌、沙门氏菌、弧菌属、梭状芽孢杆菌、芽孢杆 菌、巴斯德菌属、细螺旋体病、博德特菌属的那些,并且具体地与霍乱、破伤风、肉 毒杆菌、炭疽、鼠疫、和莱姆病关联的此类病原体;或真菌或寄生病原体,诸如念珠 菌属(白色念珠菌、克鲁氏念珠菌、光滑念珠菌、热带念珠菌等)、新生隐球菌、曲 霉属(烟曲霉、黑曲霉等)、毛霉菌目的属(Genus Mucorales)(毛霉属、犁头霉 属、根霉菌属(rhizophus))、孢子丝菌(申克氏)、芽生菌(皮炎)、副球孢子菌 (巴西)、球孢子菌(粗)及组织胞浆菌(荚膜)、以及由以下寄生虫:内阿米巴属 (溶组织内(histolytica))、结肠小袋纤毛虫、福勒氏耐格里原虫、棘阿米巴属种、 兰伯贾第虫、隐孢子虫属种、卡氏肺囊虫、间日疟原虫、果氏巴贝虫、布氏锥虫、克 氏锥虫、冈氏(Toxoplasma gondi)等)、孢子丝菌属、芽生菌鼠、副球孢子菌属、 球孢子菌属、组织胞浆菌属、内阿米巴属(溶组织内(Histolytica))、肠袋虫属、 耐格里属、棘阿米巴属、贾第虫属、隐孢子虫属、肺囊虫属、疟原虫属、巴贝虫属、 或锥虫属等。因此,这些抗体和抗原结合片段在治疗感染性疾病中具有效用。
这些抗体和抗原结合片段的另一个用途是阻滞或消耗患有T细胞癌的患者中的T 细胞。在一个实施例中,此类阻滞或消耗是使用结合到邻近于H7CR与其配体的结合 位点的一个位点上的抗H7CR抗体完成的,使得正常的H7CR功能受损或破坏。作为 此类破坏的结果,消耗有效(功能性)浓度的T细胞。在一个优选实施例中,此类消 耗是使用轭合至一种毒素的抗H7CR抗体完成的,使得它们与T细胞的结合导致该细 胞的死亡。优选地,在任一个实施例中,该抗体的Fc区的序列已经缺失(例如,Fab 或F(ab)2等)或被修饰,使得该分子展现减弱的或无Fc受体(FcR)结合活性,或展 现增强的抗体依赖性细胞介导的细胞毒性(ADCC)或补体依赖性细胞毒性(CDC) 活性。
2.免疫系统的下调剂的使用
一个可替代的实施例涉及结合到B7-H7或H7CR Ig的分子,诸如抗B7-H7抗体 以及此类抗体的片段,其通过结合到B7-H7来拮抗(即,衰减或损坏)H7CR功能以 及T细胞增殖和/或细胞因子产生。向一个受试者给予此类分子下调该受试者的免疫 系统,并且对于治疗炎症或自身免疫是特别有用的。
另一个实施例提供如下抗体,这些抗体结合到H7CR并且阻滞配体与H7CR的相 互作用并且不激动H7CR。
下调免疫系统在治疗炎性疾病以及自身免疫疾病中是希望的。可通过给予这些抗 体治疗的自身免疫失调的实例包括但不限于斑形脱发、僵直性脊椎炎、抗磷脂综合 症、自身免疫性阿狄森氏病、肾上腺的自身免疫性疾病、自身免疫性溶血性贫血、自 身免疫性肝炎、自身免疫性卵巢炎以及睾丸炎、自身免疫性血小板减少症、白塞氏 病、大疱性类天疱疮、心肌病、乳糜湾性皮炎(celiac sprue-dermatitis)、慢性疲劳免 疫功能紊乱综合症(CFIDS)、慢性发炎性脱髓鞘性多发性神经病、丘-施二氏综合征 (Churg-Strauss syndrome)、瘢痕性类天疱疮、肢端硬化综合症(CREST syndrome)、冷凝集素疾病、克罗恩氏疾病、盘状狼疮、原发性混合型冷球蛋白血 症、纤维肌痛-纤维性肌炎、急性肾小球肾炎、格拉夫疾病、格林-巴利综合症 (guillain-barre)、桥本氏甲状腺炎(hashimoto's thyroiditis)、特发性肺纤维化、特 发性血小板减少性紫癜(ITP)、IgA神经病、青少年性关节炎、扁平苔癣、红斑狼 疮、耳性眩晕病、混合结缔组织病、多发性硬化症、视神经脊髓炎(NMO)、1型或 免疫介导的糖尿病、重症肌无力、寻常天疱疮、恶性贫血、多发性结节性动脉炎、多 发性软骨炎、多腺体综合症、风湿性多肌痛、多发性肌炎以及皮肤肌炎、原发性无丙 种球蛋白血症、夏科氏肝硬变、牛皮癣、牛皮癣性关节炎、雷诺氏现象(Raynaud' sphenomenon)、赖特氏综合症(Reiter's syndrome)、类风湿性关节炎、类肉瘤病、 硬皮病、修格连氏综合症、僵人综合症、全身性红斑狼疮、红斑狼疮、高安氏动脉炎 (Takayasu arteritis)、颞动脉炎/巨细胞性动脉炎、溃疡性结肠炎、葡萄膜炎、血管 炎如疱疹样皮炎血管炎、白癜风以及韦格纳氏肉芽肿(Wegener's granulomatosis)。
可预防、治疗或管理的炎性失调的实例包括但不限于哮喘、脑炎、发炎性肠病、 慢性阻塞性肺病(COPD)、过敏病症、败血性休克、肺纤维化、未分化的脊椎关节 炎(undifferentitated spondyloarthropathy)、未分化的关节炎、关节炎、炎性骨质溶解 以及慢性病毒性或细菌性感染所致的慢性炎症。
可采用所述的抗H7CR抗体来产生抗独特型肽或抗体(沃尔曼(Wallmann),J. 等人(2010)“过敏症中的抗Id:一个经典概念的及时性(Anti-Ids in Allergy: Timeliness of a Classic Concept)”,世界过敏症组织期刊(World Allergy Organiz.J.)3 (6):195–201;纳迪(Nardi),M.等人(2000)“针对血小板抗GpIIIa的抗独特型 抗体有助于调节HIV-1-ITP患者中的血小板减少(Antiidiotype Antibody Against Platelet Anti-GpIIIa Contributes To The Regulation Of Thrombocytopenia In HIV-1-ITP Patients)”,实验医学杂志(J.Exp.Med.)191(12):2093-2100)或H7CR的模拟 物(臧(Zang),Y.C.等人(2003)“由对应于髓鞘碱性蛋白-反应性T细胞中的常见 CDR3序列基序的TCR肽诱导的人抗独特型T细胞(Human Anti-Idiotypic T Cells Induced By TCR Peptides Corresponding To A Common CDR3 Sequence Motif In Myelin Basic Protein-Reactive T Cells)”,国际免疫杂志(Int.Immunol.)15(9):1073- 1080;洛伊阿罗(Loiarro),M.等人(电子出版2010年4月8日)“人类疾病中的靶 向TLR/IL-1R信号传导(Targeting TLR/IL-1R Signalling In Human Diseases)”,炎症 介质(Mediators Inflamm.)2010:674363)。此类分子充当H7CR的替代,并且因此 向一个受试者给予它们,通过结合B7-H7配体并防止它结合内源H7CR受体而下调该 受试者的免疫系统。此类分子在治疗移植物抗宿主病中具有效用。类似地,增强此类 抗体以及此类受体/配体之间的结合的激动剂抗体在作为H7CR信号传导的激动剂方面 具有效用,并因此在治疗炎症和自身免疫疾病中具有效用。
因此,这些抗体和抗原结合片段在治疗炎症性以及自身免疫疾病中具有效用。
F.给药方法
各种递送系统是己知的并且可以用于给予在此描述的治疗或预防组合物,例如, 封装在脂质体、微粒、微胶囊中、能够表达抗体或融合蛋白的重组细胞、受体介导的 内吞作用(参见,例如,吴(Wu)和吴(Wu),1987,生物化学杂志(J.Biol. Chem.)262:4429-4432)、构建作为一个逆转录病毒或其他载体的部分的核酸等。
给予一种人源化抗体的方法包括但不限于:肠胃外给予(例如,真皮内的、肌内 的、腹膜内的、静脉内的以及皮下的)、硬膜外给予、以及粘膜给予(例如,鼻内途 径和口腔途径)。在一个特定实施例中,所披露的抗体是经肌内、静脉内、或皮下给 药的。可以通过任何方便的途径给予这些组合物,例如通过输注或单次快速静脉注射 (bolus injection)、通过经由上皮或皮肤粘膜内层(例如口腔粘膜、直肠和肠道粘 膜,等等)吸收,并且可以将其与其他生物活性剂一起给予。给药可以是全身性的或 局部的。此外,也可以例如通过使用吸入器或雾化器以及具有雾化剂的配制品而采用 肺部给药。参见,例如美国专利号6,019,968;5,985,20;5,985,309;5,934,272; 5,874,064;5,855,913;5,290,540;以及4,880,078;以及PCT公开号WO 92/19244; WO 97/32572;WO 97/44013;WO 98/31346;以及WO 99/66903。在一个特定实施例 中,可能期望将该药物组合物局部给予到需要治疗的区域;这可以通过例如但不限于 下列方式实现:局部输注:通过注射或通过植入物的方式,所述植入物是多孔的、无 孔的或凝胶的材料,包括膜,例如硅橡胶(sialastic)膜,或纤维。优选地,当给予所 披露的抗体中的一个或多个时,必须注意使用不会吸收该抗体或该融合蛋白的材料。
在一些实施例中,该人源化或嵌合抗体是以脂质体配制用于靶向递送所披露抗 体。脂质体是由同心有序的磷脂双分子层组成的囊泡,其封装水相。脂质体典型地包 括不同类型的脂类、磷脂和/或表面活性剂。脂质体的组分是以双层构型安排的,类似 于生物膜的脂类安排。脂质体是特别优选的递送运载体,部分归因于其生物相容性、 低免疫原性、以及低毒性。用于制备脂质体的方法是本领域中已知的,参见,例如, 爱泼斯坦(Epstein)等人,1985,美国国家科学院院刊(Proc.Natl.Acad.Sci. USA),82:3688;黄(Hwang)等人,1980美国国家科学院院刊(Proc.Natl.Acad. Sci.USA),77:4030-4;美国专利号4,485,045以及4,544,545。
制备具有延长的血清半衰期即增强的循环时间的脂质体的方法,诸如披露于美国 专利号5,013,556中的那些,可用于产生抗体配制品。在所披露的方法中使用的优选 脂质体不是迅速地从循环中清除的,即未被吸收至单核吞噬细胞系统(MPS)中。该 脂质体包括立体稳定的脂质体,这些脂质体是使用本领域的普通技术人员已知的常见 方法制备的。尽管不旨在受具体作用机制的限制,立体稳定的脂质体包含具有体积大 且高度灵活的亲水部分的脂类组分,其减少脂质体与血清蛋白的不想要的反应,减少 血清组分的调理作用并且减少被MPS识别。优选地使用聚乙二醇制备立体稳定的脂 质体。对于制备脂质体以及立体稳定的脂质体,参见,例如,本达斯(Bendas)等 人,2001生物制药(BioDrugs),15(4):215-224;艾伦(Allen)等人,1987 FEBS通讯(FEBS Lett.)223:42-6;克立巴诺夫(Klibanov)等人,1990 FEBS通讯 (FEBS Lett.)268:235-7;布卢姆(Blum)等人,1990,生物化学和生物物理学学 报(Biochim.Biophys.Acta.),1029:91-7;托尔钦林(Torchilin)等人,1996,脂质 体研发期刊(J.Liposome Res.)6:99-116;利特青格尔(Litzinger)等人,1994,生 物化学和生物物理学学报(Biochim.Biophys.Acta),1190:99-107;丸山(Maruyama) 等人,1991,化学与药学通报(Chem.Pharm.Bull.),39:1620-2;克立巴诺夫 (Klibanov)等人,1991,生物化学和生物物理学学报(Biochim.Biophys.Acta), 1062;142-8;艾伦(Allen)等人,1994,先进药物递送综述(Adv.Drug Deliv. Rev),13:285-309。也可使用适于特异性器官靶向(参见例如美国专利号 4,544,545)或特异性细胞靶向(参见例如美国专利申请公开号2005/0074403)的脂质 体。用于在组合物以及方法中使用的特别有用的脂质体可以通过反相蒸发方法用包括 磷脂酰胆碱、胆固醇、以及PEG衍生化磷脂酰乙醇胺(PEG-PE)的脂类组合物来产 生。使脂质体挤出通过具有限定孔径的滤器以产生具有所希望的直径的脂质体。在一 些实施例中,一种抗体的一个片段例如F(ab’),可使用之前所述的方法轭合至这些脂 质体,这些方法参见,例如,马丁(Martin)等人,1982,生物化学杂志(J.Biol. Chem.)257:286-288。
该人源化或嵌合抗体也可被配制为免疫脂质体。免疫脂质体是指一种脂质体组合 物,其中一种抗体或其一个片段被共价或非共价地连接到该脂质体表面。连接一种抗 体至该脂质体表面的化学是本领域中已知的,参见例如美国专利号6,787,153;艾伦 (Allen)等人,1995,隐形脂质体(Stealth Liposomes),博卡拉顿:CRC出版社 (Boca Rotan:CRC Press),233-44;汉森(Hansen)等人,1995,生物化学和生物 物理学学报(Biochim.Biophys.Acta),1239:133-144。
该人源化或嵌合抗体可以被包装在指明抗体的量的密封容器诸如安瓿或小药囊 中。在一个实施例中,这些抗体是作为一种处于密封容器中的干燥的无菌冻干粉或无 水浓缩物来提供,并且可以用水或盐水重构至用于给予受试者的适当浓度。优选地, 这些抗体是作为一种干燥的无菌冻干粉在密封容器中按以下单位剂量提供的:至少5 mg、更优选地至少10mg、至少15mg、至少25mg、至少35mg、至少45mg、至少 50mg、或至少75mg。冻干的抗体应在2℃与8℃之间在其原始容器中储存,并且 这些抗体在重构之后应在12小时内,优选地6小时内、5小时内、3小时内、或1小 时内给予。在一个可替代实施例中,抗体是以液体形式在指明该抗体、融合蛋白、或 轭合分子的量和浓度的密封容器中提供的。优选地,液体形式的抗体是在密封容器中 以至少1mg/ml、更优选至少2.5mg/ml、至少5mg/ml、至少8mg/ml、至少10 mg/ml、至少15mg/kg、至少25mg/ml、至少50mg/ml、至少100mg/ml、至少150 mg/ml、至少200mg/ml的抗体提供。
配制品中采用的精确剂量还将取决于给药途径和病症的严重性,并且应当根据执 业医师的判断和每一患者的情况来决定。可从来源于体外或动物模型测试系统的剂量- 反应曲线外推出有效剂量。对于所披露的抗体,给予至患者的剂量典型地是0.0001 mg/kg至100mg/kg患者体重。优选地,给予至患者的剂量是0.0001mg/kg以及20 mg/kg、0.0001mg/kg和10mg/kg、0.0001mg/kg和5mg/kg、0.0001和2mg/kg、 0.0001和1mg/kg、0.0001mg/kg和0.75mg/kg、0.0001mg/kg和0.5mg/kg之间, 0.0001mg/kg至0.25mg/kg、0.0001至0.15mg/kg、0.0001至0.10mg/kg、0.001至0.5 mg/kg、0.01至0.25mg/kg或0.01至0.10mg/kg患者体重。通常,人抗体在人体内相 比其他物种具有更长的半衰期,归因于对外来多肽的免疫应答。因此,更低剂量的人 抗体以及更小频率给予常常是合适的。进一步,给予抗体或其片段的剂量和频率可通 过增强这些抗体的摄取以及组织渗透性(通过修饰诸如,例如脂化)来减少。
在又另一个实施例中,可以在控释或持续释放系统中递送这些组合物。可使用本 领域的普通技术人员已知的任何技术来产生包括一种或多种抗体的持续释放配制品。 参见,例如美国专利号4,526,938;PCT公开WO 91/05548;PCT公开WO 96/20698; 宁(Ning)等人,1996,“使用持续释放凝胶进行的人类结肠癌异种移植物的瘤内放 射免疫治疗(Intratumoral Radioimmunotheraphy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel)”,放射治疗&肿瘤学(Radiotherapy&Oncology)39: 179-189,桑(Song)等人,1995,“长循环乳剂的抗体介导的肺部靶向(Antibody Mediated Lung Targeting of Long-Circulating Emulsions)”,药物科学&技术的PDA杂 志(PDA Journal of Pharmaceutical Science&Technology)50:372-397;克里克 (Cleek)等人,1997,“用于心血管应用的bFGF抗体的生物可降解聚合载体 (Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application)”,Pro.Int’l.Symp.Control.Rel.Bioact.Mater.24:853-854;以及兰 (Lam)等人,1997,“用于局部递送的重组人源化单克隆抗体的微囊化 (Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery)”,Proc.Int’l.Symp.Control Rel.Bioact.Mater.24:759-760。在一个实施例 中,一种泵可被用于控释系统(参见兰格(Langer),同上;塞夫顿(Sefton), 1987,CRC Crit.Ref.Biomed.Eng.14:20;布赫瓦尔德(Buchwald)等人,1980,外 科手术(Surgery)88:507;以及索德科(Saudek)等人,1989,新英格兰医学杂志 (N.Engl.J.Med.)321:574)。在另一个实施例中,聚合材料可用以实现抗体的控 释(参见例如,控释的医学应用(Medical Applications of Controlled Release),兰格 (Langer)以及怀斯(Wise)(编辑),CRC出版社,博卡拉顿,佛罗里达 (1974);受控的药物生物利用率,药物产物设计以及性能(Controlled Drug Bioavailability,Drug Product Design and Performance),斯莫伦(Smolen)以及鲍尔 (Ball)(编辑),威利,纽约(1984);兰杰(Ranger)以及佩帕斯(Peppas), 1983,大分子科学综述杂志大分子化学(J.,Macromol.Sci.Rev.Macromol.Chem.) 23:61;还参见利维(Levy)等人,1985,科学(Science)228:190;杜林 (During)等人,1989,神经学年鉴(Ann.Neurol.)25:351;霍华德(Howard)等 人,1989,神经外科杂志(J.Neurosurg.)71:105);美国专利号5,679,377;美国 专利号5,916,597;美国专利号5,912,015;美国专利号5,989,463;美国专利号 5,128,326;PCT公开号WO 99/15154;以及PCT公开号WO 99/20253)。用于持续释 放配制品中的聚合物的实例包括但不限于聚(2-羟乙基甲基丙烯酸酯)、聚(甲基丙烯酸 甲酯)、聚(丙烯酸)、聚(乙烯-共-乙酸乙烯)、聚(甲基丙烯酸)、聚乙交酯(PLG)、聚 酐、聚(N-乙烯基吡咯烷酮)、聚(乙烯醇)、聚丙烯酰胺、聚(乙二醇)、聚丙交酯 (PLA)、聚(丙交酯-共-乙交酯)(PLGA)、以及聚原酸酯。在又另一个实施例中, 可以将控释系统置于治疗靶标(例如肺)的附近,因此仅需要全身剂量的一部分(参见 例如古德森(Goodson),控释的医学应用(Medical Applications of Controlled Release),同上,第2卷,第115-138页(1984))。在另一个实施例中,根据邓恩 (Dunn)等人(参见U.S.5,945,155)使用可用于作为控释移植物的聚合组合物。这种 具体的方法是基于来自该聚合物系统的生物活性材料的原位控释的治疗效果。移植通 常可发生在需要治疗性治疗的患者的体内的任何处。在另一个实施例中,使用一个非 聚合持续递送系统,借此该受试者的体内的非聚合移植物被用作药物递送系统。在体 内移植时,该移植物的有机溶剂会从该组合物消散、分散或浸出至周围组织液中,并 且该非聚合材料会逐渐凝结或沉淀以形成实心微孔基质(参见U.S.5,888,533)。控释 系统在兰格(Langer)的综述中讨论(1990,科学(Science)249:1527-1533)。可 以使用本领域的普通技术人员已知的任何技术来生产包括一种或多种治疗剂的持续释 放配制品。参见,例如美国专利号4,526,938;国际公开号W0 91/05548和W0 96/20698;宁(Ning)等人,1996,放射治疗&肿瘤学(Radiotherapy&Oncology) 39:179-189;桑(Song)等人,1995,药物科学&技术的PDA杂志(PDA Journal of Pharmaceutical Science&Technology)50:372-397;克里克(Cleek)等人,1997, Pro.Int’l.Symp.Control.Rel.Bioact.Mater.24:853-854;以及兰(Lam)等人, 1997,Proc.Int’l.Symp.Control Rel.Bioact.Mater.24:759-760。
在一个特定实施例中,其中该治疗或预防组合物是编码一种披露的抗体或其一个 抗原结合片段的一种核酸,该核酸可体内给予以促进其编码的抗体的表达,通过将其 构建为适当的核酸表达载体的部分并且将它给予以便其进入细胞内,例如,通过使用 一种反转录病毒载体(参见美国专利号4,980,286),或通过直接注射,或通过使用微 粒轰击(例如,一种基因枪;生物射弹的,杜邦公司(Dupont)),或用脂类或细胞 表面受体或转染剂涂覆,或通过与已知进入细胞核的一种同源框样肽连接来给予它 (参见例如,约里奥(Joliot)等人,1991,美国国家科学院院刊(Proc.Natl.Acad. Sci.USA)88:1864-1868)等。可替代地,核酸可以引入细胞内且通过同源重组整合 入宿主细胞DNA内用于表达。
用治疗有效量或预防有效量的所披露抗体对受试者进行的治疗可以包括一种单一 治疗、或优选地可以包括一系列治疗。
G.药用组合物
披露的这些组合物包括在药用组合物的制造中有用的散装药物组合物(例如不纯 的或非无菌的组合物)以及可用于单位剂型的制备的药用组合物(即适合于给予受试 者或病人的组合物)。此类组合物包括在此披露的预防或治疗有效量的预防和/或治疗 剂或那些药剂与药学上可接受的载体的组合。优选地,这些组合物包括预防或治疗有 效量的人源化抗体以及药学上可接受的载体。
在一个特定的实施例中,术语“药学上可接受的”表示联邦或州政府的管理机构批 准的或者在美国药典或其他普遍认可的药典中列出的,用于在动物体内并且更特别地 在人体内的使用。术语“载体”是指与治疗剂一起给予的稀释剂、佐剂(如弗氏佐剂 (完全和不完全的))、赋形剂或运载体。此类药物载体可以为无菌液体,如水和 油,包括石油、动物、植物或合成来源的油,如花生油、豆油、矿物油、芝麻油等。 当该药用组合物是静脉内给药时,水是一种优选的载体。盐水溶液以及葡萄糖和甘油 水溶液也可以用作液体载体,特别是对于可注射溶液而言。合适的药物赋形剂包括淀 粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻米、面粉、白垩、硅胶、硬脂酸钠、单硬 脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇以及类似试 剂。如果希望的话,组合物还可包含少量湿润剂或乳化剂或pH缓冲剂。这些组合物 可采取溶液、悬浮液、乳液、片剂、丸剂、胶囊、散剂、持续释放配制品等形式。
一般地,组合物的成分分开或混合在一起以单位剂型提供,例如,作为在密封容 器中的干燥的冻干粉或无水浓缩剂,所述密封容器例如是指明活性剂的量的安瓿或小 药囊。在通过输注给予组合物时,可以用含有无菌药用级水或盐水的输液瓶配制。在 通过注射给予组合物时,可以提供无菌注射用水或盐水的安瓿,使得可以在给药前将 这些成分混合。
可将组合物配制成为中性或盐的形式。药学上可接受的盐包括但不限于由阴离子 形成的那些,例如来源于盐酸、磷酸、乙酸、草酸、酒石酸等的那些,以及由阳离子 形成的那些,例如来源于钠、钾、铵、钙、铁的氢氧化物,异丙胺,三乙胺,2-乙氨 基乙醇,组氨酸,普鲁卡因等的那些。
H.试剂盒
另一个实施例提供了包括一个或多个填充有本披露人源化抗体的容器的药物包或 试剂盒。此外,一个或多个其他对治疗一种疾病有用的预防或治疗剂也可包括于药物 包或试剂盒中。该药物包或试剂盒包括填充有披露的药物组合物的一种或多种成分的 一个或多个容器可任选地,与这样一个或多个容器相关联的可以是由管理药物或生物 制品的制造、使用或销售的政府机构规定的形式的公告,所述公告反映该机构针对人 类给予,对制造、使用或销售的许可。
这些试剂盒可用于上面的方法中。在一个实施例中,一种试剂盒可包括一个或多 个披露的人源化抗体。在另一个实施例中,试剂盒进一步包括在一个或多个容器中的 一种或多种其他可用于治疗癌症的预防剂或治疗剂。在另一个实施例中,试剂盒进一 步包括一种或多种可结合一种或多种与癌症关联的癌抗原的细胞毒性抗体。在某些实 施例中,另一个预防剂或者治疗剂是一种化学治疗剂。在其他实施例中,预防剂或治 疗剂是一种生物的或激素的治疗剂。
I.诊断方法
披露的抗体及其抗原结合片段可用于诊断目的,如用于检测、诊断或监测与 H7CR表达关联的疾病、失调或感染。对一种疾病、失调或感染特别是一种自身免疫 疾病进行的检测或诊断可以通过以下方式进行:(a)使用免疫特异性地结合到此类 抗原的一种或多种抗体(或其片段)测定H7CR在一个受试者的细胞或组织样品中的 表达;并且(b)将该抗原的水平与对照水平(例如,在正常组织样品中的水平或在 不同时间点在组织中的水平)进行比较,借此相比于该抗原的对照水平而言该抗原的 测定水平的增加或降低指示该疾病、失调或感染。在免疫测定,诸如酶联免疫吸附测 定(ELISA)、放射性免疫测定(RIA)以及荧光激活的细胞分选(FACS)中优选采 用此类抗体以及片段。
一个方面涉及将此类抗体以及片段、并且特别是结合到人H7CR的此类抗体以及 片段用于体外或原位组织样品或体内细胞中的IHC分析的试剂。因此,这些抗体以及 其片段在检测以及诊断人的疾病、失调、或感染中具有效用。在一个实施例中,此类 诊断包括:a)将有效量的免疫特异性地结合到H7CR的标记的抗体或抗原结合片段 给予至一个受试者(例如,经肠胃外、皮下、或腹膜内);b)在给药后等待一个时 间间隔以允许该标记的分子优先集中在受试者中H7CR表达的部位(并且未结合的标 记的分子被清除至背景水平);c)测定背景水平;并且d)检测该受试者中的标记的 抗体,使得在背景水平之上对标记的抗体的检测指示该受试者患有该疾病、失调、或 感染。根据此实施例,用一个成像部分标记该抗体,该成像部分可使用本领域的普通 技术人员已知的成像系统检测到。背景水平可以通过不同方法确定,这些方法包括将 所检测到的标记的分子的量与之前针对一个具体系统测定的标准值进行对比。
在本领域中应理解,该受试者和使用的成像系统的大小将决定需要用来产生诊断 图像的成像部分的量。体内肿瘤成像描述于比尔谢尔(Burchiel)等人,“放射性标记的 抗体及其片段的免疫药代动力学(Immunopharmacokinetics of Radiolabeled Antibodies and Their Fragments)”,(肿瘤显像:癌的放射化学检测(Tumor Imaging:The Radiochemical Detection of Cancer),第13章,S.W.比尔谢尔(Burchiel)以及B.A.罗 兹(Rhodes)编辑,马森出版公司(Masson Publishing Inc.)(1982)。
依赖于若干变量,包括所使用的标记的类型以及给予模式,在给药后用以允许该 标记的分子优先集中在受试者的部位并且未结合的标记的分子被清除至背景水平的一 个时间间隔是6至48小时或6至24小时或6至12小时。在另一个实施例中,给药后 的时间间隔是5至20天或5至10天。
在一个实施例中,通过重复用于诊断疾病、失调或感染的方法对该疾病、失调或 感染进行监测,例如,初次诊断一个月之后,初次诊断六个月之后,初次诊断一年之 后等。
可以使用本领域中已知的用于体内扫描的方法在受试者中检测该标记的分子的存 在。这些方法依赖于所使用的标记的类型。技术人员将能够确定用于检测一种具体的 标记的适当的方法。可用于这些诊断方法的方法以及装置包括但不限于计算机断层摄 影(CT)、全身扫描诸如正电子发射体层摄影(PET)、磁共振成像(MRI)、以及 超声检查。
在一个特定实施例中,该分子是用放射性同位素标记的,并且在患者中使用辐射 响应外科仪器检测(瑟斯顿(Thurston)等人,美国专利号5,441,050)。在另一个实施 例中,该分子是用荧光化合物标记的,并且在患者中使用荧光响应的扫描仪器检测。 在另一个实施例中,该分子是用正电子发射金属标记的,并且在患者中使用正电子发 射断层摄影检测。在又另一个实施例中,该分子是用顺磁标记来标记的,并且在患者 中使用磁共振成像(MRI)检测。
目前总体上已经描述了本发明,其内容可以通过参考下面的实例更容易理解,这 些实例是以说明的方式提供,而并非旨在限制本发明,除非特别指明。
实例1
抗人H7CR抗体的表征以及H7CR的表达模式
材料和方法
对于结合亲和力评估,将20万个CHO.hH7CR转染子(图2)、原初CD4+ CD45RA+T细胞(图3A)或原初CD8+CD45RA+T细胞(图3B)重悬于100μl流 式细胞术缓冲液中(PBS+2%FBS)。将嵌合1.3和4.5的0、0.1ng、0.3ng、1ng、 3ng、10ng、30ng、100ng、300ng、1μg、3μg以及10μg的连续稀释物添加到细 胞,并在4℃孵育30min。然后将细胞用2ml流式细胞术缓冲液洗涤两次,并且重悬 于100μl流式细胞术缓冲液中。添加1μl抗hIg PE第二抗体(生物传奇公司)并与细 胞孵育15min。然后将样本进行洗涤,并且重悬于100μl流式细胞术缓冲液中。使用 BD Canto(BD生物科学)以板形式获取流式细胞术数据,并且通过FlowJo软件分 析。然后将染色数据(MFI)输入至Prism 5软件中以产生结合曲线。使用了单一位点 特异性结合算法的曲线拟合计算每个抗体的个体KD。
使用5μg/ml H7CR 1.3、4.5以及7.8mAb来对H7CR稳定转染子进行染色以显 示结合特异性(图4)。也使用10μg/ml B7-H7mIg融合蛋白以对H7CR CHO转染子 进行染色。将H7CR mAb添加到该系统中以评价H7CR mAb对B7-H7-H7CR相互作 用的阻滞能力(图5)。
在人扁桃体石蜡包埋切片上对H7CR的免疫组织化学染色是用4.5抗体以5 μg/ml浓度使用标准方案(图6)进行的。对于细胞表面染色以及通过流式细胞术进行 的分析,将细胞用指示的mAb在4℃孵育30min,用缓冲液洗涤并且分析。通过谱 系标记物以及1.3抗体染色评价H7CR在人以及小鼠PBMC上的表达(图7-11)。通 过抗B7-H7抗体染色评价B7-H7在活化的单核细胞衍生的DC上的表达(图12)。
结果
发现仓鼠抗体1.3、4.5以及7.8能够免疫特异性地结合到人H7CR。图2显示抗 H7CR抗体1.3和4.5各自的结合亲和力。发现抗体4.5具有3.5nM的Kd。发现抗体 1.3具有5.9nM的Kd。H7CR mAb结合至原初CD4以及CD8T细胞的曲线表明,对 于两个抗体的受体饱和剂量是1μg/ml(图3,图A和B)。
图4(图A-C)显示抗体1.3、4.5以及7.8结合到表达于CHO细胞的表面上的人 H7CR的能力。在存在B7-H7-鼠IgG2a融合蛋白的情况下,通过将这些抗体用H7CR CHO转染子进行孵育,将这些抗体针对其阻滞H7CR与B7-H7的相互作用的能力进 行测试。如图5(图A-D)中所示,H7CR抗体的存在不会破坏B7-H7Ig结合到 H7CR的能力。因此,这三个抗体基本上不能够阻滞H7CR与B7-H7的相互作用。如 图6中所示,发现该抗人H7CR抗体(克隆4.5)能够结合到如内源地表达于人扁桃 体组织的表面上的H7CR。
这些抗H7CR抗体允许确定H7CR和B7-H7的表达谱。图7显示H7CR表达与T 和NK细胞中的原初T细胞表型关联。图8(图A-H)显示四个健康PMBC供体(供 体1,图A以及B;供体2,图C以及D;供体3(图E以及F)以及供体4(图G 以及H))的H7CR和B7-H7的表达谱。图9(图A-H)显示四个健康PMBC供体 (供体1,图A以及B;供体2,图C以及D;供体3(图E以及F)以及供体4(图 G以及H))的H7CR和B7-H7的表达谱。图10(图A-AD)显示人单核细胞、 CD8+CD3+淋巴细胞、CD8–CD3+淋巴细胞、CD16+NK细胞、以及CD3–CD8–细 胞对H7CR和B7-H7的表达。图11(图A-AD)显示食蟹猴单核细胞、CD8+CD3+ 淋巴细胞、CD8–CD3+淋巴细胞、CD16+NK细胞、以及CD3–CD8–细胞对H7CR 和B7-H7的表达,并且指示食蟹猴对于体内以及毒理学研究是一个相关物种。
进行了对B7-H7的表达的体外功能性分析。将成熟单核细胞衍生的树突细胞针对 其表达B7-H7以及其他活化标记物的能力进行评价。此研究(图12,图A-K)的结 果证实了此类标记物的表达,并且显示成熟树突细胞对于体外功能性测试是相关的。
实例2
抗H7CR抗体促进抗原特异性记忆T细胞应答
材料和方法
为了进一步表征该抗H7CR抗体,进行了一个破伤风类毒素(TT)记忆召回应答 测定。通过用1ng/ml TNFα以及1μg/ml PGE2孵育两天使单核细胞衍生的不成熟的 DC成熟,并且在DC成熟的第二天在50μg/ml破伤风类毒素(TT)存在的情况下孵 育过夜。将这些树突细胞用X-Vivo介质洗涤三次,并且然后在100ng/ml TT和10 μg/ml H7CR 1.3、4.5或7.8单克隆抗体(图13)、或人源化1.3变体(图23)存在的 情况下,在存在以1:20的比率经羧基荧光素琥珀酰亚胺酯(CFSE)标记的自体T细 胞的情况下孵育两周。通过CFSE稀释使用流式细胞术监测细胞增殖。在一些实验 中,进行对人IFNγ和TNFα的细胞内染色。将高尔基(Golgi)阻滞剂布雷菲德菌素 A(e生物科学(eBioscience))添加至DC-T细胞培养系统中持续8小时。收获活化 的人T细胞并且将其用冷PBS洗涤。细胞表面标记物首先被染色。根据制造商方案 (Cytofix/Cytoperm,BD)进行对IFNγ以及TNFα的细胞内染色。
在不同时间点收集培养上清液用于通过Bio-Plex Pro人细胞因子17-Plex试剂盒 (M5000031YV,伯乐(BioRad))根据制造商手册进行总细胞因子分析。收集数据 并且通过Bio-Plex 200系统(伯乐(BioRad))进行分析。
结果
此分析的结果(图13)显示这些抗H7CR抗体促进抗原特异性记忆T细胞应答。 对第7天的上清液进行评价以确定这些细胞表达的细胞因子的性质和水平。这个分析 的结果示于图14中(图A-L)。结果显示抗H7CR抗体1.3、4.5以及7.8介导不相同 的细胞因子表达谱。值得注意地,抗体1.3介导高水平的IFNγ、TNFα、GM-CSF以 及IL-10,并且抗体4.5介导高水平的IL-5以及IL-13。
将细胞用高尔基阻滞(Golgi Block,无PMA和Ionmycin)孵育5小时之后,使细 胞经受细胞内染色,并且评测它们对IFNγ的细胞内表达和羧基荧光素琥珀酰亚胺酯 (CSFE)稀释。此研究的结果揭示用抗H7CR抗体治疗增强了增殖,如通过CFSE稀 释和抗原特异性T细胞中的IFNγ表达表示的(图15A以及15B)。分裂的T细胞中的 IFNγ+百分数从0.15%(图15A;对照)增加至0.96%(图15B;抗体1.3治疗的)。
在1.3人源化变体(图23)中,变体1、3以及5显示与这些TT特异性T细胞的 亲本嵌合1.3抗体是可比的CFSE稀释的增强。
实例3
B7-H7:H7CR的相互作用调节抗原特异性的人T细胞应答
材料和方法
为了确定B7-H7:H7CR通路对抗原特异性的T细胞应答的作用,将纯化的人 CD4+T细胞用CFSE标记,并且用自体单核细胞衍生的树突细胞(已用50μg/ml破伤 风类毒素(“TT”)作为抗原进行了预孵育)培养。将这些树突细胞用X-Vivo介质洗 涤三次,并且然后在100ng/ml TT以及10μg/ml H7CR单克隆抗体存在的情况下,在 存在以1:20的比率经羧基荧光素琥珀酰亚胺酯(CFSE)标记的自体T细胞的情况下 孵育两周。通过CFSE稀释使用流式细胞术监测细胞增殖。
结果
当拮抗的抗H7CR mAb包括在培养物(以扩增T细胞上的H7CR信号)中时,发 现TT特异性的T细胞增殖得以强烈增强(图16A)。在开始细胞培养时,包含 CTLA4-Ig(一种阻滞B7:CD28相互作用的融合蛋白)大大抑制了T细胞增殖,即 使在存在拮抗的抗H7CR mAb的情况下。这些结果指示,H7CR共刺激依赖于内源 B7:CD28相互作用。
在存在拮抗的抗H7CR mAb的情况下的细胞孵育展现细胞因子产生的大幅增强, 这些细胞因子包括IFN-γ(图16B,图A)以及IL-5、IL-10、TNF-α和IL-17(图 16B,图B)。这些结果指示,H7CR共刺激对于CD4+T辅助细胞的子集是非特异性 的。总体上,这些结果表明,该H7CR信号促进了pan人CD4+T细胞的生长以及分 化,是一种类似于CD28共刺激的特征。
实例4
抗H7CR抗体1.3和4.5的人源化
使用如下的工艺将仓鼠抗H7CR抗体1.3和4.5人源化,该工艺包括产生一个同 源建模抗体3D结构,并且基于结构建模建立亲本抗体的谱。产生一组人源化重链和 轻链可变区序列,其每个将亲本抗体序列的特异性区域和人框架序列的大多数进行了 组合。产生了总共6个人源化重链序列以及6个人源化轻链序列。
使用Geneious产生比较了抗体1.3的可变域与人种系框架序列数据库的序列比 对。优选的受体框架是基于跨框架的整体序列一致性、匹配界面位置、类似地归类的 CDR典型位置以及必须去除的N-糖基化位点的存在而鉴定的。
在Discovery Studio中产生这些抗体的可变轻链和重链的结构模型。模板结构是 通过用1.3轻链和重链可变域序列(有和没有其CDR)搜索PDB数据库鉴定的。使 用MODELLER进行1.3序列与模板的比对并且基于同源性对结构建模(萨利 (Sali),A.等人(1993)“通过空间约束的满意度进行的比较性蛋白质建模 (Comparative Protein Modelling By Satisfaction Of Spatial Restraints)”,分子生物学 (J.Molec.Biol.)234(3):779-815)。
使用3D模式系统地分析多个将亲本抗体序列的不同区域与人框架的区域合并的 杂交序列,以鉴定被预测对这些CDR的定义结构具有最少影响的杂交序列(乔西亚 (Chothia),C.等人(1987)“免疫球蛋白的高变区的典型结构(Canonical Structures For The Hypervariable Regions Of Immunoglobulins)”,分子生物学(J.Mol.Biol.) 196:901-917;马丁(Martin),A.C.等人(1996)“同源蛋白质的环的结构家族:自 动分类、建模和在抗体上的应用(Structural Families In Loops Of Homologous Proteins:Automatic Classification,Modelling And Application To Antibodies)”,分子 生物学(J.Molec.Biol.)263(5):800-815)。特别应注意包含如下氨基酸的杂交体 序列,这些氨基酸来自人框架在CDR环的内,在韦尼耶(Vernier)区,在 VH/VL链间界面中,或在CDR典型类别决定位置中,因为判断这些杂交序列很可能 对所得到的人源化抗体的功能具有不利影响。
基于CDR分析以及结构建模建立该亲本抗体的谱。基于序列以及同源性比较鉴 定人受体框架。通过建立将该亲本抗体序列的部分与人框架序列融合的多个杂交序列 设计人源化抗体。使用3D模式,通过肉眼并且通过计算机建模有条理地分析这些人 源化序列,以分离最可能保持抗原结合的序列。目标是使得最终的人源化抗体中的人 序列的量最大化的同时保持原始抗体特异性。
珍珠串型(Collier de Perles)是可变域的2D表示,并且提供β链中氨基酸位置以 及可变域中的环的信息(鲁伊斯(Ruiz)等人(2002)“具有已知3D结构的人免疫球 蛋白的IMGT基因鉴定和珍珠串型(IMGT Gene Identification And Colliers de Perles Of Human Immunoglobulins With Known 3D Structures),”免疫遗传学 (Immunogenetics)53(10-11):857-883)。抗体1.3轻链和重链可变区的珍珠串型 分别示于图17A和图17B。图18A和18B分别显示抗体4.5轻链和重链可变区的珍珠 串型。这些链的三个CDR环显示于这些图表的顶部。在可变轻链或重链区域中不存 在游离的Cys残基或N联糖基化位点。
抗体1.3的人源化
产生比较了仓鼠抗体1.3可变域与人种系数据库的序列比对。基于整体序列一致 性、匹配界面位置、以及类似地归类的CDR典型位置,两个种系家族被鉴定为轻 链:IGKV4-1*01以及IGKV2D-28*01的可能受体框架。在FR4和J-区段上将J-区段 基因与亲本序列进行比较,并且针对轻链选择IGKJ2*01。亲本1.3VL链与这些受体 框架的比对示于表6中,不相同的残基以下划线示出。
发现仓鼠抗体1.3的重链最类似于种系IGHV4-31*02。在顶部最接近于抗体1.3 重链的50个种系中,CDR H3中没有一个具有与1.3重链相同的长度。因此,基于整 体相似性、CDR长、以及CDR典型结构,将一条重排的重链选择为第二受体框架 (AAY33199.1)。在FR4和J-区段上将J-区段基因与亲本序列进行比较,并且针对 重链选择IGHJ3*01。亲本VH链与这些受体框架的比对示于表7中,不相同的残基 以下划线示出。
对于轻链,针对两个受体框架IGKV4-1*01和IGKV2D-28*01中的每个建立三条 人源化链,从而形成六条人源化1.3轻链。针对每个受体框架(VL1A,VL2A)的第 一人源化链包含大部分人框架(人源化轻链1)。针对每个受体框架(VL1B, VL2B)的第二人源化链包含一些量的与人框架序列融合的亲本序列,这应该有助于 保持原始的CDR构象(人源化轻链2)。针对这些受体框架(VL1C,VL2C)中每个 的第三人源化链包含甚至更多的与人框架融合的亲本序列,这应该有助于维持原始的 抗体特异性以及CDR结构(人源化轻链3)。这些链的氨基酸序列是如下示出的。
抗人H7CR抗体1.3的人源化变体的轻链可变区的氨基酸序列,如源自于 IGKV4-1*01受体框架(CDR被加下划线示出):
1.VL1A IGKV4-1*01(人源化1):
2.VL1B IGKV4-1*01(人源化2):
3.VL1C IGKV4-1*01(人源化3):
抗人H7CR抗体1.3的人源化变体的轻链可变区的氨基酸序列,如源自于 IGKV2D-28*01受体框架(CDR被加下划线示出):
1.VL2A IGKV2D-28*01(人源化1):
2.VL2B IGKV2D-28*01(人源化2):
3.VL2C IGKV2D-28*01(人源化3):
对于重链,针对以上鉴定的IGHV4-31*02以及AAY33199.1受体框架中的每个建 立三条人源化链。以与轻链类似的方式,针对每个受体框架(VH1A,VH2A)的第一 人源化链包含大部分人序列(人源化1)。针对每个受体框架(VH1B,VH2B)的第 二人源化链应该有助于保持原始的CDR构象(人源化2)。针对这些受体框架 (VH1C,VH2C)中每个的第三链应该有助于维持原始的抗体特异性以及CDR结构 (人源化3)。这些链的氨基酸序列是如下示出的。
抗人H7CR抗体1.3的人源化变体的重链可变区的氨基酸序列,如源自于 IGHV4-31*02受体框架(CDR被加下划线示出):
1.VH1A IGHV4-31*02(人源化1):
2.VH1B IGHV4-31*02(人源化2):
3.VH1C IGHV4-31*02(人源化3):
抗人H7CR抗体1.3的人源化变体的重链可变区的氨基酸序列,如源自于 AAY33199.1受体框架(CDR被加下划线示出):
1.VH2A AAY33199.1(人源化1):
2.VH2B AAY33199.1(人源化2):
3.VH2C AAY33199.1(人源化3):
优选的抗体及其抗原结合片段包括抗人H7CR抗体1.3的上述人源化变体的36个 组合中的任一个。确切地,此类抗体包含示于表4的组合:将抗人H7CR抗体1.3的所 有36个此类人源化变体针对其各自结合如异位地表达于CHO细胞的表面上的人 H7CR分子的能力进行评价,并且发现36个中的28个能够结合到此类人H7CR分子。
抗H7CR抗体4.5的人源化
产生比较了仓鼠抗体4.5可变域与人种系数据库的序列比对。基于整体序列一致 性、匹配界面位置、以及类似地归类的CDR典型位置,两个种系家族被鉴定为轻 链:IGKV4-1*01以及IGKV2D-40*01的可能受体框架。在FR4和J-区段上将J-区段 基因与亲本序列进行比较,并且针对轻链选择IGKJ5*01。亲本1.3VL链与这些受体 框架的比对示于表8中,不相同的残基以下划线示出。
发现仓鼠抗体4.5的重链最类似于种系IGHV4-31*02。在顶部最接近于抗体4.5 重链的50个种系中,具有类似典型结构的第二受体框架是IGHV2-5*01。在FR4和 J-区段上将J-区段基因与亲本序列进行比较,并且针对重链选择IGHJ5*01。亲本VH 链与这些受体框架的比对示于表9中,不相同的残基以下划线示出。
对于轻链,针对两个受体框架IGKV4-1*01和IGKV2D-40*01中的每个建立三条 人源化链,从而形成六条人源化4.5轻链。针对每个受体框架(VL1A,VL2A)的第 一人源化链包含大部分人框架(人源化轻链1)。针对每个受体框架(VL1B, VL2B)的第二人源化链包含一些量的与人框架序列融合的亲本序列,这应该有助于 保持原始的CDR构象(人源化轻链2)。针对这些受体框架(VL1C,VL2C)中每个 的第三人源化链包含甚至更多的与人框架融合的亲本序列,这应该有助于维持原始的 抗体特异性以及CDR结构(人源化轻链3)。这些链的氨基酸序列是如下示出的。
抗人H7CR抗体4.5的人源化变体的轻链可变区的氨基酸序列,如源自于 IGKV4-1*01受体框架(CDR被加下划线示出):
1.VL1A IGKV4-1*01(人源化1):
2.VL1B IGKV4-1*01(人源化2):
3.VL1C IGKV4-1*01(人源化3):
抗人H7CR抗体4.5的人源化变体的轻链可变区的氨基酸序列,如源自于 IGKV2D-40*01受体框架(CDR被加下划线示出):
1.VL2A IGKV2D-40*01(人源化1):
2.VL2B IGKV2D-40*01(人源化2):
3.VL2C IGKV2D-40*01(人源化3):
对于重链,针对以上鉴定的IGHV4-31*02以及IGHV2-5*01受体框架中的每个 建立三条人源化链。以与轻链类似的方式,针对每个受体框架(VH1A,VH2A)的第 一人源化链包含大部分人序列(人源化1)。针对每个受体框架(VH1B,VH2B)的 第二人源化链应该有助于保持原始的CDR构象(人源化2)。针对这些受体框架 (VH1C,VH2C)中每个的第三链应该有助于维持原始的抗体特异性以及CDR结构 (人源化3)。这些链的氨基酸序列是如下示出的。
抗人H7CR抗体4.5的人源化变体的重链可变区的氨基酸序列,如源自于 IGHV4-31*02受体框架(CDR被加下划线示出):
1.VH1A IGHV4-31*02(人源化1):
2.VH1B IGHV4-31*02(人源化2):
3.VH1C IGHV4-31*02(人源化3):
抗人H7CR抗体4.5的人源化变体的重链可变区的氨基酸序列,如源自于 IGHV2-5*01受体框架(CDR被加下划线示出):
1.VH2A IGHV2-5*01(人源化1):
2.VH2B IGHV2-5*01(人源化2):
3.VH2C IGHV2-5*01(人源化3):
优选的抗体及其抗原结合片段包括抗人H7CR抗体4.5的上述人源化变体的36个 组合中的任一个。确切地,此类抗体包括示于表5中的组合。将抗人H7CR抗体4.5 的所有36个此类人源化变体针对其各自结合如内源地表达于细胞的表面上的人H7CR 分子的能力进行评价,并且所有的均被发现能够结合到此类人H7CR分子。
实例5
抗体1.3增加T细胞体内功能性
材料和方法
将1.5-2千万个人PBMC或1千万个纯化的原初CD4+人T细胞经腹膜内转移至 NOD-SCID Il2rg-/-(NSG)小鼠(杰克逊实验室(Jackson Lab))。在第0天和第2 天,将每个小鼠用300μg对照或H7CR mAb 1.3腹膜接种。转移6天之后,收获脾细 胞。将人T细胞通过染色针对人CD45、CD3、以及CD8进行检测。为了监测细胞分 裂,在转移之前将hPBMC用CFSE标记。
结果
流式细胞术分析揭示,抗体1.3扩张人抗小鼠外来反应性T细胞,如通过在人 CD4+以及CD8+T细胞两者中CFSE稀释群体的增加群体证明的。(图19A-19D)
实例6
抗体1.3增加CD40L、IFNγ、以及CD107a体内表达:外来GvDH模式
材料和方法
将1.5-2千万个人PBMC或1千万个纯化的原初CD4+人T细胞经腹膜内转移至 NOD-SCID Il2rg-/-(NSG)小鼠(杰克逊实验室(Jackson Lab))。在第0天和第2 天,将每个小鼠用300μg对照或H7CR mAb 1.3腹膜接种。转移6天之后,收获脾细 胞。将人T细胞通过染色针对人CD45、CD3、以及CD8进行检测。用PMA加离子 霉素体外再刺激脾细胞以检测IFN-γ或CD107a-产生细胞。为了监测细胞分裂,在转 移之前将hPBMC用CFSE标记。
结果
图20A-20H是FACS分析的散点图,显示注射了抗体1.3的NGS小鼠中 CD40L、IFNγ以及CD107a的增加的表达。与对照抗体处理的小鼠比较,1.3抗体显 著地增强膜结合的CD40L的CD4+T细胞表达以及IFN-γ产生。1.3抗体处理也增加 CD107a在CD8+T细胞上的表达,指示细胞溶解活性,连同IFN-γ-产生。综上所述, 1.3抗体处理促进外来-反应性CD4+以及CD8+T细胞的扩张和效应子功能。
实例7
抗体1.3的变体的表征
材料和方法
在4℃,将稀释于PBS中的100μl 1μg/ml H7CRECD人IgG1 Fc融合蛋白在平底 96孔板(科斯塔尔(Costar)9017)上固定过夜。将板用PBS+0.1%PS-20洗涤两 次,并且在室温用200μl/孔PBS 10%FBS封闭1小时。将稀释于PBS 10%FBS中的 100μl人IgG4 Fc嵌合的1.3及14个所选择的1.3人源化变体添加到每个孔中,并且 在室温孵育1小时。将板洗涤三次,并且将100μl 1μg/ml抗人IgG4 HRP(南方生物 技术公司(Southern Biotech))添加到每个孔中,并且在室温孵育1小时。将板洗涤 六次,并且将100μl TMB底物(SurModics)添加到每个孔中持续5-15min。将100 μl终止液(0.1M硫酸)添加到每个孔中。在吸光度450nm通过珀金埃尔默 (PerkinElmer)EnVision 2104多标记读取器对各板读取。
使用ELISA测定研究抗体1.3的14个变体与H7CR融合蛋白结合的亲和力。
结果
结合亲和力结果示于表10。
表10
图21A以及21B是用以下处理(从左向右)的静止的或受刺激的PMBC的点 图:人源化抗体1.3、阴性对照、OKT3、OKT3+CD28、固定的人源化抗体、固定的 阴性对照、以及固定的OKT3。在暴露于人嵌合的1.3抗体时,未观察到在细胞因子 产生方面的统计学上显著的增加。作为一个结果,在这个体外设置中,1.3抗体处理 未诱导T细胞细胞因子风暴。
嵌合的1.3抗体的序列如下:
重链核酸序列:
ATGGAATGGTCCTGGGTGTTCCTGTTCTTCCTGTCCGTGACCACCGGCGTGCACTC CCAGATCCAGCTGCAGGAATCTGGCCCTGGCCTCGTGAAGCCTTCCCAGTCCCTG TCCCTGACCTGCAGCGTGACCGGCTTCTCCATCTCCACCTCCGGCTACTACTGGAC CTGGATCCGGCAGTTCCCTGGCAAGCGGCTGGAATGGATGGGCTACATCAACTAC GGCGGAGGCACCTCCTACAACCCCAGCCTGAAGTCCCGGATCTCCATCACCCGGG ATACCTCCAAGAACCAGTTCCTGCTGCACCTGAACTCCGTGACAACCGAGGACAC CGCCACCTACTGCTGCGCTACCATGGCCGACAGATTCGCCTTCTTCGACGTGTGG GGCCAGGGCATCCAAGTGACCGTGTCCTCCGCTTCCACCAAGGGCCCCTCTGTGT TTCCTCTGGCCCCTTGCTCCCGGTCCACCTCTGAGTCTACAGCCGCTCTGGGCTGC CTCGTGAAAGACTACTTCCCCGAGCCCGTGACAGTGTCCTGGAACTCTGGCGCTC TGACCTCTGGCGTGCACACCTTCCCTGCTGTGCTGCAGTCTAGCGGCCTGTACTCC CTGTCCTCCGTCGTGACCGTGCCTTCCAGCTCTCTGGGCACCAAGACCTACACCTG TAACGTGGACCACAAGCCCTCCAACACCAAGGTGGACAAGAGAGTGGAATCTAA GTACGGCCCTCCCTGCCCCCCTTGTCCTGCCCCTGAATTTCTGGGCGGACCCTCCG TGTTTCTGTTCCCCCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCCGA AGTGACCTGCGTGGTGGTGGATGTGTCCCAGGAAGATCCCGAGGTGCAGTTCAAT TGGTACGTGGACGGCGTGGAAGTGCACAACGCCAAGACCAAGCCTAGAGAGGAA CAGTTCAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGATT GGCTGAACGGCAAAGAGTACAAGTGCAAGGTGTCCAACAAGGGCCTGCCCTCCA GCATCGAAAAGACCATCTCCAAGGCTAAGGGCCAGCCCCGCGAGCCCCAGGTGT ACACACTGCCTCCAAGCCAGGAAGAGATGACCAAGAATCAGGTGTCACTGACCT GTCTCGTGAAGGGCTTCTACCCCTCCGATATCGCCGTGGAATGGGAGTCCAACGG CCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACTCCGACGGCTCC TTCTTTCTGTACTCTCGCCTGACCGTGGACAAGTCCCGGTGGCAGGAAGGCAACG TGTTCTCCTGCTCTGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTC CCTGAGCCTGTCCCCCGGCTGATGA(SEQ ID NO:100)。
轻链核酸序列:
ATGTCCGTGCCCACCCAGGTGCTGGGATTGCTGCTGCTGTGGCTGACCGACGCC AGATGCGACATCGTGATGACCCAGTCCCCCTCCTCCCTGGCTGTGTCTGCTGGCG AGAAAGTGACCATCTCCTGCCTGTCCTCCCAGTCCCTGTTCTCCTCCAACACCAA CCGGAACTACCTGAACTGGTATCTGCAGAAGCCCGGCCAGTCCCCTAAGCTGCT GATCTACCACGCCTCCACCAGACTGACCGGCGTGCCCGATAGATTCATCGGCTCT GGCTCCGGCACCGACTTTACCCTGACCATCAGCTCCGTGCAGGCCGAGGACCTG GGCGACTACTACTGCCAGCACCACTACGAGACACCCCTGACCTTTGGCGACGGC ACCAAGCTGGAAATCAAGCGGACCGTGGCCGCTCCCTCCGTGTTCATCTTCCCAC CTTCCGACGAGCAGCTGAAGTCTGGCACCGCCTCTGTCGTGTGCCTGCTGAACA ACTTCTACCCCCGCGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGT CCGGCAACTCCCAGGAATCCGTGACCGAGCAGGACTCCAAGGACAGCACCTACT CCCTGTCCAGCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGT ACGCCTGCGAAGTGACCCACCAGGGCCTGTCTAGCCCCGTGACCAAGTCTTTCA ACCGGGGCGAGTGCTGATGA(SEQ ID NO:101)。
重链蛋白序列:
MEWSWVFLFFLSVTTGVHSQIQLQESGPGLVKPSQSLSLTCSVTGFSISTSGYYWTWI RQFPGKRLEWMGYINYGGGTSYNPSLKSRISITRDTSKNQFLLHLNSVTTEDTATYC CATMADRFAFFDVWGQGIQVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYF PEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPS NTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQ EDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCK VSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVE WESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNH YTQKSLSLSPG**(SEQ ID NO:11)。
轻链蛋白序列:
MSVPTQVLGLLLLWLTDARCDIVMTQSPSSLAVSAGEKVTISCLSSQSLFSSNTNRN YLNWYLQKPGQSPKLLIYHASTRLTGVPDRFIGSGSGTDFTLTISSVQAEDLGDYYC QHHYETPLTFGDGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKV QWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGL SSPVTKSFNRGEC**(SEQ ID NO:12)。
实例8
人源化H7CR抗体4.5变体
材料和方法
将来自三十六个变体的5μg/ml抗体用H7CR-GFP融合蛋白转染的CHO细胞在室 温下孵育30min。然后将细胞用2ml流式细胞术缓冲液洗涤两次,并且重悬于100μl 流式细胞术缓冲液中。添加1μl抗hIg PE第二抗体(生物传奇公司)并与细胞孵育 15min。然后将样本进行洗涤,并且重悬于100μl流式细胞术缓冲液中。使用BD Canto(BD生物科学)以板形式获取流式细胞术数据,并且通过FlowJo软件分析。X 轴显示H7CR-GFP表达,并且Y轴显示结合到这些转染子的变体。
结果
将H7CR抗体4.5的三十六个人源化变体针对对于H7CR的结合特异性进行测 定。结果呈现于图23中。所有三十六个4.5人源化变体保持与H7CR的结合特异性。
表11:4.5抗体人源化变体
4.5人源化
变体
针对嵌合的4.5抗体的序列数据如下:
重链核酸序列:
ATGGAATGGTCCTGGGTGTTCCTGTTCTTCCTGTCCGTGACCACCGGCGTGCACT CCCAGATCCAGCTGCAGGAATCTGGCCCTGGCCTCGTGAAGCCTTCCCAGTCCCT GTCCCTGACCTGCAGCGTGACCGGCTTCTCTATCACAACCGGCGGCTACTACTGG AACTGGATCCGGCAGTTCCCCGGCAAGAAACTGGAATGGATGGGCTACATCTAT ACCAGCGGCCGGACCTCCTACAACCCCAGCCTGAAGTCCCGGATCTCCATCACC CGGGACACCTCCAAGAACCAGTTCTTTCTGCAGCTGAACTCCATGACCACCGAG GACACCGCCACCTACTACTGCGCCGACATGGCCGATAAGGGCGGATGGTTCGCT TACTGGGGCCAGGGCACACTCGTGACCGTGTCCTCTGCTTCCACCAAGGGCCCCT CCGTGTTTCCTCTGGCCCCTTGCTCCAGATCCACCTCCGAGTCTACCGCCGCTCT GGGCTGCCTCGTGAAAGACTACTTCCCCGAGCCCGTGACAGTGTCTTGGAACTCT GGCGCCCTGACCTCTGGCGTGCACACCTTTCCAGCTGTGCTGCAGTCCTCCGGCCT GTACTCCCTGTCCTCCGTCGTGACTGTGCCCTCCAGCTCTCTGGGCACCAAGACCT ACACCTGTAACGTGGACCACAAGCCCTCCAACACCAAGGTGGACAAGCGGGTGG AATCTAAGTACGGCCCTCCCTGCCCTCCTTGCCCAGCCCCTGAATTTCTGGGCGGA CCTTCTGTGTTTCTGTTCCCCCCAAAGCCCAAGGACACCCTGATGATCTCCCGGAC CCCCGAAGTGACCTGCGTGGTGGTGGATGTGTCCCAGGAAGATCCCGAGGTGCA GTTCAATTGGTACGTGGACGGCGTGGAAGTGCACAACGCCAAGACCAAGCCTAG AGAGGAACAGTTCAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCA CCAGGATTGGCTGAACGGCAAAGAGTACAAGTGCAAGGTGTCCAACAAGGGCC TGCCCAGCTCCATCGAAAAGACCATCTCCAAGGCTAAGGGCCAGCCCCGCGAGC CCCAGGTGTACACACTGCCTCCAAGCCAGGAAGAGATGACCAAGAATCAGGTGT CACTGACCTGTCTCGTGAAGGGCTTCTACCCCTCCGATATCGCCGTGGAATGGGA GTCCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACTC CGACGGCTCCTTCTTTCTGTACTCTCGCCTGACCGTGGACAAGTCCCGGTGGCAG GAAGGCAACGTGTTCTCCTGCTCTGTGATGCACGAGGCCCTGCACAACCACTAC ACCCAGAAGTCCCTGAGCCTGTCCCCCGGCTGATGA(SEQ ID NO:13)。
轻链核酸序列:
ATGTCCGTGCCCACCCAGGTGCTGGGATTGCTGCTGCTGTGGCTGACCGACGCC AGATGCGACATCGTGATGACCCAGTCCCCCTCCTCCCTGGCTGTGTCTGCTGGCG AGAAAGTGACCATCTCCTGCCTGTCCTCCCAGTCCCTGTTCTCCAGCAACACCAA GCGGAACTACCTGAACTGGTATCTGCAGAAGCCCGGCCAGTCCCCTAAGCTGCT GATCTACCACGCCTCCACCAGACTGACCGGCGTGCCCGGAAGATTCATCGGCTC TGGCTCTGGCACCGACTTCACCCTGACCGTGTCTACCGTGCAGGCCGAGGACCT GGGCGACTACTTCTGCCAGCAGCACTACGAGACACCCCTGACCTTTGGCGACGG CACCCGGCTGGAAATCAAGAGAACCGTGGCCGCTCCCTCCGTGTTCATCTTCCCA CCTTCCGACGAGCAGCTGAAGTCCGGCACCGCTTCTGTCGTGTGCCTGCTGAACA ACTTCTACCCCCGCGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGT CCGGCAACTCCCAGGAATCCGTGACCGAGCAGGACTCCAAGGACAGCACCTACT CCCTGTCCTCTACCCTGACCCTGAGCAAGGCCGACTACGAGAAGCACAAGGTGT ACGCCTGCGAAGTGACCCACCAGGGCCTGTCTAGCCCCGTGACCAAGTCTTTCA ACCGGGGCGAGTGCTGATGA(SEQ ID NO:14)。
重链蛋白序列:
MEWSWVFLFFLSVTTGVHSQIQLQESGPGLVKPSQSLSLTCSVTGFSITTGGYYWNW IRQFPGKKLEWMGYIYTSGRTSYNPSLKSRISITRDTSKNQFFLQLNSMTTEDTATYY CADMADKGGWFAYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKD YFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHK PSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDV SQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYK CKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIA VEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALH NHYTQKSLSLSPG**(SEQ ID NO:15)。
轻链蛋白序列:
MSVPTQVLGLLLLWLTDARCDIVMTQSPSSLAVSAGEKVTISCLSSQSLFSSNTKRN YLNWYLQKPGQSPKLLIYHASTRLTGVPGRFIGSGSGTDFTLTVSTVQAEDLGDYFC QQHYETPLTFGDGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKV QWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGL SSPVTKSFNRGEC**(SEQ ID NO:16)。
本说明书提到的所有公开和专利均通过引用结合在此,引用程度就如同每个单独 公开或专利申请特定地并且单独地指示通过引用以其全文结合在此一般。在结合本发 明的特定实施例对其进行描述的同时,将会理解,能够进行进一步的修改,且本申请 意在涵盖任何一般而言依循本发明的原理的变化、用途或改编,且包括这样的偏离当 前披露的内容:其在本发明所属领域的已知或惯常操作内、且可适用于此前所示的关 键特征。
- 还没有人留言评论。精彩留言会获得点赞!