中枢神经系统疾病的成像、诊断和/或治疗用化合物的制作方法与工艺
中枢神经系统疾病的成像、诊断和/或治疗用化合物本申请为国际申请PCT/EP2011/068124于2013年6月17日进入中国国家阶段、申请号为201180060749.X、发明名称为“中枢神经系统疾病的成像、诊断和/或治疗用化合物”的分案申请。技术领域本发明涉及适合于标记或已经被18F标记的新化合物、制备这样的化合物的方法、包含这样的化合物的组合物、包含这样的化合物或组合物的试剂盒,以及这样的化合物、组合物或试剂盒在通过正电子发射断层扫描术(PET)进行诊断成像中的应用。
背景技术:
在肿瘤学、神经学和心脏病学领域中,分子成像具有比大多数常规方法更早检测疾病、疾病进展或治疗有效性的潜力。在数种已开发的有希望的分子成像技术例如光学成像、核磁共振成像(MRI)、单光子发射计算机断层扫描术(SPECT)和正电子发射断层扫描术(PET)中,PET由于其高灵敏度和提供定量和动力学数据的能力,对于药物开发来说也是特别重要的。例如,发射正电子的同位素包括碳、碘、氟、氮和氧。这些同位素能够代替它们在靶化合物中的非放射活性对应物以产生在生物学上有功能并在化学上与用于PET成像的原始分子一致的示踪剂,或者能够连接于所述对应物以产生相应母体效应分子的密切类似物。在这些同位素中,18F由于其相对长的半衰期(110分钟),因而是最方便的标记同位素,所述相对长的半衰期允许制备诊断示踪剂并随后对生物化学过程进行研究。此外,它的低β+能量(634keV)也是有利的。亲核芳香族和脂族[18F]-氟-氟化反应,对于被用作靶向并可视化疾病例如实体肿瘤或脑疾病的体内成像剂的[18F]-氟-标记的放射性药物来说,是极为重要的。在使用[18F]-氟-标记的放射性药物中非常重要的技术目标是放射活性化合物的快速制备和施用。单胺氧化酶(MAO,EC,1.4.3.4)代表了一类独特的胺氧化酶。单胺氧化酶存在两种被称为MAO-A和MAO-B的同工型(Med.Res.Rev.1984,4:323-358)。已报道了与配体复合的MAO-A和MAO-B的晶体结构(J.Med.Chem.2004,47:1767-1774和Proc.Nat.Acad.Sci.USA2005,102:12684-12689)。在人脑中,MAO-B的存在显著超过MAO-A。脑MAO-B水平随着年龄而增加,并且在阿尔兹海默氏病(AD)患者的脑中,主要由于反应性星形胶质细胞的增加而被进一步上调。由于在神经炎性过程中星形胶质细胞活性被上调并且因此MAO-B系统的活性被上调,因此放射性标记的MAO-B抑制剂可以在神经炎症和神经变性、包括阿尔兹海默氏病中用作成像生物标志物。对MAO-A或MAO-B具有选择性的抑制剂已被鉴定和研究(例如J.Med.Chem.2004,47:1767-1774和Proc.Nat.Acad.Sci.USA,2005,102:12684-12689)。MAO-B抑制剂丙炔苯丙胺(化合物A)(Biochem.Pharmacol.1972,5:393-408)和MAO-A抑制剂氯吉兰(B)(ActaPsychiatr.Scand.Suppl.1995,386:8-13)是诱导相应酶的不可逆抑制的强效单胺氧化酶抑制剂。丙炔苯丙胺的(R)-异构体(化合物(R)-A)是比(S)-异构体(未示出)更强效的抑制剂。还已经描述了抑制剂的神经保护性和其他药物效果(Curr.Pharm.Des.2010,16:2799-2817;NatureReviewsNeuroscience2006,295:295-309;Br.J.Pharmacol.2006,147:5287-5296;J.AlzheimersDis.2010,21:361-371;Prog.Neurobiol.2010,92:330-344)。例如,MAO-B抑制剂被用于提高CNS中DOPA的水平(Progr.DrugRes.1992,38:171-297),并且基于在与阿尔兹海默氏斑块相关的星形胶质细胞中包含升高水平的MAO-B这一事实,它们已被用在治疗阿尔兹海默氏病(AD)的临床试验中(Neuroscience1994,62:15-30)。已合成了氟化的MAO抑制剂并对其进行生物化学评估(Kirk等,《氟与健康》(FluorineandHealth),A.Tressaud和G.Haufe(编辑),Elsevier2008,pp.662-699)。18F和11C标记的MAO抑制剂已在体内进行研究(JournaloftheNeurologicalScience2007,255:17-22;综述:Methods2002,27:263-277)。18F标记的丙炔苯丙胺和丙炔苯丙胺类似物(D)和(E)也已被报道(分别在Int.J.Radiat.Appl.Instrument.PartA,AppliedRadiationIsotopes,1991,42:121;J.Med.Chem.1990,33:2015-2019和Nucl.Med.Biol.1990,26:111-116中)。在所述11C标记的MAO抑制剂中,[11C]-L-丙炔苯丙胺-D2,也称为DED([11C]-L-双氘-丙炔苯丙胺),已被多个研究组从它们对MAO-B活性的影响方面广泛用于研究CNS疾病,例如癫痫(ActaNeurol.Scand.2001,103:360;ActaNeurol.Scand.1998,98:224;Epilepsia1995,36:712)、肌萎缩侧索硬化症(ALS,参见J.Neurolog.Sci.2007,255:17)和外伤性脑损伤(Clin.PositronImaging1999,2:71)。此外,已在患有阿尔兹海默氏病(AD)的患者和健康对照中进行了包括DED的比较性多示踪剂研究(NeuroImage2006,33:588)。此外,DED还被用于研究吸烟和年龄对MAO-B活性的影响(Neurobiol.Aging1997,18:431;Nucl.Med.Biol.2005,32:521;Proc.Nat.Acad.Sci.USA2003,20:11600;LifeSci.1998,63:2,PL19;J.Addict.Disease1998,17:23)。DED的非氘化类似物[11C]-L-丙炔苯丙胺非常快速且不可逆地结合于MAO-B。结果,该示踪剂可以以与其被血浆递送的速率相近或更高的速率被捕获,使得具有高MAO-B水平和/或低血液流量的区域的PET图像代表灌注而不是MAO-B活性。由于同位素动力学效应造成DED的结合较慢,因此DED与其非氘化对应物相比允许更准确地评估MAO-B活性(参见例如J.Nucl.Med.1995,36:1255;J.Neurochem.1988,51:1524)。WO2009/052970A2公开了L-丙炔苯丙胺的新的18F标记的类似物。下面示出的化合物F的特点在于与[11C]-L-丙炔苯丙胺和上述的18F标记的MAO-B抑制剂D和E相比,在狒狒脑中有利的摄入和改进的性质,例如优越的代谢稳定性。可以预期,如同DED中所导入的在炔丙基位置处的氘化,也将引起化合物F的捕获速率的降低(Fowler等,JNeurochem.1988;51:1524-1534)。为清楚起见,向读者指出下述事实:F的合成,与从醇中间体例如G制备其适合的前体例如J相似,被认为经由涉及吖丙啶离子H的重排反应来进行。所述重排可以产生如此处示例的产物的位置异构混合物。因此,由于其氯基团的离去基团性质造成的位置异构前体J1和J2可以在适合条件下保持平衡,此时F可以容易地与其次要的位置异构体分离开,并在通向平衡的过程中稳定。关于吖丙啶离子重排的其他信息,参见例如P.Gmeiner等,J.Org.Chem.1994,59:6766。吖丙啶重排以立体特异性方式进行,如WO2010/121719A1中所述(也参见上述出版物和J.Cossy等,Chem.Eur.J.2009,15:1064)。待解决的问题及其解决方案本发明的目的是找到与现有技术状态相比具有优越的信号与背景比率特点的与MAO-B结合的18F标记的化合物,其可用于利用靶向单胺氧化酶B的PET成像来检测反应性星形胶质细胞;以及鉴定用于制备所述化合物的适合的前体。通过提供本发明的化合物实现了所述目的,所述化合物在靶区域中显示出优异的摄入,并令人吃惊地伴有显著增强的洗出,产生较低的不希望的信号例如非特异性结合,正如在图5a和5b中突出显示的。该效应强烈地超过对来自于最接近的现有技术(参见下面的文献参考)的化合物所报道的效应,因此本领域技术人员不能预料到该效应。令人吃惊的是,在稳态阶段中,在所研究的脑区域中观察到从[18F]丙炔苯丙胺到[18F]D2丙炔苯丙胺,信号强度降低6-8倍(参见图5a)。从使用[11C]丙炔苯丙胺的研究了解到,在具有高MAO-B活性的区域中,由于近似于或超过递送的高捕获速率,MAO-B信号被低估(Fowler等,JNuclMed1995,36:1255)。据报道,[11C]丙炔苯丙胺的氘化引起捕获速率降低,导致信号的定量更可靠。然而,在与我们所研究的区域相当的健康狒狒和人的脑区域例如纹状体、丘脑和皮层中所观察到的氘化对[11C]D2丙炔苯丙胺(DED)的信号强度降低的效应,仅仅为约1.2-2.0倍(Fowler等,J.Neurochem1988,51:1524-1534;J.Nucl.Med.1995,36:1255-1262;Mol.ImagingBiol.2005,7:377-387)。前述比率的出人意料显著的提高(6至8倍,与此相比,在现有技术中为1.2至2.0倍),使本发明的化合物成为优越的PET成像剂。
技术实现要素:
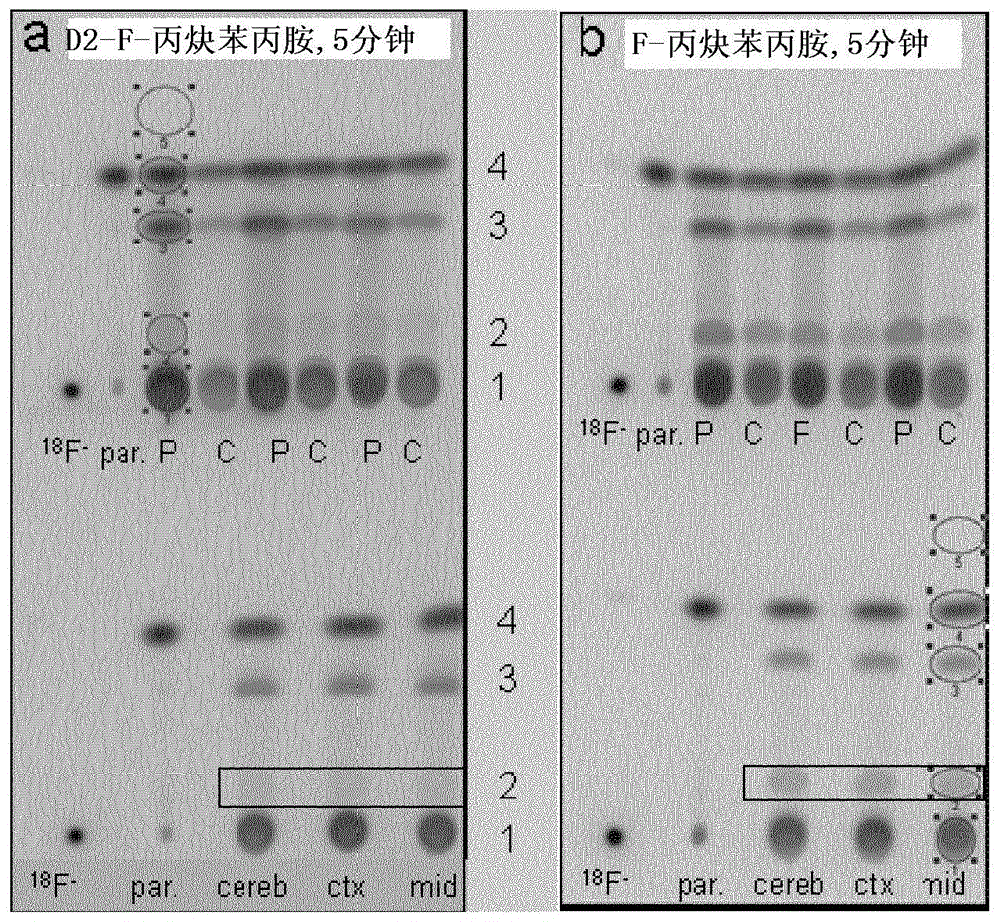
本发明涵盖了通式I的化合物:其中,D是氘;R1选自甲基、乙基、正丙基、正丁基、异丁基;R2是氟、[18F]氟或离去基团;n和m选自0和1,其前提是如果n=0,则m必须为1,如果n=1,则m必须为0,并且如果R2是氟,则n必须为1且m必须为0;所述通式I的化合物包括所述化合物的所有立体异构形式,包括但不限于对映异构体和非对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐、酯、复合物或溶剂化物。本发明还涉及制备这样的化合物的方法、包含这样的化合物的组合物、包含这样的化合物或组合物的试剂盒,以及这样的化合物、组合物或试剂盒在通过正电子发射断层扫描术(PET)进行诊断成像中的应用。具体实施方式定义当在本文中使用时,“离去基团”是指选自下列的官能团:卤素,特别是氯、溴、碘,甲磺酰氧基,对甲苯磺酰氧基,三氟甲磺酰氧基,九氟丁磺酰氧基,(4-溴苯)磺酰氧基,(4-硝基苯)磺酰氧基,(2-硝基苯)-磺酰氧基,(4-异丙基苯)磺酰氧基,(2,4,6-三异丙基苯)-磺酰氧基,(2,4,6-三甲基苯)磺酰氧基,(4-叔丁基苯)磺酰氧基,苯磺酰氧基和(4-甲氧基苯)磺酰氧基。当其自身或作为另一个基团的一部分被用在本文中时,术语“芳基”是指在环部分中含有6至12个碳、优选在环部分中含有6-10个碳的单环或双环芳香族基团,例如苯基、联苯基、萘基或四氢萘基。优选的芳基是苯基。当在本文中在本发明的说明书和权利要求书中使用时,术语“烷基”自身或作为另一个基团的一部分,是指具有1至6个碳原子的直链或支链烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、异戊基、新戊基、己基。当在本文中在本发明的说明书和权利要求书中使用时,术语“无机酸”和“有机酸”是指无机酸,其包括但不限于:诸如碳酸、硝酸、磷酸、盐酸、高氯酸或硫酸的酸,或其酸式盐例如硫酸氢钾,或者是指适合的有机酸,其包括但不限于:诸如脂族酸、环脂族酸、芳香族酸、芳脂族酸、杂环酸、羧酸或磺酸的酸,其实例分别为甲酸、乙酸、三氟乙酸、丙酸、琥珀酸、乙醇酸、葡萄糖酸、乳酸、苹果酸、延胡索酸、丙酮酸、苯甲酸、邻氨基苯甲酸、甲磺酸、延胡索酸、水杨酸、苯乙酸、扁桃酸、扑酸、甲磺酸、乙磺酸、苯磺酸、泛酸、甲苯磺酸、三氟甲磺酸和对氨基苯磺酸。本发明的化合物可以作为溶剂化物例如水合物存在,其中本发明的化合物可以含有有机溶剂或水作为化合物晶格的结构要素。所述溶剂的量可以以化学计量或非化学计量的比率存在。在化学计量的溶剂化物例如水合物的情况下,半、单、倍半、二、三、四、五等的溶剂化物或水合物是可能的。由于在本发明的化合物中存在至少一个手性中心并且可能存在另一种形式的异构中心,因此从所述异构中心产生的所有异构形式、包括对映异构体和非对映异构体,都打算被涵盖在本文中。含有手性中心的化合物可以作为外消旋混合物或作为对映异构富集混合物而被使用,或者可以使用公知的技术分离外消旋混合物并且可以使用单一的对映异构体。术语“卤素”是指氟(F)、氯(Cl)、溴(Br)或碘(I);术语“卤化物”是指氟化物、氯化物、溴化物或碘化物。本发明的主题内容在第一方面,本发明涉及通式I的化合物其中,D是氘;R1选自甲基、乙基、正丙基、正丁基、异丁基;R2是氟、[18F]氟或离去基团,其中优选的离去基团选自卤素、任选被氟取代的C1-C6-烷基磺酰氧基和任选被氢、甲基、卤素和硝基取代的芳基磺酰氧基,并且其中特别优选的离去基团是氯、溴、甲磺酰氧基和对甲苯磺酰氧基,并且其中最优选的离去基团是氯;n和m选自0和1,其前提是如果n=0,则m必须为1,如果n=1,则m必须为0,并且如果R2是氟,则n必须为1且m必须为0;所述通式I的化合物包括所述化合物的所有立体异构形式,包括但不限于对映异构体和非对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐、酯、复合物或溶剂化物。在优选实施方式中,本发明涉及通式I的化合物:其中D是氘;R1是甲基;R2选自氟或氯;n和m选自0和1,其前提是如果n=0,则m必须为1,如果n=1,则m必须为0,并且如果R2是氟或[18F]氟,则n必须为1且m必须为0;所述通式I的化合物包括对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐或溶剂化物。在更优选实施方式中,本发明涉及通式Ia的化合物:其中D是氘;R2选自氟或氯;所述通式Ia的化合物包括对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐或溶剂化物。在另一种更优选实施方式中,本发明涉及通式Ib的化合物:其中D是氘;R2是氯;所述通式Ib的化合物包括对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐或溶剂化物。在甚至更优选的实施方式中,本发明涉及通式Ic的化合物:所述通式Ic的化合物包括对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐或溶剂化物。在另一种甚至更优选的实施方式中,本发明涉及通式Id的化合物:所述通式Id的化合物包括对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐或溶剂化物。在特别优选的实施方式中,本发明涉及通式Ie的化合物及其与有机酸或无机酸的任何适合的盐或溶剂化物:其中F=19F。在特别优选的实施方式中,本发明涉及通式Ie的化合物及其与有机酸或无机酸的任何适合的盐或溶剂化物:其中F=19F。在特别优选的实施方式中,本发明涉及通式If的化合物及其与有机酸或无机酸的任何适合的盐或溶剂化物:在第二方面,本发明涉及从适合的起始材料合成式I的化合物,其中R2表示如上定义的离去基团。这样的化合物是用于引入R2=18F、即用于产生18F标记的放射性示踪剂的有用前体。所述起始材料可以包含但不限于通式IIa的醇:这样的合成包括但不限于在适合的碱例如三烷基胺例如三乙胺或例如杂芳族碱例如吡啶或2,6-二甲基吡啶存在下,在适合的溶剂例如任选卤代的烃例如二氯甲烷或醚例如四氢呋喃中,与磺酰卤例如甲磺酰氯或对甲苯磺酰氯反应。所述合成方法还可以包括但不限于使用磺酸酐例如甲磺酸酐代替上述磺酰卤,以给出其中R2是磺酸酯的式II的化合物。所述合成方法还可以包括使用四卤化碳例如四氯甲烷或四溴甲烷以及适合的有机磷试剂例如三苯基膦或三正丁基膦,以将通式IIa的醇转变成通式I的化合物,其中R2表示离去基团。在优选实施方式中,本发明涉及从式IIb的醇合成如上所述的式Id的化合物:在更优选实施方式中,本发明涉及通过将IIb与适合的磺酰氯在如上所述适合的碱存在下,在适合的溶剂中进行反应,从式IIb的醇合成如上所述的式Id的化合物。在特别优选实施方式中,本发明涉及通过将IIc与适合的磺酰氯在如上所述适合的碱存在下,在适合的溶剂中进行反应,从式IIc的醇合成如上所述的式If的化合物:在另一种特别优选实施方式中,本发明涉及通过将式IIb或IIc的醇与磺酰氯例如甲磺酰氯或对甲苯磺酰氯,在适合的碱例如三烷基胺例如三乙胺存在下,在适合的溶剂例如卤代烃例如二氯甲烷中进行反应以实现将式Ia的化合物所展示的羟基转变成氯基团,从式IIb或IIc的醇合成如上所述的式Id或If的化合物。首先,允许从所有反应物合在一起得到的反应混合物在-50℃至+30℃、优选-30℃至+30℃、甚至更优选-10℃至+25℃之间的温度下反应5分钟至6小时、优选15分钟至4小时、甚至更优选30分钟至2小时范围内的适合时间,然后将反应混合物加热5分钟至6小时、优选15分钟至4小时、甚至更优选30分钟至2小时范围内的适合时间,直至70℃至130℃、优选80℃至120℃、甚至更优选90℃至110℃之间的温度范围。加热时间段实现具有其相应的主要位置异构体的最初形成的Id/If混合物的转化,所述主要位置异构体反映了相应起始材料IIb或IIc的组成。在第三方面,本发明涉及合成方法,所述方法包括其中R2表示离去基团的通式I的化合物与其中F=18F的F-氟化剂的反应,以给出其中R2被18F代替的化合物。所述F-氟化剂是包含F-阴离子的化合物,优选为选自但不限于下列的化合物:4,7,13,16,21,24-六氧杂-1,10-二氮杂双环[8.8.8]-二十六烷KF即冠醚盐KryptofixKF,KF,HF,KHF2,CsF,NaF和F的四烷基铵盐,例如四丁基氟化铵,并且其中F=18F,以给出其中R2被18F代替的化合物。在优选实施方式中,本发明涉及通过将通式Id的化合物与其中F=18F的F-氟化剂反应来合成其中F=18F的通式Ic的化合物的方法。所述F-氟化剂是包含F-阴离子的化合物,优选为选自但不限于下列的化合物:4,7,13,16,21,24-六氧杂-1,10-二氮杂双环[8.8.8]-二十六烷KF即冠醚盐KryptofixKF,KF,HF,KHF2,CsF,NaF和F的四烷基铵盐,例如四丁基氟化铵,并且其中F=18F。在另一种优选实施方式中,本发明涉及通过将通式If的化合物与其中F=18F的F-氟化剂反应来合成其中F=18F的通式Ie的化合物的方法。所述F-氟化剂是包含F-阴离子的化合物,优选为选自但不限于下列的化合物:4,7,13,16,21,24-六氧杂-1,10-二氮杂双环[8.8.8]-二十六烷KF即冠醚盐KryptofixKF,KF,HF,KHF2,CsF,NaF和F的四烷基铵盐,例如四丁基氟化铵,并且其中F=18F。在第四方面,本发明涉及通式I的化合物用于制备18F标记的诊断成像剂或成像剂,优选作为用于PET应用的成像剂的应用。在更优选实施方式中,所述PET应用被用于CNS疾病的成像。CNS疾病包括但不限于炎性和自体免疫性、过敏性、传染性和毒素引发以及缺血引发的疾病,具有病理生理学相关性的药理学引发的炎症,神经炎性、神经变性疾病。更优选情况下,CNS疾病选自多发性硬化症、阿尔兹海默氏病、额颞叶痴呆症、路易体痴呆症、脑白质病、癫痫、神经性疼痛、肌萎缩侧索硬化症、帕金森氏病、脑病、脑肿瘤、抑郁症、药物滥用、嗜瘾疾病、粉瘤、动脉粥样硬化、药理学引发的炎症、起源不明的全身性炎症。在特别优选实施方式中,所述PET应用被用于痴呆症相关疾病例如阿尔兹海默氏病的成像。在另一种特别优选实施方式中,所述PET应用被用于神经炎性疾病例如多发性硬化症的成像。本发明还涉及包含式I的化合物的试剂盒。这样的试剂盒可以含有至少一个密封小瓶,所述密封小瓶含有式I的化合物。所述试剂盒还可以含有适合于执行本文公开的反应的试剂。本文公开的试剂也可以被包含在这样的试剂盒中,并可以储存在密封小瓶中。所述试剂盒还可以含有18F标记试剂。此外,所述试剂盒可以含有它的使用说明书。在第五方面,本发明涉及通式I的化合物用于执行生物测定和层析鉴定的应用。更优选情况下,所述应用涉及其中R2是18F或19F、更优选为19F的通式I的化合物。其中氟同位素是19F的通式I的化合物可用作参比物和/或测量试剂。通式I的化合物在本文中如上所定义,并涵盖所有实施方式和优选特征。具体来说,本发明涉及:1.式I的化合物:其中D是氘;R1选自甲基、乙基、正丙基、正丁基、异丁基;R2是氟、[18F]氟或离去基团,其中离去基团选自卤素、任选被氟取代的C1-C6-烷基磺酰氧基和任选被氢、甲基、卤素和硝基取代的芳基磺酰氧基;n和m选自0和1,其前提是如果n=0,则m必须为1,如果n=1,则m必须为0,并且如果R2是氟,则n必须为1且m必须为0;所述式I的化合物包括所述化合物的所有立体异构形式,包括但不限于对映异构体和非对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐、酯、复合物或溶剂化物。2.第1项的化合物,其中R2选自氯、溴、甲磺酰氧基和对甲苯磺酰氧基。3.第1或2项的化合物,其中D是氘;R1是甲基;R2选自氟或氯。4.式Ia的化合物:其中D是氘;R2选自氟或氯;所述式Ia的化合物包括对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐或溶剂化物。5.式Ib的化合物:其中D是氘;R2是氯;所述式Ib的化合物包括对映异构体以及外消旋混合物,及其与有机酸或无机酸的任何适合的盐或溶剂化物。6.化合物,其选自:式Ic的化合物,式Id的化合物,式Ie的化合物,其中F=18F,式Ie的化合物,其中F=19F,式If的化合物,及其与有机酸或无机酸的任何适合的盐或溶剂化物。7.第1、3、4和6项的[18F]标记的化合物,其作为诊断化合物用于PET成像。8.诊断组合物,其包含第1、3、4和6项的[18F]标记的化合物,用于PET成像。9.第1、3、4和6项的[18F]标记的化合物,其作为诊断化合物用于CNS疾病的PET成像。10.诊断组合物,其包含第1、3、4和6项的[18F]标记的化合物,用于CNS疾病的PET成像。11.第7至10项的化合物或组合物,其用于阿尔兹海默氏病的成像。12.第7至11项的化合物或组合物,其中[18F]标记的化合物是式Ie的化合物:其中F=18F。13.用于合成式I的化合物的方法:其中D是氘;R1选自甲基、乙基、正丙基、正丁基、异丁基;R2是离去基团,其中离去基团选自卤素、任选被氟取代的C1-C6-烷基磺酰氧基和任选被氢、甲基、卤素和硝基取代的芳基磺酰氧基;n和m选自0和1,其前提是如果n=0,则m必须为1,如果n=1,则m必须为0,并且如果R2是氟,则n必须为1且m必须为0;所述方法的特征在于,将式IIa的化合物与磺酸酐或磺酰卤进行反应:14.用于合成式Ib的化合物的方法:其中D是氘;R2是氯;所述方法的特征在于,将式IIb的化合物与磺酰氯进行反应:15.第14项的方法,其中磺酰氯是甲磺酰氯。16.第14或15项的方法,其用于合成式If的化合物:所述方法的特征在于,将式IIc的化合物与甲磺酰氯进行反应:17.用于合成式I的化合物的方法:其中:D是氘;R1选自甲基、乙基、正丙基、正丁基、异丁基;R2是[18F]氟;n是1并且m是0;所述方法的特征在于,将式I的化合物与适合的其中F是18F的F-氟化剂进行反应:其中D是氘;R1选自甲基、乙基、正丙基、正丁基、异丁基;R2是离去基团,其中离去基团选自卤素、任选被氟取代的C1-C6-烷基磺酰氧基和任选被氢、甲基、卤素和硝基取代的芳基磺酰氧基;n为0并且m为1。18.第17项的方法,其用于合成式Ic的化合物:其中F是18F,所述方法的特征在于,将式Id的化合物与适合的其中F是18F的F-氟化剂进行反应:19.第17或18项的方法,其用于合成式Ie的化合物:其中F是18F,所述方法的特征在于,将式If的化合物与适合的其中F是18F的F-氟化剂进行反应:20.试剂盒,其包含至少一个密封容器,所述密封容器包含第1-12项的化合物或组合物。21.试剂盒,其包含至少一个密封容器,所述密封容器包含第6项的化合物。22.第20和21项的试剂盒,其包含含有试剂的附加的密封容器。23.第1至6项的18F标记的化合物在制备用于CNS疾病的PET成像的诊断组合物中的应用,其中更优选情况下所述CNS疾病是阿尔兹海默氏病。24.第1至6项的18F标记的化合物在诊断CNS疾病、更优选为阿尔兹海默氏病的PET方法中的应用,所述方法包括向患者施用诊断有效量的所述化合物。25.第1至6项的F-标记的化合物用于执行生物测定和层析鉴定的应用,其中F是18F或19F。在本发明的情形中,CNS疾病包括但不限于炎性和自体免疫性、过敏性、传染性和毒素引发以及缺血引发的疾病,具有病理生理学相关性的药理学引发的炎症,神经炎性、神经变性疾病。更优选情况下,CNS疾病选自多发性硬化症、阿尔兹海默氏病、额颞叶痴呆症、路易体痴呆症、脑白质病、癫痫、神经性疼痛、肌萎缩侧索硬化症、帕金森氏病、脑病、脑肿瘤、抑郁症、药物滥用、嗜瘾疾病、粉瘤、动脉粥样硬化、药理学引发的炎症、起源不明的全身性炎症。在特别优选实施方式中,所述PET应用被用于痴呆症相关疾病例如阿尔兹海默氏病的成像。在另一种特别优选实施方式中,所述PET应用被用于神经炎性疾病例如多发性硬化症的成像。根据本发明,本发明的18F-标记的化合物是用于CNS疾病、特别是阿尔兹海默氏病和多发性硬化症的成像或诊断的有用的PET示踪剂。本发明化合物的通用合成本发明化合物的合成始于通式II的氨基醇中间体。许多这样的氨基醇对于本领域技术人员来说是已知的,并可以从通常可商购的适合的氨基酸构建基块或适当保护的中间体容易地合成。然后,导入氘化的炔丙基以给出叔胺IIa。这可以使用按照Fowler等,Nucl.Med.Biol.2001,28(7):779-785制备的粗品3-溴(3,3-2H2)-1-丙炔来执行;然而,在我们的手中,发现相应的甲苯磺酸酯III由于较低的挥发性和更好的可检测性而更为实用。它容易地制备自上面给出的参考文献中所描述的氘化炔丙基醇。路线1:从通式II的起始材料制备通式IIa的中间体,其中R1、n和m如本发明的权利要求书和说明书中所定义。然后通过本领域技术人员已知的方法例如磺酰化或卤化,将得到的氨基醇IIa的羟基转化成离去基团。路线2:从其中R1、n和m如本发明的权利要求书和说明书中所定义的通式IIa的中间体,制备其中R1、n和m如本发明的权利要求书和说明书中所定义并且其中R2是离去基团的本发明的通式I的化合物。在该点处值得注意的是,磺酸酯只能从磺酸酐获得,因为最初从磺酰氯形成的磺酸酯变得容易被同时产生的氯平衡离子置换。据报道,所述磺酸酯容易经由中间体吖丙啶离子而经历重排,所述重排可以产生产物的位置异构混合物,参见例如L.Lehmann等,WO2009/052970A2。关于吖丙啶离子重排的其他信息,参见例如P.Gmeiner等,J.Org.Chem.1994,59:6766。吖丙啶重排以立体特异性方式进行,如WO2010/121719A1中所述(也参见上述出版物和J.Cossy等,Chem.Eur.J.2009,15:1064)。在提供热力学控制的适合条件下,可以以高选择性形成热力学上更稳定的产物,如下面示出的实施例中所示,并且如对下面化合物If的合成所说明的。路线3:经由涉及吖丙啶离子的重排来制备本发明的通式If的化合物。得到的其中R2是离去基团的通式I的化合物,可以通过本领域技术人员已知的放射性氟化方法转变成放射性示踪剂(其中R2=18F),所述放射性氟化方法例如4,7,13,16,21,24-六氧杂-1,10-二氮杂双环[8.8.8]-二十六烷KF即冠醚盐KryptofixKF,KF,HF,KHF2,CsF,NaF和F的四烷基铵盐,例如四丁基氟化铵,并且其中F=18F。这些反应通常也可能经由中间体吖丙啶离子产生位置异构混合物,可以利用HPLC分离所述位置异构混合物以给出所需的主要位置异构体Ig。路线4:从其中R1、n和m如本发明的权利要求书和说明书中所定义并且其中R2是离去基团的通式I的本发明化合物,制备其中R1如本发明的权利要求书和说明书中所定义的通式Ig的本发明化合物。以类似的方式,通过本领域技术人员已知的方法,例如在Et3Nx3HF存在下与九氟丁磺酰氟反应,可以将氨基醇IIa转变成相应的无放射活性的氟化物Ih。这些反应通常也可能经由中间体吖丙啶离子而产生位置异构混合物。路线5:从其中R1、n和m如本发明的权利要求书和说明书中所定义的通式IIa的中间体,制备其中R1如本发明的权利要求书和说明书中所定义的通式Ih的本发明化合物。附图说明图1:在4小时的时间框中示出了经由γ-检测器检测到的[18F]D2丙炔苯丙胺(实施例3的化合物)在小鼠脑(n=3)中的分布。图2:使用由10%己烷/90%乙酸乙酯构成的溶剂产生的薄层层析图(TLC)的放射自显影。在5分钟p.i.时研究了小鼠血浆、凝血和脑组织,以检测从(a)[18F]D2丙炔苯丙胺和(b)未氘化的[18F]丙炔苯丙胺(化合物F)产生的代谢物。圆圈勾画了用于通过使用软件ImageQuant5.2测量相应条带的目标区域(ROI)。与(b)(用正方形标记)相比,(a)中由ROI2表示的条带的强度降低。18F--游离的氟化物,par.-母体化合物,P-血浆,C-凝血(n=3只小鼠);cereb.-小脑,ctx-皮层,mid-中脑(对于每个区域来说,将来自于3只小鼠的组织合并);1-[18F]甲基苯丙胺;2-[18F]苯丙胺;3-分别为[18F]去甲丙炔苯丙胺(Nordeprenyl)和[18F]D2去甲丙炔苯丙胺;4-分别为[18F]D2丙炔苯丙胺和未氘化的[18F]丙炔苯丙胺。图3:[18F]D2丙炔苯丙胺和未氘化的[18F]丙炔苯丙胺在食蟹猴血浆中的体内时间过程的演示。图4:(a)[18F]D2丙炔苯丙胺和(b)未氘化的[18F]丙炔苯丙胺在食蟹猴血浆中的体内代谢的演示。示出了母体化合物以及代谢物的时间过程,其被表示成从相应的HPLC色谱图产生的[面积%]。图5:分别使用[18F]D2丙炔苯丙胺和未氘化的[18F]丙炔苯丙胺进行的在食蟹猴的不同脑区域中的PET。(a)时间活性曲线(TAC),其被表示成在120分钟的时间中[18F]D2丙炔苯丙胺的SUV的百分数,并与未氘化的[18F]丙炔苯丙胺的相应TAC进行比较。(b)在注射[18F]D2丙炔苯丙胺后同一食蟹猴的脑的三个平面(横切、冠状和矢状)的图像。令人吃惊的是,在所研究的食蟹猴的脑区域中,在30至120分钟之间,与未氘化的[18F]丙炔苯丙胺的信号相比,被表示为TAC中标准摄入值(SUV)的百分数的[18F]D2丙炔苯丙胺的信号降低了6至8倍(图5a)。这是意料之外的,因为在与我们所研究的区域相当的狒狒和人的脑区域例如纹状体、丘脑、皮层中观察到的从[11C]丙炔苯丙胺与[11C]D2丙炔苯丙胺(DED)相比获知的由氘化效应造成的信号降低,仅仅为约1.2-2.0倍(Fowler等,J.Neurochem1988,51:1524-1534;J.Nucl.Med.1995,36:1255-1262;Mol.ImagingBiol.2005,7:377-387)。因此,在靶区域中,脑捕获也不太显著(图5b),并导致在背景信号方面与[11C]D2丙炔苯丙胺相比具有优势。图6:[18F]D2丙炔苯丙胺的制备型HPLC色谱图,其示出了所需18F放射性标记的产物的保留时间为tR=12.5分钟。图7:[18F]D2丙炔苯丙胺的分析型HPLC色谱图,其示出了所需18F放射性标记的产物的保留时间为tR=2.59分钟。图8:[19F]D2丙炔苯丙胺(实施例2的化合物)的分析型HPLC色谱图,其示出了所需非放射活性19F参比化合物的保留时间为tR=2.36分钟。图9:在大鼠、小鼠、狗、猴和人类微粒体以及大鼠和人类肝细胞制备物中的体外代谢物途径。代谢物通过LC/MS进行检测。(a)未氘化的[18F]丙炔苯丙胺的代谢物途径,以及(b)[18F]D2丙炔苯丙胺的代谢物途径。图10:通过PET观察到的[18F]D2丙炔苯丙胺在食蟹猴脑的不同区域中的分布。时间活性曲线(TAC)被表示为在120分钟的时间内标准摄入值的百分数(SUV[%])。具体实施方式实验部分概述:所有溶剂和化学品从商业来源获得,并且没有进一步纯化而直接使用。下面的表列出了在本段和实施例部分中使用的缩写词,只要它们没有在正文部分中进行解释。当NMR峰形出现在波谱中时对其进行陈述,没有考虑可能的更高阶效应。使用AdvancedChemicalDevelopment的ACDIUPAC命名软件产生化学名称。在某些情况下,使用可商购试剂的普遍接受的名称代替ACD/IUPAC产生的名称。使用微波辐射的反应可以使用Biotage微波炉来运行,所述微波炉任选装备有机器人单元。按照本发明的方法产生的化合物和中间体可能需要纯化。有机化合物的纯化对于本领域技术人员来说是公知的,并且同一化合物可能存在数种纯化方式。在某些情况下,纯化可能不是必需的。在某些情况下,化合物可以通过结晶来纯化。在某些情况下,杂质可以通过使用适合的溶剂研制来去除。在某些情况下,化合物可以通过层析、特别是快速柱层析来纯化,所述层析例如使用来自于例如Separtis的预装填的硅胶柱例如快速硅胶或快速NH2硅胶,并与例如FlashMasterII自动纯化仪(Argonaut/Biotage)和洗脱剂例如己烷/EtOAc或二氯甲烷/乙醇的梯度相组合。在某些情况下,化合物可以通过使用例如装备有二极管阵列检测器的Waters自动纯化仪的制备型HPLC和/或在线电喷雾电离质谱仪与适合的预装填反相柱的组合以及洗脱剂例如水和乙腈的梯度来进行纯化,所述洗脱剂可以含有添加剂例如三氟乙酸或氨水。在某些情况下,如上所述的纯化方法可以提供盐形式的并具有足够碱性的官能团的本发明化合物,例如在足够碱性的本发明化合物的情况下,例如为三氟乙酸盐或甲酸盐。这种类型的盐可以通过本领域技术人员已知的各种方法转化成其相应的游离碱形式。缩写词中间体1A:(2S)-2-(甲基氨基)-3-苯基-1-丙醇将氢化锂铝(6.35g,167mmol)分成小份加入到冷却至-10℃的N-甲基-L-苯丙氨酸(20g,112mmol)在THF(1200mL)中的悬液中。在初始的放热反应停止后,移除冷却浴,并将反应混合物加热回流过夜。随后,在冷却至-10℃后加入另一部分氢化锂铝(4.24g,112mmol),然后另外回流3h。将反应混合物冷却至-40℃,并小心地加入2N氢氧化钠水溶液。在升温至室温后,将混合物过滤,将残留物用MTB洗涤,并将滤液蒸发以给出粗品目标化合物(17.7g,得率96%),其不需进一步纯化而被直接使用。1HNMR(400MHz,DMSO-d6)δppm2.26(s,3H),2.51-2.62(m,3H)3.16-3.30(m,3H),7.11-7.25(m,5H)。MS(ESI):[M+H]+=166。中间体1B:(1,1-2H2)-2-丙炔-1-基4-甲基苯磺酸酯向(1,1-2H2)-2-丙炔-1-醇(3.40g,按照Fowler等,Nucl.Med.Biol.2001,28(7):779-785制备,与残留乙醇的分离通过分馏来实现)在二氯甲烷(250mL)中的溶液加入吡啶(7mL),并将混合物冷却至0℃。加入对甲苯磺酸酐(21.0g,1.1当量)并将反应混合物搅拌30分钟,移除冷却浴并将搅拌继续1.5h。将混合物在真空中浓缩,并将残留物在硅胶上通过柱层析进行纯化(在己烷中的EtOAc,2.5%→25%),以给出纯度为约90%的目标化合物(9.39g,得率68%)。1HNMR(300MHz,CDCl3)δppm2.47(mapps,4H),7.36(d,2H),7.83(d,2H)。MS(ESI):[M+H]+=213。中间体1C:(2S)-2-{甲基[(1,1-2H2)-2-丙炔-1-基]氨基}-3-苯基-1-丙醇在室温下向(2S)-2-(甲基氨基)-3-苯基-1-丙醇(3.00g,18.2mmol)在THF(150mL)中的溶液加入碳酸钾(325目,3.76g,1.50当量)。加入中间体1B,并将混合物在室温下搅拌过夜。为了实现完全转化,加入另一部分碳酸钾(0.50当量),并将混合物在室温下另外搅拌2h。将混合物在真空中浓缩,并在二氯甲烷和盐水之间分配。将有机层在硫酸钠上干燥并蒸发。将残留物在硅胶上通过柱层析进行纯化(在己烷中的EtOAc,9%→90%),以给出所需产物(2.07g,得率50%)。1HNMR(600MHz,氯仿-d)δppm2.29(s,1H)2.37-2.43(m,1H)2.44(s,3H)2.75-2.95(sbr,1H)3.05-3.12(m,2H)3.33-3.39(m,1H)3.41-3.46(m,1H)7.16-7.32(m,5H)。MS(ESI):[M+H]+=206。实施例1:N-[(2R)-2-氯-3-苯基丙基]-N-甲基(1,1-2H2)-2-丙炔-1-胺向(2S)-2-{甲基[(1,1-2H2)-2-丙炔-1-基]氨基}-3-苯基-1-丙醇(57mg,0.28mmol)在二氯甲烷(3mL)中的溶液加入三乙胺(58μL,0.42mmol),并将混合物冷却至0℃。加入甲磺酰氯(28μL,0.36mmol),并移除冷却浴。在室温下搅拌1h后,将反应混合物在微波炉中加热至100℃1h。在冷却至室温后,将混合物用二乙醚(3mL)稀释,然后用碳酸氢钠水溶液洗涤。将水性层用二乙醚萃取(2x3mL),并将合并的有机层用二氯甲烷稀释,最后用盐水洗涤。将有机层在硫酸钠上干燥并蒸发。在二氧化硅上的柱层析(在戊烷中的Et2O,5%→15%)给出仅含少量相应的主要位置异构体的标题化合物(50mg,得率80%)。1HNMR(400MHz,氯仿-d)δppm2.21(s,1H)2.38(s,3H)2.74(d,2H)2.95(dd,1H)3.23(dd,1H)4.10-4.19(m,1H)7.23-7.36(m,5H)。MS(ESI):[M+H]+=224。实施例2:N-[(2S)-1-氟-3-苯基丙-2-基]-N-甲基(1,1-2H2)-2-丙炔-1-胺[19F]D2丙炔苯丙胺向(2S)-2-{甲基[(1,1-2H2)-2-丙炔-1-基]氨基}-3-苯基-1-丙醇(2.00g,9.74mmol)在THF(50mL)中的溶液相继加入九氟丁磺酰氟(5.89g,2.0当量)、三乙胺三氢氟酸盐(3.14g,2.0当量)和三乙胺(8.15mL,6.0当量),并将得到的混合物在室温下搅拌24h。在真空中浓缩后,在二氧化硅上通过柱层析纯化粗残留物(5%→15%,在己烷中的EtOAc),以给出作为油状物的纯标题化合物(220mg,得率10%)。此外,还获得了位置异构体N-[(2R)-2-氟-3-苯基丙基]-N-甲基(1,1-2H2)-2-丙炔-1-胺(380mg,得率19%),以及由两种位置异构体构成的混合级分(400mg,20%)。实施例3:N-[(2S)-1-[18F]氟-3-苯基丙烷-2-基]-N-甲基(1,1-2H2)-2-丙炔-1-胺将[18F]氟化物在富含[18O]的水中的溶液快速通过Sep-PakQMA轻柱(用碳酸钾[0.5M,5mL],18MΩH2O,10mL预调制),以分离15GBq的[18F]氟化物,然后将其用1.5mL碳酸钾和Kryptofix2.2.2在水和乙腈中的溶液(5mgK222在0.95mLMeCN中,1mgK2CO3在0.05mL水中)从柱上洗脱。将溶剂在连续氮气流下在120℃蒸发,留下黄色残留物[18F]F-/K2CO3/K2.2.2。加入额外的1mL无水乙腈,并如上所述进行蒸发。然后将残留物冷却至50℃,并加入溶解在DMSO(600μL)中的N-[(2R)-2-氯-3-苯基丙基]-N-甲基(1,1-2H2)-2-丙炔-1-胺(实施例2;~2mg)。将封闭的反应容器在120℃加热20分钟。将反应混合物冷却至50℃,并用4mL流动相稀释,然后注入制备型HPLC进行纯化。所需的主要位置异构体N-[(2S)-1-[18F]氟-3-苯基丙烷-2-基]-N-甲基(1,1-2H2)-2-丙炔-1-胺通过反相HPLC在ACE5C18HL250x10mm,5μm上进行纯化,并使用85%0.01MH3PO4/15%MeCN作为洗脱溶剂,流速为4mL/min。洗脱物通过与放射活性检测器串联的UV吸收检测器(λ=254nm)进行监测。在tR=12.5分钟(图6)处收集所需化合物的级分,并用40mL水稀释。将溶解的产物转移至Sep-PakC18plus柱。将柱用5mL水洗涤,并用1mL乙醇将所需的18F标记的产物洗脱到产物瓶中(2.77GBq)。通过反相HPLC,在ACE3C18S/N-A67537,50x4.6mm,3μm上分析放射性配体的放射化学纯度,使用的溶剂梯度为:起始5%乙腈-在7分钟内95%乙腈在0.1%三氟乙酸中,流速:2mL/min。实施例3的所需的18F标记的产物被分离,对70分钟内的放射活性衰变进行校正,并通过与实施例2的相应的无放射活性的F-19氟标准品共注射进行证实,其放射化学纯度>99%,放射化学得率为27.5%。洗脱物通过与放射活性检测器串联的UV吸收检测器(λ=254nm)进行监测。18F标记的产物的保留时间为tR=2.59分钟(图7),无放射活性参比化合物的保留时间被确定为tR=2.36分钟(图8)。证实本发明的化合物与现有技术中公开的化合物相比具有优越性质的实施例[19F]D2丙炔苯丙胺(实施例2的化合物)对MAO-B的亲和性为IC50=41.3nM。这通过将从用含有相应cDNA插入片段的重组杆状病毒感染的昆虫细胞制备的人类MAO-B(Sigma)与AmplexRed单胺氧化酶测定试剂盒(MolecularProbes)的相应试剂进行温育来测定。对MAO-A的亲和性大于2μM。在体重为31.1-38.5g的NMRI小鼠中,在7个时间点处研究了[18F]D2丙炔苯丙胺(实施例3的化合物)的生物分布。对于每个时间点来说,使用3只小鼠。将每只小鼠用0.256MBq[18F]D2丙炔苯丙胺进行注射。在相应时间点后将小鼠处死,取出器官并在γ计数器中进行测量。对结果进行衰变校正。如图1中所示,化合物显示出高的初始放射活性脑摄入(峰:6.03±1.09%ID/g,在2分钟p.i.时)和高的初始放射活性从脑中的消除(1.44±0.15%ID/g,在30分钟p.i.时)以及进一步降低(0.91±0.09%ID/g,4小时p.i.)。出人意料的是,由2分钟时的峰值摄入与30分钟时的摄入所定义的消除比率为4.2倍。这与所述比率为3.6的未氘化化合物(峰:7.5±0.04%ID/g,在2分钟p.i.时,以及2.10±0.33%ID/g,在30分钟p.i.时)相比提高,并且将提供更好的脑图像质量。因此,预期可以获得改进的诊断性能。对于[18F]D2丙炔苯丙胺和[19F]D2丙炔苯丙胺在体外和体内的代谢性质进行研究。大鼠、小鼠和人类肝微粒体以及人类和大鼠肝细胞中代谢物分布情况的研究显示,对于氘化和未氘化的化合物两者来说N-脱烷基化是主要代谢途径。然而,在与[19F]D2丙炔苯丙胺的温育中,令人吃惊地不再能够检测到在炔丙基部分处的氧化,据观察,在炔丙基部分处的氧化是未氘化化合物(M-7)的另一种代谢途径(图9)。此外,在脑组织中,由薄层层析图(TLC)的目标区域2(ROI2,用正方形标记)表示的18F代谢物被鉴定为[18F]苯丙胺(图2b)。使用软件ImageQuant5.2(MolecularDynamics1999)对该代谢物条带的光学密度进行测量,并且该光学密度揭示出对于[18F]D2丙炔苯丙胺来说,与未氘化的[18F]丙炔苯丙胺(化合物F)相比,减少了约2.4倍(图2a)。具体来说,这些数据暗示[18F]D2丙炔苯丙胺的改善的代谢分布情况是超过未氘化化合物的优点,其预期将在脑PET图像中引起较低的背景信号。随时间监测了在食蟹猴血浆中[18F]D2丙炔苯丙胺与未氘化的[18F]丙炔苯丙胺相比的血浆放射活性代谢分布情况(图3)。正如从显示[18F]D2丙炔苯丙胺在血浆中的放射活性的图的比较中可以看出的,在30和60分钟时间点处,[18F]D2丙炔苯丙胺的放射活性比对[18F]丙炔苯丙胺所观察到的放射活性分别高出18%和31%(图3)。此外,对于两种配体,监测了在食蟹猴血浆中随时间出现的代谢物(图4)。正如可以从图3看出的,在血浆中[18F]D2丙炔苯丙胺比未氘化的[18F]丙炔苯丙胺更稳定。具体来说,产生的代谢物M1较少(图4a)。此外,[18F]D2丙炔苯丙胺的时间活性曲线(TAC)显示出可逆行为的特征(图10)。这为PET数据的量化提供了更大灵活性,并因此是有利的。MAO-B成像的特别重要的改进是下面这一令人吃惊的技术效果:在稳态阶段中,在所研究的脑区域中,从[18F]丙炔苯丙胺到[18F]D2丙炔苯丙胺的信号强度的降低在6-8倍之间(参见图5a)。从使用[11C]丙炔苯丙胺的研究可知,在具有高MAO-B活性的区域中,由于近似于或超过递送的高捕获速率,MAO-B信号被低估(Fowler等,JNuclMed1995,36:1255)。据报道,[11C]丙炔苯丙胺的氘化引起捕获速率降低,导致信号的定量更可靠。在与我们所研究的区域相当的健康狒狒和人的脑区域例如纹状体、丘脑、皮层中所观察到的氘化对[11C]D2丙炔苯丙胺(DED)的信号强度降低的效应,仅仅为约1.2-2.0倍(Fowler等,J.Neurochem1988,51:1524-1534;J.Nucl.Med.1995,36:1255-1262;Mol.ImagingBiol.2005,7:377-387)。前述比率的这种出人意料显著的提高(6至8倍,与此相比,在现有技术中为1.2至2.0倍),使本发明的化合物成为优越的PET成像剂。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1