一种D‑乳酸氧化酶及其在D‑乳酸检测中的应用的制作方法与工艺
一种D-乳酸氧化酶及其在D-乳酸检测中的应用技术领域本发明涉及一种乳酸氧化酶及其应用,尤其涉及一种新型D-乳酸氧化酶及其在D-乳酸检测中的应用。
背景技术:
乳酸广泛存在于自然界中,如酸奶、糖蜜、葡萄酒、苹果以及动植物体内。乳酸有L-乳酸和D-乳酸两种光学异构体。D-乳酸在人体血液中的异常积累会导致D-乳酸血症,D-乳酸血症必须通过快速测定急性症状发生时的D-乳酸水平进行确诊。另外,D-乳酸是也一种重要的平台化合物,广泛应用于医药、化工、生物合成等领域,因此在工业生产中也经常涉及到D-乳酸的检测。然而,目前快速测定乳酸浓度的乳酸生物传感器仅能够检测L-乳酸,因此迫切需要一种特异性快速检测D-乳酸的方法,如D-乳酸生物传感器。目前被广泛使用的L-乳酸生物传感器通常是基于过氧化氢的安培检测法,即将L-乳酸氧化酶固定在过氧化氢电极上进行L-乳酸检测,直接检测的信号是过氧化氢,过氧化氢是由固定在电极表面的L-乳酸氧化酶催化L-乳酸直接被氧气氧化而生成的。但由于到目前为止尚无能够以分子氧为电子受体催化D-乳酸氧化的D-乳酸氧化酶的报道,一定程度上阻碍了D-乳酸生物传感器的开发,因而目前D-乳酸的检测通常使用D-乳酸检测试剂盒或液相色谱分析,但与利用L-乳酸生物传感器检测L-乳酸相比,这两种D-乳酸检测方法仍存在检测费用较高、检测过程复杂、耗时相对较长等不足。目前已有文献报道了几种基于D-乳酸脱氢酶的D-乳酸生物传感器,例如Montagné等利用NAD-依赖型的D-乳酸脱氢酶结合NADH氧化酶和NAD+的方法制备的D-乳酸生物传感器(Montagnéetal.,1995,Anal.Chim.Acta.,315:297-302),Pohanka等利用来源于酵母的细胞色素c依赖型的D-乳酸脱氢酶结合添加人工电子受体吩嗪硫酸甲酯(PMS)的方法制备的D-乳酸生物传感器(Pohankaetal.,2008,FoodTechnol.Biotechnol.46:107–110),山东省科学院生物研究所利用从美国sigma公司购买的来源于菠菜的乙醇酸脱氢酶(EC1.1.1.26)制备的D-乳酸生物传感器(专利公开号:CN101349668A)。但检索发现目前尚无利用以分子氧为直接电子受体催化D-乳酸氧化的D-乳酸氧化酶及利用其制备的D-乳酸生物传感器的报道。
技术实现要素:
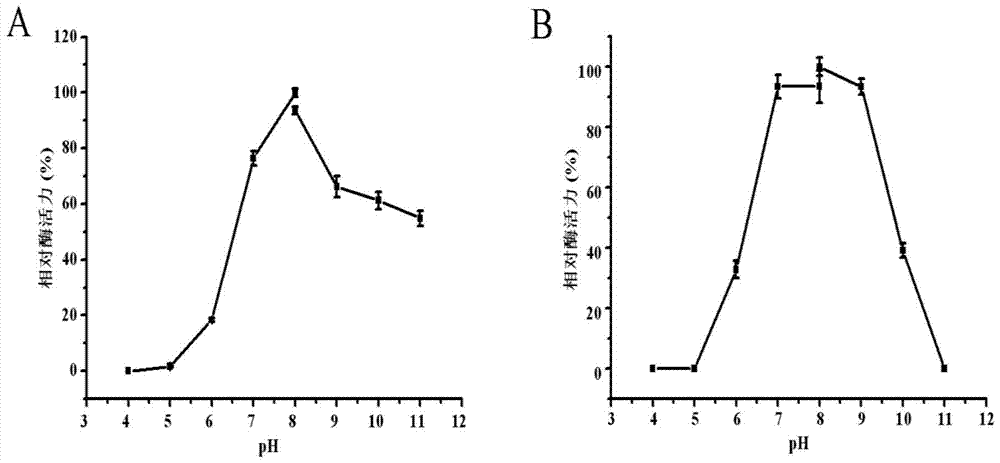
针对上述现有技术中D-乳酸检测手段的不足,本发明要解决的技术问题是提供一种新型的D-乳酸氧化酶,该酶能够以分子氧为直接电子受体氧化D-乳酸生成丙酮酸和过氧化氢;以及该酶在D-乳酸检测中的应用。本发明所述的新型D-乳酸氧化酶,其特征在于,所述D-乳酸氧化酶的氨基酸序列如SEQIDNO.2所示;该酶为可溶性蛋白,辅因子为FAD,其最适温度为55℃,最适pH为8.0,在pH7.0~9.0范围内具有60%以上的酶活;该酶能够以分子氧为直接电子受体催化D-乳酸氧化生成丙酮酸和过氧化氢,当D-乳酸浓度在0.1~1.3mmol/L范围内时,该酶催化生成的过氧化氢浓度与初始D-乳酸浓度呈线性相关;该酶对D-乳酸的表观Km和Vmax分别为3.62±0.53mmol/L和0.52±0.05U/mg,该酶对另一底物O2的表观Km和Vmax分别为0.16±0.01mmol/L和0.97±0.03U/mg。编码上述D-乳酸氧化酶的基因核苷酸序列如SEQIDNO.1所示,该基因来源于氧化葡萄糖酸杆菌621H,NCBI数据库中该基因的基因座标签(Locus_tag)为GOX2071。进一步的,上述的D-乳酸氧化酶基因还包括能够编码具有与来源于氧化葡萄糖酸杆菌621H的D-乳酸氧化酶相同功能蛋白的SEQIDNO.1序列的变异形式。这些变异形式包括:若干个核苷酸的缺失、插入和/或取代,以及在5’和/或3’末端添加若干个核苷酸。上述D-乳酸氧化酶以如下方法制得:(1)将来源于氧化葡萄糖酸杆菌621H的D-乳酸氧化酶基因(核苷酸序列如SEQIDNO.1所示)克隆到大肠杆菌表达载体pET25b中,转化表达菌株大肠杆菌BL21(DE3),氨苄青霉素抗性筛选获得含有D-乳酸氧化酶基因重组质粒的重组菌株;(2)将上述重组菌株接种于LB液体培养基中,当OD600nm达到0.4~0.8后加入终浓度1mmol/L的IPTG诱导表达,诱导表达时间为6小时,诱导表达温度为37℃;(3)利用Souce30Q阴离子交换柱进行D-乳酸氧化酶的初步纯化,利用洗脱缓冲液梯度洗脱,收集含有D-乳酸氧化酶的洗脱液;(4)将上述含有D-乳酸氧化酶的洗脱液,进一步利用HisTrapNi亲和层析柱纯化,获得D-乳酸氧化酶电泳纯的纯酶。本发明所述的D-乳酸氧化酶在制备通过测定过氧化氢浓度来检测D-乳酸的生物传感器中的应用。本发明所述的新型D-乳酸氧化酶与广泛报道的L-乳酸氧化酶的催化特性相似,但催化的底物构型完全相反。本发明所述的D-乳酸氧化酶能够以分子氧为直接电子受体氧化D-乳酸生成丙酮酸和过氧化氢,生成的过氧化氢可用作D-乳酸生物传感器过氧化氢电极的直接检测信号;该酶为可溶性蛋白,纯化和保存过程无需添加表面活性剂,因此更易于固定于生物传感器的电极表面;最适pH8.0,在pH7.0~9.0范围内仍具有60%以上的酶活,且在pH7.0~9.0范围内稳定性非常好,这一可应用的pH宽度也涵盖了正常人体血液中的pH范围(7.35~7.45);该酶最适温度为55℃,在50℃以下稳定性较好,具有较好的应用潜力。使用Clark-型液相氧电极(Oxytherm,Hansatech,英国)测定本发明所述的D-乳酸氧化酶的表观动力学参数,结果如下,该酶对D-乳酸的表观Km和Vmax分别为3.62±0.53mmol/L和0.52±0.05U/mg,该酶对另一底物O2的表观Km和Vmax分别为0.16±0.01mmol/L和0.97±0.03U/mg。在一定浓度本发明所述的D-乳酸氧化酶(0.35U/mL)催化下,D-乳酸浓度在一定范围内(如0.1~1.3mmol/L)时,初始反应液中的D-乳酸浓度与生成的过氧化氢浓度呈线性相关,因此非常有望通过将该酶固定到能够直接检测过氧化氢浓度的过氧化氢电极表面,以制备新型的D-乳酸生物传感器,从而实现D-乳酸的廉价、简便、快速的定量检测。综上,本发明具有的突出特点是:(1)本发明首次提供了一种能够以分子氧为直接电子受体氧化D-乳酸的D-乳酸氧化酶,该酶氧化D-乳酸生成的过氧化氢可用作D-乳酸生物传感器过氧化氢电极的直接检测信号。(2)本发明所提供的D-乳酸氧化酶为可溶性蛋白,易于固定到生物传感器的电极表面。(3)本发明所提供的D-乳酸氧化酶具有较好的pH稳定性和热稳定性、具有良好的线性检测范围。(4)本发明为制备具有广泛应用前景的D-乳酸生物传感器提供了新的有效酶源,在制备D-乳酸生物传感器及D-乳酸的检测领域具有应用价值。附图说明图1为重组D-乳酸氧化酶的SDS-PAGE图谱。其中,泳道M为标准分子量蛋白,泳道1为包含空质粒pET25b的E.coliBL21(DE3)对照菌株粗酶液,泳道2为包含重组质粒pET25b-GOX2071的大肠杆菌BL21(DE3)表达菌株诱导表达后的粗酶液,泳道3为重组D-乳酸氧化酶阴离子交换柱Source30Q的初步纯化结果,泳道4为重组D-乳酸氧化酶使用HisTrapNi亲和层析柱进一步纯化结果。图2为重组D-乳酸氧化酶的最适pH(A)和pH稳定性(B)检测结果。图3为重组D-乳酸氧化酶的最适温度(A)和温度稳定性(B)检测结果。图4为重组D-乳酸氧化酶催化的底物D-乳酸和产物H2O2的浓度对应关系。具体实施方式下面通过实施例进一步阐明本发明,但本发明保护内容不仅限于此。实施例1:包含氧化葡萄糖酸杆菌621HD-乳酸氧化酶基因的大肠杆菌重组表达菌株的构建1、氧化葡萄糖酸杆菌621HD-乳酸氧化酶基因GOX2071的PCR扩增采用常规的方法制备氧化葡萄糖酸杆菌621H的基因组DNA,该过程可参考科学出版社出版的《精编分子生物学指南》中细菌基因组的小量制备的方法,提取氧化葡萄糖酸杆菌621H的基因组DNA;设计引物,引入能插入质粒pET25b(Novagen)的NdeI和XhoI限制性酶切位点,引物序列如下:上游引物5’-AAGCATATGCCGGAACCAGTCATGA-3’,携带一个NdeI位点;下游引物5’-CAACTCGAGGCCCGTGTAAACAGCA-3’,携带一个XhoI位点。以提取氧化葡萄糖酸杆菌621H的基因组DNA,利用上述引物进行PCR扩增。扩增获得的D-乳酸氧化酶基因GOX2071序列长度为1434bp,其核苷酸序列如SEQIDNO.1所示。2、包含D-乳酸氧化酶基因GOX2071的重组质粒的构建将上述PCR扩增获得的产物利用BIOMIGA胶回收试剂盒进行回收,PCR回收产物与pET25b质粒分别使用限制性内切酶NdeI和XhoI双酶切,酶切产物分别进行胶回收后,使用T4DNA连接酶(Thermo)22℃连接1小时,连接产物热激转化大肠杆菌Trans-T1感受态细胞,涂布氨苄青霉素抗性平板,筛选阳性重组菌株,并利用适用于pET25b的通用引物T7和T7Ter测序。测序由北京六合华大基因公司完成,将测序结果进行序列比对分析,PCR产物与预期相符,核酸序列为1434bp,编码477个氨基酸,如SEQIDNO.1所示。测序正确的菌株即为构建获得的含有重组质粒pET25b-GOX2071的大肠杆菌重组克隆菌株。3.包含D-乳酸氧化酶基因GOX2071的重组表达菌株的构建将上述筛选到的正确的大肠杆菌重组克隆菌株接种于5mL含有终浓度100μg/mL氨苄青霉素的LB液体培养基中,37℃摇床培养6~12小时,提取重组质粒,取重组质粒30~100μg,热激转化100μL大肠杆菌BL21(ED3)感受态细胞,涂布氨苄青霉素抗性平板,筛选阳性重组菌株并提取质粒进行测序,测得序列如SEQIDNO.1所示,测序正确的重组表达菌株命名为大肠杆菌BL21(pET25b-GOX2071)。4.包含D-乳酸氧化酶基因GOX2071的重组表达菌株的保存将上述重组菌株大肠杆菌BL21(pET25b-GOX2071)在添加100μg/mL氨苄青霉素的LB液体培养基中,37℃摇床培养6~12小时,于无菌超净台内取1mL菌液加入已灭过菌的1.5mL离心管中,6,000rpm离心3分钟,弃上清,加入1mL已灭菌的20%甘油重悬菌体,于-20℃保存。实施例2:氧化葡萄糖酸杆菌621H重组D-乳酸氧化酶在大肠杆菌重组菌株中的表达将实施例1获得的重组菌株大肠杆菌BL21(pET25b-GOX2071)的甘油管,以1%接种量接种于5mL含有100μg/mL氨苄青霉素的LB液体培养基中,37℃摇床培养6~12小时后,以1%接种量转接至100mL含有100μg/mL氨苄青霉素的LB液体培养基中,37℃摇床培养6~12小时,之后再次以2.5%接种量转接至1L含有100μg/mL氨苄青霉素的LB液体培养基中,37℃摇床培养,当OD600nm达到0.4~0.8后加入终浓度1mmol/L的IPTG诱导表达,37℃诱导表达6小时。诱导培养结束后,6,000rpm离心10分钟收集菌体,菌体沉淀使用67mmol/L磷酸盐缓冲液(pH7.4)洗涤两次后,使用阴离子交换柱结合缓冲液BufferA(pH7.4,20mmol/L磷酸钠)重悬菌体细胞,调节菌体浓度至OD600nm为25,加入1mmol/LPMSF和10%甘油,于冰上超声破碎,破碎流程为工作6秒,间歇6秒,工作15分钟,菌体破碎液12,000rpm4℃下离心30~60分钟除去完整细胞和细胞碎片,所获得的上清液即为含有重组D-乳酸氧化酶的粗酶液。实施例3:氧化葡萄糖酸杆菌621H重组D-乳酸氧化酶的纯化1、利用Souce30Q阴离子交换柱对D-乳酸氧化酶的初步纯化将实施例1获得的含有重组D-乳酸氧化酶的粗酶液,使用0.22μm孔径的滤头过滤后,上BufferA平衡过的阴离子交换柱Source30Q,使用阴离子交换柱洗脱缓冲液BufferB梯度洗脱,洗脱梯度为40%,50%,65%,100%,收集含有D-乳酸氧化酶的65%梯度洗脱液,即获得初步纯化的重组D-乳酸氧化酶(图1)。上述阴离子交换柱洗脱缓冲液BufferB的配方为:20mmol/L磷酸钠,500mmol/L氯化钠,pH7.4。2、利用HisTrapNi亲和层析柱对D-乳酸氧化酶进一步的纯化将上述含有D-乳酸氧化酶的洗脱液,使用AmiconUltra-4超滤浓缩管浓缩后,加入浓缩液2倍体积的HisTrap结合缓冲液,混匀过滤后上HisTrapHP(5mL)Ni亲和层析柱,按照10%,40%,100%HisTrap洗脱缓冲液的梯度洗脱,收集含有D-乳酸氧化酶的40%梯度洗脱液,即获得电泳纯的重组D-乳酸氧化酶(图1)。上述HisTrap结合缓冲液配方为:20mmol/L磷酸钠,20mmol/L咪唑,500mmol/L氯化钠,pH7.4。上述HisTrap洗脱缓冲液配方为:20mmol/L磷酸钠,500mmol/L咪唑,500mmol/L氯化钠,pH7.4。3、重组D-乳酸氧化酶溶液的脱盐与保存将上一步HisTrapNi亲和层析柱纯化后获得的含有D-乳酸氧化酶的40%梯度洗脱液用AmiconUltra-4超滤浓缩后,加入浓缩液15倍体积的50mmol/LTris-HCl缓冲液(pH7.4),再次脱盐浓缩,所得浓缩液直接使用液氮速冻后置于-80℃保存,用于后续的酶学性质鉴定和应用研究。实施例4:氧化葡萄糖酸杆菌621H重组D-乳酸氧化酶的酶学性质1.利用人工电子受体3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)还原法测定pH和温度对重组D-乳酸氧化酶的影响利用人工电子受体MTT还原法测定重组D-乳酸氧化酶活力的方法如下,使用UltrospecTM2100pro紫外可见分光光度计测定,常规的MTT还原法酶活测定体系(0.8mL)为:50mmol/LTris-HCl缓冲液(pH7.4),10mmol/LD-乳酸,0.2mmol/LMTT,0.2mmol/LPMS,适量酶液。检测温度为30℃,检测波长为578nm,读数间隔2秒,读数时间30秒。其中,MTT的还原速率直接反映D-乳酸氧化酶氧化D-乳酸的速率,MTT的还原速率通过在578nm处的光吸收来测定。用不同pH的缓冲液配置酶反应体系,按照上述酶活测定方法测定不同pH下的相对酶活。结果表明,酶的最适pH为8.0(图2A)。将酶在上述不同pH的缓冲液中保存30分钟后,按照上述常规的MTT还原法酶活测定体系,测定相对酶活,结果表明酶在pH7.0~9.0的范围内最稳定(图2B)。上述不同pH的缓冲液分别为磷酸氢二钠-柠檬酸缓冲液pH4.0~8.0,0.05mol/L甘氨酸-氢氧化钠缓冲液pH8.0~11.0。按照上述常规的MTT还原法酶活测定体系,在不同温度下测定相对酶活,结果表明,酶的最适反应温度为55℃(图3A)。将酶在上述不同温度下保存30分钟后,在30℃下测定相对酶活,结果表明,酶在50℃以下稳定性较好(图3B)。上述不同的温度分别为20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃。2.重组D-乳酸氧化酶的表观动力学参数的测定重组D-乳酸氧化酶活力使用带有自动控温装置的Clark型液相氧电极(Oxytherm,Hansatech,英国)进行测定。测定体系(0.5mL)为:50mmol/LTris-HCl缓冲液(pH7.4),20mmol/LD-乳酸,适量酶液。反应室内转子转速为900rpm,检测温度为30℃。重组D-乳酸氧化酶的酶活力定义为:将每分钟催化1μmol的O2还原所需要的酶量定义为1个酶活力单位(U)。重组D-乳酸氧化酶对D-乳酸的表观动力学参数,采用空气-饱和的50mmol/LTris-HCl缓冲液(即固定浓度的O2)和不同浓度的D-乳酸进行测定;对O2的表观动力学参数,采用固定浓度的D-乳酸(20mmol/L)和含有不同浓度O2的50mmol/LTris-HCl缓冲液进行测定。结果显示,该酶对D-乳酸的表观Km和Vmax分别为3.62±0.53mmol/L和0.52±0.05U/mg,该酶对另一底物O2的表观Km和Vmax分别为0.16±0.01mmol/L和0.97±0.03U/mg。实施例5:氧化葡萄糖酸杆菌621H重组D-乳酸氧化酶的应用分别向酶标仪配置的96孔板的各孔中,加入90μL使用50mmol/LTris-HCl缓冲液(pH7.4)稀释至0.35U/mL的重组D-乳酸氧化酶酶液,随后用排枪加入10μL不同浓度的D-乳酸,立即吹吸混匀,室温反应1分钟,立即用排枪加入10μL3mol/L硫酸溶液终止反应。将反应液转移至1.5mL离心管,4℃13,000rpm离心15分钟除去变性蛋白沉淀,上清液中的过氧化氢浓度使用碧云天公司的过氧化氢检测试剂盒测定,具体测定步骤如下:取80μL上清液加入新的96孔板中,加入100μL冰上解冻的过氧化氢检测试剂,轻轻振荡混匀,室温放置30分钟后,立即使用酶标仪测定560nm下的吸光值。利用过氧化氢检测试剂盒配备的1mol/L过氧化氢标准品进行标准曲线的绘制,标准曲线范围选择1μmol/L~50μmol/L。根据标准曲线分别计算上述反应过程中生成的过氧化氢浓度。结果显示,在一定浓度的重组D-乳酸氧化酶催化作用下,D-乳酸浓度在一定范围内(如0.1~1.3mmol/L)时,底物D-乳酸浓度与生成的过氧化氢浓度呈线性关系(图4),表明重组D-乳酸氧化酶适宜通过固定到能够直接检测过氧化氢浓度的过氧化氢电极表面,以制备新型的D-乳酸生物传感器,用于D-乳酸的检测。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 月桂酸修饰超氧化物歧化酶的制备方法
- Marinamoeba thermophila生产耐热超氧化物歧化酶(SOD)的方法
- Corynascus thermophilus 生产耐热超氧化物歧化酶(SOD)的方法
- Thermoanaerobacter thermocopriae 生产耐热超氧化物歧化酶(SOD)的方法
- Stilbella thermophila生产耐热超氧化物歧化酶(SOD)的方法
- Thermoflavimicrobium dichotomicum生产耐热超氧化物歧化酶(SOD)的方法
- 普通嗜热放线菌生产耐热超氧化物歧化酶(sod)的方法
- 中间型嗜热放线菌生产耐热超氧化物歧化酶(sod)的方法
- Spirochaeta thermophila生产耐热超氧化物歧化酶(SOD)的方法
- Platyamoeba thermophila生产耐热超氧化物歧化酶(SOD)的方法