编码苏云金芽孢杆菌晶体蛋白质的基因及其的应用的制作方法
本申请涉及植物生物
技术领域:
,具体涉及Bt抗虫基因及其表达载体的应用。
背景技术:
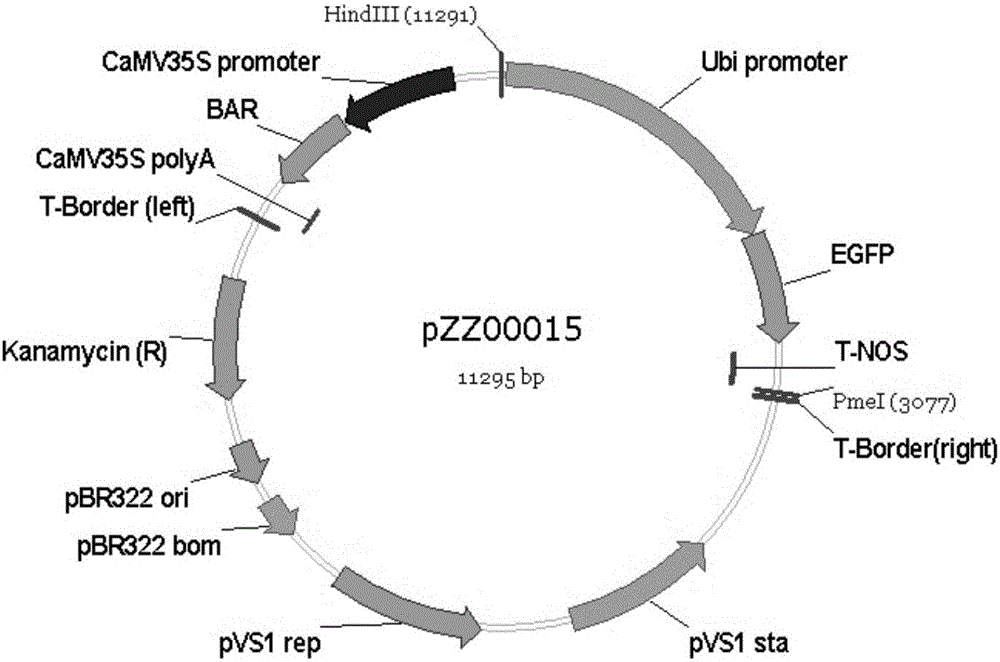
:虫害是造成农作物减产的重要原因之一,减少虫害的损失是增加粮食与饲料作物产量与品质的重要途径。据统计全球粮食与饲料作物总产量每年因虫害造成的损失达14%,直接给农业生产造成的经济损失高达数千亿美元。采用喷施化学农药和生物杀虫剂等防治手段固然可以减轻害虫对农作物的为害,但化学农药造成环境污染,生物杀虫剂成本较高。长期以来,大量喷施化学杀虫剂,不仅会增强害虫的抗药性,使益虫及其它生态区系遭受破坏,而且严重污染环境,提高生产成本,破坏生态平衡。因此,减少杀虫剂使用量,发展现代生物技术,已成为可持续发展农业中必须正视的问题。玉米是重要的饲料和工业原料作物。当前玉米虫害以玉米螟为主,发生严重并造成玉米大量减产,因此采取有效措施控制其危害对提高玉米产量、增加农民收入具有重要的意义。玉米螟俗称玉米钻心虫,其危害是造成玉米常年减产的重要生物灾害之一,严重影响玉米的产量和质量,包括亚洲玉米螟(Ostriniafurnacalis)和欧洲玉米螟(Ostrinianubilalis)。中国是亚洲玉米螟的多发区和重发区,几乎每两年就大规模发生一次。一般年份玉米受玉米螟危害减产10%-15%,大发生年减产可达30%以上,甚至绝收。因玉米螟造成的危害,每年损失的玉米产量就达600-900万吨。玉米螟不仅直接造成玉米产量损失,而且还诱发并加重玉米穗腐病的发生,使玉米的品质下降。目前防治玉米螟的主要方式仍然以杀虫剂农药防治为主。通过转基因技术可以将Bt抗虫基因导入玉米品种中,进而提高转基因玉米的 抗虫性,降低农药的使用量,节省人力、物力及社会资源。Bt基因编码杀虫晶体蛋白,来自苏云金芽孢杆菌(Bacillusthuringiensis,简称Bt),为革兰氏阳性土壤杆菌。它在芽孢形成过程中产生称为δ-内毒素的杀虫伴胞晶体蛋白,这些蛋白具有很高的杀虫活性。其作用原理为这种抗虫蛋白能被碱性肠液溶解,水解为更小的活性毒素片段——核心片段(HofteandWhiteley,1989)。核心片段能避开被蛋白酶的进一步水解,被激活的蛋白质结合在昆虫肠道上的刷状小泡上,引起穿孔从而影响渗透平衡,细胞膨胀并溶解,靶标生物停止取食并最后死亡。研究表明许多Bt蛋白靶标害虫的肠道上皮细胞都具有高亲和性的结合位点(HofteandWhiteley,1989)。在过去的几十年里,已确定数十种苏云金芽孢杆菌菌系及130多种它们编码的杀虫晶体蛋白。研究证明,Bt晶体蛋白对人体、哺乳动物、鸟类、鱼类以及很多有益昆虫均无毒害作用,不污染环境,所以Bt制剂已作为一种无公害的天然微生物杀虫剂在农业、林业及环境卫生等方面应用了近50年。Bt晶体蛋白质必须被昆虫取食到才能发挥杀虫功能,但自然环境下Bt晶体蛋白质稳定性差,杀虫效果受天气影响大,太阳照后则易降解,也不能渗透到植物组织内部,易被雨水、露水冲刷掉,这些因素极大的限制了其发展应用。Vaeck等人(Nature328:33-37,1987)首次获得转Bt杀虫蛋白抗虫烟草,获得的转基因烟草能检测到微弱的抗虫性,其表达蛋白几乎检测不到,只占可溶性蛋白的0.001%。Willbur等人(PlantPhysiol.92:1-11,1990)的研究表明,低等生物细菌和高等植物在密码子使用上存在很大差异。另外,有证据表明植物中的tRNA的不稳定的ATTTA和AATAA等序列转录出的mRNA不完整,故翻译出的蛋白质太短无杀虫活性。技术实现要素:本申请提供了可在植物中表达并产生抗虫效果的抗虫基因Cry1Ab/Cry1AcZM,及包含其的载体和宿主细胞。本申请亦提供了上述抗虫基因、表达载体和宿主细胞在转基因植物抗虫性中的应用。在一方面,本申请提供了分离的核酸分子,其特征在于,所述核酸分子包含SEQIDNO:1所示核苷酸序列,或其互补序列。在一实施方案中,本申请提供了与该基因具有至少90%、至少95%、至少98%或至少99%序列同一性的序列。在又一方面,本申请提供了表达盒,其特征在于,包含上述核酸分子。在一实施方案中,所述核酸分子与Ubi启动子和Ocs终止子、或Ubi启动子和Nos终止子、或CaMV35S启动子和Ocs终止子、或CaMV35S启动子和Nos终止子可操作地连接。在又一方面,本申请提供了表达载体,其特征在于,包含上述表达盒。在一实施方案中,所述表达载体还包含Ω序列。在一实施方案中,所述表达载体还包含Kozak序列。在一实施方案中,所述表达载体还包含PolyA序列。在一实施方案中,所述表达载体还包含Bar基因。在又一方面,本申请提供了宿主细胞,其特征在于,包含上述表达载体。在一实施方案中,所述宿主细胞为植物细胞或原核生物细胞。在一实施方案中,所述宿主细胞为大肠杆菌或农杆菌细胞。在又一方面,本申请提供了产生转基因植物的方法,其特征在于,用上述表达载体或上述宿主细胞转化植物,得到转基因植物。在一实施方案中,所述植物为单子叶植物。在一实施方案中,所述植物选自:玉米、水稻、小麦、燕麦、大麦、青稞、粟、高粱和甘蔗。在又一方面,本申请提供了产生转基因种子的方法,其特征在于,从上述方法产生的转基因植物产生转基因种子。在又一方面,本申请提供了控制鳞翅目害虫群体的方法,包括使所述鳞翅目害虫群体进食通过上述方法获得的转基因植物。在一实施方案中,所述植物为单子叶植物。在一实施方案中,所述植物选自:玉米、水稻、小麦、燕麦、大麦、粟、高粱和甘蔗。在一实施方案中,所述鳞翅目害虫为亚洲玉米螟(Ostriniafurnacalis)和欧洲玉米螟(Ostrinianubilalis)。在又一方面,本申请提供了杀死鳞翅目害虫的方法,包括向所述鳞翅目害虫喂食杀虫有效量的通过上述方法获得的转基因植物。在一 实施方案中,所述植物为单子叶植物。在一实施方案中,所述植物选自:玉米、水稻、小麦、燕麦、大麦、粟、高粱和甘蔗。在一实施方案中,所述鳞翅目害虫为亚洲玉米螟(Ostriniafurnacalis)和欧洲玉米螟(Ostrinianubilalis)。在又一方面,本申请提供了减轻鳞翅目害虫对植物的伤害的方法,包括将表达载体稳定整合进植物的基因组,其特征在于,所述表达载体包含编码抗鳞翅目害虫基因的核酸分子,所述核酸分子包含SEQIDNO:1所示核苷酸序列或与SEQIDNO:1具有至少90%、至少95%、至少98%或至少99%序列同一性的核苷酸序列,或以上的互补序列。在一实施方案中,所述植物为单子叶植物。在一实施方案中,所述植物选自:玉米、水稻、小麦、燕麦、大麦、粟、高粱和甘蔗。在一实施方案中,所述鳞翅目害虫为亚洲玉米螟(Ostriniafurnacalis)和欧洲玉米螟(Ostrinianubilalis)。在又一方面,本申请提供了转基因植物,其包括整合进其基因组的表达盒,其特征在于,所述表达盒包含编码抗鳞翅目害虫基因的核酸分子,所述核酸分子包含SEQIDNO:1所示核苷酸序列或与SEQIDNO:1具有至少90%、至少95%、至少98%或至少99%序列同一性的核苷酸序列,或以上的互补序列。在一实施方案中,本申请提供了与该基因具有至少90%、至少95%、至少98%或至少99%序列同一性的序列。在一些实施方案中,所述核酸分子包含SEQIDNO:1所示核苷酸序列或所述核酸分子由SEQIDNO:1所示核苷酸序列组成。在一些实施方案中,所述植物为单子叶植物。在一些实施方案中,所述植物选自:玉米、水稻、小麦、燕麦、大麦、粟、高粱和甘蔗。在一实施方案中,本申请还涉及该植物的器官、组织、细胞及通过由所述植物产生的加工品,如食物、饲料等。在一些实施方案中,本申请提供的抗虫基因Cry1Ab/Cry1AcZM可在植物中稳定高效表达,具有良好的抗虫效果。附图说明图1A-K为中间载体和转化载体示意图。其中:图1A为载体 pZZ01205;图1B为载体pZZ00015;图1C为转化载体pZHZH25017;图1D为载体pZZ01206;图1E为转化载体pZHZH25018;图1F为载体pZZ01207;图1G为载体pZZ00005;图1H为转化载体pZHZH25020;图1J为载体pZZ01228;图1K为转化载体pZHZH25022。图1A到图1K各载体图谱英文及各缩写含义列举如下:Ubipromoter:泛素启动子omega:欧米茄序列Cry1Ab/Cry1AcZM:优化的Bt基因序列polyA:多聚腺苷酸序列T-NOS:胭脂碱合成酶终止子T-OCS:章鱼碱合成酶终止子pMB1rep:pMB1复制子Amp(R):氨苄青霉素抗性EGFP:绿色荧光蛋白T-Border(right):T-DNA右边界序列CaMV35Spromoter:黄瓜花叶病毒35S启动子BAR:抗草胺膦基因序列CaMV35SpolyA:黄瓜花叶病毒35S多聚腺苷酸序列T-Border(left):T-DNA左边界序列Bp:碱基对Kanamycin(R):卡那霉素抗性序列pBR322ori:pBR322起始区序列pBR322born:pBR322骨架区序列pVS1rep:pVS1复制子pVS1sta:pVS1转录起始区图2为通过PCR鉴定T0代植株的结果,其中1-6泳道为不同的T0代转基因事件,呈阳性,7泳道为阴性对照,阳性条带分子量为333bp。图3为玉米转化事件基因组DNASouthern印迹检测结果图。载体pZHZH25017转化事件T1代株系玉米基因组DNA分别由HindIII和NcoI酶切与Cry1Ab/Cry1AcZM特异探针分子杂交结果,探针长度333bp。1、 6泳道为阴性对照祥249;2、7泳道为T1-1;3、8泳道为T1-2;4、9泳道为T1-3;5、10泳道为T1-4材料。两种酶切条件下分别显示一条阳性带,表明外源基因单拷贝插入。M为分子量标记泳道,标出了碱基对数。图4为免疫试纸鉴定T0代植株结果图,其中1-2号(转化载体pZHZH25017);3-4号(转化载体pZHZH25018);5号(转化载体pZHZH25020);和6号(转化载体pZHZH25022)样品呈阳性,7号样品为阴性对照。图5A为T0代玉米叶片离体抗虫生测结果图,1.抗性叶片(转化载体pZHZH25018);2.阴性对照祥249;3.阳性对照(Cry1Ac)。图5B为T0代玉米花丝离体抗虫生测结果图。1.抗性叶片(转化载体pZHZH25018);2.阴性对照祥249;3.阳性对照(Cry1Ac)。具体实施方式除非另有所指,核酸以5’至3’方向从左向右书写;氨基酸序列以氨基至羧基方向从左向右书写。氨基酸在本文可以用其通常所知的三字母符号或IUPAC-IUB生物化学命名委员会推荐的单字母符号来表示。同样地,可以用通常接受的单字母码表示核苷酸。数字范围包括限定该范围的数字。如本文所用,“核酸”包括涉及单链或双链形式的脱氧核糖核苷酸或核糖核苷酸多聚物,并且除非另有限制,包括具有天然核苷酸基本性质的已知类似物(例如,肽核酸),所述类似物以与天然存在的核苷酸类似的方式与单链核酸杂交。如本文所用,术语“编码”或“所编码的”用于特定核酸的上下文时,指该核酸包含指导该核苷酸序列翻译成特定蛋白的必需信息。使用密码子表示编码蛋白的信息。如本文所用,涉及特定多核苷酸或其所编码的蛋白的“全长序列”指具有天然(非合成)内源序列的整个核酸序列或整个氨基酸序列。全长多核苷酸编码该特定蛋白的全长、催化活性形式。本文可互换地使用术语“多肽”、“肽”和“蛋白”,以指氨基酸残基的多聚物。该术语用于氨基酸多聚物,其中一个或多个氨基酸残基是 相应天然存在的氨基酸的人工化学类似物。该术语还用于天然存在的氨基酸多聚物。本文可互换地使用术语“残基”或“氨基酸残基”或“氨基酸”,以指被并入蛋白、多肽或肽(统称“蛋白”)的氨基酸。氨基酸可以是天然存在的氨基酸,并且除非另有限制,可以包括天然氨基酸的已知类似物,所述类似物可以以与天然存在的氨基酸相似的方式起作用。如本文所用,可以互换地使用术语“分离的”和“纯化的”,以涉及核酸或多肽或其生物学活性部分,其基本上或本质上不含如在其天然存在的环境中所发现的通常伴随或反应于该核酸或多肽的组分。因而,用重组技术产生分离的或纯化的核酸或多肽时,分离的或纯化的核酸或多肽基本上不含其它细胞物质或培养基,或者化学合成分离的或纯化的核酸或多肽时,基本上不含化学前体或其它化学品。“分离的”核酸通常不含在该核酸所衍生自的生物体的基因组DNA中天然侧翼于该核酸(即位于该核酸5’和3’端的序列)的序列(诸如,例如编码蛋白的序列)。例如,在各种实施方案中,所分离的核酸可以包含在该核酸所衍生自的细胞的基因组DNA中天然侧翼于该核酸的少于约0.5kb的核苷酸序列。在本申请中,将词语“包括”、“包含”或其变体应理解为除所描述的元素、数或步骤外,还包含其它元素、数或步骤。如本文所用,术语“影响虫害”指对任何发育阶段的昆虫进食、生长和/或行为的有影响的改变,包括但不限于杀灭昆虫、延迟生长、阻碍生殖能力、拒食素活性等等。如本文所用,术语“杀虫活性”是指生物体或物质(诸如,例如蛋白)的活性,其测量可以通过但不限于害虫死亡率、害虫体重减少、害虫驱避性以及进食和暴露适当长时间后害虫的其它行为和物理变化。因而,具有杀虫活性的生物体或物质不利地影响至少一种可测量的害虫健康参数。例如,“杀虫蛋白”是自身显示或与其它蛋白组合显示杀虫活性的蛋白。如本文所用,术语“杀虫有效量”指存在于害虫环境的具有杀虫活性的物质或生物体的量。类似地,当害虫是昆虫时,“杀昆虫有效量” 可以用于指“杀虫有效量”。应理解如本文所用,术语“转基因的”包括基因型已通过异源核酸的存在而被改变的任何细胞、细胞系、愈伤组织、组织、植物部分或者植物,包括最初如此改变的那些转基因,以及通过有性杂交或无性繁殖从所述最初的转基因产生的那些。如本文所用,术语“转基因的”不包括借助常规植物育种方法或者借助天然发生的事件对基因组(染色体或染色体外)的改变,所述天然发生的事件诸如随机异花受精、非重组病毒感染、非重组细菌转化、非重组转座或者自发突变。“受试植物”或“受试植物细胞”是指遗传改造已经生效的植物或植物细胞,或者如此改造的植物或细胞的子代细胞,该子代细胞包含所述改造。“对照”或“对照植物”或“对照植物细胞”提供用于测量受试植物或植物细胞表型改变的参考点。对照植物或植物细胞可以包括,例如:(a)野生型植物或细胞,即与遗传改造起始材料具有相同基因型的植物或细胞,所述遗传改造产生受试植物或细胞;(b)与所述起始材料具有相同基因型但已用空构建体(即用对目的性状无已知效果的构建体,诸如包含标志物基因的构建体)转化的植物或植物细胞;(c)是受试植物或植物细胞的非转化分离子的植物或植物细胞;(d)与所述受试植物或植物细胞在遗传上一致但未暴露于会诱导目的基因表达的条件或刺激物的植物或植物细胞;或(e)受试植物或植物细胞自身,其处于目的基因不被表达的条件下。本领域技术人员会容易地认同,诸如位点特异性诱变和随机诱变、聚合酶链式反应方法和蛋白工程化技术的分子生物学领域的进步提供了广泛的适当的工具和操作步骤,以用于改造或者工程化农业上感兴趣的蛋白的氨基酸序列和潜在的基因序列。在一些实施方案中,可以对本申请的核苷酸序列进行改变,以进行保守氨基酸替换。保守氨基酸替换的原则和实例在下文中进一步描述。在某些实施方案中,可以依照图1中公开的单子叶密码子偏好性对本申请的核苷酸序列进行不改变氨基酸序列的替换,例如可以用单子叶植物偏好的密码子替换编码同一氨基酸序列的密码子,而不改变该核苷酸序列所编码的氨基酸序列。本申请还涉及对SEQIDNO:1进一步优化所得的核苷酸序列。该方法的更多细节描述于Murray等人(1989)NucleicAcidsRes.17:477-498。优化核苷酸序列可用于提高杀虫蛋白在植物中的表达,所述植物例如单子叶植物,例如禾本科植物,例如玉米(Zeamays)。如本文所用,术语“突变核苷酸序列”或“突变”或“诱变的核苷酸序列”指经诱变或改变而包含一个或多个核苷酸残基(例如碱基对)的核苷酸序列,所述核苷酸残基不存在于相应的野生型序列中。在一些实施方案中,以编码同一氨基酸序列的不同密码子替换本申请中的部分核苷酸序列,从而在改变核苷酸序列的同时不改变其编码的氨基酸序列。保守变体包括由于遗传密码子简并性而编码实施方案的杀虫多肽中的一种的氨基酸序列的那些序列。在一些实施方案中,根据单子叶植物偏好密码子替换本申请中的部分核苷酸序列。在一些实施方案中,突变体核苷酸序列还包括衍生的核苷酸序列,诸如使用例如位点定向诱变而产生的仍编码实施方案的杀虫蛋白的那些,诸如突变体毒素。在一些实施方案中,突变体核苷酸序列包括一个或多个核酸残基的添加、缺失或替换。在一些实施方案中,这样的添加、移除或替换可以导致相应的氨基酸残基的添加、移除或替换。一般来讲,实施方案的特定核苷酸序列的变体将与该特定核苷酸序列具有至少约90%或更高的序列一致性。通过下文所述的序列比对程序确定序列一致性。实施方案的突变体核苷酸序列与本申请的序列的差异可以少至1-15个核苷酸、少至1-10个(例如6-10个),少至5个,少至4、3、2或甚至1个核苷酸。在一些实施方案中,突变体核苷酸序列可以编码具有改良的或降低的杀昆虫活性的突变体蛋白。这样的杀虫活性相对天然蛋白可以是不同的或者是改良的,或者它可以是不变的,只要保留了杀虫活性。突变体蛋白包括衍生自天然蛋白的多肽,所述衍生是通过缺失(所谓的截短)天然蛋白N末端和/或C末端的一个或多个氨基酸或将一个或多个氨基酸添加至所述天然蛋白的N末端和/或C末端;在天然蛋白的一个或多个位点缺失或添加一个或多个氨基酸;或者在天然蛋白的一个或多个位点取代一个或多个氨基酸。实施方案包括的突变体蛋白具有生物学活性,即它们继续具有天然蛋白的所需的生物学活性,所述活性即本文所述的杀虫活性。所述变体可以得自例如基因多态性或人类的操作。本领域技术人员会理解,只要所编码多肽保留杀虫活性,任何有用的突变可以被添加至实施方案的序列。在一些实施方案中,突变体蛋白的氨基酸序列将与本申请的蛋白的氨基酸序列具有至少约90%或更高的序列一致性。在一些实施方案中,突变体蛋白与本申请的蛋白的差异可以少至1-15个氨基酸残基。在一些实施方案中,也可以突变序列,以致所编码多肽对蛋白酶的蛋白水解消化具有抗性。突变可以保护该多肽免于蛋白酶降解,所述保护例如是通过从不同区域移除诸如推定的丝氨酸蛋白酶位点和弹性蛋白酶识别位点的推定的蛋白水解位点。可以移除或改造这些推定位点的一些或全部,以致原始位点位置的蛋白水解被降低。可以通过比较突变体多肽和野生型毒素或者通过比较氨基酸序列各不相同的突变体毒素,来评价蛋白水解的变化。蛋白水解位点和推定的蛋白水解位点包括但不限于以下序列:胰蛋白酶切割位点、糜蛋白酶位点和胰蛋白酶位点。只要所述多肽的杀虫活性被提高,可以通过添加或缺失任意数目和种类的氨基酸残基来改造这些位点。因而,相对于天然序列或背景序列,由包含突变的核苷酸序列编码的多肽将包含至少一个氨基酸改变或添加,或者50或更多个氨基酸改变或添加。本领域技术人员会认识到氨基酸添加和/或取代通常基于氨基酸侧链取代基的相对相似性,例如,所述取代基的疏水性、电荷、大小等等。具有各种前述所考虑性质的示例性氨基酸取代基团为本领域技术人员所公知,并且包括精氨酸与赖氨酸;谷氨酸和天门冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;以及缬氨酸、亮氨酸和异亮氨酸。关于不影响目的蛋白生物学活性的适当氨基酸取代的指南可以在Dayhoff等人(1978)AtlasofProteinSequenceandStructure(蛋白序列和结构图集)(Natl.Biomed.Res.Found.,Washington,D.C)(通过引用并入本文)的模型中找到。可以进行诸如将一个氨基酸换作具有相似性质的另一个氨基酸的保守性取代。当在进行取代、缺失或插入前,难以预测其确切效果时,本领域技术人员将理解所述效果将通过诸如昆虫进食分析的常规筛选分析来评价。参见,例如,通过引用并入本文的Marrone等人(1985)J.Econ.Entomol.78:290-293和CzaplaandLang(1990)J.Econ.Entomol.83:2480-2485。在一些实施方案中,可以在实施方案的核苷酸序列和其它已知的Cry核苷酸序列的对应部分之间重组全长编码序列、编码目的结构域的序列基序或者实施方案的核苷酸序列的任意片段,从而获得具有改良性质的新基因。受到关注的性质包括但不限于每单位杀虫蛋白的杀虫活性、蛋白稳定性、对非靶物种、特别是对人类、家畜以及表达实施方案的杀虫多肽的植物和微生物的毒性。实施方案不受特定重排策略的限制,重排可以仅涉及本文所公开的核苷酸序列,或者可以另外涉及重排本领域已知的其它核苷酸序列。DNA重排策略为本领域所已知。序列一致性的鉴定包括杂交技术。例如,将已知核苷酸序列的全部或部分用作与其它相应核苷酸序列选择性杂交的探针,所述其它相应核苷酸序列存在于来自所选生物体的已克隆基因组DNA片段或cDNA片段群(即基因组文库或cDNA文库)。所述杂交探针可以是基因组DNA片段、cDNA片段、RNA片段或其它寡核苷酸,并且可以用诸如32P的可检测基团或其它可检测标志物来标记。因而,例如,可以通过标记基于实施方案序列的合成寡核苷酸制备杂交探针。制备杂交探针和构建cDNA及基因组文库的方法通常为本领域已知。在一些实施方案中,可以将本文公开的完整序列或者其一个或多个部分用作能够与对应序列和信使RNA特异性杂交的探针。为在各种条件下完成特异性杂交,所述探针包含独特于实施方案序列并且通常长至少约10或20个核苷酸的序列。可以使用所述探针,以通过PCR从所选生物体扩增相应的Cry序列。可以使用该技术,以从所需生物体分离其它编码序列,或将该技术用作诊断分析,以确定生物体是否存在编码序列。杂交技术包括杂交筛选所接种的DNA文库。可以在严紧条件下进行所述序列的杂交。如本文所用,术语“严紧 条件”或“严紧杂交条件”表示如下条件,即在该条件下,相对于与其它序列杂交,探针将以可检测的更大程度(例如,背景的至少2倍、5倍或10倍)与其靶序列杂交。严紧条件是序列依赖性的并且在不同环境中有所不同。通过控制杂交严紧性和/或控制清洗条件,可以鉴定与所述探针100%互补的靶序列(同源探针法)。可选择地,可以调节严紧条件,以允许一些序列错配,以便检测较低的相似度(异源探针法)。通常,探针长度少于约1000或500个核苷酸。通常,严紧条件是如下的条件,即在该条件中,盐浓度为pH7.0至8.3下,少于约1.5MNa离子,通常约0.01M至1.0MNa离子浓度(或其它盐),并且温度条件为:当用于短探针时(例如10到50个核苷酸),至少约30℃;当用于长探针时(例如大于50个核苷酸),至少约60℃。还可以通过添加诸如甲酰胺的去稳定剂来实现严紧条件。示例性的低严紧条件包括37℃下使用30%至35%的甲酰胺缓冲液、1MNaCl、1%SDS(十二烷基硫酸钠)杂交,50℃至55℃下在1×至2×SSC(20×SSC=3.0MNaCl/0.3M柠檬酸三钠)中清洗。示例性的中度严紧条件包括37℃下在40%至45%甲酰胺、1.0MNaCl、1%SDS中杂交,55℃至60℃下在0.5×至1×SSC中清洗。示例性的高严紧条件包括37℃下在50%甲酰胺、1MNaCl、1%SDS中杂交,60℃至65℃下在0.1×SSC中最后清洗至少约20分钟。任选地,清洗缓冲液可以包含约0.1%至约1%SDS。杂交持续时间通常少于约24小时,通常为约4小时至约12小时。特异性通常依赖杂交后的清洗,关键因素在于最后清洗溶液的离子强度和温度。DNA-DNA杂合体的Tm(热力学熔点)可以近似自MeinkothandWahl(1984)Anal.Biochem.138:267-284的公式:Tm=81.5℃+16.6(logM)+0.41(%GC)-0.61(%甲酰胺)-500/L;其中M是一价阳离子的克分子浓度,%GC是DNA中鸟苷和胞嘧啶核苷酸的百分数,“甲酰胺%”是杂交溶液的甲酰胺百分数,而L是杂合体的碱基对长度。Tm是(确定的离子强度和pH下)50%的互补靶序列与完全匹配的探针杂交时的温度。通常将清洗至少进行至达到平衡,并且达到低的杂交背景水平,诸如进行2小时、1小时或30分钟。每1%的错配对应使Tm降低约1℃;因而,可以调节Tm、杂交和/或清洗条件,从而与所需一致性的序列杂交。例如,如果需要≥90%一致性的序列,可以将Tm降低10℃。通常,将严紧条件选择为比确定离子强度和pH下的特异序列及其互补序列的Tm低约5℃。然而,在非常严紧的条件下,可以在比所述Tm低4℃下进行杂交和/或清洗;在中度严紧条件下,可以在比所述Tm低6℃下进行杂交和/或清洗;在低严紧条件下,可以在比所述Tm低11℃下进行杂交和/或清洗。在一些实施方案中,还包括核苷酸序列及其编码的氨基酸序列的片段。如本文所用,术语“片段”指实施方案的多核苷酸的核苷酸序列的一部分或者多肽的氨基酸序列的一部分。核苷酸序列的片段可以编码蛋白片段,所述蛋白片段保留天然或相应全长蛋白的生物学活性,并因而具有杀虫活性。突变体蛋白包括天然蛋白的生物活性片段,其包含保留天然蛋白生物学活性,即具有杀虫活性的足够数目的连续氨基酸残基。本领域已知Bt毒素的杀虫活性通常通过各种蛋白酶在昆虫肠内对所述肽的切割被活化。因为肽在昆虫肠内不总是以全效切割,所以全长毒素的片段相对于全长毒素自身可以具有增强的杀虫活性。在一些实施方案中,还可以通过截短天然或全长序列来提高多肽的杀虫活性。因而,在一些实施方案中,本申请涉及全长杀虫多肽的截短形式或片段。在一些实施方案中,所述多肽片段、变异体和突变中的一些将相对于其衍生自的天然存在的杀昆虫多肽的活性,具有增强的杀虫活性。在一些实施方案中,所述多肽片段、变异体和突变中的一些将相对于其衍生自的天然存在的杀昆虫多肽的活性,具有减弱的杀虫活性。编码实施方案的杀虫蛋白生物学活性部分的实施方案的核苷酸序列片段将编码至少50个连续的氨基酸,或者编码多达实施方案的杀虫多肽中存在的全部数量的氨基酸。作为实施方案核苷酸序列片段的核酸包括至少150个核苷酸,或者多达本文公开的核苷酸序列中所存在数量的核苷酸。特定实施方案涉及衍生自(例如产生自)实施方案的第 一核酸的片段,其中所述片段编码以杀虫活性为特征的截短的毒素。实施方案的多核苷酸片段所编码的截短的多肽的特征在于等价或改良的杀虫活性,所述等价或改良是相对于该片段衍生自的第一核酸所编码的相应全长多肽的活性。所涉及的是实施方案的该核酸片段可以在天然或相应全长编码序列的3’端被截短。核酸片段还可以在天然或相应全长编码序列的5’和3’端均被截短。本申请涉及表达盒,其特征在于,包含上述分离的核酸分子。本申请不限定表达盒中具体使用的启动子和终止子,只要其适于在植物中表达即可。在一实施方案中,所述核酸分子与35S启动子和nos终止子可操作地连接。本申请还涉及表达载体,其包含上述分离的核酸分子。在一些实施方案中,表达载体包含上述表达盒。在一些实施方案中,所述表达载体还包含PolyA序列和omega增强子。在一些实施方案中,表达载体还包含可以用于检测所述表达载体在细胞中表达情况的其他表达盒。一些实施方案还包括转化的微生物,例如农杆菌或大肠杆菌。所述转化使用至少一种实施方案的核酸、包含所述核酸的表达盒或者包含所述表达盒的载体。在一些实施方案中,所述微生物是依靠植物增殖的微生物。一些实施方案还包括转化的植物细胞或转基因植物,其包含至少一种实施方案的核苷酸序列。在一些实施方案中,使用表达载体转化植物,所述表达载体包含至少一种实施方案的核苷酸序列以及与其可操作地连接的在植物细胞中驱动表达的启动子。转化的植物细胞和转基因植物表示基因组内包含异源多核苷酸的植物细胞或植物。一般来说,所述异源多核苷酸在转化的植物细胞或转基因植物的基因组内稳定地整合,以致将所述多核苷酸传递给后代。可以将所述异源多核苷酸单独地或作为表达载体的一部分整合进基因组。在一些实施方案中,本申请涉及的植物为单子叶植物;任选地,所述植物选自:玉米、水稻、小麦、燕麦、大麦、青稞、粟、高粱和甘蔗。在一些实施方案中,本申请涉及的植物包括植物细胞、植物原生质体、可以再生出植物的植物细胞组织培养物、植物愈伤组织、植物团块和植物细胞,其为完整的植物或者植物的部分,诸如胚胎,花粉,胚珠,种子,叶,花,枝,果实,果仁,穗,穗轴,壳,秸秆,根,根尖,花药等等。本申请还包括源于本申请的转基因植物或其子代、并因而至少部分地包含本申请的核苷酸序列的植物细胞、原生质体、组织、愈伤组织、胚胎以及花、茎、果实、叶以及根。虽然实施方案不依赖特定生物学机制来增加植物对植物害虫的抗性,但是实施方案的核苷酸序列在植物中的表达可以导致产生实施方案的杀虫蛋白以及提高所述植物对植物害虫的抗性。实施方案的植物可以用于农业上影响虫害的方法。某些实施方案提供转化的农作物植物,其可以用于影响该植物的虫害的方法,所述虫害诸如鳞翅目害虫。鳞翅目害虫包括但不限于夜蛾科(Noctuidae)的害虫:秋粘虫(Spodopterafrugiperda)、甜菜夜蛾(Spodopteraexigua)、斜纹夜蛾(Spodopteralitura)、蓓带夜蛾(Mamestraconfigurata)、甘蓝夜蛾(Mamestrabrassicae)、黑切根虫(Agrotisipsilon)、西部切根虫(Agrotisorthogonia)、黄地老虎(Agrotissegetum),木棉虫(Alabamaargillacea)、粉纹夜蛾(Trichoplusiani)、大豆夜蛾(Pseudoplusiaincludens)、黎豆夜蛾(Anticarsiagemmatalis)、苜蓿绿夜蛾(Hypenascabra)、烟芽夜蛾(Heliothisvirescens)、一星粘虫(Pseudaletiaunipuncta)、粗皮夜蛾(Athetismindara)、暗缘地老虎(Euxoamessoria)、埃及金刚钻(Eariasinsulana)、翠纹金刚钻(Eariasvittella)、美洲棉铃虫(Helicoverpaarmigera)、谷实夜蛾(Helicoverpazea);螟蛾科(Pyralidae)的害虫:亚洲玉米螟(Ostriniafurnacalis)、欧洲玉米螟(Ostrinianubilalis)、脐橙螟(Amyeloistransitella)、地中海粉螟(Anagastakuehniella)、干果斑螟(Cadracautella)、二化螟(Chilosuppressalis)、斑禾草螟(Chilopartellus)、米蛾(Corcyracephalonica)、玉米根结网毛虫(Crambuscaliginosellus)、蓝草结网毛虫(Crambusteterrellus)、稻纵卷叶野螟(Cnaphalocrocismedinalis)、葡萄卷叶虫(Desmiafuneralis)、甜瓜绢野螟(Diaphaniahyalinata)、西南玉米螟(Diatraeagrandiosella)、小蔗螟 (Diatraeasaccharalis)、墨西哥稻螟(Eoreumaloftini)、烟草粉螟(Ephestiaelutella)、蜡螟(Galleriamellonella)、水稻切叶野螟(Herpetogrammalicarsisalis)、向日葵斑螟(Homoeosomaelectellum)、南美玉米苗斑螟(Elasmopalpuslignosellus)、小蜡螟(Achroiagrisella)、草地螟(Loxostegesticticalis)、豆野螟(Marucatestulalis)、印度谷螟(Plodiainterpunctella)、三化螟(Scirpophagaincertulas)、温室螟(Udearubigalis);以及卷蛾科(Tortricidae)的害虫:黑头长翅卷蛾(Aclerisvariana)、果树黄卷蛾(Archipsargyrospila)、欧洲卷叶蛾(Archipsrosana)、桔带卷蛾(Argyrotaeniacitrana)、玫瑰色卷蛾(Choristoneurarosaceana);以及其他:棉褐带卷蛾(Adoxophyesorana)、条纹向日葵螟(Cochylishospes)、榛小卷蛾(Cydialatiferreana)、苹果蠹蛾(Cydia.pomonella)、杂色卷叶蛾(Platynotaflavedana)、荷兰石竹小卷蛾(Platynotastultana)、欧洲葡萄花翅小卷叶蛾(Lobesiabotrana)、苹白小卷蛾(Spilonotaocellana)、葡萄果实蛀虫(Endopizaviteana)、女贞细卷蛾(Eupoeciliaambiguella)、巴西苹果卷叶蛾(Bonagotasalubricola)、梨小食心虫(Grapholitamolesta)和向日葵芽蛾(Suleimahelianthana)等。鳞翅目的所选其它农艺害虫包括但不限于:秋星尺蠖(Alsophilapometaria)、棉潜蛾(Bucculatrixthurberiella)、苜蓿黄蝶(Coliaseurytheme)、胡桃黄蝶(Datanaintegerrima)、白尺蠖(Ennomossubsignaria)、菩提尺蠖(Erannistiliaria)、黄毒蛾(Euproctischrysorrhoea)、黑拟蛉蛾(Harrisinaamericana)、美国白蛾(Hyphantriacunea)、番茄蠹蛾(Keiferialycopersicella)、二尾蛱蝶(Lambdinafiscellariafiscellaria)、西部铁杉尺蠖(Lambdinafiscellarialugubrosa)、柳毒蛾(Leucomasalicis)、舞毒蛾(Lymantriadispar)、番茄天蛾(Manducaquinquemaculata)、烟草天蛾(Manducasexta)、冬尺蠖(Operophterabrumata)、春尺蠖(Paleacritavernata)、大凤蝶(Papiliocresphontes)、加州株虫(Phryganidiacalifornica)、柑橘潜叶蛾(Phyllocnistiscitrella)、斑幕潜叶蛾(Phyllonorycterblancardella)、大菜粉蝶(Pierisbrassicae)、小菜粉蝶(Pierisrapae)、暗脉菜粉蝶(Pierisnapi)、小菜蛾(Plutellaxylostella)、棉红铃虫(Pectinophoragossypiella)、杂食尺蠖(Sabulodes aegrotata)、麦蛾(Sitotrogacerealella)、松异舟蛾(Thaumetopoeapityocampa)、袋衣蛾(Tineolabisselliella)、番茄斑潜蝇(Tutaabsoluta)和苹果巢蛾(Yponomeutapadella)。实施例实施例1.抗虫基因的设计与合成本申请的基因以经过融合与改造的Cry1Ab和Cry1AcN端608个氨基酸序列为基础,并用植物偏爱的密码子置换编码序列。排除了DNA序列中存在的造成植物转录不稳定的富含AT序列以及常用限制性酶切位点,然后通过置换密码子的方法进行改正消除;并在3’端加上终止密码子TAA,获得一个改造的DNA序列;确定并化学合成改造的Bt基因如序列SEQIDNO:1。改造后的DNA序列编码的蛋白质含有3个功能区段,其中N端两个功能区高度同源于Cry1Ab对应部分,C端的功能区高度同源于Cry1Ac,因此本申请基因定名为Cry1Ab/Cry1AcZM。将该序列与郭三堆等人的序列(CN1037913C,1996)及孟山都转基因玉米事件Mon810的Cry1Ab进行了同源性比对(结果见表1),并计算了GC含量(结果见表2)。表1、DNA序列同源性比较比对DNA序列Cry1Ab/Cry1AcZMCN1037913C74.9%Mon81071.4%表2、Cry1Ab/Cry1AcZM及近缘序列GC含量百分比序列名称GC比例%Cry1Ab/Cry1AcZM58CN1037913C48Mon81061实施例2.载体构建根据在植物中表达基因功能的需要,进一步对Cry1Ab/Cry1AcZM基因编码区上下游进行了表达优化设计,以此提高基因在转录水平上的强度和蛋白质翻译的效率,包括在5’端增加了一段67个核苷酸的欧米茄(Ω)序列和3个核苷酸(acc)的Kozak序列(SEQIDNO:2)用来增强真核基因的翻译效率,以及一段在3’端真核生物mRNA的poly(A)尾巴序列(SEQIDNO:3),以增加由胞核向胞质的运输及mRNA的稳定性和翻译效率。在合成的SEQIDNO:1的5’端添加HindIII和PstI酶切位点,3’端添加PmeI酶切位点,并将合成的序列克隆在Puc57simple载体上,命名为pzz01194。构建了4个植物表达载体,分述如下:(一)pZHZH25017的构建:限制酶HindIII和BamHI处理pzz00002获得Ubi启动子片段用T4DNA聚合酶补平产生的粘末端。限制酶PstI处理pzz01194,用T4DNA聚合酶补平产生的粘末端,将Ubi启动子通过平末端连接方式连入,获得含有Ubi-Cry1Ab/Cry1AcZM片段的载体,命名为pzz01201。EcoRI单酶切处理pzz01188获得Tnos终止子片段,用T4DNA聚合酶补平产生的粘末端。PmeI处理pzz01201,将Tocs终止子通过平末端连接方式连入,获得含有Ubi-Cry1Ab/Cry1AcZM-Tnos片段的载体,命名为pzz01205(图1A)。HindIII+BamHI处理pzz00002获得Ubi启动子片段,用T4DNA聚合酶补平产生的粘末端。PstI处理pzz01194,用T4DNA聚合酶补平产生的粘末端,将Ubi启动子通过平末端连接方式连入,获得含有Ubi-Cry1Ab/Cry1AcZM片段的载体,命名为pzz01201。已有含有Tnos终止子(5’端有EcoRI酶切位点,3’端有PmeI,EcoRI位点)的载体,命名为pzz01188,Tnos终止序列可通过EcoRI单酶切 pzz01188获得。EcoRI单酶切处理pzz01188获得Tnos终止子片段,用T4DNA聚合酶补平产生的粘末端。PmeI处理pzz01201,将Tocs终止子通过平末端连接方式连入,获得含有Ubi-Cry1Ab/Cry1AcZM-Tnos片段的载体pzz00015(图1B)。取已构建好载体pzz00015(图1B),以该载体的pCambia3300(带有35s-BAR-T35spolyA元件)为骨架通过HindIII+PmeI双酶切加入Ubi-EGFP-T35spolyA元件,通过HindIII+PmeI去除Ubi-EGFP-T35spolyA,然后在该位点添加新元件。HindIII+PmeI处理pzz01205载体,获得Ubi-Cry1Ab/Cry1AcZM-Tnos片段。HindIII+PmeI处理pzz00015载体,切口处连入Ubi-Cry1Ab/Cry1AcZM-Tnos,获得含有Ubi-Cry1Ab/Cry1AcZM-Tnos和35s-BAR-T35spolyA两个表达元件的表达载体命名为pZHZH25017,见图1C。(二)pZHZH25018的构建:利用限制内切酶PstI处理pzz01194,用T4DNA聚合酶补平末端,将Ubi启动子通过平末端连接方式连入,获得含有Ubi-Cry1Ab/Cry1AcZM片段的载体,命名为pzz01201。利用限制内切酶HindIII+BamHI处理含有ubi启动子的载体pzz00002获得Ubi启动子片段,用T4DNA聚合酶补平末端。已有含有Tocs终止子(5’端有EcoRI酶切位点,3’端有PmeI,EcoRI位点)的载体,命名为pzz01131,Tocs终止序列可通过EcoRI单酶切pzz01131获得。EcoRI处理pzz01131获得Tocs终止子片段,用T4DNA聚合酶补平产生的粘末端。PmeI处理pzz01201,将Tocs终止子通过平末端连接方式连入,获得含有Ubi-Cry1Ab/Cry1AcZM-Tocs片段的载体,命名为pzz01206(见图1D)。已构建好载体pzz00015,以该载体pCambia3300(带有35s-BAR-T35spolyA元件)为骨架通过HindIII+PmeI双酶切加入Ubi-EGFP-T35spolyA元件构成,可通过HindIII+PmeI去除Ubi-EGFP-T35spolyA,然后在该位点添加新元件。HindIII+PmeI处理pzz01206载体,获得Ubi-Cry1Ab/Cry1AcZM-Tocs片段。HindIII+PmeI处理pzz00015载体,切口处连入Ubi-Cry1Ab/Cry1AcZM-Tocs,获得含有Ubi-Cry1Ab/Cry1AcZM-Tocs和35s-BAR-T35spolyA两个表达元件的表达载体命名为pZHZH25018(图1E)。(三)pZHZH25020的构建1、已有含35S启动子(5’端有SalI酶切位点,3’端有BamHI酶切位点)的载体,命名为pzz01143。2、SalI+BamHI双酶切处理pzz01143获得35S启动子片段,用T4DNA聚合酶补平产生的粘末端。3、已有含有Rbcs-Cry1Ab/Cry1AcZM-Tnos片段的载体pzz01191,片段上的Rbcs启动子可通过HindIII+PstI双酶切去除。4、HindIII+PstI双酶切处理pzz01191,去除Rbcs启动子片段,剩下片段用T4DNA聚合酶补平粘末端。将步骤4获得的35S启动子片段连入,获得含有35S-Cry1Ab/Cry1AcZM-Tnos的载体,命名为pzz01207(图1F)。5、已构建好载体pzz00005(图1G),该载体以pCambia3300(带有Ubi-BAR-T35spolyA元件)为骨架,带有HindIII,PmeI酶切位点,可以通过这两个位点添加外源片段。6、HindIII+PmeI处理pzz01207载体,获得35S-Cry1Ab/Cry1AcZM-Tnos片段。7、HindIII+PmeI处理pzz00005载体,切口处连入35S-Cry1Ab/Cry1AcZM-Tnos,获得含有35S-Cry1Ab/Cry1AcZM-Tnos和Ubi-BAR-T35spolyA两个表达元件的表达载体,命名为 pZHZH25020(见图1H)。(四)pZHZH25022的构建1.利用克隆载体pzz01194开展构建;2.已有含Ubi-Cry1Ab/Cry1AcZM-Tocs片段的载体(Cry1Ab/Cry1AcZM上的PolyA片段连同Tocs可通过EcoRI+PmeI双酶切获得)的载体,命名为pzz01206。3.已有含35S-Cry1Ab/Cry1AcZMZm-Tnos片段的载体(Cry1Ab/Cry1AcZM上的PolyA片段连同Tnos可通过EcoRI+PmeI双酶切去除)的载体,命名为pzz01207。4.EcoRI+PmeI双酶切处理pzz01206,获得polyA+Tocs片段。5.EcoRI+PmeI双酶切处理pzz01207,去除polyA+Tnos片段。将步骤5获得的polyA+Tocs片段连入,获得含有35S-Cry1Ab/CryAcZm-Tocs的载体,命名为pzz01228(图1J)。6.已构建好载体pzz00005,该载体以pCambia3300(带有Ubi-BAR-T35spolyA元件)为骨架,带有HindIII,PmeI酶切位点,可以通过这两个位点添加外源片段。7.HindIII+PmeI处理pzz01228载体,获得35S-Cry1Ab/Cry1AcZm-Tocs片段。8.HindIII+PmeI处理pzz00005载体,切口处连入35S-Cry1Ab/Cry1AcZm-Tocs,获得含有35S-Cry1Ab/Cry1AcZMZm-Tocs和Ubi-BAR-T35spolyA两个表达元件的表达载体,命名为pZHZH25022(见图1K)。表3、转化载体表达盒结构序号载体号启动子结构基因终止子其他基因1pZHZH25017UbiCry1Ab/Cry1AcZMNosBar2pZHZH25018UbiCry1Ab/Cry1AcZMOcsBar3pZHZH25020CaMV35SCry1Ab/Cry1AcZMNosBar4pZHZH25022CaMV35SCry1Ab/Cry1AcZMOcsBar实施例3.遗传转化(1)玉米的遗传转化:将载体DNApZHZH25017、pZHZH25018、pZHZH25020、pZHZH25022等质粒分别通过电击法转化到农杆菌EHA105中,鉴定后备用。玉米自交系祥249自交后取长度1.5mm左右的幼胚用于转化。收集约200个果穗的幼胚为一批之后,置于EP管中把悬浮液吸出,加入含有200μM乙酰丁香酮的农杆菌菌液,共培养5分钟,然后把幼胚转移到共培养基上,暗培养三天。将暗培养后的幼胚放至愈伤诱导培养基上,有愈伤长出后,放至含5mg/L双丙氨膦的筛选培养基上,筛选培养,每两周继代一次。当抗性愈伤长出时,挑选出状态良好的胚性愈伤转到分化培养基上,培养条件为26℃,每日3000Lux光强,光照16小时,两周后出现再生小苗。将再生的小植株移到生根培养基中,待小苗长出二级次根后,移栽于混有营养土和蛭石(1∶3)的小盆中。同时取叶片样品提取DNA,PCR测定确定阳性株,然后移栽至大花盆中。植株生长到7个叶后开展抗虫性生测,自交或者杂交获得T1代种子。(2)水稻的遗传转化:本申请以粳型水稻“空育131”为转化受体,测试了Cry1Ab/Cry1AcZM在水稻中的表达。利用载体pZHZH25020,通过农杆菌介导的遗传转化方法将抗虫和抗除草基因导入到水稻中。具体的步骤为:将构建的表达载体转化入农杆菌中;将农杆菌菌液侵染水稻的胚性愈伤组织;将愈伤组织转移到添加了草胺膦的选择培养基上进行筛选,挑选抗性愈伤组织;将抗性愈伤组织转入分化培养基分化,将分化形成的再生苗转入生根培养基中培养,幼苗生根后炼苗、移栽,得到T0代转基因水稻转化体200余株。对这些转化事件进行PCR分析,筛选到阳性植株自交后得到种子,鉴定出50多个转化事件的T1株系。播种出苗后对T1代材料进行Bt蛋白质表达分析。实施例4.利用PCR和Southern印迹进行转基因事件的DNA分子鉴定(1)PCR检测采用天根生化技术公司的DNA提取试剂盒抽提T0代转基因玉米 基因组DNA。将下列试剂从-20度冰箱中取出解冻:10倍PCR缓冲液(Takara)、脱氧核苷酸混合物(10mM,Sigma)、正反向引物(正向引物CSP759(SEQIDNO:4):5’-CACGCAGATTCCAGCGGTCAA-3’;反向引物CSP760(SEQIDNO:5):5’-GACGAGGTGAAGGCGTTAGCA-3’)以及玉米叶片DNA模板。所有试剂解冻完毕后,简短离心数秒,置于冰上待用。配制PCR反应体系的混合液,混匀,简短离心数秒。PCR反应体系(20μl):2μl10倍PCR缓冲液(Takara),0.5μl脱氧核苷酸混合物(10mM,Sigma),0.8μl正反向引物混合物(5μM),0.2μlr-Taq(5U,Takara),1μl玉米叶片DNA模板,其余为ddH2O。将混合液分装至200μl规格的PCR管中,再加入1μl模板DNA,对于不同样品分别做好标记以便区分。将PCR反应管放入Thermo9700型PCR扩增仪,选择预设PCR扩增程序,开始运行反应。PCR反应程序为:94℃预变性2分钟;30个以下循环:94℃变性30秒,58℃退火30秒,72℃延伸30秒;最后72℃延伸5分钟。PCR结束后,取5μlPCR产物进行琼脂糖凝胶电泳检测。配制1.5%的琼脂糖凝胶,150V电泳25分钟后在溴化已啶(EB)中染色10分钟,在紫外凝胶成像系统中拍照。Cry1Ab/Cry1AcZM基因为转化载体所特有,这样能扩增出该基因特异带的转基因植株即为阳性植株,否则即为阴性材料。图2显示出了玉米转化苗T0的检测结果,1-6泳道分别为不同的T0代转基因事件,见附图说明。T1代株系为T0代中选植株自交或杂交的后代,其PCR检测结果亦为阳性。得到的阳性株和株系见表4。表4、常规PCR鉴定转化植株情况序号载体号T0代阳性株数T1代阳性株系数1pZHZH25017120702pZHZH25018150803pZHZH2502090554pZHZH250229565注:T1代阳性株系数为T0代自交结实后的株系(2)Southern印迹鉴定提取转基因玉米基因组总DNA,获得的DNA沉淀干燥后溶于无离子水,测定浓度后备用。以pZHZH25018质粒DNA为模板制备探针。以序列4(SEQNO4,CSP759:CACGCAGATTCCAGCGGTCAA和CSP760:GACGAGGTGAAGGCGTTAGCA)为引物,采用罗氏公司PCR地高辛探针合成试剂盒(货号:11636090910)合成用于Cry1Ab/Cry1AcZM的探针,探针大小为333bp。扩增体系包含:DNA模板5μL(50pg),CSP759引物0.5μL,CSP760引物0.5μL,PCRDIG混合物5μL,DNA聚合酶0.75μL,PCR缓冲液(10倍)5μL,ddH2O33.25μL。PCR反应程序为:94℃预变性5分钟;35个以下循环:94℃变性30秒,55℃退火30秒,72℃延伸45秒;最后72℃延伸7分钟。待PCR扩增完毕,产物于12℃保存,以1%凝胶检测标记效果。进行样品酶切及酶切片段回收,200μL酶切体系中含有20μg玉米基因组DNA、20μl限制性内切酶、20μl10倍缓冲液,加ddH2O补齐至200μl。酶切16h后取20μl进行电泳检测,检测酶切效果是否彻底。酶切产物加ddH2O补齐至400μl,加入1/10体积的3M醋酸钠溶液(pH5.2),加入4μl的Dr.GenTLEPrecipitationCarrier,加入2.5倍体积的无水乙醇,充分混匀,12,000rpm4℃离心15分钟。将沉淀用50μlddH2O溶解,加5μl6倍上样缓冲液。将DNA通过0.8%凝胶,20V电泳16h。切掉多余泳道及点样孔,剩余凝胶用变性溶液处理2次,每次15分钟,在摇床上轻摇。再用中和缓冲液处理2次,每次15分钟,在摇床上轻摇。超纯水清洗一次。20倍SSC处理10分钟中,用whatman系统进行转膜4小时以上。转膜结束后,将膜放置在用10倍SSC浸润的Whatman3MM滤纸上,紫外交联仪交联3-5分钟。用ddH2O简单洗膜,于空气中干燥。杂交及显影过程均按照罗氏地高辛检测试剂盒I(货号:11745832910)的操作手册进行。本实验检测外源基因整合到玉米基因组的拷贝数以及转化事件的异同。通过HindIII和NcoI内切酶分别切割基因组DNA,得到了整合到玉米基因组拷贝数的结果(图3)。图3示出了一转化事件T1代株系玉米基因组DNA由HindIII酶切与Cry1Ab/Cry1AcZM特异探针分子杂交结果,探针长度333bp。1、6泳道为阴性对照祥249;2、7泳道为T1-1;3、8泳道为T1-2;4、9泳道为T1-3;5、10泳道为T1-4材料。M为分子量标记泳道,有碱基对数标出。两种酶切条件下分别显示一条阳性带,表明外源基因单拷贝插入。通过这种方法鉴定出一批不同转化载体和不同插入位点的单拷贝转化事件。4个载体中(pZHZH25017,pZHZH25018,pZHZH25020,pZHZH25022),每个转化载体鉴定出超过15个以上单拷贝转化事件。实施例5.转基因植物中Bt蛋白质表达测定分别用免疫试纸条和酶联免疫反应定量(ELISA)两种方法测定了抗虫蛋白在转基因植物体内的含量。(一)免疫试纸鉴定利用生物技术公司产品AntiCry1Ab(Cry1Ac)试纸条通过如下步骤检测植物组织中的蛋白。取样:定量取测定组织(叶片、花丝等),加PBS水溶液磨碎样品(0.2克样品加1ml溶液),离心取上清液待测。检测时取试纸条,检测端浸入样品;5-10分钟后观察结果。对照线显出表示试验正常,检测线是否显出表示溶液中是否含有检测蛋白。如图所示,PCR检测呈阳性的转基因植株全部可以检测出条带来,而野生型对照材料没有检测出条带。表明外源的Cry1Ab/Cry1Ac基因可以在转基因玉米细胞内表达出蛋白质。图4示出了玉米转化苗T0代6个植株的免疫测定结果,其中:1-6号材料为阳性,7材料为阴性。通过这种方法鉴定了一批不同转化载体的单拷贝转化事件蛋白质表达。4个载体中(pZHZH25017,pZHZH25018,pZHZH25020,pZHZH25022),每个转化载体鉴定出超过15个以上的T0代转化苗。(二)ELISA检测叶片中抗虫蛋白质含量利用双抗体夹心法酶联免疫定量检测(ELISA)试剂盒,测定了由Cry1Ab/Cry1AcZM编码的Bt蛋白质在玉米和水稻不同转化事件植株叶片中的含量。酶联免疫定量检测试剂盒为上海佑隆生物科技有限公司的产品,具体操作流程参照厂家说明书。利用TecaninfiniteM200pro酶标仪,配置软件i-control1.10,在450nm处检测并读取数据。根据标准蛋白质样品浓度和读出的OD值绘制标准曲线,计算待测样品的Bt蛋白质含量(μg/g鲜重材料)。(1)检测玉米叶片中Bt蛋白质含量ELISA检测的过程简述如下:取T1代(pZHZH25018)9叶一心时期玉米新鲜叶片,取样后用电子天平(万分之一克感量)称量鲜重5mg,加样品提取液(PBS)250μl,钢珠法叶片匀浆提取总蛋白质,4000rpm离心5分钟后吸取上清液稀释后进行ELISA反应测定。根据厂家提供的Cry1Ab/Cry1Ac蛋白质标准品绘制了标准曲线(R2=0.993),用来对待测样品进行定量。根据标准曲线方程计算出了未知样品的浓度,以及叶片的Bt蛋白质含量(每克鲜重叶片中所含的微克数),每组取样数n=12。免疫印迹结果在表5A示出。表5A、不同转化事件的玉米叶片Bt蛋白质含量材料编号平均值(μg/g)标准误备注15.772684*0.68200925.435507*0.21292735.427482*0.47341245.427482*0.47341254.087210.277786阳性对照60.0150.12阴性对照备注:*为与阳性对照相比差异显著;供试材料中1-5号材料为中选的转化事件,5号材料为内部阳性对照,6号材料为阴性对照祥249。统计分析表明1-4号材料Bt蛋白质含量显著 高于5号材料。实验证明本申请所测Bt基因在中选转化事件玉米叶片中表达良好,鲜叶片中Cry1Ab/Cry1Ac蛋白质含量介于5-6μg/g之间。(2)检测水稻叶片中Bt蛋白质含量ELISA检测的过程简述如下:T1代植株(pZHZH25020)7叶一心时期水稻新鲜叶片,取样后用电子天平(万分之一克感量)称量鲜重5mg,加样品提取液(PBS)250μl,钢珠法叶片匀浆提取总蛋白质,4000rpm离心5分钟后吸取上清液稀释后进行ELISA反应测定。根据厂家提供的Cry1Ab/Cry1Ac蛋白质标准品绘制了标准曲线(R2=0.997),用来测定分析待测样品。根据标准曲线方程计算出了未知样品的浓度,以及叶片的Bt蛋白质含量(每克鲜重叶片中所含的微克数),每组取样数n=6。测定了5个不同转化事件的植株叶片,结果列入表5B。表5B、水稻不同转化事件叶片Bt蛋白质(Cry1Ab/Cry1Ac)含量材料编号平均值(μg/g)标准误备注T1-14.3459540.77963T1-21.2166330.348865T1-34.585970.77226T1-46.992914*0.423833T1-57.902484*0.883617CK-65.0329860.495962阳性对照CK-7-0.010.1阴性对照注:*为与阳性对照相比差异显著供试材料中T1-1至T1-5号为中选的水稻转化事件,6号材料为内部阳性对照,7号材料为阴性对照。统计分析表明4、5号材料蛋白质含量显著高于内部对照阳性材料6号。实验证明本申请所测Bt基因在中选转化事件水稻叶片中表达良好,鲜叶片中其Cry1Ab/Cry1Ac蛋白质含量介于4-8μg/g之间。实施例6.T0和T1抗除草剂性状鉴定除草剂抗性鉴定:将T0代阳性植株经过自交或者测交得到的种子播种于大棚温室,对6-8叶片期T1代植株进行除草剂抗性鉴定,去除不含抗性基因的植株。由于Cry1Ab/Cry1AcZM基因与抗草胺膦基因同在T-DNA左右边界序列内,同时被转化到受体玉米中。T0代和T1代自交的情况下,T2代株系植株群体除草剂抗性分离比例是判断基因纯合的依据之一。喷施所用除草剂保试达为拜耳作物科学(中国)有限公司生产,有效成分为18%草胺膦可溶液剂。草胺膦耐受性鉴定浓度的确定:该除草剂的推荐用量为150-300ml/亩(兑水30-40公斤),即稀释100-267倍,因此本申请采用100倍稀释的保试达溶液涂抹心叶期(6~8片完全展开叶)玉米转化事件的倒二叶(剪去叶尖作为考察标记)。4-5天后观察并记录除草剂耐性表现。结果表明,本实验得到了大批叶片高抗草胺磷的转化事件。4个载体中(pZHZH25017,pZHZH25018,pZHZH25020,pZHZH25022),每个转化载体都鉴定出超过50个以上的T0代转化苗以及随后的T1和T2的株系。实施例7.转基因玉米植株抗虫生测采用离体叶片法和离体花丝法两种快速测定了T0和T1植株材料抗虫方法进行了生测实验。(1)离体叶片鉴定法测定转基因玉米对玉米螟的离体抗性。当待测玉米长到6-7叶时剪取倒二叶叶端部分,放入直径9cm的培养皿中,皿底以1300μL蒸馏水打湿滤纸以保持高湿。每皿中接玉米螟初孵幼虫10头,并用透气性较好的医用胶布封口。每株3个重复,以未转基因的自交系祥249作阴性对照,另设内部阳性对照。在温度28℃、湿度75%、光照:黑暗=14:10的条件下培养。4天后检查每皿的死虫头数,并计算螟虫死亡率及校正死亡率。校正死亡率(%)=(处理死亡率-对照死亡率)/(1-对照死亡率)。结果表明,本实验得到了叶片高抗玉米螟的转化事件(见图5A和表6)。表6、T0代不同Bt基因序列表达盒转化事件叶片抗虫表现注:T0代每个载体参试12个阳性植株;(2)离体花丝鉴定法T1代优异转化事件,播种于温室。在玉米花丝盛期取新鲜花丝带回室内,整根缠绕几次后放入培养皿中,接虫方法和培养条件同离体叶片法,4天后检查玉米螟幼虫的存活状况。结果表明本实验得到了花丝高抗玉米螟的转化事件(见图5B和表7)。表7、T1代不同Bt基因序列表达盒优异转化事件抗虫表现注:T1代每个载体参试最优转化事件3个,每转化事件设3个重复,根据结果计算分类。叶片高抗螟虫的转基因材料以转化事件株系为单位,通过自交或者杂交结实,收获种子。用于进一步的分析鉴定和后代的转基因育种。实施例8.与现有基因的比较根据现有技术(CN1037913C)中的核苷酸序列,与实施例2-6相同地进行转化和转化苗的抗虫性鉴定。将CN1037913C的序列根据实施例2所述构建了一个由CaMV35S启动子驱动和具有Nos终止子的载体,命名为pCN1037913C。利用农杆菌转化技术将pCN1037913C转入祥249中,并通过分子鉴定获得了一批具有外源抗虫Bt基因的植株,均为pCN1037913C载体的不同转化事件。然后,根据实施例5,将pCN1037913C系列转化事件与本申请创制的多个不同载体玉米转化事件在相同条件下进行抗玉米螟虫特性比较。T0代不同Bt基因序列表达盒转化事件叶片抗虫表现结果列入表8。T1代不同Bt基因序列表达盒优异转化事件抗虫表现结果列入表9。表8、T0代不同Bt基因序列表达盒转化事件叶片抗虫表现注:T0代每个载体参试12个阳性植株。表9、不同Bt基因序列表达盒优异转化事件抗虫表现注:T1代每个载体参试最优转化事件3个,每转化事件设3个重复,根据结果计算并分类。结果表明,本申请设计的Bt基因Cry1Ab/Cry1AcZM序列杀虫性能好于已有序列。优异转基因事件中的T0代叶片、T1代叶片和花丝对玉米螟有更强的杀灭能力。本文所引用的所有参考文献均通过引用整体并入本文并用于所有目的,其程度与单个出版物被明确地并单独地指出通过引用整体并入本文用于所有目的相同。当通过引用并入的出版物和专利或专利申请与本说明书中包含的公开内容相冲突时,本说明书中的内容替代和/或优先于任何这类相冲突的引用材料。用于说明书和权利要求中的表达成分的量、层析条件等的所有数字应当理解为在所有情况下被术语“约”修饰。因此,除非另有所指,说明书和所附权利要求书中陈述的数字参数为近似值,其可根据本申请试图获得的所需性能而改变。本文描述的具体实施方案仅通过实例的方式提供,并且不试图以任何方式具有限制意义。说明书和实施例仅被认为是示例性的,本申请的真实范围由权利要求书所限定。如对本领域技术人员所显而易见的,可进行本申请的许多修饰和改变,而不脱离其精神和范围。因此,在不偏离本申请精神的基础上所做的这些修改或改进,均属于本申请要求保护的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1