新型NKT样细胞亚群及其治疗肿瘤的用途的制作方法
本发明属于免疫学和临床医学领域,涉及一种新型的NKT样免疫细胞亚群。具体地,所述NKT样细胞亚群包含CD8+NKT样细胞。本发明还涉及所述NKT样细胞亚群的制备方法、包含所述NKT样细胞亚群的治疗用组合物及其治疗肿瘤的用途。
背景技术:
CTL细胞和NK细胞是已知的抗肿瘤免疫应答的主要效应细胞[1]。CTL细胞可识别并杀伤表达MHC-I类分子和特异性肿瘤抗原的肿瘤细胞;但许多肿瘤组织MHC-I类分子表达下调,CTL细胞对其无法识别,而表达自然杀伤细胞受体的NK细胞将作为杀伤肿瘤的主要效应细胞。NK细胞和CTL细胞抗肿瘤效应的发挥依赖于其膜表面表达的受体与肿瘤细胞表面相应配体的结合,引发效应细胞释放细胞毒性成分以行使杀伤效应。因此,一种既表达自然杀伤细胞受体、又表达T细胞表面标志TCRβ/CD3的免疫细胞——NKT细胞的出现,引起了免疫学研究领域的极大关注。
1987年,三个独立的研究小组分别报道了一群表达中等强度的αβTCR而不表达CD4和CD8的T细胞群体[2-4];1990年Sykes报道了一种表达NK1.1同时也表达αβTCR的细胞亚群[5]。1995年,“NKT”细胞作为专有名词第一次出现,并特指一群表达NK1.1(小鼠CD161c)标志的T细胞亚群[6]。在小鼠的研究中,根据NKT细胞的CD1d限制性和TCR的多样性,Godfrey将NKT细胞分为三种类型[7]:I型NKT细胞、II型NKT细胞和NKT样细胞。I型NKT细胞是能够识别CD1d递呈的α-Galcer脂类抗原的一群NKT细胞,II型NKT细胞则能识别CD1d递呈的除α-Galcer外的脂类抗原,NKT样细胞包括除I型NKT细胞、II型NKT细胞外的其他NKT细胞亚群。其中,I型NKT细胞免疫学特征和功能的研究最为广泛,又被称为经典NKT细胞;目前文 献资料中提到的NKT细胞大多是指此NKT细胞类型。由于CD1d四聚体技术的成熟,以及CD1d缺陷转基因小鼠的出现,目前对NKT细胞的研究大多集中于经典NKT细胞(I型NKT细胞)。然而,I型NKT细胞仅为NKT细胞群体的一个亚群;NKT细胞中50%以上细胞均为NKT样细胞[7]。
II型NKT细胞特征为发育依赖于CD1d分子,但表达相对多样的TCR链。NKT样细胞则为既不依赖于CD1d分子,又表达多样TCR链的NKT细胞亚群。然而,目前对II型NKT细胞和NKT样细胞的研究较少。已有的研究表明,II型NKT细胞具有一定免疫调节功能,而NKT样细胞具有抗肿瘤效应。β2微球蛋白缺陷小鼠体内存在一群非依赖CD1d分子的NKT样细胞,该细胞能够在体外杀伤多种肿瘤细胞[8]。
尽管有研究发现NKT样细胞具有抗肿瘤效应,但大多基于特殊动物模型,缺乏基于正常小鼠的系统研究,作用机制也不明确。因此,需要明确表征具有抗肿瘤效应的NKT样细胞亚群以及其抗肿瘤机制,从而对该群细胞进行深入研究并实现临床应用。
技术实现要素:
通过大量的基础和应用研究,本申请的发明人出人意料地发现了一个具有特殊表型的NKT样细胞亚群,该亚群细胞具有强大的抗肿瘤能力。
在第一个方面,本发明提供了一种分离的NKT样细胞亚群(下文中有时简称为“本发明的NKT样细胞”),所述NKT样细胞亚群可以包含表面表达CD8分子的NKT样细胞(下文中有时简称为“本发明的CD8+NKT样细胞”或“CD8+NKT样细胞”)。
在一个实施方案中,本发明的NKT样细胞可以包含一定比例的不表达CD8分子的免疫细胞(在本文中有时也称为“CD8-免疫细胞”)。CD8+NKT样细胞在本发明的NKT样细胞中的比例可以为50%以上,优选60%以上,更优选70%以上,最优选80%以上。
在一个实施方案中,本发明的NKT样细胞可以包含100%的CD8+NKT样细胞,即,全部是CD8+NKT样细胞。
根据本发明,本发明的NKT样细胞可以分离自哺乳动物。
在第二个方面,本发明提供了活化和扩增本发明的NKT样细胞的方法(在本文中有时简称为“本发明的扩增方法”),该方法可以包括以下步骤:
1)采集受试者的外周血并分离去除红细胞;
2)从步骤1)中获得的已去除红细胞的外周血中分离单个核细胞,采用本领域中已知的细胞分选技术(例如,借助本领域中公知的细胞分选技术)利用本发明的CD8+NKT样细胞的表面标志物(例如,TCRαβ、CD3、CD56/CD161c、CD8、Vα24TCR或Vα14TCR等)分选出本发明的NKT样细胞;
3)将步骤2)中得到的本发明的NKT样细胞在体外培养,并向培养物中添加能够刺激T细胞增殖和活化的细胞因子,培养足以使其数量扩增至少10~1000倍的时间;以及
4)收获步骤3)中得到的本发明的NKT样细胞。
应该理解的是,在本发明的扩增方法中,步骤2)和步骤3)可以互换,即可以先分选再扩增,也可以先扩增后分选。由于本发明的NKT样细胞在外周血中的含量很小,因此在另一个优选的实施方案中,可以先扩增后分选(即,先进行步骤3)接着进行步骤2)),然后再将分选出目标细胞。
出于临床使用方便性和减少患者采血时交叉感染或医源性感染的考虑,可以将上述扩增后的本发明的NKT样细胞制备成治疗用组合物,从而便于保存以备随时使用。
因此,在第三个方面,本发明提供了一种治疗用组合物,其包含本发明的NKT样细胞作为主要活性成分。
在第四个方面,本发明涉及本发明的NKT样细胞或本发明的治疗用组合物在制备用于治疗肿瘤的药物中的用途。
在第五个方面,本发明提供了一种治疗需要治疗的受试者中的肿瘤的方法,该方法可以包括以下步骤:
1)采集所述受试者的外周血;
2)从所述受试者的外周血中分离单个核细胞,富集(例如,采用本领域中已知的细胞分选技术)本发明的NKT样细胞并在体外扩增;以及
3)收获步骤2)中获得的经扩增的本发明的NKT样细胞并过继回输给所述受试者。
由于本发明的NKT样细胞在外周血中的含量很小,因此在上述治疗方法中,可以先扩增单个核细胞后再富集本发明的NKT样细胞。
上面的概述描述了本发明的某些方面、优势和新特征。但要理解,所有这些优势不一定全部由本发明的任何特定实施方案来实现。因此,本领域技术人员会认识到,本发明可以通过本文所教导的一个或多个优点的组合的方式来实施或进行,而不一定实现如本文所教导或提示的其他优点或全部优点。
附图说明
以下参照附图说明本发明的优选实施方案并详细描述本发明的上述和其他特征、方面和优势。要理解的是,此意在举例说明而非限制本发明。在附图中:
图1图示了本发明的小鼠CD8+NKT样细胞的表型,在图中黑线代表分子表达水平,灰线代表相应同型对照的表达水平。
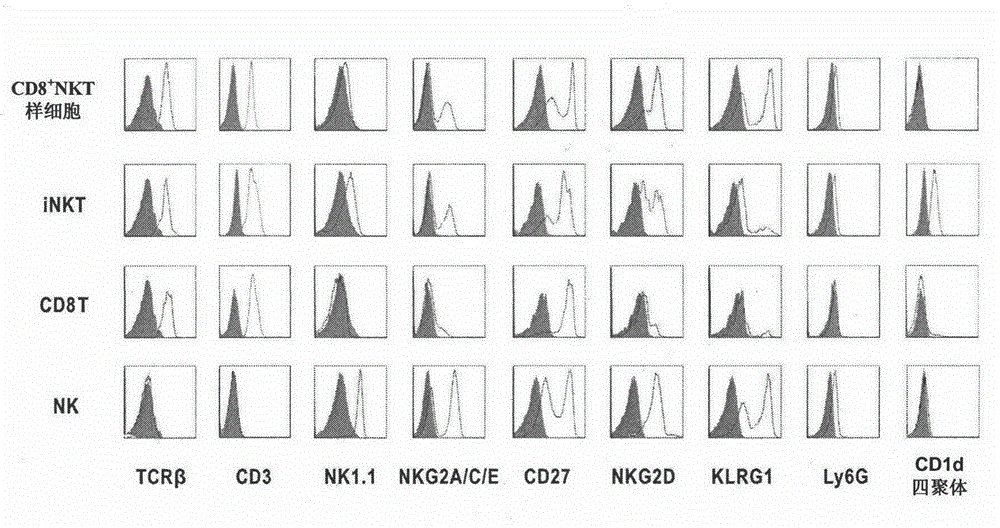
图2图示了本发明的小鼠CD8+NKT样细胞与NK细胞、iNKT细胞和CTL细胞的表型差异,填充区域代表同型对照的表达水平,空心区域代表相应分子的表达水平。
图3是本发明的小鼠CD8+NKT样细胞、NK细胞和CD8+T细胞的透射电镜照片和激光共聚焦显微镜照片,其中图3A是透射电镜照片,图3B是激光共聚焦显微镜照片。在图3B的照片中,红色是溶酶体染料LysoTracker染色的结果,绿色是FITC标记的抗小鼠CD90抗体的染色结果,蓝色是Hoechst33342染料的染色结果。
图4比较了本发明的小鼠CD8+NKT样细胞、CD8+T细胞和CD4+T细胞的细胞因子分泌能力,其中图4A显示抗原刺激后24h时检测的结果,图4B显示抗原刺激后48h时检测的结果。
图5示意性地显示了本发明的CD8+NKT样细胞的体外扩增方法的一个实例的流程图。
图6是显示本发明的CD8+NKT样细胞的体外扩增能力的图,其显示了用细胞因子处理后不同时间点CD8+NKT样细胞的扩增倍数。其中 图6A图示了来自小鼠的CD8+NKT样细胞的结果,图6B图示了来自于人的CD8+NKT细胞的结果。
图7是对于尾静脉接种B16黑色素瘤细胞的小鼠,过继回输CD8+NKT样细胞以及PBS后21天获取的肺标本的照片,在照片中肺上的黑色斑点为黑色素瘤转移灶。
图8是显示不同抗原特异性的小鼠CD8+NKT样细胞对EL4-OVA8肿瘤细胞的体外抗原特异性杀伤作用的图。
图9图示了对于接种EL4-OVA8肿瘤细胞的小鼠,过继回输具有不同抗原特异性的CD8+NKT样细胞后小鼠体内肿瘤大小和生存时间曲线。图9A是对于接种EL4-OVA8肿瘤细胞的小鼠,过继回输5x105具有不同抗原特异性的CD8+NKT样细胞后小鼠体内肿瘤大小的曲线;图9B是对于接种EL4-OVA8肿瘤细胞的小鼠,过继回输2.5x105具有不同抗原特异性的CD8+NKT样细胞后小鼠体内肿瘤大小的曲线。
图10比较了本发明的CD8+NKT样细胞与NK细胞对Yac-1肿瘤细胞的非抗原特异性杀伤作用。该图是显示在不同的效靶比条件下,CD8+NKT样细胞与NK细胞对Yac-1肿瘤细胞的杀伤率的折线图。
图11比较了OVA抗原特异性的CD8+NKT样细胞与OVA抗原特异性的CD8+T细胞对EL4-OVA8肿瘤细胞的杀伤效应。该图是显示OVA抗原特异性的CD8+NKT样细胞和OVA抗原特异性CD8+T细胞对EL4-OVA8肿瘤细胞的杀伤率的折线图。
图12显示了本发明的CD8+NKT样细胞、NK细胞和CD8T细胞上各种Granzyme、Perforin和Lamp-1表达的热图,图中右上方为色阶,从黄到红表示表达强度从低到高。
具体实施方式
除非另外定义,本文中使用的全部技术和科学术语具有与本发明所属领域中的一般技术人员通常理解的相同的含义。尽管与本文中所述的那些相似或等同的任何方法和材料可以用于实施或测试本发明,但是现在描述优选的方法和材料。本文中引用应用的全部出版公开物和专利申请通过引用整体结合于本文中。本文中没有任何内容可以被解释为承认本发明无权通过在先发明而使早于本公开内容的日期获得 授权。
必须注意,用于本文中和所附权利要求中时,单数形式“一个”、“某个”和“该”包括复数指代物,除非上下文另外清楚地规定。
定义
“NKT细胞”:NKT细胞的定义有广义和狭义两种。广义的NKT细胞是指既表达NK细胞表面标志(小鼠为CD161c,人为CD56)又表达T细胞表面标志的细胞群体。随着脂类抗原结合CD1d四聚体技术的发展,研究人员在小鼠的研究中发现一群能够结合负载脂类抗原α-GalCer的CD1d四聚体的细胞亚群,该群体大多既表达NK细胞表面标志,又表达T细胞表面标志,且分泌大量细胞因子,发挥免疫调节作用;这群细胞根据Godfrey定义,为I型NKT细胞,即狭义NKT细胞。目前这群细胞研究最为广泛,也最为深入,因此这群细胞被称为经典NKT细胞。现有文献资料中提及的NKT细胞主要是指狭义NKT细胞。在本发明中,如果未明确指明,当提及NKT细胞时均是指广义NKT细胞。
“iNKT细胞”:即狭义NKT细胞,由于该群体表达恒定TCR链(对于小鼠为Vα14Jα18,对于人为Vα24Jα18),又被称为invariant NKT细胞(在本文中有时简称为iNKT细胞)[7]。
“NKT样细胞”:NKT样细胞是指既表达NK细胞表面标志(在小鼠中为CD161c,在人中为CD56),又表达T细胞表面标志(例如,TCR和/或CD3),发育不依赖于CD1d分子的细胞亚群。这群细胞的特点是单个细胞的表面可以各自表达不同类型的TCR,但这群细胞不包括表面表达Vα24TCR(人)或Vα14TCR(小鼠)的细胞[7]。该细胞群体的定义是与经典或狭义NKT细胞相对的(就Vα24TCR或Vα14TCR而言)。
“Vα24TCR”在本发明中是指表达Vα24基因的TCR序列。经典免疫学理论认为,TCR序列重排导致T细胞的TCR序列具有多样性,但是某些特殊表达TCR的细胞亚群却偏好表达某一类型的TCR序列。如经典NKT细胞偏好表达Vα24TCR。“Vα14TCR”的定义与“Vα24TCR”类似。
“CD1d限制性”在本发明中是指免疫细胞的发育对于CD1d分子的依赖性。在NKT细胞群体中,经典NKT细胞被认为是CD1d限制性,NKT样细胞被认为是非CD1d限制性。
“CD8+”在本发明中是指细胞表面上表达CD8标志。
“CTL细胞”在本发明中是Cytotoxic T Lymphocyte的缩写,是指表达CD8标志的T细胞(也称为“CD8+T细胞”)经过抗原特异性刺激后转变成的一群具有强大杀伤病毒感染的靶细胞能力的效应性T细胞。要注意的是,经典CTL细胞的概念并不包含表达NK细胞标志(CD56)的NKT细胞和NKT样细胞。
本发明的NKT样细胞
本发明公开了一种NKT样细胞亚群,其包含表面表达CD8分子的NKT样细胞。
在一个实施方案中,本发明的NKT样细胞可以包含一定比例的不表达CD8分子的免疫细胞。CD8+NKT样细胞在本发明的NKT样细胞中的比例可以为50%以上,优选60%以上,更优选70%以上,最优选80%以上。
优选地,本发明的NKT样细胞可以包含100%的CD8+NKT样细胞,即,全部是CD8+NKT样细胞。
根据本发明,本发明的CD8+NKT样细胞的表面上可以表达CD3和CD56(或CD161c),但不表达Vα24TCR(Vα14TCR),即其表型可以表示为CD3+CD56+CD8+Vα24TCR-或CD3+CD161c+CD8+Vα14TCR-。
在一个具体的实施方案中,本发明的CD8+NKT样细胞的表面上还可以表达TCRαβ,即表型为TCRαβ+CD3+CD56+CD8+Vα24TCR-或TCRαβ+CD3+CD161c+CD8+Vα14TCR-。
图1图示了本发明的CD8+NKT样细胞的表型。在图1中,可以看出小鼠CD8+NKT样细胞表达T细胞谱系标志CD3和TCRβ,也表达NK细胞谱系标志NK1.1(CD161c),但不表达iNKT的谱系标志CD1d。另外,从图1中还可以看出,CD8+NKT样细胞表达T细胞活化标志CD44、CD62L和CD122,以及NK细胞受体NKG2A/C/E、KLRG1、NKG2D、Ly49G2和CD27。这些结果表明这群细胞兼具NK细胞和T 细胞的功能特征。
图2图示了本发明的CD8+NKT样细胞与NK细胞、iNKT细胞和CTL细胞的表型差异。从图2中可以看出:(1)与NK细胞相比,小鼠CD8+NKT样细胞表达NK细胞标志NK1.1(CD161c)、NKG2A/C/E、CD27、KLRG1和Ly6G,但比NK细胞多表达TCRβ和CD3;(2)与CTL细胞相比,小鼠CD8+NKT样细胞表达T细胞谱系标志TCRβ和CD3,但不表达NK细胞受体;(3)与iNKT细胞相比,CD8+NKT样细胞不能结合负载脂类抗原的CD1d四聚体。上述结果表明本发明的CD8+NKT样细胞是独立于现有技术中已发现的任何一群具有确定表型的具有抗肿瘤效应的免疫细胞亚群的新的免疫细胞亚群。
图3是本发明的CD8+NKT样细胞、NK细胞和CD8+T细胞的透射电镜照片和激光共聚焦显微镜照片。图3A的透射电镜照片显示,小鼠CD8+NKT样细胞中含有大量的颗粒样物质,而NK和CD8+T细胞中类似的颗粒样物质较少。从图3B的激光共聚焦显微照片中发现本发明的CD8+NKT样细胞体积较大,其直径为约15μm以上,而NK细胞和CD8+T细胞的直径小于10μm,大约在7μm左右。同时,CD8+NKT样细胞中的颗粒样物质为溶酶体染料染色阳性,提示这些颗粒样物质可能含有发挥细胞毒效应的颗粒酶,而NK细胞和CD8+T细胞中这些溶酶体染料染色阳性的颗粒则很少。另外,通过对细胞核和细胞膜的染色还发现,CD8+NKT样细胞的核质比与其他两种细胞相比较小。以上的这些形态学差异提示,本发明的CD8+NKT样细胞是完全不同于NK细胞和CD8+T细胞的一个新的独特的免疫细胞亚群。而且,从形态学上也可以预期CD8+NKT样细胞的功能与其他两者也存在很大的差异。细胞内溶酶体染料染色阳性的颗粒提示本发明的CD8+NKT样细胞可能具有颗粒酶介导的细胞毒效应。
图4比较了本发明的CD8+NKT样细胞、CD8+T细胞和CD4+T细胞的细胞因子分泌能力。从图4中可以看出在特异性抗原刺激后24h和48h,小鼠CD8+NKT样细胞分泌的IFN-γ水平显著高于CD8+T细胞和CD4+T细胞;其分泌的IL-2水平低于CD8+T细胞,但与CD4+T细胞相当。从细胞因子表达谱来说,相对于CD4+T细胞,在CD8+T细胞中IFN-γ和IL-2两者均为高水平表达,而在本发明的CD8+NKT 样细胞中仅IFN-γ高表达,由此可见本发明的CD8+NKT样细胞具有独特的细胞因子表达谱。
另外,出于刺激T细胞的活化效率和强度以及增加细胞总数量(因为本发明的NKT样细胞亚群在血液中的比例较小)从而延长回输后血中半衰期的考虑,本发明的NKT样细胞可以包含一定比例的CD8-免疫细胞。在此情况下,本发明的NKT样细胞可以包含50%、60%、70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以上,优选60%以上,更优选70%以上,最优选80%以上的CD8+NKT样细胞。
扩增本发明的NKT样细胞的方法
本发明进一步提供了扩增本发明的NKT样细胞的方法。
在本发明中,哺乳动物可以是选自牛科动物、马科动物、猫科动物、犬科动物、兔科动物、猪科动物、骆驼科动物、啮齿类动物和灵长类动物等的动物,包括但不限于牛、马、山羊、绵羊、猫、兔、猪、骆驼、羊驼、大鼠、小鼠、豚鼠、非人灵长类动物(诸如猿、猴、狒狒、猩猩)和人,优选是牛、马、犬、山羊、绵羊、猪、骆驼、大鼠、小鼠、猴和人,更优选是人。
本发明的哺乳动物也可以是宠物动物,包括但不限于宠物狗、宠物猫、啮齿动物宠物(例如,龙猫、仓鼠、小白鼠、沙鼠、金花鼠、八齿鼠、松鼠、鼯鼠和大花鼠等)、宠物兔、貂、刺猬、羊驼、豚鼠、牛、猴、绵羊、猪、马、鹿、大象、犀牛等,优选宠物狗、宠物猫、猴、绵羊等。
如无特殊说明,上述对哺乳动物的描述和定义适用于本文中提到哺乳动物的所有章节、段落、任何实施方案、实施例以及权利要求书。
在本发明的扩增方法中,采集外周血和分离单个核细胞的方法不受特别的限制,可以采用本领域中公知的方法,例如,可以采用体外循环的方法或设备(例如,可以使用人单个核细胞分离机,循环3000~6000mL外周血)。
在本发明的扩增方法中,从抗凝血中去除红细胞的方法也不受特别的限制,可以采用本领域中公知的方法。例如,可以采用密度梯度 离心的方法。
在本发明的扩增方法中所采用的细胞分选技术是本领域中所熟知的,可以采用本领域中常用的方法或设备来完成,在本发明中不受任何限制。只要是可以利用表面标志物来分选细胞的技术、方法和设备均可以在本发明中使用。例如,可以采用磁性分选技术或流式细胞术。细胞分选技术例如磁性分选技术或流式细胞术的具体实施方法可以在许多科学文献中找到,或按照设备或仪器生产厂商的说明书或推荐实验流程实施,本领域技术人员完全有能力获得这些具体实施方法或实验流程。
对于表面标志物,可以根据受试者的物种种类(例如人、小鼠、狗等)以及需要分选和富集的目标细胞占最终分离细胞的比例范围(例如,50%、60%、70%、80%或90%以上)来选择一种或多种标志物的组合。例如,对于人,可以选择CD3、CD56、CD8和Vα24TCR的组合,为了更高的富集率,还可以增加TCRαβ,即CD3、CD56、CD8、Vα24TCR和TCRαβ的组合(即,分选出TCRαβ+CD3+CD56+CD8+Vα24TCR-NKT样细胞)。对于小鼠,可以选择CD3、CD161c、CD8和Vα14TCR的组合,为了更高的富集率,还可以增加TCRαβ,即CD3、CD161c、CD8、Vα14TCR和TCRαβ的组合(即,分选出TCRαβ+CD3+CD161c+CD8+Vα14TCR-NKT样细胞)。
在本发明的扩增方法中,本发明的NKT样细胞的培养条件不受特别的限制。对于培养基,可以采用常规用于T细胞培养的培养基,例如RPMI-1640培养基。对于培养条件,可以采用本领域中T细胞培养的常用条件,例如,温度37℃、CO2浓度5%,每3~5天更换一次培养基。对于本发明的NKT样细胞的扩增和活化,可以通过添加一些细胞因子来实现,例如,能够刺激T细胞增殖和活化的细胞因子,包括但不限于GM-CSF、IL-2、IL-4、IL-5、IL-6、IL-7、IL-9、IL-12、IL-15、4-1BBL等。
对于培养时间,本领域技术人员可以根据扩增后的细胞的用途具体确定。可以通过定期取样进行细胞计数来估算细胞扩增数量或倍数,从而控制培养时间。如果用于人体临床应用,对于免疫细胞过继回输,回输的细胞量可以在1×109~1×1012个细胞,优选1~10×1010个细胞。如 果用于小鼠,则回输的细胞量可以在1~100×106个细胞。一般而言,培养的时间应足以使初步分离或分选的细胞的数量扩增10~1000倍的时间,一般培养7~30天,优选10~27天,更优选14~21天。
本发明的扩增NKT样细胞的方法的一个具体实施方案可以包括以下步骤:
1)将受试者的外周血采集到抗凝试管中,通过密度梯度离心的方法去除红细胞;
2)从已去除红细胞的外周血中分离单个核细胞,利用表面标志物CD3、CD56(对于受试者是人的情况)或CD161c(对于受试者是小鼠的情况)、CD8、Vα24TCR以及任选的TCRαβ,借助于流式细胞术分选出CD3+CD56+CD8+Vα24TCR-或(以及任选地TCRαβ+CD3+CD56+CD8+Vα24TCR-)NKT样细胞;
3)将步骤2)中得到的本发明的NKT样细胞在完全培养基中,置于37℃、5%CO2环境下体外培养,并向培养物中添加选自GM-CSF、IL-2、IL-4、IL-5、IL-6、IL-7、IL-9、IL-12、IL-15、4-1BBL等的一种细胞因子或多种细胞因子的组合,培养足以使其数量扩增10~1000倍的时间(培养时间为大约7~30天,优选10~27天,更优选14~21天,期间定期取样通过细胞计数估算);以及
4)收获步骤3)中得到的本发明的NKT样细胞。
作为一个非限制性实例,图5中示意性地显示了扩增本发明的NKT样细胞的方法的一个具体实施例的流程图。在图5中所示的具体实例中,采用Ficoll离心并收集外周血中的单个核细胞,通过流式细胞仪分选CD8+NKT样细胞亚群,然后通过添加细胞因子组合将分选后的细胞进行扩增,即先分选后扩增的方案。
图6图示了本发明的CD8+NKT样细胞的体外扩增能力。从图6A中可以看出体外培养小鼠CD8+NKT样细胞21天时,CD8+NKT样细胞扩增超过1000倍。由于培养30天时,细胞数量已经足以保证回输的细胞数量,因此对于小鼠,扩增的时间可以选择培养7~30天,优选10-21天。
另外,从图6B中可以看出,人CD8+NKT样细胞在14天时扩增达到782倍,之后生长趋缓,在21天时达到1120倍。考虑到体外细胞的潜在成瘤性以及与临床治疗计划的配合,细胞培养时间不宜过长,因此在临床应用中,细胞培养时间可以选择7~30天,优选10~27天,更优选14~21天。
本发明的治疗用组合物
如上所述,可以将本发明的NKT样细胞制备成治疗用组合物,从而便于长期保存以备随时使用,这样可以不仅减少受试者的采血次数从而减少受试者的痛苦和费用,还可以减少医疗操作从而减少交叉性感染或医源性感染的机会。
根据本发明,本发明的治疗用组合物包含本发明的NKT样细胞作为主要活性成分。在本发明中,主要活性成分是指能够发挥目标效应的成分。在本发明中,当本发明的治疗用组合物用于治疗肿瘤时,则目标效应是抗肿瘤效应,因而主要活性成分是指所述治疗用组合物中能够发挥抗肿瘤效应的成分。
当本发明的治疗用组合物为包含治疗用细胞的细胞制剂的形式时,则主要活性成分是指发挥目标效应的细胞成分。当本发明的治疗用组合物为包含细胞与具有某种治疗用途的生物分子(例如,蛋白质或多肽、肽、核酸、抗体、氨基酸等)和/或化学药物(例如,化学合成药物)的组合形式时,则主要活性成分为发挥目标效应的细胞成分以及生物分子和/或化学药物的组合。优选地,所述生物分子和/或化学药物的治疗用途与所述治疗用细胞的治疗用途相同,例如,均用于抗肿瘤。所述生物分子和/或化学药物的治疗用途与所述治疗用细胞的治疗用途也可以不同。例如,当本发明的治疗用组合物中包含的治疗用细胞用于抗肿瘤时,所述生物分子和/或化学药物可以是具有拮抗细胞治疗的不良反应或副作用以及肿瘤并发症或合并症(例如,发热、寒战、焦虑;腹水、恶心、呕吐、腹胀、腹泻、梗阻、心力衰竭、心律失常、干咳、咳嗽、呼吸困难、少尿、多尿、蛋白尿、血尿、疼痛、皮肤过敏、皮肤红斑、皮肤瘙痒等等)的活性的分子或药物。
当本发明的治疗用组合物为细胞制剂的形式时,则按细胞数量计, 本发明的NKT样细胞占本发明的治疗用组合物中的细胞总数的50%、60%、70%、80%、90%或95%以上,甚至100%,优选60%以上,更优选80%以上,最优选90%以上。
当本发明的治疗用组合物为包含治疗用细胞和治疗用生物分子和/或化学药物的组合形式(所述组合形式可以是混合物的形式,也可以是分开独立包装的形式,在本发明中不受任何限制)时,则按重量计本发明的NKT样细胞占本发明的治疗用组合物中的主要活性成分(即,细胞以及生物分子和/或化学药物的总量)的50%、60%、70%、80%、90%或95%以上,甚至100%,优选60%以上,更优选80%以上,最优选90%以上。
在一个优选实施方案中,本发明的治疗用组合物还可以包含药学上可接受或生理学可接受的药用辅料、载体、稳定剂、稀释剂、赋形剂、缓冲液、等渗剂和/或添加剂等。
在进一步优选的实施方案中,本发明的治疗用组合物还可以包含常规用于T细胞低温保存的抗冻液(例如,ZENOAQ公司CELLBANKER系列细胞冻存液),从而可以进行深低温(-80℃以下,例如,在液氮中)保存。
本发明的NKT样细胞的医学用途
本发明的发明人在大量的研究中出人意料地发现本发明的NKT样细胞具有令人吃惊的强大的抗肿瘤作用,而且这种抗肿瘤作用不仅具有特异性,还具有非特异性,因此本发明的NKT样细胞具有较宽的抗瘤谱。
虽然现有技术中曾有报道发现NKT样细胞具有抗肿瘤效应,但由于对NKT样细胞的研究很少,因此现有技术对NKT样细胞的抗肿瘤效应仅处于现象观察的初步阶段,尚缺乏对于NKT样细胞群的具体亚群构成、表型、抗肿瘤效应强度、抗瘤谱以及具体的抗肿瘤机制的整体认识。
特别地,发明人通过研究发现,本发明的NKT样细胞所发挥的抗肿瘤效应可以依赖于抗原特异性和非抗原特异性两种机制。这是出人意料的,因为现有技术中即没有提到NKT样细胞的抗肿瘤效应源自于 某一具有特殊表面标志的细胞亚群,更没有提到NKT样细胞或NKT样细胞中的某一亚群具有抗原特异性和非抗原特异性双向抗肿瘤作用。而且从实验结果来看,本发明的NKT样细胞不仅抗肿瘤效应强,而且抗瘤谱广,大大超过了现有技术中其他免疫细胞治疗如CAR-T和CIK的抗瘤谱。
在图7图示的实验中,对于尾静脉接种B16黑色素瘤细胞的小鼠,过继回输本发明的CD8+NKT样细胞和PBS对照。从图7中可以看到注射PBS的小鼠的肺上遍布黑色素瘤转移灶,而过继回输CD8+NKT样细胞后,转移灶数目显著减少。下面的表1中总结了不同组的转移灶数目以及统计学结果(结果统计采用t-检验)。
表1
图8比较了不同抗原特异性的小鼠CD8+NKT样细胞对EL4-OVA8肿瘤细胞的体外抗原特异性杀伤作用。在本实验中,将分别从OT-I小鼠和SV小鼠分离的CD8+NKT样细胞(这两群细胞分别对OVA和SV具有抗原特异性)在体外与CD8+NKT样细胞共培养,结果发现OVA抗原特异性的CD8+NKT样细胞对EL4-OVA8肿瘤细胞的杀伤作用显著高于SV抗原特异性CD8+NKT样细胞,这提示本发明的CD8+NKT样细胞对肿瘤细胞的杀伤作用具有一定的抗原选择性(即,经由某些抗原发挥特异性杀伤作用),而不仅仅通过非抗原特异性杀伤途径。
图9显示了不同剂量的具有不同抗原特异性的CD8+NKT样细胞对小鼠体内肿瘤大小和生存时间的影响。图9A是过继回输5x105个细胞的结果,图9B过继回输2.5x105个细胞的结果。图9A的结果显示,从回输后19天开始,过继回输OVA特异性CD8+NKT样细胞的小鼠体内EL4-OVA8肿瘤的体积显著小于回输SVEL4-OVA8肿瘤细胞的小鼠中的肿瘤体积。在高剂量组中(图9B)也观察到相应的趋势。从图9B还可 以看出在高剂量的条件下,OVA抗原特异性CD8+NKT样细胞甚至能够完全抑制肿瘤的生长。而此时,SV抗原特异性CD8+NKT样细胞也出现了一定的抗肿瘤作用(p<0.05),结合图9A中SV抗原特异性CD8+NKT样细胞对肿瘤体积和生存时间没有显著性影响,这个结果就高度提示在达到一定的剂量后,本发明的CD8+NKT样细胞可以通过抗原特异性和非抗原特异性两种途径杀伤肿瘤,而且抗原特异性作用在较低剂量下就可以出现。
图10比较了在不同的效靶比条件(分别为1∶1、5∶1和20∶1)下,CD8+NKT样细胞与NK细胞对Yac-1肿瘤细胞的非抗原特异性杀伤作用。图10的结果显示,在不同的效靶比条件下,CD8+NKT样细胞与NK细胞均对Yac-1肿瘤细胞均具有非特异性杀伤作用,且NK细胞的杀伤作用强于CD8+NKT样细胞。
图11比较了OVA抗原特异性CD8+NKT样细胞与OVA抗原特异性的CD8+T细胞对EL4-OVA8肿瘤细胞的杀伤效应。图11的结果显示OVA抗原特异性CD8+NKT样细胞对肿瘤细胞的杀伤作用显著强于OVA抗原特异性的CD8+T细胞。
图12显示了CD8+NKT样细胞、NK细胞和CD8T细胞上各种Granzyme、Perforin和Lamp-1表达的热图。结果显示,在小鼠CD8+NKT样细胞上,与颗粒释放途径相关的蛋白Granzyme、Perforin和Lamp-1(CD107a)表达水平均显著高于NK细胞和CD8+T细胞(除蛋白Gzmm、Gzma以外)。该结果提示本发明的CD8+NKT样细胞对肿瘤细胞的杀伤作用很可能就是通过颗粒酶释放途径实现的。
由此可见,CD8+NKT样细胞兼具NK细胞特有的非抗原特异性识别并杀伤肿瘤细胞能力,以及CTL细胞特有的抗原特异性识别并杀伤肿瘤细胞的能力,而且这两种作用具有一定的剂量依赖性。
因此,本发明的NKT样细胞可以用于治疗肿瘤。在一个实施方案中,所述肿瘤可以选自实体瘤和血液系统肿瘤。实体瘤包括但不限于胃癌、食管癌、小肠癌、大肠癌、结肠癌、直肠癌、肛门癌、肝癌、胆囊癌、乳腺癌、卵巢癌、宫颈癌、子宫癌、胰腺癌、肺癌、咽癌、喉癌、鼻咽癌、胸腺瘤、黑素瘤、睾丸癌、肉瘤、前列腺癌、转移癌、 肾癌、黑色素瘤等。血液系统肿瘤包括但不限于髓系肿瘤、淋巴系肿瘤、组织细胞肿瘤和肥大细胞肿瘤,其中所述髓系肿瘤包括但不限于骨髓增殖性疾病(MPD)、骨髓增生异常综合征(MDS)、骨髓增生异常/骨髓增殖性疾病(MD/MPD)和急性髓系白血病(AML);所述淋巴系肿瘤包括但不限于T/NK细胞肿瘤、B细胞肿瘤和霍奇金病。
利用本发明的NKT样细胞治疗肿瘤的方法
本发明还提供了一种治疗受试者中的肿瘤的方法(在本文中有时称为“本发明的治疗方法”)。该方法的一个具体实施方案可以包括以下步骤:
1)采集受试者的外周血;
2)从所述受试者的外周血中分离单个核细胞,然后富集本发明的NKT样细胞并在体外培养使其数量达到1×109~1×1012个细胞;以及
3)收获步骤2)中获得的经扩增的本发明的NKT样细胞并过继回输给所述受试者。
如上所述,在本发明的治疗方法中,在步骤2)中采用的是先富集(例如采用细胞分选的方法)后扩增的方式,但是也可以先扩增后富集的方式,在本发明中不受特别的限制。由于本发明的NKT样细胞在外周血中的含量很小,因此在一个优选的实施方案中,也可以将单核细胞先扩增到一定量后再富集,然后再将富集的本发明的NKT样细胞过继回输,或任选地根据需要的细胞数量进一步扩增到所需数量后再回输。
在本发明的治疗方法中,对于人体临床应用,过继回输的细胞量可以在1×109~1×1012个细胞,优选1~10×1010个细胞。如果用于小鼠,则回输的细胞量可以在1~100×106个细胞。如果回输的细胞量过大(例如,超过1×108个细胞),则可能产生免疫过度,诱发自身免疫性疾病。而如果回输的细胞量过小(例如,小于1×106个细胞),则达不到预期治疗效果。
在一个优选的实施方案中,在步骤2)中收获细胞后,为减少所述受试者的采血次数并减少医源性感染机会,如上所述,可以将所述细胞制成本发明的治疗用组合物并保存备用。在此情况下,步骤3)中将 本发明的治疗用组合物回输给所述受试者。
在本发明中,术语“治疗”是指向需要其的受试者施用本发明的NKT样细胞或本发明的治疗用组合物以获得选自下列各项中的任一个或多个有益效果:减小肿瘤大小、预防复发或转移、改善受试者生活质量、缓解或减轻一种或多种与肿瘤相关的症状或并发症,或尽管没有减小肿瘤尺寸但延长受试者生存时间等。
在一个优选的实施方案中,回输方式包括但不限于静脉输注、腹腔灌注和瘤体内直接注射。
在另一个优选的实施方案中,过继回输本发明的NKT样细胞的频次可以为每月2次,每次回输细胞量可以为1~10×1010个细胞。
在一个实施方案中,所述肿瘤可以选自实体瘤和血液系统肿瘤。实体瘤包括但不限于胃癌、食管癌、小肠癌、大肠癌、结肠癌、直肠癌、肛门癌、肝癌、胆囊癌、乳腺癌、卵巢癌、宫颈癌、子宫癌、胰腺癌、肺癌、咽癌、喉癌、鼻咽癌、胸腺瘤、黑素瘤、睾丸癌、肉瘤、前列腺癌、转移癌、肾癌、黑色素瘤等。血液系统肿瘤包括但不限于髓系肿瘤、淋巴系肿瘤、组织细胞肿瘤和肥大细胞肿瘤,其中所述髓系肿瘤包括但不限于骨髓增殖性疾病(MPD)、骨髓增生异常综合征(MDS)、骨髓增生异常/骨髓增殖性疾病(MD/MPD)和急性髓系白血病(AML);所述淋巴系肿瘤包括但不限于T/NK细胞肿瘤、B细胞肿瘤和霍奇金病。
在优选的实施方案中,所述受试者可以是哺乳动物,优选地选自牛、马、犬、山羊、绵羊、猪、骆驼、大鼠、小鼠、猴和人,更优选是人。所述受试者还可以是宠物动物。
在本发明中,利用本发明的NKT样细胞治疗肿瘤的方法(在本文中有时称为“本发明的治疗方法”)实质上是一种免疫细胞疗法,其可以与其他常规的肿瘤治疗方法(包括但不限于,手术、化疗、放疗、靶向治疗、中医等)联合使用。在此,在本申请的申请日之前的现有技术中存在的用于治疗肿瘤的所有手术方式、化疗方案和化疗药物、放疗手段和治疗方案、靶向治疗及靶向药物、中医治疗方案和中药等均可用于本发明中而没有任何限制,它们的具体组合由临床医生根据患者 的具体病情来综合判断和决定。
优选地,本发明的治疗方法与常规的肿瘤治疗方法联合使用。更优选地,本发明的治疗方法在采用常规肿瘤治疗方法减小瘤负荷后实施。在一个典型的治疗方案中,在手术切除原发病灶后,经术后化疗后,实施本发明的治疗方法。在另一个典型的治疗方案中,在实施放疗后,实施本发明的治疗方法。在一个典型的治疗方法中,在放疗和化疗后,实施本发明的治疗方法。临床医生可以根据患者的具体情况,例如,肿瘤大小、分期、部位、性质、病理类型和诊断、患者一般状况、既往治疗情况等因素综合地考虑治疗肿瘤的联合治疗方案以及应用本发明的治疗方法的时机。
利用本发明的NKT样细胞治疗肿瘤的安全性评价
下面的表2、表3、表4显示了对采用本发明的NKT样细胞治疗肿瘤的安全性评价。通过体内致瘤性试验、异常毒性试验和急性毒性试验,均未发现受体小鼠有异常表现。
表2显示了CD8+NKT样细胞的体内致瘤性检测结果。
表2CD8+NKT样细胞的体内致瘤性检测
表3显示了CD8+NKT样细胞的异常毒性试验结果。
表3CD8+NKT样细胞的异常毒性试验
表4显示了CD8+NKT样细胞的急性毒性试验结果。
表4CD8+NKT样细胞的急性毒性试验
注:该注射剂量为正常人细胞回输剂量的20倍
由此可见,将CD8+NKT样细胞回输给受试者是安全的。
本发明的优选实施方案包括:
1.一种分离的NKT样细胞亚群,其包含表面表达CD8分子的NKT样细胞。
2.根据实施方案1所述的NKT样细胞亚群,其特征在于所述NKT样细胞亚群包含50%以上,优选60%以上,更优选70%以上,最优选80%以上的表面表达CD8分子的NKT样细胞。
3.根据实施方案2所述的NKT样细胞亚群,其特征在于所述NKT样细胞亚群包含100%的表面表达CD8分子的NKT样细胞。
4.根据实施方案1-3中任一项所述的NKT样细胞亚群,其特征在于所述表面表达CD8分子的NKT样细胞的细胞表面上表达CD3和CD56,但不表达Vα24TCR。
5.根据实施方案1-3中任一项所述的NKT样细胞亚群,其特征在于所述表面表达CD8分子的NKT样细胞的细胞表面上表达CD3和 CD161c,但不表达Vα14TCR。
6.根据实施方案4或5所述的NKT样细胞亚群,其特征在于所述表面表达CD8分子的NKT样细胞的细胞表面上还表达TCRαβ。
7.根据实施方案1-6中任一项所述的NKT样细胞亚群,其特征在于所述NKT样细胞亚群分离自哺乳动物。
8.根据实施方案7所述的NKT样细胞亚群,其特征在于所述哺乳动物选自牛科动物、马科动物、猫科动物、犬科动物、兔科动物、猪科动物、骆驼科动物、啮齿类动物和灵长类动物,优选牛、马、犬、山羊、绵羊、猫、兔、猪、骆驼、羊驼、大鼠、小鼠、豚鼠、非人灵长类动物和人,更优选牛、马、犬、山羊、绵羊、猪、骆驼、大鼠、小鼠、猴和人。
9.根据实施方案7所述的NKT样细胞亚群,其特征在于所述哺乳动物是宠物动物,优选宠物狗、宠物猫、啮齿动物宠物、宠物兔。
10.根据实施方案1-9中任一项所述的NKT样细胞亚群在制备用于治疗肿瘤的药物中的用途。
11.一种治疗用组合物,其包含实施方案1-9中任一项所述的NKT样细胞亚群作为主要活性成分。
12.根据实施方案11所述的治疗用组合物,其还包含药学上可接受的载体、稀释剂、赋形剂和/或添加剂。
13.根据实施方案11或12所述的治疗用组合物在制备用于治疗肿瘤的药物中的用途。
14.根据实施方案10或13所述的用途,其特征在于所述肿瘤是实体瘤或血液系统肿瘤。
15.根据实施方案14所述的用途,其特征在于所述实体瘤选自胃癌、食管癌、小肠癌、大肠癌、结肠癌、直肠癌、肛门癌、肝癌、胆囊癌、乳腺癌、卵巢癌、宫颈癌、子宫癌、胰腺癌、肺癌、咽癌、喉癌、鼻咽癌、胸腺瘤、黑素瘤、睾丸癌、肉瘤、前列腺癌、转移癌、肾癌、黑色素瘤。
16.根据实施方案14所述的用途,其特征在于所述血液系统肿瘤选自髓系肿瘤、淋巴系肿瘤、组织细胞肿瘤和肥大细胞肿瘤。
17.根据实施方案16所述的用途,其特征在于所述髓系肿瘤选自骨髓 增殖性疾病(MPD)、骨髓增生异常综合征(MDS)、骨髓增生异常/骨髓增殖性疾病(MD/MPD)和急性髓系白血病(AML)。
18.根据实施方案16所述的用途,其特征在于所述淋巴系肿瘤选自T/NK细胞肿瘤、B细胞肿瘤和霍奇金病。
19.实施方案1-9中任一项所述的NKT样细胞亚群的制备方法,该方法包括以下步骤:
1)采集受试者的外周血并分离去除红细胞;
2)从步骤1)中获得的已去除红细胞的外周血中分离单个核细胞,采用细胞分选技术利用根据实施方案1-9中任一项所述的表面表达CD8分子的NKT样细胞的表面标志物从所述单个核细胞中分选出实施方案1-9中任一项所述的所述NKT样细胞亚群;
3)将步骤2)中得到的所述NKT样细胞亚群在体外培养,并向培养物中添加能够刺激T细胞增殖和活化的细胞因子,培养足以使其数量扩增至少10~1000倍的时间;以及
4)收获步骤3)中得到的所述NKT样细胞亚群。
20.根据实施方案19所述的方法,其特征在于在步骤3)中,所述NKT样细胞亚群在体外培养7~30天,优选10~27天,更优选14~21天。
21.根据实施方案19所述的方法,其特征在于在步骤3)中所述NKT样细胞亚群被扩增至1×109~1×1012个细胞,优选1~10×1010个细胞。
22.实施方案1-9中任一项所述的NKT样细胞亚群的制备方法,该方法包括以下步骤:
1)采集受试者的外周血并分离去除红细胞;
2)从步骤1)中获得的已去除红细胞的外周血中分离单个核细胞并在体外培养,向培养物中添加能够刺激T细胞增殖和活化的细胞因子,培养足以使其数量扩增至少10~1000倍的时间;
3)采用细胞分选技术利用实施方案1-9中任一项所述的表面表达CD8分子的NKT样细胞的表面标志物从步骤2)中获得的经扩增培养的细胞中分选出实施方案1-9中任一项所述的所述NKT样细胞亚群;以及
4)收获步骤3)中得到的所述NKT样细胞亚群。
23.根据实施方案22所述的方法,其特征在于在步骤2)中,将所述单 个核细胞在体外培养7~30天,优选10~27天,更优选14~21天。
24.根据实施方案22所述的方法,其特征在于在步骤2)中所述单个核细胞被扩增至1×109~1×1012个细胞,优选1~10×1010个细胞。
25.根据实施方案19-24中任一项所述的方法,其特征在于所述表面标志物包括CD3、CD56和Vα24TCR。
26.根据实施方案19-24中任一项所述的方法,其特征在于所述表面标志物包括CD3、CD161c和Vα14TCR。
27.根据实施方案25或26所述的方法,其特征在于所述表面标志物还包括TCRαβ。
28.根据实施方案19-27中任一项所述的方法,其特征在于所述细胞因子选自GM-CSF、IL-2、IL-4、IL-5、IL-6、IL-7、IL-9、IL-12、IL-15和4-1BBL中的任一种或其任意组合。
29.一种治疗需要治疗的受试者中的肿瘤的方法,该方法可以包括以下步骤:
1)采集所述受试者的外周血;
2)从所述受试者的外周血中分离单个核细胞,富集根据实施方案1-9中任一项所述的NKT样细胞亚群并在体外扩增;以及
3)收获步骤2)中获得的经扩增的NKT样细胞亚群,并过继回输给所述受试者。
30.根据实施方案29所述的方法,其特征在于所述受试者是哺乳动物。
31.根据实施方案30中所述的方法,其特征在于所述哺乳动物选自牛科动物、马科动物、猫科动物、犬科动物、兔科动物、猪科动物、骆驼科动物、啮齿类动物和灵长类动物,优选牛、马、犬、山羊、绵羊、猫、兔、猪、骆驼、羊驼、大鼠、小鼠、豚鼠、非人灵长类动物和人,更优选牛、马、犬、山羊、绵羊、猪、骆驼、大鼠、小鼠、猴和人。
32.根据实施方案30所述的方法,其特征在于所述哺乳动物是宠物动物,优选宠物狗、宠物猫、啮齿动物宠物和宠物兔。
33.根据实施方案29-32中任一项所述的方法,其特征在于所述肿瘤是实体瘤或血液系统肿瘤。
34.根据实施方案33所述的方法,其特征在于所述实体瘤选自胃癌、 食管癌、小肠癌、大肠癌、结肠癌、直肠癌、肛门癌、肝癌、胆囊癌、乳腺癌、卵巢癌、宫颈癌、子宫癌、胰腺癌、肺癌、咽癌、喉癌、鼻咽癌、胸腺瘤、黑素瘤、睾丸癌、肉瘤、前列腺癌、转移癌、肾癌、黑色素瘤。
35.根据实施方案33所述的方法,其特征在于所述血液系统肿瘤选自髓系肿瘤、淋巴系肿瘤、组织细胞肿瘤和肥大细胞肿瘤。
36.根据实施方案35所述的方法,其特征在于所述髓系肿瘤选自骨髓增殖性疾病(MPD)、骨髓增生异常综合征(MDS)、骨髓增生异常/骨髓增殖性疾病(MD/MPD)和急性髓系白血病(AML)。
37.根据实施方案35所述的方法,其特征在于所述淋巴系肿瘤选自T/NK细胞肿瘤、B细胞肿瘤和霍奇金病。
38.根据实施方案29-37中任一项所述的方法,其特征在于在步骤3)中将所述NKT样细胞亚群经静脉回输。
39.根据实施方案29-37中任一项所述的方法,其特征在于在步骤3)中将所述NKT样细胞亚群进行瘤体注射。
40.根据实施方案29-37中任一项所述的方法,其特征在于在步骤3)中将所述NKT样细胞亚群进行腹腔灌注。
41.根据实施方案29-40中任一项所述的方法,其特征在于在步骤2)中所述NKT样细胞亚群被扩增至1×109~1×1012个细胞,优选1~10×1010个细胞。
42.一种治疗受试者中的肿瘤的方法,该方法包括以下步骤:
1)采集所述受试者的外周血;
2)从所述受试者的外周血中分离单个核细胞并在体外扩增;
3)从步骤2)中扩增的细胞中富集根据实施方案1-9中任一项所述的NKT样细胞亚群;以及
4)收获步骤3)中获得的经扩增的NKT样细胞亚群,并过继回输给所述受试者。
43.根据实施方案42所述的方法,其特征在于所述受试者是哺乳动物。
44.根据实施方案43中所述的方法,其特征在于所述哺乳动物选自牛科动物、马科动物、猫科动物、犬科动物、兔科动物、猪科动物、骆驼科动物、啮齿类动物和灵长类动物,优选牛、马、犬、山羊、 绵羊、猫、兔、猪、骆驼、羊驼、大鼠、小鼠、豚鼠、非人灵长类动物和人,更优选牛、马、犬、山羊、绵羊、猪、骆驼、大鼠、小鼠、猴和人。
45.根据实施方案43所述的方法,其特征在于所述哺乳动物是宠物动物,优选宠物狗、宠物猫、啮齿动物宠物和宠物兔。
46.根据实施方案42-45中任一项所述的方法,其特征在于所述肿瘤是实体瘤或血液系统肿瘤。
47.根据实施方案46所述的方法,其特征在于所述实体瘤选自胃癌、食管癌、小肠癌、大肠癌、结肠癌、直肠癌、肛门癌、肝癌、胆囊癌、乳腺癌、卵巢癌、宫颈癌、子宫癌、胰腺癌、肺癌、咽癌、喉癌、鼻咽癌、胸腺瘤、黑素瘤、睾丸癌、肉瘤、前列腺癌、转移癌、肾癌、黑色素瘤。
48.根据实施方案46所述的方法,其特征在于所述血液系统肿瘤选自髓系肿瘤、淋巴系肿瘤、组织细胞肿瘤和肥大细胞肿瘤。
49.根据实施方案48所述的方法,其特征在于所述髓系肿瘤选自骨髓增殖性疾病(MPD)、骨髓增生异常综合征(MDS)、骨髓增生异常/骨髓增殖性疾病(MD/MPD)和急性髓系白血病(AML)。
50.根据实施方案48所述的方法,其特征在于所述淋巴系肿瘤选自T/NK细胞肿瘤、B细胞肿瘤和霍奇金病。
51.根据实施方案42-47中任一项所述的方法,其特征在于在步骤3)中将所述NKT样细胞亚群经静脉回输。
52.根据实施方案42-47中任一项所述的方法,其特征在于在步骤3)中将所述NKT样细胞亚群进行瘤体注射。
53.根据实施方案42-47中任一项所述的方法,其特征在于在步骤3)中将所述NKT样细胞亚群进行腹腔灌注。
54.根据实施方案42-53中任一项所述的方法,其特征在于在步骤2)中所述NKT样细胞亚群被扩增至1×109~1×1012个细胞,优选1~10×1010个细胞。
以下实施例进一步描述本发明,但所述实施例仅用于说明本发明,但而不是要限制本发明的范围。当阅读说明书并参考公知常识时,其 它实施方案对本领域技术人员来说将是显而易见的。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为自常规试剂公司购买得到。
实施例
实施例1:小鼠CD8+NKT样细胞表型检测
(1)分离小鼠脾脏细胞,用密度为1.083的Ficoll液进行密度梯度离心,分离其中的单个核细胞。
(2)按照stemcell公司panNK阳性分选试剂盒的要求,分选小鼠脾脏细胞中的panNK阳性细胞。具体操作步骤如下:
①将脾脏单个核细胞用PBS缓冲液重悬于108/mL;
②按照50μL/mL细胞悬液的用量添加CD49b-PE(CD49b是panNK的标志),室温避光孵育15分钟;
③按照100μL/mL细胞悬液的用量添加cocktail液,室温避光孵育15分钟;
④按照50μL/mL细胞悬液的用量添加磁珠,室温避光孵育10分钟;
⑤向细胞悬液中添加PBS至2.5mL,转移入5mL BD Falcon流式细胞仪上样管中,放入stemcell阳性分选磁铁内静置5分钟;
⑥拿起磁铁,倾倒掉阴性细胞;
⑦2.5mL PBS重悬细胞,放入stemcell阳性分选磁铁内静置5分钟;
⑧拿起磁铁,倾倒掉阴性细胞;
⑨从磁铁中取出BD Falcon流式细胞仪上样管,500μL PBS重悬阳性细胞。
(3)200μL PBS重悬阳性细胞,标记10μL APC标记的α-GalCer-loaded CD1d tetramer(Proimmune公司),4℃孵育30分钟。
(4)1mL PBS洗涤一遍,500μL PBS重悬细胞,50μL/管分装样本后标记(以下荧光抗体非特殊说明,均购自BioLegend公司):
管①标记TCRβ-FITC,CD8-PerCP,CD3-APC-Cy7,NK1.1-PE-Cy7;
管②标记TCRβ-FITC,CD8-APC-Cy7,NKG2D-PE-Cy7,CD44-PerCP;
管③标记TCRβ-APC-Cy7,CD8-PerCP,KLRG1-PE-Cy7,Ly49G2-FITC(eBioscience公司);
管④标记TCRβ-APC-Cy7,CD8-PerCP,CD27-PE-Cy7,NKG2A/C/E-FITC;
管⑤标记TCRβ-APC-Cy7,CD8-PE-Cy7,CD62L-FITC,CD122-PerCP;
管⑥-⑩标记上述抗体相应的同型对照抗体(来自BioLegend公司),不再赘述。
(5)各样本管4℃孵育30分钟。
(6)各样本管加1mL PBS,1500rpm离心10分钟,弃上清。
(7)重复步骤(6),300μL PBS重悬细胞。
(8)BD FACSAria II流式细胞仪上样,对CD8+DX5+TCRβ+CD1d Tetramer-细胞(小鼠CD8+NKT样细胞)进行表型检测。
结果显示,小鼠CD8+NKT样细胞既表达T细胞谱系标志CD3和TCRβ,也表达NK细胞谱系标志NK1.1(CD161c),但不表达iNKT的谱系标志CD1d。另外,从图1中还可以看出,本发明的CD8+NKT样细胞表达T细胞活化标志CD44、CD62L和CD122,以及NK细胞受体NKG2A/C/E、KLRG1、NKG2D、Ly49G2和CD27。
实施例2:小鼠CD8+NKT样细胞与NK细胞、iNKT细胞和CTL细胞的表型差异
(1)分离小鼠脾脏细胞,用密度为1.083的Ficoll液进行密度梯度离心,分离其中的单个核细胞。
(2)按照stemcell公司panNK阳性分选试剂盒的要求,分选小鼠脾脏细胞中的panNK阳性细胞。具体操作步骤如下:
①将脾脏单个核细胞用PBS缓冲液重悬于108/mL;
②按照50μL/mL细胞悬液的用量添加CD49b-PE(CD49b是panNK的标志),室温避光孵育15分钟;
③按照100μL/mL细胞悬液的用量添加cocktail液,室温避光孵育15分钟;
④按照50μL/mL细胞悬液的用量添加磁珠,室温避光孵育10分钟;
⑤向细胞悬液中添加PBS至2.5mL,转移入5mL BD Falcon流式细胞仪上样管中,放入stemcell阳性分选磁铁内静置5分钟;
⑥拿起磁铁,倾倒掉阴性细胞;
⑦2.5mL PBS重悬细胞,放入stemcell阳性分选磁铁内静置5分钟;
⑧拿起磁铁,倾倒掉阴性细胞;
⑨从磁铁中取出BD Falcon流式细胞仪上样管,500μL PBS重悬阳性细胞。
(3)200μL PBS重悬阳性细胞,标记10μL APC标记的α-GalCer-loaded CD1d tetramer(Proimmune公司),4℃孵育30分钟。
(4)1mL PBS洗涤一遍,500μL PBS重悬细胞,50μL/管分装样本后标记(均购自BioLegend公司):
管①标记TCRβ-FITC,CD8-PerCP,CD3-APC-Cy7,NK1.1-PE-Cy7
管②标记TCRβ-FITC,CD8-APC-Cy7,NKG2D-PE-Cy7
管③标记TCRβ-APC-Cy7,CD8-PerCP,KLRG1-PE-Cy7,Ly6G-FITC
管④标记TCRβ-APC-Cy7,CD8-PerCP,CD27-PE-Cy7,NKG2A/C/E-FITC
管⑤-⑧标记上述抗体相应的同型对照抗体(来自BioLegend公司),不再赘述。
(5)各样本管4℃孵育30分钟。
(6)各样本管加1mL PBS,1500rpm离心10分钟,弃上清。
(7)重复步骤(6),300μL PBS重悬细胞。
(8)BD FACSAria II流式细胞仪上样,设门关注CD8+DX5+TCRβ+CD1d Tetramer-细胞(小鼠CD8+NKT样细胞)、CD8-DX5+TCRβ+CD1d Tetramer+细胞(小鼠iNKT细胞)、CD8+DX5-TCRβ+CD1d Tetramer-细胞(小鼠CD8+T细胞)、DX5+TCRβ-细胞(小鼠NK细胞),并分析其表型。
结果显示,本发明的小鼠CD8+NKT样细胞与NK细胞、iNKT细胞和CTL细胞的表型差异。从图2中可以看出:(1)与NK细胞相比,CD8+NKT样细胞表达NK细胞标志NK1.1(CD161c)、NKG2A/C/E、 CD27、KLRG1和Ly6G,但比NK细胞多表达TCRβ和CD3;(2)与CTL细胞相比,CD8+NKT样细胞表达T细胞谱系标志TCRβ和CD3,但不表达NK细胞受体;(3)与iNKT细胞相比,CD8+NKT样细胞不能结合负载脂类抗原的CD1d四聚体。
实施例3:CD8+NKT样细胞、NK细胞和CD8T细胞的透射电镜照片和激光共聚焦显微镜照片
(1)分离小鼠脾脏细胞,用密度为1.083的Ficoll液进行密度梯度离心,分离其中的单个核细胞。
(2)按照stemcell公司panNK阳性分选试剂盒的要求,分选小鼠脾脏细胞中的panNK阳性细胞。具体操作步骤如下:
①将脾脏单个核细胞用PBS缓冲液重悬于108/mL;
②按照50μL/mL细胞悬液的用量添加CD49b-PE(CD49b是panNK的标志),室温避光孵育15分钟;
③按照100μL/mL细胞悬液的用量添加cocktail液,室温避光孵育15分钟;
④按照50μL/mL细胞悬液的用量添加磁珠,并加入20μL/mL TCRβ-FITC和CD8-APC-Cy7,室温避光孵育10分钟;
⑤向细胞悬液中添加PBS至2.5mL,转移入5mL BD Falcon流式细胞仪上样管中,放入stemcell阳性分选磁铁内静置5分钟;
⑥拿起磁铁,将阴性细胞倾倒入新的离心管中;
⑦2.5mL PBS重悬细胞,放入stemcell阳性分选磁铁内静置5分钟;
⑧拿起磁铁,倾倒掉阴性细胞;
⑨从磁铁中取出BD Falcon流式细胞仪上样管。
(3)200μL PBS重悬阳性细胞,标记10μL APC标记的α-GalCer-loaded CD1d tetramer(Proimmune公司),4℃孵育30分钟。
(4)1mL PBS洗涤一遍,500μL PBS重悬细胞,BD FACSAria II流式细胞仪上样,设门分选CD8+DX5+TCRβ+细胞(小鼠CD8+NKT样细胞)和DX5+TCRβ-细胞(小鼠NK细胞);阴性细胞上样分选CD8+DX5-TCRβ+细胞(小鼠CD8+T细胞)。
(5)CD8+NKT样细胞、CD8+T细胞和NK细胞分别以2×106/mL密度铺板于96孔板,添加含有IL-2 50ng/mL,IL-4 10ng/mL,IL-5 10ng/mL,IL-6 100ng/mL,IL-7 80ng/mL,IL-9 1ng/mL,IL-12 100ng/mL,IL-15 20ng/mL,GM-CSF 10ng/mL、4-1BBL20ng/mL的1640完全培养基,体外培养5天后收集细胞送样进行透射电镜和激光共聚焦显微镜扫描。
(6)激光共聚焦显微镜观察CD8+NKT样细胞、CD8+T细胞和NK细胞的形态包括以下步骤:
①调节3种细胞在PBS缓冲液中的密度均为1×106/ml;
②按照1∶100的体积比加入CD90.2-FITC抗体,并加入终浓度为1μmol/L的LysoTracker染料。4℃孵育30分钟;
③PBS缓冲液充分洗涤2遍,加入终浓度为10μg/ml的Hoechst 33342染料。室温孵育10分钟后即可观察。
图3A的透射电镜照片显示,CD8+NKT样细胞中含有大量的颗粒样物质,而NK和CD8+T细胞中类似的颗粒样物质较少。从图3B的激光共聚焦显微照片中发现本发明的CD8+NKT样细胞体积较大,其直径为约15μm以上,而NK细胞和CD8+T细胞的直径小于10μm,大约在7μm左右。同时,CD8+NKT样细胞中的颗粒样物质为溶酶体染料染色阳性,提示这些颗粒样物质可能含有发挥细胞毒效应的颗粒酶,而NK细胞和CD8+T细胞中这些溶酶体染料染色阳性的颗粒则很少。另外,通过对细胞核和细胞膜的染色还发现,CD8+NKT样细胞的核质比与其他两种细胞相比较小。
实施例4:小鼠CD8+NKT样细胞、CD8+T细胞和CD4+T细胞的细胞因子分泌能力比较
1.OT-I小鼠CD8+NKT样细胞和CD8+T细胞的分离
(1)分离OT-I小鼠脾脏细胞,用密度为1.083的Ficoll液进行密度梯度离心,分离其中的单个核细胞。
(2)按照stemcell公司panNK阳性分选试剂盒的要求,分选OT-I小鼠脾脏细胞中的panNK阳性细胞。具体操作步骤如下:
①将脾脏单个核细胞用PBS缓冲液重悬于108/mL;
②按照50μL/mL细胞悬液的用量添加CD49b-PE(CD49b是panNK的标志),室温避光孵育15分钟;
③按照100μL/mL细胞悬液的用量添加cocktail液,室温避光孵育15分钟;
④按照50μL/mL细胞悬液的用量添加磁珠,并加入20μL/mL TCRβ-FITC和CD8-APC-Cy7,室温避光孵育10分钟;
⑤向细胞悬液中添加PBS至2.5mL,转移入5mL BD Falcon流式细胞仪上样管中,放入stemcell阳性分选磁铁内静置5分钟;
⑥拿起磁铁,将阴性细胞倾倒入新的离心管中;
⑦2.5mL PBS重悬细胞,放入stemcell阳性分选磁铁内静置5分钟;
⑧拿起磁铁,倾倒掉阴性细胞;
⑨从磁铁中取出BD Falcon流式细胞仪上样管,500μL PBS重悬阳性细胞;
(3)200μL PBS重悬阳性细胞,标记10μL APC标记的α-GalCer-loaded CD1d tetramer(Proimmune公司),4℃孵育30分钟;
(4)1mL PBS洗涤一遍,500μL PBS重悬阳性细胞,BD FACSAria II流式细胞仪上样,设门分选CD8+DX5+TCRβ+细胞(小鼠CD8+NKT样细胞);阴性细胞上样分选CD8+DX5-TCRβ+细胞(小鼠CD8+T细胞)。
2.OT-II小鼠CD4+T细胞的分离:
(1)分离OT-II小鼠脾脏细胞,用密度为1.083的Ficoll液进行密度梯度离心,分离其中的单个核细胞。
(2)按照Miltenyi公司CD4阳性分选试剂盒的要求,分选OT-II小鼠脾脏细胞中的CD4+T细胞。具体操作步骤如下:
①将脾脏单个核细胞用PBS缓冲液重悬于108/mL;
②按照100μL/mL细胞悬液的用量添加抗小鼠CD4磁珠抗体,4℃避光孵育15分钟;
③2mL PBS重悬标记后的细胞,加入到Miltenyi磁性分离柱上;
④液体滴尽后再加入2mLPBS;再重复一遍;
⑤将分选柱与磁铁解离,冲洗出阳性细胞,纯度在90%以上。
3.淋巴细胞群体的抗原特异性活化和胞内细胞因子检测:
(1)用含10%胎牛血清的1640培养基重悬,按照8×104/孔的密度接种于96孔圆底培养板,每孔加入1×104/孔负载抗原的树突状细胞(对于OT-I小鼠来源的CD8+NKT样细胞和CD8+T细胞,添加OVA257-264肽段终浓度为1μg/mL;对于OT-II小鼠来源的CD4+T细胞,添加OVA323-339肽段终浓度为1μg/mL)刺激。每孔培养基总体积为100μL。
(2)培养24小时、48小时,分别收取培养上清,应用eBioscience公司Th细胞因子检测试剂盒(BMS822FF mouse Th1/Th2/Th17/Th22 13plex)检测细胞因子浓度。具体操作完全按照说明书进行,不再赘述。
从图4中可以看出在特异性抗原刺激后24h和48h,CD8+NKT样细胞分泌的IFN-γ水平显著高于CD8+T细胞和CD4+T细胞;其分泌的IL-2水平低于CD8+T细胞,但与CD4+T细胞相当。从细胞因子表达谱来说,相对于CD4+T细胞,在CD8+T细胞中IFN-γ和IL-2两者均为高水平表达,而在本发明的CD8+NKT样细胞中仅IFN-γ高表达。
实施例5:人CD8+NKT样细胞的体外扩增方法的一个实例的流程图
(1)取人静脉血于含有肝素抗凝剂的真空管中,用密度1.077的Ficoll淋巴细胞分离液(Sigma公司),通过密度梯度离心的方法分离血液中的单个核细胞(PBMC)。
(2)PBS缓冲液重悬PBMC,密度为2×106/mL,按照1∶100的比例加入PerCP标记的的人CD3抗体,PE标记的抗人CD56抗体,APC标记的抗人CD8抗体,PE-Cy7标记的抗人CD4抗体,FITC标记的抗人iNKT Vα24TCR抗体,4℃孵育30分钟。
(3)20mL PBS重悬,1500rpm离心10分钟。
(4)重复步骤(3)。
(5)按照图5第二步的设门策略分选CD3+CD56+Vα24TCR-CD8+CD4-细胞亚群。
(6)以2×106/mL密度培养。培养体系为含有IL-2 50ng/mL(购自Peprotech公司,下同),IL-4 10ng/mL,IL-5 10ng/mL,IL-6 100ng/mL,IL-7 80ng/mL,IL-9 1ng/mL,IL-12 100ng/mL,IL-15 20ng/mL,GM-CSF10ng/mL、4-1BBL 20ng/mL的无血清培养基Takara GT-T551(宝日医 公司)。
(7)培养21天即可收集使用。
实施例6:CD8+NKT样细胞的体外扩增能力展示
1.小鼠CD8+NKT样细胞的体外扩增能力展示:
(1)按照实施例4描述的OT-I小鼠CD8+NKT样细胞的分离方法分选OT-I小鼠CD8+NKT样细胞。
(2)在含有IL-2 50ng/mL(购自Peprotech公司,下同),IL-4 10ng/mL,IL-5 10ng/mL,IL-6 100ng/mL,IL-7 80ng/mL,IL-9 1ng/mL,IL-12 100ng/mL,IL-15 20ng/mL,GM-CSF 10ng/mL、4-1BBL 20ng/mL和10%胎牛血清(Gibco公司)的1640培养基(Gibco公司)中,以2×106/mL密度培养;培养体系中同时添加1×104/孔负载1μg/mLOVA257-264抗原(Chinese Peptide Company合成)的树突状细胞。
(3)培养后每7天收集细胞,用血球计数板计数细胞数量,绘制细胞生长曲线。
2.人CD8+NKT样细胞的体外扩增能力展示:
(1)按照实施例5描述的人CD8+NKT样细胞的分离方法分离CD8+NKT样细胞。
(2)以2×106/mL密度培养。培养体系为含有IL-2 50ng/mL(购自Peprotech公司,下同),IL-4 10ng/mL,IL-5 10ng/mL,IL-6 100ng/mL,IL-7 80ng/mL,IL-9 1ng/mL,IL-12 100ng/mL,IL-15 20ng/mL,GM-CSF10ng/mL、4-1BBL 20ng/mL的无血清培养基Takara GT-T551(宝日医公司)。
(3)培养后每7天收集细胞,用血球计数板计数细胞数量,绘制细胞生长曲线。
实施例7:过继回输CD8+NKT样细胞以及PBS对尾静脉接种B16黑色素瘤细胞的小鼠中黑色素瘤肺转移的影响
(1)按照实施例6描述的方法分离并体外扩增小鼠CD8+NKT样细胞。
(2)取C57BL/6雌性小鼠,尾静脉荷瘤B16-F10黑色素瘤细胞2×105。
(3)荷瘤后24小时,腹腔注射标定剂量的CD8+NKT样细胞(5×106)或PBS。
(4)荷瘤后14天时处死小鼠,分离肺组织,计数各组肉眼可见的黑色素瘤转移灶,并拍照记录。
实施例8:具有不同抗原特异性的小鼠CD8+NKT样细胞对EL4-OVA8肿瘤细胞的体外抗原特异性杀伤作用
(1)按照实施例4描述的方法体外扩增OT-I特异性TCR转基因小鼠和SV特异性TCR转基因小鼠CD8+NKT样细胞(分别记为NKTOVA和NKTSV)。
(2)含有10%胎牛血清的1640培养EL4-OVA8肿瘤细胞。
(3)收集EL4-OVA8细胞,以1×106/mL重悬于PBS中,按照1μM终浓度加入活细胞荧光染料CMFDA(Life Technologies公司),4℃孵育10分钟。
(4)含10%胎牛血清的PBS缓冲液洗涤肿瘤细胞,重新计数后以1×104/孔接种于96孔板。
(5)收集两种CD8+NKT样细胞,以20∶1的效靶比加入预先接种靶细胞的培养孔内,设置6个复孔。
(6)效应细胞和靶细胞共培养24小时后,收集剩余各组细胞,标记7-AAD,4℃孵育10分钟后,流式细胞仪检测荧光染料标记的靶细胞中7-AAD阳性细胞比例,即为效应细胞对靶细胞的杀伤率。
实施例9:过继回输具有不同抗原特异性的CD8+NKT样细胞对接种EL4-OVA8肿瘤细胞的小鼠体内肿瘤大小和生存时间曲线的影响
(1)按照实施例4描述的方法体外扩增OT-I特异性TCR转基因小鼠和SV特异性TCR转基因小鼠CD8+NKT样细胞(分别记为NKTOVA和NKTSV)。
(2)含有10%胎牛血清的1640培养EL4-OVA8肿瘤细胞。
(3)取C57BL/6雌性小鼠,皮下荷瘤5×106EL4-OVA8肿瘤细胞。
(4)荷瘤后24小时,腹腔注射不同剂量的NKTOVA和NKTSV细胞(分别为5×105和2.5×106)或PBS。
(5)荷瘤后不同时间点测量皮下荷瘤大小(以长(mm)×宽(mm)表示,图9A、9B)。
实施例10:小鼠CD8+NKT样细胞与NK细胞对Yac-1肿瘤细胞的非抗原特异性杀伤作用比较
(1)按照实施例3描述的方法体外分离并活化C57BL/6小鼠CD8+NKT样细胞(简记为NKT)和NK细胞(简记为NK)。
(2)含有10%胎牛血清的1640培养Yac-1肿瘤细胞。
(3)收集Yac-1细胞,以1×106/mL重悬于PBS中,按照1μM终浓度加入活细胞荧光染料CMFDA(Life Technologies公司),4℃孵育10分钟。
(4)含10%胎牛血清的PBS缓冲液洗涤肿瘤细胞,重新计数后以1×104/孔接种于96孔板。
(5)收集CD8+NKT样细胞和NK细胞,以1∶1、5∶1和20∶1的效靶比加入预先接种靶细胞的培养孔内,设置6个复孔。
(6)效应细胞和靶细胞共培养24小时后,收集剩余各组细胞,标记7-AAD,4℃孵育10分钟后,流式细胞仪检测荧光染料标记的靶细胞中7-AAD阳性细胞比例,即为效应细胞对靶细胞的杀伤率。
实施例11:OVA抗原特异性的CD8+NKT样细胞与OVA抗原特异性的CD8+T细胞对EL4-OVA8肿瘤细胞的杀伤效应比较
(1)按照实施例4描述的方法体外分离并活化OT-I特异性TCR转基因小鼠CD8+NKT样细胞(简记为NKTOVA)和CD8+T细胞(简记为CTLOVA)。
(2)含有10%胎牛血清的1640培养EL4-OVA8肿瘤细胞。
(3)收集EL4-OVA8细胞,以1×106/mL重悬于PBS中,按照1μM终浓度加入活细胞荧光染料CMFDA(Life Technologies公司),4℃孵育10分钟。
(4)含10%胎牛血清的PBS缓冲液洗涤肿瘤细胞,重新计数后以1×104/孔接种于96孔板。
(5)收集CD8+NKT样细胞和CD8+T细胞,以20∶1的效靶比加入预 先接种靶细胞的培养孔内,设置6个复孔。
(6)效应细胞和靶细胞共培养24小时后,收集剩余各组细胞,标记7-AAD,4℃孵育10分钟后,流式细胞仪检测荧光染料标记的靶细胞中7-AAD阳性细胞比例,即为效应细胞对靶细胞的杀伤率。
实施例12:小鼠CD8+NKT样细胞、NK细胞和CD8T细胞上各种Granzyme、Perforin和Lamp-1表达水平比较
(1)按照实施例3描述的方法分离并活化OT-I特异性TCR转基因小鼠CD8+NKT样细胞、NK细胞和CD8T细胞。
(2)收集各细胞1×107,离心后弃去上清,加入1ml Trizol重悬,吹打均匀。
(3)样本送至基因公司,利用Affymetrix基因表达芯片进行表达谱分析。
(4)应用R语言提取各种细胞颗粒释放途径相关基因的表达谱,作出热图以便于比较。
除非明确地不包括或者其它限制,将本文所引用的每篇文献(包括任何交叉引用的或相关的专利或专利申请)在此以引用方式全文并入本文。对任何文献的引用不是认可:其作为本文所公开的或要求保护的任何发明的现有技术,或者其单独或与任何其它参考文献组合,或者参考、提出、建议或者公开任何此类的发明。此外,当本文中术语的任何含义或定义与以引用方式并入的文献中同一术语的任何含义或定义矛盾时,应当服从在本文中赋予该术语的含义或定义。
虽然已经举例说明和描述了本发明的具体实施方案,但是对于本领域技术人员来说显而易见的是,在不脱离本发明实质和范围的情况下可以做出多种其他改变和变型。因此,在随附的权利要求书中包括属于本发明范围内的所有这些改变和变型。
参考文献:
[1]Watzl,C.and Long,E.O.,Exposing tumor cells to killer cell attack.Nat Med 2000.6:867-868.
[2]Budd,R.C.,Miescher,G.C.,Howe,R.C.,Lees,R.K.,Bron,C.and MacDonald,H.R.,Developmentally regulated expression of T cell receptor beta chain variable domains in immature thymocytes.J Exp Med 1987.166:577-582.
[3]Fowlkes,B.J.,Kruisbeek,A.M.,Ton-That,H.,Weston,M.A.,Coligan,J.E.,Schwartz,R.H.and Pardoll,D.M.,A novel population of T-cell receptor alpha beta-bearing thymocytes which predominantly expresses a single V beta gene family.Nature 1987.329:251-254.
[4]Ceredig,R.,Lynch,F.and Newman,P.,Phenotypic properties,interleukin 2 production,and developmental origin of a"mature"subpopulation of Lyt-2-L3T4-mouse thymocytes.Proc Natl Acad Sci U S A 1987.84:8578-8582.
[5]Sykes,M.,Unusual T cell populations in adult murine bone marrow.Prevalence of CD3+CD4-CD8-and alpha beta TCR+NK1.1+cells.J Immunol 1990.145:3209-3215.
[6]Makino,Y.,Kanno,R.,Ito,T.,Higashino,K.and Taniguchi,M.,Predominant expression of invariant V alpha 14+TCR alpha chain in NK1.1+T cell populations.Int Immunol 1995.7:1157-1161.
[7]Godfrey,D.I.,MacDonald,H.R.,Kronenberg,M.,Smyth,M.J.and Van Kaer,L.,NKT cells:what′s in a name?Nat Rev Immunol 2004.4:231-237.
[8]Maeda,M.,Shadeo,A.,MacFadyen,A.M.and Takei,F.,CD1d-independent NKT cells in beta 2-microglobulin-deficient mice have hybrid phenotype and function of NK and T cells.J Immunol 2004172:6115-6122.
- 还没有人留言评论。精彩留言会获得点赞!