一种NK细胞体外扩增方法与流程
本发明涉及一种细胞扩增方法,具体涉及一种nk细胞体外扩增方法,属于生物
技术领域:
。
背景技术:
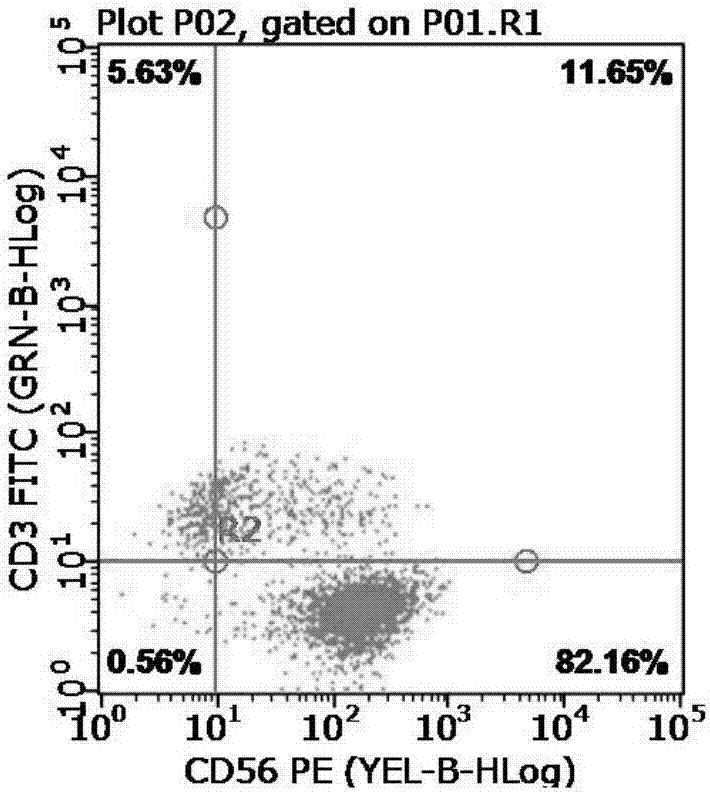
:nk细胞是一群表型为cd3-,cd56+的细胞亚群,其杀伤活性无mhc限制,不依赖于抗体,被称为自然杀伤细胞。nk细胞通常含有大量穿孔素和颗粒酶b,当激活靶向细胞的时候,nk细胞通过释放穿孔素和颗粒酶b来攻击靶细胞。nk细胞在人血液中含量极低(单个核细胞的5%-10%),因此在临床应用上受到很大的限制,需要进行体外扩增。当前,nk细胞培养体系中大都是通过添加il-2、il-15、il-18等介素类刺激细胞的生长,通过一段时间的培养,效果上不仅扩增倍数不足,而且所得nk细胞的纯度也不能满足需求。此外,通过饲养细胞来培养,在数量和纯度上有很好的效果,但是饲养本身就存在一定的风险,因此不能作为最佳选择。技术实现要素:为解决现有技术的不足,本发明的目的在于提供一种能够提高效应细胞的含量和细胞的总扩增量的nk细胞体外扩增方法。为了实现上述目标,本发明采用如下的技术方案:一种nk细胞体外扩增方法,其特征在于,包括以下步骤:step1:配制主要成分为50ng/ml抗cd3单克隆抗体+50ng/ml抗cd16单克隆抗体的试剂a,配制主要成分为300iu/mlil-2的试剂b,配制主要成分为20ng/mlil-12+20ng/mlil-15的试剂c,准备淋巴细胞分离液40ml作为试剂d;step2:取试剂a于t-175培养瓶包被,4℃过夜;step3:取50ml-100ml外周血,离心,离心所得细胞留step4使用,取血清,将所得血清于56℃灭火30min,冷析1h,再离心,取血清4℃保存备用;step4:取两支离心管,每支离心管中加20ml试剂d,将step3所得细胞用d-pbs重悬并调整至50ml,分别向每支装有20ml试剂d的离心管中缓缓添加25ml重悬细胞液,利用密度梯度离心法收集pbmc;step5:将step4收集的pbmc用d-pbs清洗2遍,将清洗后的pbmc按照1×106/ml-2×106/ml重悬于100mlx-vivo15培养基中,然后加入试剂b和试剂c,同时添加step3所得自体血清5ml,置于二氧化碳培养箱孵育;step6:第3天补加x-vivo15培养基150ml,补加试剂b和试剂c各150ul,补加step3所得自体血清5ml;step7:第6天补加x-vivo15培养基250ml,补加试剂b和试剂c各250ul,然后分别转移至2个培养袋中,每个培养袋加step3所得自体血清5ml;step8:第9天分别在两个培养袋补加x-vivo15培养基350ml,补加试剂b和试剂c各350ul,每个培养袋加step3所得自体血清5ml;step9:第12天分别在两个培养袋补加x-vivo15培养基400ml,补加试剂b和试剂c各400ul,每个培养袋添加step3所得自体血清5ml;step10:第14天收集细胞,取样做质检和流式。前述的nk细胞体外扩增方法,其特征在于,在step3中,外周血的离心条件为:2000rpm离心10min。前述的nk细胞体外扩增方法,其特征在于,在step3中,冷析后的血清的离心条件为:3500rpm离心15min。前述的nk细胞体外扩增方法,其特征在于,在step4中,密度梯度离心法的离心条件为:1500rpm离心30min。前述的nk细胞体外扩增方法,其特征在于,在step5中,pbmc的清洗方法为:1350rpm离心5min。本发明的有益之处在于:用主要成分为50ng/ml抗cd3单克隆抗体+50ng/ml抗cd16单克隆抗体的试剂a包被培养瓶,将细胞种植到该培养瓶中之后,在孵育的第1天至第3天这个过程中,抗cd3单克隆抗体和抗cd16单克隆抗体对细胞进行刺激,使细胞分泌相关的因子,提高了所需表型细胞的百分比,所以在体外培养时提高了效应细胞的含量和细胞的总扩增量,即提高了nk细胞的扩增倍数和纯度。附图说明图1是常规组的流式图;图2是实验组的流式图;图3是常规组与实验组的增值曲线对比图。具体实施方式以下结合附图和具体实施例对本发明作具体的介绍。本发明的nk细胞体外扩增方法,其包括以下步骤:step1、配制试剂1、试剂a试剂a的主要成分为50ng/ml抗cd3单克隆抗体+50ng/ml抗cd16单克隆抗体,其配制方法为:于超净台中分别取100ng抗cd3单克隆抗体和100ng抗cd16单克隆抗体,然后用2ml注射用水溶解,即配制成所需试剂a,即配即用。2、试剂b试剂b的主要成分为300iu/mlil-2,其配制方法为:于超净台中取li-2一支(100万iu),然后用3.3mlx-vivo15培养基溶解,即配制成所需试剂b,按照所需要量进行分装,-20℃保存。3、试剂c试剂c的主要成分为20ng/mlil-12+20ng/mlil-15,其配制方法为:于超净台中分别取400ugil-12和400ugil-15,然后用2mlx-vivo15培养基溶解,即配制成所需试剂c,按照需求量进行分装,-20℃保存。4、试剂d试剂d是淋巴细胞分离液,准备40ml。step2、包被取试剂a于t-175培养瓶包被,4℃过夜。step3、处理外周血取50ml-100ml外周血,3500rpm离心15min,离心所得细胞留step4使用,取血清,将所得血清于56℃灭火30min,冷析1h,再离心,取血清4℃保存备用。step4:收集pbmc将step3所得细胞用d-pbs重悬,调整至50ml。取两支离心管,每支离心管中加20ml试剂d,分别向每支装有20ml试剂d的离心管中缓缓添加25ml重悬细胞液,这个过程不能破坏分层。利用密度梯度离心法收集pbmc,1500rpm离心30min。step5、孵育及补加营养物质和刺激物将step4收集的pbmc用d-pbs清洗2遍,1350rpm离心5min,将清洗后的pbmc按照1×106/ml-2×106/ml重悬于100mlx-vivo15培养基中,然后加入试剂b和试剂c,同时添加step3所得自体血清5ml,置于二氧化碳培养箱孵育。第3天补加x-vivo15培养基150ml,补加试剂b和试剂c各150ul,补加step3所得自体血清5ml。第6天补加x-vivo15培养基250ml,补加试剂b和试剂c各250ul,然后分别转移至2个培养袋中,每个培养袋加step3所得自体血清5ml。第9天分别在两个培养袋补加x-vivo15培养基350ml,补加试剂b和试剂c各350ul,每个培养袋加step3所得自体血清5ml。第12天分别在两个培养袋补加x-vivo15培养基400ml,补加试剂b和试剂c各400ul,每个培养袋添加step3所得自体血清5ml。第14天收集细胞,取样做质检和流式。常规组的流式图如图1所示。实验组的流式图如图2所示。对比图1和图2可知:cd3-、cd56+的效应细胞比例有很大的提高,说明nk细胞的纯度得到了很大的提高。常规组和实验组的增值数据如表1所示。常规组和实验组的增值曲线对比图如图3所示。表1常规组和实验组的增值数据孵育天数常规组实验组d00.5×1080.5×108d33.2×1085.1×108d66.7×10811.4×108d914.5×10823.8×108d1230.6×10849.8×108d1468.6×108106.8×108通过表1和图3可知:实验组相对常规组在扩增量上有显著的提高,说明nk细胞的扩增倍数得到了提高。需要说明的是,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1