表雄酮和去氢表雄酮糖基化衍生物及其制备方法和应用与流程
本发明属于医药及其制备和应用的技术领域,具体涉及一种表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物及其制备方法和在制备抗乳腺癌药物中的应用。
背景技术:
肿瘤细胞的代谢比正常细胞旺盛,尤其是恶性肿瘤更为明显。肿瘤细胞代谢的异常使其对糖等物质的需求更为迫切。糖缀合物的糖链大多存在于细胞表面和细胞分泌的蛋白上,与细胞通讯、信号传递密切相关。同时,糖类化合物对某些细胞具有特异性寻靶作用,能够进行药物的定向转运。糖基部分可以通过增加药物的溶解性,提高其与肿瘤细胞结合的特异性,从而改变母体药物的药理活性。有研究表明在kryptogenin的C-3位和C-26位通过糖苷键同时引入单糖得到糖基化修饰的甾体衍生物如式A和式B所示,其对宫颈癌HeLa细胞株表现出优于母体10倍的抑制作用,半数抑制浓度IC50分别为4.25μM和8.36μM(Bioorganic&MedicinalChemistryLetters,2007,17(1):156-160);甾体糖衍生物具有强效的广谱抗肿瘤活性,甚至对于白血病耐药细胞以及各种肺癌细胞株同样有效。如式C所示化合物,其抗肿瘤活性(IC50)是一些常规临床抗癌药如嘧吡霉素C、阿霉素、喜树碱以及紫杉醇等的10至100倍(CarbohydrateResearch,2002,337(14):1269-1274)。构效关系分析表明甾体母核以及糖基结构是该类化合物保持高效抗肿瘤活性的关键。去氢表雄酮是人体外周循环中的最常见的内源性甾体激素,其主要由肾上腺皮质分泌,是生物合成雄激素和雌激素的重要前体物质。表雄酮是去氢表雄酮在人体代谢过程中的重要中间产物之一。作为合成各种甾体激素类药物的重要中间体,去氢表雄酮和表雄酮及其衍生物的抗肿瘤活性在近些年来受到了越来越多的关注。有研究表明,体内去氢表雄酮具有广泛的生物学活性。目前,从去氢表雄酮的衍生物阿比特龙(Abiraterone)已成为治疗去势抵抗性前列腺癌的重要药物;近期中国专利(专利申请号:201410682215.6)报道了表雄酮C-16、C-17位稠合噻二唑环衍生物(CH21)和去氢表雄酮C-16、C-17位稠合噻二唑环衍生物(CH12)具有较好的抑制乳腺癌细胞株T47D增殖活性。以CH12和CH21作为先导化合物,并引入糖基结构改善其水溶性,进而增强其抗肿瘤活性及选择性,对开发新的抗肿瘤药物的具有重要的意义。
技术实现要素:
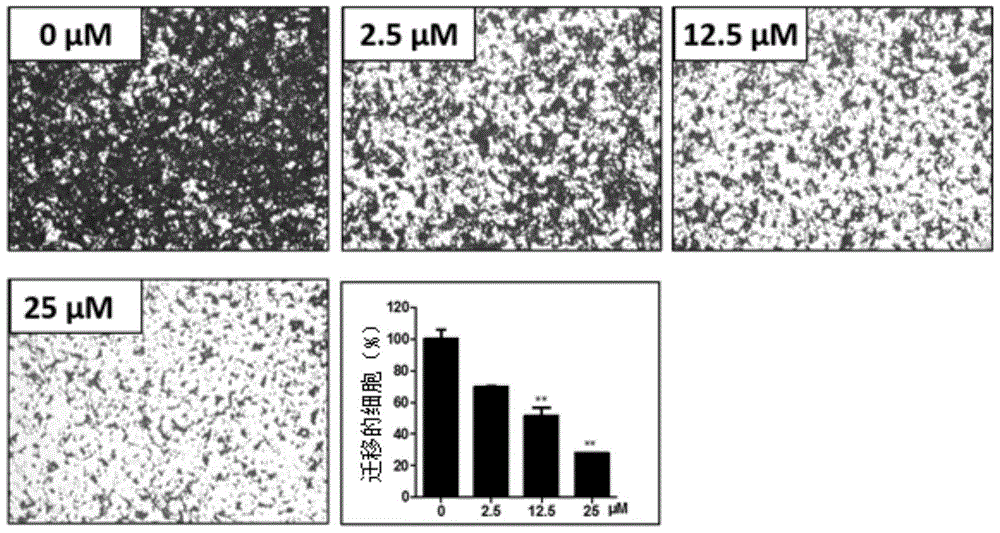
为克服现有技术的缺陷,本发明提出了一种表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物及其制备方法,将苯甲酰保护的单糖三氯乙酰亚胺酯与CH21或CH12为原料,形成糖苷键;然后脱除糖环的苯甲酰基保护基,得到所述的表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物。本发明的制备方法简单,合成路线短,原料简单易得,适合工业化的大规模生产。本发明提出了一种表雄酮糖基化衍生物,其结构如式(1)所示:其中,R选自:四种中的一种。本发明还提出的一种去氢表雄酮糖基化衍生物,所述去氢表雄酮糖基化衍生物结构如式(2)所示:其中,R选自:四种中的一种。本发明还提出一种表雄酮糖基化衍生物的制备方法,所述方法包括:(1)偶联反应:将苯甲酰保护的单糖三氯乙酰亚胺酯与式(m)所示的表雄酮C-16、C-17位稠合噻二唑环衍生物CH21在溶剂二氯甲烷中,在三氟甲磺酸三甲基硅脂的催化下室温进行偶联反应6-12小时,形成糖苷键,其中,苯甲酰基保护的单糖三氯乙酰亚胺酯作为单糖活性给体,结构如式(A-3)、(B-3)、(C-3)或(D-3)所示;(2)脱保护:在体积比为1:1的无水四氢呋喃和甲醇的混合溶剂中,甲醇钠为碱水解苯甲酰基,室温条件下反应3-6小时,脱除糖环苯甲酰基保护基得到一类如式(1)所示的表雄酮糖基化衍生物;其中,优选地,所述表雄酮糖基化衍生物的结构式如式(A-5-1)、式(B-5-1)、式(C-5-1)和或式(D-5-1)所示。其中,苯甲酰基保护的D-葡萄糖三氯乙酰亚胺酯(A-3)、苯甲酰基保护的D-甘露糖三氯乙酰亚胺酯(B-3)、苯甲酰基保护的D-鼠李糖三氯乙酰亚胺酯(C-3)和苯甲酰基保护的D-半乳糖三氯乙酰亚胺酯(D-3)的制备过程可参照文献JournalofShenyangPharmaceuticalUniversity,2005,22(5):352-354;Tetrahedron,2008,64(30-31):7386-7399;TetrahedronLetters,2005,46(31):2445-2448。其中,CH21化合物的制备过程为:以表雄酮为原料,经羟基保护、缩合反应、关环反应、羟基脱保护反应得到如下式,制备过程参照中国专利(专利申请号:201410682215.6)。本发明还提出的一种去氢表雄酮糖基化衍生物的制备方法,所述方法包括:(1)偶联反应:将苯甲酰保护的单糖三氯乙酰亚胺酯与式(n)所示的去氢表雄酮C-16、C-17位稠合噻二唑环衍生物CH12在溶剂二氯甲烷中,在三氟甲磺酸三甲基硅脂的催化下进行偶联反应6-8小时,形成糖苷键,其中,苯甲酰基保护的单糖三氯乙酰亚胺酯作为单糖活性给体,结构如式(A-3)、(B-3)、(C-3)或(D-3)所示;(2)脱保护:在体积比为1:1的无水四氢呋喃和甲醇的混合溶剂中,甲醇钠为碱水解苯甲酰基,室温条件下反应3-6小时,脱除糖环苯甲酰基保护基得到一类如式(2)所示的去氢表雄酮糖基化衍生物;其中,优选地,所述去氢表雄酮糖基化衍生物的结构式如式(A-5-2)、式(B-5-2)、式(C-5-2)或式(D-5-2)所示。其中,CH12化合物的制备过程为:以去氢表雄酮为原料,经羟基保护、缩合反应、关环反应、羟基脱保护反应得到如下式,制备过程参照中国专利(专利申请号:201410682215.6)。本发明制备方法中,以上反应采用薄板层析法来跟踪监测反应的完成程度,反应完毕后采用浓缩、萃取、柱层析分离等对合成产物进行后处理,最终产物通过核磁共振谱。本发明还提供了表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物在制备抗乳腺癌药物中的应用。本发明表雄酮和去氢表雄酮衍生物在抑制乳腺癌细胞增殖、迁移和克隆形成方面具显著效果,且对于乳腺癌细胞(T47D)与正常的成纤维细胞(HAF)具有较好的选择性。本发明抗乳腺癌的表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物及其制备方法的优点包括,将苯甲酰保护的单糖三氯乙酰亚胺酯分别与CH21及CH12反应,形成糖苷键,然后脱除糖环苯甲酰基保护基分别得到一类表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物。本发明制备方法的反应条件温和、所用试剂价格便宜、环境友好、合成路线短,合成方法简便。本发明制备方法中,将表雄酮和去氢表雄酮的C-16、C-17位分别引入噻二唑环得到CH21和CH12,分别与苯甲酰保护的单糖三氯乙酰亚胺酯形成糖苷键,然后脱除糖环苯甲酰基保护基分别得到一类表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物。抗肿瘤活性测试结果如图1所示,图1和表明本发明所制备的表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物均具有抗肿瘤活性,特别是表雄酮糖基化衍生物C-5-1和去氢表雄酮糖基化衍生物C-5-2分别在1.0μM浓度和0.2μM浓度时表现出比其母体化合物CH21和CH12更强的抑制T47D细胞增殖的活性;,表1表示本发明表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物对人源乳腺癌细胞株T47D及人源成纤维细胞HAF(正常细胞)的半数抑制浓度;由表1可以看出本发明的化合物C-5-1和C-5-2表现出比母体化合物CH21更强的抑制T47D细胞增殖活性,并且具有对肿瘤细胞及正常细胞的杀伤选择性;并且这种增殖抑制作用还具有对肿瘤细胞的明显选择性,特别是化合物表雄酮糖基化衍生物C-5-1(IC50HAF/IC50T47D=1247,其中HAF为正常细胞,T47D为乳腺癌细胞)。同时C-5-1还在较低浓度下表现出了显著的对乳腺癌细胞克隆的抑制活性(IC50=0.1360μM)和对乳腺癌细胞迁移的抑制活性(IC50=9.478μM)。本发明所制备的表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物可作为潜在肿瘤治疗药物,特别是某一特定类型乳腺癌的治疗药物,具有良好应用前景。附图说明图1表示本发明表雄酮糖基化衍生物、去氢表雄酮糖基化衍生物在0.2μM浓度和1.0μM浓度时分别对人源乳腺癌细胞系T47D的体外细胞毒活性即增殖抑制活性;结果表明化合物A-5-1、B-5-1、C-5-1、D-5-1、A-5-2、B-5-2、C-5-2、D-5-2对人源乳腺癌细胞系T47D均有一定的增殖抑制活性,其中的化合物C-5-1和C-5-2对人源乳腺癌细胞株T47D的抑制活性相对各自母体化合物CH21和CH12均有明显提高。图2表示表雄酮糖基化衍生物C-5-1对人源乳腺癌细胞株T47D细胞迁移活性的抑制。结果表明化合物C-5-1能够在较低浓度下显著抑制人源乳腺癌细胞株T47D的迁移。图3表示表雄酮糖基化衍生物C-5-1对人源乳腺癌细胞株T47D克隆形成的抑制。结果表明C-5-1能够在较低浓度下显著抑制T47D的克隆形成。具体实施方式结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。下述实施例中,化合物结构由核磁共振仪测定;试剂主要由上海国药化学试剂公司提供;产品纯化主要通过柱色谱,硅胶(200-300)由青岛海洋化工厂生产。实施例1:苯甲酰基保护的单糖三氯乙酰亚胺酯单糖的制备(制备过程参照文献JournalofShenyangPharmaceuticalUniversity,2005,22(5):352-354;Tetrahedron,2008,64(30-31):7386-7399;TetrahedronLetters,2005,46(31):2445-2448)【式(A-1)所示化合物】将D-葡萄糖(900mg,5mmol),DMAP(244mg,2mmol)溶解在无水吡啶(30mL)中,加入苯甲酰氯(5mL),室温反应6小时。反应完全后,向反应液中加入稀盐酸(100ml),乙酸乙酯(30ml×3)萃取,合并有机相,饱和食盐水(30ml×2)洗涤,无水Na2SO4干燥,浓缩,硅胶柱层析(PE:EA=3:1)纯化,得如式(A-1)所示的白色固体(3.36g,96%)。1HNMR(400MHz,CDCl3)δ8.18(d,J=7.4Hz,2H),8.04(d,J=7.5Hz,2H),7.96(d,J=7.5Hz,2H),7.89(d,J=7.9Hz,4H),7.67(t,J=7.4Hz,1H),7.59–7.50(m,4H),7.44(dd,J=12.3,7.2Hz,3H),7.37(dd,J=14.4,6.7Hz,3H),7.31(t,J=7.6Hz,4H),6.87(d,J=3.2Hz,1H),6.34(t,J=10.0Hz,1H),5.88(t,J=9.8Hz,1H),5.70(dd,J=10.2,3.4Hz,1H),4.64(d,J=10.2Hz,2H),4.55–4.46(m,1H).【式(B-1)所示化合物】按照化合物A-1的合成方法以D-甘露糖(900mg,5mmol)为原料,合成如式(B-1)所示的白色固体(3.22g,92%)。1HNMR(400MHz,CDCl3)δ8.18(d,J=7.8Hz,2H),8.06(d,J=7.2Hz,4H),7.92(d,J=7.8Hz,2H),7.83(d,J=7.9Hz,2H),7.65(t,J=7.3Hz,1H),7.59(t,J=7.4Hz,1H),7.53(dd,J=9.8,4.4Hz,3H),7.48(t,J=7.4Hz,1H),7.44–7.32(m,7H),7.25(dd,J=14.5,6.7Hz,2H),6.60(s,1H),6.26(t,J=10.1Hz,1H),6.04(dd,J=10.2,2.8Hz,1H),5.89(s,1H),4.67(d,J=12.2Hz,1H),4.55(d,J=10.0Hz,1H),4.48(dd,J=12.3,3.3Hz,1H).【式(C-1)所示化合物】按照化合物A-1的合成方法以一水L-鼠李糖(910mg,5mmol)为原料,合成如式(C-1)所示的白色固体(2.73g,94%)。1HNMR(400MHz,CDCl3)δ8.18(d,J=7.7Hz,2H),8.12(d,J=7.6Hz,2H),7.98(d,J=7.6Hz,2H),7.83(d,J=7.4Hz,2H),7.69–7.59(m,2H),7.55–7.48(m,5H),7.45–7.36(m,3H),7.26(t,J=7.9Hz,2H),6.55(s,1H),5.99(dd,J=9.6,2.6Hz,1H),5.86(s,1H),5.80(t,J=8.2Hz,1H),4.35(s,1H),1.40(d,J=4.6Hz,3H).【式(D-1)所示化合物】按照化合物A-1的合成方法以D-半乳糖(900mg,5mmol)为原料,合成如式(D-1)所示的白色固体(3.20g,91%)。1HNMR(400MHz,CDCl3)δ8.16–8.09(m,4H),7.97(d,J=7.8Hz,2H),7.87(d,J=7.9Hz,2H),7.83(d,J=7.8Hz,2H),7.65(t,J=7.4Hz,2H),7.56–7.50(m,5H),7.46(t,J=7.3Hz,2H),7.39(t,J=7.6Hz,2H),7.29(dd,J=15.0,7.3Hz,4H),6.97(d,J=3.3Hz,1H),6.20(s,1H),6.14(dd,J=10.7,2.9Hz,1H),6.04(dd,J=10.7,3.4Hz,1H),4.85(t,J=6.6Hz,1H),4.65(dd,J=11.2,6.4Hz,1H),4.44(dd,J=11.3,7.0Hz,1H).【式(A-2)所示化合物】将A-1(3.3g,4.71mmol)溶解在四氢呋喃(20mL)中,缓慢滴加甲胺醇溶液(5mL),室温反应2小时。反应完全后,向反应液中加入稀盐酸调pH呈弱酸性,乙酸乙酯(30ml×3)萃取,合并有机相,饱和食盐水(30ml×2)洗涤,无水Na2SO4干燥,浓缩,硅胶柱层析(PE:EA=2:1)纯化,得到如式(A-2)所示的白色固体(2.3g,82%)。1HNMR(400MHz,CDCl3)δ8.02(d,J=7.8Hz,2H),7.96(d,J=7.8Hz,2H),7.91(d,J=8.0Hz,2H),7.85(d,J=8.1Hz,2H),7.51–7.45(m,3H),7.40–7.32(m,7H),7.28–7.23(m,2H),6.24(t,J=9.9Hz,1H),5.75–5.69(m,2H),5.29(dd,J=10.2,3.1Hz,1H),4.67–4.61(m,2H),4.41(dd,J=12.3,3.9Hz,1H).【式(B-2)所示化合物】按照化合物A-2的合成方法以化合物B-1(3.2g,4.57mmol)为原料,得到如式(B-2)所示的白色固体(2.4g,88%)。1HNMR(400MHz,CDCl3)δ8.11(d,J=7.7Hz,2H),8.02(d,J=7.9Hz,2H),7.95(d,J=7.9Hz,2H),7.84(d,J=7.8Hz,2H),7.56(t,J=7.2Hz,2H),7.49(t,J=7.3Hz,1H),7.42–7.33(m,7H),7.26(t,J=6.4Hz,2H),6.17(t,J=10.1Hz,1H),6.00(dd,J=10.2,2.7Hz,1H),5.74(s,1H),5.53(s,1H),4.76(d,J=12.2Hz,1H),4.67(d,J=10.0Hz,1H),4.44(dd,J=12.2,3.1Hz,1H).【式(C-2)所示化合物】按照化合物A-2的合成方法以化合物C-1(2.7g,4.65mmol)为原料,得到如式(C-2)所示的白色固体(1.86g,84%)。1HNMR(400MHz,CDCl3)δ8.11(d,J=7.8Hz,2H),7.98(d,J=6.4Hz,2H),7.83(d,J=7.0Hz,2H),7.59(t,J=7.0Hz,1H),7.53–7.47(m,3H),7.40(dd,J=13.4,6.0Hz,3H),7.26(t,J=7.6Hz,2H),5.94(dd,J=10.1,3.1Hz,1H),5.73(s,1H),5.47(s,1H),4.51–4.44(m,1H),3.69(s,1H),1.36(d,J=8.0Hz,3H).【式(D-2)所示化合物】按照化合物A-2的合成方法以化合物D-1(3.10g,4.42mmol)为原料,得到如式(D-2)所示的白色固体(2.19g,83%)。1HNMR(400MHz,CDCl3)δ8.12(d,J=8.4Hz,2H),8.08–7.97(m,4H),7.83(t,J=6.8Hz,2H),7.65(t,J=7.2Hz,1H),7.61–7.50(m,4H),7.47–7.38(m,5H),7.31–7.25(m,2H),6.12(d,J=7.7Hz,1H),6.05–5.89(m,1H),5.78–5.65(m,1H),5.12–4.87(m,1H),4.74–4.63(m1H),4.51–4.41(m1H).【式(A-3)所示化合物】将A-2(2.25g,3.77mmol)溶解在无水二氯甲烷(20mL)中,依次加入三氯乙腈(3.78mL,37.7mmol)、DBU(0.29mL,1.89mmol)室温反应4小时。反应完全后,减压除去溶剂,硅胶柱层析(PE:EA=5:1)纯化,得到如式(A-3)所示的白色固体(2.43g,87%)。1HNMR(400MHz,CDCl3)δ8.63(s,1H),8.06–8.02(m,2H),7.98–7.94(m,4H),7.90–7.85(m,2H),7.56(t,J=7.4Hz,1H),7.51(t,J=7.4Hz,2H),7.46–7.42(m,3H),7.37(t,J=7.8Hz,4H),7.30(t,J=7.8Hz,2H),6.84(d,J=3.7Hz,1H),6.28(t,J=10.0Hz,1H),5.82(t,J=9.8Hz,1H),5.63(dd,J=10.2,3.7Hz,1H),4.67–4.63(m,2H),4.49(dd,J=12.9,5.5Hz,1H).【式(B-3)所示化合物】按照化合物A-3的合成方法以化合物B-2(2.35g,3.94mmol)为原料,得到如式(B-3)所示的白色固体(2.36g,81%)。1HNMR(400MHz,CDCl3)δ8.85(s,1H),8.06(dd,J=14.5,7.2Hz,4H),7.95(d,J=7.3Hz,2H),7.83(d,J=7.2Hz,2H),7.61–7.55(m,2H),7.50(t,J=7.4Hz,1H),7.43–7.34(m,7H),7.28–7.24(m,2H),6.56(d,J=1.7Hz,1H),6.23(t,J=10.2Hz,1H),5.99–5.92(m,2H),4.72(dd,J=12.3,2.4Hz,1H),4.66–4.59(m,1H),4.49(dd,J=12.3,4.1Hz,1H).【式(C-3)所示化合物】按照化合物A-3的合成方法以化合物C-2(1.80g,3.78mmol)为原料,得到如式(C-3)所示的白色固体(1.97g,84%)。1HNMR(400MHz,CDCl3)δ8.83(s,1H),8.12(d,J=8.3Hz,2H),7.99(d,J=7.1Hz,2H),7.83(d,J=8.3Hz,2H),7.66–7.62(m,1H),7.55–7.50(m,3H),7.46–7.39(m,3H),7.29–7.27(m,2H),6.50(d,J=1.5Hz,1H),5.94–5.87(m,2H),5.82–5.76(m,1H),4.44–4.39(m,1H),1.43(d,J=6.2Hz,3H).【式(D-3)所示化合物】按照化合物A-3的合成方法以化合物D-2(2.15g,3.60mmol)为原料,得到如式(D-3)所示的白色固体(2.14g,80%)。1HNMR(400MHz,CDCl3)δ8.64(s,1H),8.11–8.08(m,2H),7.99–7.95(m,4H),7.81(dd,J=8.3,1.1Hz,2H),7.66–7.62(m,1H),7.55–7.49(m,4H),7.47–7.44(m,1H),7.41(t,J=7.8Hz,2H),7.36(t,J=7.8Hz,2H),7.28–7.25(m,2H),6.92(d,J=3.7Hz,1H),6.16(d,J=2.4Hz,1H),6.08(dd,J=10.7,3.3Hz,1H),5.97(dd,J=10.7,3.7Hz,1H),4.87(t,J=6.4Hz,1H),4.62(dd,J=11.4,6.9Hz,1H),4.44(dd,J=11.5,6.0Hz,1H).实施例2:表雄酮糖基化衍生物的制备【式(A-4-1)所示化合物】将A-3(889mg,1.2mmol)、CH21(200mg,0.6mmol)溶解在无水二氯甲烷(20mL)中,加入三氟甲磺酸三甲基硅脂(0.24mL,0.3mmol),室温反应6小时。反应完全后,减压除去溶剂,加入水(30mL),乙酸乙酯(30mL×3)萃取,合并有机相,无水硫酸钠干燥,硅胶柱层析(PE:EA=3:1)纯化,得到如式(A-4-1)所示的白色固体(442mg,81%)。1HNMR(400MHz,CDCl3)δ8.04(d,J=8.3Hz,2H),7.98(d,J=7.2Hz,2H),7.92(d,J=8.2Hz,2H),7.84(d,J=8.2Hz,2H),7.56–7.49(m,3H),7.40(dd,J=16.9,9.2Hz,5H),7.35(t,J=7.7Hz,2H),7.27(t,J=7.7Hz,2H),5.94(t,J=9.6Hz,1H),5.66(t,J=9.6Hz,1H),5.25(d,J=4.5Hz,1H),4.92(d,J=7.5Hz,1H),4.62–4.56(m,2H),4.18–4.15(m,1H),3.59–3.49(m,1H),3.02(dd,J=15.1,6.3Hz,1H),2.61(dd,J=15.0,12.0Hz,1H),2.48(d,J=12.5Hz,1H),2.23–2.15m,3H),2.08–2.02(m,1H),1.97(d,J=12.2Hz,1H),1.95–1.84(m,1H),1.10(s,3H),0.97(s,3H).【式(B-4-1)所示化合物】按照化合物A-4-1的合成方法以化合物B-3(889mg,1.2mmol)和CH21(200mg,0.6mmol)为原料,得到如式(B-4-1)所示的白色固体(426mg,78%)。1HNMR(400MHz,CDCl3)δ8.11–8.04(m,4H),8.00–7.95(m,2H),7.86–7.81(m,2H),7.61–7.56(m,2H),7.51(t,J=7.4Hz,1H),7.45–7.35(m,7H),7.26(dd,J=4.8,2.7Hz,2H),6.05(t,J=10.0Hz,1H),5.93(dd,J=10.1,3.3Hz,1H),5.64(dd,J=3.2,1.8Hz,1H),5.25(d,J=1.4Hz,1H),4.70(dd,J=11.8,2.1Hz,1H),4.54–4.51(m,1H),4.47(dd,J=11.9,5.1Hz,1H),3.74–3.65(m,1H),3.03(dd,J=15.5,6.3Hz,1H),2.61(dd,J=15.5,12.0Hz,1H),2.48–2.40(m,1H),2.23–2.17(m,1H),1.96(d,J=10.5Hz,1H),1.60–1.49(m,3H),1.36–1.21(m,4H),1.10(s,3H),0.93(s,3H).【式(C-4-1)所示化合物】按照化合物A-4-1的合成方法以化合物C-3和CH21为原料,得到如式(C-4-1)所示的白色固体(89%)。1HNMR(400MHz,CDCl3)δ8.13(dd,J=8.3,1.3Hz,2H),7.95(dd,J=8.3,1.2Hz,2H),7.81(dd,J=8.3,1.2Hz,2H),7.63–7.58(m,1H),7.55–7.47(m,3H),7.45–7.34(m,3H),7.29–7.24(m,3H),5.85(dd,J=10.1,3.4Hz,1H),5.68(t,J=10.0Hz,1H),5.63(dd,J=3.4,1.8Hz,1H),5.19(t,J=4.3Hz,1H),4.33–4.23(m,1H),3.66–3.55(m,1H),3.11–3.00(m,1H),2.65(dd,J=15.5,11.9Hz,1H),2.54–2.43(m,2H),2.39(dd,J=17.8,6.7Hz,1H),2.27–2.21(m,1H),2.14–2.43(m,1H),2.04–1.92(m,3H),1.86–1.70(m,5H),1.38(d,J=6.3Hz,3H),1.16(s,3H),1.14(s,3H).【式(D-4-1)所示化合物】按照化合物A-4-1的合成方法以化合物D-3和CH21为原料,得到如式(D-4-1)所示的白色固体(421mg,77%)。1HNMR(400MHz,CDCl3)δ8.11(d,J=7.3Hz,2H),8.03(d,J=7.2Hz,2H),7.97(d,J=7.3Hz,2H),7.79(d,J=7.3Hz,2H),7.62(t,J=7.4Hz,1H),7.56(dd,J=13.1,5.7Hz,1H),7.53–7.46(m,3H),7.44–7.38(m,5H),7.27–7.22(m,2H),5.98(d,J=2.9Hz,1H),5.78(dd,J=10.3,8.0Hz,1H),5.60(dd,J=10.4,3.4Hz,1H),4.92(d,J=8.0Hz,1H),4.69(dd,J=11.2,6.9Hz,1H),4.42(dd,J=11.2,6.5Hz,1H),4.33(t,J=6.7Hz,1H),3.62–3.52(m,1H),3.02(dd,J=15.5,6.3Hz,1H),2.61(dd,J=15.5,12.0Hz,1H),2.48(d,J=12.5Hz,1H),2.26–2.16(m,3H),2.08–1.98(m,2H),1.93–1.86(m,1H),1.81–1.78(m,2H),1.76–1.59(m,5H),1.11(s,3H),1.01(s,3H).【式(A-5-1)所示化合物】将A-4-1(420mg,0.46mmol)溶解在无水四氢呋喃(10mL)和甲醇(10mL)混合溶剂中,加入甲醇钠(497mg,9.2mmol),室温反应6小时。反应完全后,除去溶剂,加入稀盐酸调pH呈弱酸性,乙酸乙酯(30mL×3)萃取,无水硫酸钠干燥,硅胶柱层析(DCM:MeOH=5:1)分离纯化,得到如式(A-5-1)所示的白色固体(200mg,88%)。1HNMR(400MHz,DMSO-d6)δ4.89(d,J=4.5Hz,1H),4.87–4.83(m,2H),4.43(t,J=5.8Hz,1H),4.23(d,J=7.8Hz,1H),3.67–3.63(m,1H),3.45–3.37(m,2H),3.16(t,J=4.2Hz,1H),3.11(dd,J=8.6,4.6Hz,1H),3.06(d,J=5.3Hz,2H),3.02(d,J=5.9Hz,1H),2.92–2.87(m,1H),2.71–2.61(m,1H),2.31–2.23(m,1H),2.14(dd,J=17.2,11.1Hz,1H),1.76(dd,J=17.2,6.6Hz,3H),1.72–1.62(m,5H),1.55–1.37(m,2H),1.01(s,3H),0.85(s,3H).【式(B-5-1)所示化合物】按照化合物A-5-1的合成方法以化合物B-4-1(420mg,0.46mmol)为原料,得到如式(B-5-1)所示的白色固体(198mg,87%)。1HNMR(400MHz,CDCl3)δ5.03(s,1H),3.99(s,2H),3.94(s,2H),3.75(d,J=14.3Hz,1H),3.61(d,J=11.1Hz,1H),3.55(s,1H),2.99(dd,J=15.4,6.0Hz,1H),2.58(dd,J=15.1,12.2Hz,1H),2.50–2.36(m,1H),2.20–2.14(m,1H),1.89(d,J=8.7Hz,1H),1.82(d,J=10.9Hz,1H),1.74(s,4H),1.55(d,J=7.3Hz,2H),1.43–1.26(m,5H),1.08(s,3H),0.89(s,3H)【式(C-5-1)所示化合物】按照化合物A-5-1的合成方法以化合物C-4-1为原料,得到如式(C-5-1)所示的白色固体(86%)。1HNMR(400MHz,CDCl3)δ4.95(s,1H),3.89(s,1H),3.83–3.77(m,1H),3.76–3.71(m,1H),3.62–3.51(m,1H),3.49–3.43(m,1H),3.01(dd,J=15.5,6.3Hz,1H),2.59(dd,J=15.3,12.1Hz,1H),2.48–2.39(m,1H),2.24–2.17(m,1H),1.82(d,J=11.1Hz,2H),1.77(d,J=12.3Hz,4H),1.66(s,4H),1.54(dd,J=17.3,10.8Hz,2H),1.31(d,J=6.1Hz,3H),1.27–1.23(m,1H),1.09(s,3H),0.90(s,3H).【式(D-5-1)所示化合物】按照化合物A-5-1的合成方法以化合物D-4-1为原料,得到如式(D-5-1)所示的白色固体(87%)。1HNMR(400MHz,DMSO-d6)δ4.78(d,J=3.4Hz,1H),4.51–4.44(m,2H),4.29(d,J=3.2Hz,1H),4.19(d,J=6.6Hz,1H),3.69(s,1H),3.66(t,J=6.4Hz,1H),3.55–3.45(m,4H),3.44–3.37(m,2H),3.04(dd,J=15.8,6.3Hz,1H),2.67(dd,J=15.8,12.0Hz,1H),2.29–2.25(m,1H),2.18–2.12(m,1H),1.84–1.77(m,2H),1.73–1.66(m,4H),1.60(d,J=12.6Hz,1H),1.54–1.47(m,1H),1.36–1.24(m,5H),1.02(s,3H),0.85(s,3H).实施例3:去氢表雄酮糖基化衍生物的制备【式(A-4-2)所示化合物】将A-3(889mg,1.2mmol)、CH12(200mg,0.6mmol)溶解在无水二氯甲烷(20mL)中,加入三氟甲磺酸三甲基硅脂(0.24mL,0.3mmol),室温反应6小时。反应完全后,减压除去溶剂,加入水(30mL),乙酸乙酯(30mL×3)萃取,合并有机相,无水硫酸钠干燥,硅胶柱层析(PE:EA=3:1)纯化,得到如式(A-4-2)所示的白色固体(415mg,76%))。1HNMR(400MHz,CDCl3)δ8.01(d,J=8.2Hz,2H),7.97(d,J=8.2Hz,2H),7.90(d,J=8.2Hz,2H),7.83(d,J=8.2Hz,2H),7.55–7.48(m,3H),7.40(dd,J=16.9,9.2Hz,5H),7.34(t,J=7.7Hz,2H),7.29(t,J=7.7Hz,2H),5.90(t,J=9.6Hz,1H),5.64(t,J=9.7Hz,1H),5.50(dd,J=9.3,8.3Hz,1H),5.26(d,J=4.5Hz,1H),4.95(d,J=7.8Hz,1H),4.62–4.57(m,2H),4.18–4.15(m,1H),3.59–3.49(m,1H),3.02(dd,J=15.5,6.3Hz,1H),2.61(dd,J=15.4,12.0Hz,1H),2.48(d,J=12.5Hz,1H),2.23–2.17m,3H),2.08–2.00(m,1H),1.96(d,J=12.4Hz,1H),1.92–1.85(m,1H),1.11(s,3H),0.99(s,3H).【式(B-4-2)所示化合物】按照化合物A-4-2的合成方法以化合物B-3和CH12为原料,得到如式(B-4-2)所示的白色固体(73%)。1HNMR(400MHz,CDCl3)δ8.11–8.04(m,4H),8.00–7.95(m,2H),7.51(t,J=7.4Hz,1H),7.45–7.35(m,7H),7.26(dd,J=4.8,2.7Hz,2H),6.05(t,J=10.0Hz,1H),5.64(dd,J=3.2,1.8Hz,1H),5.25(d,J=1.4Hz,1H),4.70(dd,J=11.8,2.1Hz,1H),4.69–4.66(m,1H),4.54–4.51(m,1H),4.47(dd,J=11.9,5.1Hz,1H),3.74–3.65(m,1H),3.03(dd,J=15.5,6.3Hz,1H),2.61(dd,J=15.5,12.0Hz,1H),2.48–2.40(m,1H),2.23–2.17(m,1H),1.96(d,J=10.5Hz,1H),1.60–1.49(m,3H),1.36–1.21(m,4H),1.10(s,3H),0.93(s,3H).【式(C-4-2)所示化合物】按照化合物A-4-2的合成方法以化合物C-3和CH12为原料,得到如式(C-4-2)所示的白色固体(78%)。1HNMR(400MHz,CDCl3)δ8.10(dd,J=8.3,1.2Hz,2H),7.98(dd,J=8.3,1.2Hz,2H),7.82(dd,J=8.3,1.2Hz,2H),7.64–7.59(m,1H),7.55–7.47(m,3H),7.45–7.36(m,3H),7.28–7.24(m,3H),5.86(dd,J=10.1,3.4Hz,1H),5.67(t,J=10.0Hz,1H),5.61(dd,J=3.4,1.8Hz,1H),5.45–5.39(m,1H),5.17(t,J=4.3Hz,1H),4.31–4.23(m,1H),3.66–3.55(m,1H),3.11–3.00(m,1H),2.65(dd,J=15.5,11.9Hz,1H),2.54–2.43(m,2H),2.39(dd,J=17.8,6.7Hz,1H),2.27–2.21(m,1H),2.14–2.43(m,1H),2.04–1.92(m,3H),1.86–1.69(m,5H),1.35(d,J=6.3Hz,3H),1.16(s,3H),1.15(s,3H).【式(D-4-2)所示化合物】按照化合物A-4-2的合成方法以化合物D-3和CH12为原料,得到如式(D-4-2)所示的白色固体(72%)。1HNMR(400MHz,CDCl3)δ8.11(d,J=7.3Hz,2H),8.03(d,J=7.2Hz,2H),7.97(d,J=7.3Hz,2H),7.79(d,J=7.3Hz,2H),7.62(t,J=7.4Hz,1H),7.56(dd,J=13.1,5.7Hz,1H),7.53–7.46(m,3H),7.44–7.38(m,5H),7.27–7.22(m,2H),5.98(d,J=2.9Hz,1H),5.78(dd,J=10.3,8.0Hz,1H),5.60(dd,J=10.4,3.4Hz,1H),5.26(d,J=4.4Hz,1H),4.92(d,J=8.0Hz,1H),4.69(dd,J=11.2,6.9Hz,1H),4.42(dd,J=11.2,6.5Hz,1H),4.33(t,J=6.7Hz,1H),3.62–3.52(m,1H),3.02(dd,J=15.5,6.3Hz,1H),2.61(dd,J=15.5,12.0Hz,1H),2.48(d,J=12.5Hz,1H),2.26–2.16(m,3H),2.08–1.98(m,2H),1.93–1.86(m,1H),1.81–1.78(m,2H),1.76–1.59(m,5H),1.11(s,3H),1.01(s,3H).【式(A-5-2)所示化合物】将A-4-2(400mg,0.44mmol)溶解在无水四氢呋喃(10mL)和甲醇(10mL)混合溶剂中,加入甲醇钠(475mg,8.8mmol),室温反应6小时。反应完全后,除去溶剂,加入稀盐酸调pH呈弱酸性,乙酸乙酯(30mL×3)萃取,无水硫酸钠干燥,硅胶柱层析(DCM:MeOH=5:1)分离纯化,得到如式(A-5-2)所示的白色固体(178mg,83%)。1HNMR(400MHz,DMSO-d6)δ5.95(d,J=3.2Hz,1H),5.38(d,J=3.3Hz,1H),4.94(d,J=4.6Hz,1H),4.92–4.88(m,1H),4.45(s,1H),4.23(d,J=7.7Hz,1H),3.64(dd,J=11.2,5.4Hz,1H),3.52–3.45(m,1H),3.42(dd,J=9.8,3.8Hz,1H),3.18–3.11(m,1H),3.05(d,J=4.7Hz,3H),2.93–2.88(m,1H),2.70(dd,J=15.6,12.0Hz,1H),2.41(dd,J=13.0,3.3Hz,1H),2.31(d,J=11.2Hz,1H),2.23–2.12(m,2H),2.09–2.01(m,1H),1.05(s,6H).【式(B-5-2)所示化合物】按照化合物A-5-2的合成方法以化合物B-4-2为原料,得到如式(B-5-2)所示的白色固体(85%)。1HNMR(400MHz,DMSO-d6)δ5.35(dd,J=11.1,8.3Hz,1H),4.78(d,J=1.2Hz,1H),4.69(d,J=5.0Hz,1H),4.66(d,J=4.3Hz,1H),4.53(d,J=5.9Hz,1H),4.43(t,J=5.9Hz,1H),3.65(dd,J=10.3,6.2Hz,1H),3.56(s,1H),3.49–3.39(m,4H),3.40–3.35(m,2H),3.17(d,J=5.2Hz,1H),3.08(dd,J=15.8,6.4Hz,1H),2.71(dd,J=15.8,11.9Hz,1H),2.41–2.36(m,1H),2.35–2.30(m,1H),2.25(d,J=11.3,1H),2.22–2.15(m,1H),2.09–2.02(m,1H),1.91–1.82(m,3H),1.75–1.67(m,4H),1.41–1.33(m,1H),1.06(d,J=1.6Hz,1H).【式(C-5-2)所示化合物】按照化合物A-5-2的合成方法以化合物C-4-2为原料,得到如式(C-5-2)所示的白色固体(94%)。1HNMR(400MHz,CDCl3)δ5.38(s,1H),4.97(s,1H),3.96(d,J=36.0Hz,2H),3.78–3.73(m,1H),3.57–3.52(m,1H),3.50–3.45(m,1H),3.02(dd,J=15.4,6.2Hz,1H),2.62(dd,J=15.4,12.0Hz,1H),2.48(d,J=12.2Hz,1H),2.38(d,J=10.5Hz,1H),2.24–2.18(m,2H),2.14–2.04(m,1H),1.97–1.85(m,3H),1.84–1.68(m,4H),1.60(dd,J=23.5,10.8Hz,1H),1.31(d,J=15.8Hz,3H),1.12(s,3H),1.09(s,3H).【式(D-5-2)所示化合物】按照化合物A-5-2的合成方法以化合物D-4-2为原料,得到如式(D-5-2)所示的白色固体(86%)。1HNMR(400MHz,DMSO-d6)δ5.37(dd,J=11.0,8.3Hz,1H),4.80(d,J=3.6Hz,1H),4.54–4.46(m,2H),4.29(d,J=3.7Hz,1H),4.20(d,J=6.9Hz,1H),3.69(s,1H),3.64(t,J=6.1Hz,1H),3.52–3.43(m,4H),3.42–3.37(m,2H),3.00(dd,J=14.7,6.8Hz,1H),2.69(dd,J=15.1,11.3Hz,1H),2.28–2.25(m,1H),2.16–2.10(m,1H),1.86–1.77(m,2H),1.73–1.67(m,4H),1.61(d,J=12.6Hz,1H),1.55–1.46(m,1H),1.38–1.25(m,5H),1.02(s,3H),0.85(s,3H)。实施例4:表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物抗肿瘤细胞增殖测试采用SRB法在乳腺癌细胞系T47D和人成纤维细胞系HAF中测试本发明的表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物对相应细胞的增殖抑制率。计算半数抑制浓度(IC50)进行比较。1、测试原理:磺酰罗丹明B(SRB)是一种粉红色阴离子染料,易溶于水,在酸性条件下可特异性地与细胞内组成蛋白质的碱性氨基酸结合,其在515nm波长处产生吸收峰。在一定吸光度范围内,吸光度与细胞数量成线性正相关,故可用作细胞数量的定量检测。2、样品测试(1)各细胞以适当的密度接种到96孔板上,经过24小时培养后,实验组给予不同浓度的本发明的衍生物处理96小时,对照组使用正常培养基。(2)药物作用96小时后,取出培养板,每孔加入25μL50%TCA溶液固定细胞,4℃放置1小时以上。(3)取出固定后的培养板,用水冲洗5遍,自然晾干或吹风机吹干后,每孔加入50μL0.4%SRB溶液,染色10分钟,弃去染色液,1%冰醋酸洗涤并用吹风机吹干。(4)用100μLTris-base碱液(10mM)溶解与细胞蛋白结合的染料,采用酶标仪515nm处测定光吸收值。(5)IC50用GraphPad软件计算得到。3、结论各测试化合物对人源乳腺癌细胞T47D分别在0.2μM和1μM浓度下的抑制率见图1和表1,结果表明化合物A-5-1、B-5-1、C-5-1、D-5-1、A-5-2、B-5-2、C-5-2、D-5-2均有较好的抑制乳腺癌细胞T47D增殖的能力,特别是化合物C-5-1(IC50=0.0696μM)抑制乳腺癌细胞T47D增殖的能力明显强于其母体化合物CH21(IC50=1.22μM),以及表雄酮(IC50=1.23μM)和去氢表雄酮(IC50=2.55μM),且对正常成纤维HAF细胞增殖的抑制能力很小(IC50=86.8μM),表现出了对正常成纤维细胞HAF很低的细胞毒性,以及对乳腺癌细胞系T47D和正常成纤维细胞HAF的极大的选择性(IC50HAF/IC50T47D=1247)。该选择性与母体化合物CH21(IC50HAF/IC50T47D=32)相比提高了39倍,与表雄酮(IC50HAF/IC50T47D=35)相比提高了36倍,与去氢表雄酮(IC50HAF/IC50T47D=21)相比提高了59倍。因此,本发明所涉及的表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物可作为一种潜在的治疗乳腺癌的药物。表1.表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物对乳腺癌T47D细胞以及人成纤维细胞HAF体外细胞毒活性实施例5:C-5-1抑制乳腺癌细胞系T47D的细胞迁移活性采用微孔滤膜培养小室系统(Transwell试验)测试化合物C-5-1对乳腺癌细胞系T47D的细胞迁移能力的影响。1、测试原理:Transwell小室的底层是一张带有微孔具有通透性的膜,孔径大小为0.1-12.0μm,本发明采用的是一般常用的聚碳酸酯膜(polycarbonatemembrane)。将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上室内盛装上层培养液,下室内盛装下层培养液,上下层培养液以聚碳酸酯膜相隔。将细胞接种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养液中的成分对细胞生长、运动等的影响。应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。在细胞迁移实验中,可以通过对滤膜下面的细胞进行计数,来反映细胞的迁移情况。1、化合物抑制迁移活性测试:(1)消化并计数处于对数生长期的T47D细胞,细胞重悬在无血清并含有不同浓度(0,0.5,2.5,12.5μM)待测化合物的基础培养基中,细胞以5x104个/孔(200μL)接种至Transwell小室的上室中,对照组加入等量的基础培养基。下室中则加入600μL含有对应浓度待测化合物的完全培养基。(2)置于细胞培养箱中培养14h。(3)取出Transwell小室用多聚甲醛固定小室细胞20min。(4)2‰结晶紫染液将细胞染色处理5min,清洗小室,将未结合的结晶紫洗掉,用棉签轻轻擦拭Transwell小室的上侧,将未迁移到下侧的细胞擦掉。(5)自然干燥,显微镜下拍照,统计多个视野的细胞数目。(6)统计数据,细胞迁移率(%)=加药物细胞迁移数/对照组细胞迁移数*100%。3、结论:实验结果如(图2)所示,图2表明C-5-1能够在体外实验中以剂量依赖性的方式抑制T47D细胞的迁移。在12.5μM的浓度下,即表现出了与对照组的极显著差异(P<0.01);到25μM浓度时,对细胞迁移的抑制率达到了70%左右。实施例6:C-5-1抑制乳腺癌细胞系T47D的克隆形成实验采用体外克隆形成实验的方法测试化合物对T47D细胞克隆形成能力的影响。1、测试原理细胞克隆形成率即细胞接种存活率,表示接种细胞后贴壁的细胞成活并形成克隆的数量。贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。2、样品测试(1)消化处理处于对数生长期的相应细胞,并进行计数,每孔2x103个细胞接种于六孔板中,确保接种的细胞分布均匀。(2)待细胞贴壁后换液,加入含有不同浓度(0,0.1,0.5,2.5μM)测试化合物的完全培养基。(3)培养一周后,用吸泵吸掉原来的培养基,磷酸盐缓冲液清洗3次,用多聚甲醛溶液对细胞进行固定处理(20min),然后2‰结晶紫染液将细胞染色5min,最后用缓慢流动的自来水轻轻清洗,以洗掉未结合的结晶紫染液,室温自然干燥。(4)显微镜下拍照,计算细胞克隆形成数量3、结论实验结果如图3所示,图3表明C-5-1能够在体外实验中以剂量依赖性的方式抑制T47D细胞的克隆形成数量和形成克隆的大小。在0.1μM的浓度下,即表现出了与对照组的极显著差异(P<0.001);到2.5μM浓度时,对细胞克隆形成的抑制率达到了90%以上。综上,本发明制备的表雄酮糖基化衍生物和去氢表雄酮糖基化衍生物可作为一种潜在的制备抗乳腺癌的药物。本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 脱氢表雄酮的治疗用途和传送系统的制作方法
- 利用脱氢表雄酮甾体及抗毒蕈碱药物治疗呼吸道疾病及肺病的组合物、制剂和试剂盒的制作方法
- 脱氢表雄酮的治疗用途和传送系统的制作方法
- 使用脱氢表雄酮治疗系统性红斑狼疮的制作方法
- 治疗哮喘或慢性阻塞性肺病的脱氢表雄酮或硫酸脱氢表雄酮与pde-4抑制剂的组合的制作方法
- 治疗哮喘或慢性阻塞性肺病的脱氢表雄酮或硫酸脱氢表雄酮与抗胆碱能支气管扩张剂的组合的制作方法
- 与脱氢表雄酮或类似物组合的选择性雌激素受体调节剂的制作方法
- 脱氢表雄酮的笼形物和相应的药物组合物的制作方法
- 与脱氢表雄酮或类似物组合的选择性雌激素受体调节剂的制作方法
- 利用脱氢表雄酮甾体及抗毒蕈碱药物治疗呼吸道疾病及肺病的组合物、制剂和试剂盒的制作方法