黄瓜CsMYB6基因在调控植物表皮毛及果刺发育中的应用的制作方法
本发明属于农业生物技术领域,具体地说,涉及黄瓜CsMYB6基因在调控植物表皮毛及果刺发育中的应用。
背景技术:
黄瓜(Cucumis sativus L.)是葫芦科(Cucurbitaceae)甜瓜属(Cucumis)一年生草本植物,染色体数为2n=2x=14。黄瓜原产于温暖湿润的喜马拉雅山南麓印度北部地区,在我国已有2000多年的栽培历史,并已成为黄瓜的次生起源中心。黄瓜是世界四大重要蔬菜作物之一,也是我国设施栽培的主要蔬菜种类,在我国的蔬菜生产中占有重要地位。
黄瓜的果实是由子房和花托共同发育而成的瓠果。果实的商品性,例如瓜把长短、果瘤大小、果刺密度等,是影响产品市场销售的主要因素。与欧美国家鲜食黄瓜果实均为无刺瘤类型相比,我国市场供应的黄瓜果实则绝大多数为密刺瘤类型及少量稀刺瘤类型品种。因此,在综合考虑抗病性、丰产性等综合性状的同时,选育果实刺瘤状况等外观品质符合市场需求的品种成为黄瓜育种的目标之一。
表皮毛是大多数植物地上部分表皮组织所特有的一种结构,表皮毛的形态多种多样,而且在不同生物中有不同的功能。有的表皮毛由单细胞构成,有的由多个细胞构成;有的具有分支,有的则不具有分支;有的有腺体,有的则无腺体。作为植物组织表面的表皮毛,它的主要功能是增加表皮层厚度,以减少热量和水分的散失;同时它还保护植物免受昆虫和病原体的侵害以及降低机械损伤和紫外光伤害。一些特化的表皮毛还具有很重要的经济作用。比如,棉纤维(又称为种子表皮毛)作为重要的天然纤维,是纺织工业重要的原材料。黄瓜等 蔬菜的表皮毛不仅具有保护功能,还影响了果实的商品性质,研究表明黄瓜的表皮毛为多细胞、无分支表皮毛,果实上的果刺与叶片上的表皮毛形态结构一样,均为多细胞无腺体的表皮毛,茎叶上的表皮毛是由4-9个长形细胞组成,纵状排列成杆状,基部的细胞膨大,顶端细胞呈杆状,细胞壁角质化,质地硬而脆。黄瓜植株茎、叶、卷须、花萼、子房表面均覆有表皮毛,多数黄瓜品种子房表面有刺瘤,刺瘤随着果实发育膨大而随之长大。
模式植物拟南芥表皮毛遍布于叶片、萼片、叶柄和茎,无腺体,是典型的单细胞表皮毛。一般长为200-500μm,3-5个分支。在不同的器官上,表皮毛的形态和密度有很大差异,莲座叶表皮毛有3–4个分支,而茎生叶表皮毛的分支数较少,茎上的表皮毛没有分支。拟南芥表皮毛虽然不分泌化学物质,但可以阻碍草食动物的侵害。拟南芥表皮毛的发育过程可作为一种很好的模式系统来研究细胞命运决定、细胞周期调控、细胞极性以及细胞增大等细胞分化方面的问题。近几年,对其发育的分子机制研究取得了很大进展。
目前对拟南芥表皮毛发育的研究主要集中在莲座叶上的表皮毛,它们由新叶基部快速分裂的原表皮细胞发育而来。建立在形态学标准基础上,拟南芥表皮毛发育可分为6个阶段。阶段1:起始阶段,一个定向的表皮细胞相对于周围的表皮细胞快速膨胀,细胞核进行核内复制。阶段2:当表皮毛前期细胞扩展到比周围细胞直径大2–3倍时,开始出现垂直于表皮细胞层面的凸起,产生了表皮毛细胞的杆状结构。阶段3:随后,正在生长的细胞顶端发育出细胞增大的共轭焦点,表皮毛分支开始发生。拟南芥叶表皮毛根据地理品系一般会形成2–4个分支。分支的方向与叶片基部到顶部轴向相互对齐,且分支间的角度非常规则。阶段4:在所有分支发生后,细胞通过弥散性生长继续增大,这样该细胞在直径和高度上就会有所增大。起初,正在生长的表皮毛分支是钝的。阶段5:随后,顶端逐渐变尖。阶段6:在细胞增大 停止后,表皮毛细胞表面形成数量不等的乳突,周围由一圈表皮支持细胞围绕。表皮毛在经历了这6个阶段的发育过程后,其形状、大小、空间排布发生了根本性变化,暗示这个过程的完成需要大量基因的参与。大量在表皮毛发育方面有缺陷的拟南芥突变体已经被分离出来。根据基因突变影响表皮毛发育的时期来进行分类,可以将突变体分成5类。第1类与表皮毛发育起始相关,表现为表皮毛数量的增多或减少;第2类与核内复制的调控异常相关,这些异常包括核内复制周期数目的变化以及从有丝分裂到核内复制的转变模式的变化;第3类突变体的表现为表皮毛分支数的增多或减少;第4类突变体与表皮毛伸展方位相关,表现为表皮毛无序生长;第5类突变体表现为表皮毛的成熟模式异常。
目前研究较多的表皮毛分支调控基因有AN、NOK、STI、FRC、TFCA、TFCC和ZWI。近年来,NOK基因被确定为MYB6基因,一种MIXTA-like类转录因子,在控制拟南芥表皮毛分支的生成中起到了重要作用。有研究表明微管和微丝在表皮毛分支形成过程中起到了重要作用,微管参与表皮毛突起形成的起始和定位,微丝参与接下来的突起延长过程。
Sharon Regan等发现在拟南芥中控制表皮毛分支的MYB6基因在杨树中的同源基因PtaMYB186参与了杨树表皮毛的起始发育过程。35S::PtaMYB186植株叶片表皮毛数量大量增多,同时转基因植株的生长势和对食草性昆虫的抵抗性也有很大的提高。这说明了参与拟南芥表皮毛分支形成的基因在无表皮毛分支的作物中发挥着同样重要的作用。近年来研究表明棉花表皮毛的形态建成可能由GhMYB25基因调控,GhMYB25也是一个R2R3MYB类基因,一种MIXTA-like转录因子,在棉纤维细胞发育的早期表达活跃。在GL1基因启动子的调控下,GhMYB25的过表达载体在gl1拟南芥突变体中可以产生完整的表皮毛;同时35S::GhMYB25拟南芥植株的种子上分化出了表皮毛, GhMYB25包含可以与bHLH互作的保守氨基酸序列,暗示它可能通过与bHLH类蛋白互作来调控纤维细胞的分化。在陆地棉中,GhMYB109也在发育的纤维中表达,也包含与bHLH互作的保守氨基酸序列;已克隆了两个编码WD-repeat蛋白的基因,这两个基因的表达可以互补拟南芥ttg1突变体。这些研究结果表明在拟南芥和棉花中可能存在相似的表皮毛形成机制。与单细胞表皮毛相比,多细胞表皮毛的形成机制可能更为复杂,还需要在更多的其它植物种类中研究分析表皮毛形成的机制。目前尚未发现与黄瓜MYB6基因研究的相关报道。
技术实现要素:
本发明的目的是提供黄瓜CsMYB6基因在调控植物表皮毛及果刺发育中的应用。
为了实现本发明目的,本发明提供黄瓜CsMYB6基因在调控植物表皮毛及果刺发育中的应用,其中所述黄瓜CsMYB6基因的核苷酸序列为:
i)Seq ID No.1所示的核苷酸序列;
ii)在严格条件下与Seq ID No.1所示序列杂交且表达相同功能蛋白质的核苷酸序列;或
iii)与i)或ii)的核苷酸序列具有90%以上同源性且表达相同功能蛋白质的核苷酸序列;
所述严格条件为在含0.1%SDS的0.1×SSPE或含0.1%SDS的0.1×SSC溶液中,在65℃下杂交,并用该溶液洗膜。
前述的应用,所述植物为双子叶植物。优选地,所述双子叶植物为拟南芥、黄瓜。
前述的应用包括将黄瓜CsMYB6基因转入目的植物中,得到与所述目的植物相比,表皮毛及果刺发育受抑制的转基因植物。所述表皮毛发育受抑制体现为与目的植物相比,所述转基因拟南芥的叶片表皮毛数和分支数减少,转基因黄瓜果刺数目减少。
前述应用具体为:在目的植物中过表达所述黄瓜CsMYB6基因,使转基因植物的表皮毛及果刺数目减少。
优选地,过表达使用的表达载体为pBI121。
本发明进一步提供一种黄瓜品质改良的方法,构建黄瓜CsMYB6基因的重组过表达载体,并采用农杆菌介导的方法,将构建的重组过表达载体转入黄瓜中,获得品质改良的(无刺型)转基因黄瓜。
前述的方法,将黄瓜CsMYB6基因插入载体pBI121的多克隆位点间,即构建得到重组过表达载体CsMYB6-pBI121。
本发明通过构建与表皮毛发育相关的基因CsMYB6的过表达载体,并将其转入拟南芥野生型和拟南芥MYB6基因突变体中,证明异源CsMYB6的过量表达可引起拟南芥叶片表皮毛数量及表皮毛分支数目的大量减少。这表明CsMYB6基因可能与拟南芥MYB6基因具有部分相同的功能,抑制了表皮毛分支的形成,并且不同于拟南芥MYB6,CsMYB6基因同时抑制拟南芥表皮毛和黄瓜果刺的形成,本发明首次验证了黄瓜CsMYB6基因的功能,对于黄瓜品质的改良具有重要作用。
附图说明
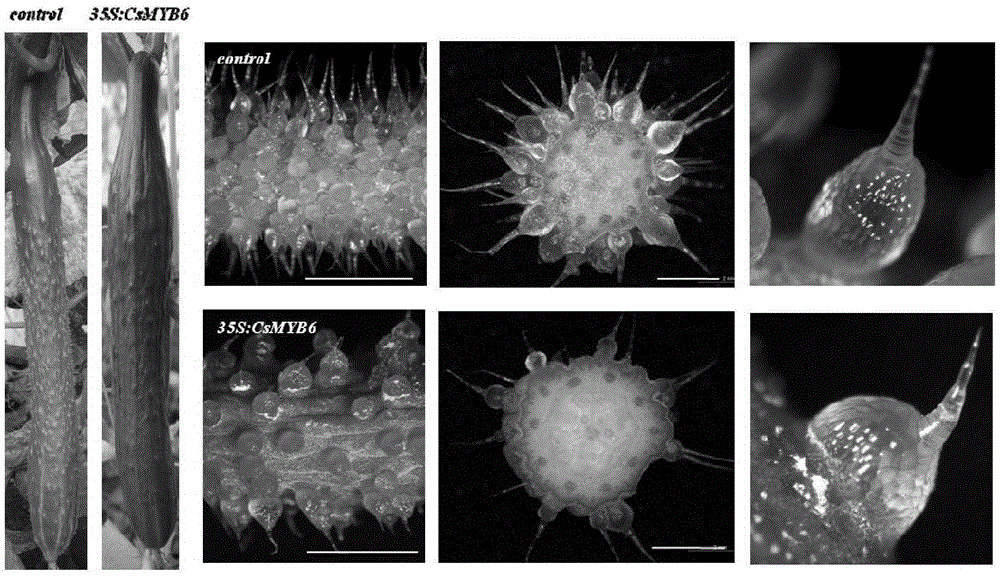
图1为本发明实施例2中过表达转基因CsMYB6黄瓜株系的表型。
图2为本发明实施例2中过表达转基因CsMYB6黄瓜株系Line1、2和3的黄瓜开花当天果实横切面上果刺数目统计结果。
图3为本发明实施例2中过表达转基因CsMYB6拟南芥株系的表型;其中,Col代表野生型拟南芥,myb6代表拟南芥myb6突变体,35S:CsMYB6::myb6代表CsMYB6异源转化拟南芥myb6突变体的转基因植株,35S:CsMYB6::Col代表CsMYB6异源转化野生型拟南芥的转基因植株。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如Sambrook等分子克隆实验 手册(Sambrook J&Russell DW,Molecular cloning:a laboratory manual,2001),或按照制造厂商说明书建议的条件。
实施例1黄瓜CsMYB6基因的克隆
1.1材料
以黄瓜3407(由中国农业大学农学与生物技术学院提供)为试材,该品种表皮毛明显、刺瘤密集。将黄瓜种子播于日光温室中,进行普通的栽培管理,待植株开始结瓜时,取雌花芽液氮速冻,存于-80℃冰箱保存,备用。
1.2总RNA的提取与cDNA合成
1.2.1总RNA的提取
采用柱式植物RNAout试剂盒(购自北京天恩泽基因科技有限公司,产品目录号为71203)提取黄瓜果实的总RNA,并用DNase去除RNA样品中残留的DNA。步骤如下:
(1)在研钵中加入约200mg黄瓜果实,加入液氮研磨至粉末状。将研磨物转移至干净无RNA酶的1.5ml塑料离心管,加入1ml细胞裂解液(试剂盒自带),充分振荡混匀。
(2)在离心管中加入300μl的去蛋白液(试剂盒自带)和200μl自备氯仿,在振荡器上振荡30秒混匀,此时溶液呈均匀的乳浊状。振荡器振荡时必须使管底溶液震荡起来。室温12000rpm离心3-5min,两相间有约5-10mm厚的细胞破碎物。
(3)将上清液(约600μl)转移到另一干净的1.5ml塑料离心管中,下层有机相和中间层含有DNA、蛋白质和其他杂质,避免触及或吸取。最好留下100μL上清液不取。加入等体积的漂洗液,充分颠倒混匀。将一半的溶液转移到离心吸附柱中,12000rpm室温离心1min,弃穿透液。
(4)将剩下的一半溶液转移到同一离心吸附柱中,12000rpm室温离心1min,弃穿透液。
(5)加700μl通用洗柱液,12000rpm室温离心1min,弃穿透液。加300μl通用洗柱液,12000rpm室温离心1min,弃穿透液。12000rpm室温离心1min。此步十分重要,否则残留的乙醇会影响RNA的使用。往吸附柱的中央加入50μl DNAase反应液,室温静置10-15min,加入500μl通用洗柱液,12000rpm室温离心1min,弃穿透液。12000rpm室温离心1min。
(6)将离心吸附柱转移到RNase-free收集管中,加入50μl RNA洗脱液,室温放置1-2min。12000rpm室温离心1min,离心管中溶液即为RNA样品,存放于-80℃待用。
1.2.2cDNA第一链的合成
以1μg黄瓜果实RNA为模板,利用RTase合成cDNA第一链。反转录操作参照试剂盒说明进行[试剂盒名称:1st Strand cDNA Synthesis Kit(50次量);北京六合通经贸有限公司;产品目录号:D6110A]。
cDNA第一链合成后于-20℃保存备用。
1.3黄瓜CsMYB6基因的克隆
对黄瓜的一对野生型和突变体材料进行转录组测序,根据测序结果的分析和基因的注释,选择其中的一个候选基因进行研究,暂命名为CsMYB6基因,根据CsMYB6的基因ID(Csa3M824850)在黄瓜基因组数据库(http://cucumber.genomics.org.cn/page/cucumber/index.jsp)中找到该基因的CDS序列,根据其CDS全长序列设计引物:
正向引物:5’-ATGGGAAGGTCTCCTTACTGCG-3’(Seq ID No.3)
反向引物:5’-TCAGAATCTCAGGAATTCACCAAGA-3’(Seq ID No.4)
以cDNA为模板,利用上述正、反向引物,通过PCR扩增获得黄瓜CsMYB6基因。黄瓜CsMYB6基因的核苷酸序列如Seq ID No.1所示, 其编码蛋白的氨基酸序列如Seq ID No.2所示。
PCR扩增反应体系:5U/μl Taq DNA聚合酶(TaKaRa)0.25μl,10×PCR反应缓冲液(Mg2+Plus)5μl,dNTP Mixture(各2.5mM)4μl,模板DNA 2.5ng,20μM正、反向引物各1μl,灭菌蒸馏水补足至总体积50μl。
PCR扩增程序:95℃3min;95℃10sec,54℃30sec,72℃60sec,共30个循环;72℃5min。
1.4载体构建
1.4.1重组过表达载体的构建
使用的表达载体为pBI121,选用酶切位点为XbaI和SmaI。在目的基因的ORF区两端设计引物,并在引物(Seq ID No.3和4)5'端加上相应的酶切位点和保护碱基,以黄瓜cDNA为模板进行PCR扩增。
PCR扩增反应体系:5U/μl Taq DNA聚合酶(TaKaRa)0.25μl,10×PCR反应缓冲液(Mg2+Plus)5μl,dNTP Mixture(各2.5mM)4μl,模板DNA 2.5ng,20μM正、反向引物各1μl,灭菌蒸馏水补足至总体积50μl。
PCR扩增程序:95℃3min;95℃10sec,54℃30sec,72℃60sec,共30个循环;72℃5min。
回收PCR扩增产物,与载体pBI121分别用特异的限制性内切酶酶切,酶切反应体系为:10×NEB缓冲液2:4.0μl;PCR产物或载体:1μg;酶XbaI:2.0μl;酶SmaI:2.0μl;ddH2O补足至50μl。37℃酶切过夜。凝胶回收酶切产物,然后用T4连接酶连接,转化大肠杆菌DH5α,PCR鉴定后的阳性菌液送深圳华大基因科技有限公司测序,测序正确则成功构建重组过表达载体,命名为CsMYB6-pBI121(即35S:CsMYB6)。提取质粒备用。
1.5农杆菌转化
重组过表达载体CsMYB6-pBI121转化农杆菌,将电转仪打开预热 同时预冷电转杯若干。将80μl的农杆菌感受态细胞置于冰上融化,加入1-2μl构建好的重组质粒CsMYB6-PBI121,轻弹混匀,转移到电转杯的底部。将电转杯放在电转仪的座上,电击。快速加1ml不含抗生素的液体YEB培养基至电转杯中,轻柔吹打悬浮细胞。将细胞吸出至Eppendorf管中,28℃缓慢振荡培养1h。吸取100μl菌液加到含有卡那和利福平的YEB固体培养基上,用无菌的弯头玻棒轻轻的将细胞均匀涂开,室温放置待平板表面干燥后,用封口膜封好平板。倒置平板,28℃培养36-48hr。PCR鉴定筛选阳性菌,PCR鉴定所用的引物为:
正向引物:5’-ATGGGAAGGTCTCCTTACTGCG-3’(Seq ID No.5)
反向引物:5’-TCAGAATCTCAGGAATTCACCAAGA-3’(Seq ID No.6)
结果获得了含有702bp的目的片段的阳性农杆菌。
实施例2CsMYB6基因过表达载体转化拟南芥和黄瓜
2.1转基因拟南芥的获得
(1)所用拟南芥材料为野生型Col和拟南芥myb6突变体49c(购自ABRC,产品目录号为CS28169和SALK_025449)。种子消毒后播于MS固体培养基上,4℃处理2天后放入人工气候室,培养条件为:16hr光照/8hr黑暗,恒温22℃。
(2)拟南芥转化
将含有目的载体的阳性农杆菌接种于含有卡那霉素和利福平的YEB液体培养基(Kan:50μg/mL;Rif:50μg/mL)中,28℃振荡培养过夜至OD600=1.0-2.0。4000rpm室温离心15min,收集菌体。用200mL MS盐溶液(1/2MS,5%蔗糖,200μL/L Silwet L-77)悬浮菌体。将拟南芥植株倒置,使花序浸入农杆菌转化液中5s,重复两次。将浸染过的植株直立放置于托盘中,用黑色不透明的塑料袋盖住以保持湿度。24hr后移走塑料袋,继续培养至收获T0代种子。
同时,设未转化的Col为野生型对照拟南芥植株。
(3)转基因拟南芥植株的PCR检测
配制Kan终浓度为20μg/ml的MS筛选培养基。收获转化植株的T0代种子,消毒后播种于MS筛选培养基上,4℃春化处理两天后转移到光照培养箱中于16hr光照/8hr黑暗,恒温22℃条件下进行培养。两周后选取在筛选培养基上能正常生长的阳性植株,移入穴盘中继续培养。拟南芥抽薹后,取转化株T0代(3个株系)莲座叶,分别以拟南芥植株、野生型对照拟南芥植株的莲座叶的cDNA为模板,设计如下引物:
上游引物:5′-CCAAAGCCGGTCTTGAGAGA-3′(Seq ID No.7)
下游引物:5′-GCTATGGCAGACCACCTGTT-3′(Seq ID No.8)
扩增CsMYB6的全长CDS序列。获得转基因植株后,参考对照植株,观察转CsMYB6基因植株表型发现转化植株叶片表皮毛数目和分支数目明显减少(表1)。
表1 35S:CsMYB6转化拟南芥T2代叶片表皮毛数量统计
2.2转基因黄瓜的获得
(1)选饱满完整的黄瓜种子,剥去种壳,先在75%酒精中消毒30s,再置于3.0%次氯酸钠溶液中杀菌15min,无菌水冲洗数遍以后播在MS培养基上,待其子叶萌发后进行下步实验(约2天)。
(2)制备活化的农杆菌。
(3)取黄瓜种子的幼嫩子叶,去除生长点后每片子叶分成均匀的2 块,只保留靠近生长点的一半。将切好的黄瓜子叶浸入菌液15分钟;然后用灭菌的滤纸吸干多余菌液,接入MS分化培养基;弱光下或暗处,28℃共培养两天。
(4)共培养后的外植体转入含有卡那霉素50mg/L、羧苄青霉素500mg/L的MS分化培养基上,恒温培养(25℃,光照时间14h/d,光照强度2000LX)。
(5)约15-20d,待抗性芽长至1cm左右时,将其切下移入MS培养基(含卡那霉素100mg/L,羧苄青霉素200mg/L)中诱导生根,获得抗性植株。
(6)待转基因黄瓜根系发育好后,移入盛有无菌土的花盆中,温室常规管理。
(7)转基因黄瓜植株的PCR检测和荧光定量PCR检测。对所有转基因的黄瓜植株取雌花芽进行RNA提取及cDNA第一条链的合成,同实施例1的描述。荧光定量PCR分析所用试剂盒为SYBR Premix Ex Taq(TaKara,DRR041S),荧光定量PCR仪为ABI 7500,设计如下引物:
CsMYB6-F:5′-CCAAAGCCGGTCTTGAGAGA-3′(Seq ID No.9)
CsMYB6-R:5′-GCTATGGCAGACCACCTGTT-3′(Seq ID No.10)
荧光定量PCR的反应体系为:
扩增程序为:95℃,30sec;95℃,5sec;60℃,40sec,40个循环。以 ACTIN基因为内参,利用2-△△Ct算法计算各基因表达量变化。
结果:获得6株过表达植株,CsMYB6基因表达量均明显高于对照。
2.3过表达基因CsMYB6植株的表型检测
待上述转CsMYB6基因黄瓜植株、转空载体对照植株及野生型对照植株长至结果期时,取不同发育阶段的果实进行观察其表型,结果如图1所示,CsMYB6基因过表达的转基因株系黄瓜果实上的果刺的数量明显比转空载体的对照植株要少。统计过表达转基因黄瓜株系Line1、2的黄瓜开花当天果实横切面上果刺数目,结果如图2所示。
转基因CsMYB6拟南芥与对照野生型拟南芥的表型如图3所示。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献
Sharon Regan,Endogenous overexpression of Populus MYB186increases trichome density,improves insect pest resistance,and impacts plant growth.The Plant Journal,2010,64,419–432
Adriane Machado,The MYB transcription factor GhMYB25regulates early fibre and trichome development.The Plant Journal.2009,59,52–62
- 还没有人留言评论。精彩留言会获得点赞!