牙源性干细胞和基因修饰的牙源性干细胞的用途的制作方法
本发明涉及牙源性干细胞(牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞、根尖牙乳头干细胞)和基因修饰的牙源性干细胞的用途,特别是牙源性干细胞和基因修饰的牙源性干细胞在制备用于治疗牙周病、修复多种原因(例如牙周病)引起的牙周骨组织及软组织缺损和/或促进牙周组织再生的产品中的用途,以及在制备用于治疗急、慢性骨组织损伤(例如骨折)或骨组织缺损的产品中的用途。本发明还涉及基因修饰的牙源性干细胞,以及包含牙源性干细胞和/或基因修饰的牙源性干细胞的组合物。
背景技术:
牙周病是口腔临床的常见病,是以牙周组织(包括牙周膜、牙骨质、牙槽骨和牙龈)的破坏为主要特征的感染性疾病,临床的主要表现为牙龈炎症和出血、牙周袋的形成、牙槽骨吸收及牙齿松动、移位直至丧失。牙周疾病不仅是牙齿丧失的主要原因,而且与某些全身系统性疾病的发生有关。牙周疾病在人群中普遍存在,其中牙龈炎在儿童和青少年中的患病率达70%~90%,慢性牙周炎达60%以上,侵袭性牙周炎为5%~15%,而且牙周炎占拔牙原因的30%~44%。一旦牙周附着和牙槽骨的破坏已经发生,最理想的方式是完整地重建健康的牙周组织。目前,临床常采用的牙周炎治疗方法包括:牙周基础治疗(洁治、刮治、根面平整)、牙周翻瓣术及牙周组织再生术。牙周组织再生国内外最新的研究方法有:(1)引导性组织再生术(guided tissue regeneration,GTR):将可吸收或不可吸收的生物膜或钛膜置于牙周组织缺损处,以避免上皮组织长入牙周缺损内,牙周缺损内可置入充填材料、人工骨、载体或牙周再生诱导因子等。(2)组织工程牙周组织再生技术,其中,种子细胞的获取是研究的热点。目前发现的与牙齿相关的干细胞主要包括:牙髓干细胞(dental pulp stem cells,DPSC)、脱落乳牙牙髓干细胞(stem cells from human exfoliated deciduous teeth,SHED)、牙周膜干细胞(stem cells from the periodontal ligament,PDLSCs)、根尖牙乳头干细胞(stem cells from dental apical papilla,SCAP)。对这些细胞的深入研究,不仅对牙齿的发生、发育有积极作用,而且可能成为牙齿组织工程种子细胞的来源。
技术实现要素:
本发明的发明人经过大量实验,令人惊奇地发现不同来源的牙源性干细胞可用于修复多种原因(例如牙周病)引起的牙周骨组织及软组织缺损和用于促进牙周组织再生,同时令人惊奇地发现不同来源的牙源性干细胞还可用于修复牙周骨之外的其它全身骨组织损伤,并且进一步证明了经过基因修饰的牙源性干细胞、特别是肝细胞生长因子(HGF)基因修饰的干细胞具有更好的治疗效果。
本发明第一方面涉及牙源性干细胞在制备用于预防和/或治疗牙周病、修复牙周病引起的牙周骨组织或软组织缺损和/或促进牙周组织再生的产品中的用途。
本发明第二方面涉及牙源性干细胞在制备用于预防和/或治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复的产品中的用途。
根据本发明第一方面或第二方面任一项的用途,其中所述的牙源性干细胞选自牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞和根尖牙乳头干细胞中的至少一种,例如两种。
在本发明的一个实施方案中,所述牙源性干细胞为牙髓干细胞。
在本发明的另一个实施方案中,所述牙源性干细胞包括牙髓干细胞和牙周膜干细胞。
本发明的第三方面涉及基因修饰的牙源性干细胞,其特征在于该牙源性干细胞表达外源肝细胞生长因子。
根据本发明第三方面任一项的牙源性干细胞,其中所述的牙源性干细胞选自牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞和根尖牙乳头干细胞中的至少一种,例如两种。
在本发明的一个实施方案中,所述牙源性干细胞为牙髓干细胞。
在本发明的另一个实施方案中,所述牙源性干细胞包括牙髓干细胞和牙周膜干细胞。
根据本发明第三方面任一项的牙源性干细胞,通过将外源肝细胞生长因子基因导入牙源性干细胞,使其表达外源肝细胞生长因子。
根据本发明第三方面任一项的牙源性干细胞,其通过腺病毒或腺相关病毒载体将外源肝细胞生长因子基因导入牙源性干细胞。
本发明第四方面涉及本发明第三方面任一项所述的牙源性干细胞在制备用于预防和/或治疗牙周病、修复牙周病引起的牙周骨组织或软组织缺损和/或促进牙周组织再生的产品中的用途。
本发明第五方面涉及本发明第三方面任一项所述的牙源性干细胞在制备用于预防和/或治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复的产品中的用途。
本发明还涉及组合物,其包含有效量的牙源性干细胞以及任选的药学上可接受的载体或赋形剂,所述组合物用于预防和/或治疗牙周病、修复牙周病引起的牙周骨组织或软组织缺损和/或促进牙周组织再生,或者用于预防和/或治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复。
在本发明的一个实施方案中,所述组合物为包含牙源性干细胞的细胞悬液。
优选地,所述的牙源性干细胞选自牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞和根尖牙乳头干细胞中的至少一种,例如两种。
在本发明的一个实施方案中,所述牙源性干细胞为牙髓干细胞。
在本发明的另一个实施方案中,所述牙源性干细胞包括牙髓干细胞和牙周膜干细胞。
本发明还涉及组合物,其包含有效量的本发明第三方面任一项的牙源性干细胞以及任选的药学上可接受的载体或赋形剂。
在本发明的一个实施方案中,所述组合物为包含本发明第三方面任一项的牙源性干细胞的细胞悬液。
本发明还涉及本发明的组合物在制备用于预防和/或治疗牙周病、修复牙周病引起的牙周骨组织或软组织缺损和/或促进牙周组织再生的产品中的用途。
本发明还涉及本发明的组合物在制备用于预防和/或治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复的产品中的用途。
本发明还涉及肝细胞生长因子在制备用于治疗牙周病、修复牙周病引起的牙周骨组织或软组织缺损和/或促进牙周组织再生、或者用于治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复的产品中的用途。
本发明还涉及一种预防和/或治疗牙周病、修复牙周骨组织或软组织缺损和/或促进牙周组织再生的方法,所述方法包括给予有需要的受试者治疗有效量的牙源性干细胞、本发明第三方面任一项所述的基因修饰的牙源性干细胞或本发明任一项的组合物。
本发明还涉及一种预防和/或治疗急、慢性骨组织损伤、骨组织缺损、促进骨组织修复的方法,所述方法包括给予有需要的受试者治疗有效量的牙源性干细胞、本发明第三方面任一项所述的基因修饰的牙源性干细胞或本发明任一项的组合物。
在本发明的实施方案中,其中所述牙源性干细胞选自牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞和根尖牙乳头干细胞中的至少一种,例如两种。
在本发明的一个实施方案中,以细胞悬液注射的方式用于上述治疗。
本发明还涉及牙源性干细胞,其用于预防和/或治疗牙周病、修复牙周骨组织或软组织缺损和/或促进牙周组织再生,或者用于预防和/或治疗急、慢性骨组织损伤、骨组织缺损、促进骨组织修复。
在本发明的实施方案中,其中所述牙源性干细胞选自牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞和根尖牙乳头干细胞中的至少一种,例如两种。
本发明还涉及本发明第三方面任一项的牙源性干细胞,其用于预防和/或治疗牙周病、修复牙周骨组织或软组织缺损和/或促进牙周组织再生,或者用于预防和/或治疗急、慢性骨组织损伤、骨组织缺损、促进骨组织修复。
在本发明的实施方案中,其中所述牙源性干细胞选自牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞和根尖牙乳头干细胞中的至少一种,例如两种。
以下进一步详述本发明。
本发明首先证实了不同来源的牙源性干细胞对牙周骨组织及软组织缺损和牙周组织再生的治疗作用,因此本发明第一方面涉及牙源性干细胞在制备用于治疗牙周病、修复牙周病引起的牙周骨组织或软组织缺损和/或促进牙周组织再生的产品中的用途。
本发明首先从不同组织(例如牙髓、牙周膜、根尖牙乳头)中分离培养牙源性干细胞,并对得到的牙源性干细胞分别进行细胞表面标志检测和成骨、成脂肪诱导分化,证明为间充质干细胞。接着将得到的牙源性干细胞制成细胞悬液,并用实验证明了不同来源的牙源性干细胞对牙周骨组织及软组织缺损和牙周组织再生具有较好的治疗作用。
同时,本发明还证实除了牙周骨外,不同来源的牙源性干细胞还可用于全身其它骨组织损伤的修复,因此本发明第二方面涉及牙源性干细胞在制备用于治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复的产品中的用途。
本发明还涉及包括有效量的牙源性干细胞的组合物,所述组合物用于治疗牙周病、修复牙周病引起的牙周骨组织或软组织缺损和/或用于促进牙周组织再生,或者用于治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复。
同时,发明人也发现,牙源性干细胞局部应用治疗牙周病也存在一定的局限性,因为细胞植入体内后脱离了特殊的培养环境,只能通过微循环渗透方式摄取营养,而营养所及范围仅在100-200μm之间。因此,90%以上的细胞在植入的几天内因营养缺乏而很快死亡,细胞并不能很好发挥其抗炎、抗凋亡、促增殖等功能。
肝细胞生长因子(Hepatocyte Growth Factor,HGF)是一种多功能的生长因子,它在体内参与并主导促血管生成、抑制纤维化、抑制细胞凋亡和抗炎等病理生理学过程。本发明发现,在牙周组织修复过程中HGF具有以下几方面的生理作用:(1)抑制炎症因子的表达:如可溶性细胞间粘附分子-1(sICAM-1)等;(2)抑制细胞凋亡:通过激活PI3K/Akt信号途径、SPK-S1P信号途径等来发挥其抗凋亡作用;(3)促进血管生成:通过促进血管内皮细胞增殖及血管生成增加血液灌流,改善局部的血液供应与低氧发生。但HGF蛋白结构复杂,体内代谢快,为了获得HGF在损伤局部的高浓度就需要持续大剂量给予重组蛋白。因此,采用基因治疗策略,用携带HGF的重组腺病毒修饰的牙源性干细胞治疗牙周病或全身其它骨组织损伤,具有干细胞治疗和细胞生长因子治疗的双重优势,并发挥协同作用。一方面通过局部注射,牙源性干细胞大部分蓄留或归巢于损伤的牙周组织或其它骨组织,在发挥干细胞修复作用的同时,使局部高表达HGF,同时发挥HGF的生物学作用;而高表达HGF又可以促进牙源性干细胞的存活和增殖,从而加强牙源性干细胞的治疗效果。
因此本发明的第三方面涉及基因修饰的牙源性干细胞,其特征在于该牙源性干细胞表达外源肝细胞生长因子。在本发明的实施方案中,所述肝细胞生长因子表达是指分泌到细胞外的分泌表达。在本发明的实施方案中,通过将外源肝细胞生长因子的基因导入牙源性干细胞,使其表达外源肝细胞生长因子。
其中所述将外源肝细胞生长因子基因导入牙源性干细胞的方法为本领域常用的外源基因导入细胞的方法,例如可以为病毒转染、质粒转染和脂质体转染等。在本发明的一个实施方案中,所述将外源基因导入牙源性干细胞的方法为病毒转染的方法,例如为腺病毒或腺相关病毒转染。在本发明的一个实施方案中,所述病毒为腺病毒。
在本发明的一个实施方案中,所述的HGF为人肝细胞生长因子,其基因序列记载于Miyazawa K等,Molecular cloning and sequence analysis of cDNA for human hepatocyte growth fator.Biochem Biophys Res Commun,1989,163(2):967-973。
本发明所述的HGF修饰的牙源性干细胞制备方法为:
分离、纯化牙源性干细胞(例如牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞、根尖牙乳头干细胞),体外培养至第3代,用肝细胞生长因子对牙源性干细胞进行修饰(例如采用携带人肝细胞生长因子基因的重组腺病毒(Ad-HGF)进行修饰)。修饰后24-48小时,即可收集细胞悬液用于注射治疗。
实验证明,HGF修饰的牙源性干细胞可以归巢到损伤牙周组织或其它骨组织的局部,并表达HGF。HGF不但能够发挥抗炎、促进血管生成等生物学效应,还能促进移植的牙源性干细胞的存活和增殖;而牙源性干细胞则能够发挥其免疫调节作用,减轻损伤局部的炎症。在HGF和MSC的联合作用下,可有效减轻牙周组织损伤,促进牙周组织或其它骨组织再生,从而达到治疗目的。
因此本发明还涉及本发明第三方面任一项所述的基因修饰的牙源性干细胞在制备用于治疗牙周病、修复牙周病引起的牙周骨组织或软组织缺损和/或促进牙周组织再生、治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复的产品中的用途。
本发明还涉及组合物,其包含有效量的牙源性干细胞或者本发明第三方面任一项所述的基因修饰的牙源性干细胞。
在本发明的一个实施方案中,所述基因修饰的牙源性干细胞是指用HGF修饰的牙源性干细胞,即通过导入HGF基因而大量表达HGF的牙源性干细胞。
在本发明的一个实施方案中,所述组合物用于治疗牙周病、修复牙周病引起的牙周骨组织及软组织缺损和/或用于促进牙周组织再生,或者用于治疗急、慢性骨组织损伤(例如骨折)、骨组织缺损或促进骨组织修复。
在本发明的一个实施方案中,采用牙源性干细胞或HGF修饰的牙源性干细胞治疗牙周骨缺损的方法是:
于小型猪下颌第一磨牙建立实验性牙周炎模型后,于骨缺损区注射牙源性干细胞或HGF修饰的牙源性干细胞悬液。临床检查(包括龈沟出血指数、牙周袋深度、临床附着丧失)和影像学、组织学等指标来评价治疗效果。
在本发明的一个实施方案中,采用牙源性干细胞或HGF修饰的牙源性干细胞治疗急、慢性骨组织损伤、骨组织缺损、促进骨组织修复的方法是:
建立小鼠股骨干骨折模型,于骨折局部注射牙源性干细胞或HGF修饰的牙源性干细胞悬液,通过影像学来评价治疗效果。
因此本发明还涉及一种治疗牙周病、修复牙周骨组织或软组织缺损和/或牙周组织再生、或治疗急、慢性骨组织损伤、骨组织缺损、促进骨组织修复的方法,所述方法包括给予有需要的受试者治疗有效量的牙源性干细胞或本发明第三方面任一项所述的基因修饰的牙源性干细胞。在本发明的实施方案中,其中所述牙源性干细胞选自牙髓干细胞、脱落乳牙牙髓干细胞、牙周膜干细胞和根尖牙乳头干细胞中的至少一种,例如两种。在本发明的一个实施方案中,以细胞悬液注射的方式用于上述治疗。
在本发明中,所述的牙源性干细胞属于间充质干细胞,所述间充质干细胞是指来源于发育早期的中胚层和外胚层的一类干细胞,具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点。不表达造血干细胞系的表面标志如CD14、CD31、CD34、CD45等及白细胞分化抗原HLA-DR,但表达CD29、CD44、CD90、CD105、CD166、CD73等表面标志。
在本发明中,所述牙源性干细胞来源于哺乳动物,在本发明的一个实施方案中,所述的牙源性干细胞来自选自以下的哺乳动物:人、猪(例如五指山小型猪、贵州香猪)、牛、马、猴、大鼠、小鼠、豚鼠、羊、绵羊、山羊。
在本发明中,所述基因修饰的牙源性干细胞是指将外源肝细胞生长因子基因导入牙源性干细胞后,外源肝细胞生长因子基因得以表达的牙源性干细胞。
在本发明中,所述用于治疗牙周病、修复牙周骨组织或软组织缺损和/或促进牙周组织再生、或治疗急、慢性骨组织损伤、骨组织缺损、促进骨组织修复是指用于自体或异体的疾病的治疗或组织再生。
在本发明中,所述牙周病主要包括牙龈炎和牙周炎两大类,前者只发生在牙龈组织,而后者则是累及四种牙周支持组织(牙龈、牙周膜、牙槽骨和牙骨质)的慢性感染性疾病,往往引发牙周支持组织的炎性破坏,其主要临床表现是牙龈炎症、出血、牙周袋形成、牙槽骨吸收、牙槽骨高度降低、牙齿松动、移位、咀嚼无力,严重者导致牙齿的拔除或者牙齿的自行脱落。
在本发明中,所述牙周组织即指牙周支持组织,包括牙龈、牙周膜、牙槽骨和牙骨质。
在本发明中,所述牙周骨组织包括牙槽骨和牙骨质。
在本发明中,所述牙周软组织包括牙龈和牙周膜。
在本发明中,所述牙周骨组织及软组织缺损包括慢性牙周炎、侵袭性牙周炎、坏死性和溃疡性牙周病损伤所致的骨缺损及软组织缺损等。
在本发明中,所述骨组织也称为骨,组成人体的支撑系统,主要由骨质、骨膜和骨髓组成,按形态可分为长骨、短骨、扁骨、不规则骨和混合骨。
在本发明中,所述骨组织缺损是指骨的结构完整性被破坏,其中创伤、感染、肿瘤、骨髓炎手术清创、以及各种先天性疾病是导致骨缺损的主要原因。
在本发明的实施方案中,所述骨组织损伤是指骨折。在本发明中,所述未修饰是指未经HGF修饰,即未将外源HGF导入细胞。
在本发明中,术语“产品”是指适于牙源性干细胞应用的各种形式,例如药物、组合物、药物组合物等。
在本发明中,术语“组合物”是具有本领域技术人员通常理解的含义,并且通常是指可直接或间接(例如临用前稀释)用于临床使用的形式,例如剂型、药物剂型、给药形式等。在临床应用领域或者药物领域,术语“组合物”还通常与“药物组合物”具有同等含义。
可改变本发明组合物或药物组合物中牙源性干细胞的实际剂量水平,以便所得的干细胞量能有效针对具体宿主、患者在特定组合物及其组成以及相应给药方式的情况下得到所需的治疗或预防反应。剂量水平须根据具体干细胞的活性、给药途径、所治疗病况的严重程度、疾病或病情的治疗进程、形成和修复(以及生成、再生、培养等)处理或操作的进程、以及待治疗患者的病况和既往病史来选定。但是,本领域的做法是,干细胞的剂量以及施用时间从低于为得到所需治疗效果而要求的水平开始,逐渐增加剂量,直到得到所需的效果。因此,就本发明而言,本领域技术人员在本发明详细公开的信息的教导下,可以根据例如但不限于上述的具体情况来确定在具体情况下所适用的具体剂量,而无需要作具体限定。特别是,可以参考本发明实施例部分中所用的具体量来确定任一情况下的使用量。
本发明牙源性干细胞可以单独(即以原样形式)或以药物组合物的形式给药。本发明药物组合物可根据给药途径配成各种适宜的剂型。使用一种或多种生理学上可接受的载体,包含赋形剂和助剂,它们有利于将牙源性干细胞加工成可以在药学上使用的制剂。适当的制剂形式取决于所选择的给药途径,可以按照本领域熟知的常识进行制造。在本发明的一个实施方案中,所述牙源性干细胞存在于细胞相容的介质(例如,生理盐水如0.9%生理盐水,等等)中。在本发明的一个实施方案中,所述牙源性干细胞存在于细胞相容的介质中,并且在低温下保存,例如在冷藏、冷冻等条件下保存,并且可任选在临用前复溶成适用根据本发明精神而施用的形式。
发明的有益效果
本发明成功验证了不同来源的牙源性干细胞对牙周骨组织、软组织缺损的修复以及其它骨组织损伤的修复的治疗作用,为扩大种子细胞来源提供了有力的证据;同时,证明了HGF基因修饰的牙源性干细胞对牙周骨组织、软组织缺损的修复以及其它骨组织损伤修复的治疗作用要优于单纯的牙源性干细胞,表明HGF和牙源性干细胞可在修复治疗中发挥协同作用。
附图说明
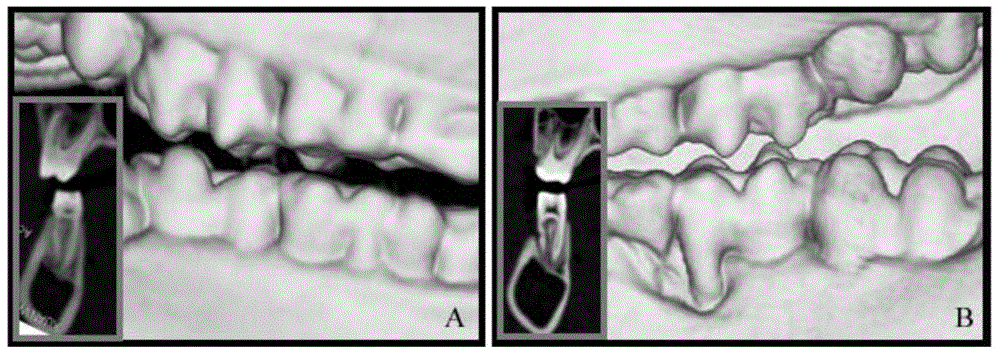
图1小型猪实验性牙周炎动物模型建立。A为建模前的牙齿及其CT影像;B为牙周手术后28天建立牙周炎模型的牙齿及其CT影像,可以看出,小型猪实验性牙周炎动物模型已成功建立。
图2牙源性干细胞治疗小型猪实验性牙周炎疗效。A为对照组治疗前牙齿CT影像;B为对照组三月后牙齿CT影像;C为Ad-HGF修饰的DPSC悬液治疗前牙齿CT影像;D为Ad-HGF修饰的DPSC悬液治疗三月后牙齿CT影像;E为DPSC悬液治疗前牙齿CT影像;F为DPSC悬液治疗三月后牙齿CT影像;G为Ad-HGF修饰的DPSC+PDLSC混合细胞悬液治疗前牙齿CT影像;H为Ad-HGF修饰的DPSC+PDLSC混合细胞悬液治疗三月后牙齿CT影像;I为DPSC+PDLSC混合细胞悬液治疗前牙齿CT影像;J为DPSC+PDLSC混合细胞悬液治疗三月后牙齿CT影像。;K为对照组三月后牙齿大体图像;L为Ad-HGF修饰的DPSC悬液治疗三月后牙齿大体图像;M为DPSC悬液治疗三月后牙齿大体图像;N为Ad-HGF修饰的DPSC+PDLSC混合细胞悬液治疗后牙齿大体图像;O为未经修饰的DPSC+PDLSC混合细胞悬液治疗后牙齿大体图像。
图3牙源性干细胞治疗组与对照组小型猪牙周临床附着丧失(AL)、龈沟出血指数(SBI)、牙周袋深度(PD)。HGF-DPSC注射组表示经HGF修饰的牙髓干细胞注射组;DPSC注射组表示未修饰牙髓干细胞注射组;HGF-DPSC+PDLSC注射组表示经HGF修饰的牙周膜干细胞与HGF修饰的牙髓干细胞混合悬液组;DPSC+PDLSC注射组表示未经修饰的牙周膜干细胞与牙髓干细胞混合悬液组;对照组表示注射生理盐水组。
图4牙源性干细胞治疗组与对照组小型猪血液学指标中血红蛋白(Hb)、白细胞(WBC)、红细胞(RBC)、血小板(PLT)的变化。HGF-DPSC注射组表示经HGF修饰的牙髓干细胞注射组;DPSC注射组表示未修饰牙髓干细胞注射组;HGF-DPSC+PDLSC注射组表示经HGF修饰的牙周膜干细胞与HGF修饰的牙髓干细胞混合悬液组;DPSC+PDLSC注射组表示未经修饰的牙周膜干细胞与牙髓干细胞混合悬液组;对照组注射生理盐水组。
图5牙源性干细胞治疗组与对照组小型猪血液学指标中免疫球蛋白IgA,IgG,IgE,IgM的变化。HGF-DPSC注射组表示经HGF修饰的牙髓干细胞注射组;DPSC注射组表示未修饰牙髓干细胞注射组;HGF-DPSC+PDLSC注射组表示经HGF修饰的牙周膜干细胞与HGF修饰的牙髓干细胞混合悬液组;DPSC+PDLSC注射组表示未经修饰的牙周膜干细胞与牙髓干细胞混合悬液组;对照组表示注射生理盐水组。
图6小鼠股骨急性损伤(骨折)后两周的CT影像。其中CON为空白对照组,MSC为注射人牙髓干细胞组,E-MSC为注射HGF基因修饰的人牙髓干细胞组。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
其中α-MEM培养基购自美国GIBCO公司,其主要成分为丙酮酸钠、L-缬氨酸、丙氨酸、亚油酸、L-盐酸精氨酸、抗坏血酸、L-天门冬酰胺、生物素、L-天门冬氨酸、D-泛酸钙、L-盐酸半胱氨酸、叶酸、L-盐酸胱氨酸、肌醇、L-谷氨酰胺、烟酰胺、L-谷氨酸、氯化胆碱、甘氨酸、盐酸吡哆辛、L-盐酸组氨酸、核黄素、L-异亮氨酸、盐酸硫胺、L-亮氨酸、维生素、L-盐酸赖氨酸等。
实施例1牙源性干细胞的分离、培养、扩增和基因修饰
(1)牙源性干细胞的分离培养
分别采用组织块培养法或酶消化法分离牙髓、牙周膜、根尖牙乳头,培养至第三代。对得到的牙源性干细胞分别进行细胞表面标志检测和成骨、成脂诱导分化,证明为间充质干细胞。具体分离培养方法见下:
牙周膜干细胞的分离培养方法:
麻醉下无菌拔除人阻生第三磨牙或正畸需要拔除牙齿,新鲜拔除的牙齿立即放入装有无菌PBS和抗生素的离心管,在12小时内分离培养牙周膜干细胞。轻轻剥离牙根中部1/3牙周膜组织,用PBS反复清洗,尽量剪碎,置含3mg/mlⅠ型胶原酶和4mg/ml Dispase溶液中,37℃水浴消化0.5-1小时,过70μm细胞筛收集细胞,1000rpm离心10min,用适量培养基重悬成单细胞悬液。将细胞接种于10cm培养皿中,在α-MEM培养基(含10%胎牛血清,2mmol/L谷氨酰胺)中于37℃、5%CO2培养,每3-5天换液一次。每天在倒置显微镜下观察细胞生长状况。1-2周后,取克隆性生长的细胞用0.25%胰蛋白酶消化传代。
牙髓干细胞的分离培养方法:
麻醉下无菌拔除人阻生第三磨牙或正畸需要拔除牙齿,新鲜拔除的牙齿立即放入装有无菌PBS和抗生素的离心管,在12小时内分离培养牙髓干细胞。将拔除牙齿劈冠后取牙髓组织,用PBS反复清洗,尽量剪碎,置含3mg/mlⅠ型胶原酶和4mg/ml Dispase溶液中,37℃水浴消化0.5-1小时,过70μm细胞筛收集细胞,1000rpm离心10min,用适量培养基重悬成单细胞悬液。将细胞接种于10cm培养皿中,在α-MEM培养基(含10%胎牛血清,2mmol/L谷氨酰胺)中于37℃、5%CO2培养,每3-5天换液一次。每天在倒置显微镜下观察细胞生长状况。1-2周后,取克隆性生长的细胞用0.25%胰蛋白酶消化传代。
根尖牙乳头干细胞的分离培养方法:
麻醉下无菌拔除牙根未发育完全的人第三磨牙,切取根尖部分根尖牙乳头,用PBS反复清洗,剪碎,置于含Ⅰ型胶原酶(3g/L)和Dispase(4g/L)的消化液,37℃下消化1小时,过70μm细胞筛收集细胞,1000转/分钟离心10分钟,用培养基重新悬浮成单细胞悬液。将细胞接种于25cm2细胞培养瓶中在α-MEM培养基(含15%胎牛血清,2mmol/L谷氨酰胺,100U/ml青霉素,100μg/ml链霉素)37℃、5%CO2培养,每2~3天换液1次。每天在倒置显微镜下观察细胞生长状况。当细胞生长至80%汇合状态时,用0.25%胰蛋白酶按1:2消化传代,流式细胞仪检测STRO-1,CD90和CD146表面标志物鉴定干细胞,从而获得人根尖牙乳头间充质干细胞(SCAP)
按照上述方法分离培养的牙源性干细胞分别进行细胞表面标志检测和成骨、成脂诱导分化(参见Perry BC,Zhou D,Wu X,Yang FC,Byers MA,Chu TM,Hockema JJ,Woods EJ,Goebel WS.Collection,cryopreservation,and characterization of human dental pulp-derived mesenchymal stem cells for banking and clinical use.Tissue Eng Part C Methods.2008;14(2):149–156;Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells.Science,1999,284(5411):143-147.),证明为间充质干细胞。
(2)牙源性干细胞的体外修饰
以每平方厘米培养面积接种10000个牙源性干细胞,培养24小时后,按150MOI加入Ad-HGF(Ad-HGF的制备方法请参照专利“一种重组腺病毒及其在心肌缺血治疗中的应用,ZL专利号01129209.1”),对牙源性干细胞进行修饰,48小时后得到HGF修饰的牙源性干细胞。
以上制备得到的牙源性干细胞和体外修饰的牙源性干细胞用于以下各实施例中。
实施例2牙源性干细胞对牙周骨组织及软组织缺损的修复治疗作用
首先建立五指山小型猪实验性牙周炎模型,然后,采用细胞膜片植入和细胞悬液注射技术,在CT影像和临床检查确定牙周炎模型建立后,将细胞悬液注射至牙周炎骨缺损部位,分别于治疗后3d、7d、14d、28d和3m,观察牙周骨组织及软组织缺损的修复、牙周组织病理改变、血液学检测指标(血常规、血生化、免疫球蛋白)的改变、炎症因子表达改变等。以下以牙髓干细胞和牙周膜干细胞为例,检测牙源性干细胞对牙周骨组织及软组织缺损的治疗作用。
(1)小型猪实验性牙周炎模型的建立
采用制造骨缺损及结扎丝线的方法建立小型猪实验性牙周炎模型。选择牙周健康14月龄小型猪6头,对照组、牙髓干细胞与牙周膜干细胞混合悬液注射组、及牙髓干细胞细胞悬液注射组各2头。分别在下颌第一恒磨牙近中邻面形成3mm×5mm×7mm缺损(图1B),然后在缺损处放置4.0丝线,10d后取出,分别在术前、术后4周、3月进行临床指标(菌斑指数、龈沟出血指数、牙周袋深度、临床附着丧失)和影像学观察。从图1可以看出,小型猪实验性牙周炎模型已成功建立。
(2)牙源性干细胞治疗小型猪实验性牙周炎所致骨组织及软组织缺损
手术后4w,采用细胞悬液注射技术,将含有1×107个MSC的细胞悬液注射至小型猪牙周炎骨缺损部位,以生理盐水作为对照。其中对于牙髓干细胞与牙周膜干细胞的混合细胞组,牙髓干细胞与牙周膜干细胞的个数比为9:1。
(3)牙源性干细胞治疗的结果
牙源性干细胞细胞悬液治疗后3月,牙周炎骨组织及软组织缺损的恢复明显好于对照组。CT薄层冠状扫描图显示与治疗前相比较,在第一磨牙近中颊根区域有明显的新生骨质影像,而对照组新生骨不明显。大体标本观察,牙源性干细胞治疗组牙周组织修复较好,牙龈轻度红肿,而对照组牙龈明显红肿,退缩(如图2-A、B、E、F、I、J、KM、O)。
牙源性干细胞悬液注射组动物的牙周组织的临床指标(龈沟出血指数、牙周袋深度、临床附着丧失)都好于对照组(如图3)。
实施例3HGF修饰的牙源性干细胞对牙周骨组织及软组织缺损治疗作用
首先建立小型猪实验性牙周炎模型,然后,采用细胞悬液注射技术,在CT影像和临床检查确定牙周炎模型建立后,将细胞悬液注射至牙周炎骨缺损部位,分别于治疗后3d、7d、14d、28d和3m,观察牙周骨组织及软组织缺损的修复、牙周组织病理改变等。以下以HGF修饰的牙髓干细胞和牙周膜干细胞为例,检测HGF修饰的牙源性干细胞对牙周骨组织及软组织缺损的治疗作用。
(1)小型猪实验性牙周炎模型的建立
同实施例2。
(2)HGF修饰的牙源性干细胞干预小型猪实验性牙周炎
手术后4w,采用细胞悬液注射方式将含有1×107个HGF修饰的牙源性干细胞注射入小型猪牙周炎骨缺损部位,以假手术(仅注射生理盐水)作为对照,包括对照组、经HGF修饰的牙髓干细胞与牙周膜干细胞混合悬液注射组(两种细胞都经过修饰)、及经HGF修饰的牙髓干细胞细胞悬液注射组,同时设立未修饰的牙源性干细胞治疗组。其中对于牙髓干细胞与牙周膜干细胞的混合细胞组,牙髓干细胞与牙周膜干细胞的个数比为9:1。
(3)HGF修饰的牙源性干细胞治疗的结果
HGF修饰的牙源性干细胞治疗后3个月,牙周炎骨组织及软组织缺损的恢复明显好于对照组也好于未修饰牙源性干细胞治疗组。CT薄层冠状扫描图显示与治疗前相比较,HGF修饰的牙源性干细胞治疗组在第一磨牙近中颊根区域有明显的大量新生骨质影像,未修饰牙源性干细胞治疗组有中等量的新生骨质影像,而对照组新生骨不明显。大体标本观察,HGF修饰的牙源性干细胞治疗组牙周组织基本恢复正常,牙龈无红肿,牙源性干细胞治疗组牙周组织修复较好,牙龈轻度红肿,而对照组牙龈明显红肿,退缩(如图2-B、C、D、G、H、K、L、N)。
HGF修饰的牙源性干细胞悬液注射组动物的牙周组织的临床指标(龈沟出血指数、牙周袋深度、临床附着丧失)都好于对照组(如图3)。
此外,由血液学检测指标(如图4)和免疫学检测指标(如图5)显示,HGF修饰的人牙源性干细胞悬液局部注射都未引起明显的血液学、血生化和免疫指标的改变。
HGF修饰的其它来源的牙源性干细胞也具有相似的治疗效果。
上述结果表明,HGF修饰的牙源性干细胞治疗组动物牙周软组织和牙周骨缺损的修复较未修饰牙源性干细胞组动物好,且治疗后动物的炎性反应低于对照和未修饰牙源性干细胞组,显示出HGF修饰的牙源性干细胞比无HGF修饰的牙源性干细胞具有更好的治疗效果。
采用小型猪实验性牙周炎模型,通过临床指标观察、影像学检查观察发现,无论是未修饰的人牙源性干细胞,还是HGF基因修饰的人牙源性干细胞,均成功地修复了牙周炎骨缺损,远远好于空白对照组。血液学研究表明,无论是治疗前、还是治疗后,各个治疗组的血常规、血生化、免疫球蛋白和免疫学指标都没有显著性变化,说明人牙源性干细胞注射治疗后,无炎性病变产生,无肝肾功能的损伤,无近期或者远期体液免疫反应产生和细胞免疫排斥反应产生。该研究结果为人牙源性干细胞注射治疗牙周炎,从而扩大种子细胞来源提供了有力的实验依据。
综上所述,牙源性干细胞修复牙周骨组织及软组织缺损,获得良好的治疗效果,表明利用牙源性干细胞进行组织工程牙周组织再生是可行的,可获得较好的效果。HGF修饰的牙源性干细胞可在损伤牙周组织的局部表达HGF,通过分泌多种细胞因子发挥抗炎等生物学效应表明HGF和牙源性干细胞可在牙周骨缺损治疗中,发挥协同效应。
实施例4小鼠股骨急性损伤(骨折)的修复
1.C57小鼠(5-6周)股骨干骨折模型的建立
(1)用2.5%戊巴比妥钠按照10mg/kg剂量对实验小鼠进行腹腔注射至深麻醉,右后肢备皮,仰卧位固定,右侧肢体屈膝90℃,碘伏消毒,铺无菌巾。
(2)于右膝关节上外侧做一纵行1CM切口,暴露股骨远端和股四头肌肌腱,将股四头肌肌腱拨向内侧,充分暴露股骨内外髁间沟,将直径为0.45mm不锈钢针针于此处刺入骨髓,起到髓内钉固定的作用。剪断钢针针柄,将针尾包埋于皮下,关闭创口。
(3)将己插针的小鼠转移到冲撞模型的冲撞台上,插针肢体置于贴板上。500g砝码,从17CM(根据小鼠体型适度调整)高处落下,使该侧肢体股骨骨折。
(4)麻醉状态下X线放射检查骨折造模情况。
(5)小鼠麻醉复苏,送回动物房,造模后第二天进行干细胞局部注射。
2.干细胞局部注射
(1)将造模成功的小鼠分成3组,每组3只小鼠,分别为空白对照组(CON,注射生理盐水)、注射人牙髓干细胞的MSC组和注射HGF基因修饰的人牙髓干细胞的E-MSC组;
(2)MSC组和E-MSC组的细胞浓度为5x105/0.4ml,空白对照组应用0.9%生理盐水;
(3)将小鼠于骨折处局部碘伏消毒;
(4)一助手固定小鼠,用1ml注射器吸取0.4ml相应的细胞溶液,从小鼠股骨干中段注射于骨折局部。
3.骨折修复的观察指标
注射干细胞两周后在CT下观察骨折的修复情况。
4.结果
CT检查结果参见图6。
可以看出,空白对照组两周后仍可见大量骨痂,骨质修复不明显;MSC组两周后可见一定量的骨痂,骨质有部分修复;而E-MSC组两周后骨痂大部分已吸收,骨质已基本修复。
尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!