新型IFN‑β蛋白类似物的制作方法
背景技术:
天然干扰素(IFN-β)大都响应病毒感染或在接触其他生物物质之后由细胞产生。IFN-β涉及抗病毒、抗增殖和免疫调节活性。
多种重组人干扰素-β,称为干扰素-β1a和干扰素-β2b市售可得,用于治疗复发形式的多发性硬化(M Revel,Pharmacol Ther 2003年10月,100(1):49-62)。IFN-β1a是一种166个氨基酸的糖蛋白,其在残基上有单个N-连接的糖链。序列包含3个半胱氨酸,其中2个形成二硫键(Cys31和Cys141)并且一个Cys17是游离的并靠近表面,但被隐埋。干扰素-β1b是非糖基化的并且具有Cys17Ser突变。
干扰素-β以多种方式显示其抗病毒功能;一种是从靶细胞引发抗病毒活性(抑制病毒复制)而另一种是诱导感染的细胞凋亡(Taniguchi等,Current Opinion in Immunology,2002年2月,14(1):111-116)。除了这种直接作用以外,干扰素-β影响免疫系统细胞并且其诱导细胞表面上MHC-I型分子的表达。然后通过细胞毒性T淋巴细胞(CTL)消除病毒感染的细胞。消除机制是基于对感染的细胞表面上MHC I型呈递的病毒抗原的CTL识别。
免疫-肿瘤学是一种癌症护理的进化方法,其聚焦于重新引导患者的免疫系统以消除肿瘤。
宿主系统清除肿瘤细胞的免疫机制之一是通过CTL杀死肿瘤细胞。消除机制是基于对肿瘤细胞表面上MHC I型呈递的肿瘤抗原的CTL识别。
病毒和肿瘤可使用包括下调MHC I型表达的免疫逃逸机制。
能够降低直接抗病毒应答和/或通过CTL消除感染细胞机制的分子以及具有直接抗增殖活性和/或重新引导宿主免疫系统杀伤肿瘤细胞的能力的分子具有作为新型和更强效抗病毒和癌症治疗剂的潜力。
WO 2006/053134鉴定了在25℃和60%相对湿度持续6个月储存下显示至多40%脱酰胺的IFN-β1b蛋白。该蛋白有增加的抗病毒和抗增殖活性。还没有报告增加的免疫调节活性。
因此,仍然需要提供新型和更强效的治疗性IFN-β类似物,尤其是IFN-β1a类似物。
本发明的发明人惊讶地发现IFN-β1a在氨基酸25位处天冬酰胺处的脱酰胺导致增加的免疫调节,例如,MHC I型的上调和增加的抗病毒活性。另外,发明人意外发现免疫调节和抗病毒活性中脱酰胺诱导的增加取决于IFN-β1a的唾液酸化。
此外,本发明的发明人发现导致IFN-β1a的几乎完全脱酰胺的特定脱酰胺条件。
因此可以高生物功效和低成本产生本发明的脱酰胺的IFN-β蛋白。此外,单独或与其他治疗剂或手段联用的本发明的修饰的IFN-β蛋白可增强例如癌症免疫治疗剂和抗病毒治疗剂,如疫苗的临床功效。另外,IFN-β疗法可受益于使用较低剂量的IFN-β和与IFN-β治疗相关的副作用减少。
技术实现要素:
本发明提供了包含干扰素-β(IFN-β)蛋白质,优选IFN-β1a的组合物,其中至少80%在对应于根据SEQ ID NO:1的干扰素-β1a蛋白的氨基酸25位的氨基酸位置上的氨基酸天冬酰胺处脱酰胺。
本发明还提供了修饰的干扰素-β(IFN-β)1a蛋白,其中对应于根据SEQ ID NO:1的干扰素-β1a蛋白的氨基酸25位的氨基酸位置上的氨基酸天冬酰胺经脱酰胺。
本发明还提供了用于治疗,用作免疫调节剂,用作疫苗或用于癌症免疫疗法的修饰的IFN-β1a蛋白或组合物。
本发明的修饰的IFN-β1a蛋白具有SEQ ID NO:2定义的序列。
本发明还提供用于治疗选自病毒感染、癌症和神经疾病的病症的修饰的IFN-β1a蛋白或组合物。
本发明还提供对蛋白质,优选IFN-β,更优选IFN-β1a进行脱酰胺的方法,包括:
(a)在碱性条件下孵育待脱酰胺的蛋白质约16至约24小时,优选20小时;并且
(b)纯化脱酰胺的蛋白。
附图的简要说明
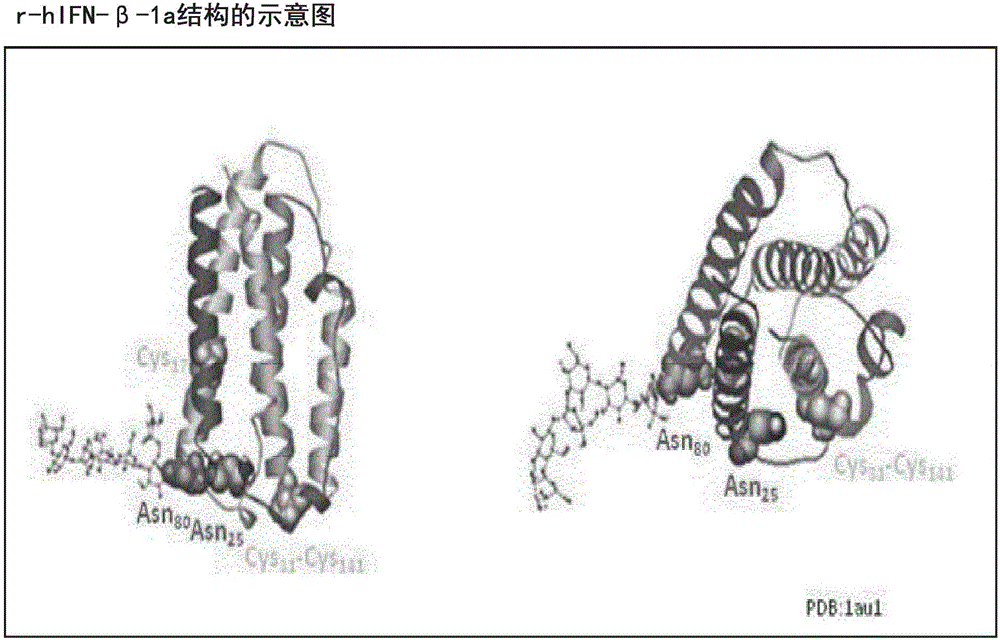
图1A和1B显示了人IFN-β-1a的一级结构(SEQ ID NO:1)和3D模型结构。IFN-β1a是一种166个氨基酸的糖蛋白,其在残基上有单个B-连接的糖侧链。序列包含3个半胱氨酸,其中2个形成二硫键(Cys31和Cys141)并且一个Cys17是游离的并靠近表面,但被隐埋。
图2A是人工降解的IFN-β1a的RP-UPLC曲线;图2B是图2A的部分放大。
图3A是未处理的IFN-β1a的脱酰胺水平;图3B是图3A的部分图像放大。
图4A是人工脱酰胺的IFN-β1a的脱酰胺水平;图4B是图4A的部分图像放大。
图5是重叠的未处理的IFN-β1a和人工脱酰胺的IFN-β1a的脱酰胺水平。
图6A是人工去唾液酸化的IFN-β1a的脱酰胺水平;图6B是图6A的部分图像放大。
图7A是人工脱酰胺并去唾液酸化的IFN-β1a的脱酰胺水平;图7B是图7A的部分图像放大。
图8A和B是重叠的人工去唾液酸化的IFN-β1a和人工脱酰胺并去唾液酸化的IFN-β1a的脱酰胺水平。
图9是MHC I型免疫调节生物试验:剂量响应曲线。
图10是IFN-β1a的免疫调节生物活性。
图11是A549/EMCV系统的抗病毒活性:剂量响应曲线。
图12是IFN-β1a的抗病毒活性。
发明详述
本发明提供了包含干扰素-β(IFN-β),优选IFN-β1a的组合物,其中至少80%在对应于根据SEQ ID NO:1的干扰素-β1a蛋白的氨基酸25位的氨基酸位置上的氨基酸天冬酰胺处脱酰胺(参考图1)。
本发明还提供了修饰的IFN-β1a蛋白,其中对应于根据SEQ ID NO:1的干扰素-β1a蛋白的氨基酸25位的氨基酸位置上的氨基酸天冬酰胺经脱酰胺。
本发明的修饰的IFN-β1a蛋白具有SEQ ID NO:2定义的序列。
优选地,组合物中至少85%、90%、95%或至少96%的IFN-β蛋白,例如IFN-β1a脱酰胺,最优选96%。
脱酰胺是蛋白质的可能修饰途径之一。这种类型的修饰主要发生在天冬酰胺和谷氨酰胺残基处。对于经过脱酰胺的天冬酰胺,形成了三种可能的修饰产物:
●琥珀酰亚胺中间体(其中,天冬酰胺酰蛋白已经失去了氨分子)
●天冬氨酰蛋白(其中天冬酰胺已经转化成天冬氨酸)
●异天冬氨酰蛋白(其中天冬酰胺已经转化成异天冬氨酸;在这种情况中,蛋白质主链在天冬氨酸侧链的COOH上连续,而不是氨基酸的COOH上)。
最后两个修饰产物产生蛋白质的净电荷变化,因为天冬酰胺的天然氨基侧链已经转化成天冬氨酸的更酸性的羧基。
不受任何理论限制,预期按照Asn25的空间位置(参见图1B),其脱酰胺成Asp25增加了与空间上靠近的Arg147的静电相互作用,可能与Arg147和Thr144形成额外的氢键。天冬氨酸和精氨酸之间的静电相互作用可能在精氨酸胍基的2个氮中心和/或羧基的2个氧原子上传递,如图1B所示。
本文所述的组合物包含脱酰胺的IFN-β蛋白,例如IFN-β1a,其中待脱酰胺的氨基酸天冬酰胺的天冬酰胺残基被天冬氨酸残基、异天冬氨酸残基或环酰亚胺(imidid)残基如琥珀酰亚胺替换。优选地,约65%至约70%,更优选约68%的天冬酰胺残基被天冬氨酸替换,约15%至约20%,更优选约18%被异天冬氨酸替换,并且约8%至约13%,优选约11%被琥珀酰亚胺替换。
类似地,在本文所述的修饰的IFN-β1a蛋白中,待脱酰胺的氨基酸天冬酰胺的天冬酰胺残基被天冬氨酸残基、异天冬氨酸残基或环酰亚胺残基如琥珀酰亚胺替换。
本文所述的组合物还显示与CHO细胞中产生的IFN-β蛋白(优选SEQ ID NO:1)相比增加的免疫调节活性,优选增加的I型MHC复合物上调。具体地,由于增加的I型MHC上调,本文所述的脱酰胺或修饰的IFN-β蛋白可通过恢复肿瘤或感染的细胞的细胞表面上呈递抗原,其进而产生增加数量的针对CTL活性的细胞表面上靶标数量,最终增加了CTL的细胞杀伤活性的功效来在癌症免疫疗法或抗病毒疫苗接种中起作用。可在IFN-β单一疗法或与常规疗法,如抗病毒或癌症(免疫)疗法联用中使用这种免疫调节活性。
本文所述的组合物还显示出增加的抗病毒活性(参考实施例3.2)。
此外,本文所述的修饰的IFN-β1a蛋白或组合物可包含糖基化,尤其是唾液酸化的IFN-β蛋白。糖基化可以是接合至天冬酰胺或精氨酸残基的氮的N-连接的糖基化;接合至丝氨酸、苏氨酸、酪氨酸、羟基赖氨酸或羟基脯氨酸残基的羟基氧的O-连接的糖基化;接合至丝氨酸残基的磷酸-丝氨酸-连接的糖基化或者接合至色氨酸残基上的碳的C-连接的糖基化。优选地,糖基化是N-连接的糖基化。最优选地,糖基化接合至对应于SEQ ID NO:1的天冬酰胺80的天冬酰胺。
另外,本文所述的修饰的IFN-β1a蛋白或组合物可包含IFN-β蛋白,其具有在任何真核细胞中产生的IFN-β蛋白的糖基化模式,如中华仓鼠卵巢(CHO)细胞、人胚胎肾细胞(293T)、人肝细胞癌细胞(HepG2)、人T细胞淋巴瘤细胞(Jurkat)、人T细胞急性淋巴细胞白血病细胞(Molt4)、人EBV-永生化B-细胞系(Dakiki)、人横纹肌肉瘤细胞(RD)和人纤维肉瘤细胞(HT1080),优选CHO细胞。
修饰的IFN-β1a蛋白的聚糖链可以是三触角或四三触角构造,优选如CHO细胞中进行的那样。
此外,本文所述的修饰的IFN-β1a蛋白或组合物可在接合至修饰的IFN-β1a蛋白的聚糖链的末端包含唾液酸化的IFN-β蛋白,优选用N-乙酰基神经氨酸。由于唾液酸氨基的修饰(例如,通过乙酰基或乙醇酰基)和每个聚糖触角上唾液酸的数量(例如,3或4唾液酸化)是组织特异性的,聚糖链的唾液酸化优选如CHO细胞进行的唾液酸化。在一个特别优选的实施方式中,所有的聚糖侧链是唾液酸化的,例如,如CHO细胞进行的那样。
本发明的组合物可包含单独IFN-β蛋白或与本文所述的其他治疗剂联用的IFN-β作为活性剂,优选地与本文所述的药学上可接受的运载体、佐剂或添加剂,例如,本文所述的任选含其他运载体、佐剂或添加剂的水性溶液。
类似地,本文所述的修饰的IFN-β1a蛋白可单独使用或其本文所述的其他治疗剂或药学上可接受的运载体联用。
本文所述的组合物可包含药学上可接受的运载体、佐剂或添加剂。这类运载体、佐剂或添加剂是本领域已知的并且依赖于体内应用的指示和定位。它们的选择也可能考虑治疗剂的释放速率,例如,中速释放或延迟。本文所述的修饰的IFN-β1a蛋白或组合物优选用于全身给药。组合物或修饰的IFN-β1a蛋白可口服,局部,例如在皮肤上,或胃肠外,优选通过注射或输注给予。
用于口服给药的运载体、佐剂或添加剂是消毒水,影响pH的试剂,如有机和无机酸或其盐,用于调节pH的缓冲剂,等张剂,如氯化钠,碳酸氢钠,葡萄糖,果糖,去污剂和乳化剂,如油类,如花生油,大豆油,蓖麻油,合成脂肪酸酯,聚合运载体,络合剂,防腐剂和稳定剂。
本文所述的组合物还可包含抗氧化剂,如亚硫酸钠或甲硫氨酸,优选甲硫氨酸。
类似地,本文所述的修饰的IFN-β1a蛋白可与本文所述的抗氧化剂联用。
在本发明的其他实施方式中,本文所述的修饰的IFN-β1a蛋白或组合物作为免疫调节剂,作为疫苗用于治疗中,或用于癌症免疫疗法中。
本文所述的组合物或修饰的IFN-β1a蛋白可单独使用或与其他治疗剂联用,如抗病毒剂,例如,利巴韦林、疫苗、免疫调节剂如肿瘤免疫治疗剂、细胞因子、白介素或趋化因子(L-BLP-25或其他肿瘤相关抗原)。
免疫调节疗法可设计为引发或扩大免疫应答。或者,免疫调节疗法可降低或抑制免疫应答。在本发明的优选实施方式中,免疫调节疗法引发或扩大免疫应答。本文所述的本发明的组合物或修饰的IFN-β1a蛋白作为免疫调节剂可单独使用或与本文所述的其他免疫调节剂联用。
本文所述的疫苗可以是预防性疫苗、治疗性疫苗或癌症疫苗。疫苗还可包含治疗上可接受的注射用运载体、纳米贴片或口服递送疫苗。这类运载体是本领域技术人员已知的并且可包括佐剂,如白蛋白,防腐剂如苯甲酸,苯酚,间甲酚,甲醛或硫柳汞,抗生素和/或稳定剂,如MSG或2-苯氧基乙醇。
本文所述的组合物或修饰的IFN-β1a蛋白可用于治疗对象中选自下组的病症:病毒感染、癌症、和神经疾病。
本文所述的组合物或修饰的IFN-β1a蛋白可用于治疗由例如,丙肝病毒(HCV)、流感、登革热病毒等引起的病毒感染。具体地,HCV可导致丙型肝炎或慢性肝相关疾病,如硬化、肝衰竭和肝细胞癌,其可通过本文所述的本发明组合物或修饰的IFN-β1a蛋白治疗。
可用本文所述的组合物或修饰的IFN-β1a蛋白治疗的癌症可选自下组:乳腺癌,肺癌如非小细胞肺癌,肝癌,结直肠癌,前列腺癌,卵巢癌,脑癌,胆囊癌,胰腺癌等。
本文所述的组合物或修饰的IFN-β1a蛋白也可用于治疗神经疾病,如神经创伤。例如,它们可用于神经再生,如视神经再生,例如,其中所述治疗包括调节突触成型性或增强轴突。
本文所述的组合物或修饰的IFN-β1a蛋白也可用于治疗神经疾病,如多发性硬化。
本文所述的优选对象可以是HCV感染的透析病人。
本文所述的治疗可包括免疫调节,优选上调I型MHC复合物,如本文所述。
本文所述的组合物和修饰的IFN-β1a蛋白还可如本文所述与化学免疫疗法、化疗、放疗、疫苗和/或其他治疗剂,如抗病毒剂如利巴韦林,细胞因子如IL-2或IFN-α或化学治疗性抗体如利妥昔单抗联用。
例如,本文所述的本发明的组合物或修饰的IFN-β1a蛋白可与化学免疫疗法(这类免疫疗法基于肿瘤相关抗原)联用,例如与L-BLP25联用。
本文所述的本发明或修饰的IFN-β1a蛋白可如本文所述与化疗和/或放疗联用。具体地,可在节律性化疗期间使用修饰的蛋白质或组合物来通过T细胞细胞毒性增强抗肿瘤免疫应答,并增加组合化疗(或放疗)的功效。
本发明还提供了使蛋白质脱酰胺的方法,包括:
(a)在碱性条件下孵育待脱酰胺的蛋白质约16至约24小时,优选20小时;并且
(b)纯化脱酰胺的蛋白。
优选地,待脱酰胺的蛋白质是IFN-β,特别是IFN-β1a。
本文所述的孵育可在约8.9至约9.5的pH下,优选约pH 9.2下进行。
此外,本文所述的孵育可在任何适于脱酰胺的缓冲剂中进行。合适的缓冲剂为本领域的技术人员已知。优选地,孵育在碳酸氢铵中进行,更优选终浓度0.2M。
此外,本文所述的孵育还在约20℃至约25℃,如约21℃至约24℃,优选约23℃的温度下。
本文所述的纯化可包括任何本领域已知的纯化方法。优选地,纯化包括超滤,更优选用pH 3.8的乙酸铵超滤。
实施例
1.脱酰胺的IFN-β的制备
通过对IFN-β-1a DS(药物)物质的化学(碱性pH用于脱酰胺)或酶(唾液酸酶用于去唾液酸化)处理来制备不同的IFN-β-1a降解形式。
实验设计预见未处理和人工脱酰胺的IFN-β-1a的物理-化学和生物特征,旨在评价脱酰胺赋予IFN-β-1a免疫调节和抗病毒活性。此外,设计包括去除唾液酸后对未处理和脱酰胺的样品的测试以评价唾液酸化在调节这些特异性生物活性中的作用(如果存在)。
如下所述制备了人工降解的样品:
○通过将IFN-β-1a DS在23℃下在pH 9.2的1.2M碳酸氢铵中孵育20小时来进行脱酰胺。孵育前的最终碳酸氢铵浓度是约0.2M并且IFN-β-1a浓度为约0.3mg/mL。一般使用碱性条件来诱导天冬酰胺转化成天冬氨酸并且已经在过去证明高效且持续性脱酰胺IFN-β-1a。
○通过将蛋白质与来自Glyko(参考GK80040)的唾液酸酶在37℃下,pH6.0下孵育1小时来进行去唾液酸化。这种酶能够特异性释放接合至聚糖结构的唾液酸。这种治疗应用于天然以及人工脱酰胺的IFN-β-1a。
在各治疗后,样品已经超滤以使其缓冲剂交换50mM乙酸铵pH 3.8(IFN-β-1a DS缓冲剂)以具有与未处理的DS相当的基质。然后测试各IFN-β-1a降解的样品以确认治疗成功,特异性降解的程度及其对生物活性的影响。
2.物理-化学表征的结果
2.1RP-UPLC试验结果
在图2中总结了所有制备的样品针对UV曲线和蛋白质浓度获得的结果。图2中的所有曲线显示IFN-β-1a的尖峰,证明未处理的IFN-β-1a和所有人工降解的样品的最优色谱性能。
表1:通过RP-UPLC测定的蛋白质含量
上述报告的数据已经用作研究中的参考含量。
对应于未处理的IFN-β-1a的样品显示与未处理的IFN-β-1a预期的值一致的蛋白质含量(约300μg/ml)。人工脱酰胺的IFN-β-1a和人工脱酰胺并去唾液酸化的IFN-β-1a中检测的蛋白质含量高于未处理的IFN-β-1a,这是由于样品在Amicon Ultra中的超滤和浓缩。
所有样品已显示适于进行所有计划的表征测试的IFN-β-1a浓度和量。
2.2通过肽作图/UPLC确定的脱酰胺水平-结果
如图3-8所示,在与脱酰胺的物质相关的峰丰度上有明显变化。这种观察结果已经在下表中确认并定量。
表2:通过肽作图/UPLC确定的脱酰胺水平
如上表报告,已经清楚地证明所用的脱酰胺处理确保接近97%水平的几乎完全IFN-β-1a脱酰胺。另外,相对于未处理的样品,去唾液酸化处理并没有改变脱酰胺水平。
3.生物学表征的结果
该部分中报告了MHC I型表达以及抗病毒活性的结果。
3.1通过免疫调节生物试验确定的MHC I型表达
免疫调节试验是基于IFN-β-1a以剂量相关方式上调A549细胞中MHC I型表达的能力。使用特异性荧光标记的抗体通过流式细胞术检测MHC I型的表达。
简而言之,A549细胞(32.000个细胞/孔)与范围从0.000381ng/mL到1600ng/mL的12种不同浓度的IFN-β-1a在37℃,5%CO2下孵育48小时。为了评价MHC I型的基线表达水平,也运行未处理的细胞。然后,收获细胞并且通过使用FITC-偶联的抗-hMHC I型抗体的FACS分析来评估MHC I型的表达。按照内部流程来进行FACS分析。
由4PL算法来拟合参照和样品的剂量响应曲线,并且自动计算能够导致50%的最大可能表达的浓度(EC50)。
结果表示为在EC50值的基础上相对于参照物质的活性百分比。对于各样品,结果是在不同的三周内进行并且各自由2次独立运行组成的三次独立试验(总共6轮分析)的平均。
在计算生物活性之前,如图9所示检查了所有样品的生物学性质。
所有样品的剂量响应曲线有相当的上下平台和斜率,这证明了进一步评价所需的曲线相似性。在图10中与示意图一起报告的效力值以更好地理解差异。
上述图10中报告的数据显示与未处理的IFN-β-1a和去唾液酸化的IFN-β-1a相比,由脱酰胺的IFN-β-1a样品介导的MHC I型表达的上调。从所得的数据中推知,脱酰胺过程产生具有上调其揭示的生物终点的表达所需的双重能力的IFN-β-1a。该结果在脱酰胺的IFN-β-1a与未处理的IFN-β-1a的比较中以及脱酰胺/去唾液酸化的IFN-β-1a与去唾液酸化的IFN-β-1a的比较中是明显的。可以看到,生物活性的脱酰胺依赖性增加依赖于IFN-β1a的去唾液酸化。
3.2通过A549/EMCV系统确定抗病毒活性
通过测量IFN-β-1a在A549细胞上引发的针对脑心肌炎病毒(EMCV)细胞病变影响的保护来评价IFN-β-1a的抗病毒活性。该方法的简要说明如下所示。
将A549细胞接种(40.000个细胞/孔)在含浓度为0.016ng/ml至2ng/ml的IFN-β-1a的96孔微量滴定板中,然后在37℃,5%CO2下孵育20小时。在孵育结束时,向每孔中加入EMCV悬浮液。在37℃,5%CO2下孵育24小时后,加入ATPLite 1步骤并且通过发光计酶标仪测量各孔中的cps以评价细胞的增殖和活力。
由4PL算法来拟合参照和样品的剂量响应曲线,并且自动计算能够导致50%的最大可能表达的浓度(EC50)。
结果表示为在EC50值的基础上相对于参照物质的活性百分比。对于各样品,结果是在不同的三天内进行的三次独立试验的平均。
在计算生物活性之前,如图11所示检查了所有样品的生物学性质。
基于收集的EC50评价测量各测试的IFN-β-1a样品的生物学活性的效力值,以EC50RHS IFN-β-1a与各测试样品的EC50之间的百分比表示(估计相对效力%)。实验以n=2次的次数独立进行并且计算CV%(变异系数)。结果示于图12。
表12中的数据显示与未处理的IFN-β-1a相比,脱酰胺的IFN-β-1a样品介导的A549细胞有更高的抗病毒活性。
从所得的数据开始,脱酰胺过程产生的IFN-β-1a获得了增加所显示的生物响应的更高能力。相反,当与去唾液酸化的IFN-β-1a比较时,这种脱酰胺特征无法在脱酰胺/去唾液酸化的IFN-β-1a样品中看到,这种情况中的脱酰胺过程无法拯救去唾液酸过程对生物活性的影响。
- 还没有人留言评论。精彩留言会获得点赞!