用于有效纯化来自微生物发酵的中性人乳低聚糖(HMO)的方法与流程
人乳表现为碳水化合物、脂肪、蛋白质、维生素、矿物质和微量元素的复杂混合物。目前为止最主要的部分由碳水化合物代表,其可以进一步分为乳糖和更复杂的低聚糖。然而乳糖用作能量来源,复杂低聚糖不能被婴儿代谢。复杂低聚糖部分最高占据总的碳水化合物部分的1/10,且由可能多于150种不同低聚糖组成。这些复合低聚糖的出现和浓缩是特别针对人类的,因而不能大量存在于其他哺乳动物例如家养乳用动物的乳中。
已知人乳中这些复合低聚糖的存在很长时间,这些低聚糖的生理功能经过了几十年的医学研究(Gura,T.(2014)Nature's first functional food.Science 345(6198)747-749)。对于一些更大量的人乳低聚糖,已确定了特定的功能(Bode,L.(2012)Human milk oligosaccharides:every baby needs a sugar mama.Glycobiology 22(9),1147-1162;Bode L,Jantscher-Krenn E(2012)Structure-function relationships of human milk oligosaccharides.Adv Nutr 3(3)383S-391S,Morrow AL,Ruiz-Palacios GM,Altaye M,Jiang X,Guerrero ML,Meinzen-Derr JK,Farkas T,Chaturvedi P,Pickering LK,Newburg DS(2004)Human milk oligosaccharides are associated with protection against diarrhea in breast-fed infants.J Pediatr 145(3)297-303)。
有限的供应和获得单独人乳低聚糖的纯部分的困难引起对这些复杂分子中一些的化学路线的开发。然而,通过化学合成、酶合成或发酵来合成人乳低聚糖被证明是具有挑战性的。至少直到今天仍不能大规模地提供足够用于食品应用的数量和质量。在这方面,特别是人乳低聚糖的化学合成路线(例如2'-岩藻糖基乳糖;参见WO2010/115935Al)涉及几种有毒化学品,其施加了污染最终产物的风险。
由于人乳低聚糖的化学合成中涉及的挑战,开发了几种酶法和发酵途径(Miyazaki等,(2010)Methods in Enzymol.480,511-524;Murata等,(1999)Glycoconj.J.16,189-195;Baumgartner,F.等,(2013)Microb.Cell Fact.12,40;Lee等,(2012)Microb.Cell Fact.11,48;US 7521212Bl或Albermann等,(2001)Carbohydr.Res.334(2)97-103页)。然而,这些方法产生的低聚糖的复合混合物,即期望的产物被起始物料如乳糖、生物合成中间体和底物如单独的单糖和多肽等污染。
在现有技术中用于从这些复杂混合物纯化单独的低聚糖产物的方法在技术上是复杂的,且对于食品应用也是不经济的。为了从复杂混合物如乳清或糖蜜纯化二糖乳糖或蔗糖,已开发了涉及多次结晶的工业规模的方法。所述方法的缺点是它们是复杂的且只会带来低的收率。
为了纯化来自微生物发酵的复杂低聚糖、例如一些人乳低聚糖,凝胶过滤层析法是至今为止所选择的方法。凝胶过滤层析法的缺点是它不能有效地按比例放大并且它不适用于连续运行。因此,凝胶过滤层析法是不经济的,且使得它不可能以合理的量和质量提供一些人乳低聚糖—如2'-岩藻糖基乳糖或乳-N-四糖—以在人类食品或其他应用如动物食品(例如宠物食品)中使用它们。其他哺乳动物在其乳中也含有与人类相同或相似的中性复杂低聚糖(例如,在狗、猪、黑猩猩的乳中也发现了2'-岩藻糖基乳糖),在此基础上,作为动物饲料或宠物食品的应用是令人关注的(Castanys-Munzo,E.,Martin,J.M&Prieto,P.A.(2013)2'-fucosyllactose:an abundant,genetically determined soluble glycan present in human milk.Nutr.Rev.71(12)773-789)。
在微生物发酵中重组菌株(重组细菌或酵母菌株)的使用带来另一个问题,其导致发酵产物被重组物质污染。然而,被重组DNA或蛋白质污染对现在的监管者和消费者是不可接受的。特别对于重组DNA分子的检测限是非常低的。如果使用目前被视为检测金标准的基于qPCR的检测,即使是很少的单个DNA分子也可以被检测到。另外蛋白质造成过敏反应的风险,因此应当从期望的低聚糖产物中被有效地去除。
电渗析(ED)表示结合透析和电解的技术,基于溶液中离子通过半透膜的选择性电迁移,电渗析可以用于它们的分离或浓缩。电渗析的首次工业应用可追溯到1960年代初用于婴儿配方中的干酪乳清的去矿质。电渗析的进一步发展的应用包括调节饮料如葡萄酒、葡萄原汁、苹果汁和橙汁的pH。
用于生产饮用水的半咸水脱盐和用于婴儿食品生产中的乳清去矿质代表了目前应用的最大领域。
基本的电渗析原理由电解池组成,该电解池由浸没在用于传导离子的电解质中与直流发电机相连的一对电极构成。与直流发电机的正极相连的电极是阳极,与负极相连的电极被称为阴极。电解质溶液则承载由负电荷离子和正电荷离子分别向阳极和阴极移动引起的电流。电渗析中使用的膜基本上是多孔离子交换树脂片,其具有带负电荷或正电荷的基团,因此分别称为阳离子膜或阴离子膜。离子交换膜通常由与二乙烯基苯交联的携带合适官能团(如分别用于阳离子膜或阴离子膜的磺酸或季铵基团)的聚苯乙烯制得。可以使用氯化钠、或乙酸钠、丙酸钠等作为电解质。电渗析堆叠以这样的方式装配:使得阴离子膜和阳离子膜在两个电极块之间的压滤机中平行,很好地分隔经受离子消耗的流和经受离子富集的流(这两种溶液也被称为稀释液(经受离子消耗)和浓缩液(经受离子富集)。电渗析方法的核心是膜堆叠,其由被间隔物分隔且安装在两个电极之间的几个阴离子和阳离子交换膜构成。通过施加直流电流,阴离子和阳离子将穿过膜向电极迁移,产生稀释流(脱盐的)和浓缩流。
一般来说,所用膜的孔隙大小是相当小的,以防止受到两个流之间通常高的浓度差驱动而使产物从稀释流向浓缩流扩散。分离生物质后,必须从期望的产物定量地去除蛋白质和特别地重组DNA分子(大小为整个基因组)。如果有可能,这样的大分子(与HMO分子大小相比)的电渗析将是相当漫长的,且一定伴有期望的产物从稀释物到浓缩物的显著损失。
渗滤是涉及向溶液添加淡水以“洗除”或去除可透过膜的组分的方法。因此,渗滤可以用于通过使用合适的膜、基于组分分子大小来分离组分,其中一种或更多种物质被有效保留而其他物质是可透过膜的。具体地,通过使用纳滤膜的渗滤对于分离盐与低分子化合物是有效的。通常,纳滤膜具有150至300道尔顿的截留分子量。目前,纳滤(NF)在乳制品工业中广泛用于乳清的浓缩和去矿质。纳滤已被用于从人乳富集人乳低聚糖部分。在该方法中,纳滤已经与乳糖的酶降解相结合用于从乳糖分离HMO部分(Sarney D.B,Hale,C.,Frankel,G&Vulfson,E.N.(2000)A novel approach to the recovery of biological active oligosaccharides from milk using a combination of enzymatic treatment and nanofiltration.Biotechnol.Bioeng 69,461-467)。
在用于有效纯化来自微生物发酵的食品级人乳低聚糖的已开发方法中,采用纳滤以浓缩期望的产物并且还去除可透过膜的盐。
从现有技术出发,技术问题是以大的量、高纯度和高收率提供中性HMO的新方法的提供。
该技术问题通过根据权利要求1的方法、根据权利要求15的人乳低聚糖(HMO)和根据权利要求19的HMO的用途得到解决。从属权利要求显示了有利的实施方案。
本发明提供了从通过微生物发酵获得的发酵液以分批方式或连续方式纯化中性人乳低聚糖(HMO)的方法,其中提供包含纯度≥80%的中性HMO的纯化溶液。发酵液含有中性HMO、生物质、培养基组分和污染物。在发酵液中中性HMO的纯度为<80%。
在该方法中,对发酵液应用以下纯化步骤:
i)从发酵液分离生物质,
ii)进行阳离子交换剂处理以去除带正电荷的物质,
iii)进行阴离子交换剂处理以去除带负电荷的物质,
iv)纳滤步骤(包括中性HMO的浓缩和/或渗滤或者由中性HMO的浓缩和/或渗滤组成)和/或电渗析步骤(特别用于去除盐和其他低分子量化合物)。
存在于无细胞的发酵液中的污染物为例如除期望的中性HMO外的其他低聚糖,如一价和二价盐、氨基酸、多肽、蛋白质、有机酸、核酸等。期望的中性HMO可以以在纯化溶液中≥80%的纯度被获得。
申请人已发现,利用本发明的纯化方法可以实现来自微生物发酵的中性HMO的有效纯化,其提供适合用于食品和饲料应用的纯度的HMO。此外,由于不需要层析分离步骤,该方法是有高成本效益的。此外,已经发现,不论在步骤iv)中实施电渗析步骤或纳滤步骤或两个步骤连续实施,均获得了≥80%的纯度。
根据本发明的方法的一个优点是获得不含来自所用重组微生物发酵菌株的DNA和蛋白质的期望的中心HMO。特别是阳离子交换剂处理(步骤ii)的实施使得能够去除带正电荷的物质,例如带正电荷的蛋白质。因此,与现有技术已知的不实施阳离子交换剂处理的常规纯化方案相比,本发明的方法提供包含较少的带正电荷的污染物的HMO。进一步发现,使分离了(优选通过超滤)生物质的发酵液通过阳离子交换剂(以质子形式)之后,获得的溶液是稳定的,且可以在室温或冷却下储存几个星期。此外,如通过最多50个扩增循环的定量PCR所确定的,获得的中性HMO不含重组物质。另外,由根据本发明的方法获得的产物的特征在于少量蛋白质或不含蛋白质。
此外,根据本发明的中性HMO纯化是高效的,纯化HMO的未知收率为>70%(任选地>75%)(由不含细胞的发酵培养基相比HMO浓缩物测定)。
因而,提供包括以下步骤的混合方法:生物质分离、离子交换和纳滤和/或电渗析步骤,优选还包括活性炭处理,该方法用于有效地提供高纯度的、不含来自使用重组发酵菌株的发酵方法的重组遗传物质、内毒素和蛋白质的中性HMO。利用根据本发明的方法,可以以非常方便和经济的方式提供大量的高质量人乳低聚糖。
可以从通过使用重组微生物的微生物发酵获得的发酵液纯化中性HMO,该重组微生物优选细菌或酵母,更优选在化学成分确定的培养基中生长的重组微生物。任选地,将在步骤i)中分离的生物质再循环到微生物发酵。
在根据本发明的方法的另一个优选实施方案中,发酵液中中性HMO的纯度为≤70%、≤60%、≤50%、≤40%、≤30%、≤20%、≤10%或≤5%,和/或纯化溶液含有纯度≥85%,优选≥90%的中性HMO。
在根据本发明的方法的另一个优选实施方案中,中性HMO的收率为>70%(任选地>75%)和/或纯化溶液不含DNA、蛋白质和/或重组遗传物质。
在根据本发明的方法的另一个优选实施方案中,中性HMO选自2'-岩藻糖基乳糖、3-岩藻糖基乳糖、2',3-二岩藻糖基乳糖、乳-N-三糖II、乳-N-四糖、乳-N-新四糖、乳-N-岩藻五糖I、乳-N-新岩藻五糖、乳-N-岩藻五糖II、乳-N-岩藻五糖III、乳-N-岩藻五糖V、乳-N-新岩藻五糖V、乳-N-二岩藻六糖I、乳-N-二岩藻六糖II、6'-半乳糖基乳糖、3'-半乳糖基乳糖、乳-N-六糖和乳-N-新六糖。。
在根据本发明的方法的一个特别优选的实施方案中,中性HMO是2'-岩藻糖基乳糖。
在根据本发明的方法的另一个优选实施方案中,通过以下步骤实现从发酵液分离生物质:
a)超滤,其优选通过分离生物质和>500kDa、更优选>150kDa的物质来实施;和/或
b)通过错流过滤器过滤,该过滤器优选具有≤100kDa的截留、更优选具有≤10kDa的截留、甚至更优选≤5kDa的截留;
其中步骤a)优选在步骤b)之前实施。
在根据本发明的方法的另一个优选实施方案中,本发明的方法的纯化步骤ii)至v)中至少一个在该方法中重复至少一次。
在根据本发明的方法的另一个优选实施方式中,在纯化步骤ⅰ)至iv)中至少一个之后,对发酵液应用活性炭处理至少一次以将显色物质和更大的低聚糖吸附至活性炭。通过对发酵液应用该另外的纯化步骤,可以从发酵液去除显色物质和更大的低聚糖。
本发明的方法的特征在于
a)在纯化步骤i)至iv)中至少一个之后;或
b)在用于将显色物质和更大的低聚糖吸附至活性炭的至少一次活化炭处理之后;或
c)在纯化步骤i)至iv)中至少一个之后实施的浓缩步骤之前;
对包含中性人乳低聚糖的溶液进行渗滤和/或浓缩。优选地,用纳滤膜、更优选用具有的尺寸排阻极限的纳滤膜对所述溶液进行渗滤和/或浓缩。最优选地,将溶液渗滤直至达到≤15mS/cm、优选≤10mS/cm、更优选≤5mS/cm的电导率。
发现采用纳滤的渗滤作为在含HMO溶液的电渗析处理之前去除大量污染物的预处理是有效的。此外,还发现纳滤在超滤步骤之后在小分子污染物的去除中是有效的,其中所述去除对于在离子交换剂处理前将HMO溶液浓缩和去矿质是有益的。在人乳低聚糖的纯化中用于浓缩和渗滤的纳滤膜的使用导致更低能耗和处理成本以及改善的产品质量,这是因为减少的热暴露导致减少的美拉德反应和醛醇缩合反应。
在步骤i)之前的步骤中,可以对发酵液实施葡糖苷酶处理、优选β-葡糖苷酶处理,其中所述处理优选通过以下实施
a)添加能够表达适用于降解不需要的中间体、底物和/或低聚糖副产物的一种或更多种糖苷酶的微生物菌株;和/或
b)使用表达一种或更多种糖苷酶的发酵菌株,其优选通过向发酵液添加诱导物和/或通过改变发酵液的温度来实施;和/或
c)向发酵液添加粗酶形式或纯化酶形式的一种或更多种糖苷酶,优选至少β-葡糖苷酶。
在根据本发明的方法的另一个优选实施方案中,在纯化步骤i)至iv)中至少一个之后,优选在纯化步骤iv)之后,使用真空蒸发或反渗透或纳滤(例如用尺寸排阻极限的纳滤膜进行纳滤)将发酵液
a)浓缩至≥100g/L、优选≥200g/L、更优选≥300g/L的浓度;和/或
b)在<80℃、优选<50℃、更优选20℃至50℃、甚至更优选30℃至45℃、最优选35℃至45℃的温度下浓缩(特别地与真空蒸发或反渗透有关);和/或
c)在<80℃、优选<50℃、更优选4℃至40℃的温度下浓缩(特别地与纳滤有关)。
在根据本发明的方法的另一个优选实施方案中,将纯化溶液无菌过滤和/或使其经受内毒素去除,其优选借助该纯化溶液通过3kDa过滤器的过滤来实施。
在根据本发明的方法的另一个优选实施方案中,使包含中性HMO的溶液经受电渗析以进一步去除带电荷的物质,例如一价和二价盐。
在根据本发明的方法的另一个优选实施方案中,将纯化溶液浓缩至>1.5M的浓度,并冷却至<25℃、更优选<8℃的温度,以获得中性HMO的结晶物质。
在根据本发明的方法的另一个优选实施方案中,将纯化溶液喷雾干燥,特别地以20至60(重量/体积)、优选30至50(重量/体积)、更优选35至45(重量/体积)的浓度,在110℃至150℃、优选120℃至140℃、更优选125℃至135℃的喷嘴温度和/或60℃至80℃、优选65℃至70℃的出口温度下进行喷雾干燥。
此外,本发明包括用根据本发明的方法能够制备的中性人乳低聚糖(HMO)。
在优选的实施方案中,HMO存在于无菌过滤浓缩物中,例如含有浓度≥30%(重量/体积)、更优选≥40%(重量/体积)的中性HMO产物的无菌浓缩物。
在另一个优选的实施方案中,HMO是喷雾干燥的或结晶的。
在另一个优选的实施方案中,HMO选自2'-岩藻糖基乳糖、3-岩藻糖基乳糖、2',3-二岩藻糖基乳糖、乳-N-三糖II、乳-N-四糖、乳-N-新四糖、乳-N-岩藻五糖I、乳-N-新岩藻五糖、乳-N-岩藻五糖II、乳-N-岩藻五糖III、乳-N-岩藻五糖V、乳-N-新岩藻五糖V、乳-N-二岩藻六糖I、乳-N-二岩藻六糖II、6'-半乳糖基乳糖、3'-半乳糖基乳糖、乳-N-六糖和乳-N-新六糖。
在特别优选的实施方案中,HMO是2'-岩藻糖基乳糖。
在另一个优选的实施方案中,HMO具有
a)在300g/l溶液中小于1mSi/cm的电导率;
b)不含重组DNA物质,任选地不含任何DNA;和/或
c)不含来源于重组微生物的蛋白质,任选地不含任何蛋白质。
另一个优选的实施方案涉及用于医学的HMO,其优选用于预防或治疗胃肠道紊乱。
此外,本发明包括根据本发明的HMO在食品中作为添加剂的用途,优选在人类食品和/或宠物食品中作为添加剂,更优选在人类婴儿食品中作为添加剂。
参考以下附图和实施例旨在对根据本发明的主题进行更详细解释,而不希望将所述主题限制于具体实施方案。
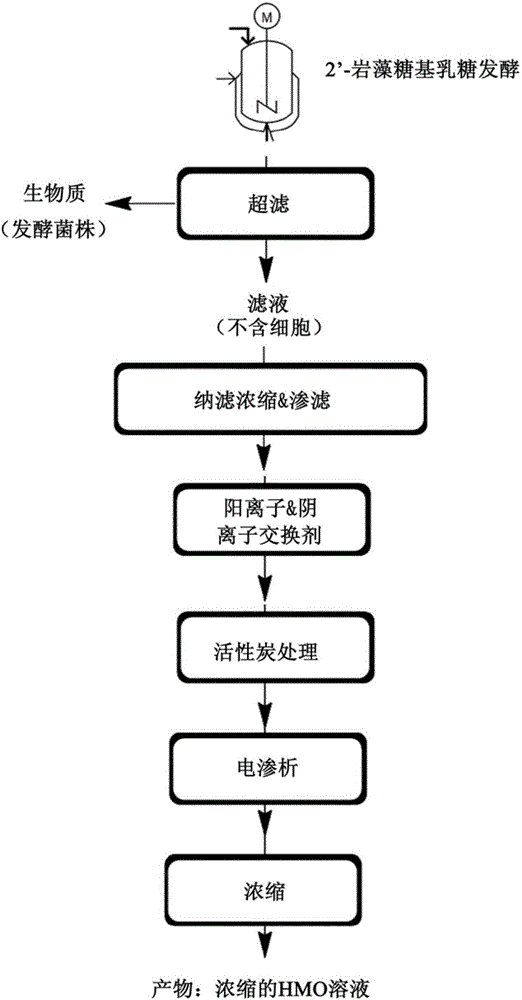
图1示出用于从发酵液纯化2'-岩藻糖基乳糖的根据本发明的方法的优选实施方案的示意图,其包括以下步骤:超滤、阳离子和阴离子交换剂处理、活性炭处理、纳滤、电渗析和浓缩。
图2示出用于从发酵液纯化2'-岩藻糖基乳糖的根据本发明的方法的另一个优选实施方案的示意图,其包括以下步骤:超滤、纳滤、阳离子和阴离子交换剂处理、活性炭处理、电渗析和浓缩。
图3示出用于从发酵液纯化2'-岩藻糖基乳糖的根据本发明的方法的另一个优选实施方案的示意图,其包括以下步骤:超滤、阳离子和阴离子交换剂处理、纳滤、活性炭处理、电渗析和浓缩。
实施例1:从使用重组微生物生产菌株I的发酵纯化2'-岩藻糖基乳糖。
在成分确定的盐培养基中进行2'-岩藻糖基乳糖补料分批发酵,其使用重组的合成2'-岩藻糖基乳糖的E.coli菌株(E.coli BL21(DE3)ΔlacZ),该菌株含有由wbgL基因编码的基因组整合2'-岩藻糖转移酶(参见EP111151571.4),且具有全部由强组成型四环素启动子控制的E.coli lacY、manB、manC、gmd和fcl的另外拷贝,含有包含基因galM、galK、galT和galE的功能性半乳糖操纵子。该成分确定的盐培养基包含7g/l NH4H3PO4、7g/l K2HPO4、2g/l KOH、0.37g/l柠檬酸、1ml/l消泡剂(Struktol J673,Schill+Seilacher)、1mM CaCl2、4mM MgSO4、微量元素和2%的甘油作为碳源。
微量元素由以下组成:0.101g/l氨三乙酸、pH6.5,0.056g/l柠檬酸铁铵,0.01g/l MnCl2·4H2O,0.002g/l CoCl2·6H2O,0.001g/l CuCl2·2H2O,0.002g/l硼酸,0.009g/l ZnSO4·7H2O,0.001g/l Na2MoO4·2H2O,0.002g/l Na2SeO3,0.002g/l NiSO4·6H2O。
甘油-补料由甘油800g/l、MgSO4 2.64g/l和微量元素溶液4ml/l组成。为了形成2'-岩藻糖基乳糖,使用216g/l的乳糖补料。用氨溶液(25%体积/体积)控制pH。补料分批发酵在30℃在持续曝气和搅拌下培养90小时。发酵开始后90小时,所添加乳糖的大部分转换为2'-岩藻糖基乳糖。为了去除发酵上清液中仍然存在的乳糖,在发酵开始后90小时向发酵罐添加第二细菌菌株。
添加的第二细菌菌株与使用的第一细菌菌株在基因上相同,然而仅在β-整合有半乳糖苷酶的基因组的表达上不同。添加的第二细菌菌株的孵育导致剩余乳糖在5小时内消失。每1升发酵液添加约10ml表达β-半乳糖苷酶的第二细菌菌株的起始培养物。
然后使用具有10kDa截留的错流过滤器(Microdyn Nardir)通过超滤从发酵培养基分离生物质。
获得含有42g/l的2'-岩藻糖基乳糖的约1m3不含细胞的发酵培养基。然后使不含细胞的发酵培养基经过强阳离子交换剂(以H+形式的Lewatit S 6368A(Lanxess),离子交换剂床体积的大小为100升),以去除带正电荷的污染物。然后通过添加2M氢氧化钠溶液将获得的溶液调到pH7。
然后(立即)使该溶液经过阴离子交换柱(离子交换剂的床体积是100升)。所使用的强阴离子交换剂Lewatit S 2568(Lanxess)是氯(Cl-)形式的。将获得的溶液再次中和至pH7。然后使用Alfa-Laval NF99HF纳滤膜和六倍体积的无菌去离子水渗滤由此获得的溶液。用纳滤膜进一步浓缩该溶液,其中获得200g/l的2'-岩藻糖基乳糖溶液和7mS/cm的电导率。
然后用活性炭处理浓缩的2'-岩藻糖基乳糖溶液以去除显色物质如美拉德反应产物和醛醇缩合反应产物。每升浓缩的2'-岩藻糖基乳糖溶液使用20g活性炭Norit GAC EN,得到显著脱色的溶液。
然后使用装配有PC-Cell E200膜堆叠的PC-Cell BED 1-3电渗析仪(PC-Cell,Heusweiler,Germany)将由此获得的浓缩的2'-岩藻糖基乳糖溶液电渗析至0.3mS/cm。所述堆叠含有以下膜:阳离子交换膜CEM:PC SK和具有60Da尺寸排阻极限的阴离子交换膜AEM:PcAcid60。使用0.025M氨基磺酸(磺酰胺酸)溶液作为ED过程中的电解质。
然后,在40℃在真空下浓缩获得的溶液以获得45%的2′-岩藻糖基乳糖溶液。然后,使用Na+形式的离子交换剂Lewatit S 6368 A(Lanxess)(所用离子交换剂的床体积是10升)再次处理浓缩溶液,之后使用Cl-形式的阴离子交换剂Lewatit S 2568(Lanxess)(所用离子交换剂的床体积是10升)中和。
然后用活性炭(Norit DX1 Ultra)处理获得的2′-岩藻糖基乳糖溶液。对于1升的45%的2′-岩藻糖基乳糖溶液使用30g活性炭。
然后使该溶液再次经受电渗析直到获得小于0.3mSi/cm的电导率。
之后,通过使溶液经过3kDa的过滤器(Pall Microza超滤中空纤维模块SEP-2013,Pall Corporation,Dreieich)对该溶液进行无菌过滤。
然后喷雾干燥获得的2′-岩藻糖基乳糖溶液的一部分以用于分析。
为NMR谱读取,将喷雾干燥的产物溶于六氘代二甲基亚砜(DMSO-d6)中。关于质子和13C分析,观察到以下特征化学位移:
1H NMR(500MHz,DMSO-d6)δ6.63(d,J=6.5Hz,1H),6.28(d,J=4.7Hz,1H),5.21(d,J=2.4Hz,1H),5.19(d,J=2.4Hz,1H),5.01(d,J=2.2,2H),4.92(d,J=5.0Hz,1H),4.89(dd,J=4.6,1.3Hz,2H),4.78(d,J=5.3Hz,1H),4.74(d,J=5.1Hz,1H),4.63(m,6H),4.53(t,d,J=5.5,1H),4.46(d,J=5.2Hz,1H),4.44(d,J=5.0Hz,1H),4.38-4.26(m,5H),4.23(d,J=0.9,1H),4.05(d,J=0.9,1H),4.00(quin,J=3.3,1H),3.68-3.60(m,7H),3.59-3.50(m,13H),3.50-3.37(m,6H),3.24(dt,J=8.8,2.2Hz,1H),3.14(m,2H),2.96(td,J=8.4,4.7Hz,1H),1.04(d,J=6.1Hz,3H),1.03(d,J=6.1Hz,3H).
13C NMR(126MHz,DMSO-d6)δ100.99,100.85,100.35,100.25,96.59,92.02,78.13,77.78,77.16,77.01,75.2775.05,74.67,73.70,72.33,71.62,71.56,70.91,69.90,69.64,68.75,68.16,66.33,60.17,59.82,59.67,16.37,16.36.
发现化学位移与2′-岩藻糖基乳糖结构一致。
使用该方案,可以获得45%的2′-岩藻糖基乳糖浓缩物,2′-岩藻糖基乳糖的纯度为94.5%(通过HPLC分析测定)。主要污染物是3′-岩藻糖基乳糖(1.8%)、二岩藻糖基乳糖(2.9%)和乳糖(0.3%)。
纯化收率为约70%。
重要的是,使用50个循环的qPCR在10g冷却物质中没有可测到的重组物质。使用纳米-Bradford分析(Roth,Karlsruhe Germany)测定的获得物质的蛋白质量为<50μg/g冻干物质。灰分总量测定为0.19%。重金属(砷、镉、铅和汞)的浓度为低于0.1μg/g物质。内毒素水平测定为<0.005EU/ml 2'-岩藻糖基乳糖浓缩物。
实施例2:从使用重组微生物生产菌株II的发酵纯化2'-岩藻糖基乳糖。
通过具有100kDa截留的错流过滤器(Microdyn Nadir)过滤包含浓度为47g/l的2'-岩藻糖基乳糖的1m3微生物发酵物,以获得不含细胞的发酵培养基。
采用以下培养基作为发酵培养基:主要培养基组分:甘油30g/l、NH4H2PO4 7g/l、K2HPO4 7g/l、柠檬酸盐0.3g/l、KOH 2g/l、MgSO4·7H2O 2g/l;微量元素:CaCl2·6H2O 20mg/l、氨三乙酸101mg/l、柠檬酸铁铵56mg/l、MnCl2·4H2O 9.8mg/l、CoCl2·6H2O 1.6mg/l、CuCl2·2H2O 1mg/l、H3BO3 1.6mg/l、ZnSO4·7H2O 9mg/l、Na2MoO4·2H2O 1.2mg/l、Na2SeO31.2mg/l;供养物质(feed material):甘油和乳糖。
然后使不含细胞的发酵培养基经过H+形式的阳离子交换剂(Lewatit S 6368 A(Lanxess)(离子交换剂床体积为100升)以去除带正电荷的污染物。然后通过添加2M氢氧化钠溶液将获得的溶液调至pH7。然后,立即使该溶液经过包含氯(Cl-)形式的强阴离子交换剂Lewatit S 2568(Lanxess)的阴离子交换柱(所用离子交换剂床体积是100升)。将获得的溶液再次中和至pH7。然后将这样获得的溶液渗滤(使用10倍体积的无菌去离子水),并使用纳滤膜(Alfa-Laval NF99HF)将其浓缩以获得200g/l的2'-岩藻糖基乳糖溶液和约7mSi/cm的电导率。
然后用活性炭处理浓缩的2'-岩藻糖基乳糖溶液,每升浓缩的2'-岩藻糖基乳糖溶液使用20g Norit GAC EN。向过滤的2'-岩藻糖基乳糖溶液,每升添加40g的Norit DX1Ultra活性炭。然后使溶液与活性炭在4℃下接触约18小时。18小时后,通过过滤从该2'-岩藻糖基乳糖溶液去除活性炭。
然后使用装配有PC-Cell E200膜堆叠的PC-Cell BED 1-3电渗析仪(PC-Cell,Heusweiler,Germany)将该溶液电渗析至电导率<0.3mS/cm。所述堆叠含有以下膜:阳离子交换膜CEM:PC SK和具有60Da尺寸排阻极限的阴离子交换膜AEM:PcAcid60。使用0.025M氨基磺酸(磺酰胺酸)溶液作为ED过程中的电解质。
然后浓缩获得的溶液以得到40%的2'-岩藻糖基乳糖溶液。然后,使获得的2'-岩藻糖基乳糖溶液经过Cl-形式的Lewatit S 2568(Lanxess)(床体积为10升),并用活性炭(Norit DX1Ultra)在8℃下处理18小时。然后通过使溶液经过3kDa的过滤器(Pall Microza超滤中空纤维模块SEP-2013,Pall Corporation,Dreieich)对该溶液进行无菌过滤,并使用NUBILOSA LTC-GMP喷雾干燥器(NUBILOSA,Konstanz,Germany)喷雾干燥溶液。
使用该方案,可以获得纯度为94%的2'-岩藻糖基乳糖(通过HPLC分析测定)。主要污染物是3'-岩藻糖基乳糖(1.8%)、二岩藻糖基乳糖(3.2%)和乳糖(0.2%)。纯化收率为约70%。
- 还没有人留言评论。精彩留言会获得点赞!