分离自含有大量活性成分的PSEUDOLYSIMACHIONROTUNDUMVAR.SUBINTEGRUM的新化合物,用于预防或治疗变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病的包含该化合物的组合物及它们的用途的制作方法
本发明涉及从Pseudolysimachion rotundum var.subintegrum分离的新化合物,预防或治疗变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病的包含该化合物的组合物以及它们的用途。
背景技术:
通常,炎性应答是在组织或细胞受到引起组织或细胞的一些器质性变化的任意侵染的情况下与水肿、疼痛等相关的人体的正常应答。最近,已经发现多种类型的细胞因子参与炎性疾病。
可根据应答类型将变应性反应分为四类,即,I型、II型、III型和IV型,或者根据过敏原引起复敏的时间到反应发作的时间的时间段类型,将变应性反应分为两类,即,速发型变应性反应(例如I型、II型或III型)和迟发型变应性反应(例如IV型)。
其中,I型变态反应(涉及IgE抗体并被称为过敏性类型的变态反应)引起支气管哮喘、特应性疾病(例如皮炎或肠胃炎等)、变应性鼻炎(例如花粉症)、变应性结膜炎、食物变态反应等。
哮喘被认为是复杂的气道综合征,其特征在于各种临床症状,例如咳嗽、气流阻塞引起的呼吸困难、急性或慢性气道炎症、气道高反应性(AHR)和结构重塑,并且可以可逆地或不可逆地恢复。大多数哮喘是变应性疾病,其特征在于慢性气道炎症和支气管高反应性(Minoguchi K和Adachi M.,Pathophysiology of asthma.In:Cherniack NS,Altose MD,Homma I.编,Rehabilitation of the patient with respiratory disease.New York:McGraw-Hill,1999,pp 97-104)。
哮喘可分为两种类型,即,外因性哮喘和内因性哮喘。外因性哮喘是通过暴露抗原而引起的,并且在皮肤试验或针对抗原的支气管激发试验中显示出阳性反应。通常导致年龄越来越年轻化。外因性哮喘主要由屋尘螨(House Dust Mite Dermatophagoides)和花粉、动物的上皮、真菌等引起。内因性哮喘由上呼吸道感染、运动、情绪不稳定、湿度的气候变化引起,并且其常见于成年患者。此外,由于血清中的IgE增加,可通过皮肤试验检测到外因性哮喘的IgE抗原。
关于病理生理学,通过T辅助细胞2(T-helper2,Th2)-细胞驱动的慢性炎症来识别哮喘,而且来自气道中的免疫细胞和结构细胞的各种炎性介质(例如细胞因子、趋化因子、信号分子、粘附分子和生长因子)参与了哮喘的各个阶段(Elias JA等,J Clin Invest.2003,111,pp 291-297)。在患有哮喘的患者的支气管中,活化的炎性细胞(例如嗜酸性粒细胞、肥大细胞、肺泡巨噬细胞等)释放各种炎性介质(例如半胱氨酰白三烯、前列腺素等),并且参与了有效的支气管收缩(Maggi E.等,Immunotechnology 1998,3,233-244;Pawankar R.等,Curr.Opin.Allergy Clin.Immunol.2001,1,3-6;Barnes PJ等,Phamacol.Rev.1998,50,515-596)。
因此,由于参与炎性细胞活化的各种细胞因子(例如IL-4、IL-5、IL-13等和IgE)的再生以及从炎性细胞释放的半胱氨酰白三烯的再生是炎症、变应性反应和哮喘的主要原因,迄今为止,已经进行了大量研究以从以上物质的再生开发抑制剂。
通常,慢性阻塞性肺病(COPD)是由肺中导致呼吸道阻塞的异常炎性疾病引起的肺部疾病之一。COPD产生由排出气流阻碍导致的呼吸困难,并显示出不同于哮喘的共同特征的特征(例如气道限制或气道阻塞的可逆性差、随时间推移的渐进性发展等),并可将COPD分为肺气肿和慢性阻塞性支气管炎(Barnes P.J.,Pharmacol.Rev.2004,56,515-548)。
据报道,COPD是心血管发病率和死亡率的危险因素之一,并且是2001年全球第五大死亡原因。基于慢性阻塞性肺病的全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)标准(FEV1与FVC的比例小于0.7),在大于45岁的韩国人中,慢性阻塞性肺病的患病率为17.2%(男性,25.8%;女性,9.6%)(Kim,D.S.等,Am.J.Respir.Crit.Care Med.2005,172,842-847;Sin,D.D.等,Proc.Am.Thorac.Soc.2005,2,8-11;BuistA.S.等,Lancet,2007,370,741-750)。
大多数COPD患者均具有三种病理机制(慢性阻塞性支气管炎、肺气肿和黏液堵塞),因为所述机制均由吸烟诱发,但它们可能在肺气肿和阻塞性支气管炎的比例方面有所不同。在发达国家,吸烟是目前为止COPD的最常见原因,但存在数种其它的危险因素,包括空气污染(特别是来自燃烧燃料的室内空气污染)、饮食不良和职业性暴露。COPD的特征在于肺功能随年龄的正常下降加速。缓慢的渐进性气流限制导致残疾和过早死亡,并且与极少发展为严重程度的哮喘中的症状和可变气道阻塞极其不同。
据报道,COPD的综合征和病理生理作用在根本上不同于哮喘的综合征和病理生理作用。尽管COPD和哮喘均参与呼吸道中的炎症,但是炎性过程的性质方面存在明显的差异,并在炎性细胞、介质、对炎症的应答、解剖分布以及对抗炎性疗法的应答方面有所差异,例如,(a)就炎性细胞而言,肥大细胞、嗜酸性粒细胞、CD4+细胞(Th2)、巨噬细胞等主要作用于哮喘的发生,而嗜中性粒细胞、CD8+(Tc)等主要作用于COPD的发生;(b)就炎性介质而言,白三烯B、组胺、IL-4、IL-5、IL-13、嗜酸性粒细胞活化趋化因子、RENTES、氧化应激等主要参与哮喘的发生,而TNF-α、IL-8、GRO-α等主要参与COPD的发生;(c)就炎性综合征而言,通过在早期作用于整个肺道,哮喘显示出与COPD的炎性综合征不同的炎性综合征,例如AHR(气道高反应性)、上皮脱落、纤维化、无实质参与(no parenchymal involvment)、黏液分泌、相对可逆的气道阻塞、咳嗽、打喷嚏、呼吸困难等,COPD通过作用于成人的外周气道而发生,并且显示出各种现象,例如上皮化生、实质损坏、相对不可逆的气道阻塞、慢性支气管炎、气肿等(Barnes PJ.,Chest2000,117,10S-14S;Saetta M.等,Am.J.Respir.Crit.Care Med.2001,163,1304-1309)。
对COPD的组织病理学研究显示主要牵涉外周气道(细支气管)和肺实质,而哮喘牵涉所有气道中的炎症,但不牵涉肺实质。存在细支气管的阻塞,并伴随纤维化以及T淋巴细胞和巨噬细胞的浸润。存在肺实质的损坏,以及增加数量的巨噬细胞和CD8(细胞毒性)T淋巴细胞(Saetta M.等,Am.J.Respir.Crit.Care Med.1998,157,822-826)。在患有严重COPD的患者中,支气管活检显示出与CD8细胞和巨噬细胞的浸润相似的变化以及增高数量的嗜中性粒细胞(Di Stefano A.等,Am.J.Respir.Crit.Care Med.1998,158,1277-1285)。
与哮喘相比,除了在恶化期间或当患者具有伴随的哮喘时,嗜酸性粒细胞是不显著的(Fabbri L.等,Thorax 1998,53,803-808;Fabbri LM.等,Am.J.Respir.Crit.Care Med.2003,167,418-424)。
因此,慢性阻塞性肺病(COPD)的治疗方法应与哮喘的治疗方法不同;然而,当前的疗法关注于对两种疾病进行非特异性地治疗。因此,尚不存在特别批准用于COPD的抗炎治疗,并且可用的抗炎治疗最初是针对哮喘而开发的。COPD研究面临的挑战是多方面的:需要阐明这种疾病的复杂和异质病理学的潜在机制;需要证实炎症在疾病进展中的作用。(Hele D.等,Expert.Opino.Invest.Drug,2003,12,5-18;Fox,J C.等,Curr.Opin.Pharmacol.2009,9,231-242)。
对处于更长效的β-激动剂、更安全的类固醇和联合治疗的形式的目前可用于治疗哮喘的疗法正在进行改进,并且对COPD抗胆碱能药的改善提供了症状性缓解。已将类固醇用于治疗恶化,但是到目前为止,尚且没有治疗显示出显著影响了COPD中的肺功能方面的渐进性衰退或哮喘的发展。
因此,迄今为止,已经进行了大量研究,以开发具有成功且特异性地治疗变应性疾病、炎性疾病、哮喘或COPD的潜力的新药。
本发明人关注于开发从自然资源(具有安全性和有效性,例如植物、动物等)来源的有效治疗剂,该治疗剂具有变应性疾病、炎性疾病、哮喘或COPD的有效治疗活性,并且最终,已在随后发现了意想不到的惊人结果,例如兔儿尾苗(Pseudolysimachion longifolium)的提取物的有效的抗炎活性、抗变态反应活性和抗哮喘活性(韩国专利号10-860080B1和US2012/0183632A1),以及分离自该提取物的以下各种化合物:例如毛蕊花甙(6-O-3,4-二羟基苯甲酰基梓醇)、胡黄连苷II(6-O-4-羟基-3-甲氧基苯甲酰基梓醇)、梓醇6-咖啡酸酯(6-O-3,4-二羟基肉桂酰基梓醇)、6-O-藜芦酰基梓醇(6-O-3,4-二甲氧基苯甲酰基梓醇)、米内苷(6-O-3-羟基-4-甲氧基肉桂酰基梓醇)、梓醇等(韩国专利公开号10-2006-125499A1);来自Pseudolysimachion rotundum var.subintegrum的提取物的新纯化提取物的有效的抗炎活性、抗变态反应活性和抗哮喘活性,该新纯化提取物含有大量的活性成分(例如梓醇衍生物)(ATC2:韩国专利号1476045B1,ATC1:韩国专利号1504651B1);以及迄今为止,此类提取物的抗COPD活性(韩国专利号1476095B1)。
Pseudolysimachion rotundum var.subintegrum是分布在韩国、中国、日本、Ostrov Sakhalin和俄罗斯的多年生草本植物。
基于对Pseudolysimachion rotundum var.subintegrum的提取物的抗炎活性、抗变态反应活性和抗哮喘活性进行的在先研究,本发明人试图开发分离自Pseudolysimachion rotundum var.subintegrum的提取物的显示出抗炎活性、抗变态反应活性、抗哮喘活性和抗COPD活性的新化合物。
然而,在以上引用的文献(以引用的方式将其公开内容并入本文)中,没有关于分离自Pseudolysimachion rotundum var.subintegrum的提取物的显示出抗炎活性、抗变态反应活性、抗哮喘活性和抗COPD活性的新化合物的报道或公开。
因此,本发明人已经发现了分离自Pseudolysimachion rotundum var.subintegrum的提取物的显示出抗炎活性、抗变态反应活性、抗哮喘活性和抗COPD活性的新化合物,并且本发明的化合物通过以下各种试验显示出有效的抗炎活性、抗变态反应活性、抗哮喘活性和抗COPD活性:体外试验,例如(1)使用HT1080、H292和EL4细胞系的细胞毒性试验;(2)对TNF-α诱导的MUC5AC的表达(低聚黏液/凝胶形成)的抑制试验;(3)NF-κB荧光素酶报告子分析;(4)对NF-κB转录因子活性的抑制试验;(5)经由抑制NF-κB活性,对靶基因(例如MMP-9、MUC5AC和IL-4)的mRNA表达的抑制;(6)通过MUC5AC蛋白再生分析,对MUC5AC再生的剂量依赖性抑制作用;以及体内试验,例如(7)使用经OVA敏化/激发的小鼠模型,对炎性细胞(例如嗜酸性粒细胞)的数量的降低作用;(8)对杯状细胞增生和气道高反应性的阻抑,以及对以下的抑制试验:BALF洗液中的炎性细胞因子(例如IL-4、IL-5、IL-13等)、IgE的释放和发炎细胞的浸润;(9)使用COPD动物模型(C57B/6N小鼠),对BALF洗液中的炎性细胞的增殖的抑制试验,对嗜中性粒细胞弹性蛋白酶活性和ROS(活性氧簇)再生的抑制,对IL-6、TNF-α和浸润的炎性细胞等的水平的降低作用。
技术实现要素:
技术问题
本发明提供了分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)。
本发明还提供了药物组合物和保健食品,该药物组合物和保健食品包含有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)作为活性成分,以治疗和预防变应性疾病、炎性疾病、哮喘或COPD疾病。
本发明还提供了分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)用于制造药物的用途,所述药物用于治疗或预防炎性疾病、变应性疾病、哮喘或COPD。
本发明还提供了在哺乳动物或人中治疗或预防炎性疾病、变应性疾病、哮喘或COPD的方法,该方法包括向所述哺乳动物或人给予有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)以及其药学上可接受的载体。
技术方案
本发明提供了通过以下的化学式(1)表示的(3R,5S,5aS,6R,7S,8R,8aS)-8-氯-8a-羟基-5-(2-羟基乙酰氧基)六氢-1H-3,6-亚甲基桥环戊二烯并[e][1,3]二氧杂环庚烯-7-基3,4-二羟基苯甲酸酯((3R,5S,5aS,6R,7S,8R,8aS)-8-chloro-8a-hydroxy-5-(2-hydroxy acetoxy)hexahydro-1H-3,6-methanocyclopenta[e][1,3]dioxepin-7-yl 3,4-dihydroxybenzoate)(KS534)、其异构体、其药学上可接受的盐或溶剂化物:
[化学式1]
可通过本领域熟知的常规方法,将本发明的新化合物转化为其药学上可接受的盐和溶剂化物。对于盐而言,由其药学上可接受的游离酸形成的其酸加成盐是有用的,并且可通过常规方法制备。例如,在将化合物溶解于过量的酸溶液中后,通过水混溶性有机溶剂(例如甲醇、乙醇、丙酮或乙腈)使盐沉淀,以制备其酸加成盐,并且进一步可对等量的化合物和稀酸与水或醇(例如乙二醇单甲醚)的混合物进行加热,随后通过蒸发干燥或在减压下过滤,以获得其干燥的盐形式。
作为上述方法的游离酸,可使用有机酸或无机酸。在本文中可使用例如有机酸,如甲磺酸、对甲苯磺酸、乙酸、三氟乙酸、柠檬酸、马来酸、琥珀酸、草酸、苯甲酸、乳酸、乙醇酸、葡糖酸、半乳糖醛酸、谷氨酸、戊二酸、葡萄糖醛酸、天冬氨酸、抗坏血酸、羰基酸、香草酸、氢碘酸等,以及无机酸,如盐酸、磷酸、硫酸、硝酸、酒石酸等。
此外,可通过使用碱来制备本发明化合物的药学上可接受的金属盐形式。其碱金属或碱土金属盐可通过常规方法制备,例如,在将化合物溶解于过量的碱金属氢氧化物或碱土金属氢氧化物溶液中后,将不溶性盐过滤,对剩余的滤液进行蒸发和干燥,以获得其金属盐。作为本发明的金属盐,钠盐、钾盐或钙盐是药学上合适的,并且可通过使碱金属盐或碱土金属盐与合适的银盐(例如硝酸银)反应来制备相应的银盐。
如果在本文中没有具体指明,化合物的药学上可接受的盐包括可存在于化合物中的所有酸性盐或碱性盐。例如,本发明的药学上可接受的盐包括羟基基团的盐,例如其钠盐、钙盐和钾盐;氨基基团的盐,例如溴化氢盐、硫酸盐、硫酸氢盐、磷酸盐、磷酸氢盐、二氢磷酸盐、乙酸盐、琥珀酸盐、柠檬酸盐、酒石酸盐、乳酸盐、扁桃酸盐、甲磺酸盐和对甲苯磺酸盐等,其可通过本领域熟知的常规方法制备。
由于化合物具有不对称中心,能够以光学上不同的非对映异构体的形式存在,因此,本发明的化合物包含所有光学活性异构体、R或S立体异构体及其混合物。本发明还包括外消旋混合物、多于一种的光学活性异构体或其混合物的所有用途,以及本领域熟知的非对映异构体的所有制备或分离方法。
本发明的化合物可由本领域熟知的分离或纯化方法分离,例如硅胶柱色谱法或重结晶法,例如在韩国专利公开号10-2006-125499中公开的方法;或者通过本领域熟知的方法化学合成,其仅仅是示例性的,并且并不会以任何方式限制本发明。
可通过以下程序从Pseudolysimachion rotundum var.subintegrum制备本发明的新化合物(KS534)。
例如,新化合物(KS534)的特征在于通过以下方法制备:在第一步骤,向干燥的Pseudolysimachion rotundum var.subintegrum加入至少一种提取溶剂,所述提取溶剂选自水、C1-C4低级醇(例如甲醇、乙醇、丁醇等)或它们的混合物、优选水和甲醇的混合物、更优选处于水中的10%-100%(w/w)甲醇;在第二步骤,经受选自热水回流提取、冷水提取、超声提取或常规提取中的至少一种提取方法,优选在10℃-150℃(优选20℃-70℃)的温度下进行30分钟-72小时(优选1小时-48小时)的时间段的冷水提取,更优选在10℃-60℃(优选20℃-50℃)的温度下重复进行30分钟-72小时(优选6小时-48小时)的时间段的冷水提取,然后在40℃-120℃(优选60℃-90℃)的温度下重复进行30分钟-72小时(优选6小时-48小时)的时间段的回流提取,以提供第一提取物;在第三步骤,经受过滤、在真空下的浓缩和干燥方法,以得到干燥的粗提取物;以及重复地经受选自如下的至少一种纯化方法,以提供本发明的新化合物(KS534),(i)反相分配色谱法、(ii)快速柱色谱法、(iii)RP C18柱色谱法、(iv)硅胶柱色谱法、(v)离子交换色谱法或(iv)体积排阻色谱法。
本文所定义的术语“药学上可接受的载体或赋形剂”包括用于组成药物的非活性成分、药物添加剂。它们包括染料、香料、粘合剂、软化剂、填充剂、润滑剂、防腐剂以及更多的种类。常见的赋形剂包括玉米淀粉、乳糖、滑石、硬脂酸镁、蔗糖、明胶、硬脂酸钙、二氧化硅、虫胶和釉料,其在本领域中是熟知的(参见,食品和药品管理局的主页:www.fda.gov或药物信息在线:www.drugs.com)或在先文献(例如,Rowe,Raymond C等,Handbook of Pharmaceutical Excipients,Pharmaceutical Press,第7版,2012)。
本文所公开的术语“预防”包括经由给予本发明的组合物来抑制或延缓本文公开的一些疾病或紊乱的发生的任何行为;并且本文所公开的术语“治疗”包括经由给予本发明的组合物来减轻或有利地改变与本文公开的一些疾病或紊乱相关的症状的任何行为。
本发明人已经发现可从Pseudolysimachion rotundum var.subintegrum制备新化合物(KS534),该化合物通过以下各种试验显示出有效的抗炎活性、抗变态反应活性、抗哮喘活性和抗COPD活性:体外试验,例如(1)使用HT1080、H292和EL4细胞系的细胞毒性试验;(2)对TNF-α诱导的MUC5AC的表达(低聚黏液/凝胶形成)的抑制试验;(3)NF-κB荧光素酶报告子分析;(4)对NF-κB转录因子活性的抑制试验;(5)经由抑制NF-κB活性,对靶基因(例如MMP-9、MUC5AC和IL-4)的mRNA表达的抑制;(6)通过MUC5AC蛋白再生分析,对MUC5AC再生的剂量依赖性抑制作用;以及体内试验,例如(7)使用经OVA敏化/激发的小鼠模型,对炎性细胞(例如嗜酸性粒细胞)的数量的降低作用;(8)对杯状细胞增生和气道高反应性的阻抑,以及对以下的抑制试验:BALF洗液中的炎性细胞因子(例如IL-4、IL-5、IL-13等)、IgE的释放和发炎细胞的浸润;(9)使用COPD动物模型(C57B/6N小鼠),对BALF洗液中的炎性细胞的增殖的抑制试验,对嗜中性粒细胞弹性蛋白酶活性和ROS(活性氧簇)再生的抑制,对IL-6、TNF-α和浸润的炎性细胞等的水平的降低作用。
因此,根据本发明的另一方面,本发明提供了包含有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)作为活性成分的药物组合物或保健功能性食品,以治疗和预防变应性疾病、炎性疾病、哮喘或COPD疾病。
本发明提供了包含分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)和药学上可接受的载体或赋形剂的药物组合物或保健功能性食品,以用于治疗或预防变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)。
根据本发明的另一方面,还提供了分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)用于制造药物的用途,所述药物用于治疗或预防变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)。
根据本发明的另一方面,还提供了分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)和药学上可接受的载体或赋形剂用于制造药物的用途,所述药物用于治疗或预防变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)。
根据本发明的另一方面,还提供了在哺乳动物中治疗或预防变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)的方法,其中,该方法包括向患有变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)的哺乳动物给予治疗有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)。
根据本发明的另一方面,还提供了在哺乳动物中治疗或预防变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)的方法,其中,该方法包括向患有变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)的哺乳动物给予包含治疗有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)和药学上可接受的载体或赋形剂的组合物。
基于组合物的总重量,本发明用于治疗和预防变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)的组合物可包含0.1wt%-99wt%、优选0.1wt%-50wt%的上述化合物。
本发明所述的组合物可作为药物组合物提供,所述药物组合物包含药学上可接受的载体、佐剂或稀释剂,例如乳糖、右旋糖、蔗糖、山梨醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、金合欢橡胶、海藻酸盐/酯、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油。制剂可额外包含填充剂、抗凝集剂(anti-agglutinating agents)、润滑剂、保湿剂、矫味剂、乳化剂、防腐剂等。可对本发明的组合物进行配制,以便在将其通过使用本领域熟知的任何程序给予患者后,提供活性成分的快速释放、缓释或延迟释放。
例如,可将本发明的组合物溶解于通常用于生产注射剂的油、丙二醇或其它溶剂中。载体的合适实例包括生理盐水、聚乙二醇、乙醇、植物油、肉豆蔻酸异丙酯等,但不限于此。对于局部给予,可将本发明的提取物以软膏剂和霜剂的形式配制。
可将含有本发明组合物的药物制剂以任何形式制备,例如口服剂型(粉剂、片剂、胶囊剂、软胶囊剂、水性药物、糖浆剂、酏剂、丸剂、粉剂、囊剂(sachet)、颗粒剂)或局部制剂(霜剂、软膏剂、洗剂、凝胶剂、香膏剂、贴剂、糊剂、喷雾溶液剂、气雾剂等)或可注射制剂(溶液剂、混悬剂、乳剂)。
处于药物剂型的本发明的组合物能够以它们的药学上可接受的盐的形式使用,并且还可单独使用或以适当的联合使用、以及与其它药学上的活性化合物组合使用。
本发明的提取物或化合物的期望剂量根据受试者的状况和体重、严重程度、药物形式、给予途径和给予周期而变化,并且可由本领域技术人员进行选择。然而,为了获得期望的效果,通常推荐以本发明的提取物按照重量/天计以0.0001mg/kg-1000mg/kg、优选0.001mg/kg-100mg/kg的量给予。该剂量可单次给予或每天分数次给予。
可经由多种途径将本发明的药物组合物给予受试动物,例如哺乳动物(大鼠、小鼠、家畜或人)。所有的给予模式均在考虑之列,例如,可进行口服给予、直肠给予,或者通过静脉内注射给予、肌肉内注射给予、皮下注射给予、皮内注射给予、鞘内注射给予、硬膜外注射给予或脑室内注射给予。
本发明还提供了包含有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)作为活性成分的药物组合物和保健食品,以治疗和预防变应性疾病、炎性疾病、哮喘或COPD疾病。
本发明还提供了分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)用于制造药物的用途,所述药物用于治疗或预防炎性疾病、变应性疾病、哮喘或COPD。
本发明还提供了在哺乳动物或人中治疗或预防炎性疾病、变应性疾病、哮喘或COPD的方法,该方法包括向所述哺乳动物或人给予治疗有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)以及其药学上可接受的载体。
本发明的提取物还可在多种功能性保健食品和保健食品的制备中用作主要组分或添加剂和辅助剂。
因此,本发明的另一目的是提供包含治疗有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)的保健功能性食品,该提取物包含用于预防或减缓变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)的活性成分。
本文所定义的术语“功能性保健食品”是指通过向常规食品中添加本发明的提取物以在人或哺乳动物中预防或改善目的疾病而具有增强的机能(例如身体机能或生理机能)的功能性食品。
本发明的另一目的是提供包含治疗有效量的分离自Pseudolysimachion rotundum var.subintegrum的提取物的新化合物(KS534)以及营养学上可接受的添加剂的保健食品,以用于预防或减缓变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)。
本文所定义的术语“保健食品”是指含有本发明的提取物或化合物的食品,该食品未显示出特效的预期效果,但作为少量的添加剂的形式或作为总量的粉剂、颗粒剂、胶囊剂、丸剂、片剂等的形式显示出总的预期效果。
本文所定义的术语“营养学上可接受的添加剂”包括如下的任意物质,该物质的预期用途引起或可被合理预期直接或间接地引起所述物质成为任何食物的组分或者影响任何食物的特性,并且可根据其来源将所述物质分为三组:即,(1)化学合成添加剂,例如酮、甘氨酸、柠檬酸钾、烟酸等;(2)天然添加剂,例如柿子染料、甘草提取物、结晶纤维素、gua dum等;(3)与如下混合的添加剂,例如L-谷氨酸钠、防腐剂、焦油染料等,或者各种类型(根据其在食品中的功能),例如增稠剂、熟化剂、漂白剂、螯合剂、湿润剂、防结块剂、澄清剂、固化剂、乳化剂、稳定剂、增稠剂、碱和酸、发泡剂、营养素、着色剂、矫味剂、甜味剂、防腐剂、抗氧化剂等,其是本领域或现有文献中熟知的(参见,GSFA的在线主页“Codex General Standard for Food Additives”(GSFA,Codex STAN 192-1995):www.codexalimentarius.net/gsfaonline/index.html)。
如果将物质添加到食品中以在该食品中用于特定目的,则将该物质称为直接添加剂,间接食品添加剂是由于其包装、储存或其它处理而以痕量成为食品的部分的添加剂。
本文所公开的术语“保健食品或保健功能性食品”可被囊括在食品、保健饮料、膳食补充剂等中,并且可配制成药学上给药形式的剂型,例如粉剂、颗粒剂、片剂、混悬剂、乳剂、糖浆剂、咀嚼片剂、胶囊剂、饮料等;或食品形式,例如面包、米糕、干果、糖果、巧克力、口香糖、冰淇淋、奶(例如低脂奶、乳糖水解奶、羊奶、加工奶)、乳制品(例如发酵奶、黄油、浓缩奶、奶油、乳脂肪、天然奶酪、加工奶酪、奶粉、乳清等)、加工肉制品(例如汉堡包、火腿、香肠、培根等)、加工蛋制品、鱼肉制品(例如鱼饼等)、面条产品(例如方便面、干面条、湿面条、油炸面条、非油炸面条、糊化干面条、熟面条、冷冻面条、意大利面等)、茶产品(例如茶袋、浸出茶等)、健康饮品(例如果汁饮品、蔬菜汁饮品、碳酸软饮品、豆乳饮品、乳酸饮料、混合饮料等)、调味食品(例如酱油、豆酱、红辣椒酱、chunjang(通过焦糖着色的发酵豆制品)、cheonggukjang(通过枯草芽孢杆菌(B.subtilis)而天然发酵的大豆)、混合糊、醋、酱汁、番茄酱、咖喱、调料等)、人造奶油、起酥油、比萨等,以用于预防或改善目的疾病,但本文并不打算仅限于此。
另外,可将上述提取物或化合物添加到食品或饮料中,以用于预防和改善目的病症。对于功能性保健食品组合物而言,在作为功能性保健食品或保健食品的食品或饮料中的上述提取物或化合物的量的范围通常可为食品总重量的约0.01w/w%-100w/w%。特别地,尽管在功能性保健食品、保健食品或特殊的营养食品中,本发明的提取物的优选量可根据每种食品的预期目的而变化,但是通常优选将其作为添加剂以如下的量来使用:基于100%比例的食品组合物,本发明的提取物或化合物的量的范围在食品(例如面条等)中为约0.01%-5%,在保健食品中为40%-100%。
如果本发明的保健饮料组合物以所示的比例包含上述提取物或化合物作为必需组分,对其它液体组分没有特别限制,其中,其它组分可以是各种祛臭剂或天然碳水化合物等(例如常规饮料)。上述天然碳水化合物的实例是:单糖,例如葡萄糖、果糖等;二糖,例如麦芽糖、蔗糖等;常规的糖,例如糊精、环糊精;以及糖醇,例如木糖醇和赤藓糖醇等。作为除上述祛臭剂以外的其它祛臭剂,可有利地使用天然祛臭剂(例如taumatin、甜叶菊提取物(例如levaudioside A、甘草甜素等))以及合成祛臭剂(例如糖精、阿斯巴甜等)。在100ml的本发明饮料组合物的比例内,上述天然碳水化合物的量的范围通常为约1g-20g、优选5g-12g。
除了上述组成之外的其它组分是各种营养素、维生素、矿物质或电解质、合成的矫味剂、着色剂和改良剂(在奶酪、巧克力等的情况中)、果胶酸及其盐、海藻酸及其盐、有机酸、保护性胶体粘合剂、pH控制剂、稳定剂、防腐剂、甘油、醇、碳酸饮料中使用的碳化剂等。除上述组分之外的其它组分可以是用于制备天然果汁、果汁饮料和蔬菜汁饮料的果汁,其中,所述组分可单独使用或组合使用。组分的比例不是很重要,但相对于每100w/w%的本发明组合物,其范围通常为约0w/w%-20w/w%。其中的包含上述提取物或化合物的可增加食品的实例是各种食品、饮料、口香糖、维生素复合物、健康改善食品等。
本发明的提取物或本发明的化合物没有毒性和副作用,因此它们可安全使用。
对于本领域技术人员显而易见的是,在不脱离本发明的精神或范围的情况下,可对本发明的组合物、用途和制备进行各种修改和变化。
通过以下实施例对本发明进行更具体地说明。然而,应当理解的是,本发明不以任何方式限于这些实施例。
有益效果
如本发明所描述的,分离自Pseudolysimachion rotundum var.subintegrum的提取物的本发明的新化合物(KS534)通过以下各种试验显示出有效的抗炎活性、抗变态反应活性、抗哮喘活性和抗COPD活性:体外试验,例如(1)使用HT1080、H292和EL4细胞系的细胞毒性试验;(2)对TNF-α诱导的MUC5AC的表达(低聚黏液/凝胶形成)的抑制试验;(3)NF-κB荧光素酶报告子分析;(4)对NF-κB转录因子活性的抑制试验;(5)经由抑制NF-κB活性,对靶基因(例如MMP-9、MUC5AC和IL-4)的mRNA表达的抑制;(6)通过MUC5AC蛋白再生分析,对MUC5AC再生的剂量依赖性抑制作用;以及体内试验,例如(7)使用经OVA敏化/激发的小鼠模型,对炎性细胞(例如嗜酸性粒细胞)的数量的降低作用;(8)对杯状细胞增生和气道高反应性的阻抑,以及对以下的抑制试验:BALF洗液中的炎性细胞因子(例如IL-4、IL-5、IL-13等)、IgE的释放和发炎细胞的侵袭;(9)使用COPD动物模型(C57B/6N小鼠),对BALF洗液中的炎性细胞的增殖的抑制试验,对嗜中性粒细胞弹性蛋白酶活性和ROS(活性氧簇)再生的抑制,对IL-6、TNF-α和浸润的炎性细胞等的水平的降低作用。
附图说明
结合附图,从以下的详细描述中,将更清楚地理解本发明的上述目的和其它目的、特征和其它优点,其中:
图1示出了K534化合物的1H-1H COSY相关和HMBC相关;
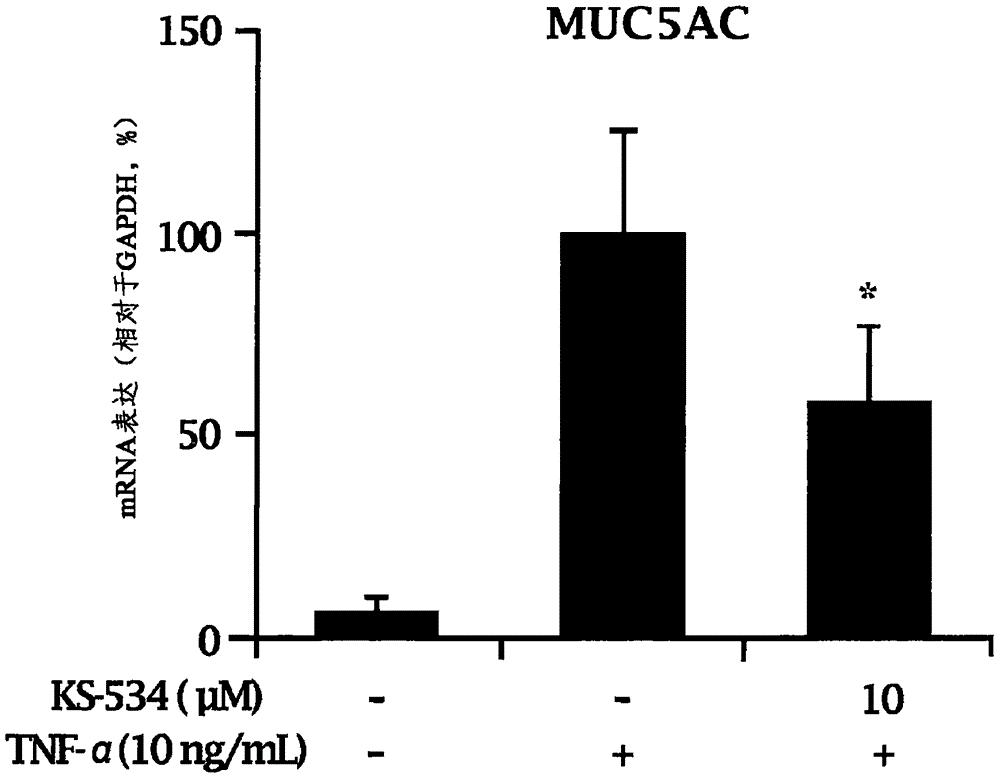
图2示出了通过使用qRT-PCR,试验样品对MUC5AC的mRNA表达的作用;
图3示出了通过使用荧光素酶报告子分析,试验样品对TNF-α诱导的NF-κB的活性的抑制作用(通过Student’s-t检验进行统计分析,并且认为P值(**,<0.01)是统计学显著的);
图4呈现了通过使用改良的-ELISA法,试验样品对MUC5AC蛋白的表达水平的抑制作用(通过Student’s-t检验进行统计分析,并且认为P值(**,<0.01和***,<0.001)是统计学显著的);
图5呈现了本发明化合物对BALF中的炎性细胞的数量的作用;
图6呈现了本发明化合物对BALF中的炎性细胞因子的数量的作用;
图7呈现了本发明化合物对血清中的OVA特异性IgE的水平和总IgE的数量的作用;
图8呈现了通过使用组织学检查,本发明化合物对肺组织细胞中的炎性反应的作用;
图9呈现了使用组织学检查,本发明化合物对肺组织细胞中的黏膜分泌过多的作用;
图10呈现了本发明化合物对BALF中的炎性细胞的数量的作用;
图11呈现了本发明化合物对BALF中的ROS再生的作用;
图12呈现了本发明化合物对BALF中的弹性蛋白酶活性和BALF含量的水平的作用;
图13代表了本发明化合物对BALF中的TNF-α和IL-6的水平的作用;
图14描绘了使用组织学检查,本发明化合物对肺组织细胞中的炎性反应的作用。
具体实施方式
对于本领域技术人员来说显而易见的是,在不脱离本发明的精神或范围的情况下,可对本发明的组合物、用途和制备进行各种修改和变化。
通过以下实施例对本发明进行更具体地说明。然而,应当理解的是,本发明不以任何方式限于这些实施例。
实施例
以下参考例、实施例和实验例意在进一步说明本发明,而并不会限制其范围。
参考例1.分析装置
通过熔点测定装置(Koflermicrohostage)对熔点进行测定(未进行校正);通过Jasco P-1020旋光仪测定旋光度;通过UV-VIS 2450光谱仪测定UV数据;通过Jasco FT/IR-4200测定FT-IR光谱;使用TMS作为内标,通过Varian UNITY 400MHz FT-NMR光谱仪测定NMR光谱;通过Waters Q-TOF Premier光谱仪测定HRESIMS;以及在实验中使用UV/VIS-155检测器和泵305,通过Gilson HPLC进行HPLC分析。
实施例1:从Pseudolysinachion rotundum var.subintegrum制备新化合物(KS534)
1-1.粗提物的制备
将2.0kg干燥的Pseudolysimachion rotundum var.subintegrum(根据GAP,KRIBB 0020697,KRIBB的植物提取物库,培养于韩国Soi-myeon Eumseong-gun Chungcheongbuk-do,244;Taejeon,韩国)切成小块,并与10L的40%乙醇混合。将混合物在室温下搅拌24小时,并在78℃下回流提取12小时,进行三次,以收集滤液。用滤纸将提取物过滤,以除去残渣。在55℃-65℃于减压下,通过旋转蒸发器(EYELA,N-2100,日本)将收集的滤液浓缩,并用冷冻干燥机干燥,以得到198.7g干燥的粗提取物。
1-2.纯化的提取物的制备
将20g干燥的粗提取物溶解于混合溶剂(25%MeOH-水)中,并通过使用制备型反相色谱(Zeoprep C18,75μm,200mm×250mm,Zeochem,Louisville,U.S.A)进行进一步纯化。将洗脱级分(f1-f4)收集并在真空下浓缩。将5.0g的f2级分加载至中压液相色谱(MPLC),通过使用柱RP C-18(Zeoprep C18,20mm×250mm,10μm,Zeochem,Louisville,U.S.A)和洗脱溶剂(MeOH-水溶液=2∶8、3∶7、4∶6、10∶0),以得到5个亚级分f2a、f2b、f2c、f2d和f2e。
1-3.新化合物KS534的制备
使0.8g亚级分f2c进行半制备HPLC(Synergy Polar-RP 4μm,21.2mm×250mm,Phenomenex,Torrance,CA,U.S.A.,处于H2O中的22%MeCN),以得到亮棕色粉末状的新的环烯醚萜化合物(3R,5S,5aS,6R,7S,8R,8aS)-8-氯-8a-羟基-5-(2-羟基乙酰氧基)六氢-1H-3,6-亚甲基桥环戊二烯并[e][1,3]二氧杂环庚烯-7-基3,4-二羟基苯甲酸酯(KS534;C22H26ClO13),显示如下理化性质。
[α]20D-30.0°(c 0.2,MeOH)。
HRESIMS(观察到m/z 533.1035[M-H]-):准分子3∶1离子簇
IR光谱:3412cm-1(羟基基团);1692cm-1(不饱和酯羰基)
1H和13C NMR光谱:表1
1H-1H COSY光谱(图1)
NOESY光谱(图1)
[表1]DMSO-d6中的KS534的1H(400MHz)和13C(100MHz)NMR光谱数据
实验例1.细胞毒性的初步测定。
为了测定本发明化合物的细胞毒性,通过文献(Shiyama等,Talanta,1997,44,1299-1305;Tominaga等,Anal.Commun.,1999,36,47-50)中公开的方法进行以下的初步试验。
1-1.细胞系和细胞培养物的制备
HT1080(CRL-12012)、H292(CRL-1848)和鼠EL4细胞(TIB-39)购自美国典型培养物保藏中心公司。
在补充有10%FBS(胎牛血清;Gibco)和抗生素(100单位/ml青霉素+100单位/ml链霉素)的DMEM培养基(SB30243.01,Dulbecco改良的Eagle培养基;DMEM,HyClone)中,对HT1080(CRL-12012)和鼠EL4细胞进行培养。在补充有10%FBS和抗生素的RPMI培养基(SH30027.01,RPMI 1640,Gibco)中,对H292细胞进行培养。在37℃于加湿的5%CO2气氛条件下,对细胞进行培养。PMA(P8139,佛波醇12-肉豆蔻酸酯13-乙酸酯)购自公司(Sigma Chemical Co.,St.Louis,MO),且TNF-α来自公司(300-01A,PeproTech,NJ USA Inc.),以在实验中使用。
1-2.H292细胞中的细胞毒性的评价
将H292细胞系(人肺黏膜癌细胞系)以5×104个细胞/ml的浓度悬浮于补充有10%FBS的RPMI培养基中,并将100μL的悬浮液接种到96孔板中,以使细胞附着至该板12小时。用各种浓度的试验样品(KS534化合物)进行处理并培养24小时。将10μL的CCK-8溶液与90μL的培养基混合,并将100μL的溶液加至各孔。在反应30分钟至4小时后,在570nm处对溶液的吸光度进行测定。基于用0.2%DMSO处理的阴性对照组,根据以下的数学公式1对细胞存活率进行计算,并将结果示于表2中。
[数学公式1]
细胞存活率(%)=OD 570nm(试验组)/OD 570nm(阴性对照组)×100
结果,如表2所示,已证实在低于20μM下,KS534化合物在H292细胞中不会显示出细胞毒性。
[表2]
实验例2.对MUC5AC的表达的抑制。
为了测定H292细胞系中的对通过TNF-α诱导的MUC5AC的表达的抑制作用,进行以下试验:
2-1.mRNA表达水平的测定
通过文献(Kim等,J.Cell.Biochem.2008,104,1906-1917)中公开的方法,进行总RNA的分离、cDNA合成和定量实时PCR。
总的来说,使用TRIzol试剂(155596-026,Life Technologies)分离总RNA,并使用酶(Omniscript逆转录酶,205113,Qiagen,CA)合成第一cDNA链。根据制造商的手册,通过使用装置1(S1000热循环仪,Bio-rad,USA)和装置2(2×Greenstar master mix,Bioneer,韩国)来进行定量实时PCR扩增。
2-2.对MUC5AC表达的作用
为了测定H292细胞系中的对通过TNF-α诱导的MUC5AC的表达的抑制作用,进行以下试验:
测定KS534化合物对MUC5AC mRNA表达的抑制作用,以验证对炎性疾病(例如COPD)的治疗或预防活性。
具体地,通过实时聚合酶链式反应(实时PCR)、定量实时聚合酶链式反应(qPCR)和MUC5AC免疫分析法,测定TNF-α诱导的MUC5AC的再生量。将H292细胞以2×104个细胞/孔的浓度接种到48孔板中,以附着24小时,并将培养基用新的含有0.1%FBS的培养基替换,培养24小时。用10μM KS534处理2小时,并用20ng/ml的TNF-α处理,培养12小时。
为了提取总RNA,在定量后,使用Trizol B(Invitrogen)提取RNA,并使用Omniscript RT试剂盒(Qiagen,GmbH,Hilden,德国)合成cDNA。将合成的cDNA分别与模板、表3所示的MUC5AC引物和GAPDH引物混合,并且使用PCR mix(PCR Master Mix,Bioneer,韩国)按照如下进行PCR:94℃下5分钟,1个循环,用于预变性;95℃下30秒,60℃下45秒以及72℃下45秒,30个循环,用于变性;72℃下10分钟,1个循环,用于最终延伸。
[表3]
结果已证实,如在表4和图2中可看出的,在用TNF-α处理的对照组中,MUC5AC的量增加;而在用10μM KS534处理的试验组中,MUC5AC的mRNA表达的量降低58.47%(KS534对MUC5AC表达的抑制率:41.52%)。
因此,已验证了KS534化合物抑制MUC5AC的基因表达,并且其在治疗COPD方面是有用的。
[表4]KS534对Muc5AC mRNA表达的抑制活性的总结
实验例3.对NF-κB活性的抑制
为了测定对NF-κB活性的抑制作用,进行以下试验:
3-1.NF-κB荧光素酶报告子分析
通过文献(Pulin Che等,Assay Drug Dev.Technol.,2012,10,61-68)中公开的方法进行NF-κB荧光素酶报告子分析。
为了建立用于NF-κB荧光素酶报告子分析的稳定细胞,根据制造商的方案将NF-κB应答元件克隆到载体(pGL4.32载体,E849A,Promega)中,并通过使用Lipofectamine 2000(11668-019,Invitrogen)将其感染至细胞(H292细胞,CRL-1848,ATCC)。使用潮霉素(400μg/mL)对感染的细胞筛选2周,并单独地对集落进行克隆和增殖。将细胞以5×103个细胞/孔的浓度放置在96孔板上24小时。将试验样品以预定浓度进行预处理,并用20ng/ml的TNF-α处理12小时。通过E6110试剂盒(OneGlo Luciferase Assay试剂盒,Promega)对荧光素酶的活性进行测定,并使用DMSO作为赋形剂对照。
3-2.对NF-κB转录因子的活化的抑制作用
据报道,TNF-α活化NF-κB转录因子以诱导MUC5AC表达(Busse,P.J.等,J.Allergy Clin.Immun.,2005,116,1256-1263;Smirnova,M.G.等,Cytokine.2000,12,1732-1736)。
基于KS534化合物对MUC5AC表达的抑制作用,本发明人已进行研究以证实存在于MUC5AC启动子中的NF-κB转录因子的活性是否受到KS534化合物的抑制。
在以下实验之前,建立了具有荧光素酶报告子载体pGL4.32(luc2P/NF-κB-RE/Hygro,Promega公司)的稳定表达的H292细胞(正常的人支气管上皮细胞)。将细胞以5×104个细胞/mL的浓度悬浮于含有10%FBS的DMEM培养基(Hyclone公司)中,并将100μL的细胞各自接种到96孔板上,以附着至板12小时。将培养基用新的含有0.1%FBS的培养基替换,培养12小时,并用10μM的KS534处理2小时。用20ng/ml的TNF-α处理,培养12小时。通过One-glow荧光素酶分析系统(Promega公司),对荧光素酶的活化程度进行测定。在将孔板中的所有培养基移除后,用PBS溶液洗涤该板两次,并向各孔中加入60μL的被动裂解缓冲液(PLB),以裂解细胞30分钟。将50μL的细胞裂解溶液转移至新的96孔板,并向其中加入50μL的含有LAR II试剂的萤火虫荧光素酶底物。通过Microplate Luminometer LB 96V(EG&G Berthold公司)对发光测定0.5秒,并将结果示于表5和图3中。
[表5]KS534对NF-κB活性的抑制率的总结
结果已证实,基于通过TNF-α诱导的NF-κB活性(100%),用10μM KS534处理的试验组显示出63.35%的有效抑制作用(KS534的抑制率:36.65%)。
因此,已验证KS534化合物显著抑制了NF-κB转录因子的活性。
实验例4.对MUC5AC蛋白的再生的抑制。
为了测定对MUC5AC蛋白的再生的抑制作用,通过文献(Sikder,MA.等,Phytother.Res.,2014,28,62-68)中公开的方法进行以下试验。
4-1.对MUC5AC蛋白的再生的抑制作用
为了测定对炎性疾病(例如COPD)的治疗活性,按照如下测定了对MUC5AC释放的抑制作用:
对于针对再生的MUC5AC进行的免疫分析,将50μL的实验例3中收集的上清液分配至96孔板,在50℃下于恒温箱中干燥。
在用添加了1%BSA的PBS溶液进行洗涤后,加入MUC5AC抗体(ab3649,abcam Co.)以在室温下一起反应1小时,然后向其中加入二抗,一起反应1小时。再次洗涤后,向其中加入3,3’,5,5’-四甲基联苯胺过氧化物溶液(54827-17-7,Sigma-aldrich),一起反应20分钟。在通过加入硫酸溶液使反应终止后,通过VERSAmax酶标仪(SMP500-14915,Molecular Devices,USA)对450nm处的吸光度进行测定(Sikder,M.A.等,Phytother.Res.,2014,28,62-68;Takeyama,K.等,Proc.Natl.Acad.Sci.U.S.A.,1999,96,3081-3086)。结果示于表6和图4中。
结果已证实,在用TNF-α处理的组中,MUC5AC的分泌量显著增加,并且基于用TNF-α处理的组中的MUC5AC的分泌量(100%),用2.5μM、5μM和10μM KS534处理的试验组对MUC5AC的再生分别显示出93.38%、78.27%和64.77%(KS534的抑制率:6.62%、21.73%和35.23%)的有效抑制作用。
[表6]KS534对Muc5AC分泌的抑制活性的总结
实验例5.经哮喘诱导的动物模型中的抗哮喘活性。
为了测定试验样品在哮喘诱导动物模型中的抗哮喘活性,通过文献(Shin,I.S.等,Food Chem.Toxicol.,2013,62,506-513)中公开的方法进行以下试验。
5-1.动物敏化和气道激发
从Samtako公司(Seoul,韩国)购买无特定病原体的雌性BALB/c小鼠(约20g,6周龄),针对相关呼吸道病原体对所述小鼠进行血清学常规筛选,并在实验前使小鼠在如下条件的实验环境下适应1周:控制22±2℃的温度、55±15%的相对湿度、光照/黑暗周期。
简言之,每两周通过腹膜内注射20μg OVA(卵白蛋白;A5503,Sigma,St.Louis,MO),对小鼠进行敏化,所述OVA在处于200μl的PBS缓冲液(pH 7.4)中的2mg氢氧化铝(A8222,Sigma-Aldrich,MO.USA)中乳化。在初始敏化后的第21天至第23天,使用超声雾化器(NE-U12;Omron Corp.,Tokyo,日本),用OVA(处于PBS中的1%)通过气道对小鼠激发30分钟。在抗原处理24小时后,测定气道高反应性,并在最后一次激发48小时后将小鼠处死。在最后一次激发48小时后,用过量的戊巴比妥(50mg/kg,Hanil,韩国)将小鼠处死,施行气管切开术。在将1.4ml的生理盐水溶液(PBS)灌入肺中之后,通过气管插管抽吸三次来获得支气管肺泡灌洗液(BALF)。
将组分为以下数组,即,(a)正常对照组(NC):用OVA处理或未用OVA处理的组;(b)哮喘诱导组(OVA):用OVA处理以诱导哮喘的组;(c)对比组:用阳性对照组(M30,孟鲁司特;30mg/kg,PO,Sigma-Aldrich Co.Ltd.,SML-0101+OVA)处理的组;以及(d)试验样品组:用KS534化合物(30mg/kg,PO,Sigma-Aldrich Co.Ltd.,SML-0101+OVA)处理的组。
测试组的各组由7只小鼠组成,并且在第一次OVA处理后的第21天至第23天,向所述小鼠口服给予各种浓度的试验样品。
将从多个实验获得的所有结果记录为平均值±SD(标准偏差),并使用SPSS 10.0程序,通过利用单因素ANOVA检验来确定各组之间的对比。根据Dunnett的多重比较检验(作为事后检验)来确定各组之间的统计学显著性。结果表示为P值:<0.05(*),统计学上显著的。
5-2.BALF的分离和免疫细胞的测定
使用离心机,对回收自各小鼠的支气管肺泡灌洗液(BALF)的上清液进行分离,并保存在冰箱中,以测定炎性细胞的水平。
将BALF加载到载玻片上,并使用Cellspin机器(Cyto12.5+clip5,Hanil Science Industrial,韩国)离心以将细胞固定到载玻片上。根据制造商的说明,通过染色试剂(Sysmex,Cat No.38721,瑞士)对细胞进行染色,并通过显微镜(×400)对各样品中的炎性细胞数进行计数。
如图5所示,与作为正常对照组(NC)的未用OVA处理的组相比,在作为哮喘诱导组(OVA)的经OVA吸入和处理的对照组中,嗜酸性粒细胞和炎性细胞的总数显著增加。
在口服给予各种浓度的试验样品的试验样品组中,嗜酸性粒细胞和炎性细胞的总数显著降低。
5-3.BALF中的细胞因子水平的分析
为了证实试验样品对支气管肺泡灌洗液(BALF)中的Th2细胞因子(IL-4、IL-5和IL-13)的水平的抑制作用,根据制造商的手册,通过使用与各细胞因子特异性地反应的ELISA试剂盒(VersaMax,Molecular Devices,USA),对支气管肺泡灌洗液(BALF)中的Th2细胞因子(IL-4、IL-5和IL-13)的水平进行测定。
如图6所示,与作为正常对照组(NC)的未用OVA处理的组中的Th2细胞因子水平相比,在作为哮喘诱导组(OVA)的用OVA处理的对照组中,Th2细胞因子(IL-4、IL-5和IL-13)的水平显著增加。
在用孟鲁司特(MO,30mg/kg)处理的阳性对照组以及经口服给予各种浓度的试验样品(KS534)的试验样品组中,Th2细胞因子(IL-4、IL-5和IL-13)的增加的水平显著降低。
5-4.对血清中的OVA特异性IgE和IgE的水平的作用
为了证实实施例中制备的试验样品对血清中的IgE和OVA特异性IgE的水平的抑制作用,通过文献(Kay,A.B.,N.Engl.J.Med.,2001,344,30-37)中公开的方法进行以下ELISA试验。
对从以上制备的后腔静脉中分离的血清进行回收,以测定血清中的OVA特异性IgE和IgE的水平。
将血清加入96孔板(ELISA板,2592,Costa,USA),并在4℃下用含有20μg/ml的OVA(Sigma,MO,USA)的0.1M NaHCO3缓冲溶液(pH 8.3)涂覆16小时。在使用含有1%牛血清白蛋白(P2007,Biosesang,韩国)的PBS对非特异性反应进行抑制后,将用于试验的血清稀释至1∶400,并在室温下一起反应2小时。在用含有0.05%吐温20的PBS洗涤后,在室温下,使血清与经稀释的(×300)抗小鼠IgE单克隆抗体(MCA419,Serotec,Oxford,UK)反应2小时,并与经稀释的(×4000)HRP-缀合的山羊抗大鼠IgG多克隆A(432402,Biolegend,USA)反应1小时。洗涤后,用3,3′,5,5′-四甲基联苯胺(432402,Biolegend Ins,USA)底物对溶液进行染色,通过2N H2SO4将反应终止,以通过使用光谱法(Versamax,Molecular Devices,US)对450nm处的吸光度进行测定。
如图7所示,在作为哮喘诱导组(OVA)的用OVA处理的对照组中,血清中的OVA特异性IgE和IgE的水平显著增加,而在用孟鲁司特(MO)处理的阳性对照组以及经口服给予各种浓度的试验样品(KS534)的试验样品组中,血清中的OVA特异性IgE和IgE的水平显著降低。
5-5.肺组织学
为了证实实施例中制备的试验样品的抗哮喘作用,通过文献(Kwak YG.等,J.Clin.Invest.,2003,111,1083-1092)中公开的方法对支气管肺泡组织进行以下组织病理学分析。
在10%中性缓冲福尔马林中,将未进行支气管肺泡灌洗的BALB/c小鼠提供的肺组织固定24小时。在包埋于环氧树脂中之后,然后制成4μm厚的切片,将组织用H&E溶液(苏木精;Sigma MHS-16和曙红,Sigma HT110-I-32)染色,以观察肺组织的炎症,并用过碘酸希夫(PAS,IMEB Inc.,USA)染色,以观察肺组织中的黏膜分泌。通过光学显微镜来测定肺组织的病理变化。
如图8所示,在支气管周围发现许多炎性细胞(包括嗜酸性粒细胞),在作为哮喘诱导组(OVA)的用OVA处理的对照组中也发现上皮细胞的增生以及气管肌的肥大,而在用孟鲁司特(MO,30mg/kg)处理的阳性对照组以及经口服给予各种浓度的试验样品(KS534)的试验样品组中,发炎细胞的侵袭显著降低。
如图9所示,在作为哮喘诱导组(OVA)的用OVA处理的对照组中,来自肺组织中的支气管上皮细胞的杯状细胞的黏膜分泌急剧增加,而在用孟鲁司特(MO,30mg/kg)处理的阳性对照组以及经口服给予各种浓度的试验样品(KS534)的试验样品组中,来自肺组织中的支气管上皮细胞的杯状细胞的黏膜分泌显著降低。
总的来说,本发明的KS534化合物可预防或治疗各种疾病,例如OVA引起的哮喘。本发明的KS534化合物有效地抑制炎性细胞(包括嗜酸性粒细胞)的浸润和Th2型IL-4、IL-5、IL-13的再生,以及降低IgE的水平和OVA特异性IgE的再生,这已通过针对支气管肺泡组织的组织病理学分析得到证实。
总之,已证实本发明的KS534化合物有效地减轻了哮喘的主要综合征(例如嗜酸性粒细胞增多症、肺部炎症、黏液分泌过多)以及抑制免疫应答,由于本发明的KS534化合物与常规的可用化学药物(孟鲁司特)具有相似或等效的功效,因此可将其用作哮喘的有效的天然治疗剂。
实验例6.动物模型试验
为了测定在COPD动物模型中的本发明化合物的抗COPD作用,使用如同文献(Bhavsar,T.等,J.Chronic Obstr.Pulm.Dis.,2008,3,477-481)中公开的COPD诱导小鼠进行以下试验。
6-1.实验动物
从Koatech公司(www.koatech.co.kr,Seoul,韩国)购买无特定病原体的雄性C57BL/6N小鼠(约22g-24g,6周龄),针对相关呼吸道病原体对所述小鼠进行血清学常规筛选,并在饲养室(控制温度22±2℃,湿度55±15%,光照/黑暗周期12小时)中饲养,允许自由获取饲料(不含抗生素,Samyang Oil&Feed Corp.,韩国)和水,适应实验环境1周。
6-2.药物和给药
(1)试验样品
将2种试验样品(即,KS534(15mg/kg和30mg/kg)、Daxas(主要成分:罗氟司特,10mg/kg))溶解在0.5%羧甲基纤维素钠(C9481,Sigma-Aldrich,USA)中,用作试验样品。
(2)给药
在气管内灌注(i.t.)之前1小时,向小鼠口服给予KS534和罗氟司特(ROF II-492,HETERO,印度)。
6-3.COPD小鼠模型的制备
(1)标准香烟
将3R4F Kentuchy参考香烟(加利福尼亚大学,USA)用作产生香烟烟雾的标准香烟。在打开后用22±1℃的温度和60±2%的湿度调和48小时-72小时之后,使用香烟,每支香烟含有9.4mg焦油、11mg TPM(总颗粒物质)和12mg一氧化碳。
(2)程序
使用香烟烟雾发生器(DBL Co.Ltd.,www.dhbiolink.com,韩国)进行香烟烟雾的暴露。将小鼠分为五组:正常(NC)、COPD(用LPS鼻内灌注香烟烟雾)、Rof(10mg/kg的罗氟司特,p.o.+用LPS鼻内灌注香烟烟雾)以及KS534-15和KS534-30(分别为15mg/kg和30mg/kg的KS534,p.o.+用LPS鼻内灌注香烟烟雾)。使用香烟烟雾发生器进行香烟烟雾的暴露(一次抽吸/分钟,在2秒内35mL抽吸体积,每60秒,每天8支香烟)。使小鼠在暴露室(50cm×30cm×30cm)中接受1h的香烟烟雾暴露,进行3天。在香烟烟暴露3天前1小时,通过口服管饲向小鼠给予罗氟司特和piscroside C。在最终暴露至香烟烟雾后的1小时,在麻醉下经鼻内灌注LPS(10μg溶解于50μL蒸馏水中)。实验结束后,分离并收集各大鼠的血液、BALF和肺细胞,以进行试验。
6-4.BALF分离和免疫细胞数量的测定
在完成实验后,用Zoletil50(3VX9,Virbac,法国,p.o)麻醉大鼠,并且通过尾静脉释放血液。为了从肺中分离BALF,用缝线将右肺的支气管结扎,然后进行气管造口术。将IV-用导管(16GA,3S-Cath,Dukwoo,韩国)放入支气管中,并且用缝线将支气管和导管(16GA,3S-Cath,Dukwoo,韩国)均固定。将含有1mL的DPBS 0.7(Dubecco磷酸盐缓冲盐水,Invitrogen,USA)的注射器连接至其上,并驱使DPBS循环三次以分离BALF。将用缝线结扎的右肺分离,用10%中性福尔马林溶液固定,并将剩余的肺组织保存在-70℃下的冰箱中。将分离的BALF在1500rpm下离心15分钟以制备细胞团块物(cell pellet),并将上清液保存在-70℃下的冰箱中,以用于细胞因子分析。将细胞团块物悬浮于DPBS中,并通过使用细胞离心分离机(CS03270047,Hanil,韩国)使细胞附着至载玻片玻璃。施行Diff-Quik染色(ZS1003,Sysmex,日本),并通过光学显微镜(DM1000,Leica,德国)观察细胞,以对各试验样品中的免疫细胞数进行计数。
如图10所示,在COPD诱导组中,观察到BALF中的嗜中性粒细胞的特征性的增高水平。与COPD诱导组相比,用罗氟司特处理的药物对照组显示出嗜中性粒细胞的水平降低约21.1%。一段时间后,与COPD诱导组相比,用15mg/kg和30mg/kg的KS534处理的组显示出嗜中性粒细胞的水平分别显著降低26.3%和25.7%。
6-5.对BALF中的嗜中性粒细胞弹性蛋白酶活性和ROS的作用
通过DCF-DA(二氢二氯荧光素二乙酸酯,35854,Sigma-Aldrich,USA)对从小鼠分离的BALF中的ROS水平进行测定,并将DCF-DA的终浓度调节至20μM,以200μL孵育30分钟。通过装置Flexstation3(Molecular Device,USA)对荧光进行测定。通过使用N-琥珀酰基-(丙氨酸)3-对硝基苯胺(S4760,Sigma-Aldrich)作为底物并孵育90分钟,测定BALF中的嗜中性粒细胞弹性蛋白酶的活性。在405nm处测定所得的吸光度。
如图11所示,在COPD诱导组中,BALF中的ROS(活性氧簇)的再生急剧增加。然而,与COPD诱导组相比,用罗氟司特处理的药物对照组显示出ROS水平降低约22.2%,并且与COPD诱导组相比,用15mg/kg和30mg/kg的KS534处理的组显示出ROS的水平显著降低19.5%和27.5%。
如图12所示,在COPD诱导组中,蛋白水平在BALF中急剧增加。与COPD诱导组相比,用罗氟司特处理的药物对照组显示出蛋白水平的显著降低。与COPD诱导组相比,用15mg/kg和30mg/kg的KS534处理的组显示出蛋白水平显著降低20.8%和28.5%。
如图12所示,在COPD诱导组中,嗜中性粒细胞弹性蛋白酶的活性在BALF中急剧增加。与COPD诱导组相比,用罗氟司特处理的药物对照组显示出嗜中性粒细胞弹性蛋白酶的活性的显著降低。与COPD诱导组相比,用15mg/kg和30mg/kg的KS534处理的组显示出嗜中性粒细胞弹性蛋白酶的活性的显著降低。
6-6.BALF中的细胞因子分析
通过酶联免疫吸附分析法(ELISA)对从小鼠分离的BALF中的IL-6(SM6000B,R&D System,USA)和TNF-α(555268,BD Bioscience,USA)的水平进行测定。根据制造商的手册,对各细胞因子进行分析,并通过ELISA leader(VersaMax,Molecular Devices,USA)测定450nm处的吸光度。
如图13所示,在COPD诱导组中,BALF中的IL-6水平急剧增加。与COPD诱导组相比,用罗氟司特处理的药物对照组显示出IL-6水平的显著降低,并且与COPD诱导组相比,用15mg/kg和30mg/kg的KS534处理的组显示出IL-6的水平降低35.8%和50.6%。在COPD诱导组中,BALF中的TNF-α水平急剧增加。与COPD诱导组相比,用罗氟司特处理的药物对照组显示出TNF-α水平的显著降低,并且与COPD诱导组相比,用15mg/kg和30mg/kg的KS534处理的组显示出TNF-α的水平降低18.3%和27.6%。
如图14所示,发炎细胞的侵袭在细支气管周围显著增加,并且在COPD诱导组中也发现上皮细胞的增生以及气管肌的肥大,而在用罗氟司特处理的阳性对照组以及经口服给予各种浓度的试验样品(KS534)的试验样品组(30mg/kg,KS534)中,发炎细胞的侵袭显著减少。
总的来说,在COPD诱导组中,BALF中的IL-6和TNF-α的水平以及炎性细胞的数量显著增加,而且在COPD诱导组中,ROS的再生和弹性蛋白酶的活性急剧增加。一段时间后,本发明的KS534化合物有效地降低了炎性介质(例如嗜中性粒细胞)和炎性细胞因子(例如IL-6和TNF-α)的数量,这已通过针对支气管肺泡组织的组织病理学分析得到证实。
总之,已证实与用作阳性对照组的常规可用药物(罗氟司特)(针对蛋白酶活性并未显示出显著降低)相比,本发明的KS534化合物有效地抑制了COPD的大多数病理学综合征。因此,本发明的KS534化合物可用作COPD的有效的天然治疗剂。
6-7.统计
使用单因素ANOVA检验,对从多个实验获得的全部结果进行确定,并根据Dunnett多重比较检验(用于事后对比结果),验证各组之间的统计学显著性。
实验例7.大鼠中的口服给药的急性毒性试验
通过向6周龄的SPF Sprague-Dawley大鼠给予本发明的化合物来进行急性毒性试验。
向由2只大鼠组成的各组口服给予250mg/kg、500mg/kg、1000mg/kg、5000mg/kg的本发明的提取物和化合物,并对大鼠的症状观察14天。在给予提取物或化合物之后,对所有的临床变化(即,死亡率、临床征象、体重变化)进行观察,并进行血液试验(例如血液学试验和血液生物化学试验)。尸体解剖后,观察腹部器官和胸部器官的异常变化。
在任何组或任一性别中,在死亡率、临床征象、体重变化和总体发现方面没有显示出任何变化。此外,在用5000mg/kg的本发明提取物或化合物处理的试验组中未显示任何毒性。
因此,已证实本发明的提取物和本发明制备的化合物是有效且安全的物质,其在口服给药中显示出大于5000mg/kg的LD50。
发明的方式
在下文中,将对赋形剂的配制方法和种类进行描述,但是本发明不限于此。代表性的制备例描述如下。
注射剂的制备
通过常规的注射剂制备方法,将活性组分溶解,将pH控制至约7.5,然后将所有组分填充入2mL安瓿中并灭菌,制备注射制剂。
粉剂的制备
通过将以上组分混合并填充密封包装,制备粉末制剂。
片剂的制备
通过将以上组分混合并进行压片,制备片剂。
胶囊剂的制备
通过常规的明胶制备方法,将以上组分混合并填充明胶胶囊,制备片剂。
液体剂的制备
通过常规的液体剂制备方法,将活性组分溶解,然后将所有组分填充入1000mL安瓿中并灭菌,制备液体制剂。
保健食品的制备
上述维生素和矿物质混合物能够以多种方式进行变化。不应认为此类变化脱离了本发明的精神和范围。
保健饮料的制备
通过常规的保健饮料制备方法,将活性组分溶解、混合、在85℃下搅拌1小时、过滤,然后将所有组分填充入1000mL安瓿中并灭菌,制备保健饮料制剂。
由此对本发明进行描述,本发明显然能够以多种方式进行变化。不认为此类变化脱离了本发明的精神和范围,并且对于本领域技术人员显而易见的是,所有此类修改意在被囊括在所附的权利要求的范围内。
工业实用性
如在本发明中所描述的,来自Pseudolysimachion rotundum var.subintegrum的提取物的本发明的KS534化合物通过以下各种试验显示出有效的抗炎活性、抗变态反应活性、抗哮喘活性和抗COPD活性:体外试验,例如(1)使用HT1080、H292和EL4细胞系的细胞毒性试验;(2)对TNF-α诱导的MUC5AC的表达(低聚黏液/凝胶形成)的抑制试验;(3)NF-κB荧光素酶报告子分析;(4)对NF-κB转录因子活性的抑制试验;(5)经由抑制NF-κB活性,对靶基因(例如MMP-9、MUC5AC和IL-4)的mRNA表达的抑制;(6)通过MUC5AC蛋白再生分析,对MUC5AC再生的剂量依赖性抑制作用;以及体内试验,例如(7)使用经OVA敏化/激发的小鼠模型,对炎性细胞(例如嗜酸性粒细胞)的数量的降低作用;(8)对杯状细胞增生和气道高反应性的阻抑,以及对以下的抑制试验:BALF洗液中的炎性细胞因子(例如IL-4、IL-5、IL-13等)、IgE的释放和发炎细胞的侵袭;(9)使用COPD动物模型(C57B/6N小鼠),对BALF洗液中的炎性细胞的增殖的抑制试验,对嗜中性粒细胞弹性蛋白酶活性和ROS(活性氧簇)再生的抑制,对IL-6、TNF-α和浸润的炎性细胞等的水平的降低作用。因此,本发明的KS534化合物可用作治疗剂或功能性保健食品,以用于治疗和预防变应性疾病、炎性疾病、哮喘或慢性阻塞性肺病(COPD)。
- 还没有人留言评论。精彩留言会获得点赞!