κ‑酪蛋白来源生物活性肽的制备和应用的制作方法
本申请是原申请的分案申请,原申请的申请日为:2014.12.09;申请号为:2014108094134;发明创造名称为:κ-酪蛋白的生物活性多肽及其制备和应用。
本发明涉及蛋白领域,具体涉及多种来源于κ-酪蛋白的生物活性多肽及其制备和应用。
背景技术:
由于生物活性肽作为促进健康的生物活性成分,具有传递生理信息,调节生理功能的作用,对于人体的神经、消化、生殖、生长、运动、代谢、循环等系统的正常生理活动的维持非常重要。它们不仅具有抗病毒、细菌、抗高血压、降胆固醇等作用,而且作为免疫调节剂具有调节免疫反应、抗肿瘤等功能;能够清除自由基具有延缓衰老的功效,是当前国际食品界最热门的研究课题和极具发展前景的功能因子。各种活性肽常作为功能食品添加成分用于食品的实践生产,特别是在乳饮料、食品添加剂的应用方面已经取得良好效果。乳源性生物活性肽生物的功能及对消费者的健康的影响正备受重视。
近年来,越来越多的科学研究表明很多来源于生物蛋白的小肽具有多种生物学活性,如激素作用、免疫调节、抗血栓、抗高血压、降胆固醇、抑菌、抗病毒、抗癌作用等。同时,研究发现小肽可以被人体更好地吸收和利用,改变了传统的蛋白质只能被降解成氨基酸才能被吸收利用的观点。在众多生物蛋白中各种牛乳蛋白是非常重要的生物活性多肽来源之一,它们被乳酸菌分解利用,并发生了一系列生理生化反应,使蛋白质变为多肽或者游离的氨基酸,最终被人体消化吸收或通过小肠上皮细胞的吸收转运直接进入人体的血液循环,发挥其生物活性作用。
因此,这些生物活性小肽不仅成为筛选药物的天然资源宝库,也是功能性食品工业的主要原料成分。目前,生物活性肽的制备及其应用开发已经成为世界范围内研究的热点。
免疫活性肽是继阿片肽发现后首次从乳中获得并证明其生理活性的一类生物活性肽。1981年,jolles等人首次发现,利用胰蛋白酶水解人乳蛋白,从水解物中得到一种免疫活性肽段,其氨基酸序列为val-glu-pro-ile-pro-tyr,该短肽被证明在体外实验中能够增强小鼠腹腔巨噬细胞对绵羊血红细胞的吞噬作用,静脉注射,则能增强小鼠对肺炎克氏杆感染的抵抗能力。elitsur等人经胃蛋白酶处理酪蛋白得到arg-tyr-leu-gly-tyr-leu-glu和arg-tyr-leu-gly-tyr-leu,研究证明该两短肽不仅具有阿片样活性,也具有免疫调节活性,可增强淋巴细胞增殖,提高自然杀伤细胞(nk)能力,促进噬中性白细胞的移动。张少辉等人利用瑞士乳杆菌发酵脱脂乳获得了生物活性多肽qepvl及其降解产物qepv,经过体外抗氧化实验、体外免疫功能促进实验,验证了多肽qepv具有较好的抗氧化生物学活性和促进细胞免疫的活性,一方面能够清除机体内的自由基,减少自由基对人体的伤害;另一方面,生物活性多肽qepvl和qepv还能够增强机体免疫力,增强淋巴细胞、巨噬细胞的增殖能力,使巨噬细胞一氧化氮诱生量增加,并促巨噬细胞分泌细胞因子。
尽管牛乳蛋白内隐含有许多具有生物活性的肽序列,但这些生物活性肽序列只有通过一定的手段将其释放出来才能发挥作用。获取乳蛋白源活性肽的主要手段有两种:发酵,利用微生物(乳酸菌)发酵乳源蛋白获取;酶解,包括来自动物的消化道酶和来自植物和微生物的蛋白酶。
研究结果表明乳源性生物活性肽作为一类小分子物质,以其分子量低、活性强、用量少的独特优势,已越来越多的引起人们的重视。所以它们不仅仅作为功能性食品原料用于各种功能性食品的制造,而且作为免疫调节剂具有调节免疫反应、抗肿瘤等功能;能够清除自由基具有延缓衰老的功效。此外,多数乳源性生物活性肽能够抵抗胃肠道的消化,在小肠内以完整的形式被机体吸收,而不必被分解成单个氨基酸,具有易消化吸收,食用安全性极高。因此乳源性生物活性肽的能够提高机体抵御外界不良因素的刺激、降低机体发病率等功能特性备受重视,有望成为具有清除自由基、减少患癌几率和延缓衰老的非药物性物质原料,在功能性食品和医药领域具有非常广阔的应用前景,今后必将成为国际食品界和生物医药产业界的最热门的研究课题,为提高人类健康水平、不得病或者说少得病、延缓衰老、延长寿命发挥重要的作用。
技术实现要素:
本发明的目的在于提供:
一种分离的生物活性多肽ntvpa,其包括
(a)由asn-thr-val-pro-ala(seqidno:1)所示的氨基酸组成的多肽;
(b)或在seqidno:1所示的氨基酸序列中经取代、缺失或添加一个或几个氨基酸且具有同等活性的由(a)衍生的多肽;
一种分离的生物活性多肽vvtil,其包括
(c)由val-val-thr-ile-leu(seqidno:2)所示的氨基酸组成的多肽;
(d)或在seqidno:2所示的氨基酸序列中经取代、缺失或添加一个或几个氨基酸且具有同等活性的由(c)衍生的多肽;
一种分离的生物活性多肽pkknq,其包括
(e)由pro-lys-lys-asn-gln(seqidno:3)所示的氨基酸组成的多肽;
(f)或在seqidno:3所示的氨基酸序列中经取代、缺失或添加一个或几个氨基酸且具有同等活性的由(e)衍生的多肽。
较优的,所述生物活性多肽的来源为乳源性。
κ-酪蛋白的氨基酸序列为既有技术,具体氨基酸序列如seqidno:4所示:
metmetlysserphepheleuvalvalthrileleualaleuthrleuglyalaglnglu
glnasnglnglugluproileargcysglulysaspgluargphepheserasplysile
alalystyrileproileglntyrvalleuserargtyrprosertyrglyleuasntyrtyr
glnglnlysprovalalaleuileasnasnglnpheleuprotyrprotyrtyralalys
proalaalavalargserproalaglnileleuglntrpglnvalleuserasnthrval
proalalyssercysglnalaglnprothrthrmetalaarghisprohisprohisleu
serphemetalaileproprolyslysasnglnasplysthrgluileprothrileasn
thrilealaserglygluprothrserthrserthrprothrthrgluserthrvalleu
glyaspserprogluvalilegluserproprogluileasnthrvalglnvalthrser
thralaval。
本发明的生物活性多肽ntvpa为乳源性,具体来源于κ酪蛋白,并且为κ酪蛋白(seqidno:4)第102~106位的氨基酸残基。
本发明的生物活性多肽vvtil为乳源性,具体来源于κ酪蛋白(seqidno:4)第8~12位的氨基酸残基。
本发明的生物活性多肽pkknq为乳源性,具体来源于κ酪蛋白(seqidno:4)第131~135位的氨基酸残基。
较优的,所述生物活性多肽ntvpa、vvtil、pkknq均具有体外抗氧化活性和增强机体免疫力的功能。
本发明的生物活性多肽ntvpa、vvtil、pkknq均可以通过基因工程的方法和化学方法人工合成,也可以从乳制品中通过分离纯化、酶降解的方法获得。
本发明还公开了编码前述生物活性多肽ntvpa、vvtil、pkknq的核苷酸片段。
κ-酪蛋白的氨基酸序列以及核苷酸序列为既有技术,编码κ-酪蛋白第102~106位氨基酸残基的核苷酸片段能编码成熟的生物活性多肽ntvpa,编码κ-酪蛋白第8~12位氨基酸残基的核苷酸片段能编码成熟的生物活性多肽vvtil,编码κ-酪蛋白第131~135位氨基酸残基的核苷酸片段能编码成熟的生物活性多肽pkknq。
本发明第二方面公开了前述生物活性多肽的制备方法,步骤如下:
1)发酵:将瑞士乳杆菌(lactobacillushelveticus)添加到脱脂乳中进行厌氧发酵,获得瑞士乳杆菌发酵乳;
2)多肽的粗提:对步骤1)的瑞士乳杆菌发酵乳进行低温离心分离,取上清液;
3)多肽的纯化:
a.对步骤2)的上清液进行超滤处理,收集滤液;
b.固相萃取柱分离:收集的滤液采用waterssep-pakc18固相萃取柱萃取,收集生物活性多肽混合物;
4)多肽的消化及稳定性:采用两步酶解法酶解步骤3)的生物活性多肽混合物,获得被消化后的生物活性多肽混合物;第一步酶解所采用的酶为胃蛋白酶,第二步酶解所采用的酶为胰酶。
本发明所述脱脂乳为经过脱脂处理的牛乳,通常脱脂乳中脂肪含量小于0.1%。
较优的,步骤1)中,瑞士乳杆菌为瑞士乳杆菌(lactobacillushelveticus,cicc6024)。
较优的,步骤1)中,所述厌氧发酵的条件为:发酵温度36~38℃,发酵培养6~8h;更优选发酵温度37℃,发酵培养7h。
较优的,步骤2)中,所述低温离心的条件为:4℃,8000~10000rpm,离心15~30min。
较优的,步骤3)a中,所述超滤处理所采用的是截留分子量分别为3kda的超滤管。
更优的,步骤3)a中,所述超滤处理过程中,转速为4800r/min,时间为30min,离心温度为4℃。
较优的,步骤3)b中,固相萃取柱分离,具体方法为:活化和平衡waterssep-pakc18固相萃取柱;将步骤3)a中收集的滤液进行稀释后上样,采用洗脱液洗脱,收集所得到的洗脱液,即包含生物活性多肽混合物。
较优的,步骤3)b中,固相萃取柱分离法中,所采用的洗脱液为甲醇和ddh2o的混合液,所述甲醇和ddh2o的混合液中甲醇与ddh2o的体积比为80:20,所述甲醇和ddh2o的混合液中含有0.1%(v/v)的甲酸。
较优的,步骤3)b中,固相萃取柱分离法中,采用甲醇活化waterssep-pakc18固相萃取柱;优选2ml甲醇。
较优的,步骤3)b中,固相萃取柱分离法中,采用ddh2o平衡waterssep-pakc18固相萃取柱;优选1mlddh2o。
较优的,步骤3)b中,固相萃取柱分离法中,将步骤3)a中收集的滤液进行稀释50倍后上样,采用400ul洗脱液洗脱。
较优的,步骤3)b固相萃取柱分离法中,先采用2ml甲醇活化waterssep-pakc18固相萃取柱,采用1mlddh2o平衡waterssep-pakc18固相萃取柱;上样样品为2ml;将步骤3)a中收集的滤液稀释50倍,采用400μl洗脱液洗脱。
较优的,步骤4)所述两步酶解法具体步骤为将步骤3)得到的含有多肽的混合物溶于灭菌去离子水中,调节ph值为2.0±0.1,再加入胃蛋白酶,获得反应液,于37±0.5℃的恒温水浴中保温反应90min,获得第一步酶解液;将第一步酶解液的ph值调整为7.5±0.1,并加入胰酶,于37±0.5℃的恒温水浴中保温反应150min,获得第二步酶解液;将第二步酶解液采用沸水浴法使酶失活,时间为5min,获得酶解产物;采用冷冻干燥获得粉状酶解产物。
更优选的,所述沸水浴法为95℃水浴法。
较优的,步骤4)所述胃蛋白酶的添加量为胃蛋白酶10~30mg/g底物;所述胰酶的添加量为胰酶30~50mg/g底物。
更优的,步骤4)所述胃蛋白酶的添加量为胃蛋白酶20mg/g底物;所述胰酶的添加量为胰酶40mg/g底物。
较优的,提取分子量为501.26da的多肽的洗脱峰,即为生物活性多肽ntvpa;提取分子量为544.38da的多肽的洗脱峰,即为生物活性多肽vvtil;提取分子量为614.37da的多肽的洗脱峰,即为生物活性多肽pkknq。
在本发明中,已知ntvpa的分子量,提取分子大小为501.26da的洗脱峰,即为本发明的生物活性多肽ntvpa。具体的,本发明ntvpa分子大小为501.26da的洗脱峰其保留时间为1.93min。
在本发明中,已知vvtil的分子量,提取分子大小为544.38da的洗脱峰,即为本发明的生物活性多肽vvtil。具体的,本发明ntvpa分子大小为544.38da的洗脱峰其保留时间为7.30min。
在本发明中,已知pkknq的分子量,提取分子大小为614.37da的洗脱峰,即为本发明的生物活性多肽pkknq。具体的,本发明pkknq分子大小为614.37da的洗脱峰其保留时间为10.36min。
本发明第三方面公开了前述生物活性多肽ntvpa、vvtil、pkknq或其衍生物在制备抗氧化和/或增强机体免疫力的食品、保健品及药物中的应用。
本发明的生物活性多肽ntvpa、vvtil、pkknq、或其衍生物可以用于酸奶等乳制品以及各种食品、减少自由基对皮肤伤害的化妆品;并且由于本发明的生物活性多肽ntvpa、vvtil、pkknq能够通过胃肠道直接吸收不被降解,因此可以用于制备提高免疫力的保健品,或者用于制备具有抗氧化和/或增强机体免疫力的药物。
本发明第四方面公开了一种抗氧化药物,包含前述生物活性多肽ntvpa、vvtil、pkknq或前述生物活性多肽的衍生物。
本发明第五方面公开了一种增强机体免疫力药物,包含前述生物活性多肽ntvpa、vvtil、pkknq或前述生物活性多肽的衍生物。
本发明第六方面公开了一种潜在的延缓衰老/抗衰老的保健产品,包含前述生物活性多肽ntvpa、vvtil、pkknq或前述生物活性多肽的衍生物。
所述多肽的衍生物,是指在多肽的氨基酸侧链基团上、氨基端或羧基端进行羟基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修饰,得到的多肽衍生物。
本发明生物活性多肽的有益效果为:本发明的乳源性生物活性多肽ntvpa、vvtil、pkknq具有很好的抗氧化活性和促进机体免疫力活性;一方面能够清除机体内的自由基,减少自由基对人体的伤害;另一方面,本发明的生物活性多肽还能够增强机体免疫力,增强巨噬细胞的吞噬功能,提高机体抵御外界病原体感染的能力,降低机体发病率,而且模拟消化实验结果表明发现的三条生物活性多肽在通常的动物体内消化条件下稳定,不会被进一步降解,能够被动物机体直接吸收利用发挥其具有的生物活性功能,对开发具有抗氧化功能、增强免疫功能、延缓衰老的食品、保健品和药品具有十分重要的意义和应用价值。
附图说明
图1:瑞士乳杆菌发酵乳消化产物的洗脱图谱
图2:质量色谱提取图(m/z=501.26)
图3:质荷比为501.26的片段的一级质谱图
图4:质量色谱提取图(m/z=544.38)
图5:质荷比为544.38的片段的一级质谱图
图6:质量色谱提取图(m/z=614.37)
图7:质荷比为614.37的片段的一级质谱图
图8:质荷比为501.26的片段的二级质谱图
图9:质荷比为501.26预测得到的序列的az,by断裂情况(ntvpa)
图10:质荷比为544.38的片段的二级质谱图
图11:质荷比为544.38预测得到的序列的az,by断裂情况(vvtil)
图12:质荷比为614.37的片段的二级质谱图
图13:质荷比为614.37预测得到的序列的az,by断裂情况(pkknq)
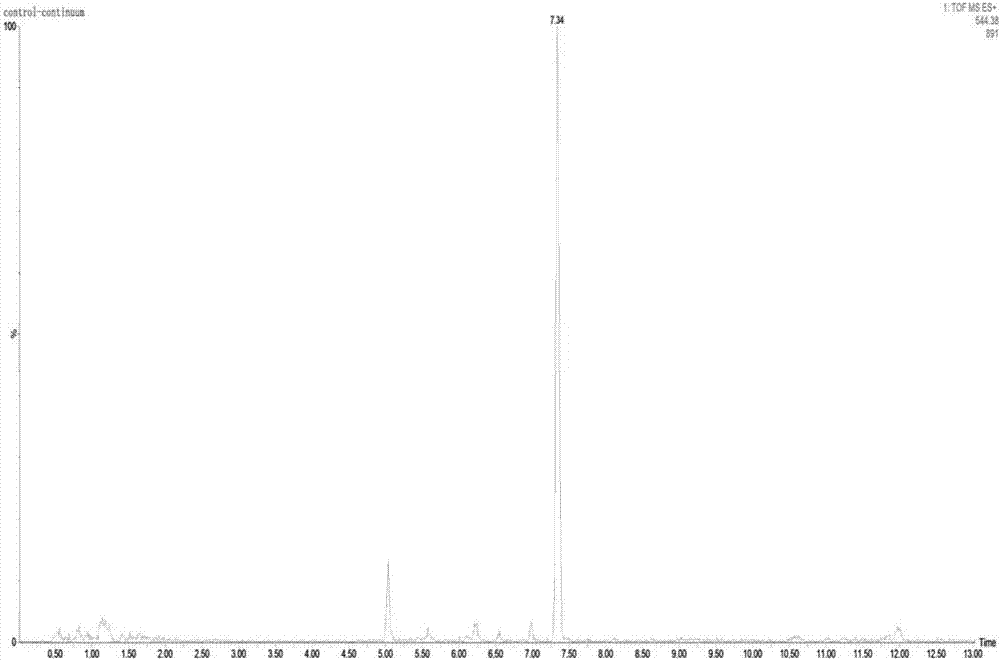
图14:对照组质量色谱提取图(m/z=544.38)
图15:对照组质荷比为544.38的片段的一级质谱图
图16:对照组质荷比为544.38的片段的二级质谱图
图17:对照组质荷比为544.38预测得到的序列的az,by断裂情况(vvtil)
图18:trolox标准曲线
具体实施方式
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
实施例1活性肽ntvpa、vvtil、pkknq的制备
一、瑞士乳杆菌发酵乳的制备
采用脱脂奶粉(新西兰nzmp牌脱脂奶粉)与水配置12wt%的脱脂乳(12wt%的脱脂乳的制备为将12g脱脂奶粉加入到88g水中,下同)。随后,将购买的菌种活化即以2%的量接种到12%(w/v)的灭菌脱脂乳中培养,温度37℃,培养时间7h,即完成瑞士乳杆菌的活化,连续活化2次,制得发酵乳,作为瑞士乳杆菌发酵乳发酵剂备用。
取10ml已制备的瑞士乳杆菌发酵剂接种到500ml已灭菌的12wt%脱脂乳中(接种率为2v/v%),37℃发酵7小时后,搅开凝乳后,在4℃条件下保存,得到瑞士乳杆菌发酵乳。二、生物活性多肽混合物的制得和确认
1.实验方法
1)样品处理
分别将前一步骤制备的瑞士乳杆菌发酵乳和对照发酵乳,以及12wt%的脱脂乳装入离心管中进行低温离心,离心条件为9000rpm/min,4℃,20min。离心后弃沉淀,取上清液。
将上清液分别倒入超滤管中,滤膜的截留分子量为3kda,超滤过程中,转速为4800r/min,时间为30min,离心温度为4℃。收集瑞士乳杆菌发酵乳的滤液,于-4℃冷冻保存。
将2ml超滤液稀释50倍后固相萃取,用1mlc18小柱,2ml甲醇活化柱子,1mlddh2o平衡柱子,上样样品为2ml稀释50倍后的滤液,最后400μl洗脱液洗脱,其中洗脱液为80:20v/v甲醇/水和0.1%v/v的甲酸。
将得到的洗脱液氮吹后冻干成干粉,后模拟胃肠道消化实验:首先,采用灭菌去离子水溶解干粉,在溶液中加入胃蛋白酶(购自sigma公司),比例是每克样品加入胃蛋白酶20mg,调节反应液的ph值至2.0,在37℃恒温水浴中保温90min;然后将反应液的ph值调整至7.5,加入胰酶(corolasepp,购自德国ab公司),比例是每克样品加入胰酶40mg,在37℃恒温水浴中保温150min;最后置于95℃水浴中加热5min使酶失活。同时设置对照组,除不加入胃蛋白酶和胰蛋白酶外,在相同时间做相同的ph和温度处理。将对照组和样品组真空冷冻干燥成粉末后,存储于-80℃备用。
2)液质分析
液相色谱条件:
仪器:watersacquityuplc超高效液相色谱仪
色谱柱规格:cshc18色谱柱
流速:0.4ml/min
温度:45℃
紫外检测波长:220nm
进样量:5μl
流动相a液:ddh2o
流动相b液:乙腈溶液
梯度条件:0min-2.5min保持99%a液,1%b液;2.5min-5minb液从1%变为5%,a液从99%变为95%;5min-10minb液从5%变为10%,a液从95%变为90%;10min-17min%b液从10%变为25%,a液从90%变为75%;17min-22min,b液从25%变为40%,a液从75%变为60%;22min-27min,b液从40%变为80%,a液从60%变为20%;27min-29min,b液从80%变为100%,a液为0%,保持2min;31min-31.5min,b液从100%变为5%,a液从0%变为95%;31.5min-32min,b液从5%变为1%,a液从95%变为99%;32min-34min,保持99%a液,1%b液。
质谱条件:
离子方式:es+
质量范围(m/z):50-2000
毛细管电压(capillary)(kv):3.0
采样锥(v):35.0
离子源温度(℃)):105
去溶剂温度(℃):350
锥孔气流量(l/hr):50.0
去溶剂气流(l/hr):600.0
碰撞能量(ev):6.0
碰撞气流(ml/min):0.6
扫描时间(sec):0.26
内扫描时间(sec):0.02
根据上述实验条件,利用masslynx软件分析,得到瑞士乳杆菌发酵乳消化产物中多肽物质保留时间和分子量,如表1所示,用masslynx软件提取多肽的质量色谱提取图、一级质谱图,见图2-7。
表1瑞士乳杆菌发酵乳消化产物中的多肽核质比
三、生物活性多肽的氨基酸序列确定方法
1.实验方法
(1)牛乳来源κ-酪蛋白氨基酸序列库的建立
κ-酪蛋白氨基酸序列通过biopep搜索得到,将搜索得到的酪蛋白氨基酸序列建成一个数据库。
2)多肽质量的匹对
对uplc-ms分析得到的质量,在牛奶蛋白的氨基酸序列数据库中进行搜索,得到相关的多肽序列。该步骤通过java程序和mysql数据库实现,具体的要求如下:输入由uplc-ms得到的质量,输出质量误差在±0.01内的多肽序列、该序列的质量、该序列的具体蛋白来源。
3)多肽序列的验证
将得到的氨基酸序列通过masslynx软件中的biolynx验证,将预测得到多肽序列理论上的二级质谱图与ms/ms得到的实际二级质谱图对比,软件通过二级质谱图中主要的峰是否匹对成功,给出分值,来确认预测得到的多肽。二级质谱匹对图和预测得到的序列的az,by断裂情况图见图8-13所示。
2.实验结果
经过验证得到生物活性多肽ntvpa、vvtil、pkknq,均为乳源性,具体来源于牛乳κ-酪蛋白,其中ntvpa为κ-酪蛋白第102~106位的氨基酸残基,vvtil为κ-酪蛋白第8~12位的氨基酸残基,pkknq为κ-酪蛋白第131~135位的氨基酸残基,分别记为seqidno:1-3。
此外,通过对照组的实验结果可知多肽ntvpa、pkknq均未在对照组的相同保留时间处出峰,即ntvpa、pkknq两种都是经胃肠道模拟消化降解得到,并不存在于瑞士乳杆菌发酵乳中。而多肽vvtil在对照组的相同保留时间处出峰,如图14~17所示,并且峰面积的改变不大,说明多肽vvtil是由瑞士乳杆菌分解牛乳中κ-酪蛋白得到的生物活性多肽,而且在消化酶的作用下相对稳定,经胃肠道模拟消化试验后不易被降解。
实施例2生物活性肽的抗氧化活性实验
采用清除自由基法(dpph·法)和总抗氧化能力法(abts法),对实施例1得到的生物活性多肽的抗氧化活性进行了测试。
1、[dpph·]法测定生物活性肽的体外抗氧化活性
1)实验试剂及仪器
试剂:1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl[dpph·]),日本wako公司生产;甲醇,上海国药公司提供;合成实施例1中得到的乳源性生物活性多肽。
主要仪器:pro200酶标仪,奥地利tecan公司产品;96孔细胞培养板,美国millipore公司制造;分析天平,meitelei-tolido公司产品。
2)实验方法
(1)0.1mmol/l[dpph·]甲醇溶液
用分析天平称取19.72mg[dpph·]溶于500ml甲醇溶液中,配制得到的0.1mmol/l[dpph·]甲醇溶液,锡纸避光保存,即配即用。
(2)[dpph·]法测定生物活性肽的抗氧化活性
在1.5mlep管中加入500μl浓度为0.1mmol/l[dpph·]甲醇溶液、按表2分别加入500μl不同浓度的待测样品和去离子水作为空白对照。
待检测样品加样完毕后,混合均匀,室温静置30min后取200微升至96孔板中,用酶标仪在517nm处检测吸光值。按照下式计算自由基清除率,实验结果见表1。
公式:[dpph·]自由基清除率=(a0-as)/a0×100%
其中a0表示空白对照组的吸光值,as表示样品组的吸光值。
表2dpph法测定生物活性多肽的总抗氧化能力结果
通过[dpph·]法对生物活性多肽ntvpa、vvtil、pkknq体外总抗氧化活性进行了测定,发现多肽ntvpa具有清除自由基能力,其具体ic50(mg/ml)值见表2。根据抗氧化能力的标准可认定发明的生物活性多肽具有抗氧化能力。
2、abts法测定生物活性肽的体外抗氧化活性
1)实验试剂及仪器
试剂:总抗氧化力试剂盒(abts法),碧云天公司生产;甲醇,上海国药公司提供;合成实施例1中得到的乳源性生物活性多肽。
主要仪器:pro200酶标仪,奥地利tecan公司产品;96孔细胞培养板,美国millipore公司制造。
2)实验方法
(1)abts工作液的配置
取40微升abts溶液与40微升氧化剂溶液配制成abts工作母液,配制后避光存放12-16小时后使用,配好的abts工作母液在室温下避光存放,2-3天内稳定。使用前,把abts工作母液用pbs稀释成abts工作液,大约40倍,要求abts工作液的吸光度减去相应的pbs空白对照后,a734为0.7±0.05。
(2)trolox标准曲线的制作
用样品配制溶液稀释标准品,把10mmtrolox标准溶液稀释成0.005、0.01、0.03、0.05、0.1、0.25、0.5和1.0mm。在96孔板的每个检测孔中加入200微升abts工作液,标准曲线检测孔内加入10微升各种浓度的trolox标准溶液,轻轻混匀。室温孵育4分钟后,用酶标仪在734nm处测定吸光值。
trolox浓度与吸光值呈良好的正比关系,浓度越高,吸光值越低。本发明trolox标准曲线结果见图14,标准曲线的线性关系良好,相关系数为0.9981,trolox标准曲线的精密度和准确度均符合检测要求,可用于后续计算。
(3)abts法测定生物活性肽的抗氧化活性
在96孔板的每个检测孔中加入200微升abts工作液,空白对照孔中加入10微升pbs溶液,样品检测孔内加入10微升各种样品,轻轻混匀。室温孵育4分钟后,用酶标仪在734nm处测定吸光值。测定根据标准曲线计算出样品的总抗氧化能力。总抗氧化能力表示方式以trolox标准溶液的浓度来表示。按照下式计算总抗氧化能力,实验结果见表3:
表3abts法测定生物活性多肽的总抗氧化能力结果
通过总抗氧化能力法(abts法)对生物活性多肽ntvpa、vvtil、pkknq体外总抗氧化活性进行了测定,发现生物活性多肽ntvpa具有较强的抗氧化能力:在浓度为5mg/ml情况下多肽ntvpa所对应的trolox浓度为1.0554mmol/l。因此,可认定发明的生物活性多肽ntvpa具有显著的抗氧化能力,而vvtil、pkknq具有一定的抗氧化能力,但相对ntvpa较弱。
根据以上实验结果说明来源于κ-酪蛋白的生物活性多肽ntvpa、vvtil、pkknq具有抗氧化能力,能够清除动物机体内的自由基,具有潜在的延缓衰老/抗衰老功能。
以上所述,仅为本发明的较佳实施例,上述实施例仅例示性说明本发明的原理及其功效,而并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
sequencelisting
<110>浙江辉肽生命健康科技有限公司
<120>κ-酪蛋白来源生物活性肽的制备和应用
<130>171879
<160>4
<170>patentinversion3.3
<210>1
<211>5
<212>prt
<213>artificial
<220>
<223>ntvpa
<400>1
asnthrvalproala
15
<210>2
<211>5
<212>prt
<213>artificial
<220>
<223>vvtil
<400>2
valvalthrileleu
15
<210>3
<211>5
<212>prt
<213>artificial
<220>
<223>pkknq
<400>3
prolyslysasngln
15
<210>4
<211>184
<212>prt
<213>artificial
<220>
<223>κ-酪蛋白
<400>4
metmetlysserphepheleuvalvalthrileleualaleuthrleu
151015
glyalaglngluglnasnglnglugluproileargcysglulysasp
202530
gluargphepheserasplysilealalystyrileproileglntyr
354045
valleuserargtyrprosertyrglyleuasntyrtyrglnglnlys
505560
provalalaleuileasnasnglnpheleuprotyrprotyrtyrala
65707580
lysproalaalavalargserproalaglnileleuglntrpglnval
859095
leuserasnthrvalproalalyssercysglnalaglnprothrthr
100105110
metalaarghisprohisprohisleuserphemetalailepropro
115120125
lyslysasnglnasplysthrgluileprothrileasnthrileala
130135140
serglygluprothrserthrserthrprothrthrgluserthrval
145150155160
leuglyaspserprogluvalilegluserproprogluileasnthr
165170175
valglnvalthrserthralaval
180
- 还没有人留言评论。精彩留言会获得点赞!