包含水杨酸酯和聚水杨酸酯的组合物及方法与流程
发明背景
本技术涉及包含水杨酸酯和聚水杨酸酯的组合物的合成,以及包含其的个人护理(包括化妆品)和药物(包括兽医的)组合物。
水杨酸(2-羟基苯甲酸)天然存在于多种植物组织中,且尤其是以高水平存在于若干流行的水果、蔬菜和物种中。水杨酸(sa)最丰富的天然来源之一是柳树皮,其在传统上具有用作止痛剂和退烧药的历史。sa的这些抗炎症作用主要是由于其对于环氧合酶活性的作用,其减少炎症前列腺素的合成以及增加各种有助于减少炎症的促消散(pro-resolvin)脂质介质的产生。
水杨酸作为口服抗炎症药物主要是作为乙酰水杨酸(阿司匹林)来使用。水杨酸也在外用配方中用作活性成分,来治疗皮肤病症如牛皮癣、疣、以及最值得注意的寻常痤疮。个人护理(包括化妆品)配方中也包括sa,以通过促进脱落来改善皮肤的光滑度。
总的来说,sa的外用效力大多是产生自其角质脱离和粉刺脱离活性,以及对于某些适应症,其抑菌性质也很重要。
对于可用于药物(包括兽医的)和个人护理(包括化妆品)应用的新活性成分始终存在着兴趣。此类成分可以创建为已知分子(其中的一或多种对皮肤具有有益作用)的组合。这些化合物经常具有原成分(pro-ingredient)的特征,其在皮肤中经水解,会释放其活性成分,其以原成分的形式可受到保护防止降解或者具有增强的可用性(例如,皮肤穿透性)。此种类型成分的实例为四-异棕榈酰抗坏血酸,其设计为增强维生素c的稳定性以及其增强其向皮肤内的递送。此种原成分实现其生物学功能的能力预期会依赖于通过皮肤中存在的酯酶活性而释放天然成分。
另一种类型的潜在期望的活性成分将会是一或多种分子的新型组合(共价的或离子的),其中至少一种分子对皮肤具有有益的作用。
发明概述
在某些实施方案中,本技术涉及合成水杨酸衍生物的方法,所述方法包括以下步骤:(a)在溶剂的存在下活化具有羧基、羟基或胺基基团的的目标分子,以产生活化的目标分子;(b)在羧基或羟基基团上活化水杨酸,以产生活化的水杨酸;和(c)将所述活化的目标分子与所述活化的水杨酸组合以产生水杨酸衍生物。
在其它实施方案中,本技术涉及合成水杨酸衍生物的方法,所述方法包括以下步骤:(a)将目标分子和水杨酸与溶剂组合以提供包含所述目标分子和水杨酸的溶液;和(b)将所述溶液与活化剂接触以提供包含活化的水杨酸的溶液.
在某些实施方案中,本技术涉及用于合成单取代的、二取代的、和多取代的水杨酸酯的混合物的方法,所述方法包括以下步骤:(a)将水杨酸和目标分子在一或多种溶剂中组合;和(b)通过提高水杨酸对目标分子的摩尔比例,来提高二取代的和多取代的水杨酸酯的比例.
在某些实施方案中,本技术涉及水杨酸衍生物的混合物,所述混合物包含:(a)单取代的水杨酸衍生物;和(b)二取代和多取代的水杨酸衍生物。
在某些实施方案中,本技术涉及用于合成单取代的、二取代的、和多取代的水杨酸衍生物的方法,所述方法包括以下步骤:(a)将活化的水杨酸与活化的目标分子在一或多种溶剂中组合;和(b)通过改变活化的水杨酸对活化的目标分子的比例,来控制二取代的和多取代的水杨酸衍生物的比例。
在某些实施方案中,本技术涉及合成聚水杨酸的方法,所述方法包括在溶剂的存在下活化水杨酸以产生聚水杨酸。
在某些实施方案中,本技术涉及药物或个人护理组合物,其包含:包含两个或更多个水杨酸酯官能团的水杨酸衍生物、或聚水杨酸酯。
在其它实施方案中,本技术涉及在患者的细胞或组织中诱导促消散介质的产生的方法,所述方法包括施用本文的组合物;或者刺激消散素(resolvin)的产生的方法,所述方法包括将患者的细胞或组织与本文的组合物接触。
附图简述
图1显示了在已经与依照本文某些实施方案的组合物接触过的外周血单个核细胞(pbmc)中14-hdohe的定量水平。
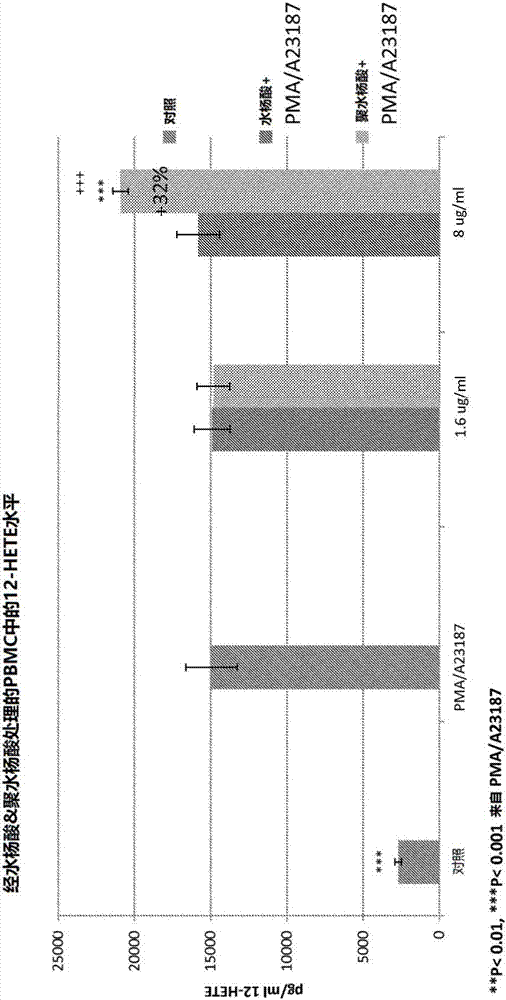
图2显示了在已经与依照本文某些实施方案的组合物接触过的外周血单个核细胞(pbmc)中12-hete的定量水平。
图3和4显示了导致促炎症和促消散脂质介质的通路。
图5显示了具有对依照本文某些实施方案的组合物进行分析的结果的层析谱,所述组合物包含依照本文的特定实施方案而配制的sa衍生物(此种情形中,聚水杨酸)。
发明详述
在本文的某些实施方案中,本技术涉及用于将sa共价偶合至其自己以形成各种长度的聚合物的方法,或者将sa偶合至任何其它目标分子(其与之形成键)的方法。在各种实施方案中,此种键可以是但不限于可用的羟基基团处的酯键或者可用的伯胺基处的酰胺键。因而,可形成许多新的分子实体,其将可以用于递送结合至其它分子的sa(其可能会赋予额外的益处)。
如本文所用,术语"水杨酸衍生物"或"sa衍生物"是指与一或多个(也即,n=1或更多)sa部分相连的或者附着有一或多个(也即,n=1或更多)sa部分的任何化合物的分子;或者是连接或附着有任何化合物(其已与sa组合,同样,n=l或更多)的sa的分子。如本文所用,"连接"或"附着"是指共价结合、离子结合或者其它的化学关联,并且也包括通过如fisher酯化的过程或者其他涉及在高温下与酸结合的过程来结合。在某些实施方案中,本文所讨论的方法是指将sa与分子组合(在所述分子上期望连接或附着所述sa,该分子在本文称作"目标分子"),以生成水杨酸衍生物的方法。
如本文所用,术语"聚水杨酸"、"聚水杨酸酯"和"聚水杨酸分子"是指包含两个或更多个彼此偶联的sa单元的分子,并且可包括直链或环状结构。
在某些实施方案中,本技术涉及这样的方法,其包括将sa溶解于适宜的溶剂以及活化其上的任何活性基团,作为形成聚水杨酸或水杨酸衍生物的步骤。例如,sa上的一或多个羧基或羟基基团可以被活化。可用的sa活化剂的实例包括但不限于以下:
(1)碳二亚胺,包括但不限于:ν,ν'-二环己基碳二亚胺(dcc);ν,ν'-二异丙基碳二亚胺(dic);n-环己基-n'-(2-吗啉代乙基)碳二亚胺甲基对甲苯磺酸盐(cmc);l-叔-丁基-3-乙基碳二亚胺;l-乙基-3-(3-二甲基氨丙基)碳二亚胺(edc);n,n'-二-叔-丁基碳二亚胺;n-(3-二甲基氨丙基)-n'-乙基碳二亚胺;或1,3-二-对-甲苯基碳二亚胺;
(2)二咪唑,包括但不限于:1,1'-羰基二咪唑;1,1'-硫代羰基二咪唑;或1,1'-草酰基二咪唑;
(3)脲鎓和磷鎓试剂,包括但不限于:o-(苯并三氮唑-1-基)-n,n,n',n'-四甲基脲鎓四氟硼酸盐;(7-氮杂苯并三氮唑-1-基氧)三吡咯烷基磷鎓六氟磷酸盐;(苯并三氮唑-1-基氧)三(二甲胺基)磷鎓六氟磷酸盐;n,n,n',n'-四甲基-o-(n-琥珀酰亚胺基)脲鎓四氟硼酸盐(tstu);l-[双(二甲氨基)亚甲基]-lh-1,2,3-三唑[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu);ν,ν,ν',ν'-四甲基-o-(lh-苯并三氮唑-l-基)脲鎓六氟磷酸盐(hbtu);或(l-氰基-2-乙氧基-2-氧亚乙基氨基氧)二甲氨基吗啉代碳鎓六氟磷酸盐(comu)。
本发明的实施方案设想在活化目标分子、sa或二者期间使用一或多种溶剂。在某些实施方案中,任何的一或多种溶剂可以是相同的或不同的-例如,当提到超过一种溶剂时,或者说提到"第一"和"第二"溶剂时,在各种实施方案中,所述第一和第二溶剂可以是相同的或不同的溶剂。用于溶解或活化sa、或用于溶解或活化要与sa(活化或未活化的)反应的另一目标分子的可用溶剂的实例,包括但不限于以下:极性疏质子溶剂,例如,乙腈;二甲基亚砜(dmso);六甲基磷酰胺(hmpa);l,3-二甲基-3,4,5,6-四氢-2(lh)-嘧啶酮(dmpu);l,3-二甲基-2-咪唑烷酮(dmi);二甲基甲酰胺(dmf);或l-甲基-2-吡咯烷酮(nmp)。
在某些实施方案中,使用上文的活化剂之一将sa的羧基或羟基基团活化,使得其反应以与另一sa分子(或者是与任何其它具有一或多个可用羧基或羟基基团的目标分子)形成酯键。在某些实施方案中,使用上文的活化剂之一将sa的羧基或羟基基团活化,还使得其反应以与具有可用胺基基团(如伯胺基)的目标分子形成酰胺键。要清楚的是,在一些实施方案中,可以通过活化羧基和羟基基团中的一个或者二者来形成酯键。对于涉及聚水杨酸的某些实施方案,可以通过仅活化羧基基团、或者活化羧基和羟基基团,来形成酯键。对于涉及sa衍生物的某些实施方案,可以通过任何以下方法形成酯键(在本文也称作"连接":活化sa上的羧基和目标分子上的羟基;活化sa上的羟基和目标分子上的羧基;或者sa和目标分子二者上的两种基团都可以被活化。
在活化的sa反应以与目标分子(具有可用的羧基或羟基基团)形成酯键的情形中,在某些实施方案中通过将所述目标分子溶解于适宜的溶剂中并活化可用的羧基或羟基基团可有助于所述反应。可用的羧基或羟基基团活化剂的实例包括但不限于以下:1,8-二氮杂二环十一碳-7-烯(dbu);l,5-二氮杂二环[4.3.0]壬-5-烯(dbn);三乙胺(tea);2,6-二-叔-丁基吡啶;磷腈配体(t-bu-p4,bemp);hünig配体(二异丙基乙胺,dipea);或2,2,6,6-四甲基哌啶(tmp)。
在某些实施方案中,sa的活化可以与含有可用羟基基团的目标分子(若有的话)的活化分别进行。由于sa的活化是放热过程,该反应在其中进行的反应瓶,在各种实施方案中,可以在水浴中经以下的时间段来冷却:约1至约90分钟、约5至约60分钟、或约1天至约3天或者更久(取决于反应规模和成分的添加速率)。更高的温度通常预期会导致更快的反应;在各种实施方案中,反应的温度可以为约40至约45摄氏度,高至约80摄氏度,或者是室温(约20至约25摄氏度)。在某些实施方案中,一或多种碳二亚胺可用于sa的活化(单独或者与一或多种其它分子如n-羟基丁二酰亚胺(nhs)组合)。在活化之后,可以通过将活化的sa溶液与目标分子(活化或未活化)的溶液混合来开始偶合反应,其中混合的比例例如为,两种溶液约1.5至约1的比例或者基于期望结果的任何其它比例。在某些实施方案中,过量活化剂或过量sa的存在将会导致更大量的二取代的和多取代的水杨酸酯。在各种实施方案中,所得的混合物可以在室温下搅拌:约1小时至约72小时、或约1天、约2天、或约3天。
当使仅有活化的sa的溶液反应时,将会形成聚水杨酸酯。聚合的程度将取决于反应时间和活化的sa的浓度、以及温度。当活化的sa与其本身之外的目标分子(其可含有一或多个可用的羧基或羟基基团,活化或未活化,和/或一或多个胺基基团)反应时,在水杨酸酯和/或第二分子的胺之外可形成聚水杨酸酯。在某些实施方案中,可以通过改变sa与一或多种目标分子的相对浓度来控制终产物的量和比例,并且因而可以将其改造或设计为一或多种缀合的种类的混合物。反应产物因而可以是复杂混合物。
在目标分子只含有一个可用羧基、羟基或胺基基团的情形中,混合物一般会预期含有一些未修饰的目标分子,外加经不同长度的聚水杨酸酯链(范围在一个(单一水杨酸酯残基)至若干个)衍生的目分子。如果所述目标分子含有两个或更多个可用的羧、羟基、或胺基基团、或者一或多个两种类型可用基团的组合,反应产物将预期会是相应的复杂混合物。在此情形中,每个可用的羧基、羟基、或胺基基团将会经不同长度的聚水杨酸酯链(从0(无水杨酸酯基团)至若干个)衍生。在某些实施方案中,所得的组合物可包含具有多至约2至约20种分子、约5至约20种分子、约8至约15种分子、约12至约15种分子、或者20种或更多种分子串在一起的分子。在某些实施方案中,可以通过改变水杨酸酯对目标分子的摩尔比例来改变目标分子经水杨酸酯的平均衍生程度。
在某些实施方案中,可以使用固态合成技术来合成本文的组合物——例如,结合至硅石或其它不可溶材料的碳二胺活化剂。
在某些实施方案中,例如,其中活化的sa与作为目标分子的活化的白藜芦醇反应,经不同取代的化合物一般可以经可预测的方式来进行分离。已经开发了用于对sa和sa缀合的目标分子进行生成、分离、纯化和浓缩的过程;这些过程使得可以分离经特定取代的终产物(例如,白藜芦醇水杨酸酯)。类似的方法可以应用于拆分活化的sa与白藜芦醇之外的目标化合物(含有一或多个可用羟基或伯胺基)反应所得到的混合物的成分。
在某些实施方案中,本发明的方法还包括对本文反应所得的溶液进行干燥的步骤以产生固体水杨酸衍生物。在其它实施方案中,最终产物不需要是固体而是可以包含任何以下的(整体或者部分):液体、凝胶、溶胶、悬液、泡沫、胶体、气雾剂、乳剂、喷雾或流体。
使用本申请中所述技术创建的反应产物,可以包括在任何各种类型的个人护理(包括化妆品)、药物(包括兽医的)配方中,包括但不限于:霜、腮红、洗液、浆液、粉底、粉末、眼影、眼线、睫毛膏、唇彩(例如,口红和唇膏)、软膏、药膏、膏剂、香油、凝胶、油、膏药、泡沫、面膜、肥皂、沐浴露、洗发水、护发素、防晒霜、收敛剂、去角质剂、除臭剂、用于痤疮、粉刺、疣、湿疹、红斑痤疮的治疗物;真菌治疗物、指甲治疗物和指甲油、晒伤治疗物、脸部面膜等等。
如本文所述,在某些实施方案中,用于与活化的sa反应的目标分子是含有羧基、羟基、或胺基基团的任何感兴趣的分子。可用的目标分子可包括但不限于任何以下的,可用于形成水杨酸的酯的示例性羧酸包括但不限于:
取代的或未取代的饱和单羧酸,如乙酸、丙酸、丁酸(c4)、戊酸、己酸、辛酸(c8)、月桂酸、硬脂酸(c18)、异硬脂酸(支链c18)、亚油酸,亚麻酸、豆蔻酸(c14)、花生酸(c20)、花生四烯酸、芥子酸、山嵛酸(c22)、月桂酸(c12)、癸酸(c10)、羊油酸(c6)、和棕榈酸(c16);不饱和单羧酸,如丙烯酸、甲基丙烯酸、山梨酸、油酸、亚油酸、亚麻酸、二十二碳六烯酸、和二十碳五烯酸,或者任何c2至c25或更大的此类酸;
氨基酸,如精氨酸、谷氨酰胺、和酪氨酸;
酮酸,如丙酮酸和乙酰乙酸;
芳香羧酸,如抗坏血酸、苯甲酸、水杨酸、2种和3种糠酸和阿魏酸;二-和三-羧酸,如草酸、丙二酸、苹果酸、琥珀酸、和戊二酸。
适宜的还有经环二硫基取代的羧酸,例如,硫辛酸。命名"c"随后跟着数字表示烷基链中碳原子的数目。
在各种实施方案中,可以期望在组合物中包括一或多种植物提取物。若包括的话,建议的范围是总组合物重量的约0.0001至约10%、约0.0005至约8%或者约0.001至约5%。适宜的植物提取物包括来自植物(草、根、花、果实、植体、种子、叶、花粉、花蜜)的提取物;例如,酵母发酵提取物、海扇藻(padicapavonica)提取物、嗜热栖热菌(thermusthermophilis)发酵提取物、亚麻荠(camelinasativa)种子油、齿叶乳香(boswelliaserrata)提取物、橄榄提取物、拟南芥(aribodopsisthaliana)提取物、银荆(acaciadealbata)提取物、糖槭(acersaccharinum,糖枫)、嗜酸菌(acidophilus)、菖蒲(acorus)、七叶树(aesculus)、伞菌(agaricus)、龙舌兰(agave)、龙牙草(agrimonia)、藻类、芦荟、柑橘、芸苔、肉桂、桔子、苹果、蓝莓、蔓越莓、桃、梨、柠檬、青柠、豌豆、海草、咖啡因、绿茶、甘菊、柳树皮、桑葚、罂粟、以及任何其他类型的植物提取物。进一步的实例包括但不限于:光果甘草(glycyrrhizaglabra)、黑柳(salixnigra)、巨藻(macrocycstispyrifera)、苹果(pyrusmalus)、草莓虎耳草(saxifragasarmentosa)、葡萄(vilisvinifera)、黑桑(morusnigra)、黄芩(scutellariabaicalensis)、罗马洋甘菊(anthemisnobilis)、南欧丹参(salviasclarea)、迷迭香(rosmarinusofficianalis)、香橼(citrusmedicalimonum)、人参(panaxginseng)、以及其混合物。
其它可用的目标分子包括任何以下的:
糖——包括单糖如葡萄糖、核糖、果糖、甘露糖、半乳糖;二糖如蔗糖、海藻糖、麦芽糖、纤维二糖;多糖如树胶、几丁质(chitan);氨基糖和氨基糖衍生物如透明质酸和硫酸软骨素;
脂质——包括磷脂、甾醇脂、鞘脂、游离脂肪酸、神经酰胺和胆固醇;
多酚——包括单宁、鞣花单宁、间苯二酚、以及其它多酚,
有机酸——包括五倍子酸、熊果酸、氢化肉桂酸如阿魏酸、和杂环羧酸如糠酸;
抗氧化剂——包括抗坏血酸、去甲二氢愈创木酸(ndga);
黄酮和类黄酮——包括槲皮素、花色素、橘皮苷;
维生素——包括a、b、c、d、e和k;
氨基酸-包括组氨酸、丙氨酸、异亮氨酸、精氨酸、亮氨酸、天冬酰胺、赖氨酸、天冬氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、谷氨酸、苏氨酸、谷氨酰胺、色氨酸、甘氨酸、缬氨酸、鸟氨酸、脯氨酸、硒代半胱氨酸、丝氨酸、酪氨酸;
黄嘌呤——包括咖啡因、茶碱和可可碱;
类菌孢素氨基酸;
酶——包括谷胱甘肽s-转移酶(gst)、超氧化物歧化酶(sod),过氧化物酶、过氧化氢酶;和
有机聚合物——包括葡聚糖、聚葡萄糖胺、多糖、聚丙烯酸酯、聚乙烯吡咯烷酮。
在某些实施方案中,本发明的方法包括以下步骤:(1)获得目标分子,使其经受活化剂以产生活化的目标分子;(2)获得水杨酸,使其经受活化剂以产生活化的水杨酸酯;和(3)将(1)和(2)组合以产生sa衍生物。
在某些实施方案中,对于目标分子和水杨酸的活化可以分别进行。在一个非限制性的实例中,可以通过在溶剂中用活化剂处理来活化目标分子。类似地,可以通过用过量的水杨酸活化剂的溶剂处理来活化水杨酸。在各种实施方案中,可以继而在所述两种溶剂中进行偶合反应。在其它实例中,可以使用碳二亚胺(单独或者与其它分子如n-羟基丁二酰亚胺(nhs)组合)来活化水杨酸。
在非限制性的实例中,目标分子的活化可以在室温进行约10分钟。由于水杨酸活化是放热过程,在某些实施方案中,当在1至约60分钟、或约5至约30分钟、或约10至约20分钟的时间段里(取决于反应规模和温度)分部分添加水杨酸活化剂时,可以将反应瓶保持在冷浴中。在某些实施方案中,在完成水杨酸活化剂的添加后,可以(但并非必须)移除所述冷浴。在各种实施方案中,此活化也可以进行约30至约90分钟,或者更长,包括3至5天以上。含有活化的目标分子的反应混合物可以继而与活化的水杨酸组合。在各种实施方案中,所得的混合可以在室温搅拌,达到约72小时、或约1天、约2天、或约3天。
在某些实施方案中,聚水杨酸酯产物分布取决于活化的水杨酸对活化的目标分子的摩尔比例,且更高的比例有利于更多取代的产物。因而,在某些实施方案中,所述sa衍生物混合物包含单取代的、二取代的、和多取代的sa衍生物;可以通过改变活化的水杨酸对活化的目标分子的摩尔比例,来控制混合物中各种取代的sa衍生物的比例,且更高的活化的水杨酸的比例一般会导致更多高度取代的产物。因而在某些实施方案中,所述sa衍生物混合物包含单取代的、二取代的、和多取代的目标分子,以及在目标分子的一或多个羟基上的其它多聚水杨酸酯——也就是说,一或多个水杨酸分子缀合至目标分子上的任何一个或多个/所有的羟基。
因而,在某些实施方案中,研究者可以通过改变活化的水杨酸和活化的目标分子的摩尔比例,来优化单-、二-、和聚-水杨酸酯-取代的目标分子的比例。例如,研究者可以通过降低活化的水杨酸对活化的目标分子的摩尔比例,来选择提高单取代的sa衍生物的量;反之,如果其想要更高比例的二-或聚-水杨酸酯-取代的目标分子(例如,n=12至20或更大),其可以通过提高活化的水杨酸对活化的目标分子的摩尔比例,来优化这些量。实际上,在某些实施方案中,研究者可以决定,将更高取代的终产物的比例最大化,是进行本文方法更有益的方式。
在某些实施方案中,本技术涉及用于合成单取代的、二取代的、和多取代的sa衍生物的混合物的方法,所述方法包括以下步骤:(a)将活化的水杨酸与活化的目标分子在一或多种溶剂中组合,以产生一或多种sa衍生物;和(b)通过改变活化的水杨酸对活化的目标分子的摩尔比例,来控制二取代和多取代的sa衍生物的比例。本技术的某些实施方案包括控制多取代的产物的水解的步骤,以产生单-、二-、和聚-水杨酸酯修饰的衍生物的期望分布。
在本文的某些实施方案中,所得的分子展现出对活细胞的优越作用,例如,通过刺激消散素的产生。消散素是促消散(抗炎症)脂质介质,并且是由人体从ω-3脂肪酸二十碳五烯酸(epa)和二十二碳六烯酸(dha)、以及花生四烯酸(aa)所制成的化合物。所述消散素包括:e-类消散素、d-类消散素、脂氧素、保护素和maresins,以及膜联蛋白al和硫化氢。大量的消散素产生是经cox-2通路发生的,特别是在阿司匹林的存在下。实验证据表明,消散素通过抑制炎症细胞和化合物的产生及转运至炎症部位来减少细胞炎症。在某些实施方案中,本文所产生的组合物刺激消散素或消散素前体,如例如,图1和2中所示。
12-羟基二十碳四烯酸(12-hete)是20碳的多不饱和脂肪酸花生四烯酸的衍生物。12-hete的存在表明12-lox酶存在且有活性。12-lox酶依赖于alox12、alox12b、aloxe3基因。因而,细胞中12-hete产生的增加可得到这样的结论:12-lox酶存在并且受到与细胞接触的化合物所调节。
另外,12-lox酶的活化对于14-hdohe(消散素maresin1的前体)的产生是必须的。12-lox也参与了另外两种消散素lxa4/lxb4的合成。因而,在某些实施方案中,对12-hete或14-hdohe进行定量可得到这样的结论:12-lox通路是有活性的并且可能产生maresin1、lxa4、或lxb4。
另外12-hete通路还参与了trioxilin和羟基环氧素(hepoxilin)通路,这在牛皮癣中会引起兴趣。
图1显示了外周血单个核细胞(pbmc)中14-hdohe水平的结果,其中所述外周血单个核细胞(pbmc)经过以下处理:(1)无处理(对照);(2)pma外加a23187(引发炎症反应的佛波酯和钙离子载体);(3)在水杨酸的存在下,pma外加a23187;和(4)在聚水杨酸的存在下,pma外加a23187。最左侧的条显示了由对照细胞产生的14-hdohe水平。接下来的条显示了用pma外加a23187处理的水平。接下来相邻的两组条显示了在水杨酸的存在下,分别用pma外加a23187(每组的左侧)和用聚水杨酸(每组的右侧)以1.6微克每毫升μg/ml及8微克每毫升μg/ml的量处理的效果之间的比较。
图2显示了pbmc中12-hete水平的结果,其中所述pbmc经过以下处理:(1)无处理(对照);(2)pma外加a23187(引发炎症反应的佛波酯和钙离子载体);(3)在水杨酸的存在下,pma外加a23187;和(4)在聚水杨酸的存在下,pma外加a23187。最左侧的条显示了由对照细胞产生的12-hete水平。接下来的条显示了用pma外加a23187处理的水平。接下来相邻的两组条显示了在水杨酸的存在下,分别用pma外加a23187(每组的左侧)和用聚水杨酸(每组的右侧)以1.6微克每毫升μg/ml及8微克每毫升μg/ml的量处理的效果之间的比较。
因而,在各种实施方案中,本文的组合物在与细胞或组织接触时,导致促消散介质如12-hete或14-hdohe水平的增加,增加的量为:与仅接触水杨酸时的水平相比,增加至少约25%、至少约30%、约20至约75%、约25至约65%、约30至约55%、约30至约50%、或约30至约40%。例如,如图1和2中可见,将水杨酸添加至细胞或组织可导致比对照有值得注意的提高,而添加水杨酸衍生物如聚水杨酸可导致更大的且统计学上显著的提高。因而,使用具有psa分子的组合物可以发现出乎意料的有益效果,仅仅基于个体sa分子数目的增加是无法预料的所述有益效果的程度的。也就是说,添加水杨酸衍生物如psa带来的提升,超过了基于psa中个体sa分子(它们没有连接在一起时)活性的总和所预期的提升。
特定的通路导致了本文特定实施方案感兴趣的代谢物——例如,从dha的通路导致14-hdha(其与14-hdohe相同),其导致maresin1(期望的促消散介质)。图3和4显示了导致本文特定实施方案感兴趣的代谢物的其它特定通路——具体而言,导致从dha至maresin1以及从aa至脂氧素(例如,lxa4和lxb4)的通路(图3);和12-hete,其显示12脂氧化酶活性(图4)。
图5显示了具有对依照本文某些实施方案的组合物进行分析的结果的自动定量层析谱,所述组合物包含根据本文特定实施方案配制的sa衍生物(在此情形中,聚水杨酸)。如图中所见,从左至右,每个峰代表添加的水杨酸分子——也就是说,单-、二-、三-等等。如图中所见,使用本文的方法可以实现期望的组分布。
实施例
本文所讨论的方法用于生成分子,其中的许多经过测试来确定其性质。具体而言,创建了聚水杨酸的样品,其包含各种分布的单-、二-、三-、和聚-水杨酸,例如,图5中所示。
所得的sa衍生物以不同的剂量评估了pmbc细胞(以pma/a23187刺激)中消散通路的8种中间体脂质的合成。
接种了pmbc细胞并使其静置1小时;继而添加测试化合物并使其再温育1小时。添加炎症刺激物(pma外加a23187)1小时,收集上清并分析脂质中间体。
分析的结果显示出以下:本文包含聚水杨酸的组合物显示出确定的抗炎症作用(pge2和ltb4分泌的降低)以及14-hdohe和12-hete(d-消散素、maresin和保护素的两种前体)产生的提高。
另外,本文的聚水杨酸化合物显示出提高12-hete和14-hdohe而未完全封闭15-hete的分泌,因而使5-脂氧化酶通路可以低水平活化,其对于脂氧素和e-类消散素的产生是必须的。因而,其显示出用于促进整个特化促消散介质(spm)谱的合成的高度潜力。引入促消散介质有助于抗炎症作用——也就是说,其对于减少炎症(许多疾病的标志)是有价值的步骤。
总而言之,本技术由于很多原因而具有高度优越性,包括但不限于以下原因:本文所述的方法与现有技术中已知的那些方法不同;本文所述的方法生成水杨酸酯作为产物,并且这些产物可以通过波谱和化学分析来进行确认(存在和身份);并且本文的方法可用于获得许多不同的水杨酸酯,包括聚水杨酸酯。本文所使用的合成途径以及随后的纯化方法可避免毒性和致突变溶剂,并且是高度适宜修改来进行规模扩大的。
其它的优势包括以下:本发明的方法可提供中性形式的sa,其高度稳定并且使活性成分可以持续递送和延时释放。例如,在某些实施方案中,本技术涉及水杨酸经酶(例如皮肤酯酶)在皮肤中持续延时释放的方法。皮肤可以从二-和聚-水杨酸衍生出单水杨酸;由此,本技术的组合物可具有对皮肤期望的益处。
在其它实施方案中,本技术涉及通过本文的方法来提高目标分子稳定性的方法。例如,在某些实施方案中,本文的方法和组合物可以用于使不稳定的分子如例如ndga或白藜芦醇稳定。
在某些实施方案中,本文的方法和组合物可以提供对皮肤穿透性的增强。选择包括无水的或亲水的系统中的配方。
本领域技术人员会理解,依照本技术公开的方法和组合物,可以与多种多样的方法和材料联合使用。虽然本技术已经在某些示例性的实施方案的背景下进行了公开,但是本领域技术人员会容易地认识到,本技术可超越具体公开的实施方案而延伸至其它的实施方案。因而,本发明的所要保护的范围不应当受到上文公开的特定实施方案的限制。
- 还没有人留言评论。精彩留言会获得点赞!