使用三肽基肽酶制备醇的方法与流程
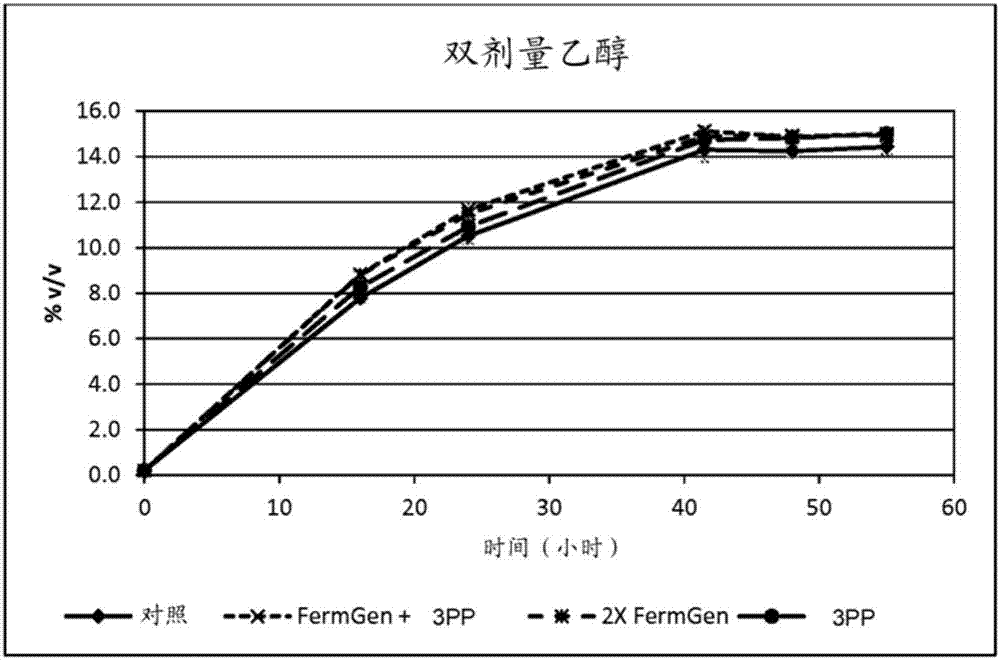
相关申请的交叉引用本申请要求于2014年10月24日提交的美国临时申请62/068,294的优先权权益,该申请在此以引用方式并入。本发明涉及在醇生产,特别是在用于生物燃料生产的生物乙醇生产中使用的三肽基肽酶。
背景技术:
:蛋白酶(与肽酶同义)是能够在底物肽、低聚肽和/或蛋白质中切割氨基酸之间的肽键的酶。蛋白酶基于其催化反应机制和涉及催化用活性位点的氨基酸残基而被分成7个家族。丝氨酸蛋白酶、天冬氨酸蛋白酶、半胱氨酸蛋白酶和金属蛋白酶为4个主要家族,而苏氨酸蛋白酶、谷氨酸蛋白酶和未分组的蛋白酶构成其余的3个家族。通常根据优先切割的底物中特定氨基酸之间的键来定义蛋白酶的底物特异性。通常,底物肽中的氨基酸位置相对于易裂键的位置(即,蛋白酶切割的位置)来定义:nh2-……p3-p2-p1*p1’-p2’-p3’……-cooh使用以上假设的肽示出,易裂键以星号(*)表示,而氨基酸残基以字母“p”表示,残基n-末端相对于易裂键以p1开始并且在从易裂键离开移向n-末端时数量越来越大。氨基酸残基c-末端相对于易裂键以p1’开始,并且移向c-末端残基的数量增大。蛋白酶通常也可基于其底物特异性而被细分为两大类。第一类为内切蛋白酶,其为能够切割肽或蛋白质底物的内部肽键并趋于远离n-末端或c-末端起作用的蛋白分解肽酶。内切蛋白酶的示例包括胰蛋白酶、胰凝乳蛋白酶和胃蛋白酶。相比之下,第二类蛋白酶是切割位于接近蛋白质或肽底物的c-末端或n-末端的氨基酸之间的肽键的外肽酶。外肽酶类中的某些酶可具有三肽基肽酶活性。此类酶因而能够从底物肽、低聚肽和/或蛋白质的未取代的n-末端切割3个氨基酸片段(三肽)。已知三肽基肽酶从底物的n-末端切割三肽序列,但除在p1和/或p1’位置处具有脯氨酸的键之外。另选地,三肽基肽酶可以是脯氨酸特异性的,并且仅能够切割相对于易裂键具有脯氨酸残基n-末端(即,在p1位置中)的底物。技术实现要素:在广义方面,本发明提供了用于制备醇的方法,该方法包括:(a)混合包含以下氨基酸序列的三肽基肽酶:选自seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55中的一个或多个氨基酸序列或它们的功能性片段或与其具有至少70%的同一性的氨基酸序列;或者由以下核苷酸序列表达的三肽基肽酶:选自seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80、seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95的核苷酸序列中的一种或多种,或与其具有至少70%同一性的核苷酸序列,或因遗传密码的简并性而不同于这些核苷酸序列的核苷酸序列,或在中等或高严格条件下杂交的核苷酸序列;以及(b)回收醇。在第一方面,本发明提供了用于制备醇的方法,该方法包括:(a)将主要具有外肽酶活性的三肽基肽酶与原料或其级分在所述原料或级分发酵之前、期间或之后混合;以及(b)回收醇。在第二方面,本发明提供了主要具有外肽酶活性的三肽基肽酶用于在醇的制造中提高醇的收率的用途。在第三方面,本发明提供了主要具有外肽酶活性的一种或多种三肽基肽酶用于在醇的制造中提高产醇宿主的发酵能力的用途。在第四方面,本发明提供了通过本发明的方法可获得的(或获得的)醇生产的副产物。附图说明现在将参考附图而仅以举例的方式描述本发明的实施方案,其中:图1示出在200ppm脲发酵中对肽酶而言的乙醇水平。图2示出双剂量发酵中的乙醇水平。图3示出对不同蛋白酶的发酵中的葡萄糖水平。图4示出相比于蛋白酶以400ppm脲发酵的乙醇水平。图5示出400ppm脲发酵的发酵后期乙醇水平。图6示出采用添加的三肽基肽酶发酵的乙醇水平。图7示出发酵中的总葡萄糖释放。图8示发酵和不同的蛋白酶处理中的小糖的浓度。图9示出三肽基肽酶单独或与(酸性真菌内切蛋白酶)组合对乙醇收率的影响。图10示出双剂量发酵速率比较结果。图11示出表达载体pttt-tri083的质粒图谱。图12示出表达载体pttt-pyrg13-tri071的质粒图谱。内源性的信号序列被来自里氏木霉(trichodermareesei)酸性真菌蛋白酶(afp(获得于genencordivision,foodenzymes))的分泌信号序列和来自里氏木霉葡糖淀粉酶基因(trga1)的内含子替代(参见图12的下部)。图13示出多个三肽基肽酶氨基酸序列之间的比对。示出xeanld、y’tzx’g和qnfsv基序(加框)。具体实施方式本发明的一项重要发现在于在醇生产期间使用主要具有外肽酶活性的三肽基肽酶来提高醇的收率。此外或另选地,另一项发现在于在醇生产期间使用主要具有外肽酶活性的三肽基肽酶来提高产醇宿主的发酵能力。基于这些发现,本发明提供了用于制备醇的方法,该方法包括:(a)将主要具有外肽酶活性的三肽基肽酶与原料或其级分在所述原料或级分发酵之前、期间或之后混合;以及(b)回收醇。如本文所用,术语“醇”是指作为生物发酵过程的结果产生的任何醇。醇可例如为乙醇和/或丁醇。优选地,醇可例如为生物燃料,诸如生物乙醇。本发明的方法包括用于回收醇的步骤。术语“醇的回收”或“回收醇”是指醇的纯化和/或分离。适当地,回收步骤产生基本上不含其它组分(例如污染物)的醇。因此,回收可产生至少约90%纯度,适当地至少约95%纯度,更适当地至少99%纯度的醇。优选地,回收可产生至少约99.9%纯度的醇。醇的回收可通过本领域的技术人员已知的任何方法实现。在一个实施方案中,可对醇进行蒸馏。如本文所用,术语“混合”是指混合一种或多种成分和/或酶,其中一种或多种成分或酶以任何次序和任何组合添加。适当地,混合可涉及同时或顺序地混合一种或多种成分和/或酶。在一个实施方案中,可顺序地混合一种或多种成分和/或酶。优选地,可同时混合一种或多种成分和/或酶。在一个实施方案中,在本发明的方法和/或用途中使用的三肽基肽酶可在至少约25℃的温度下与底物(例如,蛋白质和/或肽底物)一起温育。换句话讲,本发明的方法可在至少约25℃的温度下进行。适当地,三肽基肽酶可在至少约30℃,适当地至少约35℃的温度下与底物一起温育。在一个实施方案中,在本发明的方法和/或用途中使用的三肽基肽酶可在约25℃至约40℃的温度,适当地在约25℃至约35℃的温度下与底物一起温育。在另一个实施方案中,在本发明的方法和/或用途中使用的三肽基肽酶可在约40℃至约70℃的温度下与底物(例如,蛋白质和/或肽底物)一起温育。换句话讲,本发明的方法可在约40℃至约70℃的温度下进行。适当地,三肽基肽酶可在约40℃至约65℃的温度,更适当地在约45℃至约65℃的温度下与底物一起温育。优选地,三肽基肽酶可在约50℃至约60℃的温度下与底物一起温育。术语“三肽基肽酶”是指主要具有外肽酶活性并且能够从蛋白质、低聚肽和/或肽底物的n-末端切割三肽的蛋白酶。在一个实施方案中,三肽基肽酶不为内切蛋白酶。在另一个实施方案中,三肽基肽酶不为从底物的n-末端切割四肽的酶。在另一个实施方案中,三肽基肽酶不为从底物的n-末端切割二肽的酶。在另一个实施方案中,三肽基肽酶不为从底物的n-末端切割单个氨基酸的酶。三肽基肽酶可切割存在于原料中的蛋白质和/或肽底物以释放三肽,令人惊奇地,这可在发酵期间增加醇的产量。因此,在另一方面,本发明提供了主要具有外肽酶活性的三肽基肽酶用于在醇的制造中提高醇的收率的用途。使用三肽基肽酶的另一个优点在于其用途可提高产醇宿主在醇生产期间的发酵能力。因此,在另一方面,本发明提供了主要具有外肽酶活性的三肽基肽酶用于在醇的制造中提高产醇宿主的发酵能力的用途。在一个实施方案中,根据本发明使用的三肽基肽酶可为s53家族的外切-三肽基肽酶。如本文所用,术语“s53家族的外切-三肽基肽酶”是指主要具有外肽酶活性并且具有从蛋白质和/或肽底物的n-末端切割三肽的能力的蛋白酶。s53家族肽酶广义地涵盖丝氨酸蛋白酶类。虽然s53家族包括内切蛋白酶和外肽酶两者,但本文预期该定义仅指主要具有外肽酶活性的那些三肽基肽酶。在本文教导的“外肽酶广泛特异性测定”(ebsa)中,“s53家族的外切-三肽基肽酶”具有至少约50nkat/mg蛋白质的活性。适当地,在本文教导的ebsa活性测定中,根据本发明的“s53家族的外切-三肽基肽酶”具有约50-2000nkat/mg蛋白质的活性。在一个实施方案中,三肽基肽酶可为“耐脯氨酸三肽基肽酶”,在本文也称为3pp。如本文所用,术语“耐脯氨酸三肽基肽酶”是指可从肽、低聚肽和/或蛋白质底物的n-末端切割三肽的外肽酶。“耐脯氨酸三肽基肽酶”能够切割脯氨酸处于位置p1的肽键以及切割除脯氨酸之外的氨基酸处于p1的肽键,和/或能够切割脯氨酸处于位置p1’的肽键以及切割除脯氨酸之外的氨基酸处于p1’的肽键。有利地,在本发明中使用的三肽基肽酶(例如,耐脯氨酸三肽基肽酶)可对在p1和/或p1’处具有脯氨酸以及在p1和/或p1’处具有任何其它氨基酸的底物具有活性。这是非常令人惊奇的,因为本领域已记载的三肽基肽酶通常在脯氨酸处于p1时受到抑制或者在脯氨酸处于p1时呈活性,但在除脯氨酸之外的氨基酸存在于底物中的位置p1时失活,这有时在本文称为脯氨酸特异性三肽基肽酶。进一步有利地,具有此类活性的三肽基肽酶(例如,耐脯氨酸三肽基肽酶)能够对宽泛范围的肽和/或蛋白质底物起作用,并且由于具有此类广泛的底物特异性不易于抑制切割富含某些氨基酸(例如,脯氨酸和/或赖氨酸和/或精氨酸和/或甘氨酸)的底物。使用此类耐脯氨酸三肽基肽酶因而可有效和/或快速降解蛋白质底物(例如,存在于底物中以制备水解产物)。适当地,在本发明的方法和/或用途中使用的三肽基肽酶(例如,耐脯氨酸三肽基肽酶)能够从在p1处具有脯氨酸;以及在p1处具有选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸或合成氨基酸的氨基酸的肽的n-末端切割三肽。另选地或除此之外,在本发明的方法中使用的三肽基肽酶(例如,耐脯氨酸三肽基肽酶)能够从在p1’处具有脯氨酸;以及在p1’处具有选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸或合成氨基酸的氨基酸的肽的n-末端切割三肽。在一个实施方案中,三肽基肽酶(例如,耐脯氨酸三肽基肽酶)能够切割脯氨酸处于位置p1的肽键以及切割除脯氨酸之外的氨基酸处于p1的肽键。在另一个实施方案中,三肽基肽酶(例如,耐脯氨酸三肽基肽酶)能够切割脯氨酸处于位置p1’的肽键以及切割除脯氨酸之外的氨基酸处于p1’的肽键。适当地,三肽基肽酶(例如,耐脯氨酸三肽基肽酶)还能够切割其中存在于位置p1和/或p1’处的脯氨酸以其顺式或反式构型存在的肽键。适当地,“除脯氨酸之外的氨基酸”可为选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸或合成氨基酸的氨基酸。在另一个实施方案中,“除脯氨酸之外的氨基酸”可为选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸或缬氨酸的氨基酸。适当地,在此类实施方案中,合成氨基酸可排除在外。优选地,耐脯氨酸三肽基肽酶可能能够切割其中脯氨酸存在于位置p1和/或p1’处的肽键。令人惊奇地是,三肽基肽酶可对在位置p1和/或p1’处具有脯氨酸的底物起作用。甚至更令人惊奇地是,除了该活性之外,三肽基肽酶还可当除脯氨酸之外的氨基酸存在于位置p1和/或p1’时具有活性。除对如上所述的任何各种物质具有活性之外,在本发明中使用的三肽基肽酶(例如,耐脯氨酸三肽基肽酶)另外可耐受选自以下的一个或多个位置处的脯氨酸:p2、p2’、p3和p3’。适当地,除具有上述活性之外,三肽基肽酶(例如,耐脯氨酸三肽基肽酶)还可耐受位置p2、p2’、p3和p3’处的脯氨酸。这是有利的,因为其允许有效地切割具有脯氨酸区段的肽和/或蛋白质底物并允许切割宽泛范围的肽和/或蛋白质底物。三肽基肽酶(例如,耐脯氨酸三肽基肽酶)可对在p1位置处具有一个或多个赖氨酸、精氨酸或甘氨酸的肽和/或蛋白质具有优先活性。不受理论的束缚,通常就多种三肽基肽酶和/或蛋白酶而言,在p1位置处包含这些氨基酸的肽和/或蛋白质底物可能难以消化,并且在遇到此类残基时,三肽基肽酶和/或蛋白酶对肽和/或蛋白质底物的切割可停止或减慢。有利地,利用本发明的三肽基肽酶(例如,耐脯氨酸三肽基肽酶)可以有效地消化在p1处包含赖氨酸、精氨酸和/或甘氨酸的蛋白质和/或肽底物。适当地,三肽基肽酶(例如,耐脯氨酸三肽基肽酶)可对在p1位置处具有赖氨酸的肽和/或蛋白质具有优先活性。有利地,这允许有效地切割赖氨酸含量较高的底物,诸如乳清蛋白。在一个实施方案中,三肽基肽酶(例如,耐脯氨酸三肽基肽酶)可包含氨基酸丝氨酸、天冬氨酸盐和组氨酸的催化三联体。本发明中使用的三肽基肽酶可为热稳定的三肽基肽酶。术语“热稳定的”意指当酶加热至高达约60℃的温度时保持其活性。适当地,“热稳定的”可意指当酶加热至约65℃,更适当地约70℃时保持其活性。在另一个实施方案中,“热稳定的”意指当酶加热至高达约75℃的温度时保持其活性。适当地,“热稳定的”可意指当酶加热至约80℃,更适当地约90℃时保持其活性。有利地,当与非热稳定的变体相比时,热稳定的三肽基肽酶不易于变性(例如,当在发酵前添加至原料时)和/或在经受升高的温度时将在较长时间段内保持其活性。本发明中使用的三肽基肽酶可在约ph2至约ph8的范围内具有活性。适当地,三肽基肽酶可在约ph4至约ph8的范围内,更适当地在约ph4.5至约ph6.5的范围内具有活性。适当地,本发明的方法可在2至约7的ph下进行。在一个实施方案中,本发明的方法可在约4至约7(例如4.5至6.5)的ph下进行。使用在ph4至约ph7的ph范围内具有活性的三肽基肽酶是有利的,因为其允许三肽基肽酶与在该ph范围内具有活性的一种或多种内切蛋白酶一起使用。当使用在约ph4至约ph7的ph范围内具有活性的三肽基肽酶时,适当地,其可与中性或碱性的内切蛋白酶组合使用。有利地,这意指在酶处理之间不必改变用于产生水解产物的包含蛋白质和/或肽底物的反应培养基的ph。换句话讲,其允许三肽基肽酶和内切蛋白酶同时添加到反应物中,这可使得产生水解产物的过程更快和/或更有效和/或更节约成本。此外,这允许更有效的反应,因为在较低的ph值下,底物可从溶液中沉淀出来并因此未被切割。可在本发明中使用任何合适的碱性内切蛋白酶。在一个实施方案中,碱性内切蛋白酶可为酶的丝氨酸蛋白酶家族的成员(ec3.4.21)。丝氨酸蛋白酶具有引发蛋白质的肽键水解的丝氨酸活性位点。基于丝氨酸蛋白酶的结构,存在两大类丝氨酸蛋白酶:胰凝乳蛋白酶样(胰蛋白酶样)和枯草杆菌蛋白酶样。原型枯草杆菌蛋白酶(ecno.3.4.21.62)最初获自枯草芽孢杆菌(bacillussubtilis)。枯草杆菌蛋白酶及其同系物是merops分类方案的s8肽酶家族的成员。s8家族的成员具有在其氨基酸序列中次序为asp、his和ser的催化三联体。适当地,碱性内切蛋白酶可为选自以下项中的一者或多者:枯草杆菌蛋白酶、中性细菌蛋白酶、嗜热菌蛋白酶、胰蛋白酶和胰凝乳蛋白酶。在一个实施方案中,枯草杆菌蛋白酶可为丝氨酸蛋白酶家族的枯草杆菌蛋白酶。适当地,枯草杆菌蛋白酶可为可获得(例如获得的)自芽孢杆菌属细菌的枯草杆菌蛋白酶。在一个实施方案中,枯草杆菌蛋白酶可为fna枯草杆菌蛋白酶,例如,如在us20120003718中所教导的,其内容以引用方式并入本文。在另一个实施方案中,三肽基肽酶可在酸性ph下具有活性(适当地,三肽基肽酶可在酸性ph下具有最佳活性)。三肽基肽酶可在小于约ph6,更适当地小于约ph5的ph下具有活性。优选地,三肽基肽酶可在约2.5至约ph4.0,更适当地在约3.0至约3.3的ph下具有活性。适当地,本发明的方法可具体地在水解步骤中于2至约4(例如3至3.3)的ph下进行。在一个实施方案中,耐脯氨酸三肽基肽酶可在约2.5的ph下具有活性。在一个实施方案中,耐脯氨酸三肽基肽酶可在约2.5的ph下具有活性。在一些实施方案中,三肽基肽酶可与内切蛋白酶组合使用。如本文所用,术语“内切蛋白酶”与“肽链内切酶”同义并且指能够切割肽或蛋白质底物的内部肽键(例如,不位于接近肽或蛋白质底物的c-末端或n-末端)的蛋白分解肽酶。此类内切蛋白酶可被定义为趋于远离n-末端或c-末端而起作用的酶。合适的内切蛋白酶包括动物、植物或微生物来源的那些。包括经化学修饰或蛋白质工程改造的突变体,以及天然制成的蛋白质。内切蛋白酶可为丝氨酸蛋白酶或金属蛋白酶、碱性微生物蛋白酶、胰蛋白酶样蛋白酶或胰凝乳蛋白酶样蛋白酶。碱性内切蛋白酶的示例为枯草杆菌蛋白酶,尤其是源自芽孢杆菌属的那些,例如枯草杆菌蛋白酶novo、枯草杆菌蛋白酶carlsberg、枯草杆菌蛋白酶309、枯草杆菌蛋白酶147和枯草杆菌蛋白酶168(参见例如wo89/06279)。另外的示例包括美国专利re34,606、5,955,340、5,700,676、6,312,936和6,482,628中描述的那些突变体蛋白酶,所有这些专利以引用方式并入本文。胰蛋白酶样内切蛋白酶的示例为胰蛋白酶(如猪或牛来源)和镰孢菌蛋白酶(参见例如wo89/06270和wo94/25583)。可用的蛋白酶的示例还包括但不限于wo92/19729、wo98/20115、wo98/20116和wo98/34946中所述的变体。可商购获得的蛋白酶包括但不限于:primasetm、duralasetm、blazetm、和(novonordiska/s和novozymesa/s)、maxacaltm、maxapemtm、purafectoxptm、purafectprimetm、fnatm、fn2tm、fn3tm、puramaxtm、excellasetm、和purafasttm(daniscousinc./dupontindustrialbiosciences,paloalto,california,usa)、blaptm和blaptm变体(henkelkommanditgesellschaftaufaktien,duesseldorf,germany)和kap(嗜碱芽孢杆菌枯草杆菌蛋白酶(b.alkalophilussubtilisin);日本东京花王公司(kaocorp.,tokyo,japan))。另外的示例性蛋白酶是来自液化淀粉芽孢杆菌(bacillusamyloliquifaciens)的npre和来自纤维单胞菌属(cellulomonassp.)菌株69b4的asp(daniscousinc./dupontindustrialbiosciences,paloalto,california,usa)。各种蛋白酶描述于wo95/23221、wo92/21760、wo09/149200、wo09/149144、wo09/149145、wo11/072099、wo10/056640、wo10/056653、wo11/140364、wo12/151534、美国专利公布2008/0090747,和美国专利5,801,039、5,340,735、5,500,364、5,855,625、usre34,606、5,955,340、5,700,676、6,312,936和6,482,628,以及各种其它专利。在一些另外的实施方案中,金属蛋白酶可用于本发明,包括但不限于wo07/044993中描述的中性金属蛋白酶。合适的内切蛋白酶包括天然存在的蛋白酶或经过特定选择或工程改造以在相对低的温度下工作的工程改造的变体。在一个实施方案中,内切蛋白酶可为选自以下的一种或多种:丝氨酸蛋白酶、天冬氨酸蛋白酶、半胱氨酸蛋白酶、金属蛋白酶、苏氨酸蛋白酶、谷氨酸蛋白酶以及选自未分组蛋白酶家族的蛋白酶。在一个实施方案中,内切蛋白酶可为选自以下的一种或多种:酸性真菌蛋白酶、枯草杆菌蛋白酶、胰凝乳蛋白酶、胰蛋白酶、胃蛋白酶、木瓜蛋白酶、布鲁马林(bromalin)、热稳定细菌中性金属内肽酶、金属中性肽链内切酶、碱性丝氨酸蛋白酶、真菌内切蛋白酶或选自商业蛋白酶产品afp、fp2、np。优选地,根据本发明使用的内切蛋白酶可为天冬氨酸内切蛋白酶。在一个实施方案中,内切蛋白酶可为酸性内切蛋白酶。适当地,内切蛋白酶可为酸性真菌蛋白酶。优选地,酸性真菌蛋白酶可为天冬氨酸内切蛋白酶。合适的酸性真菌蛋白酶的至少一个示例为酶组合物(购自dupontindustrialbiosciences——以前为genencor(usa))。在一个实施方案中,根据本发明使用的蛋白酶可能不可获得(例如获得)自拟诺卡氏菌(nocardiopsis)。有利地,将内切蛋白酶与三肽基肽酶组合使用可增大底物切割的效率。不受理论的束缚,据信内切蛋白酶能够在远离c-末端或n-末端的多个区域切割肽和/或蛋白质底物,从而产生三肽基肽酶的更多个n-末端以用作底物,由此有利地增大反应效率和/或减少反应时间。术语“产醇宿主”是指能够使可发酵糖源发酵以产生醇的任何生物体。此类生物体也可被称为产乙醇生物或被称为产乙醇的。如本文所用,“可发酵糖”指能够在发酵条件下被代谢的糖类。这些糖通常指葡萄糖、麦芽糖和麦芽三糖(dp1、dp2和dp3)。在一些实施方案中,蔗糖也可为可发酵糖。适当地,可发酵糖通过水解淀粉可获得(例如获得)。如本文所用,“淀粉”指由植物的复杂多糖碳水化合物构成的任何材料,由具有式(c6h10o5)x(其中“x”可以是任何数字)的直链淀粉和支链淀粉构成。具体地讲,该术语指任何基于植物的材料,包括但不限于谷物、谷类、草、块茎和根,更具体地讲,指小麦、大麦、玉米、裸麦、稻、高粱、麸皮、木薯、粟、马铃薯、甘薯和木薯粉。“颗粒状淀粉”是指未煮过的(生)淀粉,其未经受糊化,其中“淀粉糊化”意指使淀粉分子溶解以形成粘性悬浮液。适当地,块茎可为粮谷块茎。如本文所用,“淀粉的水解”等是指加入水分子时裂解糖苷键。因此,具有“淀粉水解活性”的酶在加入水分子情况下催化糖苷键的切割。产醇宿主可选自任何合适的真核生物。在一个实施方案中,产醇宿主可为细菌。适当地,选自变形菌门(proteobacteria),更适当地选自鞘脂单胞菌科(shingomonadaceae)。在一个具体的实施方案中,产醇宿主可为来自于选自以下项的一个或多个属的细菌:发酵单胞菌属(zymomonas)、节杆菌属(arthrobacter)、芽孢杆菌属(bacillus)、梭菌属(clostridium)、欧文氏菌属(erwinia)、埃希氏菌属(escherichia)、克雷伯氏菌属(klebsiella)、乳杆菌属(lactobacillus)、假单胞菌属(pseudomonas)、链霉菌属(streptomyces)、热厌氧杆菌属(thermoanaerobacter)。适当地,细菌可选自运动发酵单胞菌(zymomonasmobilis)。在一些实施方案中,产醇宿主可为真菌。根据本发明使用的真菌可为任何子囊真菌(例如,子囊菌(ascomycete))。适当地,产醇宿主可为酵母。适当地,酵母可选自:酵母属(saccharomyces)、克鲁维酵母属(kluyveromyces)、接合酵母属(zygosaccharomyces)、伊萨酵母属(issatchenkia)、kazachstania和有孢圆酵母属(torulaspora)。更适当地,酵母可为选自以下的一种或多种:酿酒酵母(saccharomycescerevisiae)、贝酵母(saccharomycesbayanus)、卡氏酵母(saccharomycescarlsbergensis)、saccharomyceskudriavtsevii、saccharomyceskudriavzevii和巴斯德氏酵母(saccharomycespastorianus)。适当地,酵母可为酿酒酵母变种糖化酵母(saccharomycescerevisiaevar.diastaticusyeast)。如本文所用,术语“原料”是指包含以下中的至少一者的组合物:淀粉、纤维素、半纤维素、木质纤维素、可发酵糖或它们的组合。“原料的级分”是指在处理所述原料期间分离出来的任何原料组分。原料可为淀粉、基于谷物的材料(例如,谷类、小麦、大麦、裸麦、稻、黑小麦、粟、买罗高粱、高粱或玉米)、块茎(例如,马铃薯或木薯)、根、糖(例如,蔗糖、甜菜糖、糖蜜或糖浆)、釜馏物、湿饼、ddgs、纤维素生物质、半纤维素生物质、乳清蛋白、基于大豆的材料、木质纤维素生物质或它们的组合。木质纤维素生物质可包含纤维素、半纤维素和芳族聚合物木质素。半纤维素和纤维素(包括不溶性阿拉伯木聚糖)本身也为潜在的能量源,因为它们由c5-糖和c6-糖组成。单c6-糖可被动物用作能量源,而寡c5-糖可被存在于动物肠道中的微生物群落转化成短链脂肪酸(vandenbroek等人,2008molecularnutrition&foodresearch,52,146-163),该短链脂肪酸可被动物的肠道吸收和消化。适当地,木质纤维素生物质可为任何纤维素、半纤维素或木质纤维素材料,例如农业残余物、生物能源作物、工业固体废物、市政固体垃圾、来自造纸的淤渣、庭院垃圾、木料废物、林业废物以及它们的组合。木质纤维素生物质可选自玉米棒、作物废弃物诸如玉米苞叶、玉米面筋粉(cgm)、玉米秸秆、玉米纤维、草、甜菜渣、小麦秸秆、小麦壳、燕麦秸秆、小麦粗粉、次小麦粉、米糠、稻壳、小麦麸、燕麦壳、湿饼、干酒糟(ddg)、含可溶物干酒糟(ddgs)、棕榈仁、柑橘渣、棉花、木质素、大麦秸秆、干草、稻秸、稻壳、柳枝稷、芒草、大米草、草芦、废纸、甘蔗渣、高粱渣、饲用高粱、高粱秸秆、大豆秸秆、大豆、由研磨树、枝、根、叶、木屑、锯末、灌木和灌丛、蔬菜、水果和花获得的组分。湿饼、干酒糟和含可溶物干酒糟是在通过谷物蒸馏产业所用的方法从发酵的谷物或谷物混合物中蒸馏而移除乙醇之后得到的产物。来自蒸馏的釜馏物(例如,包含水,其余的谷物、酵母细胞等)被分为“固体”部分和液体部分。固体部分称为“湿饼”并且可原样用作动物饲料。液体部分(部分地)蒸发成糖浆(可溶物)。液体部分通常被称为稀釜馏物。当对湿饼进行干燥时,其为干酒糟(ddg)。当将湿饼与糖浆(可溶物)一起进行干燥时,其为含可溶物干酒糟(ddgs)。湿饼可用于乳牛场的作业(dairyoperations)和肉牛饲养场。干ddgs可用于牲畜(例如,乳牛、牛和猪)饲料和家禽饲料。玉米ddgs对乳牛而言是极好的蛋白质源。玉米面筋粉(cgm)是玉米研磨工业的粉末状副产物。cgm例如在动物饲料中具有实用性。其可用作饲料诸如宠物食物、牲畜饲料和家禽饲料的廉价蛋白质源。其尤其是氨基酸半胱氨酸的良好来源,但对于赖氨酸必须与其它蛋白质保持平衡。基于谷物的材料可为选自以下的一种或多种:玉米、小麦、大麦、燕麦、裸麦、玉蜀黍、粟、稻、木薯和高粱。在一些实施方案中,当与不包含一种或多种三肽基肽酶的发酵混合物相比时,在本发明的方法和/或用途中使用三肽基肽酶可增大发酵混合物中的三肽浓度。原料或其部分可在发酵之前、期间或之后经受一个或多个工序。在一个实施方案中,原料或其部分可经受一个或多个选自以下的工序:研磨、烹饪、糖化、发酵以及同时糖化和发酵。如本文所用,术语“研磨”是指对原料的任何研磨。例如,研磨可包括湿磨、干磨或它们的组合。研磨是指如下过程:有助于将用于制备原料的原材料粉碎成适当尺寸的颗粒以利于原料下游工艺,例如为了有利于烹饪过程。在一些方法中,研磨过程有助于暴露淀粉。湿磨是需要在处理前湿浸泡例如玉米谷粒的研磨过程。然后进行一系列的单元操作,从而回收淀粉。在经受一系列研磨机之前,通常用稀释的亚硫酸将谷物浸渍或“浸泡”在水中24小时至48小时。下游工艺可包括除去油(例如,玉米油),之后进行另外的阶段以分离出纤维、蛋白质(例如谷蛋白)和淀粉组分(例如,诸如胚乳)。这可使用筛网和旋液分离器(hydroclonicseparators)通过离心来实现。接着,可使从该过程保留的淀粉和水经受发酵。干磨是指在进一步加工前将原材料诸如谷物研磨成面粉(例如粗粉)的过程。通常,然后用水将面粉浆化以在下游步骤(例如糖化)中处理之前形成麦芽浆。可将氨添加到麦芽浆中并且用于控制ph并为用于发酵的产醇宿主提供营养源。在一个优选的实施方案中,可在处理原料或其级分期间使用干磨。适当地,可在研磨或干碾磨期间将三肽基肽酶与原料或其级分混合。适当地,在研磨或干碾磨之后获得的原料或其级分可经受液化和/或糖化和/或发酵和/或同时糖化和发酵。这可例如在研磨之后并在液化或糖化之前具有或不具有烹饪步骤。原料或其级分可经受烹饪。通常,烹饪过程可发生在研磨后。适当地,烹饪过程可发生于90℃-120℃。适当地,烹饪可在液化和/或糖化之前进行。适当地,烹饪过程可在发酵之前降低细菌水平。在一些实施方案中,可在该阶段或其后添加一种或多种酶。适当地,可在烹饪过程之后,例如在液化过程中添加α-淀粉酶。在一些实施方案中,原料或其级分可能不经受烹饪。在此类实施方案中,糖化和发酵或ssf可在包含颗粒状淀粉或生淀粉(例如,在低于淀粉糊化的温度下处理的淀粉)的原料或其级分上进行。在一个实施方案中,原料或其级分可经受酶处理,例如采用α-淀粉酶和/或淀粉葡糖苷酶。在一些实施方案中,该酶处理替代烹饪步骤。在一些实施方案中,原料或其级分可经历一个或多个液化步骤。如本文所用,术语“液化”是指通常利用增大温度使淀粉液化的过程。淀粉的液化导致粘度显著增大。因此,可引入淀粉酶以降低粘度。淀粉液化的温度根据淀粉的来源变化。淀粉处理也可在约25℃至恰好低于液化温度的温度下进行。这些类型的工艺通常称为颗粒状淀粉水解、直接淀粉水解、生淀粉水解、低温淀粉水解或其它术语。在一些情况下,在低于液化温度的温度下对淀粉进行预处理,以增强酶水解或用于处理淀粉的其它过程。液化可在高温或低温以及本领域的技术人员已知或能够选择的合适温度下进行。例如,液化可在使存在于原料或其级分中的淀粉和/或多糖液化的温度(例如,使粘度增大的温度)下进行。此类温度将取决于原料或其级分的来源以及其中的淀粉和/或多糖含量。在一些实施方案中,技术人员可在低于(例如,恰好低于)原料或其级分中所含的淀粉和/或多糖的液化温度的温度下进行液化。液化可在高温或低温诸如约25℃至约95℃(例如约25℃至约84℃)下进行。在一个实施方案中,液化可在约85℃至约95℃下进行。在其它实施方案中,液化可在较低温度下进行和/或可采用不包括完全液化淀粉的“冷烹饪过程”。原料或其级分也可经历糖化。糖化对于发酵可以是独立的或与之同时的。分别糖化和发酵是这样的过程,其中存在于原料(例如玉米)或其级分中的淀粉转化为葡萄糖,随后产醇宿主(例如,产乙醇生物)将葡萄糖转化为乙醇。同时糖化和发酵(ssf)是这样的过程,其中存在于原料或其级分中的淀粉转化为葡萄糖,与此同时并且在相同的反应器中,产醇宿主(例如,产乙醇生物)将葡萄糖转化为乙醇。在一些实施方案中,糖化可在低温下进行。在糖化期间,通常可添加一种或多种酶以利于葡萄糖分解。适用于糖化的酶制剂包括ssf(购自dupontindustrialbiosciences——以前为genencor),其包括淀粉酶(1,4-α-d-葡聚糖葡聚糖水解酶——ec3.2.1.1)、葡糖淀粉酶(1,4-α-d-葡聚糖葡糖水解酶e.c.3.2.1.3)、异淀粉酶、β淀粉酶、普鲁兰酶以及曲霉胃蛋白酶1(ec3.4.23.18)。另选地或除此之外,可在糖化步骤期间添加一种或多种内切蛋白酶和/或外肽酶。适当地,内切蛋白酶和/或外肽酶可获得(例如获得)自木霉属(trichoderma)。在一个实施方案中,可在糖化步骤期间添加fermgentm(购自genencor)。在一些实施方案中,可在糖化过程期间添加纤维素酶和/或半纤维素酶和/或另外的酶。适当地,还可添加一种或多种选自以下的另外的酶:内切葡聚糖酶(e.c.3.2.1.4);纤维二糖水解酶(e.c.3.2.1.91)、β-葡糖苷酶(e.c.3.2.1.21)、纤维素酶(e.c.3.2.1.74)、地衣多糖酶(e.c.3.1.1.73)、脂肪酶(e.c.3.1.1.3)、脂质酰基转移酶(通常归类为e.c.2.3.1.x)、磷脂酶(e.c.3.1.1.4,e.c.3.1.1.32或e.c.3.1.1.5)、植酸酶(例如6-植酸酶(e.c.3.1.3.26)或3-植酸酶(e.c.3.1.3.8)、淀粉酶、α-淀粉酶(e.c.3.2.1.1)、木聚糖酶(例如,内切-1,4-β-d-木聚糖酶(e.c.3.2.1.8)或1,4β-木糖苷酶(e.c.3.2.1.37)或e.c.3.2.1.32,e.c.3.1.1.72,e.c.3.1.1.73)、葡糖淀粉酶(e.c.3.2.1.3)、半纤维素酶(例如,木聚糖酶)、蛋白酶(例如,枯草杆菌蛋白酶(e.c.3.4.21.62)或芽孢杆菌溶素(e.c.3.4.24.28)或碱性丝氨酸蛋白酶(e.c.3.4.21.x)或角蛋白酶(e.c.3.4.x.x))、脱支酶、角质酶、酯酶和/或甘露聚糖酶(例如,β-甘露聚糖酶(e.c.3.2.1.78))转移酶、葡糖苷酶、阿拉伯呋喃糖苷酶。可在原料或其级分的一个或多个处理阶段添加三肽基肽酶。适当地,可在研磨期间添加三肽基肽酶。适当地,可在糖化期间添加三肽基肽酶。优选地,可在同时糖化和发酵期间添加三肽基肽酶。适当地,可在液化期间添加三肽基肽酶。适当地,可在发酵期间添加三肽基肽酶。在一些实施方案中,三肽基肽酶可与内切蛋白酶组合使用。在一些实施方案中,可将三肽基肽酶与原料或其级分在发酵之后混合。适当地,可然后(例如,经由研磨)进一步处理混合物。本发明的方法可包括一个或多个发酵。可在任何发酵之前、期间或之后添加本发明的三肽基肽酶。在一些实施方案中,可将根据本发明的三肽基肽酶与发酵后可获得的(例如,获得的)原料或其级分(例如,全釜馏物或ddgs)混合。在一个实施方案中,发酵后可获得的(例如,获得的)原料或其级分(例如,全釜馏物或ddgs)可用根据本发明的三肽基肽酶处理(或进一步处理)。适当地,这可与原料或其级分的一个或多个额外处理(例如,加酸和/或碾磨)组合使用。在一个实施方案中,经处理的原料或其级分然后可充当一个或多个额外发酵的原料。可在额外发酵中添加根据本发明的三肽基肽酶。适当地,本发明中使用的原料或其级分可为含纤维的级分。本发明的方法可包括在将三肽基肽酶与原料或其级分混合之前、期间或之后添加产醇菌株。所述方法还可包括将脲与原料或其级分混合。有利地,使用本发明的三肽基肽酶可降低需要添加至原料的脲的量。用途在一个方面,本发明提供了在醇(优选生物乙醇)的制造中主要具有外肽酶活性的三肽基肽酶用于提高醇(优选生物乙醇)的收率的用途。如本文所用,术语“提高醇的收率”是指当与在处理方法期间不使用三肽基肽酶时发酵后回收的醇的浓度相比时,在处理方法期间使用三肽基肽酶时发酵后回收的醇(例如,生物乙醇)的浓度增大。适当地,醇的收率可提高至少约0.1%v/v,更适当地至少约0.3%v/v,甚至更适当地至少0.5%v/v。在一些实施方案中,将三肽基肽酶与内切蛋白酶组合使用可使回收的醇的浓度提高至少约0.4%v/v,适当地至少0.6%v/v,更适当地至少0.8%v/v。在另一个方面,本发明提供了主要具有外肽酶活性的三肽基肽酶用于在醇的制造中提高产醇宿主的发酵能力的用途。不受理论的束缚,据信本发明的三肽基肽酶可增大存在于原料或其级分中的三肽的浓度。本发明的一个优点在于如此形成的三肽可为例如产醇宿主的良好氨基酸源和/或能量和/或营养源。产醇宿主的发酵能力的提高可通过以下测量:与未和三肽基肽酶混合的所述产醇宿主在发酵期间消耗的糖(例如葡萄糖)的水平相比,产醇宿主在发酵期间消耗的糖(例如葡萄糖)的量增大。适当地,与未和三肽基肽酶混合的产醇宿主在发酵期间消耗的葡萄糖水平相比,发酵培养基中的糖(例如葡萄糖)的水平在约15小时至约20小时之间测量时可小于约0.1%w/v。适当地,发酵培养基中糖(例如葡萄糖)的水平可小于0.2%w/v,适当地小于约0.3%w/v。醇和/或糖(例如葡萄糖)的浓度可通过本领域的技术人员已知的任何方法测量。例如,可使用高效液相色谱法(hplc)分析。另选的发酵结束(eof)产物包括但不限于代谢物,诸如柠檬酸、乳酸、琥珀酸、谷氨酸一钠、葡糖酸、葡糖酸钠、葡糖酸钙、葡糖酸钾、衣康酸以及其它羧酸、葡糖酸δ-内酯、异抗坏血酸钠、赖氨酸以及其它氨基酸、ω-3脂肪酸、异戊二烯、1,3-丙二醇、乙醇、丁醇、其它醇、以及其它生化物质和生物材料。除eof之外,三肽基肽酶也可用于制备糖浆(例如,dp1、2、3等、特制糖浆、低聚糖、以及多糖)。三肽基肽酶也可生成可用于生产宿主的肽;或者与另外的一种或多种蛋白酶协同作用以生成氨基酸和/或有潜在价值的肽。产醇宿主的表达本发明中使用的三肽基肽酶可由产醇宿主表达和分泌。适当地,三肽基肽酶可对产醇宿主是异源的。如本文所用,术语“对产醇宿主是异源的”可指在产醇宿主中正常表达的酶,但是酶或编码其的核苷酸序列已经以某些方式被工程改造,由此使得酶和/或核苷酸序列不同于“天然”酶和/或编码所述酶的核苷酸序列。另选地或除此之外,异源酶可为来源于不同生物体的酶,例如来源于外源的酶。换句话讲,其可指不在产醇宿主中正常表达的酶。在其它实施方案中,三肽基肽酶可对产醇宿主是同源的。在一些实施方案中,产醇宿主可共表达三肽基肽酶以及一种或多种选自以下的酶:葡糖淀粉酶、淀粉酶、另外的淀粉改性酶、蛋白酶、植酸酶、纤维素酶、半纤维素酶、另外的酶以及它们的组合。适当地,除表达三肽基肽酶之外,产醇宿主还可另外地表达一种或多种选自以下的酶:内切葡聚糖酶(e.c.3.2.1.4);纤维二糖水解酶(e.c.3.2.1.91)、β-葡糖苷酶(e.c.3.2.1.21)、纤维素酶(e.c.3.2.1.74)、地衣多糖酶(e.c.3.1.1.73)、脂肪酶(e.c.3.1.1.3)、脂质酰基转移酶(通常归类为e.c.2.3.1.x)、磷脂酶(e.c.3.1.1.4,e.c.3.1.1.32或e.c.3.1.1.5)、植酸酶(例如6-植酸酶(e.c.3.1.3.26)或3-植酸酶(e.c.3.1.3.8)、淀粉酶、α-淀粉酶(e.c.3.2.1.1)、普鲁兰酶、异淀粉酶、β-淀粉酶、α-葡糖苷酶、木聚糖酶(例如,内切-1,4-β-d-木聚糖酶(e.c.3.2.1.8)或1,4β-木糖苷酶(e.c.3.2.1.37)或e.c.3.2.1.32,e.c.3.1.1.72,e.c.3.1.1.73)、葡糖淀粉酶(e.c.3.2.1.3)、半纤维素酶、蛋白酶(例如,枯草杆菌蛋白酶(e.c.3.4.21.62)或芽孢杆菌溶素(e.c.3.4.24.28)或碱性丝氨酸蛋白酶(e.c.3.4.21.x)或角蛋白酶(e.c.3.4.x.x))、脱支酶、角质酶、酯酶和/或甘露聚糖酶(例如,β-甘露聚糖酶(e.c.3.2.1.78))、转移酶、葡糖苷酶、阿拉伯呋喃糖苷酶。活性和测定本发明中使用的三肽基肽酶主要具有外肽酶活性。如本文所用,术语“外肽酶”活性意指能够从底物(诸如蛋白质和/或肽底物)的n-末端切割三肽的三肽基肽酶。如本文所用,术语“主要具有外肽酶活性”意指不具有或基本上不具有内切蛋白酶活性的三肽基肽酶。“基本上不具有内切蛋白酶活性”意指当相比于本文教导的“外肽酶广泛特异性测定(ebsa)”中的1000nkat的外肽酶活性时,耐脯氨酸三肽基肽酶或s53家族的外肽酶在本文教导的“内切蛋白酶测定”中具有小于约100u的内切蛋白酶活性。适当地,“基本上不具有内切蛋白酶活性”意指当相比于本文教导的“外肽酶广泛特异性测定”中的1000nkat的外肽酶活性时,耐脯氨酸三肽基肽酶在本文教导的“内切蛋白酶测定”中具有小于约100u的内切蛋白酶活性。优选地,耐脯氨酸三肽基肽酶或s53家族的外肽酶在相比于本文教导的“外肽酶广泛特异性测定”中的1000nkat的外肽酶活性时,在本文教导的“内切蛋白酶测定”中可具有小于约10u的内切蛋白酶活性,更优选地,在相比于本文教导的“外肽酶广泛特异性测定”中的1000nkat的外肽酶活性时,在本文教导的“内切蛋白酶测定”中具有小于约1u的内切蛋白酶活性。甚至更优选地,当相比于在本文教导的“外肽酶广泛特异性测定”中的1000nkat的外肽酶活性时,耐脯氨酸三肽基肽酶或外切-三肽基肽酶可在本文教导的“内切蛋白酶测定”中具有小于约0.1u的内切蛋白酶活性。“内切蛋白酶测定”偶氮酪蛋白测定内切蛋白酶的活性使用iversen和1995(biotechnologytechniques9,573-576)描述的修改型式的内切蛋白酶测定法。将50μl的酶样品添加至250μl偶氮酪蛋白(0.25%w/v;得自sigma)的4倍稀释的mcilvaine缓冲液(ph5)中并在振荡(800rpm)下于40℃温育15min。通过添加50μl的2m三氯乙酸(tca)(得自sigmaaldrich,denmark)并在20,000g下离心5min使反应终止。向195μl样品的上清液添加65μl的1mnaoh,并在450nm处测量吸光度。一个内切蛋白酶活性单位被定义为:在40℃下,使得450nm处的吸光度在15min内增加0.1的量。“外肽酶测定”第1部分——“外肽酶广泛特异性测定”(ebsa)在微量滴定板中,将10μl的显色肽溶液(10mmh-ala-ala-ala-pna,溶解于二甲基亚砜(dmso);mw=387.82;bachem,switzerland)添加至130μl乙酸钠(20mm,用乙酸调节至ph4.0)并在40℃加热5分钟。添加10μl适当稀释的酶,在mtp读出器(versamax,moleculardevices,denmark)中测量405nm处的吸收值。一开特的蛋白分解活性被定义为每秒释放1摩尔对硝基苯胺所需的酶量。在一个实施方案中,根据本发明的三肽基肽酶在本文教导的ebsa活性测定中具有至少约50nkat的活性。适当地,在本文教导的ebsa活性测定中,根据本发明的三肽基肽酶具有约50-2000nkat单位的活性。为了测定三肽基肽酶是否为耐脯氨酸三肽基肽酶,可将以下测定与第1部分组合。第2部分(i)——p1脯氨酸测定(a)将底物h-arg-gly-pro-phe-pro-ile-ile-val(mw=897.12;得自schafer-n,copenhagen)以1mg/ml的浓度溶解于10倍稀释的mcilvain缓冲液(ph=4.5)中。(b)在40℃下,将1000ul的底物溶液与10ug的耐脯氨酸三肽基肽酶溶液一起温育。(c)在七个时间点(0min、30min、60min、120min、720min和900min)采取100ul样品,用50ul5%tfa稀释,热灭活(10min,80℃)并保持于-20℃直至lc-ms分析;(d)用接口至ltqorbitrapclassic混合质谱仪(thermoscientific,bremen,germany)的agilent1100seriescapillaryhplc系统(agilenttechnologies,santaclara,ca)进行lc-mc/ms分析;(e)将样品上样到50mmfortistmc18柱上,该柱具有2.1mm的内径和1.7μm的实际尺寸;(f)在ionmax源中使用14min梯度的2%-28%的溶剂b(h2o/ch3cn/hcooh(50/950/0.65v/v/v))以200μl/min的流速进行分离——ltqorbitrapclassic仪器以数据依赖性ms/ms模式操作;(g)通过orbitrap(在m/z400下,采用60.000的分辨率获得ms扫描)测量肽质量,并且选择最强肽m/z中的多至2者并在线性离子阱(ltq)中用cid进行碎裂。启动动态排除,列表大小为500个质量,持续时间40s,并且相对于列表上的质量,排除质量宽度为±10ppm;(h)使用开放源代码程序skyline1.4.0.4421(购自maccosslabsoftware,universityofwashington,departmentofgenomesciences,372015thaveneseattle,washington,us)以访问raw文件并提取ms1强度来构建色谱图。在60,000分辨率下将前体同位素导入过滤器设定为计数三(m、m+1和m+2),并使用最强电荷状态;(i)将底物和切割产物的肽序列键入skyline中,并且计算每个样品中的强度(0min、30min、60min、120min、720min和900min水解)。(j)一个活性单位被定义为在该测定中于720min内将水解50%的底物并同时释放arg-gly-pro的酶量。第2部分(ii)——p1’脯氨酸测定(a)将肽h-ala-ala-phe-pro-ala-nh2(mw=474.5;得自schafer-n,copenhagen)以0.1mg/ml的浓度溶解于10倍稀释的mcilvain缓冲液(ph=4.5)中。(b)在40℃下,用10ug的耐脯氨酸三肽基肽酶溶液温育1000ul的底物溶液。(c)在七个时间点(0min、30min、60min、120min、720min和900min)采取100ul样品,用50ul5%tfa稀释,热灭活(10min,80℃)并保持于-20℃直至lc-ms分析;(d)用接口至ltqorbitrapclassic混合质谱仪(thermoscientific,bremen,germany)的agilent1100seriescapillaryhplc系统(agilenttechnologies,santaclara,ca)进行lc-mc/ms分析;(e)将样品上样到50mmfortistmc18柱上,该柱具有2.1mm的内径和1.7μm的实际尺寸;(f)在ionmax源中使用14min梯度的2%-28%的溶剂b(h2o/ch3cn/hcooh(50/950/0.65v/v/v))以200μl/min的流速进行分离——ltqorbitrapclassic仪器以数据依赖性ms/ms模式操作;(g)通过orbitrap(在m/z400下,采用60.000的分辨率获得ms扫描)测量肽质量,并且选择最强肽m/z中的多至2者并在线性离子阱(ltq)中用cid进行碎裂。启动动态排除,列表大小为500个质量,持续时间40s,并且相对于列表上的质量,排除质量宽度为±10ppm。(h)使用开放源代码程序skyline1.4.0.4421(购自maccosslabsoftware,universityofwashington,departmentofgenomesciences,372015thaveneseattle,washington,us)以访问raw文件并提取ms1强度来构建色谱图。在60,000分辨率下将前体同位素导入过滤器设定为计数三(m、m+1和m+2),并使用最强电荷状态;(i)将底物和切割产物的肽序列键入skyline中,并且计算每个样品中的强度。(j)一个活性单位被定义为在该测定中于720min内将水解50%的底物并同时释放ala-ala-phe的酶量。如果在本发明中使用的三肽基肽酶为如本文所定义的耐脯氨酸三肽基肽酶,则在一个实施方案中,耐脯氨酸三肽基肽酶的每mg蛋白质在本文教导的第1部分活性中具有至少50nkat的活性,并且在本文教导的第2(i)部分或第2(ii)部分测定中具有至少100u的活性。在一个实施方案中,根据本发明的耐脯氨酸三肽基肽酶的每mg蛋白质在本文教导的第1部分活性中具有约50-2000nkat的活性,并且在本文教导的第2(i)部分或第2(ii)部分测定中具有约1-500单位活性。应当注意,蛋白质测量描述于实施例4中。“p1和p1’蛋白质活性测定”适当地,本发明中使用的三肽基肽酶能够切割在位置p1和p1’处具有脯氨酸的底物。这可用下文教导的测定来评估。在该测定中,就三肽基肽酶水解合成底物aappa的能力而言,通过lc-ms和免标记量化来检查三肽基肽酶。(a)将肽h-aappa-nh2(mw=424.3,得自schafer-n,copenhagen)溶解于20mmmes缓冲液,ph=4.0(1mg/ml);(b)在室温下,将1000ul的h-aappa-nh2溶液与200ul耐脯氨酸三肽基肽酶溶液(40ug/ml)(底物/酶100:0.8)一起温育;(c)在七个时间点(0min、5min、15min、60min、180min、720min和1440min)采取100ul样品,用50ul5%tfa稀释,热灭活(10min,80℃)并保持于-20℃直至lc-ms分析;(d)用接口至ltqorbitrapclassic混合质谱仪(thermoscientific,bremen,germany)的easylc系统(thermoscientific,odense,dk)进行nanolc-ms/ms分析;(e)将样品上样到定制的2cm捕获柱(100μm内径,375μm外径,装填reprosilc18,5μm反相颗粒(dr.maischgmbh,ammerbuch-entringen,germany))上,该柱连接至具有钢针的10cm分析柱(75μm内径,375μm外径,装填reprosilc18,3μm反相颗粒(dr.maischgmbh,ammerbuch-entringen,germany));(f)在纳升电喷雾离子源(thermoscientific,odense,dk)中使用10min梯度的0%-34%的溶剂b(h2o/ch3cn/tfe/hcooh(100/800//100/1v/v/v/v))以300nl/min流速进行分离——ltqorbitrapclassic仪器以数据依赖性ms/ms模式操作;(g)通过orbitrap(在m/z400下,采用60000的分辨率获得ms扫描)测量肽质量,并且选择最强肽m/z中的多至2者并在线性离子阱(ltq)中用cid进行碎裂。启动动态排除,列表大小为500个质量,持续时间40s,并且相对于列表上的质量,排除质量宽度为±10ppm;(h)使用开放源代码程序skyline1.4.0.4421(购自maccosslabsoftware,universityofwashington,departmentofgenomesciences,372015thaveneseattle,washington,us)以访问raw文件,该程序可用ms1强度来构建色谱图。在60,000分辨率下将前体同位素导入过滤器设定为计数三(m、m+1和m+2),并使用最强电荷状态;(i)将底物和切割产物的肽序列键入skyline中,并且计算每个样品中的强度。(j)一个活性单位被定义为在该测定中于24h内将水解50%的底物并同时释放aap的酶的量。在一个实施方案中,根据本发明的耐脯氨酸三肽基肽酶的每mg蛋白质在本文教导的第1部分活性中具有至少50nkat的活性,并且在本文教导的第2(i)部分或第2(ii)部分测定中具有至少100u的活性。在一个实施方案中,根据本发明的耐脯氨酸三肽基肽酶的每mg蛋白质在本文教导的第1部分活性中具有约50-2000nkat的活性,并且在本文教导的第2(i)部分或第2(ii)部分测定中具有约1-500单位活性(蛋白质浓度如实施例2计算)。在一个实施方案中,在本文教导的“p1和p1’脯氨酸活性测定”中,本发明中使用的耐脯氨酸三肽基肽酶的每mg蛋白质可具有至少10u的活性。在一个实施方案中,在本文教导的“p1和p1’脯氨酸活性测定”中,根据本发明的耐脯氨酸三肽基肽酶的每mg蛋白质可具有约1u-500u的活性。除上文之外,耐脯氨酸三肽基肽酶还可具有根据以上教导的第1部分的“外肽酶活性测定”的活性。在一个实施方案中,本发明中使用的耐脯氨酸三肽基肽酶的每mg蛋白质在本文教导的“p1和p1’脯氨酸活性测定”中可具有至少10u的活性,并且在本文教导的第1部分的“外肽酶活性测定”中具有至少50nkatal的活性。在另一个实施方案中,根据本发明的耐脯氨酸三肽基肽酶的每mg蛋白质在本文教导的“p1和p1’脯氨酸活性测定”中具有约1u-500u的活性,并且在本文教导的第1部分的“外肽酶活性测定”中具有约50u-2000ukatal的活性。氨基酸和核苷酸序列根据本发明使用的三肽基肽酶可获得(例如获得)自任何来源,只要其具有本文所述的活性即可。在一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自木霉属。适当地得自里氏木霉,更适当地,得自里氏木霉qm6a。适当地得自绿木霉菌(trichodermavirens),更适当地,得自绿木霉菌gv29-8。适当地得自深绿木霉(trichodermaatroviride)。更适当地,得自深绿木霉imi206040。在一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自曲霉属(aspergillus)。适当地得自烟曲霉(aspergillusfumigatus),更适当地得自烟曲霉cae17675。适当地得自白曲霉(aspergilluskawachii),更适当地得自白曲霉ifo4308。适当地得自构巢曲霉(aspergillusnidulans),更适当地得自构巢曲霉fgsca4。适当地得自米曲霉(aspergillusoryzae),更适当地得自米曲霉rib40。适当地得自赤曲霉(aspergillusruber),更适当地得自赤曲霉cbs135680。适当地得自土曲霉(aspergillusterreus),更适当地得自土曲霉nih2624。在一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自平脐蠕孢属(bipolaris),适当地得自玉米小斑病菌(bipolarismaydis),更适当地得自玉米小斑病菌c5。在一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自togninia,适当地得自togniniaminima,更适当地得自togniniaminimaucrpa7。在一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自踝节菌属(talaromyces),适当地得自柄篮状菌(talaromycesstipitatus),更适当地得自柄篮状菌atcc10500。在一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自节皮菌属(arthroderma),适当地得自贝纳米节丝皮裸囊菌(arthrodermabenhamiae),更适当地得自贝纳米节丝皮裸囊菌cbs112371。在一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自稻瘟菌(magnaporthe),适当地得自稻瘟病菌(magnaportheoryzae),更适当地得自稻瘟病菌70-1。在另一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自镰孢属(fusarium)。适当地得自尖孢镰孢菌(fusariumoxysporum),更适当地得自尖孢镰孢菌4号生理小种(fusariumoxysporumf.sp.cubenserace4)。适当地得自禾谷镰孢菌(fusariumgraminearum),更适当地得自禾谷镰孢菌ph-1。在另一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自暗球腔菌属(phaeosphaeria),适当地得自小麦颖枯病菌(phaeosphaerianodorum),更适当地得自小麦颖枯病菌sn15。在另一个实施方案中,根据本发明使用的耐脯氨酸三肽基肽酶可获得(例如获得)自伞草属(agaricus),适当地得自双孢蘑菇(agaricusbisporus),更适当地得自双孢蘑菇变种burnettiijb137-s8。在另一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自枝顶孢属(acremonium),适当地得自嗜碱枝顶孢(acremoniumalcalophilum)。在另一个实施方案中,根据本发明使用的耐脯氨酸三肽基肽酶可获得(例如获得)自sodiomyces,适当地得自sodiomycesalkalinus。在一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自青霉属(penicillium)。适当地,三肽基肽酶可获自指状青霉菌(penicilliumdigitatum),更适当地得自指状青霉菌pd1。适当地,三肽基肽酶可获自草酸青霉(penicilliumoxalicum),更适当地得自草酸青霉114-2。适当地,三肽基肽酶可获自罗克福尔青霉菌(penicilliumroqueforti),更适当地得自罗克福尔青霉菌fm164。适当地,三肽基肽酶可获自产红青霉(ppenicilliumrubens),更适当地得自产红青霉wisconsin54-1255。在另一个实施方案中,根据本发明使用的三肽基肽酶可获得(例如获得)自新萨托菌属(neosartorya)。适当地,三肽基肽酶可获自费氏新萨托菌(pneosartoryafischeri),更适当地得自费氏新萨托菌nrrl181。在一个实施方案中,根据本发明使用的三肽基肽酶(例如,耐脯氨酸三肽基肽酶)不可获得(例如获得)自黑曲霉(aspergillusniger)。至少一种三肽基肽酶可:(a)包含氨基酸序列seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段;(b)包含与seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段具有至少70%的同一性的氨基酸;(c)由包含序列seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80、seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95的核苷酸序列编码;(d)由与seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80、seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95具有至少约70%的序列同一性的核苷酸序列编码;(e)由在中等严格性条件下与seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80、seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95杂交的核苷酸序列编码;或(f)由因遗传密码的简并性而不同于seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80、seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95的核苷酸序列编码。三肽基肽酶可表达为经历进一步转录后和/或翻译后修饰的多肽序列。在一个实施方案中,三肽基肽酶可包含氨基酸序列seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28或它们的功能性片段。在另一个实施方案中,三肽基肽酶包含与seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28或它们的功能性片段具有至少70%的同一性的氨基酸。在一个实施方案中,三肽基肽酶可包含氨基酸序列seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18或它们的功能性片段。在另一个实施方案中,三肽基肽酶包含与seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18或它们的功能性片段具有至少70%的同一性的氨基酸。在另一个实施方案中,三肽基肽酶可为已经历转录后和/或翻译后修饰(例如,翻译后切割)的“成熟”三肽基肽酶。适当地,此类修饰可导致酶的活化。适当地,三肽基肽酶可包含氨基酸序列seqidno.29、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段。在另一个实施方案中,三肽基肽酶包含与seqidno.29、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段具有至少70%的同一性的氨基酸。在另一个实施方案中,三肽基肽酶可包含氨基酸序列seqidno.29、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45或它们的功能性片段。在另一个实施方案中,三肽基肽酶包含与seqidno.29、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45或它们的功能性片段具有至少70%的同一性的氨基酸。术语“功能性片段”为氨基酸序列的保持其肽酶活性的部分。换句话讲,其为氨基酸序列的保持如本文所定义的三肽基肽酶活性(例如保持如使用本文教导的ebsa测定所测量的三肽基肽酶活性)的部分。在一个实施方案中,三肽基肽酶的功能性片段可为耐脯氨酸三肽基肽酶的功能性片段。耐脯氨酸三肽基肽酶的功能性片段为耐脯氨酸三肽基肽酶的主要具有外肽酶活性的部分,其中所述耐脯氨酸三肽基肽酶能够从(i)(a)在p1处具有脯氨酸;以及(b)在p1处具有选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸或合成氨基酸的氨基酸的肽的n-末端切割三肽;和/或能够从(ii)(a’)在p1’处具有脯氨酸;以及(b’)在p1’处具有选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸或合成氨基酸的氨基酸的肽的n-末端切割三肽。另选地或除此之外,耐脯氨酸三肽基肽酶的功能性片段为耐脯氨酸三肽基肽酶的主要具有外肽酶活性的部分,并且能够从在p1和p1’处具有脯氨酸的肽的n-末端切割三肽。“部分”为仍具有如上定义的活性的任何部分,适当地,该部分的长度可为至少50个氨基酸,更适当地至少100个氨基酸。在其它实施方案中,所述部分的长度可为约150个氨基酸或约200个氨基酸。在一个实施方案中,在转录后和/或翻译后修饰(例如,切割)之后,功能性片段可为三肽基肽酶的一部分。适当地,功能性片段可包含如下所示的序列:seqidno.29、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54或seqidno.55。三肽基肽酶可包含选自seqidno.1或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.1或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.2或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.2或其功能性片段具有至少70%的同一性的氨基酸。耐脯氨酸三肽基肽酶可包含选自seqidno.3或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.3或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.4或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.4或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.5或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.5或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.6或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.6或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.7或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.7或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.8或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.8或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.9或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.9或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.10或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.10或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.11或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.11或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.12或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.12或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.13或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.13或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.14或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.14或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.15或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.15或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.16或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.16或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.17或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.17或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.18或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.18或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.19或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.19或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.20或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.20或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.21或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.21或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.22或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.22或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.23或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.23或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.24或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.24或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.25或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.25或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.26或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.26或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.27或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.27或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.28或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.28或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.29或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.29或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.30或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.30或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.31或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.31或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.32或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.32或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.33或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.33或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.34或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.34或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.35或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.35或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.36或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.36或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.37或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.37或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.38或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.38或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.39或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.39或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.40或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.40或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.41或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.41或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.42或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.42或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.43或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.43或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.44或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.44或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.45或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.45或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.46或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.46或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.47或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.47或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.48或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.48或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.49或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.49或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.50或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.50或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.51或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.51或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.52或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.52或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.53或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.53或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.54或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.54或其功能性片段具有至少70%的同一性的氨基酸。三肽基肽酶可包含选自seqidno.55或其功能性片段的一种或多种氨基酸序列。三肽基肽酶可包含与seqidno.55或其功能性片段具有至少70%的同一性的氨基酸。适当地,三肽基肽酶可包含与seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段具有至少80%的同一性的氨基酸。适当地,三肽基肽酶可包含与seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段具有至少85%的同一性的氨基酸。适当地,三肽基肽酶可包含与seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段具有至少90%的同一性的氨基酸。适当地,三肽基肽酶可包含与seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段具有至少95%的同一性的氨基酸。适当地,三肽基肽酶可包含与seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段具有至少97%的同一性的氨基酸。适当地,三肽基肽酶可包含与seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55或它们的功能性片段具有至少99%的同一性的氨基酸。在一个实施方案中,三肽基肽酶可包含选自以下项中的一者或多者的氨基酸序列:seqidno.29、seqidno.1、seqidno.2、seqidno.3、seqidno.4、seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10、seqidno.11、seqidno.12、seqidno.13、seqidno.14、seqidno.15、seqidno.16、seqidno.17、seqidno.18、seqidno.19、seqidno.20、seqidno.21、seqidno.22、seqidno.23、seqidno.24、seqidno.25、seqidno.26、seqidno.27、seqidno.28、seqidno.30、seqidno.31、seqidno.32、seqidno.33、seqidno.34、seqidno.35、seqidno.36、seqidno.37、seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45、seqidno.46、seqidno.47、seqidno.48、seqidno.49、seqidno.50、seqidno.51、seqidno.52、seqidno.53、seqidno.54、seqidno.55。在一些实施方案中,三肽基肽酶可包含选自以下项中的一者或多者的氨基酸序列:seqidno.1、seqidno.2、seqidno.3、seqidno.29和seqidno.30、或与其具有至少70%的同一性的序列。适当地,与其具有至少80%的同一性或与其具有至少90%的同一性的序列。在一些实施方案中,可能合适的是三肽基肽酶可包含选自以下的氨基酸序列:seqidno.3、seqidno.4、seqidno.30和seqidno.31、或与其具有至少70%的同一性的序列。适当地,与其具有至少80%的同一性或与其具有至少90%的同一性的序列。有利地,这些特定氨基酸序列可能特别适于切割富含赖氨酸、精氨酸和/或甘氨酸的肽和/或蛋白质底物。特别是在赖氨酸、精氨酸和/或甘氨酸存在于p1位置的情况下。在其它实施方案中,三肽基肽酶可包含选自以下项中的一者或多者的氨基酸序列:seqidno.1、seqidno.2、seqidno.5、seqidno.6、seqidno.7、seqidno.29、seqidno.32、seqidno.33和seqidno.34、或与其具有至少70%的同一性的序列。适当地,与其具有至少80%的同一性或与其具有至少90%的同一性的序列。适当地,耐脯氨酸三肽基肽酶可具有序列seqidno.1、seqidno.2或seqidno.29。三肽基肽酶可包含一个或多个选自以下的序列基序:xeanld、y’tzx’g和qnfsv。适当地,三肽基肽酶可包含xeanld。x可为选自以下的一种或多种氨基酸:g、t、s和v。在另一个实施方案中,耐脯氨酸三肽基肽酶可包含y’tzx’g。y’可为选自以下的一种或多种氨基酸:i、l和v。z可为选自以下的一种或多种氨基酸:s和t。x’可为选自以下的一种或多种氨基酸:i和v。在另一个实施方案中,三肽基肽酶可包含序列基序qnfsv。在另一个实施方案中,三肽基肽酶可包含序列基序xeanld和y’tzx’g或xeanld和qnfsv。在另一个实施方案中,三肽基肽酶可包含序列基序y’tzx’g和qnfsv。适当地,三肽基肽酶可包含序列基序xeanld、y’tzx’g和qnfsv。一个或多个基序存在于本发明所用的三肽基肽酶中。图13指出了这些基序的定位。在一个实施方案中,三肽基肽酶可由如seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80所示的核苷酸序列或与其具有至少70%的同一性的核苷酸序列编码。适当地,由与其具有至少80%的同一性或与其具有至少90%的同一性的序列编码。优选地,三肽基肽酶可由与seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79或seqidno.80具有至少95%的序列同一性,更优选与seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79或seqidno.80具有至少99%的同一性的核苷酸序列编码。在另一个实施方案中,三肽基肽酶可由在中等严格性条件下与seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80杂交的核苷酸序列编码。适当地,由在高严格性条件下与seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80杂交的核苷酸序列编码。在另一个实施方案中,三肽基肽酶可由因遗传密码的简并性而不同于seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80的核苷酸序列编码。在一个实施方案中,核苷酸序列可为dna、cdna、合成dna和/或rna序列,该核苷酸序列包含如seqidno.56、seqidno.57、seqidno.58、seqidno.59、seqidno.60、seqidno.61、seqidno.62、seqidno.63、seqidno.64、seqidno.65、seqidno.66、seqidno.67、seqidno.68、seqidno.69、seqidno.70、seqidno.71、seqidno.72、seqidno.73、seqidno.74、seqidno.75、seqidno.76、seqidno.77、seqidno.78、seqidno.79、seqidno.80、seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95所示的核苷酸序列。优选地,该序列为dna序列,更优选地编码本发明的三肽基肽酶的cdna序列。在一个方面,优选地,本发明中使用的氨基酸和/或核苷酸序列是分离的形式。术语“分离”意指至少基本上不含至少一种如在自然界中发现的那样以及本质上与序列天然相关的其它组分的序列。用于本发明的氨基酸和/或核苷酸序列可以基本上不含所述物质原本与之相关联的一种或多种污染物的形式提供。因此,例如,其可基本上不含一或多种潜在污染性的多肽和/或核酸分子。在一个方面,优选地,在本发明中使用的氨基酸和/或核苷酸序列是纯化的形式。术语“纯化的”意指给定的组分是以高水平存在。组分有利地是组合物中存在的主要组分。优选地,其以至少约90%、或至少约95%或至少约98%的水平存在,所述水平是相对于所考虑总组合物以干重/基于干重来测定。酶在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.1、其功能性片段或与seqidno.1具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.2、其功能性片段或与seqidno.2具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.3、其功能性片段或与seqidno.3具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.4、其功能性片段或与seqidno.4具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.5、其功能性片段或与seqidno.5具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.6、其功能性片段或与seqidno.6具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.7、其功能性片段或与seqidno.7具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.8、其功能性片段或与seqidno.8具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.9、其功能性片段或与seqidno.9具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.10、其功能性片段或与seqidno.10具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.11、其功能性片段或与seqidno.11具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.12、其功能性片段或与seqidno.12具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.13、其功能性片段或与seqidno.13具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.14、其功能性片段或与seqidno.14具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.15、其功能性片段或与seqidno.15具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.16、其功能性片段或与seqidno.16具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.17、其功能性片段或与seqidno.17具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.18、其功能性片段或与seqidno.18具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.19、其功能性片段或与seqidno.19具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.20、其功能性片段或与seqidno.20具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.21、其功能性片段或与seqidno.21具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.22、其功能性片段或与seqidno.22具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.23、其功能性片段或与seqidno.23具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.24、其功能性片段或与seqidno.24具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.25、其功能性片段或与seqidno.25具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.26、其功能性片段或与seqidno.26具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.27、其功能性片段或与seqidno.27具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.28、其功能性片段或与seqidno.28具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.29、其功能性片段或与seqidno.29具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.30、其功能性片段或与seqidno.30具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.31、其功能性片段或与seqidno.31具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.32、其功能性片段或与seqidno.32具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.33、其功能性片段或与seqidno.33具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.34、其功能性片段或与seqidno.34具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.35、其功能性片段或与seqidno.35具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.36、其功能性片段或与seqidno.36具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.37、其功能性片段或与seqidno.37具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.38、其功能性片段或与seqidno.38具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.39、其功能性片段或与seqidno.39具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.40、其功能性片段或与seqidno.40具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.41、其功能性片段或与seqidno.41具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.42、其功能性片段或与seqidno.42具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.43、其功能性片段或与seqidno.43具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.44、其功能性片段或与seqidno.44具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.45、其功能性片段或与seqidno.45具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.46、其功能性片段或与seqidno.46具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.47、其功能性片段或与seqidno.47具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.48、其功能性片段或与seqidno.48具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.49、其功能性片段或与seqidno.49具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.50、其功能性片段或与seqidno.50具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.51、其功能性片段或与seqidno.51具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.52、其功能性片段或与seqidno.52具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.53、其功能性片段或与seqidno.53具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.54、其功能性片段或与seqidno.54具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,在本发明中使用的酶可为耐脯氨酸三肽基肽酶,包含:seqidno.55、其功能性片段或与seqidno.55具有至少70%的同一性的序列。适当地,酶可与其具有至少80%或85%的同一性。优选地,与其具有至少90%或95%的同一性。更优选地,与其具有至少97%或99%的同一性。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的三肽基肽酶:如seqidno.56所示的序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的三肽基肽酶:如seqidno.57所示的序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.58所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.59所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.60所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.61所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.62所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.63所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.64所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.65所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.66所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.67所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.68所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.69所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.70所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.71所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.72所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.73所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.74所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.75所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.76所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.77所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.78所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.79所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.80所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.81所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.82所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.83所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.84所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.85所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.86所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.87所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.88所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.89所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.90所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.91所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.92所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.93所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.94所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。在一个实施方案中,本发明中使用的酶可为由包含以下序列的核苷酸序列编码的耐脯氨酸三肽基肽酶:如seqidno.95所示序列或与其具有至少70%的同一性的序列。适当地,由与其具有至少80%或85%的同一性的序列编码。优选地,由与其具有至少90%或95%的同一性的序列编码。更优选地,由与其具有至少97%或99%的同一性的序列编码。核苷酸序列本发明的范围涵盖编码具有本文所限定的特定性质的蛋白质的核苷酸序列。如本文所用,术语“核苷酸序列”是指寡核苷酸序列或多核苷酸序列,以及其变体、同系物、片段和衍生物(诸如其部分)。核苷酸序列可为基因组起源的或者合成或重组起源的,其可以是双链的或单链的而无论是代表有义链还是反义链。与本发明有关的术语“核苷酸序列”包括基因组dna、cdna、合成dna和rna。优选地,其意指dna,更优选地,意指编码本发明的cdna序列。在一个优选的实施方案中,当与本发明的范围本身有关以及当为本发明的范围本身所涵盖时,核苷酸序列不包括处于其天然环境中时或其连接至其也存在于其/它们的天然环境中的天然相关的序列时的天然的根据本发明的核苷酸序列。为了易于参考,我们应将这个优选的实施方案称为“非天然核苷酸序列”。为此,术语“天然核苷酸序列”意指处于它的天然环境中且当与和它天然相关联的整个启动子可操作地连接时的整个核苷酸序列,所述启动子也处于它的天然环境中。然而,本发明范围所涵盖的氨基酸序列可以是分离和/或纯化的其天然生物体中的核苷酸序列的后表达。然而,优选地,本发明的范围所涵盖的氨基酸序列可由核苷酸序列在其天然生物体中表达,但其中该核苷酸序列不处于在该生物体中其天然与之相关联的启动子的控制之下。通常,由本发明的范围所涵盖的核苷酸序列使用重组dna技术制备(即重组dna)。然而,在本发明的备选实施方案中,核苷酸序列可用本领域所熟知的化学方法整体或分部分地合成(参见caruthersmh等人,(1980)nucacidsressympser215-223和hornt等人,(1980)nucacidsressympser225-232)。核苷酸序列的制备编码具有本文所定义的特定性质的蛋白质或适于修饰的蛋白质的核苷酸序列可从产生所述蛋白质的任何细胞或生物体鉴定和/或分离和/或纯化。多种方法是核苷酸序列鉴定和/或分离和/或纯化领域所熟知的。以举例的方式,一旦已鉴定和/或分离和/或纯化合适的序列后即可使用pcr扩增技术来制备更多条序列。以另一个示例的方式,可使用来自产生酶的生物体的染色体dna或信使rna来构建基因组dna和/或cdna文库。如果该酶的氨基酸序列是已知的话,可合成标记的寡核苷酸探针并用于从由生物体制备的基因组文库鉴定酶编码克隆。另选地,可将含有与另一已知酶基因同源的序列的标记的寡核苷酸探针用于鉴定酶编码克隆。在后一种情况中,使用较低严格性的杂交和洗涤条件。另选地,酶编码克隆可通过这样来鉴定:将基因组dna的片段插入表达载体(诸如质粒)中,用所得的基因组dna文库转化酶阴性细菌,然后将转化细菌接种于含有酶底物(即麦芽糖)的琼脂板上,从而使得表达该酶的克隆被鉴定。在又一个另选方案中,编码该酶的核苷酸序列可以通过已确立的标准方法,例如,beucages.l.等人,(1981)tetrahedronletters22,第1859-1869页所描述的亚磷酰胺方法,或matthes等人,(1984)emboj.3,第801-805页所描述的方法,合成制备。在亚磷酰胺方法中,寡核苷酸例如在自动dna合成仪中合成,将其纯化、退火、连接并克隆进适当的载体中。核苷酸序列可以为混合的基因组和合成起源、混合的合成和cdna起源或混合的基因组和cdna起源,根据标准技术通过连接合成、基因组或cdna起源的片段制备(视情况而定)。每一连接的片段对应整个核苷酸序列的各个部分。dna序列还可使用特定引物通过聚合酶链反应(pcr)制备,例如如us4,683,202或saikirk等人(science(1988)239,第487-491页)中所述,这些文档的教导以引用方式并入本文中。氨基酸序列本发明的范围还涵盖具有本文所限定的特定性质的酶的氨基酸序列。如本文所使用,术语“氨基酸序列”与术语“多肽”和/或术语“蛋白质”同义。在一些情况中,术语“氨基酸序列”与术语“肽”同义。在一些情况中,术语“氨基酸序列”与术语“酶”同义。氨基酸序列可从合适的来源制备/分离,或者其可通过合成制备或者其可通过利用重组dna技术制备。本发明中所涵盖的蛋白质可与其它蛋白质,特别是酶一起使用。因而,本发明还涵盖蛋白质的组合,其中该组合包含本发明的蛋白质/酶和其它蛋白质/酶,所述其它蛋白质/酶可以是根据本发明的其它蛋白质/酶。该方面在后面的部分中有所讨论。优选地,当与本发明的本身范围有关或当为本发明的本身范围所涵盖时氨基酸序列不是天然的酶。就这一点而言,术语“天然的酶”意指处于其天然环境中并且在其已由其天然核苷酸序列表达时的整个酶。分离在一个方面,优选地,根据本发明的氨基酸序列、或核酸、或酶是分离的形式。术语“分离的”意指序列或酶或核酸至少基本上不含所述序列或酶或核酸在自然界中天然与之相关联或在自然界中存在的至少一种其它组分。本发明的序列、酶或核酸可以基本上不含所述物质原本与之相关联的一种或多种污染物的形式提供。因此,例如,其可基本上不含一或多种潜在污染性的多肽和/或核酸分子。纯化在一个方面,优选地,根据本发明的序列、酶或核酸是纯化的形式。术语“纯化的”意指给定的组分是以高水平存在。组分有利地是组合物中存在的主要组分。优选地,其以至少约80%的水平存在,所述水平是相对于所考虑总组合物以干重/基于干重来测定。适当地,其可以至少约90%、或至少约95%、或至少约98%的水平存在,所述水平是相对于所考虑总组合物以干重/基于干重来测定。序列同一性或序列同源性本发明还涵盖与具有本文所限定的特定性质的多肽的氨基酸序列具有一定程度的序列同一性或序列同源性的序列或编码这种多肽的任何核苷酸序列(下文称为“同源序列”)的用途。在此,术语“同系物”意指与主题氨基酸序列和主题核苷酸序列具有一定同源性的实体。在此,术语“同源性”可等同于“同一性”。该同源氨基酸序列和/或核苷酸序列应该提供和/或编码保持该酶的功能活性和/或增强该酶的活性的多肽。在本说明书的语境中,同源序列意指包括这样的氨基酸或核苷酸序列,其可与主题序列有至少75%、85%或90%的同一性、优选地至少95%或98%的同一性。通常,同系物将包含与例如主题氨基酸序列相同的活性位点等等。尽管同源性也可以根据相似性(即氨基酸残基具有类似的化学性质/功能)来考虑,但在本发明的语境中优选根据序列同一性来表示同源性。在一个实施方案中,同源序列意指包含这样的氨基酸序列或核苷酸序列,其相比于主题序列具有一个或若干个添加、缺失和/或置换。在一个实施方案中,本发明涉及其氨基酸序列示于本文的蛋白质,或者通过在亲本蛋白质的氨基酸序列中置换、缺失或添加一个或若干个氨基酸(诸如2、3、4、5、6、7、8、9个氨基酸),或更多个氨基酸(例如10个或多于10个氨基酸)并具有亲本蛋白质的活性而来源于该(亲本)蛋白质的蛋白质。适当地,关于氨基酸序列的同一性程度是在至少20个连续氨基酸上,优选地在至少30个连续氨基酸上,优选地在至少40个连续氨基酸上,优选地在至少50个连续氨基酸上,优选地在至少60个连续氨基酸上,优选地在至少100个连续氨基酸上,优选地在至少200个连续氨基酸上进行测定。在一个实施方案中,本发明涉及编码其氨基酸序列示于本文的蛋白质,或者编码通过在亲本蛋白质的氨基酸序列中置换、缺失或添加一个或若干个氨基酸(诸如2、3、4、5、6、7、8、9个氨基酸),或更多个氨基酸(诸如10个或多于10个氨基酸)并具有亲本蛋白质的活性而来源于该(亲本)蛋白质的蛋白质的核酸序列(或基因)。在本说明书的语境中,同源序列意指包含这样的核苷酸序列,其可与编码本发明多肽的核苷酸序列(主题序列)具有至少75%、85%或90%的同一性,优选地至少95%或98%的同一性。通常,同系物将包含与主题序列相同的编码活性位点等的序列。尽管同源性也可以根据相似性(即氨基酸残基具有类似的化学性质/功能)来考虑,但在本发明的语境中优选根据序列同一性来表示同源性。同源性比较可通过眼,或更通常地,借助于容易获得的序列比较程序来进行。这些可商购获得的计算机程序可计算两条或更多条序列之间的%同源性。%同源性可在连续的序列上计算,即将一条序列与另一条序列进行比对,并将一条序列中的每个氨基酸与另一条序列中的对应氨基酸直接比较,一次一个残基。这称为“不产生空位的”比对。通常,这种不产生空位的比对仅在相对较短数目的残基上进行。尽管这是十分简单和可靠的方法,但其不能考虑,例如,在原本相同的一对序列中,一个插入或缺失将引起后面的氨基酸残基不再对准,从而在进行全局比对时可能导致%同源性有大的降低。因此,大多数序列比较方法被设计来产生最佳的比对,该最佳比对考虑可能的插入和缺失而不会罚掉过多的整体同源性分数。这通过在序列比对中插入“空位”以试图使局部同源性最大化来实现。然而,这些更复杂的方法给比对中出现的每一个空位分配“空位罚分”使得,对于同样数目的相同氨基酸,具有尽可能少空位的序列比对(反映两条比较序列之间相关性较高)将获得比具有许多空位的序列比对高的分数。通常使用“仿射空位成本(affinegapcosts)”,其对空位的存在征收相对较高的成本,对空位中每一个后续的残基征收较少的罚分。这是最通常使用的空位计分系统。高的空位罚分将当然产生具有较少空位的最佳比对。大多数比对程序允许修改空位罚分。然而,当用这种软件进行序列比较时优选使用默认值。最大%同源性或%同一性的计算因而首先需要在考虑空位罚分的情况下产生最佳比对。进行这种比对的合适计算机程序是vectornti(英杰公司(invitrogencorp.))。可进行序列比较的软件的示例包括但不限于例如blast软件包(参考ausubel等人,1999,shortprotocolsinmolecularbiology,第4版-第18章)、blast2(参见femsmicrobiollett1999174(2):247-50;femsmicrobiollett1999177(1):187-8以及tatiana@ncbi.nlm.nih.gov)、fasta(altschul等人1990j.mol.biol.403-410)以及alignx。至少blast、blast2和fasta可用于诸如例如在genomequest搜索工具(www.genomequest.com)中离线和在线搜索(参见ausubel等人1999,第7-58至7-60页)。尽管最终的%同源性也可以同一性来度量,但比对过程本身通常不是基于要么全有要么全无的成对比较。相反,通常使用标度化相似性计分矩阵,该矩阵基于化学相似性或进化距离给每一成对比较分配分值。通常使用的这种矩阵的示例是blosum62矩阵-blast程序包的默认矩阵。vectornti程序通常使用公用默认值或定制的符号比较表(如果提供的话)(对于进一步的细节请参见用户手册)。对于一些应用而言,优选的是使用vectornti软件包的默认值。另选地,百分比同源性可用vectornti(英杰公司)中的多比对特征来计算,该特征基于类似于clustal(higginsdg&sharppm(1988),gene73(1),237-244)的算法。一旦该软件产生了最佳比对,则有可能计算%同源性,优选%序列同一性。作为序列比较的一部分该软件通常进行这些计算,并生成数值结果。当测定序列同一性时应该使用空位罚分,然后优选地将如下参数用于逐对比对:对于blast空位开放(gapopen)9空位延伸(gapextension)2对于clustaldna蛋白质权重矩阵iubgonnet250空位开放1510空位延伸6.660.1在一个实施方案中,可使用采用上面限定的空位罚分和空位延伸组的clustal。适当地,关于核苷酸序列的同一性程度是在至少20个连续核苷酸上,优选地在至少30个连续核苷酸上,优选地在至少40个连续核苷酸上,优选地在50个连续核苷酸上,优选地在至少60个连续核苷酸上,优选地在至少100个连续核苷酸上测定。适当地,关于核苷酸序列的同一性程度是在至少100个连续核苷酸上,优选地在至少200个连续核苷酸上,优选地在至少300个连续核苷酸上,优选地在400个连续核苷酸上,优选地在至少500个连续核苷酸上,优选地在至少600个连续核苷酸上,优选地在至少700个连续核苷酸上,优选地在至少800个连续核苷酸上测定。适当地,关于核苷酸序列的同一性程度可在整个序列上测定。适当地,关于蛋白质(氨基酸)序列的同一性程度是在至少100个连续氨基酸上,优选地在至少200个连续氨基酸上,优选地在至少300个连续氨基酸上进行测定。适当地,关于氨基酸或蛋白质序列的同一性程度可在本文所教导的整个序列上进行测定。在本发明语境中,术语“查询序列”是指与主题序列比对以便查看其是否落在本发明范围之内的同源序列或外源序列。因此,此类查询序列可例如为现有技术序列或第三方序列。在一个优选的实施方案中,通过全局比对程序对序列进行比对,并且通过识别程序所识别的准确匹配数除以主题序列的长度来计算序列同一性。在一个实施方案中,查询序列与主题序列之间的序列同一性程度如下确定:1)使用默认计分矩阵和默认空位罚分通过任何合适的比对程序来比对两个序列,2)识别准确匹配数,其中准确匹配是比对程序在比对中在给定位置上识别两个比对序列中的相同氨基酸或核苷酸,3)将准确匹配数除以主题序列的长度。在另一个优选的实施方案中,全局比对程序选自clustal和blast(优选blast),并且通过识别程序所识别的准确匹配数除以主题序列的长度来计算序列同一性。序列还可以具有氨基酸残基的缺失、插入或置换,这产生了沉默改变并形成功能等价的物质。可基于残基的极性、电荷、溶解度、疏水性、亲水性和/或两亲性质的相似性作出有意的氨基酸置换,只要该物质的二级结合活性得以保持。例如,带负电的氨基酸包括天冬氨酸和谷氨酸;带正电的氨基酸包括赖氨酸和精氨酸;并且具有类似亲水性值的含不带电的极性头部基团的氨基酸包括亮氨酸、异亮氨酸、缬氨酸、甘氨酸、丙氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、苯丙氨酸和酪氨酸。可例如根据下表进行保守置换。第二列同一区块中的氨基酸和优选第三列同一行中的氨基酸可彼此置换:本发明还涵盖可能出现的同源置换(在本文中,置换和替换都用来指将现有的氨基酸残基与替代的残基进行交换),即对等置换,诸如碱性对碱性,酸性对酸性,极性对极性等。非同源置换也可能出现,即从一类残基置换成另一类残基,或者涉及加入非天然氨基酸,诸如鸟氨酸(下文称为z)、二氨基丁酸鸟氨酸(下文称为b)、正亮氨酸鸟氨酸(下文称为o)、吡啶丙氨酸、噻吩丙氨酸、萘丙氨酸和苯甘氨酸。替换还可通过合成氨基酸(例如非天然氨基酸)进行,包括;α*和α-二取代的*氨基酸、n-烷基氨基酸*、乳酸*、天然氨基酸的卤化物衍生物,诸如三氟酪氨酸*、对-cl-苯丙氨酸*、对-br-苯丙氨酸*、对-i-苯丙氨酸*、l-烯丙基-甘氨酸*、β-丙氨酸*,l-α-氨基丁酸*、l-γ-氨基丁酸*、l-α-氨基异丁酸*、l-ε-氨基己酸#、7-氨基庚酸*、l-甲硫氨酸砜#*、l-正亮氨酸*、l-正缬氨酸*、对-硝基-l-苯丙氨酸*、l-羟脯氨酸#、l-硫代脯氨酸*、苯丙氨酸(phe)的甲基衍生物,诸如,4-甲基-phe*、五甲基-phe*、l-phe(4-氨基)#、l-tyr(甲基)*、l-phe(4-异丙基)*、l-tic(1,2,3,4-四氢异喹啉-3-羧基)*、l-二氨基丙酸#和l-phe(4-苄基)*。符号*用于以上讨论的目的(与同源或非同源置换相关),以指示衍生物的疏水性质,而#用于指示衍生物的亲水性质,#*指示两亲性特征。变体氨基酸序列可以包含可在序列的任何两个氨基酸残基之间插入的合适的间隔基团,这些间隔基团除了氨基酸间隔基诸如甘氨酸或β-丙氨酸残基外还包括烷基基团诸如甲基、乙基或丙基基团。变异的另一种形式涉及存在类肽形式的一个或多个氨基酸残基,这将是本领域技术人员十分了解的。为避免疑义,“类肽形式”用于指其中α-碳取代基处于残基的氮原子而不是α-碳上的变体氨基酸残基。用于制备类肽形式的肽的方法在本领域中是已知的,例如simonrj等人,pnas(1992)89(20),9367-9371和horwelldc,trendsbiotechnol.(1995)13(4),132-134。本发明中使用的核苷酸序列可在其中包含合成的或修饰的核苷酸。对寡核苷酸的多种不同类型的修饰在本领域中是已知的。这包括甲基膦酸酯和硫代磷酸酯主链和/或在分子的3'和/或5'端添加吖啶或聚赖氨酸链。出于本发明的目的,应当理解本文所述的核苷酸序列可通过本领域可用的任何方法修饰。可进行此类修饰以提高本发明的核苷酸序列的体内活性或寿命。本发明还涵盖与本文所示的序列互补的核苷酸序列或其任何衍生物、片段或衍生物的用途。如果序列与其片段互补,则该序列可用作探针来鉴定其它生物体中的相似编码序列等等。不与本发明的序列100%同源但落在本发明的范围之内的多核苷酸可以多种方式获得。本文所述的序列的其它变体可例如通过探测从一系列个体,例如来自不同种群的个体制备的dna文库来获得。此外,可获得其它同系物,此类同系物及其片段通常将能够选择性地杂交至本文序列表所示的序列。此类序列可通过如下方法获得:探测从其它动物物种制备的cdna文库或基因组dna文库,并且在中等至高严格性条件下用包含随附的序列表中的序列中任一者的全部或部分的探针探测此类文库。可应用类似的考虑来获得本发明的多肽或核苷酸序列的物种同系物和等位基因变体。变体和株系/物种同系物还可用简并pcr获得,简并pcr将使用这样的引物,其被设计成靶向变体和同系物内编码本发明序列内的保守氨基酸序列的序列。保守序列可例如通过将来自若干变体/同系物的氨基酸序列进行比对来预测。序列比对可用本领域已知的计算机软件来进行。例如,广泛使用gcgwisconsinpileup程序。简并pcr中使用的引物将含有一个或多个简并位置并将在比针对已知序列用单序列引物克隆序列所用的严格性条件低的严格性条件下使用。或者,这种多核苷酸可通过对已表征的序列进行定点诱变来获得。在例如需要沉默密码子序列变化来优化多核苷酸序列在其中表达的特定宿主细胞的密码子偏好的情形中这可能是有用的。为了引入限制性酶识别位点,或者为了改变被多核苷酸所编码的多肽的性质或功能,可能需要其它的序列变化。本发明的多核苷酸(核苷酸序列)可用于制备引物(例如pcr引物)、可变扩增反应的引物、如用放射性或非放射性标记通过常规手段标记有显示标记的探针,或者多核苷酸可克隆进载体中。这种引物、探针和其它片段的长度将为至少15个,优选地至少20个,例如至少25个、30个或40个核苷酸,并且也为本文所用的术语“本发明的多核苷酸”所涵盖。根据本发明的多核苷酸诸如dna多核苷酸和探针可通过重组、通过合成或通过可供本领域技术人员使用的任何手段产生。它们还可以通过标准技术克隆。通常,引物将通过合成手段产生,涉及所需核酸序列的逐步制备,一次一个核苷酸。使用自动化技术完成该过程的技术在本领域中是容易获得的。较长的多核苷酸将通常使用重组手段产生,例如使用pcr(聚合酶链反应)克隆技术。引物可被设计为含有合适的限制性酶识别位点使得可将扩增的dna克隆进合适的克隆载体中。杂交本发明还涵盖与本发明的核酸序列互补的序列或能够杂交至本发明的序列或杂交至与本发明序列互补的序列的序列。如本文所用,术语“杂交”应包括“一条核酸链与互补链通过碱基配对接合的过程”以及在聚合酶链反应(pcr)技术中所进行的扩增过程。本发明还涵盖能够杂交至与本文给出的序列互补的序列的核苷酸序列或其任何衍生物、片段或衍生物的用途。术语“变体”还涵盖与能够杂交至本文给出的核苷酸序列的序列互补的序列。优选地,术语“变体”涵盖与能够在中等严格性条件下(例如,50℃和0.2xssc{1xssc=0.15mnacl,0.015m柠檬酸三钠,ph7.0})杂交至本文给出的核苷酸序列的序列互补的序列。更优选地,术语“变体”涵盖与能够在高严格性条件下(例如65℃和0.1xssc{1xssc=0.15mnacl,0.015m柠檬酸三钠,ph7.0})杂交至本文给出的核苷酸序列的序列互补的序列。本发明还涉及可杂交至本发明的核苷酸序列(包括本文所示的那些的互补序列)的核苷酸序列。本发明还涉及与可杂交到本发明的核苷酸序列(包括本文给出的那些的互补序列)上的序列互补的核苷酸序列。在本发明的范围内还包括能够在中等至最高严格性条件下杂交至本文给出的核苷酸序列的多核苷酸序列。在一个优选的方面,本发明涵盖可在中等严格性条件下(例如50℃和0.2xssc{1xssc=0.15mnacl,0.015m柠檬酸三钠,ph7.0})杂交至本发明的核苷酸序列或其互补序列的核苷酸序列。在一个更优选的方面,本发明涵盖可在高严格性条件下(例如65℃和0.1xssc{1xssc=0.15mnacl,0.015m柠檬酸三钠,ph7.0}})杂交至本发明的核苷酸序列或其互补序列的核苷酸序列。优选地,在本文教导的整个序列上对杂交进行分析。分子进化作为一个非限制性示例,有可能在体内或体外对核苷酸序列作出多个定点突变或随机突变,并且随后通过各种方法筛选所编码多肽的改善的功能性。此外,可将多核苷酸序列的突变体或天然变体与野生型或其它突变体或天然变体进行重组,以产生新的变体。也可以针对所编码的多肽的功能性改善对这种新的变体进行筛选。新的优选变体的制备可通过本领域完好建立的各种方法实现,例如错误阈值诱变(wo92/18645)、寡核苷酸介导的随机诱变(us5,723,323)、dna改组(us5,605,793)、外切-介导的基因装配wo00/58517。这些和类似的随机定向分子进化方法的应用,使得可以在事先不知道蛋白质结构或功能的情况下鉴定和选择具有优选特性的本发明的酶的变体,并且使得实现了非可预测但有利的突变体或变体的生产。本领域中存在分子进化的应用的多个示例以优化或改变酶活性,例如包括但不限于以下项中的一者或多者:在宿主细胞中或体外的表达和/或活性优化,增大酶活性,改变底物和/或产物特异性,增大或减小酶或结构的稳定性,在优选的环境条件(例如,温度、ph、底物)中改变酶活性/特异性。定点诱变一旦分离了编码蛋白质的核苷酸序列,或者鉴定了推定的编码蛋白质的核苷酸序列,将该序列突变以制备本发明的酶可能是有利的。可用合成的寡核苷酸引入突变。这些寡核苷酸含有所需突变位点旁侧的核苷酸序列。合适的方法在morinaga等人(biotechnology(1984)2,第646-649页)中有所公开。向编码酶的核苷酸序列引入突变的另一种方法在nelson和long(analyticalbiochemistry(1989),180,第147-151页)中有所描述。重组在一个方面,本发明中使用的序列为重组序列–即使用重组dna技术制备的序列。这些重组dna技术在本领域普通技术人员的能力范围内。此类技术在文献(例如)j.sambrook,e.f.fritsch和t.maniatis,1989,molecularcloning:alaboratorymanual,第二版,第1-3卷,coldspringharborlaboratorypress中进行了解释。合成在一个方面,本发明中使用的序列为合成序列–即通过体外化学或酶合成而制备的序列。其包括(但不限于)用宿主生物的最佳密码子用法制备的序列-诸如甲基营养型酵母毕赤酵母属(pichia)和汉逊酵母属(hansenula)。本发明中使用的蛋白质和/或肽也可为合成来源。酶的表达还可将本发明中使用的核苷酸序列引入重组的可复制载体中。载体可用于在相容的宿主细胞中和/或从相容的宿主细胞复制核苷酸序列并以蛋白质/酶形式表达核苷酸序列。表达可使用对照序列(例如调控序列)进行控制。由宿主重组细胞通过表达核苷酸序列制备的蛋白质可以分泌或包含在细胞内,具体取决于所用的序列和/或载体。编码序列可设计有引导物质编码序列穿过特定原核或真核细胞膜分泌的信号序列。术语“表达载体”意指能够在体内或体外表达的构建体。在一个实施方案中,在本发明中使用的三肽基肽酶可由载体编码。换句话讲,载体可包含编码三肽基肽酶的核苷酸序列。优选地,将表达载体掺入合适的宿主生物的基因组中。术语“掺入”优选地涵盖稳定掺入基因组中。本发明的核苷酸序列可以存在于载体中,在该载体中核苷酸序列可操作地连接至调控序列,该调控序列能够通过合适的宿主生物提供核苷酸序列的表达。本发明中使用的载体可以转化进如下所述的合适的宿主细胞,从而提供本发明的多肽的表达。载体如质粒、粘粒、或噬菌体载体的选择通常将取决于它即将引入其中的宿主细胞。本发明中使用的载体可以包含一个或多个选择性标记基因,诸如赋予抗生素抗性(如氨苄青霉素、卡那霉素、氯霉素或四环素抗性)的基因。或者,可通过共转化(如wo91/17243中描述)实现选择。载体可以在体外使用,例如用于rna的制备或用于转染、转化、转导或感染宿主细胞。因此,在另一个实施方案中,本发明提供了如下制备本发明的核苷酸序列的方法:将本发明的核苷酸序列引入可复制载体中,将载体引入相容的宿主细胞中,以及使宿主细胞在导致载体复制的条件下生长。载体还可包含使得载体能在所考虑的宿主细胞中复制的核苷酸序列。此类序列的示例为质粒puc19、pacyc177、pub110、pe194、pamb1和pij702的复制起点。编码三肽基肽酶和/或内切蛋白酶的核苷酸序列和/或载体可经密码子优化以在特定宿主生物中表达。编码三肽基肽酶和/或内切蛋白酶的核苷酸序列和/或载体可经密码子优化以在原核或真核细胞中表达。适当地,编码三肽基肽酶和/或内切蛋白酶的核苷酸序列和/或载体可经密码子优化以在真菌宿主生物(例如木霉属,优选地里氏木霉)中表达。密码子优化是指通过以下步骤修饰核酸序列以增强在目的宿主细胞中表达的过程:用宿主细胞基因中更频繁使用的密码子替换天然序列中的至少一个密码子(例如,至少约多于1、2、3、4、5、10、15、20、25、50、60、70、80或100个密码子),同时维持天然氨基酸序列。对于特定氨基酸的某些密码子,不同物种表现出特定的偏好性。密码子偏好性(生物体间密码子使用的差异)通常与信使rna(mrna)的翻译效率相关联,其中,据信其继而取决于被翻译密码子的性质和特定转运rna(trna)分子的可用性等。细胞中优势选择的trna通常是肽合成中最频繁使用的密码子的反映。因此,可基于密码子优化,对基因进行裁剪以在给定生物体中实现最佳的基因表达。经历该裁剪的核苷酸序列和/或载体因而可称为“密码子优化的”核苷酸序列和/或载体。密码子使用表可例如在“密码子使用数据库”中容易获得,并且这些表能以多种方式进行调整。参见nakamura,y.等人,“codonusagetabulatedfromtheinternationaldnasequencedatabases:statusfortheyear2000”nucl.acidsres.(《核酸研究》)28:292(2000)。用于密码子优化特定序列以在特定宿主细胞中表达的计算机算法也是可获得的,诸如geneforge(aptagen;jacobus,pa.)。在一些实施方案中,编码本发明中使用的三肽基肽酶和/或内切蛋白酶的序列中的一个或多个密码子(例如,1、2、3、4、5、10、15、20、25、50、或更多个、或所有密码子)对应于特定氨基酸的最频繁使用的密码子。在一个实施方案中,编码三肽基肽酶的核苷酸序列可为经密码子优化以在里氏木霉中表达的核苷酸序列。在一个实施方案中,密码子优化的序列可包含如seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94、seqidno.95所示的核苷酸序列或与其具有至少70%的同一性的核苷酸序列。适当地,与其具有至少80%的同一性或与其具有至少90%的同一性的序列。优选地,密码子优化的序列可包含与seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94、seqidno.95具有至少95%的序列同一性,更优选地与seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95具有至少99%的同一性的核苷酸序列。在一个实施方案中,耐脯氨酸三肽基肽酶可由在中等严格性条件下与seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95杂交的核苷酸序列编码。适当地,由在高严格性条件下与seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95杂交的核苷酸序列编码。在另一个实施方案中,耐脯氨酸三肽基肽酶可由因遗传密码的简并性而不同于seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95的核苷酸序列编码。本发明还提供了载体(例如,质粒),该载体包含选自以下的序列中的一种或多种:seqidno.81、seqidno.82、seqidno.83、seqidno.84、seqidno.85、seqidno.86、seqidno.87、seqidno.88、seqidno.89、seqidno.90、seqidno.91、seqidno.92、seqidno.93、seqidno.94或seqidno.95。在一个实施方案中,在本发明中使用的三肽基肽酶是发酵物的一部分。如本文所用,术语“发酵物”是指在培养宿主细胞(例如,结束时)之后所存在的组分的混合物,该宿主细胞的发酵物包含例如由宿主细胞表达的三肽基肽酶。发酵物可包含根据本发明的三肽基肽酶以及其它组分,诸如颗粒物、固体、在培养期间未利用的底物、碎片、培养基、细胞废物等。在一个方面,从发酵物中移除宿主细胞(并且特别是任何孢子)和/或使其失活以提供无细胞发酵物。在其它实施方案中,在本发明中使用的三肽基肽酶是分离的或纯化的。调控序列在一些应用中,本发明中使用的核苷酸序列可操作地连接至调控序列,该调控序列能够诸如通过所选的宿主细胞提供核苷酸序列的表达。以举例的方式,本发明涵盖这样的载体,其含有可操作地连接至这类调控序列的本发明的核苷酸序列,即载体为表达载体。术语“可操作地连接”意指并置,其中所述组分处于允许它们以它们预期的方式起作用的关系。“可操作地连接”至编码序列的调控序列是以使得编码序列在与该控制序列相容的条件下实现表达的方式连接。术语“调控序列”包括启动子和增强子以及其它表达调控信号。术语“启动子”以本领域的通常意义使用,如rna聚合酶结合位点。编码本发明的酶的核苷酸序列的增强表达还可以通过选择异源调控区,如启动子、分泌前导序列和终止子区实现。优选地,根据本发明的核苷酸序列可操作地连接至至少一个启动子。其它启动子甚至能够被用来直接表达本发明的多肽。用于引导核苷酸序列在细菌、真菌或酵母宿主中转录的合适的启动子的示例在本领域中是熟知的。启动子可额外包括特征结构以确保或提高在合适宿主中的表达。例如,特征结构可为保守区,诸如pribnow框或tata框。构建体术语“构建体”-其与术语诸如“缀合物”、“盒”和“杂交体”是同义的——包括将根据本发明使用的核苷酸序列直接或间接地连接到启动子。间接连接的示例为提供合适的间隔基团诸如内含子序列,诸如sh1-内含子或adh内含子,其位于启动子和本发明的核苷酸序列之间。对于与本发明有关的术语“融合”而言同样如此,其包括直接或间接连接。在一些情况下,该术语不涵盖通常与野生型基因启动子相关联的编码蛋白质的核苷酸序列且当它们均处于其天然环境中时的天然组合。构建体甚至可以包含或表达允许选择基因构建体的标记。就一些应用而言,优选地,本发明的构建体至少包含可操作地连接至启动子的本发明的核苷酸序列。宿主细胞与本发明有关的术语“宿主细胞”包括任何包含上述核苷酸序列或表达载体的细胞,并且,其用于具有如本文所定义的特定性能的蛋白质的重组制品中。因此,本发明的另一个实施方案提供了由表达本发明的蛋白质的核苷酸序列转化或转染的宿主细胞。选择与所述载体相容的细胞,并且细胞可以为,例如,原核(例如细菌)、真菌、酵母或植物细胞。合适的细菌宿主生物的示例为革兰氏阳性或革兰氏阴性的细菌菌种。根据编码本发明的多肽的核苷酸序列的性质,和/或进一步加工表达的蛋白质的目的,真核宿主诸如酵母或其它真菌可为优选的。一般来讲,酵母细胞相对于真菌细胞是优选的,因为它们更易于操纵。然而,某些蛋白质很难从酵母细胞中分泌,或在某些情况下不能妥善处理(例如在酵母中过度糖基化)。在这些情况下,应该选择不同的真菌宿主生物。使用合适的宿主细胞(诸如酵母、真菌和植物宿主细胞)可以根据可能的需要提供翻译后修饰(如豆蔻酰化、糖基化、截短、脂化和酪氨酸、丝氨酸或苏氨酸磷酸化),从而赋予本发明的重组表达产品最佳的生物活性。宿主细胞可以为蛋白酶缺陷菌株或蛋白酶缺失菌株。这可例如为蛋白酶缺陷菌株米曲霉jal125,缺失了称作“alp”的碱性蛋白酶基因。该菌株在wo97/35956中有所描述。生物体与本发明有关的术语“生物体”包括可包含编码根据本发明的多肽的核苷酸序列和/或由此获得的产物,和/或其中启动子可允许根据本发明的核苷酸序列在存在于生物体时表达的任何生物体。合适的生物体可包括原核生物、真菌、酵母或植物。与本发明有关的术语“转基因生物体”包括包含编码根据本发明的多肽的核苷酸序列和/或由此获得的产物,和/或其中启动子可允许根据本发明的核苷酸序列在生物体内表达的任何生物体。优选地将核苷酸序列掺入生物体的基因组中。术语“转基因生物体”不涵盖当其由天然环境中的天然启动子控制时的天然环境中的天然核苷酸编码序列。因此,本发明的转基因生物体包括含有以下中任一项或以下的组合的生物体:编码根据本发明的多肽的核苷酸序列、根据本发明的构建体、根据本发明的载体、根据本发明的质粒、根据本发明的细胞、根据本发明的组织、或其产物。例如,转基因生物体还可包含在异源启动子的控制下编码本发明的多肽的核苷酸序列。宿主细胞/生物体的转化如前面所指出的那样,宿主生物可以为原核或真核生物体。合适的原核宿主的示例包括大肠杆菌(e.coli)和枯草芽孢杆菌、地衣芽孢杆菌(bacilluslicheniformis)、链霉菌属、梭菌属等等。有关原核宿主的转化的教导内容在本领域中有详细记载,例如参见sambrook等人(molecularcloning:alaboratorymanual,第2版,1989,coldspringharborlaboratorypress)。如果使用原核宿主,那么在转化之前可能需要对核苷酸序列进行适当的修饰-诸如通过移除内含子。可以使用本领域中已知的多种方法转化丝状真菌细胞–诸如涉及原生质体形成和原生质体的转化,然后用已知的方式再生细胞壁的方法。ep0238023中描述了使用曲霉菌作为宿主微生物。另外的宿主生物可以为植物。用于转化植物的通用技术的综述可见于以下文章中:potrykus(annurevplantphysiolplantmolbiol[1991]42:205-225)和christou(agro-food-industryhi-tech,1994年3月/4月,17-27)。另外的有关植物转化的教导内容可见于ep-a-0449375。有关真菌、酵母和植物的转化的通用教导内容在以下部分示出。转化的真菌宿主生物可以为真菌——诸如霉菌。合适的这类宿主的示例包括任何属于嗜热真菌属(thermomyces)、枝顶孢属(acremonium)、曲霉菌属、青霉菌属(penicillium)、毛霉菌属(mucor)、脉孢菌属(neurospora)、木霉属(trichoderma)、根霉(rhizopus)、踝节菌属(talaromyces)、腐质霉属(humicola)等的成员。在一个实施方案中,宿主生物可为丝状真菌。转化丝状真菌在us-a-5741665中进行了讨论,该专利说明了用于丝状真菌转化和培养真菌的标准技术在本领域中是熟知的。应用于粗糙脉孢菌的技术的详细综述见于例如davisanddeserres,methodsenzymol(1971)17a:79-143。还可用于转化丝状真菌的另外教导综述于us-a-5674707。此外,在丝状真菌中的基因表达教导于punt等人(2002)trendsbiotechnol2002年5月;20(5):200-6,archer&peberdycritrevbiotechnol(1997)17(4):273-306中。本发明涵盖使用这些标准技术制备的根据本发明的转基因丝状真菌的产生。适当地,宿主生物为木霉属宿主生物,例如里氏木霉宿主生物。在另一个实施方案中,宿主生物可以为曲霉菌属,诸如黑曲霉。根据本发明的转基因曲霉菌还可通过例如以下的教导内容制备:turnerg.1994(vectorsforgeneticmanipulation.载于:martinellis.d.,kinghornj.r.(编辑)aspergillus:50yearson.progressinindustrialmicrobio-logy,第29卷,elsevieramsterdam1994.第641-666页)。转化的酵母在另一个实施方案中,转基因生物体可以为酵母。酵母中异源基因表达的原理的综述在例如methodsmolbiol(1995),49:341-54和curropinbiotechnol(1997)10月;8(5):554-60中提供。就这一点而言,酵母诸如fems酿酒酵母(saccharomycescerevisiae)菌种或巴斯德毕赤酵母(pichiapastoris)菌种(参见femsmicrobiolrev(200024(1):45-66)可以用作异源基因表达的媒介物。酿酒酵母中异源基因表达和基因产物的分泌的原理的综述由ehinchcliffeekenny(1993,“yeastasavehiclefortheexpressionofheterologousgenes”,yeasts,第5卷,anthonyhrose和j.stuartharrison编辑,第2版,academicpressltd.)给出。对于酵母的转化,已经开发出若干转化方案。例如,根据本发明的转基因酵母菌(saccharomyces)可以通过以下的教导内容制备:hinnen等人(1978,proceedingsofthenationalacademyofsciencesoftheusa75,1929);beggs,jd(1978,nature,london,275,104);以及ito,h等人(1983,jbacteriology153,163-168)。可以使用各种选择性标记诸如营养缺陷型标记显性抗生素抗性标记来选择转化的酵母细胞。培养和制备用本发明的核苷酸序列转化的宿主细胞可以在有利于制备编码多肽以及有利于从细胞和/或培养基中回收多肽的条件下培养。用于培养细胞的培养基可以是任何适于使所考虑的宿主细胞生长并获得多肽的表达的常规培养基。由重组细胞制备的蛋白质可以展示在细胞表面上。蛋白质可从宿主细胞分泌并且可使用熟知的规程从培养基中方便地回收。分泌通常,期望蛋白质从表达宿主分泌至培养基中,从而可更易于从培养基中回收蛋白质。根据本发明,分泌前导序列可以根据所需的表达宿主进行选择。杂合信号序列也可以根据本发明的语境使用。异源分泌前导序列的典型示例是来源于真菌淀粉转葡糖苷酶(ag)基因(glaa——18和24个氨基酸型式两者,例如来自于曲霉属)、a-因子基因(酵母,例如酵母属、克鲁维酵母属(kluyveromyces)和汉逊酵母属(hansenula))或α-淀粉酶基因(芽孢杆菌属)的那些。以举例的方式,大肠杆菌中异源蛋白质的分泌综述于methodsenzymol(1990)182:132-143。转录后和翻译后修饰适当地,本发明中使用的三肽基肽酶和/或内切蛋白酶可由本文教导的核苷酸序列中的任一种编码。根据所用宿主细胞,可进行转录后和/或翻译后修饰。可以设想,用于本发明方法和/或用途的酶(例如,三肽基肽酶和/或内切蛋白酶)涵盖已经历转录后和/或翻译后修饰的酶(例如,三肽基肽酶和/或内切蛋白酶)。转录后和/或翻译后修饰的一个非限制性示例为“剪切”或“切割”多肽(例如,三肽基肽酶和/或内切蛋白酶)。在一些实施方案中,可“剪切”或“切割”多肽(例如,三肽基肽酶和/或内切蛋白酶)。这可导致三肽基肽酶和/或内切蛋白酶从失活或基本失活状态转化为活性状态(即,能够表现本文所述的活性)。三肽基肽酶可为前肽,该前肽经历进一步翻译后修饰成为成熟肽,即具有三肽基肽酶活性的多肽。以举例的方式,仅seqidno.1与seqidno.29相同,不同的是seqidno.1经历了翻译后和/或转录后修饰以移除一些氨基酸,更具体地从n-末端移除197个氨基酸。因此,本文示为seqidno.1的多肽可在一些情况下(即,在一些宿主细胞中)视为前肽——其经由翻译后和/或转录后修饰而进一步加工为成熟肽(seqidno.29)。就翻译后和/或转录后修饰而言,精确修饰,例如一个或多个切割位点可根据宿主物种略微变化。在一些宿主物种中,可能不存在翻译后和/或转录后修饰,因而前肽然后将等同于成熟肽(即,具有本发明的三肽基肽酶活性的多肽)。不受理论的束缚,与参考相比于seqidno.1的seqidno.29所示的切割位点相比,一个或多个切割位点可在任一方向移位数个残基(例如,1、2或3个残基)。换句话讲,不同于第197位(r)的切割,例如,切割可例如在第196-a、195-a、194-a、198q、199e、200p位。此外或另选地,切割可导致移除约197个氨基酸,在一些实施方案中,切割可导致移除194至200个残基。转录后和/或翻译后修饰的一个示例包括但不限于豆蔻酰化、糖基化、截短、脂化以及酪氨酸、丝氨酸或苏氨酸磷酸化。技术人员将会知道,蛋白质(例如,三肽基肽酶和/或内切蛋白酶)可能发生的转录后和/或翻译后修饰的类型可取决于蛋白质(例如,三肽基肽酶和/或内切蛋白酶)在其中表达的宿主生物。检测用于检测和测量氨基酸序列的表达的多种方案在本领域中是已知的。示例包括酶联免疫吸附测定(elisa)、放射性免疫测定(ria)和荧光激活细胞分选(facs)。多种多样的标记和偶联技术为本领域内的技术人员所熟知,并且可以用于各种核酸和氨基酸测定。多个公司诸如pharmaciabiotech(piscataway,nj)、promega(madison,wi)和usbiochemicalcorp(cleveland,oh)为这些规程提供商业试剂盒和方案。合适的报道分子或标记包括那些放射性核素、酶、荧光、化学发光或显色剂以及底物、辅酶因子、抑制剂、磁性粒子等等。教导使用这类标记的专利包括us-a-3,817,837;us-a-3,850,752;us-a-3,939,350;us-a-3,996,345;us-a-4,277,437;us-a-4,275,149和us-a-4,366,241。另外,重组的免疫球蛋白可以如us-a-4,816,567中所示进行制备。融合蛋白根据本发明使用的氨基酸序列可以制成融合蛋白,例如从而有助于提取和纯化。融合蛋白伴侣的示例包括谷胱甘肽-s-转移酶(gst)、6xhis、gal4(dna结合和/或转录激活结构域)和β-半乳糖苷酶。还可以方便地包括介于融合蛋白伴侣和目的蛋白序列之间的蛋白水解裂解位点以允许移除融合蛋白序列。优选地,融合蛋白不妨碍蛋白序列的活性。大肠杆菌中的基因融合表达系统综述于curropinbiotechnol(1995)6(5):501-6。在本发明的另一个实施方案中,可将氨基酸序列连接至异源序列以编码融合蛋白。例如,对于从肽文库中筛选能够影响物质活性的试剂,它可以用于编码表达异源表位的嵌合物质,异源表位可由可商购获得的抗体识别。常规重组和方法技术除非另有指示,否则本发明采用化学、分子生物学、微生物学、重组dna和免疫学的常规技术,这些技术在本领域的普通技术人员的能力之内。此类技术在文献中有所阐明。参见,例如j.sambrook,e.f.fritsch和t.maniatis,1989,molecularcloning:alaboratorymanual,第二版,第1-3卷,coldspringharborlaboratorypress;ausubel,f.m.等人(1995andperiodicsupplements;currentprotocolsinmolecularbiology,第9、13和16章,johnwiley&sons,newyork,n.y.);b.roe,j.crabtree和a.kahn,1996,dnaisolationandsequencing:essentialtechniques,johnwiley&sons;m.j.gait(编辑),1984,oligonucleotidesynthesis:apracticalapproach,irlpress;以及d.m.j.lilley和j.e.dahlberg,1992,methodsofenzymology:dnastructureparta:synthesisandphysicalanalysisofdnamethodsinenzymology,academicpress。这些常规文件各自以引用方式并入本文。剂量本发明的方法和/或用途中使用的三肽基肽酶和/或内切蛋白酶的剂量可为任何合适的量。在一个实施方案中,三肽基肽酶可以以约5mg至3g酶/kg原料的量投配。在一个实施方案中,适当地,三肽基肽酶可以以25mg至1000mg酶/kg原料的量投配。在一个实施方案中,三肽基肽酶可以以约0.01mg-100mg;0.5mg-100mg;1mg-50mg;5mg-100mg;5mg-20mg,10mg-100mg;0.05mg-50mg;或0.10mg-10mg酶/kg原料的量投配。在某些实施方案中,三肽基肽酶可以以约0.01g至1000g,诸如0.1g至500g,诸如0.5g至700g酶/kg原料的量,诸如以约0.01g-200g,0.01g-100g;0.5g-100g;1g-50g;5g-100g;5g-20g,5g-15g,10g-100g;0.05g-50g;或0.10g-10g酶/kg原料的量投配。在一个优选的实施方案中,三肽基肽酶可以以约5mg–20mg酶/kg原料的量投配。精确的量将取决于所用组合物的特定类型和每mg蛋白质的蛋白酶比活性。在另一个实施方案中,三肽基肽酶可以以约1mg至约1kg酶/kg原料的量投配。适当地,三肽基肽酶的剂量可以以约1mg至约250g/kg原料投配。优选地,约1mg至约100g(更优选地,约1mg至约1g)/kg原料。在一些实施方案中,三肽基肽酶的剂量可基于根据以下测定计算的原料中存在的每克干固体的三肽基肽酶单位(tppu)数:三肽基肽酶的tppu单位数可利用以下计算:在96孔微量滴定板的孔中,使150ul的1mmh-ala-ala-phe-pna(对-硝基苯胺衍生的底物)的0.1mnaoac(ph4.5)溶液与各种量的酶稀释液混合以符合测定的线性范围。在室温(25℃)下,动力学上跟踪410nm处的吸光度。1u被定义为每分钟释放1微摩尔pna的酶的量。410处的pna摩尔吸附假设为8800。因此,在一个实施方案中,三肽基肽酶可以以至少约0.01tppu/g原料中存在的干固体,适当地至少0.02tppu/g原料中存在的干固体的量投配。在另一个实施方案中,三肽基肽酶可以以约0.01tppu/g原料中存在的干固体至约0.5tppu/g原料中存在的干固体的量投配。适当地,三肽基肽酶可以以约0.1tppu/g原料中存在的干固体至约0.25tppu/g原料中存在的干固体的量投配。更适当地,三肽基肽酶可以以约0.01tppu/g原料中存在的干固体至约0.1tppu/g原料中存在的干固体的量投配。优选地,三肽基肽酶可以以约0.01tppu/g原料中存在的干固体至约0.05tppu/g原料中存在的干固体的量投配。优选地,三肽基肽酶可以以约0.02tppu/g原料中存在的干固体的量投配。内切蛋白酶可以以约50mg至约3000mg酶/kg蛋白质底物,例如0.05g至3g酶/公吨(mt)原料的量投配。适当地,内切蛋白酶可以以少于约4.0g酶/mt原料的量投配。在另一个实施方案中,内切蛋白酶可以以介于约0.5g和约5.0g酶/mt原料之间的量投配。适当地,内切蛋白酶可以以介于约0.5g和约3.0g酶/mt原料之间的量投配。更适当地,内切蛋白酶可以以约1.0g至约2.0g酶/mt原料的量投配。在一个实施方案中,内切蛋白酶可以以至少约0.01sapu/g原料中存在的干固体,适当地至少0.02sapu/g原料中存在的干固体的量投配。在另一个实施方案中,内切蛋白酶可以以约0.01sapu/g原料中存在的干固体至约0.5sapu/g原料中存在的干固体的量投配。适当地,内切蛋白酶可以以约0.1sapu/g原料中存在的干固体至约0.25sapu/g原料中存在的干固体的量投配。更适当地,内切蛋白酶可以以约0.01sapu/g原料中存在的干固体至约0.1sapu/g原料中存在的干固体的量投配。优选地,内切蛋白酶可以以约0.01sapu/g原料中存在的干固体至约0.05sapu/g原料中存在的干固体的量投配。优选地,内切蛋白酶可以以约0.02sapu/g原料中存在的干固体的量投配。在一个实施方案中,内切蛋白酶可以以至少约0.1sapu/g原料中存在的干固体投配。适当地,内切蛋白酶可以以至少约0.2sapu/g原料中存在的干固体投配。在另一些实施方案中,内切蛋白酶可以以约0.1sapu至约0.5sapu/g原料中存在的干固体投配。适当地,内切蛋白酶可以以约0.1sapu至约0.3sapu/g原料中存在的干固体投配。优选地,内切蛋白酶可以以约0.15sapu至约0.25sapu/g原料中存在的干固体投配。sapu是指分光光度测定的酸性蛋白酶单位,其中1sapu是在测定条件下每分钟从酪蛋白底物中释放一微摩尔酪氨酸的蛋白酶活性量。基于谷物的材料根据本发明使用的原料可为谷物/谷类(例如,小麦、大麦、裸麦、稻、黑小麦、粟、买罗高粱、高粱或玉米)、根、块茎(例如,马铃薯或木薯)、糖(例如,蔗糖、甜菜糖、糖蜜或糖浆)、釜馏物、湿饼、ddgs、或它们的混合物或部分。为避免疑义,谷物可通过机械方式破碎。基于谷物的材料可分解或降解为葡萄糖。对于任何发酵过程,例如生物燃料(例如生物乙醇)生产,葡萄糖可随后用作原料。基于谷物的材料可为生物燃料(例如生物乙醇)生产过程的原料。目前,大部分燃料乙醇由玉米(玉蜀黍)谷物制得,该玉米谷物被研磨或碾磨,经淀粉酶处理以将淀粉水解成糖,糖化并发酵,或经受ssf,以及蒸馏。在所述过程中通常使用其它酶。虽然在降低乙醇生产成本方面已取得了实质性进步,但是仍面临着重大挑战。仍然需要改善的技术来降低用于乙醇生产的生物燃料原料的成本。例如,在基于谷物的乙醇生产中,阿拉伯木聚糖的降解可增大淀粉的易获得性。在一些实施方案中,木聚糖酶可用于分解半纤维素,例如阿拉伯木聚糖——具体地为axinsol和axsol。仅以举例的方式,在欧洲燃料醇工业中,小粒谷物如小麦、大麦和裸麦为常见原材料,在us主要使用玉米。除淀粉之外,小麦、大麦和裸麦还包含高含量的非淀粉多糖聚合物(nsp),如纤维素、β-葡聚糖和半纤维素。其中表示不同的nsp的比率对于每种原料有所不同并且根据所用测量方法变化,但是仅以举例的方式,下表示出相比于某些其它原料,小麦、大麦和裸麦中nsp的量不同。表1:不同原料中存在的非淀粉多糖(gkg-1干物质)1非纤维素多糖:戊聚糖、(阿拉伯)木聚糖及其它半纤维素本发明的一个优点在于,在醇(例如,生物燃料)生产中使用本发明的三肽基肽酶还可由该过程产生改善的副产物,诸如湿饼、干酒糟(ddg)或含可溶物干酒糟(ddgs)。因此,本发明的一个优点在于,因为湿饼、ddg和ddgs是生物燃料(例如,生物乙醇)生产的副产物,所以本发明的用途可导致这些副产物的质量提高。醇生产的副产物本发明提供了通过本发明的方法可获得的(或获得的)醇生产的副产物。适当地,醇生产的副产物可基本上富含一种或多种三肽。如本文所用,术语“基本上富含三肽”意指由本领域已知的任何方法(例如,液相色谱-质谱(lc-ms))测量的总肽浓度的至少约20%(适当地,至少约30%)的那些肽是三肽。适当地,至少约40%,更适当地至少约50%的那些肽是三肽。在一个实施方案中,如本文所用,术语“基本上富含三肽”意指由本领域已知的任何方法(例如,液相色谱-质谱(lc-ms))测量的总肽浓度的至少约70%的那些肽是三肽。在一些实施方案中,醇生产的副产物可基本上富含一种或多种在n-末端、c-末端或它们的组合处具有脯氨酸的三肽。适当地,副产物可富含一种或多种在n-末端并在c-末端具有脯氨酸的三肽。副产物可为在醇发酵过程后可获得的任何材料。适当地,醇生产的副产物可为全釜馏物、稀釜馏物、湿饼、干酒糟(ddg)、含可溶物干酒糟(ddgs)或富含蛋白质的ddg或ddgs、或蛋白质级分。优选地,副产物可为生物燃料生产过程的副产物。与其它组分/形式的组合三肽基肽酶和/或内切蛋白酶可以以本领域已知的任何方式配制。在一个实施方案中,可将本发明中使用的三肽基肽酶和/或内切蛋白酶配制为液体、干粉或颗粒。优选地,三肽基肽酶和/或内切蛋白酶可配制为液体制剂。在其它实施方案中,三肽基肽酶和/或内切蛋白酶可配制为干粉。在一些实施方案中,可将另外的成分与三肽基肽酶(例如,耐脯氨酸三肽基肽酶)混合,所述另外的成分诸如盐(诸如na2so4)、麦芽糖糊精、石灰石(碳酸钙)、环糊精、小麦或小麦组分、淀粉、滑石、pva、多元醇(诸如山梨糖醇和甘油)、苯甲酸酯、山梨酸酯、糖(诸如蔗糖和葡萄糖)、丙二醇、1,3-丙二醇、对羟基苯甲酸酯、氯化钠、柠檬酸盐、乙酸盐、乙酸钠、磷酸盐、钙、偏亚硫酸氢盐、甲酸盐或它们的混合物。在一个优选的实施方案中,根据本发明的食物添加剂组合物或饲料添加剂组合物包含根据本发明的三肽基肽酶(例如耐脯氨酸三肽基肽酶)或根据本发明的发酵物,并且进一步包含一种或多种选自以下的成分:盐、多元醇包括山梨糖醇和甘油、小麦或小麦组分、乙酸钠、三水合醋酸钠、山梨酸钾、滑石、pva、苯甲酸酯、山梨酸酯、1,3-丙二醇、葡萄糖、对羟基苯甲酸酯、氯化钠、柠檬酸盐、偏亚硫酸氢盐、甲酸盐或它们的组合。在一个实施方案中,盐可选自:na2so4、nah2po4、na2hpo4、na3po4、(nh4)h2po4、k2hpo4、kh2po4、k2so4、khso4、znso4、mgso4、cuso4、mg(no3)2、(nh4)2so4、硼酸钠、乙酸镁、柠檬酸钠或它们的组合。干粉或颗粒可通过本领域技术人员已知的手段,诸如,在顶喷式流化床涂布器中、在wurster型底喷式流化床(buttomspraywurster)中或通过转鼓制粒(例如高剪切制粒)、挤出、衣锅包衣或在微成分混合器中制备。适当地,可将三肽基肽酶(任选地与内切蛋白酶组合)与如本文公开的产醇宿主一起干燥。对于一些实施方案而言,可涂布(例如包封)三肽基肽酶和/或内切蛋白酶。在一个实施方案中,涂层保护经修饰的酶免受热影响并且可视为防热剂。在一些实施方案中,可使用稀释剂(诸如淀粉粉末、石灰石等)稀释三肽基肽酶和/或内切蛋白酶。在一个实施方案中,三肽基肽酶和/或内切蛋白酶含有如下中的一者或多者:缓冲剂、盐、山梨糖醇和/或甘油。在另一个实施方案中,可通过将酶施加(例如喷涂)于承载基底(诸如碾碎的小麦)上来配制三肽基肽酶和/或内切蛋白酶。食品级酶的典型的液体制剂可包含以下组分(%为以w/w计):目的酶0,2%-30%,优选地2%-20%。在一些实施方案中,可将多元醇与三肽基肽酶和/或内切蛋白酶混合。多元醇诸如甘油和/或山梨糖醇可以以5%(w/w)-50%(w/w),优选地10%-50%(w/w)并且更优选地10%-30%(w/w)的量混合,%(w/w)意指%(重量多元醇/重量溶液),不受理论的束缚,较低浓度的10%多元醇可有助于增大酶的溶解度和贮存稳定性。然而,许多商业酶需要30%甘油,从而使酶随时间推移以目标浓度保持稳定。50%的较高多元醇仍可能进一步改善稳定性,但在该多元醇水平下,低水活度的益处还有利于微生物保藏。具体地对食品酶而言,这在中性ph下可极为重要,其中选择较好的防腐剂受到了限制。可将糖(具体地葡萄糖)与三肽基肽酶和/或内切蛋白酶混合。糖例如葡萄糖、果糖、蔗糖、麦芽糖、乳糖、海藻糖都为底物的示例,对许多酶而言该底物可代替多元醇的使用。适当地,它们(具体地葡萄糖)可在5%(w/w)-50%(w/w)范围内单独地或与多元醇组合使用。还可通过使用浓度为约0.1%至约20%(适当地约0.1%至约5%)的盐如nacl、kcl、cacl2、na2so4或其它食品级盐来增大酶制剂的稳定性。不受理论的束缚,据信单独的或与多元醇或糖组合的高浓度盐还可为一种实现微生物稳定性的方式。作用机制可能归因为低水活度或某些酶与盐之间的特定作用。因此,在一些实施方案中,可将三肽基肽酶与至少一种盐混合。可将乙酸钠以5%(w/w)-50%(w/w),优选地8%-40%,优选地8%-12%(w/w),优选地10%-50%,还更优选地10%-30%(w/w)的量混合,%(w/w)意指%(重量乙酸钠/重量溶液)。在一个实施方案中,可将三肽基肽酶和/或内切蛋白酶与防腐剂混合。适当地,防腐剂可为苯甲酸盐(诸如苯甲酸钠)和/或山梨酸钾。这些防腐剂可通常以约0.1%-1%,适当地约0.2%-0.5%的组合浓度使用。苯甲酸钠在ph<5.5下最有效,并且山梨酸钠在ph<6下最有效。在一个实施方案中,一种或多种成分(例如,用于配制酶(例如,三肽基肽酶和/或内切蛋白酶))可选自:小麦载体、多元醇、糖、盐和防腐剂。适当地,糖为山梨糖醇。适当地,盐为硫酸钠。适当地,多元醇可为聚乙二醇。在一个实施方案中,一种或多种成分(例如,用于配制酶(例如,三肽基肽酶和/或内切蛋白酶))可选自:小麦载体、多元醇、山梨糖醇、硫酸钠和防腐剂。适当地,一种或多种成分(例如,用于配制三肽基肽酶和/或内切蛋白酶)可选自:小麦载体、山梨糖醇和硫酸钠。适当地,可将三肽基肽酶和/或内切蛋白酶与小麦载体混合。适当地,可将三肽基肽酶和/或内切蛋白酶与山梨糖醇混合。适当地,可将三肽基肽酶和/或内切蛋白酶与硫酸钠混合。在一个实施方案中,本发明中使用的酶(例如,三肽基肽酶和/或内切蛋白酶)可用一种或多种选自以下的成分配制:多元醇,诸如甘油和/或山梨糖醇;糖,诸如葡萄糖、果糖、蔗糖、麦芽糖、乳糖和海藻糖;盐,诸如nacl、kcl、cacl2、na2so4或其它盐;防腐剂,例如苯甲酸钠和/或山梨酸钾;或它们的组合。在另一个实施方案中,在本发明的方法和/或用途中使用的三肽基肽酶可用包含以下物质(或实质上由以下物质组成;或由以下物质组成)的载体配制:na2so4、nah2po4、na2hpo4、na3po4、(nh4)h2po4、k2hpo4、kh2po4、k2so4、khso4、znso4、mgso4、cuso4、mg(no3)2、(nh4)2so4、硼酸钠、乙酸镁、柠檬酸钠或它们的组合。在另一个实施方案中,在本发明的方法和/或用途中使用的三肽基肽酶可用na2so4配制。三肽基肽酶和/或内切蛋白酶可与其它组分组合使用。在一个实施方案中,“另外的组分”可为一种或多种酶。因此,在一个实施方案中,本发明的方法和/或用途可进一步包括利用一种或多种纤维素酶活性、半纤维素酶活性、另外的酶活性或它们的组合。适当地,一种或多种纤维素酶活性、半纤维素酶活性、另外的酶活性或它们的组合选自:选自以下的酶中的一种或多种:内切葡聚糖酶(e.c.3.2.1.4);纤维二糖水解酶(e.c.3.2.1.91)、β-葡糖苷酶(e.c.3.2.1.21)、纤维素酶(e.c.3.2.1.74)、地衣多糖酶(e.c.3.1.1.73)、脂肪酶(e.c.3.1.1.3)、脂质酰基转移酶(通常归类为e.c.2.3.1.x)、磷脂酶(e.c.3.1.1.4,e.c.3.1.1.32或e.c.3.1.1.5)、植酸酶(例如6-植酸酶(e.c.3.1.3.26)或3-植酸酶(e.c.3.1.3.8)、酸性磷酸酶、淀粉酶、α-淀粉酶(e.c.3.2.1.1)、木聚糖酶(例如,内切-1,4-β-d-木聚糖酶(e.c.3.2.1.8)或1,4β-木糖苷酶(e.c.3.2.1.37)或e.c.3.2.1.32,e.c.3.1.1.72,e.c.3.1.1.73)、葡糖淀粉酶(e.c.3.2.1.3)、普鲁兰酶、半纤维素酶、蛋白酶(例如,枯草杆菌蛋白酶(e.c.3.4.21.62)或芽孢杆菌溶素(e.c.3.4.24.28)或碱性丝氨酸蛋白酶(e.c.3.4.21.x)或角蛋白酶(e.c.3.4.x.x))、脱支酶、角质酶、酯酶和/或甘露聚糖酶(例如,β-甘露聚糖酶(e.c.3.2.1.78))、转移酶、葡糖苷酶、阿拉伯呋喃糖苷酶。适当地,其它组分可为植酸酶(例如,6-植酸酶(e.c.3.1.3.26)或3-植酸酶(e.c.3.1.3.8))。在一个实施方案中,其它组分可为选自以下的酶中的一种或多种:木聚糖酶(e.c.3.2.1.8,e.c.3.2.1.32,e.c.3.2.1.37,e.c.3.1.1.72,e.c.3.1.1.73)、淀粉酶(包括α-淀粉酶(e.c.3.2.1.1)、g4-形成淀粉酶(e.c.3.2.1.60)、β-淀粉酶(e.c.3.2.1.2)和γ-淀粉酶(e.c.3.2.1.3);和/或蛋白酶(例如,枯草杆菌蛋白酶(e.c.3.4.21.62)或芽孢杆菌溶素(e.c.3.4.24.28)或碱性丝氨酸蛋白酶(e.c.3.4.21.x)或角蛋白酶(e.c.3.4.x.x))。在一个实施方案中,其它组分可为淀粉酶(例如,α-淀粉酶(e.c.3.2.1.1))和蛋白酶(例如,枯草杆菌蛋白酶(e.c.3.4.21.62))的组合。在一个优选的实施方案中,三肽基肽酶可用一种或多种葡糖淀粉酶、α-淀粉酶和/或另外的蛋白酶配制。适当地,另外的蛋白酶可为内切蛋白酶。在一个实施方案中,其它组分可为β-葡聚糖酶,例如,内切-1,3(4)-β-葡聚糖酶(e.c.3.2.1.6)。在一个实施方案中,其它组分可为甘露聚糖酶(例如,β-甘露聚糖酶(e.c.3.2.1.78))。在一个实施方案中,其它组分可为脂肪酶(e.c.3.1.1.3)、脂质酰基转移酶(通常归类为e.c.2.3.1.x)、或磷脂酶(e.c.3.1.1.4,e.c.3.1.1.32或e.c.3.1.1.5)、适当的脂肪酶(e.c.3.1.1.3)。在一个实施方案中,其它组分可为蛋白酶(例如,枯草杆菌蛋白酶(e.c.3.4.21.62)或芽孢杆菌溶素(e.c.3.4.24.28)或碱性丝氨酸蛋白酶(e.c.3.4.21.x)或角蛋白酶(e.c.3.4.x.x))。在一个实施方案中,另外的酶可为α-淀粉酶(e.c.3.2.1.1)、普鲁兰酶(ec3.2.1.41))、β-淀粉酶(e.c.3.2.1.2)、麦芽糖淀粉酶(例如,葡聚糖1,4-α-麦芽糖水解酶(ec3.2.1.133)),g4-形成淀粉酶(e.c.3.2.1.60)、异淀粉酶(ec3.2.1.68)、葡糖淀粉酶(e.c.3.2.1.3)或它们的组合。在一些实施方案中,根据本发明的方法和/或用途可进一步包括使用一种或多种糖苷水解酶(gh)。gh酶可包括木聚糖酶、甘露聚糖酶、淀粉酶、β-葡聚糖酶、纤维素酶、以及其它糖酶,并且可基于如下特性分类:氨基酸β-葡聚糖酶、纤维素酶、以及其它糖酶,并且可基于如下特性分类:氨基酸的序列、它们的三维结构以及它们催化位点的几何结构(gilkes等人,1991,microbiol.reviews55:303-315)。在一个实施方案中,根据前述实施方案的gh酶(例如,木聚糖酶)可为选自由以下项组成的组中的一者或多者的gh家族酶:gh10、gh11、gh5、gh7、gh8和gh43。最初,所有已知且表征的木聚糖酶均属于家族gh10或gh11。进一步的工作然后鉴定了属于家族gh5、gh7、gh8和gh43的多种其它类型的木聚糖酶(collins等人(2005)femsmicrobiolrev.,29(1),3-23)。gh11木聚糖酶的结构可描述为β-果冻卷结构或全β-链夹层折叠结构(himmel等人1997appl.biochem.biotechnol.63-65,315-325)。gh11酶具有约20kda的催化结构域。gh10木聚糖酶具有分子量在32kda-39kda范围内的催化结构域。gh10木聚糖酶的催化结构域的结构由八重β/α筒组成(harris等人1996–acta.crystallog.sec.d52,393-401)。三维结构可用于大量的家族gh10酶,首先实现是变铅青链霉菌木聚糖酶a(derewenda等人,jbiolchem,1994年8月19日;269(33)20811-4)、粪碱纤维单胞菌(c.fimi)内切-聚糖酶cex(white等人,biochemistry,1994年10月25日;33(42)12546-52)和纤维弧菌(cellvibriojaponicus)xyn10a(先前为荧光假单胞菌(pseudomonasfluorescens)亚种木聚糖酶a)(harris等人,structure1994年11月15日;2(11)1107-1116的那些。作为clangha的成员,它们具有典型的(α/β)8tim筒状折叠,而两个关键的活性位点谷氨酸位于β-链4(酸/碱)和7(亲核体)的c-末端(henrissat等人,procnatlacadsciusa,1995年7月18日;92(15)7090-4)。gh家族酶可通过本领域已知的技术由技术人员鉴定。蛋白质相似性搜索(例如,蛋白质blast,http://blast.ncbi.nlm.nih.gov/blast.cgi?cmd=web&page_type=blasthome)可确定未知序列是否可落入例如gh10木聚糖酶家族成员的项目内,具体地讲,gh家族可基于关键区中的序列同源性分类。此外或另选地,为了确定未知蛋白质序列是否为gh10家族内的木聚糖酶蛋白质,不仅可对序列相似性/同源性/同一性,还可对3d结构相似性进行评价。gh-家族的分类通常基于3d折叠。预测未知蛋白质序列的3d折叠的软件为hhpred(http://toolkit.tuebingen.mpg.de/hhpred)。预测蛋白质结构的该种软件的功效依赖于使用待用作模板的已知结构来鉴定同源序列。其效果良好,因为结构比一级序列发散(diverge)得更慢。甚至当其序列发散到不能识别的程度时,同一家族的蛋白质也可能具有极为类似的结构。例如,可将未知序列以fasta格式粘贴到软件中(http://toolkit.tuebingen.mpg.de/hhpred)。在完成了这步后,可提交搜索。搜索的输出将示出具有已知3d结构的序列的列表。为了确认未知序列实际为例如gh10木聚糖酶,可发现gh10木聚糖酶有>90的概率在同系物的列表之内。并非所有被鉴定为同系物的蛋白质将表征为gh10木聚糖酶,但是一些将是这样。后者蛋白质是具有已知结构并且它们被鉴定为木聚糖酶的生化特征的蛋白质。前者并未生化表征为gh10木聚糖酶。若干参考文献描述了该方案,诸如j.(2005)proteinhomologydetectionbyhmm-hmmcomparison-bioinformatics21,951-960(doi:10.1093/bioinformatics/bti125)和j,biegerta和lupasan.(2005)thehhpredinteractiveserverforproteinhomologydetectionandstructureprediction-nucleicacidsresearch33,w244--w248(web服务器发布)(doi:10.1093/nar/gki40)。根据cazy网站(http://www.cazy.org/),家族10糖苷水解酶可如下表征:已知活性:内切-1,4-β-木聚糖酶(ec3.2.1.8);内切-1,3-β-木聚糖酶(ec3.2.1.32);番茄皂甙酶(tomatinase)(ec3.2.1.-)机制:保持clan:gh-a催化亲核物质/碱glu(实验)催化质子供体:glu(实验)3d结构状态:(β/α)8根据本发明使用的gh10木聚糖酶可具有分子量在32kda-39kda范围内的催化结构域。gh10木聚糖酶的催化结构域的结构由八重β/α筒组成(harris等人1996–acta.crystallog.sec.d52,393-401)。三维结构可用于大量的家族gh10酶,首先实现是变铅青链霉菌木聚糖酶a(derewenda等人,jbiolchem,1994年8月19日;269(33)20811-4)、粪碱纤维单胞菌(c.fimi)内切-聚糖酶cex(white等人,biochemistry,1994年10月25日;33(42)12546-52)和纤维弧菌(cellvibriojaponicus)xyn10a(先前为荧光假单胞菌(pseudomonasfluorescens)亚种木聚糖酶a)(harris等人,structure1994年11月15日;2(11)1107-1116)那些。作为clangha的成员,它们具有典型的(α/β)8tim筒状折叠,而两个关键的活性位点谷氨酸位于β-链4(酸/碱)和7(亲核体)的c-末端(henrissat等人,procnatlacadsciusa,1995年7月18日;92(15)7090-4)。因此,如本文所用,“gh10木聚糖酶”意指这样的多肽:具有木聚糖酶活性并具有(α/β)8tim筒状折叠,而两个关键的活性位点谷氨酸位于β-链4(酸/碱)和7(亲核体)的c-末端。在一个特别优选的实施方案中,三肽基肽酶不可与具有以下多肽序列的酶组合:mrtaaasltlaatclfelasalmpraplipamkakvalpsgnatfeqyidhnnpglgtfpqrywynpefwagpgspvllftpgesdaadydgfltnktivgrfaeeiggavillehrywgasspypelttetlqyltleqsiadlvhfaktvnlpfdeihssnadnapwvmtggsysgalaawtasiapgtfwayhassapvqaiydfwqyfvpvvegmpkncskdlnrvveyidhvyesgdierqqeikemfglgalkhfddfaaaitngpwlwqdmnfvsgysrfykfcdavenvtpgaksvpgpegvglekalqgyaswfnstylpgscaeykywtdkdavdcydsyetnspiytdkavnntsnkqwtwflcneplfywqdgapkdestivsrivsaeywqrqchayfpevngytfgsangktaedvnkwtkgwdltnttrliwangqfdpwrdasvssktrpggplqsteqapvhvipggfhcsdqwlvygeanagvqkvideevaqikawvaeypkyrkp在另一个实施方案中,其它组分可为另外的蛋白酶。适当地,另外的蛋白酶可选自:氨肽酶和羧肽酶。如在该语境中使用的术语“氨肽酶”是指能够从蛋白质和/或肽底物的n-末端切割单个氨基酸、二氨基酸或它们的组合的外肽酶。优选地,氨肽酶能够仅从蛋白质和/或肽底物的n-末端切割单个氨基酸。氨肽酶可获得(例如获得)自乳杆菌,适当地获得自瑞士乳杆菌(lactobacillushelveticus)。在一个实施方案中,氨肽酶可为氨肽酶n(例如,pepn)(ec3.4.11.2)。在另一个实施方案中,氨肽酶可包含如下所示序列:mavkrfyktfhpehydlrinvnrknktingtstitgdvienpvfinqkfmtidsvkvdgknvdfdviekdeaikiktgvtgkavieiaysapltdtmmgiypsyyelegkkkqiigtqfettfarqafpcvdepeakatfslalkwdeqdgevalanmpevevdkdgyhhfeetvrmssylvafafgelqsktthtkdgvligvyatkahkpkeldfaldiakraiefyeefyqtkyplpqslqlalpdfsagamenwglvtyreayllldpdntslemkklvatvithelahqwfgdlvtmkwwdnlwlnesfanmmeylsvdglepdwhiwemfqtseaasalnrdatdgvqpiqmeindpadidsvfdgaivyakgsrmlvmvrsllgddalrkglkyyfdhhkfgnatgddlwdalstatdldigkimhswlkqpgypvvnafvaedghlkltqkqffigegedkgrqwqiplnanfdapkimsdkeidlgnykvlreeaghplrlnvgnnshfiveydktllddilsdvneldpidklqllqdlrllaegkqisyasivpllvkfadsksslvinalyttaaklrqfvepesneeknlkklydllskdqvarlgwevkpgesdedvqirpyelsaslyaenadsikaahqiftenednlealnadirpyvlinevknfgnaelvdklikeyqrtadpsykvdlrsavtstkdlaaikaivgdfenadvvkpqdlcdwyrgllanhygqqaawdwiredwdwldktvggdmefakfitvtagvfhtperlkefkeffepkinvpllsreikmdvkvieskvnlieaekdavndavakaid如本文所用,术语“羧肽酶”具有其在本领域中常用的含义并且指能够从肽和/或蛋白质底物的c-末端切割n个氨基酸的外肽酶。在一个实施方案中,n可为至少1,适当地,n可为至少2。在其它实施方案中,n可为至少3,适当地至少4。在其它实施方案中,可将三肽基肽酶(任选地与内切蛋白酶组合)与一种或多种另外的外肽酶一起使用。在一个实施方案中,耐脯氨酸三肽基肽酶(任选地与内切蛋白酶组合)不与脯氨酸特异性外肽酶组合。在一个实施方案中,额外组分可为稳定剂或乳化剂或粘结剂或载体或赋形剂或稀释剂或崩解剂。如本文所用,术语“稳定剂”定义为保持产品免于随时间推移而变化的成分或成分的组合。如本文所用,术语“乳化剂”是指防止乳液分离的成分。乳液是两种不可混溶的物质,一种以小滴形式存在,包含于另一者中。乳液可由以下组成:水包油,其中小滴或分散相为油并且连续相为水;或油包水,其中水变为分散相并且连续相为油。也可通过使用乳化剂使泡沫(其是液包气)和混悬液(其为液包固混悬液)稳定。如本文所用,术语“粘结剂”是指通过物理或化学反应将产品粘结在一起的成分。例如,在“胶凝”期间,水被吸收,从而提供结合效果。然而,粘结剂可吸收其它液体(诸如油),从而将其保持在产品中。在本发明上下文中,粘结剂将通常用于固体或低水分产品(例如烘焙产品:甜点、甜甜圈、面包等等)中。制粒粘结剂的示例包括以下项中的一者或多者:聚乙烯吡咯烷酮、羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)、蔗糖、麦芽糖、明胶和阿拉伯树胶。“载体”意指适于施用酶的材料且包括本领域已知的任何此类材料,诸如例如任何液体、凝胶、溶剂、液体稀释剂、稳定剂等等,其为无毒的并且并不以有害方式与组合物的任何组分相互作用。本发明提供了组合物的用途以及用于制备该组合物的方法,所述组合物包含与至少一种选自如下中的至少一者的生理学上可接受的载体组合的三肽基肽酶(任选地与内切蛋白酶组合):麦芽糖糊精、石灰石(碳酸钙)、环糊精、小麦或小麦组分、蔗糖、淀粉、na2so4、滑石、pva、山梨糖醇、苯甲酸酯、山梨酸酯、甘油、蔗糖、丙二醇、1,3-丙二醇、葡萄糖、对羟基苯甲酸酯、氯化钠、柠檬酸盐、乙酸盐、磷酸盐、钙、偏亚硫酸氢盐、甲酸盐以及它们的混合物。在另一个实施方案中,本发明提供了组合物的用途和制备组合物的方法,该组合物包含用选自由以下项组成的组中的一者或多者的化合物配制的本发明的酶:na2so4、nah2po4、na2hpo4、na3po4、(nh4)h2po4、k2hpo4、kh2po4、k2so4、khso4、znso4、mgso4、cuso4、mg(no3)2、(nh4)2so4、硼酸钠、乙酸镁、柠檬酸钠或它们的组合。“赋形剂”的示例包括以下中的一者或多者:微晶纤维素和其它纤维素、乳糖(lactose)、柠檬酸钠、碳酸钙、磷酸氢钙、甘氨酸、淀粉、乳糖(milksugar)和高分子量聚乙二醇。“崩解剂”的示例包括以下中的一者或多者:淀粉(优选玉米、马铃薯或木薯淀粉)、羟基乙酸淀粉钠、交联羧甲基纤维素钠和某些复合硅酸盐。“稀释剂”的示例包括以下中的一者或多者:水、乙醇、丙二醇和甘油、以及它们的组合。其它的组分可同时使用(例如当它们混合在一起时或者甚至当它们通过不同的途径递送时)或者依序用于组合物(例如它们可通过不同的途径递送)。在一个实施方案中,优选地,组合物不包含铬或有机铬。在一个实施方案中,优选地,组合物不包含山梨酸。本发明中使用的三肽基肽酶和/或内切蛋白酶可以以任何合适的形式使用。三肽基肽酶和/或内切蛋白酶可以固体或液体制剂或其备选形式使用。固体制剂的示例包括散剂、糊剂、大丸剂、胶囊剂、丸粒、片剂、药丸、颗粒剂、胶囊剂、胚珠、溶液或混悬剂、粉剂和颗粒剂,其可以是可润湿的、喷雾干燥的或冷冻干燥的。液体制剂的示例包括但不限于水性、有机或水性-有机溶液、混悬剂和乳剂。三肽基肽酶和/或内切蛋白酶可包含调味剂或着色剂,以供立即、延迟、改性、持续、脉冲或受控释放应用。以举例的方式,如果三肽基肽酶和/或内切蛋白酶以固体例如丸粒形式使用,其还可包含以下中的一者或多者:赋形剂,诸如微晶纤维素、乳糖、柠檬酸钠、碳酸钙、磷酸氢钙和甘氨酸;崩解剂,诸如淀粉(优选地玉米、马铃薯或木薯淀粉)、羟基乙酸淀粉钠、交联羧甲基纤维素钠和某些复合硅酸盐;制粒粘结剂,诸如聚乙烯吡咯烷酮、羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)、蔗糖、明胶和阿拉伯树胶;润滑剂,诸如硬脂酸镁、硬脂酸、甘油基二十二烷酸酯和滑石可包括在内。用于制备这些形式的营养上可接受的载体的示例包括(例如)水、盐溶液、醇、有机硅(silicone)、蜡、石油凝胶、植物油、聚乙二醇、丙二醇、脂质体、糖、明胶、乳糖、直链淀粉、硬脂酸镁、滑石、表面活性剂、硅酸、粘性石蜡、香料油、脂肪酸甘油单酯和脂肪酸甘油二酯、石油醚(petroethral)脂肪酸酯、羟甲基-纤维素、聚乙烯吡咯烷酮等等。用于这些形式的优选赋形剂包括乳糖(lactose)、淀粉、纤维素、乳糖(milksugar)或高分子量聚乙二醇。对于水性混悬剂和/或酏剂而言,可将本发明的组合物与各种甜味剂或调味剂、着色物质或染料、与乳化剂和/或助悬剂以及与稀释剂(诸如水、丙二醇和甘油)以及它们的组合进行组合。包装在一个实施方案中,可包装根据本发明的三肽基肽酶和/或内切蛋白酶。在一个优选的实施方案中,将三肽基肽酶和/或内切蛋白酶包装于袋(诸如纸袋)中。在一个另选的实施方案中,可将三肽基肽酶和/或内切蛋白酶密封于容器中。可使用任何合适的容器。优点本文的发明人发现,三肽基肽酶可切割存在于原料中的蛋白质和/或肽底物以释放三肽,令人惊奇地发现这例如在生物乙醇生产期间增加醇的产量。在另一个实施方案中,使用三肽基肽酶可有利地提高产醇宿主在醇生产期间的发酵能力。不受理论的束缚,据信本发明的三肽基肽酶可使存在于原料或其级分中的三肽的浓度增大,所述三肽可为产醇宿主的良好的氨基酸源和/或能量和/或营养源。因此,本发明的优点在于其可改善产醇宿主的总体健康状态。有利地,使用本发明的三肽基肽酶可降低需要向原料添加的脲的量。本发明的一个优点在于,在醇(例如,生物燃料)生产中使用本发明的三肽基肽酶可由该过程产生改善的副产物,诸如湿饼、干酒糟(ddg)或含可溶物干酒糟(ddgs)。因此,本发明的一个优点在于,因为湿饼、ddg和ddgs是生物燃料(例如,生物乙醇)生产的副产物,所以本发明的用途可导致这些副产物的质量提高。具体地,副产物可富含蛋白质。在一个具体实施方案中,(副)产物可富含三肽,例如富脯氨酸三肽。有利地,在本发明中使用的所教导的三肽基肽酶能够对宽泛范围的肽和/或蛋白质底物起作用,并且由于具有此类广泛的底物特异性不易于阻止切割富含某些氨基酸(例如,脯氨酸和/或赖氨酸和/或精氨酸和/或甘氨酸)的底物。使用此类三肽基肽酶(例如,耐脯氨酸三肽基肽酶)因而可有效和/或快速地降解原料中的蛋白质底物并产生三肽。优选地,三肽基肽酶可对在p1位置处具有赖氨酸、精氨酸或甘氨酸中的一者或多者的肽和/或蛋白质具有较高的活性。不受理论的束缚,通常就多种三肽基肽酶和/或蛋白酶而言,在p1位置处包含这些氨基酸的肽和/或蛋白质底物可能难以消化,并且在遇到此类残基时,三肽基肽酶和/或蛋白酶对肽和/或蛋白质底物的切割可停止或减慢。有利地,利用本发明的三肽基肽酶,可以有效地消化在p1处包含赖氨酸、精氨酸和/或甘氨酸的蛋白质和/或肽底物和/或不显著减慢切割反应,这导致更有效地消化原料中的底物和/或更有效地生成三肽。本发明还提供了耐脯氨酸三肽基肽酶的用途,所述耐脯氨酸三肽基肽酶除具有上述活性之外,还可耐受位置p2、p2’、p3和p3’处的脯氨酸。这是有利的,因为其允许有效地切割具有脯氨酸区段的肽和/或蛋白质底物并允许切割宽泛范围的肽和/或蛋白质底物,这导致更有效地消化原料。有利地,三肽基肽酶可对在p1位置处具有赖氨酸的肽和/或蛋白质具有优先活性,这允许有效地切割赖氨酸含量较高的底物,诸如乳清蛋白。本发明还提供了热稳定的三肽基肽酶,该热稳定的三肽基肽酶在与非热稳定变体相比时不易于变性和/或因此将在较长时间段内保持活性。有利地,耐脯氨酸三肽基肽酶可在约ph7的ph范围内具有活性,因而可与碱性内切蛋白酶一起使用。这意指在酶处理之间不必改变用于产生水解产物的包含蛋白质和/或肽底物的反应培养基的ph。换句话讲,其允许三肽基肽酶和内切蛋白酶同时添加到反应中(例如,在本发明的方法和/或用途期间),这可使得该过程更快和/或更有效和/或更节约成本。此外,这允许更有效的反应,因为在较低的ph值下,底物可从溶液中沉淀出来并因此未被切割。在酸性ph下具有活性的三肽基肽酶可与酸性内切蛋白酶组合使用,并且有利地不需要在酶处理之间改变反应培养基的ph。有利地,将内切蛋白酶与三肽基肽酶组合使用可增大底物切割的效率。不受理论的束缚,据信内切蛋白酶能够在远离c-末端或n-末端的多个区切割肽和/或蛋白质底物,从而产生三肽基肽酶的更多个n-末端以用作底物,由此有利地增大反应效率和/或缩短反应时间。使用内切蛋白酶、三肽基肽酶和另外的组分,例如羧肽酶和/或氨肽酶具有许多优点:·其允许有效地产生能被产醇宿主有效吸收(例如,因为对摄入有更佳的渗透势)的单个氨基酸和/或二肽和/或三肽;·蛋白质和/或肽底物可更有效和/或更快速地消化;·具体地,在体外使用时,诸如在通过使三肽消化为单个氨基酸和/或二肽来制造水解产物中,降低耐脯氨酸三肽基肽酶的终点抑制(即,被其反应产物抑制);和/或·对包含高含量的脯氨酸、赖氨酸、精氨酸和/或甘氨酸的底物具有协同和/或加成活性。令人惊奇地,可通过实施本发明的方法和/或用途获得的ddgs可具有改善的味道。有利地,因此可通过本发明获得的ddgs对于用ddgs喂养的受试者(例如,动物)更为美味。其它定义除非另有定义,否则本文所用的所有技术和科学术语都具有本公开所属领域的普通技术人员通常理解的含义。singleton等人,dictionaryofmicrobiologyandmolecularbiology(《微生物学和分子生物学词典》),第20版,纽约约翰威立国际出版公司(johnwileyandsons,newyork)(1994),以及hale和marham,theharpercollinsdictionaryofbiology,harperperennial,ny(1991)为本领域技术人员提供关于本公开中所用的多个术语的一般性词典。本公开并不受本文公开的示例性方法和材料的限制,并且任何与本文所述的那些方法和材料相似或等同的方法和材料都可用于本公开的实施方案的实施或测试。数值范围包括定义该范围的数字。除非另外指明,否则分别是,任何核酸序列从左至右以5'至3'取向写出;氨基酸序列从左至右以氨基至羧基取向写出。本文提供的标题并非是对本公开的各个方面或实施方案的限制,这些方面或实施方案可通过将说明书作为一个整体来参考而得到。相应地,下面就要定义的术语通过将说明书作为一个整体来参考会得到更完全的定义。氨基酸在本文中用氨基酸名称、三字母缩写或单字母缩写来指代。如本文所用,术语“蛋白质”包括蛋白质、多肽和肽。如本文所用,术语“氨基酸序列”与术语“多肽”和/或术语“蛋白质”同义。在一些情况中,术语“氨基酸序列”与术语“肽”同义。在一些情况中,术语“氨基酸序列”与术语“酶”同义。术语“蛋白质”和“多肽”在本文中可互换使用。在本公开和权利要求书中,可使用氨基酸残基的常规一字母和三字母代码。氨基酸的3字母代码遵照iupaciub生物化学命名联合委员会(jointcommissiononbiochemicalnomenclature,jcbn)的定义。还应理解,由于遗传密码的简并性,多肽可由不止一种核苷酸序列编码。术语的其它定义可在整个本说明书中出现。在更详细地描述示例性的实施方案之前,应理解本公开并不限于所描述的具体实施方案,因为这些实施方案当然是可变的。还应理解,本文所用的术语仅出于描述具体的实施方案的目的,并不意在具有限制意义,因为本公开的范围将仅受所附权利要求的限定。在提供数值范围的情况中,应理解,该范围的上限和下限之间的每个中间数值(至下限的个位的十分之一,除非上下文另有清楚规定)也被具体公开。规定的范围中的任何规定值或中间值与该规定的范围中的任何其它规定值或中间值之间的每个较小范围,被涵盖在本公开内。这些较小范围的上限和下限可独立地被包括或排除在该范围中,而且其中任一个、没有一个或两个界限被包括在较小范围中的每个范围也被涵盖在本公开中,但依据该规定的范围中的任何被具体排除的界限而定。在规定的范围包括界限中的一个或两个的情况中,排除这些被包括的界限中的任一个或两个的范围,也被包括在本公开中。必须指出,如本文和所附权利要求书中所用,单数形式的“一个”、“一种”和“所述”包括复数指代,除非上下文另有清楚规定。因此,例如,提到“三肽基肽酶”、“内切蛋白酶”或“酶”则包括多个此类候选物质,而提到“原料”则包括提到一种或多种原料以及本领域技术人员知道的它们的等同物,以此类推。本文论述的出版物只是为了它们在本申请的提交日之前的公开内容而提供。本文的任何内容都不能被解释为承认这些出版物构成本文所附权利要求的现有技术。现在参考以下附图和实施例,仅以举例的方式描述本发明。实施例实施例1主题:玉米乙醇发酵——使用三肽基肽酶(3pp)增大发酵速率和总乙醇水平目的:为了鉴定该酶与已存在于葡糖淀粉酶产物中的蛋白酶的发酵有益效果。介绍:从里氏木霉分离三肽基肽酶(3pp)。在玉米乙醇发酵中,该肽酶具有作为添加剂的较高潜能,以三肽形式作为酵母的氮供应者。当该酶单独投配和与蛋白酶(天冬氨酸蛋白酶家族的酸性真菌内切蛋白酶)一起投配时示出发酵速率增大。材料:液化物:bigriverdyersville(5/04/2012)酵母:redstar,ethanolred脲:jtbaker,usp等级,批号a23338表1:该实验中使用的酶实验:使液化物在60℃水浴中解冻,然后将每者所需的量称重到烧杯中。添加固体脲以产生600ppm的最终浓度。用6nh2so4将ph调节至4.5,然后在通过水分天平测定干固体(ds)%后采集0时间点,一式三份。称取酵母以产生0.1%总质量的最终浓度,并且将其干投掷到液化物中,之后进行充分混合。接着,将100g量的液化物分配到250ml广口锥形瓶中,每个待测试条件一式三份。如表2所示投配酶。表1显示的三肽基肽酶的活性单位数利用以下计算:在96孔微量滴定板的孔中,使150ul的1mmh-ala-ala-phe-pna(对-硝基苯胺衍生的底物)的0.1mnaoac(ph4.5)溶液与各种量的酶稀释液混合以符合测定的线性范围。在室温(25℃)下,动力学上跟踪410nm处的吸光度。1u被定义为每分钟释放1微摩尔pna的酶的量。410处的pna摩尔吸附假设为8800。表2:用于600ppm脲发酵的烧瓶条件和酶剂量表2:里氏木霉葡糖淀粉酶(ga)和白曲霉α淀粉酶(akaa)分别以0.325gau/gds和1.95ssu/gds投配。两种蛋白酶均以0.02u/gds投配。将烧瓶用单穿孔的8号尺寸橡胶塞塞住并置于150rpm和32℃的1”轨道摇动器中。在指示的时间点一式三份收集约2ml的发酵样品,以16,000xg旋转沉淀固体3分钟备用。样品收集物由收集的500μl上清液组成,用50μl的1nh2so4使酶失活5分钟,用dih2o1:10稀释并通过13mm直径、0.45μm孔径的尼龙过滤器。就与以下竞争对手的产品的比较而言,在与3pp实验相同的时间完成这些采样差异,但并非直接相关。通过上述常规方法采集显示的全部数据。允许留下两种方法并非是错误的,但其可能被混淆(其还可能属于本领域的技术人员的基础知识)。在以下条件下,通过hplc分析所收集的样品:制备液化物并如上所述进行分配,不同的是仅添加200ppm的脲。酶如表3所述投配。表3:用于200ppm脲发酵的烧瓶条件和酶剂量表3:酶以与600ppm脲发酵相同的水平投配。温育烧瓶并收集样品,并且如上所述进行分析。图1示出200ppm脲下在对照与样品发酵之间有更好的突破。肽酶自身提供了一些益处,但在两倍剂量时并未增大。然而,当与组合时,观察到速率和最终水平大大提高。同样,图2示出2x三肽基肽酶仅产生少量增大,而两种酶的混合物却产生与双倍剂量相当的增大速率。发酵中酵母健康状态(即,酵母的发酵能力)的另一表现为葡萄糖消耗的速率(图3)。肽酶示出相对于对照的改善,这并不在较高剂量下改变。有利于比肽酶摄入更多的葡萄糖并且示出特征剂量响应。两者的混合物与双剂量的几乎相同。实施例2主题:玉米乙醇发酵——三肽基肽酶和蛋白酶a的效果目的:就新的生成三肽的肽酶有益于酿酒酵母在玉米乙醇发酵中的能力的应用而言,需要对该肽酶进行分析。结论:·新肽酶自身和与协同下两者均在发酵中有效地提高乙醇水平。·使用本发明的三肽基肽酶时的乙醇收率比在使用蛋白酶a(蛋白酶(来源于拟诺卡氏菌并且其为丝氨酸蛋白,具有内切蛋白酶和外肽酶活性两者)商购自novozymesa/s)时所见的乙醇收率高得多。·异乎寻常地,在hplc分析的中范围时间点以及显著的等待时间处的高水平较小糖可表明,使发酵样品中酶失活的简单酸杀灭步骤可能是不够的。介绍:从里氏木霉分离三肽基肽酶(tripeptidogenicpeptidase)即sedolisin3pp并将其与酸性真菌蛋白酶一起测试。在玉米乙醇发酵中,该肽酶具有作为添加剂的较高潜能,以三肽形式作为酵母的氮供应者。在该实施例中,采用三肽基肽酶、和fan(芽孢杆菌属产生的碱性蛋白酶)单独发酵以及一起发酵。材料:液化物:lincolnwayenergy酵母:redstar,ethanolred脲:jtbaker,usp等级,批号a23338表4:该实验中使用的酶实验:使得自lincolnwayenergy的液化物在60℃水浴中解冻,然后将各个实验所需的量称重到烧杯中。添加固体脲以产生400ppm的最终浓度。用6nh2so4将ph调节至4.5,然后通过水分天平测定ds%。称取酵母以产生0.1%总质量的最终浓度,并且将其干投掷到液化物中,之后进行充分混合。接着,将100g量的液化物分配到250ml广口锥形瓶中,每个待测试条件一式三份。酶如表5所示投配。表5:用于400ppm脲发酵的烧瓶条件和酶剂量表5:ssf以0.325gau/gds投配;excel以0.058%wt/wt原样玉米投配。肽酶以0.02u/gds投配;fan和蛋白酶a以0.1kg/mtds投配。将烧瓶用单穿孔的8号尺寸橡胶塞塞住并置于150rpm和32℃的1”轨道摇动器中。在指示的时间点收集约2ml的发酵样品,以16,000xg旋转沉淀固体3分钟备用,收集500μl的上清液,用50μl的1nh2so4使酶失活5分钟,用dih2o1:10稀释并通过13mm直径、0.45μm孔径的尼龙过滤器。在以下条件下,通过hplc分析所收集的样品:图4:在三肽基肽酶产生比对照更高水平的乙醇的情况下;唯一无任何蛋白酶、excel(包含葡糖淀粉酶或葡糖淀粉酶/淀粉酶组合的产品)的样品没有达到16体积%乙醇并且在发酵结束时升高了葡萄糖水平。这可能指出,在仅400ppm脲下,酵母细胞缺氮。400ppm被选择成使得发酵将结束,但仍可观察到来自于所添加蛋白酶的益处;然而,在未添加蛋白酶时发酵没有结束,因此该数目需要增大至600ppm的标准剂量。图5:易于观察到添加三肽基肽酶的益处。令人感兴趣地,fan示出乙醇的产量增大。当将两者添加至已在ssf(购自dupontindustrialbiosciences——以前为genencor)中的时,观察到速率增大。另一实验的液化物被制备为第一种,不同的是添加脲至600ppm的最终浓度。另外,采集2ml剩余的液化物的样品,一式三份,作为0时间点。酶如表6所示投配。表6:用于600ppm脲发酵的条件和酶剂量表6:葡糖淀粉酶如表2所述投配,akaa以1.95ssu/gds投配。和三肽基肽酶以0.02sapu/gds投配,并且fan和蛋白酶a以0.25kg/mtds投配。图6:和新三肽基肽酶两者均在发酵中生成更高的乙醇水平,并且当将两者一起添加时观察到加合效应。图7:对于该液化物的%ds,总葡萄糖释放约高1%。图8:葡萄糖和dp2水平示出在这些特定发酵中的一些不常见的趋势。葡萄糖高于惯常的大部分发酵,并且当运行蛋白酶a试验时,在16小时与24小时的时间点之间观察到水平增大。在24小时还观察到此种葡萄糖增大伴随着dp2降低。由于上样到hplc系统5,给定样品采集之间的时间量并分析,据信这可表明酸杀灭步骤不足以完全使葡糖淀粉酶;尤其是excel中的那些失活。实施例3材料:液化物:bigriverdyersville(5/04/2012)酵母:redstar,ethanolred脲:jtbaker,usp等级,批号a23338表7:该实验中使用的酶实验:使全玉米粉液化物在60℃水浴中解冻,然后将每者所需的量称重到烧杯中。添加固体脲以产生600ppm的最终浓度。用6nh2so4将ph调节至4.5,并且在通过水分天平测定ds%后采集0时间点,一式三份。称取酵母以产生0.1%总质量的最终浓度,并且将其干投掷到液化物中,之后进行充分混合。接着,将100g量的液化物分配到250ml广口锥形瓶中,每个待测试条件一式三份。酶如表8所示投配。表8:用于600ppm脲发酵的烧瓶条件和酶剂量表8:里氏木霉葡糖淀粉酶和akaa分别以0.325gau/gds和1.95ssu/gds投配。两种蛋白酶均以0.02u/gds投配。将烧瓶用单穿孔的8号尺寸橡胶塞塞住并置于150rpm和32℃的1”轨道摇动器中。在指示的时间点一式三份收集约2ml的发酵样品,以16,000xg旋转沉淀固体3分钟备用。将600μl的上清液收集到1.5ml的螺旋盖微量离心管中,添加60μl的1nh2so4,在99℃加热器中将管煮五分钟而无需摇动。然后冷却样品并用dih2o1:10稀释,接着通过13mm直径、0.2μm孔径的尼龙过滤器。在以下条件下,通过hplc分析所收集的样品:图9:对于3pp肽酶的乙醇收率的益处看起来是加合的;因为+三肽基肽酶样品的乙醇浓度增大类似于和三肽基肽酶(分别为1.959%和2.288%)的单独益处。图10:当将肽酶与组合时,观察到速率类似于双剂量的速率。双剂量肽酶改善了发酵速率,但是没有含的样品那样多。然而,双剂量的肽酶并未导致最终乙醇水平类似于含的样品。结论:该肽酶确实提供类似于所观察的当前酸性真菌蛋白酶的益处的发酵乙醇水平的益处。实施例4三肽基肽酶在里氏木霉中的克隆和表达除作为基因序列生成的tri079(seqidno.57)和tri083(seqidno.56)之外,使用优选的密码子生成编码耐脯氨酸三肽基肽酶的合成基因以在里氏木霉中进行表达。预测的分泌信号序列(signalp4.0:discriminatingsignalpeptidesfromtransmembraneregions.thomasnordahlpetersen,brunak,gunnarvonheijne&henriknielsen.naturemethods,8:785-786,2011)(除tri079和tri083之外)用来自于里氏木霉酸性真菌蛋白酶(afp)的分泌信号序列和来自于里氏木霉葡糖淀粉酶基因(trga1)的内含子替换(参见图12下部图)。使用lrclonasetm酶混合物(lifetechnologies)将合成基因引入目的载体pttt-pyrg13(如us8592194b2中所述,其教导以引用方式并入本文)中,从而导致本文的耐脯氨酸三肽基肽酶的表达载体pttt-pyrg13的构建。编码seqidno1、2和29的表达载体示于图11中,并且编码seqidno12和39的表达载体示于图12中。利用peg介导的原生质体转化将5-10μg的表达载体各自转化到合适的里氏木霉菌株中,实质上如(us8592194b2)所述。通过离心来收获发芽孢子,洗涤并用45mg/ml的裂解酶溶液(哈茨木霉(trichodermaharzianum),sigmal1412)处理以裂解真菌细胞壁。通过标准方法对原生质体进行进一步制备,如等人[gene61(1987)155-164]所述,其内容以引用方式并入本文。用0.85%nacl、0.015%tween80的溶液收获孢子。使用孢子悬浮液来接种液体培养物。在180rpm振荡下使培养物在28℃和80%湿度下生长7天。培养上清液通过真空过滤收获并用于测量表达和酶性能。三肽基肽酶的纯化在经20mm乙酸钠,ph4.5(缓冲液a)平衡的pd10柱(gelifesciences,usa)上对样品进行脱盐。对sources15hr25/5(gelifesciences,usa)上的离子交换色谱而言,用缓冲液a对柱进行平衡。将经脱盐的样品(7ml)以6ml/min的流速施加到柱上并用缓冲液a洗涤柱。结合的蛋白用线性梯度为0-0.35m的nacl的20mm乙酸钠(ph4.5)溶液洗脱(35min)。在整个运行期间,收集10ml级分。根据本文教导的测定(例如,ebsa测定),分析所收集样品的三肽基肽酶活性。基于280nm处的吸光度测量和使用expasyprotparam工具(http://web.expasy.org/cgi-bin/protparam/protparam)计算的蛋白质理论吸光度计算蛋白质浓度。实施例53pp肽酶对乳酸发酵的影响凝结芽孢杆菌(bacilluscoagulans)为可在高达55℃的温度下生长的强乳酸生产菌。在该研究中,对于乳酸(la)同时糖化和发酵(ssf)过程,在液化期间使用另外的3pp肽酶连同spezymealpha,以查看另外的肽酶是否可将更多的玉米蛋白质水解成作为氮源的氨基酸,并且产生更多的la。材料和方法凝结芽孢杆菌cicc20138可获自chinacenterofindustrialculturecollection。spezymealpha:7201870341,14264aau/g,2014.09.05。trga浓度:805tgau/g,批号7202033738.3pp肽酶cedar2014-11-03液化条件在表9中示出。将15%ds玉米调节至ph5.7。一种样品仅包含0.3kg/mtspezymealpha,作为对照;另两种包含0.3kg/mtalpha和0.1kg/mt或0.5kg/mt的3pp肽酶。使所有样品在65℃下以350rpm温育30min,然后在87℃下以350rpm保持90min。在液化后,将液化物离心并过滤。种子培养基(每升)包含蛋白胨10.0g、酵母提取物5.0g、nacl5.0g和葡萄糖5.0g(ph6.0)。将培养基在121℃下灭菌20min。将种子在50℃下以130rpm培养约18小时。1l发酵罐的发酵培养基包含500g玉米液化物、50ml菌株种子。同时糖化和发酵(ssf)在如下条件进行:50℃,300rpm旋转速度,经20%(m/v)nh4oh自动调节的ph6.5。添加0.75tgau/gdstrga,然后添加50ml种子开始发酵。使搅拌维持于300rpm,并且用20%(m/v)nh4oh使ph恒定保持于6.5。取样进行hplc分析。表9:液化条件预处理液化1,65℃,30min,alpha@0.3kg/mt87℃,90min265℃,30min,alpha@0.3kg/mt+phytase@0.1kg/mt87℃,90min365℃,30min,alpha@0.3kg/mt+phytase@0.1kg/mt87℃,90min表10:发酵条件结果相比于对照,在玉米液化之前用3pp肽酶预处理导致:1)玉米液化物过滤速度更高,玉米粉饼中的残余淀粉更少;2)lassf过程期间的乳酸产量更高并且残余葡萄糖更少。显而易见的是0.1kg/tds的剂量足以进行预处理。因为对于lassf并不存在外部的蛋白质营养,并且葡萄糖没有在70小时完全被消耗,似乎肽酶添加物将一些玉米蛋白水解成氨基酸,原因是氮增大发酵速率并产生更高的la收率和更少的残余葡萄糖。表11:液化性能表12:发酵性能表13:乳酸收率实施例63pp肽酶对柠檬酸发酵的影响材料和方法:制备ds=20%的玉米面浆液。基于干物质,添加0.2kg/tds的3pp肽酶并在60℃下温育40min。对照测试在相同的条件下进行但无3pp肽酶。添加0.3kg/tds的spezymealpha,然后在90c下进行1.5小时液化。将浆液离心并将上清液用作发酵培养基。将培养基在115c下灭菌15min并且然后冷却。使黑曲霉菌株在马铃薯右旋糖琼脂(pda)斜面上于35℃生长5-7d,然后用无菌水洗涤孢子,将孢子悬浮液接种到发酵培养基中并在35℃下以300rpm/min温育96小时。在发酵结束时取样。使发酵液过滤通过滤纸,并且使用培养物滤出物进行分析。通过hplc分析柠檬酸浓度和dp1、dp2、dp3、dp4+浓度。结果:表14数据示出,在预处理过程中添加3pp肽酶,最终柠檬酸收率显著增大,同时残余的糖显著减少。在液化和离心之后,我们发现上清液相比于对照更为澄清,其可在工业生产中导致更好的过滤性能。在发酵结束时,我们还发现粘度大幅度降低,这可改善下游工艺。上面说明书中提及的所有出版物以引用的方式并入本文。对本领域的技术人员将显而易见的是,可在不脱离本发明的范围和实质的情况下对所描述的本发明的方法和系统作出多种修改和变型。尽管本发明已结合特定的优选实施方案进行了说明,但应该理解受权利要求书保护的本发明不应该不当地受限于这些特定的实施方案。实际上,对生物化学和生物技术或相关领域的技术人员明显的用于执行本发明的所述模式的多种修改旨在处于如下权利要求书的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1